Method Article
CD8 による培養腫瘍細胞のアポトーシスのリアルタイム検出+ T 細胞腫瘍浸潤骨髄細胞の免疫抑制機能を勉強するには
* これらの著者は同等に貢献しました
要約
ここで前の活性化 cd8 陽性の細胞毒性を調査するプロトコルについて述べるリアルタイム顕微鏡を介してアポトーシスがん細胞を検出することにより癌細胞に対して細胞の+ T。このプロトコルは、骨髄細胞による T 細胞抑制の背後にあるメカニズムを調査し、免疫抑制の骨髄系細胞の封鎖を介してT 細胞を補給を目的とした化合物を評価できます。
要約
Cd8 陽性の腫瘍を殺す能力の増強+ T と共に、効率的な腫瘍浸潤、腫瘍細胞は免疫療法の成功の重要な要素です。いくつかの研究は、腫瘍浸潤骨髄性細胞 (骨髄由来抑制細胞 (MDSCs) と腫瘍関連マクロファージ (Tam) など) は、cd8 陽性の細胞毒性を抑制することが示されている+ T 細胞腫瘍微小環境とそのターゲットこれらの規制の骨髄細胞は、免疫療法を改善できます。Cd8 陽性の腫瘍を殺す能力単球 MDSCs と Tam の免疫抑制効果を評価するための in vitro アッセイ システムを提案するここでは、+ T 細胞。このためには、まず素朴な培養を行った脾 CD8+ T サプレッサー細胞の存在の有無で抗 CD3/CD28 活性化抗体と細胞し、蛍光の存在下でターゲット癌細胞と活性化 T 細胞を共培養カスパーゼ 3 基板。がん細胞における基板から蛍光が T 細胞による腫瘍細胞のアポトーシスの指標としてリアルタイム蛍光顕微鏡で検出されました。この分析では、我々 は正常に CD8 によって腫瘍細胞のアポトーシスの増加を検出できます+ T 細胞と Tam または MDSCs と前培養による抑制。この機能の試金は CD8 を調査するために有用な+ T 細胞骨髄性と高スループット スクリーニングを介してそれを克服するために識別 druggable ターゲットによって抑制機構を細胞します。
概要
知られているその CD8+ T のフルの細胞毒性を出すとき、細胞は腫瘍細胞をなくすことができます。T 細胞受容体 (TCR)、CD8 の活性化後+ T 細胞増殖し、細胞傷害性エフェクター細胞に分化します。展開と活性化 CD8+ T 細胞は、細胞傷害顆粒、パーフォリンが標的細胞へ転送され、カスパーゼ 3 を介したアポトーシス1など様々 な溶解経路を開始する granzymes などを分泌します。CD8+ T 細胞もアポトーシスを誘導する腫瘍細胞腫瘍壊死因子-α (TNF-α) の受容体などの標的細胞上の受容体を活性化して最初信号 ligand (FasL) または TNF 関連アポトーシス誘導リガンド (TRAIL)。さらに、活性化された CD8+ T 細胞分泌するインターフェロン-γ (IFN-γ) 腫瘍細胞増殖を抑制でき、cd8 陽性腫瘍細胞の感受性を高める+ T 細胞を介してのアップレギュレーション FasL 受容体1の。Cd8 陽性の可能性を考えると+ T 腫瘍殺害能力、(例えば、チェックポイント阻害剤、がん予防接種と養子伝キメラ抗原受容体 (車) 発現 T 細胞) の細胞毒性を後押しするいくつかの戦略が確立されています。癌2の特定の種類に示されている重要な治療効果。しかし、腫瘍浸潤の免疫が制御性 T 細胞など細胞、骨髄由来抑制細胞 (MDSCs)、腫瘍関連マクロファージ (Tam) が CD8 を抑制することができますを示唆証拠の蓄積+ T 細胞の機能と有効性を制限します。免疫療法の3,の4,5。このような免疫療法を改善するためにどのように免疫抑制細胞制限 CD8 を理解することが重要です+ T 細胞細胞毒性。CD8 の識別+ T 細胞抑制メカニズムとそれを克服する druggable ターゲットが必要になります開発および生体外の試金の活用。
ゴールド スタンダードは、CD8 を測定法+細胞毒性 T 細胞は CD8 によってターゲットから放射性プローブ (51Cr) のリリース細胞をクロム リリース試金は分離+ T 細胞、決定6。しかし、この試金は比較的低感度、高いバック グラウンド、早期アポトーシス イベント、有害ゴ ミ処理問題、および自動液体ハンドリングと検出をサポートする限られた互換性を検出できないことを含むいくつかの欠点スループットの高いアプリケーション。別の一般的な方法は、標的腫瘍細胞のアポトーシスがアネキシン V7のバインドによって検出される流れフローサイトメトリー解析です。このアッセイでは、7 の標的細胞でのアポトーシスに加えて、CD107a または CD69 の式によって示されるエフェクター細胞の活性化や 7 aminoactinomycin D (7 AAD) propidium ヨウ化 (PI) を使用してターゲット細胞死などの他のパラメーターを検出することが可能.ただし、この試金はクロム リリース アッセイに比べてサプレッサー細胞の数が多い必要があります。それはまた剥離、付着性細胞の分解を要求し、これは結果をバイアスすることができます。確かに、クロム リリースのアッセイまたはフローサイトメトリーアッセイ T 細胞機能に及ぼす影響抑制細胞を調査するため一般的に使用されません。代わりに、T 細胞にあらかじめロード蛍光染料 (例えば、CFSE) の希釈によって示される T 細胞増殖の測定は頻繁に CD8 の抑制を評価する使用+サプレッサー細胞による T 細胞機能。IFN-γ 産生 T 細胞の検出は、サプレッサー細胞の T 細胞活性化8,9に及ぼす影響を評価するための別の標準的な方法です。ただし、これらのアッセイの結果は必ずしも相関がない CD8 の能力を殺す目的セルに+ T 細胞。
サプレッサー細胞、転移性腫瘍、特にマクロファージの cd8 陽性の細胞毒性に及ぼす影響を評価するための代替機能アッセイをご紹介+ T 細胞。このメソッドは、cd8 陽性の細胞毒性を決定します+ T 細胞、腫瘍細胞のアポトーシスを検出することにより抗 CD3/CD28 活性化抗体の存在下で抑制性細胞の有無を事前に培養が蛍光のカスパーゼ 3 からの蛍光性によって示される微速度顕微鏡観察 (図 1) を自動基板6を使用しています。このプロトコルは、他の方法に比べていくつかの利点少数の細胞のみが必要ですし、感度が高い付着性腫瘍細胞死の検出を可能にし、リアルタイムのエフェクタ-ターゲット相互作用をイメージすることができます高スループット スクリーニングを受けやすいです。
このプロトコルでは転移関連付けられた大食細胞 (MAMs) およびその前駆細胞単球性-MDSCs (M MDSCs) マウスの転移性腫瘍から分離されたが、サプレッサー細胞として使用されます。転移性乳癌のマウス ・ モデル、マクロファージの明瞭な人口を特徴とする転移性腫瘍を含む肺に蓄積されます-CD11b高Ly6C低F4/80高Ly6G として。このマクロファージの人口は頻度の低い正常肺で発見し、こうして転移関連マクロファージ (MAMs)10と呼ばれます。これらのマウス モデルで別の骨髄性細胞母集団、定義として F4/80高Ly6G-CD11b高Ly6C高も主に蓄積 MAMs11に上昇を与えるそれ肺転移。彼らの特性に基づき、CD11b高Ly6C高MAM 前駆細胞が M MDSCs12あります。
プロトコル
含むマウスに基づき実施されたすべての手順は、アクセス許可から英国ホーム オフィス (P526C60B3) をライセンスされています。市販試薬と機器については、材料表に表示されます。
1. 赤色螢光蛋白の核を表すターゲット細胞の調製
- 適切なソースからターゲットのマウス癌細胞株を取得します。
注: このプロトコルの E0771 マウス乳腺腫瘍細胞 (E0771-LG)13の転移性の高い誘導体、使用されます。親の E0771 細胞は C57BL/6 マウス14に属します。 - 解凍し、維持の E0771-LG 細胞のバイアルとダルベッコ変更イーグルス媒体 (DMEM) 37 ° C、湿度 95%、および 5% CO2で細胞文化のインキュベーターで 10% (v/v) ウシ胎児血清 (FBS) を含みます。
注: それ確認すべきセルがマイコ プラズマは陰性であること。このため、2-3 日培養液 500 μ L 収集 (で抗生物質とその結果がない場合)、上記のように E0771 セル (またはテストするセル) を文化します。60 12,419 x gで媒体を遠心分離機 s を細胞の残骸を除去し、新しいチューブに上清を移します。市販マイコ プラズマ検査キットを用いたマイコ プラズマ汚染を判断 (資料の表を参照) や PCR15製造元の指示に従います。 - 12 ウェル プレートに 10% (v/v) FBS DMEM で細胞が 37 ° C、湿度 95%、および 5% CO2でインキュベーターで一晩培養ウェルあたり種子 5 x 103 E0771 LG セルです。
注: ターゲット細胞の増殖率が低い場合 (倍加時間 36 h より大きい)、1 x 10 の4セルの数を増やすことが。 - 1 ml の 10% (v/v) 10 μ g/mL polybrene を含む FBS DMEM 培地を交換し、レンチ ウイルス粒子 (1 x 106 TU/mL) の 25 μ L を追加赤色蛍光タンパク質を制限されて核のエンコーディング (mKate2、材料の表を参照してください)。
- 37 ° C、湿度 95%、および 5% CO2でインキュベーターで 24 時間培養します。
- 10% (v/v) FBS DMEM 培地を交換し、37 ° C、湿度 95%、および 5% CO2でインキュベーターで 24-48 時間培養します。
- 10% (v/v) FBS DMEM 細胞赤色蛍光タンパク質を表現し、彼らが 80-90% 合流まで、細胞の培養を開始するときに 1 μ g/mL ピューロマイシンを含む媒体を交換してください。
注: ピューロマイシン濃度ターゲット セル型の間異なるだろうし、非 transfected セルを使用して最適化する必要があります。 - 10% (v/v) FBS DMEM 1 G/ml ピューロマイシンを含む 1-3 通路用存続のサブカルチャー、そして液体窒素の蒸気相ストレージ ・ システムで使用するまで株を凍結します。
2. マウスの腫瘍のサプレッサー細胞の分離
注: このプロトコルでサプレッサー細胞 (すなわちMAMs と M MDSCs)、E0771-LG セルによって確立された転移性腫瘍を含む肺から分離。組織解離・細胞のソーティングのための条件を最適化して、さまざまな組織から細胞を分離してください。
- 1 x 106癌細胞 (E0771-lg 電子) を同系 (C57BL/6)、女性、7-10 週古いマウスの尾静脈に注入します。
- 14 日後転移性腫瘍を含む肺を切り分け、前述11として酵素消化による灌流の肺から単一細胞懸濁液を準備します。
注: このプロトコルで癌細胞が注入される 4 つのマウスと転移性肺が十分な抑制性細胞を取得する結合されます。 - 氷の上で 30 分間抗マウス CD16/CD32 抗体を用いた単一細胞懸濁液を孵化させなさい、別の 30 分10,11 CD45、F4/80、CD11b、Ly6C、および Ly6G (材料の表を参照) を蛍光抗体で染色,13。
- 1 mL の 2% (w/v) ウシ血清アルブミン (BSA) を含む PBS で一度陽性細胞を洗浄し、再を 2% (w/v) BSA を含む PBS の 500-1000 μ l 細胞ペレットを中断します。
- 追加の DAPI、3 μ M および M MDSCs を並べ替え (DAPI-CD45+F4/80+Ly6G-CD11b高Ly6C高) と MAMs (DAPI-CD45+F4/80+Ly6G-CD11b高Ly6C低) セルソーター (補足図 1) を用いたします。
注: MAMs (Ly6C低) と M-MDSCs (Ly6C高) を区別するために Ly6C レベルのしきい値は、肺胞マクロファージ (RMAC) のそれに基づいています。90% 以上の純度が予想される cytometry 流れを介して、細胞の純度を測定します。 - 20% (v/v) FBS, 1% (v/v) ペニシリン/ストレプトマイシン, L-グルタミン, 1% (v/v) 非本質的なアミノ酸、ピルビン酸ナトリウム 1 mM、2 mM と 50 nM 2-メルカプトエタノール (濃縮 DMEM、E DMEM と呼ばれる) を含む DMEM の 400 μ L で並べ替えられた細胞を再懸濁します。
- トリパン ブルー排除法16を使用して生きているセルの数をカウントし、E DMEM に 2 x 106セル/ml に調整します。
- 使用するまで氷の上細胞を保ちます。
3. CD8 の分離マウスの脾臓から細胞の+ T
- 次のようにターゲット癌細胞株 (すなわち、このプロトコルでは c57bl/6 マウス) に同系マウスから脾臓を孤立させます。
- CO2吸入によって、動物を安楽死させます。
- きれいな郭清のボードに動物を置き、70% (v/v) アルコールで皮膚を拭きます。
- 脾臓を公開するはさみを使用して腹部の皮膚をカットします。
- 胃に劣ってある、脾臓を隔離し、5 mL の氷冷 PBS を含むチューブに入れます。
- 5 mL の滅菌注射器の内部のプランジャーを使用すると、50 mL のチューブに設定 100 μ m セル ストレーナーに脾臓を挽きます。
- セルを合計 10 mL の PBS を使用してフィルターに通過します。
- 337 x gで 5 分で細胞懸濁液を遠心し、上清を吸引します。
- 1 mL の 2 ミリメートルの EDTA および 0.5% (w/v) BSA (実行バッファー) を含む PBS で細胞ペレットを再懸濁します、40 μ m セル ストレーナー フィルターします。
- 生細胞数をカウントし、実行中のバッファーを使用して 1 × 108セル/mL に調整します。
注意: 小さな細胞分注前濃縮サンプル純度チェックとして。 - CD8 の豊かな+ T 細胞の否定的な選択キットと磁力選別機を使用して (材料の表を参照してください)。
- 5 mL ポリスチレン丸底チューブに脾細胞細胞の 1 x 108 (1 mL) を転送します。
- ビオチン化抗体の 50 μ L を追加し、10 分間室温でインキュベートします。
- 標識ストレプトアビジン磁気ビーズの 125 μ L を追加し、5 分間室温でインキュベートします。
- 連続したバッファー、1.325 mL を追加し、軽くピペッティングで混ぜます。
- 磁石にチューブを置き、2.5 分間室温でインキュベートします。
- 磁石をピックアップし、新しい管に濃縮細胞懸濁液を注ぐ。
- E DMEM の 200 μ L に濃縮細胞を再懸濁します (すなわち.、 20% (v/v)、政府短期証券を含む DMEM 50 nM 2-メルカプトエタノール、1 mM ピルビン酸ナトリウム, 1% (v/v) 非本質的なアミノ酸 2 mM L グルタミン 1% (v/v) ペニシリン/ストレプトマイシン)。
- 生きているセルの数をカウントし、E DMEM に 2 x 106セル/ml に調整します。おいてセル 37 ° C で CO2インキュベーター使用まで。
注意: 小さな細胞分注後濃縮サンプル純度チェックとして。 - CD8 の純度を決定する+ T 細胞のフローサイトメトリーによって次のように。
- 前濃縮 (ステップ 3.6) から 1 x 10 の4セルまたは後濃縮 (ステップ 3.9) サンプルを取るし、実行バッファーを使用して 100 μ L にそれぞれの総量を調整します。
- 氷の上で 30 分間抗マウス CD16/CD32 抗体を用いた単一細胞懸濁液をインキュベートし、別の 30 分の CD45、CD3、CD4 および CD8 (材料の表を参照) を蛍光抗体で染色します。
- 500 μ L の PBS を含む 2% (w/v) BSA の陽性細胞を洗浄し、再を 2% (w/v) BSA を含む PBS の 500-1000 μ l 細胞ペレットを中断します。
- DAPI の 3 μ M を追加して、CD3 の割合を決める+CD4-CD8 合計 CD45 の細胞の+ +セルの人口。
4. 活性化と孤立した CD8 の拡大+ T 細胞
- あたり 50 μ L 分注 1 x 10 の5セル CD8+ T U 下 96年ウェル プレートのウェルに細胞 (3.9 の手順で準備)。
- (2.7 の手順で準備) 50 μ L サプレッサー細胞あたり 1 x 10 の5セルを追加または 50 μ L E DMEM の井戸に。
- 16 μ g/mL 抗マウス CD28 抗体、8 μ g/mL 抗マウス CD3ε 抗体、240 U/mL インターロイキン 2 (IL-2) 4 × 104 U/mL コロニー刺激要因 1 (CSF-1) E DMEM で構成される活性化メディアを準備します。
メモ: CSF 1 T 細胞活性化には必要ありませんが、このプロトコル (すなわち、MAMs と M MDSCs) でサプレッサー細胞の生存に不可欠です。したがって、それは培養条件の整合性を維持するためにターゲット癌細胞と T 細胞の共培養で保持されます。CSF 1 ナノ モル濃度ですべての組織である、単球/マクロファージの生存率、体内に必要なために、これはこれらの細胞の生理学的なコンテキストです。 - ライセンス認証メディア (手順 4.3) の 50 μ L を追加し、テストする試薬有無 E DMEM の 50 μ L。
- 37 ° C、湿度 95%、および 5% CO2で定温器にプレートを置き、4 日間培養します。
5. セットアップ ターゲットの共培養の細胞活性化 CD8+ T 細胞
- 顕微鏡検査に適した平らな底 96 ウェル プレートのウェルに 1: 100 希釈の成長因子低減水溶性基底膜マトリックス (材料表) の 30 μ L を追加し、37 ° c 少なくとも 1 時間のための CO2インキュベーターで孵化させなさい。
- ターゲット細胞 (すなわち、E0771 LG 細胞核制限赤蛍光蛋白を発現する) を準備します。
- 1 ml 0.05% トリプシン/1 分間室温で EDTA の標的細胞をインキュベートし、穏やかなピペッティングにより細胞を収穫します。
- 10% (v/v)、政府短期証券を含む DMEM の 9 mL を追加し、337 x gで 5 分で細胞懸濁液を遠心分離します。
- 再を E-DMEM 500 μ l 細胞を中断し、生きているセルの数をカウントします。
注: ターゲット細胞をカウントする前に、セルを単一細胞懸濁液を生成する 40μm セル ストレーナー フィルターします。 - 氷の上の細胞を維持し、E-DMEM を追加することによって 2 × 104セル/mL (= 50 μ L あたり 1 x 10 の3セル) に密度を調整します。
- エフェクター細胞を準備 (すなわち、前の活性化 CD8+ T 細胞)。
- + T ピペットと転送浮動 CD8 によって徹底的に 96 ウェル プレート (ステップ 4.5) の井戸に細胞が新しい 1.5 mL チューブに細胞を再懸濁します。
注: MAMs と M MDSCs しっかりと井戸に付着し、ピペッティングではデタッチされません。 - 残りのセルを収集、井戸に PBS の 200 μ L を追加し手順 5.3.1 でチューブに移します。
- 5 分 1 ml E-DMEM 一度 (337 × gで遠心分離) のセルを洗浄、吸引、上澄みを廃棄) を 100 μ E DMEM のそれらを再停止しなさいと。
- (トリパン ブルー色素排除法を使用して) 生きているセルの数をカウント、1.6 105セル/mL (= 4 × 103セル/25 μ L)、倍密度を調整し、氷の上の細胞を維持します。
- + T ピペットと転送浮動 CD8 によって徹底的に 96 ウェル プレート (ステップ 4.5) の井戸に細胞が新しい 1.5 mL チューブに細胞を再懸濁します。
- 手順 5.1 でプレートの各ウェルから基底膜マトリックスを吸い出しなさい。
- 各ウェルに標的細胞 (ステップ 5.2.4) の 1 x 103セル/50 μ L を加え、よく混ぜます。
注: も、96 の内側 60 井戸のみ、中の蒸発によるエッジ効果を避けるためにプレートは解析に使用する必要があります。 - 4 x 103 U/mL IL-2 と 10 μ M 蛍光カスパーゼ 3 基板 (材料の表を参照) を含む E DMEM の 25 μ L を追加します。
- CD8 の 4 x 103セル/25 μ L を追加+ T 細胞 (ステップ 5.3.4) に井戸を適切なよく混ぜます。
注: 井戸にあまりにも多くの細胞の存在分析より難しくなります。このモデルでは、4:1 のエフェクター: ターゲット比率 (総セル数 5 × 103細胞/ウェル) が最適、8:1 の比率と思いました。次の 4 つのコントロールが含まれている井戸があるデータの分析を支援するために必要な: エフェクター細胞 (1 x 10 の3セル密度とカスパーゼ 3 基板なしは培地に培養井戸 (1 x 103細胞/ウェル) の使用で細胞を標的/よく) 中とカスパーゼ 3 基板なし。 - 実験井戸から培地の蒸発を減らすためには、すべて空井戸 (特にプレートの周囲に井戸) に 200 μ L の PBS または滅菌水を追加します。
- 37 ° C、湿度 95%、および 5% CO2で維持されるタイムラプス蛍光顕微鏡にプレートを設定します。
注: すべてのセルを均等にクロス パターンのプレートを振るし、インキュベーターに転送する前に 10 〜 20 分のための平らな面に部屋の温度を維持するプレート。
6. 細胞のイメージング
注: 顕微鏡と蛍光物質の使用; 詳細な画像取得設定が異なります次の一般的な集録パラメーター最適な結果を得るべきであります。
- 顕微鏡を適切なオート フォーカス ルーチンを使用して、各実験ウェルの 96 ウェル プレートで総面積の 25% 以上をカバーする画像を取得します。
- 核制限の赤蛍光蛋白質 (mKate2) のための適した蛍光チャネルと同様に、位相コントラストの画像を取得する顕微鏡をセットし、緑の蛍光に適した蛍光チャネル活性化 (カスパーゼ 3 基板励起 488 nm) (図 2)。
- 位相差顕微鏡および少なくとも 72 時間のすべての 3 に 1 h 2 蛍光チャンネルで実験の井戸の画像をキャプチャします。
7. 画像解析画像解析ソフトを使用して
注: 詳細な画像分析の設定は使用するソフトウェアによって異なります (材料の表を参照してください)。次の一般的な解析手順結果を最適化するべきであります。
- どうスペクトル不混合アポトーシス核から放出される、これを達成するために必要な場合、分析プロトコル設定から標的細胞核から放出される蛍光信号を分離する必要が
- ビュー コントロールよく (mkate2 ラベル) 緑の蛍光チャネルにおけるカスパーゼ 3 基板なし中唯一の標的細胞を含みます。
- 蛍光グリーンが赤核 (核表示緑) で出力されているかどうかを観察します。
- 緑の蛍光性を核に感じ取ることが、イメージング ソフトウェアのスペクトル分離制御にアクセス、緑の信号が消えるまで緑から削除赤の割合を増やす (我々 の経験でこれは通常明るい mKate2 の 6-7%蛍光)。
- 蛍光グリーンが、核の明確でないスペクトル分離は必要ありません。
注: このスペクトル分離補正テストは、カスパーゼ 3 の基板を含む培地における標的細胞の井戸を使用しても行うことが。ただし、通常蛍光よりもむしろカスパーゼ 3 拡散の活性化による緑色蛍光を発光、いくつかのターゲット細胞核の標的細胞 (10% 未満) の自発的アポトーシスの非常に低いレベルがあります。真蛍光拡散は、蛍光グリーンをすべて核で感じ取ることがこれらの条件の下で明らかです。 - 赤と緑のチャネルにおけるカスパーゼ 3 基板なしの中でも唯一エフェクター細胞 (核ラベルなし) を含むコントロールを個別表示します。
- 緑または赤の蛍光が核で出力されているかどうかを確認します。個々 のチャンネルに感じ取ることができます赤も緑の蛍光スペクトル分離は必要ありません。
注: 我々 の経験、CD8 マウスで+ T セルは自動蛍光ではない、したがってスペクトル分離必要はありません、これらのセル。補正するスペクトル分離のテストは、カスパーゼ 3 の基板を含む培地で細胞の井戸を使用しても行えます。ただし、通常自発的アポトーシスのカスパーゼ 3 の活性化による緑色蛍光を発光エフェクター細胞核の結果のいくつかのレベルがあります。真蛍光拡散は、蛍光グリーンをすべて核で感じ取ることがこれらの条件の下で明らかです。
- 両方の蛍光チャネルに蛍光のオブジェクトを解決するのにには、サンプルは、関連するパラメーターを持つ蛍光背景差分法 (例えば、トップハット) を使用します。
注意: 緑のチャネルで使用してトップハット (核半径 10.0 μ m、緑蛍光しきい値を = = 0.7 緑校正ユニット)。赤のチャネルで使用してトップハット (核半径 10.0 μ m、赤い蛍光しきい値を = = 0.5 赤校正ユニット)。 - エッジを分割するための適切なパラメーターを使用すると、個々 の蛍光核を解決できます。
注: 我々 は、緑色または赤色蛍光チャネルの分割エッジを使用しませんでした。 - 標的核の最小サイズを決定する (カスパーゼ基板) を用いた標的細胞だけを含む井戸から赤のチャンネルに画像を使用します。
注意: 80 μ m2を使用します。 - アポトーシス エフェクター核の平均サイズを決定する (カスパーゼ基板) とエフェクター細胞のみを含む井戸から緑のチャンネルに画像を使用します。
注: 単一のアポトーシス エフェクター核がこれらの実験で 40-80 μ m2からであった。 - 解析手法 (例えば、最小面積、最小直径) 適切な最小サイズ制限を使用して蛍光ターゲット細胞核の数をカウントする設定 (図 2、ターゲット検出マスク)。
注意: 最小の核領域 (赤い蛍光性) を使用して = 80 μ m2。 - アポトーシス エフェクター核 (図 2、サイズ制限されたアポトーシス マスク) の平均サイズよりも大きいであるアポトーシス核の数をカウントする解析プロシージャを設定します。
注: サイズ フィルターを 80 μ m2に設定した (このサイズより大きい緑の蛍光性のすなわち、唯一領域数えられた、従って単一のアポトーシス エフェクター核を除く)。これらのパラメーターを使用してエフェクター細胞のアポトーシスのいくつかの集計をカウントがありますが、アポトーシスターゲット細胞核を数える解析の精度が向上します。 - どこ (ステップ 7.6) から赤の蛍光シグナルと (ステップ 7.7) から緑色の蛍光信号をサイズ限定大幅共存して (図 2R 核をカウントすることによりアポトーシス細胞数をカウントする解析方法を設定します。/G 重複マスク)。
注: 適切な共局在は、標的核の平均のサイズの 100% に 30% から及ぶかもしれない。オーバー ラップのサイズのフィルターは、40 μ m2に設定されました。 - 全体の時間にわたってアポトーシス ターゲット細胞核の数だけでなく、実験条件ごとに井戸のターゲット細胞核の数を決定します。
8. データ解析計算を行い、ソフトウェアのグラフ
- 手順 7.9 実験井戸全体の時間経過で取得したアポトーシス ターゲット細胞核数をグラフします。実験条件ごとに複数の井戸を使用する場合は、グラフィカルに平均 ± 標準偏差として結果を提示します。
- 各時点でのターゲット セルの数によって各ウェルのアポトーシス細胞数を割ることによって標的細胞の人口のアポトーシスの割合を計算します。
- 8.2 のステップで得られた結果をグラフ化します。
- 各曲線の曲線 (AUC) の下の領域を決定します。必要な場合、ピークが発生した時点だけでなく、各曲線の人口のピーク アポトーシスの割合をまた定められるかもしれない。実験条件の決定 AUC が適切な統計テストを使用して大幅に異なるかどうかを決定します。
注: ウェルチの補正と対になっていない t 検定は、AUC 結果に適用されました。
結果
この手法はターゲット癌細胞エフェクター CD8 と+ T の単純な培養抗 CD3/CD28 活性化抗体の存在下で抑制性細胞の有無事前培養されている細胞。CD8 が検出された+共培養、cd8 陽性の細胞障害作用に対する抑制性細胞の効果の評価ができ、時間の経過と共に T 細胞による癌細胞アポトーシス誘導+ T 細胞。
通常、がん細胞を増やす、原子核緑の蛍光性核ターゲットのカスパーゼ バイオ センサーのアクティブ化後これらの細胞は CD8 との接触を作るとき+ T 細胞をサプレッサー細胞 (不在で抗体による事前ライセンス認証図 3;附則ムービー 1)。アポトーシスが開始された後、少なくとも 15 時間のカスパーゼ基板から緑色蛍光ができた。いくつか自発的アポトーシス+ T エフェクター cd8 陽性の細胞が認められた時間をかけてこれらの細胞は分離 (図 4; で培養した場合でも附則ムービー 2)。ただし、CD8 の核サイズ+ T 細胞はがん細胞よりも小さく、サイズ制限画像解析法 (図 2と図 4) によるアポトーシス 'ターゲット' 細胞数からアポトーシス 'エフェクター' 細胞を除外できます従って。分析はこれらの細胞はアポトーシス (附則ムービー 3) よりもむしろ細胞分裂を行っている、従ってアポトーシス 'ターゲット' から除外されます、この影響しませんターゲット癌細胞は蛍光グリーンのない小さな丸みを帯びた形状を表示、赤/緑重複マスク (補足図 2) によってセルをカウントします。ターゲット癌細胞の自発的アポトーシスは単一文化 (附則ムービー 3) でも時折あります。ただし、対象となるガンの共培養細胞活性化 CD8+ T 細胞のがん細胞 (図 4) の単作で自発的アポトーシスの水準を超える増加腫瘍細胞のアポトーシス。一般的には、エフェクター細胞にがん細胞を標的の最適な比率を使用して、アポトーシス ターゲット癌細胞数のピークが見られる (図 5 a)。このピークはより明確なデータが (図 5 b) ターゲット細胞のアポトーシスの割合として表される場合です。この実験で標的腫瘍細胞の基底のアポトーシスは 24 h でピーク (アポトーシスの割合 = 0.08)、CD8 が 17 h で最大レベルに達した+ T 細胞によるアポトーシスの誘導 (アポトーシスの割合 = 0.66)。
我々 はさらに発見した CD8+ T MAMs と M MDSCs プレインキュベートした細胞を作ることができる標的がん細胞との接触が、この連絡先は CD8 と比較してがん細胞のアポトーシスの少ないインスタンスに見えた+ T なし事前活性化細胞サプレッサー細胞 (図 3および図 4;附則ムービー 4、附則ムービー 5)。ただし CD8+ T 事前時折骨髄細胞と培養細胞による癌細胞アポトーシス誘導、またいくつかの時間中にアポトーシスを受けるに刺激されてがないターゲット癌細胞増殖があった、実験 (附則ムービー 6)。これらの知見と一致して、がん細胞のアポトーシスのピーク画分培養 CD8+ T 細胞は、骨髄系細胞でプレインキュベートした (アポトーシスの割合 23 h で 0.38 MDSC E と 20 h で 0.25 MAM e =) がん細胞よりも有意に低かったCD8 培養+ T 細胞の抑制性細胞 (図 6) でなかった。
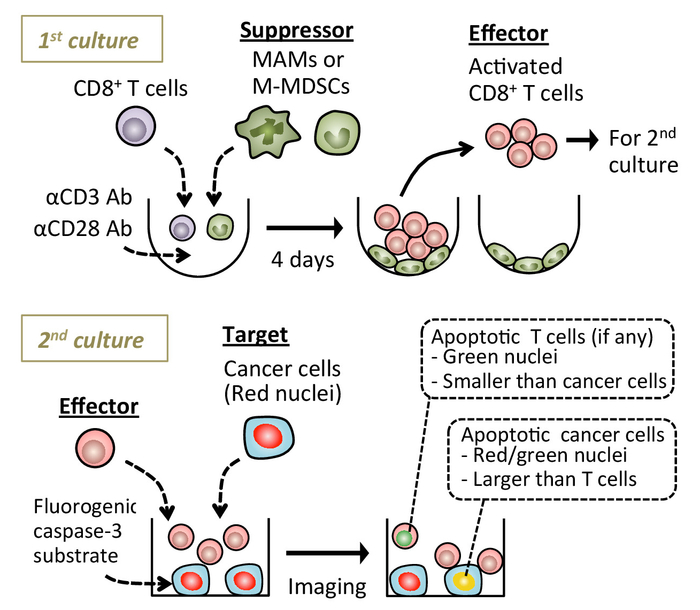
図 1: 実験手順を示す図。素朴な脾 CD8+ T 抗 CD3/CD28 活性化抗体転移関連マクロファージ (MAMs) の有無で培養される細胞や単球性-骨髄由来抑制細胞 (M MDSCs)。CD8 をフローティング 4 日後+ T 細胞の収集し、出来るカスパーゼ 3 蛍光基質の存在下でターゲット癌細胞と共培養します。がん細胞のアポトーシスは、リアルタイム蛍光顕微鏡下で検出されます。示されている画像は、生きている細胞イメージング プラットフォームを使用して取得した (資料の表を参照)。この図の拡大版を表示するのにはここをクリックしてください。

図 2: エフェクター細胞のアポトーシスとは異なるターゲット細胞のアポトーシスの Id 。赤のチャンネルのトップ行: 画像の取得によりターゲット検出マスク (ピンク解析マスク)、ターゲット細胞核の識別。中段: 緑のチャンネルで画像エフェクタとターゲット細胞のアポトーシスを示します。サイズ制限されたアポトーシス マスク (ティール解析マスク; 80 μ m2以上) により、単一のアポトーシス解析から除外するエフェクター細胞。最下行: 複合画像結合の赤、位相コントラスト (左) または赤/緑と緑のチャンネル重複マスク (右)。赤い蛍光性 (黄色解析マスク) と共局在、サイズが制限された緑の蛍光性の同定により、アポトーシスのより正確な検出はエフェクター細胞のアポトーシス (白の集計を除外することによって標的核 (黄色の矢印)矢印)。この図の拡大版を表示するのにはここをクリックしてください。
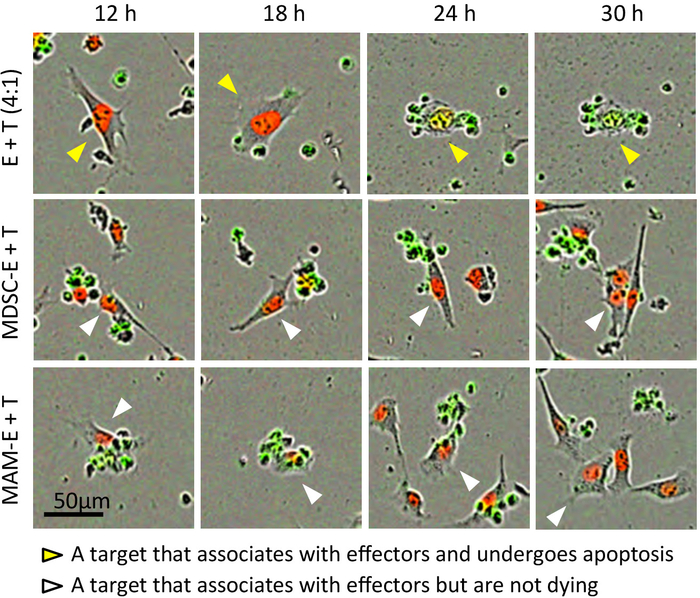
図 3: 相互作用 CD8+ T 細胞と癌細胞。エフェクター CD8 と共同培養されたターゲット E0771 LG_NLR 細胞 (T) の代表的なコマ撮りムービーから静止画+ T 細胞 (E) エフェクター/ターゲット 4:1 の比率で。MDSC E と MAM E は、エフェクター細胞プレインキュベートした M MDSCs と MAMs それぞれを示します。合成画像 (位相コントラスト、赤と緑のチャンネルからイメージを含む) が表示されます。矢印を同じセル異なるフィールドと時間点 ~ 追跡します。黄色の矢印: エフェクターに関連付けます、アポトーシス、白い矢印を受けるターゲット: ターゲットをエフェクターに関連付けますが、アポトーシスを起こしません。この図の拡大版を表示するのにはここをクリックしてください。

図 4: 癌細胞のアポトーシスの検出。イメージング後 18 時間でコマ撮りムービーから抽出した代表的なフィールド。合成画像 (左; 位相コントラスト、赤と緑のチャンネル) と赤から画像なし (中央) チャネルまたは赤/緑 (右) 重複マスク (黄色) が表示されます。右の列に黄色のドットは、がん細胞のアポトーシスを表します。この図の拡大版を表示するのにはここをクリックしてください。
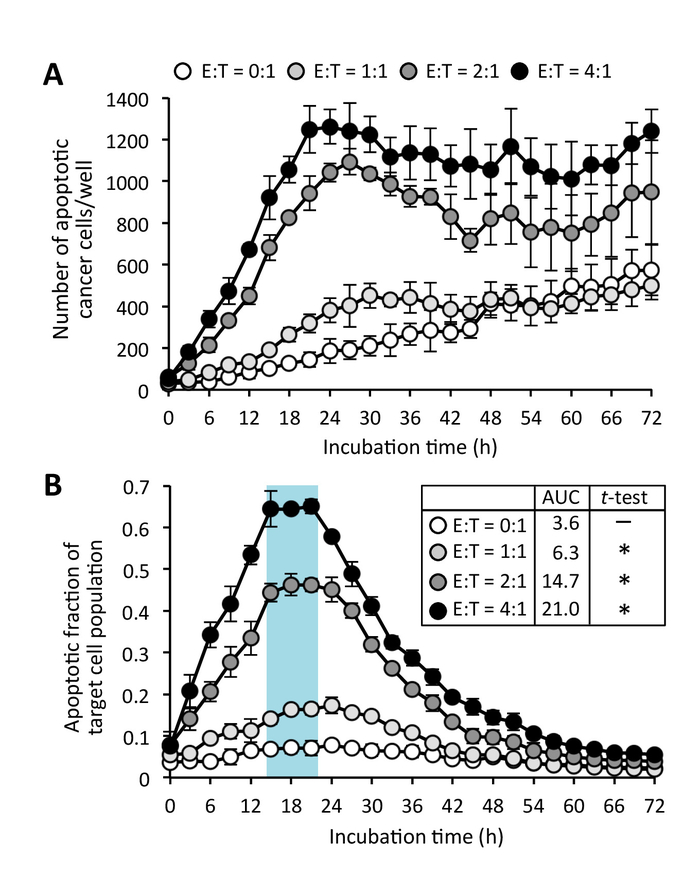
図 5: CD8+ T 細胞による癌細胞アポトーシス誘導。(A) の数アポトーシスの癌細胞エフェクター C8 と+ T 細胞ターゲットの比率 (E:T) に異なるエフェクターで。 ターゲット セル人口の (B) アポトーシスの割合。データは、平均 ± 曲線 (AUC) 下の SD 平均面積も表示されます。対になっていないt-ウェルチの補正とテストは、AUC を分析に使用されました。* P < E:T に比べて 0.0001 = 0:1。この図の拡大版を表示するのにはここをクリックしてください。
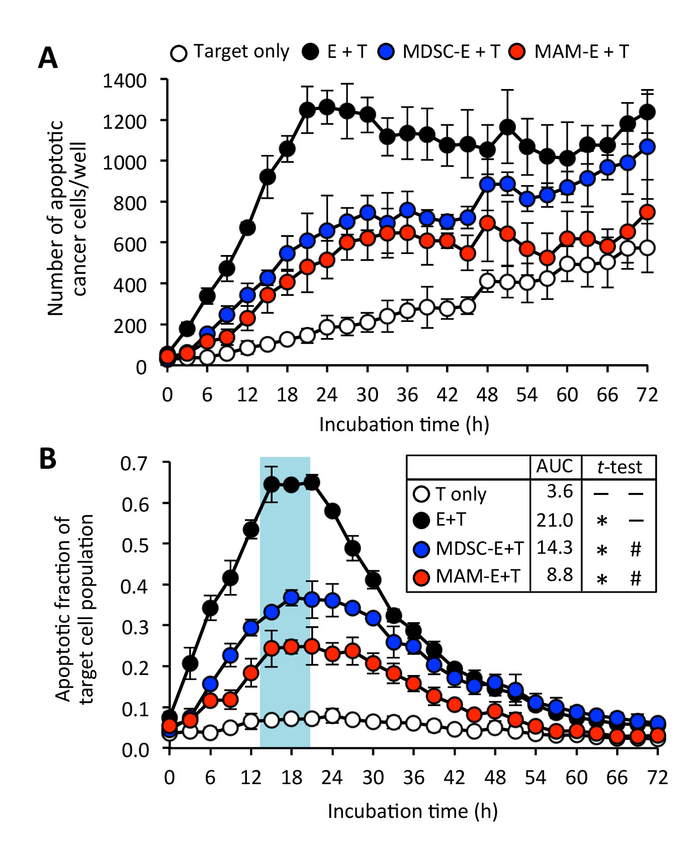
図 6: cd8 陽性の細胞毒性に及ぼす骨髄細胞の腫瘍浸潤+ T 細胞。(A) がんのアポトーシス細胞数 (対象: T) C8 で培養された+ T 細胞 (エフェクター: E) E:T 比 4:1 で。CD8+ T 細胞を単球性-骨髄由来抑制細胞の液体 (黒丸) の有無で培養済み (MDSC e: 青円) または大食細胞の転移関連 (MAM e: 赤い円)。データは、平均 ± SD. (B) アポトーシス ターゲット セル人口の。データは、平均 ± SD. 意味 AUC を示します。対になっていないt-ウェルチの補正とテストは、AUC を分析に使用されました。* P < 0.0001 に比べて T のみ、 #P < 0.0001 E + T に比べるとこの図の拡大版を表示するのにはここをクリックしてください。
補足図 1。肺転移からサプレッサー細胞を分離するための戦略をゲートします。(A) 代表的なドット プロット単球性骨髄由来抑制細胞 (M MDSCs) と転移関連マクロファージ (MAMs) を分離します。MAMs (Ly6C低) と M-MDSCs (Ly6C高) を区別するために Ly6C レベルのしきい値は、肺胞マクロファージ (RMAC) のそれに基づいています。並べ替えられた M MDSCs (B) 純度 (CD45+Ly6G-CD11b+Ly6C高) と MAMs (CD45+Ly6G-CD11b+Ly6C低)。このファイルをダウンロードするここをクリックしてください。
補足図 2。分裂細胞の代表的なイメージ。ターゲット E0771 LG_NLR モノラル細胞の代表的なコマ撮りムービーから静止画。トップ: 位相コントラスト、赤と緑のチャンネルの画像を含む画像合成。下: 赤/緑の複合画像 (赤と緑のチャンネル) 重複マスクです。このファイルをダウンロードするここをクリックしてください。
補足図 3。骨髄系細胞の腫瘍浸潤の CD8 の増殖に及ぼす影響+ T 細胞。CD8 の CFSE と蛍光標識希釈を示す (A) 代表的なヒストグラム+ T 細胞。素朴な脾 CD8+ T 細胞がプロトコル 3 で説明したように分離・ CFSE の 5 μ M の 37 ° C 15 分で付いた。ラベル付きの T 細胞は IL-2 の存在下で培養と抗 CD3/CD28 プロトコル 4 で説明したように骨髄系細胞の有無と抗体を活性化.4 日後、フローサイト メーターによる T 細胞の蛍光グリーンが検出されました。(B) 課インデックス CD8 の+ T 細胞は前述の17として計算。データは、平均 ± SEM. * P < 制御、 #P と比較して 0.01 < αCD3/CD28 株式会社に比べて 0.05ファイルのダウンロードは、こちらをご覧ください。
附則ムービー 1。図 3、4 の映画E + t.このファイルをダウンロードするここをクリックしてください。
附則ムービー 2。図 3、4 の映画エフェクター (E)。このファイルをダウンロードするここをクリックしてください。
附則ムービー 3。図 3、4 の映画ターゲット (T)。このファイルをダウンロードするここをクリックしてください。
附則ムービー 4。図 3、4 の映画MDSC E + t.このファイルをダウンロードするここをクリックしてください。
附則ムービー 5。図 3、4 の映画MAM E + t.このファイルをダウンロードするここをクリックしてください。
附則ムービー 6。図 3、4 の映画MAM E + T (増殖).このファイルをダウンロードするここをクリックしてください。
ディスカッション
この手法は 2 つの別々 の共培養手順:+ T 細胞の潜在的なサプレッサー細胞と CD8 を共培養と共培養 '中古エアコン' CD8+ T 細胞と標的腫瘍細胞 (図 1)。共培養の最初のステップはかなり類似する CD8 の+ T 細胞増殖アッセイ CD8 サプレッサー細胞の影響を決定するために一般的に使用される+ T 細胞の機能。ただし、T 細胞の増殖では、彼らの細胞毒性と常に関連しません。たとえば、我々 は M MDSCs と MAMs 共同文化を発見した CD8 の増殖を減少ではなく増加+ T 細胞の CD3/CD28 抗体 (補足図 3) 活性化の存在下でこれらはあらかじめ CD8 をエアコンに対し+T 細胞はターゲット癌細胞 (図 4図 5図 6) に対して細胞毒性を減少を示した。これらの結果は、この CD8 によって提供されるターゲット癌細胞のアポトーシスによって立証される、機能の活動評価の重要性を強調+ T 細胞の細胞毒性の試金。
このアッセイのもとその CD8+ T 細胞 E0771 LG マウス乳腺腫瘍細胞 (図 5) の最大アポトーシスを誘導するために約 15 時間培養が必要です。この遅延は、エフェクター細胞に目標とそれに伴う免疫シナプス形成、カスパーゼ-3 (補足の映画 1 の活性化によって測定されるターゲットでアポトーシス シグナルを誘導するために必要な時間との最初の接触間のタイムラグが原因かもしれない).また腫瘍細胞のアポトーシスの数はおそらく T 細胞によるターゲットの排除、死んだ細胞からの蛍光信号の損失のため 24 時間後高原に達することがわかりました。最適な時点の決定はさまざまな条件の適切な比較のために重要なので、ピーク アポトーシスの時間を特定するこの機能はこの試金の主要な利点の 1 つです。今回は+ T の間コントロール CD8 細胞傷害の違いなど細胞および CD8 の MDSC/ママの教育がある+ T 細胞は 15-18 h 72 h (図 5) と比較して大きく、したがってエンドポイントは、72 時間の潜伏期間を使って試してみる誤解を招く結果となります。
このメソッドにより CD8 限られた毒性のメカニズムに深い洞察力を提供するリアルタイムのエフェクタ-ターゲット細胞の相互作用の可視化、また+ T 細胞は抑制性細胞でプレインキュベートしました。例えば、我々 はことを観察した CD8+ T M MDSCs または MAMs プレインキュベートした細胞発生と標的腫瘍細胞相互作用、アポトーシス (附則ムービー 4、附則ムービー 5 附則ムービー 6) を常に誘発しなかった。我々 は、このイベントを定量化しなかったが可能かつ定量化し、アポトーシス誘導との相関相互作用時間と出会いの割合を比較する興味深いでしょう。もう一つの大きな利点は、このメソッドが (例えば、1 x 103ターゲットの) と 4 x 103ウェルあたりのエフェクター細胞の細胞の数が少ないを必要とすることです。実際には、必要な場合は、384 ウェル プレート形式のこのプロトコルをさらに小型することができます。したがって、このアッセイなど体内からまたは生体サンプル ex 派生の in vitroテスト貴重な細胞を使用して細胞の数が限られている高スループット スクリーニングと実験に適しています。
その一方で、現在の試金の制限は、いくつかの条件で死んだエフェクター細胞の重要な番号の存在です。エフェクター CD8 のターゲット癌細胞のアポトーシスを区別するに精度を高めるために+ T 細胞、細胞が分類されるターゲットの核と核のデータ分析のため (エフェクター細胞を含まない) のサイズ制限が適用されます。試金 (図 2)。ただし、いくつかのインスタンスは、+ T (緑) アポトーシス CD8 の集計のオーバーレイが結果を混同するかもしれない非アポトーシス ターゲット癌細胞に細胞があります。この制限は、エフェクターとエフェクター細胞の十分な数が利用できると仮定して、標的腫瘍細胞共培養する前に細胞の死んだ細胞除去カラムを使用によって軽減することができます。複雑な顕微鏡システムとエフェクター CD8 をラベリングによって偽の肯定的な信号を減少させることがあります+ T 細胞蛍光体ターゲット細胞核および蛍光カスパーゼ 3 基板とは異なります。
これまでのところ、このプロトコルは CD8 抗原非特異的活性化を調査するため利用されている+ T 細胞。MDSCs と Tam 腫瘍微小環境における T 細胞機能を抑制する、抗原非特異的メカニズムを介して、末梢リンパ組織において MDSCs は、抗原特定の方法18T 細胞反応を抑制します。OT 1 から+ T 細胞のような携帯型の免疫抑制機能に CD8 を使用して生体外で増殖アッセイを調査するトランスジェニック マウスは一般的に使用されます。このアッセイで (卵白アルブミン (OVA) 特異的 T 細胞受容体を発現する) OT 1 T 細胞共培養している OVA ペプチドの存在下で抑制 MDSCs と私たちの細胞毒性の試金の最初の文化のために適当である (すなわち.、の細胞の活性化 T存在または抑制の不在)。また、OVA は、OT 1 T 細胞による抗原特異的癌細胞殺害を誘発することができますを表現する標的がん細胞を操作することは不可能です。したがって、アッセイも MAM/MDSC を介する抗原特異的 T 細胞の活性化抑制の調査を有効になります。また、人間の CD3 と CD28 に対する活性化抗体は、市販と臨床検体から人間の Tam を分離するためのプロトコルが確立された19をされている人間の細胞を調査するアッセイを適用することが可能です。
この試金をまとめて非常に汎用性は、他の免疫細胞型の細胞毒性を調べるために使用できます。現在、我々 のラボでそれが様々 な条件の下で抗原依存性細胞毒性を調べる拡張、スクリーニングも高スループットの開発中です。
開示事項
著者が明らかに何もありません。
謝辞
この作品は、Wellcome の信頼 (101067/Z/13/Z (JWP)、109657/Z/15/Z (TK)、615KIT/J22738 (TK)、英国) と MRC (氏/N022556/1 (JWP、TK)、イギリス) からの助成金によって支えられました。NOC と DDS を認める国家表現型スクリーニング センター Phenomics 発見イニシアティブと癌研究イギリス (NOC) からのサポート
資料
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin EDTA (1X) | Gibco | 25300-054 | |
| 12-Well Cell Culture Plate | Freiner Bio-One | 665-180 | |
| 1x PBS | Gibco | 14190-094 | |
| 2-mercaptethanol | Sigma | M6250-10ML | |
| 5mL Plystyrene Round-Bottom Tube | FALCON | 352054 | |
| 96-Well Cell Culture Plate (Round Bottom ) | Costar | 3799 | Co-culture of CD8+T cells with sorted myeloid cells |
| 96-well plate (Flat bottom) | Nunc | 165305 | Co-culture of CD8+T cells with target cells for cytotoxicity assay |
| AF647 anti-mouse F4/80 Antibody | BIO-RAD | MCA497A647 | Clone: CIA3-1, Lot#: 1707, 2 μL/1x10^6 cells |
| AlexaFluor700 anti-mouse CD8 Antibody | Biolegend | 100730 | Clone: 53-6.7, Lot#: B205738, 0.5 μL/1x10^6 cells |
| anti-mouse CD28 Antibody | Biolegend | 102111 | Activation of isolated CD8+ T cells, Clone: 37.51, Lot#: B256340 |
| anti-mouse CD3e Antibody | Biolegend | 100314 | Activation of isolated CD8+ T cells, Clone: 145-2C11, Lot#: B233720 |
| APC anti-mouse CD3 Antibody | Biolegend | 100236 | Clone: 17A2, Lot#: B198730, 0.5 μL/1x10^6 cells |
| APC/Cy7 anti-mouse Ly6C Antibody | Biolegend | 128026 | Clone: HK1.4, Lot#: B248351, 1 μL/1x10^6 cells |
| Bovine Serum Albmin | Sigma | A1470-100G | |
| Cell Strainer (100μm Nylon) | FALCON | 352360 | To smash the spleen |
| Cell Strainer (40μm Nylon) | FALCON | 352340 | To filter the lung digestion |
| DAPI | Biolegend | 422801 | |
| Dulbecco′s Modified Eagle′s Medium | Gibco | 41966-029 | |
| EasySep Mouse CD8+ T Cell Isolation Kit | StemCell Technologies | 19853 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FITC anti-mouse CD4 Antibody | Biolegend | 100406 | Clone: GK1.5, Lot#: B179194, 0.5 μL/1x10^6 cells |
| Geltrex Ready-to-Use | Gibco | A1596-01 | Coating the 96-well plates for cytotoxicity assay |
| IncuCyte NucLight Red Lentivirus Reagent | Essen BioScience | 4476 | Lenti viral particules encoding mKate2 |
| IncuCyte ZOOM | Essen BioScience | Detector (fluorescence microscope) | |
| IncuCyte ZOOM 2018A | Essen BioScience | Analysis software | |
| L-Glutamine (100X) | Gibco | A2916801 | |
| Lung Dissociation Kit | Miltenyi | 130-095-927 | Preparation of single cell suspension from the tumor-bearing lung |
| MycoAlert Mycoplasma Detection Kit | Lonza | LT07-318 | |
| Non-essential amino acid (100X) | Gibco | 11140-035 | |
| NucView488 | Biotium | 10403 | Fluoregenic caspase-3 substrate |
| PE anti-mouse Ly6G Antibody | Biolegend | 127607 | Clone: 1A8, Lot#: B258704, 0.5 μL/1x10^6 cells |
| PE/Cy7 anti-mouse CD11b Antibody | Biolegend | 101216 | Clone: M1/70, Lot#: B249268, 0.5 μL/1x10^6 cells |
| Pen Strep | Gibco | 15140-122 | Penicillin Streptomycin for primary culture of cells |
| PerCP/Cy5.5 anti-mouse CD45 Antibody | Biolegend | 103132 | Clone: 30-F11, Lot#: B249564, 0.5 μL/1x10^6 cells |
| Polybrene (Hexadimethrine bromide) | Sigma | H9268 | |
| Puromycin | Gibco | A11138-03 | |
| RBC Lysis Buffer (10X) | Biolegend | 420301 | |
| Recombinant murine IL-2 | Peprotech | 212-12 | Activation of isolated CD8+ T cells |
| Sodium pyruvate (100X) | Gibco | 11360-070 | |
| TruStain fcX (anti-mouse CD16/32) Antibody | Biolegend | 101320 | |
| : Nikon 10X objective (resolution 1.22 µm) : Green channel excitation: 440 - 480 nm : Green channel emission: 504 - 544 nm : Red channel excitation: 565-605 nm : Red channel emission: 625 - 705 nm | |||
参考文献
- Barry, M., Bleackley, R. C. Cytotoxic T lymphocytes: all roads lead to death. Nature Reviews in Immunology. 2, 401-409 (2002).
- Durgeau, A., Virk, Y., Corgnac, S., Mami-Chouaib, F. Recent advances in targeting CD8 T-cell immunity for more effective cancer immunotherapy. Frontiers in Immunology. 9. , 14(2018).
- Tanaka, A., Sakaguchi, S. Regulatory T cells in cancer immunotherapy. Cell Research. 27, 109-118 (2017).
- Fleming, V., et al. Targeting myeloid-derived suppressor cells to bypass tumor-induced immunosuppression. Frontiers in Immunology. 9, 398(2018).
- Cassetta, L., Kitamura, T. Macrophage targeting: opening new possibilities for cancer immunotherapy. Immunology. 155, 285-293 (2018).
- Chahroudi, A., Silvestri, G., Feinberg, M. B. Measuring T cell-mediated cytotoxicity using fluorogenic caspase substrates. Methods. 31, 120-126 (2003).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Review of Vaccines. 9, 601-616 (2010).
- Azimi, M., et al. Identification, isolation, and functional assay of regulatory T Cells. Immunological Investigation. 45, 584-602 (2016).
- Bruger, A. M., et al. How to measure the immunosuppressive activity of MDSC: assays, problems and potential solutions. Cancer Immunology Immunotherapy. , (2018).
- Qian, B., et al. A distinct macrophage population mediates metastatic breast cancer cell extravasation, establishment and growth. PLoS One. 4, e6562(2009).
- Kitamura, T., et al. Monocytes differentiate to immune suppressive precursors of metastasis-associated macrophages in mouse models of metastatic breast cancer. Frontiers in Immunology. 8, 2004(2018).
- Bronte, V., et al. Recommendations for myeloid-derived suppressor cell nomenclature and characterization standards. Nature Communications. 7, 12150(2016).
- Kitamura, T., et al. CCL2-induced chemokine cascade promotes breast cancer metastasis by enhancing retention of metastasis-associated macrophages. Journal of Experimental Medicine. 212, 1043-1059 (2015).
- Ewens, A., Mihich, E., Ehrke, M. J. Distant metastasis from subcutaneously grown E0771 medullary breast adenocarcinoma. AnticancerResearch. 25, 3905-3915 (2005).
- Choppa, P. C., et al. Multiplex PCR for the detection of Mycoplasma fermentans, M. hominisandM. penetransin cell cultures and blood samples of patients with chronic fatigue syndrome. Molecular and Cellular Probes. 12, 301-308 (1998).
- Strober, W. Trypan blue exclusion test of cell viability. Current protocols in immunology. , Appendix 3:Appendix 3B (2001).
- Koyanagi, M., Kawakabe, S., Arimura, Y. A comparative study of colorimetric cell proliferation assays in immune cells. Cytotechnology. 68, 1489-1498 (2016).
- Gabrilovich, D. I., Nagaraj, S. Myeloid-derived-suppressor cells as regulators of the immune system. Nature Reviews in Immunology. 9, 162-174 (2009).
- Cassetta, L., et al. Isolation of mouse and human tumor-associated macrophages. Advances in Experimental Medicine and Biology. 899. 899, 211-229 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved