Method Article
Rilevazione in tempo reale nell'apoptosi delle cellule tumorali in Vitro indotta da CD8+ T cellule per studiare funzioni immuni soppressive di tumore-infiltrazione di cellule mieloidi
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Descriviamo qui un protocollo per studiare la citotossicità di pre-attivato CD8+ T cellule contro le cellule tumorali dalla rilevazione apoptotic microscopia del cancro cellule via in tempo reale. Questo protocollo può studiare i meccanismi dietro la soppressione delle cellule T indotta da cellula mieloide e valutare composti puntati replenishing T cellule tramite blocco delle cellule mieloidi soppressive immuni.
Abstract
Potenziamento della capacità di tumore-uccisione di CD8+ T cellule nei tumori, insieme a loro infiltrazione del tumore efficiente, è un elemento chiave del successo immunoterapie. Diversi studi hanno indicato che le cellule mieloidi di infiltrazione del tumore (ad es., cellule mieloidi-derivato del soppressore (MDSC) e macrofagi associati al tumore (TAM)) sopprimono citotossicità di CD8+ T cellule nel microambiente tumorale e quello di targeting Queste cellule mieloidi normative possono migliorare immunoterapie. Qui, presentiamo un sistema di analisi in vitro per valutare gli effetti soppressivi immuni di monocytic MDSC e TAMs sulla capacità di tumore-uccisione di CD8+ T cellule. A tal fine, abbiamo coltivato prima ingenuo splenica CD8+ T cellule con anticorpi attivanti anti-CD3/CD28 in presenza o in assenza di cellule del soppressore e poi co-coltivate le cellule T pre-attivate con cellule tumorali bersaglio in presenza di un fluorogenici substrato di caspase-3. Fluorescenza dal substrato in cellule di cancro è stato rilevato da microscopia di fluorescenza in tempo reale come indicatore di apoptosi delle cellule di T-cellula indotta da tumore. In questa analisi, possiamo rilevare con successo l'aumento di apoptosi delle cellule del tumore di CD8+ T cellule e la sua soppressione dalla pre-cultura con TAMs o MDSC. Questo saggio funzionale è utile per investigare CD8+ T cell meccanismi di soppressione di cellule mieloidi regolatorie e identificazione bersagli per superarla tramite screening su vasta scala.
Introduzione
È noto che CD8+ T cellule in grado di eliminare le cellule tumorali quando esercitano la loro citotossicità completo. Dopo l'attivazione del recettore delle cellule T (TCR), CD8+ T cellule proliferano e si differenziano in cellule effettrici citotossiche. L'espanso e attivati CD8+ T cellule secernono granuli citotossici, compreso perforine e granzimi, che vengono trasferiti in cellule bersaglio e avviare varie vie litiche come caspase-3 mediata apoptosi1. CD8+ T cellule possono anche indurre apoptosi delle cellule del tumore attraverso l'attivazione di recettori sulle cellule bersaglio, quali i recettori per il fattore di necrosi tumorale-α (TNF-α), apoptosi primi segnalano ligand (FasL), o TNF-related apoptosis-inducing ligand (TRAIL). Inoltre, il CD8 attivato+ T cellule secernono interferone-γ (IFN-γ) che possono sopprimere la proliferazione delle cellule tumorali e aumentare la sensibilità delle cellule del tumore di CD8+ T cellule via il su-regolamento del FasL ricevitore1. Dato il potenziale per CD8+ T capacità di uccisione di tumore, diverse strategie per aumentare la loro citotossicità (ad esempio, inibitori di checkpoint, vaccinazione anti-tumorale e trasferimento adottivo del recettore chimerico antigene (auto) che esprimono le cellule T) sono state stabilite e mostrati effetti terapeutici significativi su alcuni tipi di cancro2. Tuttavia, raccogliendo la prova suggerisce che cellule immuni di infiltrazione del tumore come cellule T regolatorie, cellule mieloidi derivato soppressore (MDSC) e macrofagi associati al tumore (TAM) possono sopprimere CD8+ T funzioni delle cellule e limitare l'efficacia di immunoterapie3,4,5. Per migliorare tale immunoterapie, è importante capire come immuni limite di cellule suppressor CD8+ la citotossicità delle cellule T. L'identificazione di CD8+ cellula T soppressione meccanismi così come bersagli per superarla, richiederà lo sviluppo e l'utilizzo di analisi in vitro.
Il metodo gold standard di misurazione CD8+ citotossicità delle cellule di T è il test di rilascio di cromo in cui il rilascio della sonda radioattiva (51Cr), dal target le cellule che vengono lisate dai CD8+ T cellule, è determinato6. Tuttavia, questo test ha diversi inconvenienti, tra cui sensibilità relativamente bassa, alta priorità bassa, incapacità di rilevare eventi apoptotici precoci, problemi di smaltimento pericolosi e limitata compatibilità con automatizzato liquid handling e rilevamento per sostenere applicazioni di throughput più elevate. Un altro metodo comune è analisi cytometric di flusso in cui apoptosi delle cellule tumorali bersaglio viene rilevato da annexin V associazione7. In questo test, è possibile rilevare altri parametri quali la morte delle cellule bersaglio utilizzando ioduro di propidio (PI) o 7-aminoactinomycin D (7-AAD) e l'attivazione delle cellule effettrici indicato dall'espressione CD107a o CD69, oltre l'apoptosi nelle cellule bersaglio7 . Tuttavia, questo test richiede tantissime cellule suppressor rispetto al test di rilascio di cromo. Richiede anche il distacco e la disaggregazione delle cellule bersaglio aderente e questo può influenzare i risultati. Infatti, il cromo rilasciare analisi o test citofluorimetrico non sono comunemente utilizzati per studiare gli effetti di cellule suppressor sulle funzioni delle cellule T. Invece, la misurazione della proliferazione di cellule T indicata dalla diluizione di un colorante fluorescente (ad es., CFSE) pre-caricati in cellule T viene spesso utilizzata per valutare l'inibizione di CD8+ funzione a cellula T di cellule del soppressore. Rilevamento della produzione di IFN-γ da cellule coltivate di T è un altro metodo standard per valutare gli effetti delle cellule del soppressore delle cellule T attivazione8,9. Tuttavia, i risultati di queste analisi non necessariamente correlato alla cella di destinazione uccidendo capacità di CD8+ T cellule.
Presentiamo qui un test funzionale alternativo per valutare gli effetti delle cellule del soppressore, specialmente macrofagi nei tumori metastatici, sulla citotossicità di CD8+ T cellule. Questo metodo determina la citotossicità di CD8+ T cellule, pre-coltivate con o senza le cellule soppressore in presenza di anticorpi attivanti anti-CD3/CD28, rilevando gli apoptosi della cellula tumorale, indicato dalla fluorescenza da un fluorogenic caspase-3 substrato6 utilizzo automatizzato microscopia time-lapse (Figura 1). Questo protocollo ha diversi vantaggi rispetto ad altri metodi; richiede solo un piccolo numero di cellule, consente il rilevamento di morte delle cellule tumorali aderente con alta sensibilità, può immagine interazione effettore--obiettivo in tempo reale ed è favorevole alla screening su vasta scala.
In questo protocollo, macrofagi associati a metastasi (MAMs) e loro progenitore monocytic-MDSC (M-MDSC) isolato da tumori metastatici in topi sono utilizzati come cellule del soppressore. In modelli murini di cancro della mammella metastatico, una popolazione distinta dei macrofagi caratterizzata come F4/80altaLy6G-CD11baltaLy6Cbasso si accumula nel polmone contenente i tumori metastatici. Questa popolazione del macrofago è raramente trovata nel polmone normale e così chiamata macrofagi associati a metastasi (MAMs)10. In questi modelli di mouse, un altro mieloide cellule popolazione, definita come F4/80altaLy6G-CD11baltaLy6Calta, inoltre si accumula principalmente nel polmone metastatico dove dà luogo a muia11. Base alle loro caratteristiche, il CD11baltaLy6Calta MAM cellule progenitrici potrebbero rappresentare M-MDSC12.
Protocollo
Tutte le procedure che coinvolgono topi sono stati condotti in conformità con la licenza autorizzazione da UK Home Office (P526C60B3). Informazioni commerciali reagenti e attrezzature sono elencati nella Tabella materiali.
1. preparazione delle cellule bersaglio che esprimono la proteina fluorescente rossa nei loro nuclei
- Ottenere una linea cellulare del cancro di destinazione del mouse da una fonte appropriata.
Nota: Nel presente protocollo, sono utilizzati un derivato altamente metastatico del E0771 del mouse tumore mammario cellule (E0771-LG)13 . Cellule parentali E0771 provengono da C57BL/6 topi14. - Scongelare e mantenere una fiala di cellule E0771-LG con di Dulbecco per volta Eagles Medium (DMEM) compresi 10% (v/v) siero bovino fetale (FBS) in un'incubatrice di coltura cellulare a 37 ° C, umidità 95% e 5% CO2.
Nota: Dovrebbe essere confermato che le cellule sono negative per micoplasma. A tal fine, cultura E0771 cellule (o cellule da sottoporre a) per 2-3 giorni come descritto in precedenza (in assenza di antibiotici e antimicotici), raccogliere 500 μL di terreno di coltura. Centrifugare il mezzo a 12.419 x g per 60 s per eliminare i detriti cellulari e trasferire il surnatante in nuovi tubi. Determinare eventuali contaminazioni da micoplasma utilizzando un kit di test disponibile nel commercio del micoplasma (vedere Tabella materiali) e/o PCR15 seguendo le istruzioni del produttore. - Cellule di3 E0771-LG seme 5x10 per pozzetto in un 12-pozzetti e cultura che le cellule con 10% (v/v) FBS-DMEM pernottamento in un incubatore a 37 ° C, umidità 95% e 5% CO2.
Nota: Se il tasso di proliferazione delle cellule bersaglio è basso (superiore a 36 h tempo di raddoppiamento della popolazione), il numero delle cellule può essere aumentato a 1 x 104. - Sostituire il mezzo con 1 mL di 10% (v/v) FBS-DMEM tra cui 10 μg/mL polybrene e aggiungere 25 μL di particelle lentivirali (1 x 106 TU/mL) codifica una nucleare limitata proteina fluorescente rossa (mKate2, fare riferimento alla Tabella materiali).
- Coltura delle cellule per 24 h in un incubatore a 37 ° C, umidità 95% e 5% CO2.
- Sostituire il mezzo con il 10% (v/v) FBS-DMEM e coltura delle cellule per 24-48 h in un incubatore a 37 ° C, umidità 95% e 5% CO2.
- Sostituire il mezzo con il 10% (v/v) FBS-DMEM compreso 1 con puromicina μg/mL, quando le cellule cominciano a esprimere la proteina fluorescente rossa e le cellule della coltura fino a quando essi sono 80-90% confluenti.
Nota: La concentrazione di con puromicina sarà diverso tra tipi di cella di destinazione e deve essere ottimizzato utilizzando un-transfected le cellule. - Sottocultura sopravvivente cellule per 1-3 passaggi con il 10% (v/v) FBS-DMEM compreso 1 con puromicina μg/mL e crioconservare gli stock in un sistema di deposito di azoto liquido vapore fase fino all'utilizzo.
2. isolamento delle cellule del soppressore dai tumori in topi
Nota: In questo protocollo, cellule del soppressore (cioè, MAMs e M-MDSC) sono isolate dal polmone contenente i tumori metastatici stabiliti dalle cellule E0771-LG. Condizioni per la dissociazione dei tessuti e delle cellule ordinamento dovrebbero essere ottimizzate per isolare le cellule dai tessuti differenti.
- Iniettare 1 x 106 cellule tumorali (E0771-LG) nella vena caudale di topi di 7-10 settimane vecchio syngeneic (C57BL/6), femminile.
- Dopo 14 giorni, è necessario isolare il polmone contenente i tumori metastatici e preparare sospensioni unicellulari dai polmoni irrorati tramite digestione enzimatica come descritto in precedenza11.
Nota: In questo protocollo, quattro topi sono iniettati con le cellule tumorali e loro polmoni metastatici sono combinati per ottenere sufficienti cellule del soppressore. - Incubare le sospensioni di singola cellula con l'anticorpo anti-topo CD16/CD32 per 30 min in ghiaccio e macchia con anticorpi fluorescenti per CD45, F4/80, CD11b, Ly6C e Ly6G (vedere Tabella materiali) per un altro 30 min10,11 , 13.
- Lavare le cellule marcate una volta con 1 mL di PBS contenente il 2% (p/v) albumina di siero bovino (BSA) e risospendere il pellet cellulare con 500-1000 μL di PBS contenente il 2% (p/v) BSA.
- Aggiungere 3 μM di DAPI e ordinare M-MDSC (CD45 DAPI–++Ly6G F4/80-CD11baltaLy6Calta) e MAMs (CD45 DAPI–++Ly6G F4/80-CD11balta Ly6Cbasso) utilizzando un Classificatore celle (complementare figura 1).
Nota: La soglia del livello di Ly6C per distinguere MAMs (Ly6Cbasso) e M-MDSC (Ly6Calta) si basa su quello dei macrofagi alveolari residenti (RMAC). La purezza delle cellule ordinate viene misurata tramite citometria a flusso con una purezza prevista di oltre il 90%. - Risospendere le cellule ordinate con 400 μL di DMEM contenente 20% (v/v) FBS, 1% (v/v) penicillina/streptomicina, 2 mM L-Glutammina, acido amminico non essenziale di 1% (v/v), piruvato di sodio di 1 mM e 50 nM 2-mercaptoetanolo (chiamato arricchito-DMEM, E-DMEM).
- Contare il numero di cellule vive, usando il metodo di esclusione blu Trypan16 e regolare a 2 x 106 cellule/mL con E-DMEM.
- Mantenere le cellule su ghiaccio fino all'utilizzo.
3. isolamento di CD8+ T cellule dalla milza dei topi
- Isolare la milza da un mouse che è syngeneic per la linea cellulare di cancro destinazione (cioè, i topi di C57BL/6 in questo protocollo) come segue:
- Eutanasia animale per inalazione di CO2 .
- Metti l'animale su una tavola di dissezione pulito e pulire la pelle con etanolo al 70% (v/v).
- Tagliare la pelle addominale utilizzando forbici per esporre la milza
- Isolare la milza, che si trova inferiore allo stomaco, e metterlo in una provetta contenente 5 mL di PBS ghiacciata.
- Utilizzando il pistone interno di una siringa sterile 5 mL, macinare la milza su un colino di cella μm 100 impostato su un tubo da 50 mL.
- Passare le cellule attraverso il filtro usando totale 10 mL di PBS.
- Centrifugare la sospensione cellulare a 337 x g per 5 min e aspirare il supernatante.
- Risospendere il pellet cellulare in 1 mL di PBS contenente 2 mM EDTA e 0,5% (p/v) BSA (tampone di corsa) e filtrare attraverso un colino di cella 40 μm.
- Contare il numero di cellule vive e regolare a 1 x 108 cellule/mL utilizzando il buffer in esecuzione.
Nota: Tenere una piccola aliquota di cellule come un campione di pre-arricchimento per un controllo di purezza. - Arricchire per CD8+ T cellule utilizzando un kit di selezione negativa e un selezionatore magnetico (Vedi Tabella materiali).
- Trasferire 1 x 108 (1 mL) delle cellule splenocytes in una provetta di turno-fondo polistirolo da 5 mL.
- Aggiungere 50 μL di anticorpi biotinilati e incubare a temperatura ambiente per 10 min.
- Aggiungere 125 µ l di biglie magnetiche streptavidina coniugata e incubare a temperatura ambiente per 5 min.
- Aggiungere 1,325 mL di tampone di corsa e mescolare delicatamente pipettando.
- Collocare la provetta nel magnete e incubare a temperatura ambiente per 2,5 min.
- Pick up il magnete e versare la sospensione cellulare arricchita di un nuovo tubo.
- Risospendere le cellule arricchite con 200 μL di E-DMEM (vale a dire., DMEM contenente 20% (v/v) FBS, 1% (v/v) penicillina/streptomicina, 2 mM L-Glutammina, acido amminico non essenziale di 1% (v/v), piruvato di sodio di 1 mM e 50 nM 2-mercaptoetanolo).
- Contare il numero di cellule vive e regolare a 2 x 106 cellule/mL con E-DMEM. Mantenere le cellule a 37 ° C in un CO2 incubatore fino all'utilizzo.
Nota: Tenere una piccola aliquota di cellule come un esempio di post-arricchimento per un controllo di purezza. - Determinare la purezza di CD8+ T cellule mediante citometria a flusso come segue:
- Prendere 1 x 104 celle da pre-arricchimento (punto 3.6) o campioni post-arricchimento (punto 3.9) e regolare il volume totale di ciascuno a 100 μL con buffer di esecuzione.
- Incubare le sospensioni di singola cellula con l'anticorpo anti-topo CD16/CD32 per 30 min in ghiaccio e macchia con anticorpi fluorescenti per CD45, CD3, CD4 e CD8 (vedere Tabella materiali) per altri 30 min.
- Lavare le cellule marcate con 500 μL di PBS contenente il 2% (p/v) BSA e risospendere il pellet cellulare con 500-1000 μL di PBS contenente il 2% (p/v) BSA.
- Aggiungere 3 μM di DAPI e determinare la percentuale di CD3+CD4–CD8+ cellule nel CD45 totale+ popolazione.
4. attivazione e l'espansione dell'isolato CD8+ T cellule
- Aliquotare 1 x 105 celle per 50 μL CD8+ T cellule (preparate al punto 3.9) nei pozzetti di una piastra di fondo U 96 pozzetti.
- Aggiungere 1 x 105 celle per 50 μL soppressore cellule (preparate al punto 2.7) o 50 μL di DMEM E nei pozzetti.
- Preparare il supporto di attivazione che è costituito da E-DMEM, fattore distimolazione di 4 x 104 U/mL 1 (CSF-1), 240 l'interleuchina (il-2) 2 U/mL, 8 μg/mL anti-topo CD3ε anticorpo e 16 μg/mL anti-CD28 anticorpo.
Nota: CSF-1 non è richiesto per l'attivazione delle cellule T, ma è essenziale per la sopravvivenza delle cellule del soppressore in questo protocollo (cioè, MAMs e M-MDSC). Così, viene mantenuta in co-coltura delle cellule di T con cellule tumorali bersaglio per mantenere la coerenza in condizioni di coltura. Dal CSF-1 è trovato nelle concentrazioni di nano-molare in tutti i tessuti ed è necessario per monocito/macrofago vitalità in vivo, questo è un contesto fisiologico per queste cellule. - Aggiungere 50 μL di mezzo di attivazione (punto 4.3) e 50 μL di DMEM E con o senza reagenti per essere testato.
- Posizionare la piastra in un incubatore a 37 ° C, umidità 95% e 5% CO2 e cultura le cellule per 4 giorni.
5. installazione di co-coltura del target le cellule con pre-attivato CD8+ T cellule
- Aggiungere 30 μL di matrice di 1: 100 diluito ridotto fattore di crescita della membrana basale solubile (Tabella materiali) nei pozzetti della piastra a 96 pozzetti fondo piatto adatto per la microscopia e incubare a 37 ° C in un incubatore a CO2 per almeno 1 h.
- Preparare le cellule bersaglio (cioè, cellule di E0771-LG che esprimono la proteina fluorescente rossa nucleare limitato).
- Incubare le cellule bersaglio con 1 mL di tripsina/EDTA 0,05% a temperatura ambiente per 1 min e raccogliere le cellule pipettando delicato.
- Aggiungere 9 mL di DMEM compreso 10% (v/v) FBS e centrifugare la sospensione cellulare a 337 x g per 5 min.
- Risospendere le cellule con 500 μL di DMEM-E e contare il numero di cellule vive.
Nota: Prima di contare le cellule bersaglio, filtrare le cellule attraverso un colino di cella 40μm di produrre sospensione unicellulare. - Regolare la densità a 2 x 104 cellule/mL (= 1 x 103 celle per 50 μL) aggiungendo E-DMEM e mantenere le cellule sul ghiaccio.
- Preparare le cellule effettrici (cioè, pre-attivato CD8+ T cellule).
- Risospendere le cellule in un pozzo di piastra a 96 pozzetti (punto 4.5) accuratamente di pipettaggio e trasferimento il CD8 galleggiante+ T cells in una nuova provetta da 1,5 mL.
Nota: MAMs e M-MDSC strettamente aderire al pozzo e non si staccano dal pipettaggio. - Per raccogliere le cellule rimanenti, aggiungere 200 µ l di PBS nel pozzo e trasferire nel tubo al punto 5.3.1.
- Lavare le cellule con 1 mL di E-DMEM una volta (Centrifugare a 337 x g) per 5 min, aspirare e scartare il surnatante) e li risospendere con 100 μL di E-DMEM.
- Contare il numero di cellule vive (utilizzando il metodo di esclusione del blu di trypan), regolare la densità a 1,6 x 105 cellule/mL (= 4 x 103 celle/25 μL) e mantenere le cellule sul ghiaccio.
- Risospendere le cellule in un pozzo di piastra a 96 pozzetti (punto 4.5) accuratamente di pipettaggio e trasferimento il CD8 galleggiante+ T cells in una nuova provetta da 1,5 mL.
- Aspirare la matrice della membrana basale da ciascun pozzetto della piastra al punto 5.1.
- Aggiungere 1 x 103 celle/50 μL di cellule bersaglio (punto 5.2.4) in ciascun pozzetto e mescolare bene.
Nota: Per evitare effetti di bordo a causa dell'evaporazione del mezzo, solo l'interni 60 pozzi del 96 ben piatto deve essere utilizzato per l'analisi. - Aggiungere 25 μL di E-DMEM tra cui 4 x 103 U/mL IL-2 e substrato di 10 μM fluorogenico caspase-3 (vedere Tabella materiali).
- Aggiungere 4 x 103 celle/25 μL di CD8+ T cellule (punto 5.3.4) in caso di pozzi e mescolare bene.
Nota: La presenza di troppe cellule in un pozzo rende l'analisi più difficile. In questo modello, un effettore di 4:1: rapporto di destinazione (cella totale numero 5 x 103 cellule/pozzetto) era ottima, ma un rapporto di 8:1 era suboptimale. Pozzetti contenenti i seguenti quattro controlli sono necessari per aiutare con l'analisi dei dati: le cellule alla densità utilizzata per i pozzi di co-coltura (1 x 103 cellule/pozzetto) in medium con e senza substrato di caspase-3, cellule effettrici (1 x 103 celle / bene) nel medium con e senza substrato di caspase-3. - Aggiungere 200 μL di PBS o acqua sterile in tutti i pozzetti vuoti (particolarmente pozzi sulla periferia del piatto) per ridurre l'evaporazione del mezzo da pozzi sperimentali.
- Mettere la piastra in un microscopio a fluorescenza time-lapse che viene mantenuto a 37 ° C, umidità 95% e 5% CO2.
Nota: Agitare la piastra a forma di croce per distribuire uniformemente tutte le cellule e quindi consentire la piastra di rimanere a temperatura ambiente su una superficie piana per 10-20 min prima del trasferimento nell'incubatore.
6. imaging delle cellule
Nota: Le impostazioni di acquisizione immagine dettagliata varierà con il microscopio e fluorofori utilizzati; i seguenti parametri di acquisizione generale dovrebbero essere impiegati per ottenere risultati ottimali.
- Utilizzando una routine di autofocus appropriato sul microscopio, acquisire immagini che coprono almeno il 25% della superficie totale in ogni pozzetto sperimentale della piastra 96 pozzetti.
- Impostare il microscopio di acquisire immagini in contrasto di fase, nonché un canale fluorescente adatto per il nucleare-limitata rosso fluorescent protein (mKate2) e attivato un canale fluorescente adatto per il verde fluorogenic substrato di caspase-3 (con eccitazione a 488 nm) (Figura 2).
- Catturare immagini in pozzi sperimentali in contrasto di fase e i 2 canali fluorescenti ogni 1-3 h per almeno 72 ore.
7. image analysis utilizzando software di analisi di immagine
Nota: Le impostazioni di analisi di immagine dettagliata varierà con il software utilizzato (Vedi Tabella materiali); le seguenti procedure di analisi generale dovrebbero essere impiegate per ottenere risultati ottimali.
- Determinare se spettrale ONU-miscelazione è necessaria per separare il segnale fluorescente emesso dai nuclei delle cellule bersaglio da che emessi dai nuclei apoptotic e se necessario, impostata un protocollo di analisi a tal fine;
- Visualizza un controllo ben contenente solo le celle di destinazione (mkate2-labeled) in mezzo senza substrato di caspase-3 nel canale verde fluorescente.
- Osservare se fluorescenza verde viene emesso dai nuclei rossi (nuclei appaiono in verdi)
- Se fluorescenza verde è evidente nei nuclei, accedere al controllo unmixing spettrale nel software di imaging e aumentare la percentuale di rosso rimosso dal verde fino a quando scomparirà il segnale verde (nella nostra esperienza, questo è di solito 6-7% per mKate2 brillante fluorescenza).
- Se fluorescenza verde non è evidente in tutti i nuclei, nessun unmixing spettrale è necessario.
Nota: Questo spectral unmixing correzione test può anche essere effettuato utilizzando un pozzo delle cellule bersaglio in medium che contiene il substrato di caspase-3. Tuttavia, ci è solitamente un livello molto basso di apoptosis spontaneo nelle cellule bersaglio (meno del 10%), con conseguente pochi nuclei delle cellule bersaglio che emette fluorescenza verde dovuta all'attivazione di caspase-3 piuttosto che fluorescenza sanguinare attraverso. Smarginatura vero fluorescenza è evidente in queste condizioni quando fluorescenza verde è evidente in tutti i nuclei. - Visualizzare un controllo ben contenenti cellule effettrici unico (nuclei senza etichetta) in mezzo senza substrato di caspase-3 nel canale rosso e verde singolarmente.
- Osservare se fluorescenza verde o rosso viene emesso dai nuclei. Se né rosso né verde fluorescenza è ravvisabile in singoli canali non unmixing spettrale è necessario.
Nota: nella nostra esperienza, il mouse CD8+ T le cellule non sono auto-fluorescente e così nessun unmixing spettrale è necessario per queste cellule. Questo test di correzione unmixing spettrale può avvenire utilizzando un pozzo di cellule effettrici in medium che contiene il substrato di caspase-3. Tuttavia, ci è solitamente un certo livello di apoptosi spontanea con conseguente nei nuclei delle cellule effettrici che emette fluorescenza verde dovuta all'attivazione di caspase-3. Smarginatura vero fluorescenza è evidente in queste condizioni quando fluorescenza verde è evidente in tutti i nuclei.
- Utilizzare un metodo di sottrazione di background di fluorescenza (ad es., TopHat), con parametri rilevanti per il campione, per risolvere gli oggetti fluorescenti in entrambi i canali fluorescenti.
Nota: Nel verde del canale abbiamo usato TopHat (raggio di nuclei = 10.0 µm, verdi fluorescenza soglia = 0,7 verde taratura unità). Nel canale rosso abbiamo usato TopHat (raggio di nuclei = 10.0 µm, rosso fluorescenza soglia = 0,5 unità di calibrazione rosso). - Utilizzare i parametri appropriati per spaccare a bordo per risolvere diversi nuclei fluorescenti.
Nota: Non abbiamo usato bordo spaccare nel canale di fluorescenza verde o rosso. - Utilizzare le immagini nel canale del rosso dai pozzetti contenenti solo le cellule bersaglio (con substrato di caspase) per determinare la dimensione minima dei nuclei di destinazione.
Nota: Abbiamo usato 80 µm2. - Utilizzare le immagini nel verde del canale dai pozzetti contenenti solo cellule effettrici (con substrato di caspase) per determinare la dimensione media dei nuclei apoptotic dell'effettore.
Nota: Singoli nuclei effector apoptotic ha variati da 40 – 80 µm2 in questi esperimenti. - Istituire una procedura di analisi per contare il numero dei nuclei delle cellule fluorescenti destinazione utilizzando una restrizione di dimensione minima appropriata (ad es., superficie minima, diametro minimo) (Figura 2, maschera di rilevamento di destinazione).
Nota: Abbiamo usato una zona minima nuclei (fluorescenza rossa) = 80 µm2. - Istituire una procedura di analisi per contare il numero di nuclei apoptotic che sono più grandi rispetto alla dimensione media dei nuclei apoptotic dell'effettore (Figura 2, maschera di dimensioni limitate apoptosi).
Nota: Dimensione filtro è stato impostato a 80 µm2 (cioè, solo alcune aree di fluorescenza verde maggiore di questa dimensione sono stati contati, escludendo quindi i singoli nuclei di effector apoptotic). Utilizzando questi parametri aumenta la precisione dell'analisi nel conteggio nuclei apoptotic target cellulare anche se alcuni aggregati di cellule effettrici apoptotica possono essere conteggiati. - Istituire una procedura di analisi per contare il numero delle cellule apoptotiche destinazione contando i nuclei dove rosso segnale fluorescente (dal punto 7.6) e con dimensioni limitate del segnale fluorescente verde (dal passaggio 7,7) significativamente colocalizzano (Figura 2, R Maschera di sovrapposizione/g).
Nota: Una co-localizzazione appropriata può variare dal 30% al 100% della dimensione media dei nuclei di destinazione. Sovrapposizione Dimensione filtro è stato impostato a 40 µm2. - Determinare il numero di nuclei di cellule apoptotic destinazione nonché il numero dei nuclei delle cellule bersaglio nei pozzetti per ogni condizione sperimentale nel corso di tutto il tempo.
8. analisi dei dati mediante il calcolo e rappresentazione grafica software
- Grafico del numero di nuclei delle cellule apoptotiche destinazione ottenuta al passaggio 7,9 nel corso di tutto il tempo per i pozzi sperimentali. Se pozzi multipli sono stati utilizzati per ogni condizione sperimentale, permette di rappresentare graficamente i risultati come media ± deviazione standard.
- Calcolare la frazione di apoptotic della popolazione delle cellule bersaglio dividendo il numero delle cellule apoptotiche in ciascun pozzetto per il numero di cellule bersaglio in ciascun pozzetto in ogni momento.
- Grafico i risultati ottenuti al punto 8.2.
- Determinare l'area sotto la curva (AUC) per ogni curva. La frazione di apoptotic picco della popolazione per ogni curva può essere determinata anche oltre il punto di tempo in cui il picco si verifica, se lo si desidera. Determinare se l'AUC determinato per le condizioni sperimentali sono significativamente differenti utilizzando appropriati test statistici.
Nota: Il test t spaiato con correzione di Welch è stato applicato ai risultati AUC.
Risultati
Questo metodo si basa sulla semplice co-coltura delle cellule di cancro del bersaglio con effettrici CD8+ T cellule che sono state pre-coltivate con o senza cellule del soppressore in presenza di anticorpi attivanti anti-CD3/CD28. Rileva CD8+ apoptosi cellulare indotta da cellule T del cancro nel tempo dopo co-coltura, permettendo così la valutazione degli effetti delle cellule del soppressore su citotossicità di CD8+ T cellule.
In genere, le cellule tumorali aumentano la fluorescenza verde nei loro nuclei dopo l'attivazione di un biosensore di caspase nucleare-targeting quando queste cellule mettersi in contatto con CD8+ T cellule che sono pre-attivato dagli anticorpi in assenza di celle (soppressore Figura 3; Film supplementare 1). Fluorescenza verde dal substrato caspase era rilevabile per almeno 15 h dopo l'apoptosi è stata iniziata. Alcuni apoptosi spontanea di effettrici CD8+ T cellule inoltre è stata osservata nel corso del tempo, anche se queste cellule sono state coltivate in isolamento (Figura 4; Film supplementare 2). Tuttavia, dimensioni di nuclei di CD8+ T cellule sono più piccole rispetto a quelle delle cellule tumorali e così cellule apoptotiche 'effettrici' possono essere esclusi dalla apoptotic cell 'target' conta con un metodo di analisi di dimensione limitazione immagine (Figura 2 e Figura 4). Anche se alcune cellule tumorali bersaglio mostrano una piccola forma arrotondata senza fluorescenza verde, ciò non pregiudica l'analisi come queste cellule sono in fase di mitosi piuttosto che apoptosi (complementare Movie 3) e quindi sono escluse dal apoptotica 'target' conta delle cellule da una maschera di sovrapposizione di rosso/verde (complementare figura 2). Apoptosi spontanea delle cellule tumorali bersaglio occasionalmente sono trovato anche nella cultura singola (complementare Movie 3). Tuttavia, la co-cultura di cancro di destinazione le celle con pre-attivato CD8+ T cellule apoptosi delle cellule del tumore aumentato sopra i livelli di apoptosi spontanea in monocoltura delle cellule tumorali (Figura 4). In genere, quando si utilizza un rapporto ottimale di cellule tumorali bersaglio per le cellule effettrici, un picco del numero delle cellule apoptotiche destinazione cancro può essere osservato (Figura 5A). Questo picco è più distinto, quando i dati sono espressi come la frazione di apoptotic della popolazione delle cellule bersaglio (figura 5B). In questo esperimento l'apoptosi basale delle cellule del tumore di destinazione ha alzato a 24 h (con frazione di apoptotic = 0,08), ma CD8+ apoptosi indotta da cellula di T ha raggiunto un livello massimo a 17 h (con frazione apoptotica = 0,66).
Più ulteriormente abbiamo trovato che CD8+ T cellule pre-incubate con MAMs o M-MDSC potrebbero fare contatto con cellule tumorali bersaglio ma questo contatto sembrava per provocare meno casi di apoptosi delle cellule di cancro rispetto ai CD8+ T cellule pre-attivato senza cellule del soppressore (Figura 3 e Figura 4; Film supplementare 4 e complementare 5). Anche se il CD8+ T cellule pre-incubate con le cellule mieloidi occasionalmente indotto apoptosi delle cellule di cancro, c'era anche qualche proliferazione delle cellule tumorali di destinazione che non sono stati stimolati all'apoptosi nel corso del tempo il esperimento (complementare Movie 6). Coerentemente con questi risultati, la frazione di picco delle cellule tumorali apoptotiche coltivate con CD8+ T cellule pre-incubate con cellule mieloidi (frazione di apoptotic = 0,38 a 23 h per MDSC-E e 0.25 a 20 h per MAM-E) era significativamente inferiore a quello delle cellule tumorali coltivate con CD8+ T cellule che non erano pre-incubate con le cellule del soppressore (Figura 6).
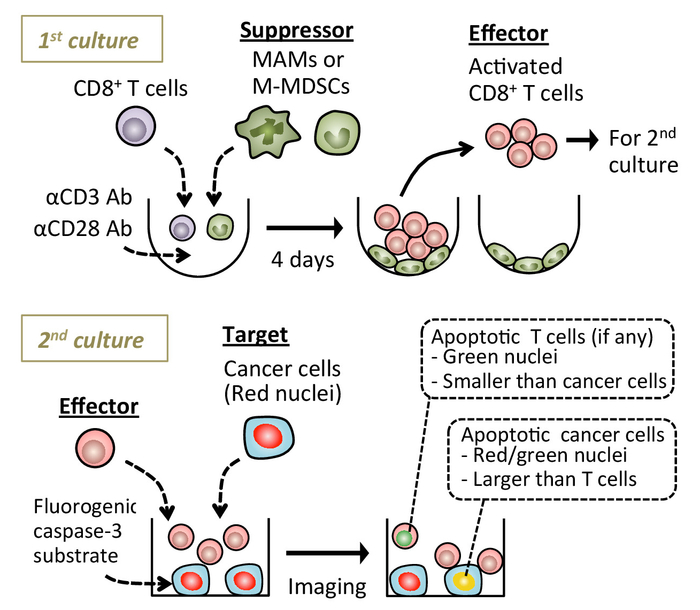
Figura 1: uno schema che mostra la procedura sperimentale. Ingenuo splenica CD8+ T le cellule sono coltivate con anticorpi attivanti anti-CD3/CD28 con o senza macrofagi associati a metastasi (MAMs) o cellule suppressor monocytic-mieloide-derivati (M-MDSC). Dopo 4 giorni, galleggiante CD8+ T cellule vengono raccolti e co-coltivate con le cellule tumorali bersaglio in presenza di substrato fluorogenico caspase-3. Cellule tumorali apoptotiche vengono rilevate nell'ambito di microscopia di fluorescenza in tempo reale. Le immagini sono state acquisite utilizzando una piattaforma live cell imaging (vedere Tabella materiali). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: identificazione delle cellule apoptotiche di destinazione distinte da cellule effettrici apoptotiche. Acquisizione immagine: riga in alto nel canale rosso permette l'identificazione dei nuclei delle cellule bersaglio di maschera di rilevazione di destinazione (maschera rosa analisi). Riga centrale: immagini acquisite nel verde del canale indicano le cellule effettrici e destinazione apoptotiche. State limitate apoptosi maschera (maschera di analisi teal; maggiore di 80 µm2) permette singolo apoptotic cellule effettrici devono essere esclusi dall'analisi. Riga inferiore: composito immagini unita rosso e verde canali con immagine di contrasto di fase (a sinistra) o rosso/verde si sovrappongono maschera (a destra). Identificazione della fluorescenza verde co-localizzata, con dimensioni limitate con fluorescenza rossa (maschera giallo analisi), consente maggiore accuratezza nel rilevamento di apoptotic nuclei di destinazione (freccia gialla) escludendo gli aggregati di cellule effettrici apoptotica (bianco punte di freccia). Clicca qui per visualizzare una versione più grande di questa figura.
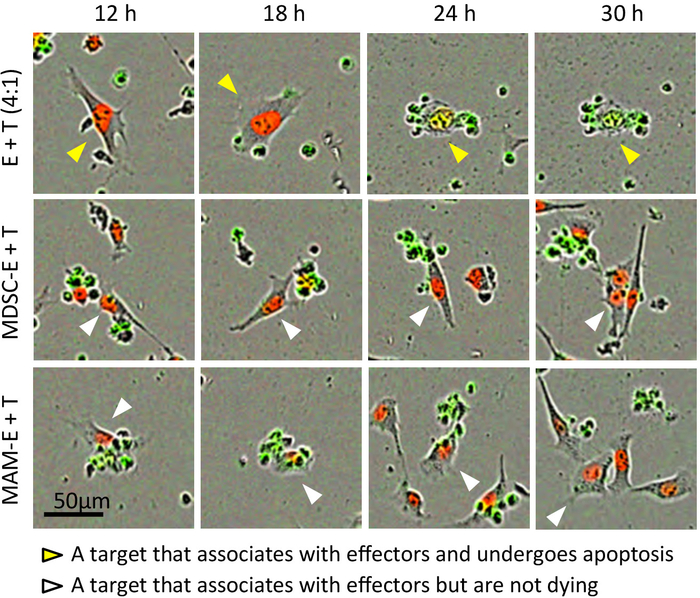
Figura 3: Interazione tra CD8+ T cellule e le cellule tumorali. Stills da filmati time-lapse rappresentativi delle cellule bersaglio E0771-LG_NLR (T) co-coltivate con effettrici CD8+ T cellule (E) con rapporto 4:1 dell'effettore/obiettivo. MDSC-E e MAM-E indicare le cellule effettrici pre-incubate con M-MDSC e MAMs rispettivamente. Immagini composite (incluse le immagini da canali di contrasto, rosso e verde di fase) sono mostrati. Punte di freccia sono tracking le stesse cellule attraverso i diversi campi e intervalli di tempo. Giallo di punte di freccia: un obiettivo che associa gli effettori e subisce le punte di freccia di apoptosi, bianco: una destinazione che associa gli effettori ma non andare incontro ad apoptosi. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: rilevazione delle cellule tumorali apoptotiche. Rappresentante campi estratti da filmati time-lapse a 18 h dopo formazione immagine. Immagini composite (sinistra; canali di contrasto, rosso e verde di fase) e immagini dal rosso canale senza (al centro) o con sovrapposizione (a destra) rosso/verde maschera (giallo) sono indicati. Punti gialli nella colonna di destra rappresentano cellule tumorali apoptotiche. Clicca qui per visualizzare una versione più grande di questa figura.
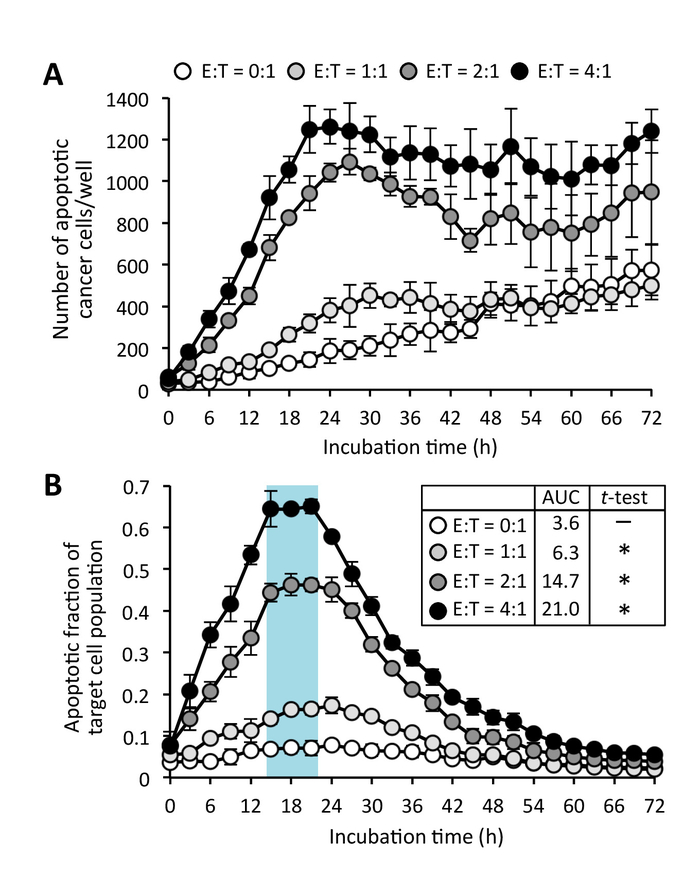
Figura 5: CD8+ apoptosi cellulare indotta da cellule T del cancro. (A) numero di cellule tumorali apoptotiche coltivate con effettore C8+ T cellule alle diverse realizzatore al rapporto di destinazione (E:T). apoptotica (B) frazione della popolazione delle cellule bersaglio. Dati sono mezzi ± SD. Mean area sotto la curva (AUC) è inoltre indicato. Spaiati t-test con correzione di Welch è stato utilizzato per analizzare l'AUC. * P < 0,0001 rispetto a t = 0:1. Clicca qui per visualizzare una versione più grande di questa figura.
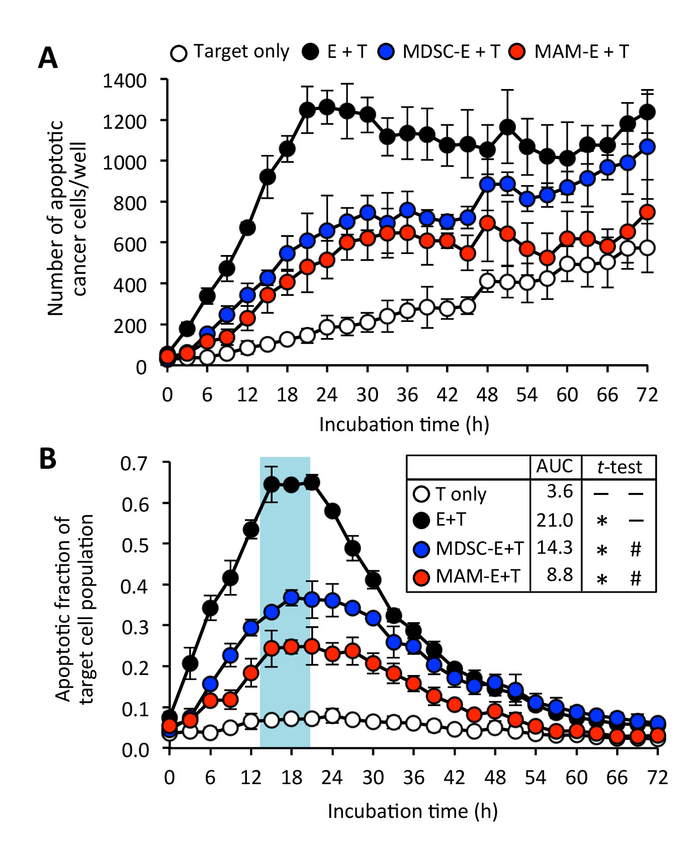
Figura 6: Effetti di tumore-infiltrazione di cellule mieloidi su citotossicità di CD8+ T cellule. (A) numero di cellule tumorali apoptotiche (destinazione: T) coltivate con C8+ T cellule (effettrici: E) a 4:1 di rapporto di E:T. CD8+ T cellule pre-sono state coltivate in assenza (cerchio nero) o in presenza di cellule monocytic-mieloide-derivati del soppressore (MDSC-e: blu cerchio) o macrofagi associati a metastasi (MAM-e: cerchio rosso). Dati sono mezzi ± SD. (B) apoptotica frazione della popolazione delle cellule bersaglio. Dati sono mezzi ± SD. dire AUC è anche mostrato. Spaiati t-test con correzione di Welch è stato utilizzato per analizzare l'AUC. * P < 0,0001 rispetto a T, #P < 0,0001 rispetto a E + T. Clicca qui per visualizzare una versione più grande di questa figura.
Complementare figura 1. Strategia di gating per isolare cellule del soppressore dal polmone metastatico. (A) rappresentante dot trame isolare cellule monocytic soppressore mieloidi-derivato (M-MDSC) e macrofagi associati a metastasi (MAMs). La soglia del livello di Ly6C per distinguere MAMs (Ly6Cbasso) e M-MDSC (Ly6Calta) è basata su quella di macrofagi alveolari residenti (RMAC). (B) purezza dei M-MDSC ordinato (CD45+Ly6G–CD11b+Ly6Calta) e MAMs (CD45+Ly6G–CD11b+Ly6Cbasso). Per favore clicca qui per scaricare questo file.
Complementare nella figura 2. Immagini rappresentative delle cellule bersaglio mitotica. Stills dal rappresentante filmati time-lapse di mono-coltura cellulare di destinazione E0771-LG_NLR. In alto: immagini composite comprese le immagini da canali di contrasto, rosso e verde di fase. In basso: immagini composite (canali rosso e verde) con maschera di sovrapposizione di rosso/verde. Per favore clicca qui per scaricare questo file.
Complementare nella figura 3. Gli effetti di tumore-infiltrazione di cellule mieloidi sulla proliferazione di CD8+ cellule di T. (A) rappresentante istogrammi risultati diluizione di etichettatura fluorescente con CFSE in CD8+ T cellule. Ingenuo splenica CD8+ T cellule erano isolate come descritto nel protocollo-3 ed etichettate con 5 µM di CFSE a 37 ° C per 15 min. Le cellule di T con etichettate erano coltivate in presenza di IL-2 e anti-CD3/CD28 attivando anticorpi con o senza cellule mieloidi come descritto nel protocollo n. 4. Dopo 4 giorni, è stato rilevato in cellule di T di fluorescenza verde citometro a flusso. (B) indice di divisione di CD8+ T celle calcolate come descritto in precedenza17. Dati sono mezzi ± SEM. * P < 0.01 rispetto al controllo, #P < 0,05 rispetto al αCD3/CD28 ab. per favore clicca qui per scaricare questo file.
Film supplementare 1. Film di figure 3 e 4; E + T. Per favore clicca qui per scaricare questo file.
Film supplementare 2. Film di figure 3 e 4; Effettrici (E). Per favore clicca qui per scaricare questo file.
Complementare film 3. Film di figure 3 e 4; Destinazione (T). Per favore clicca qui per scaricare questo file.
Complementare Movie 4. Film di figure 3 e 4; MDSC-E + T. Per favore clicca qui per scaricare questo file.
Film supplementare 5. Film di figure 3 e 4; MAM-E + T. Per favore clicca qui per scaricare questo file.
Complementare film 6. Film di figure 3 e 4; MAM-E + T (proliferazione). Per favore clicca qui per scaricare questo file.
Discussione
Questo metodo si basa su due passaggi separati co-cultura: co-coltura CD8+ T cellule con potenziale cellule del soppressore e co-coltura il CD8 'pre-condizionato'+ T cellule con le cellule tumorali bersaglio (Figura 1). Il primo passo di co-coltura è abbastanza simile a quella per CD8+ T cell analisi di proliferazione comunemente utilizzate per determinare l'effetto delle cellule del soppressore il CD8+ la funzione delle cellule T. Tuttavia, la proliferazione delle cellule T non correla sempre con loro citotossicità. Ad esempio, abbiamo trovato che la co-cultura con M-MDSC o MAMs aumentato piuttosto che ridotta proliferazione di CD8+ T cellule in presenza di CD3/CD28 attivando anticorpi (complementare figura 3), mentre questi pre-condizionata CD8+ Cellule di T hanno dimostrato ridotta citotossicità contro le cellule tumorali bersaglio (Figura 4, Figura 5, Figura 6). Questi risultati evidenziano l'importanza della valutazione dell'attività funzionale, evidenziato dalla destinazione apoptosi di cancro, offerti da questo CD8+ analisi di citotossicità delle cellule T.
In questa analisi, abbiamo identificato che CD8+ T cellule richiede circa 15 h di co-coltura al fine di indurre la massima apoptosi delle cellule di tumore mammario del topo E0771-LG (Figura 5). Questo ritardo potrebbe essere dovuto il ritardo tra il contatto iniziale di cellule effettrici con obiettivi e accompagnamento immuni sinaptogenesi, così come tempo necessario per indurre segnali apoptotici in destinazioni come misurato dall'attivazione di caspase-3 (supplementari Movie 1 ). Inoltre abbiamo identificato che il numero delle cellule apoptotiche tumore ha raggiunto un plateau dopo 24 h, che è probabilmente dovuto l'eliminazione degli obiettivi dalle cellule T e/o perdita di segnale fluorescente dalle cellule morte. Questa funzionalità per identificare il tempo di picco apoptosi è uno dei principali vantaggi di questo test, poiché la determinazione di un punto di tempo ottimale è importante per paragoni adeguati tra diverse condizioni. Nel nostro caso, ad esempio, la differenza nella citotossicità tra controllo CD8+ T cellule e CD8 MDSC/MAM-istruiti+ T cellule era molto più grande a 15-18 h rispetto a 72 h (Figura 5), e quindi un endpoint esperimento utilizzando un periodo di incubazione di 72h produrrebbe risultati fuorvianti.
Questo metodo consente anche la visualizzazione dell'interazione delle cellule effettrici-target in tempo reale, che fornirebbe maggiori approfondimenti il meccanismo alla base di citotossicità limitata di CD8+ T cellule pre-incubate con cellule del soppressore. Ad esempio, abbiamo osservato che CD8+ T cellule pre-incubate con M-MDSC o MAMs incontrato e interagito con le cellule del tumore di destinazione ma non ha sempre indotto apoptosi (complementare 4 film, complementare Movie 5, complementare Movie 6). Anche se non abbiamo quantificare questo evento, che sarebbe fattibile e interessante quantificare e confrontare la proporzione di incontri e il loro tempo di interazione in correlazione con l'induzione di apoptosi. Un altro grande vantaggio è che questo metodo richiede un piccolo numero di cellule (ad es., 1 x 103 di destinazione) e 4 x 103 di cellule effettrici per pozzetto. In realtà, questo protocollo può essere ulteriormente miniaturizzato per il formato piastra 384 pozzetti se lo si desidera. Pertanto, questo test è adatto per esperimenti e screening su vasta scala dove i numeri delle cellule sono limitati come test in vitro utilizzando preziose cellule derivate da in vivo o ex vivo campioni.
D'altra parte, una limitazione del dosaggio attuale è la presenza di un numero significativo di cellule effettrici morto in alcune condizioni. Al fine di aumentare la precisione nel distinguere l'apoptosi delle cellule tumorali bersaglio da quella di effettrici CD8+ T cellule, i nuclei delle cellule sono etichettati come destinazione ed una restrizione di dimensione (che esclude le cellule effettrici) viene applicato per l'analisi dei dati in questo i nuclei test (Figura 2). Tuttavia, ci sono alcuni casi dove sovrapposizione degli aggregati di apoptotic (verde) CD8+ T cellule in cellule di cancro non-apoptotica bersaglio, che possono confondere i risultati. Questa limitazione potrebbe essere ridotto dall'uso di una colonna di rimozione di cellule morte il priore di cellule effettrici di co-coltura con le cellule del tumore di destinazione, presupponendo che un numero sufficiente di cellule effettrici è disponibile. Con i più complessi sistemi di microscopia, potrebbe anche essere possibile ridurre il falso segnale positivo di etichettatura effettrici CD8+ T cellule con un fluoroforo distinto dai nuclei delle cellule bersaglio e substrato fluorogenic caspase-3.
Finora, questo protocollo è stato utilizzato per indagare l'antigene aspecifica attivazione di CD8+ T cellule. Anche se MDSC e TAMs nel microambiente tumorale sopprimere le funzioni delle cellule T attraverso meccanismi non specifico antigene, MDSC nei tessuti linfoidi periferici sopprimere le risposte delle cellule T in un modo specifico antigene18. Per indagare le funzioni immunitarie soppressive di tali tipi di cellule, un'analisi di proliferazione in vitro usando CD8+ T cellule da OT-1 topi transgenici è comunemente usato. In questa analisi, le cellule di OT-1 T (che esprimono il recettore specifico delle cellule di T di ovoalbumina (uova)) sono co-coltivate con soppressore MDSC in presenza di peptidi di ovuli, che è applicabile per la prima cultura nella nostra analisi di citotossicità (vale a dire., l'attivazione delle T cellule in la presenza o l'assenza di soppressori). È anche fattibile per manipolare le cellule tumorali bersaglio per esprimere gli ovuli, che possono indurre l'uccisione delle cellule antigene-specifiche cancro dalle cellule di OT-1 T. Di conseguenza, l'analisi consentirà inoltre indagine della MAM/MDSC-mediata soppressione dell'attivazione di cellule T antigene-specifiche. È anche possibile applicare l'analisi per studiare le cellule umane, come l'attivazione anticorpi contro umano CD3 e CD28 sono commercialmente disponibili, e un protocollo per isolare TAMs umana da campioni clinici è stato stabilito19.
Collettivamente, questo test è molto versatile e può essere utilizzato per esaminare la citotossicità di altri tipi delle cellule immuni. Attualmente, nei nostri laboratori, esso viene esteso per esaminare la citotossicità delle cellule antigene-dipendente in varie condizioni ed è anche in fase di sviluppo per high throughput screening.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni dal Wellcome Trust (101067/Z/13/Z (JWP), 109657/Z/15/Z (TK), 615KIT/J22738 (TK), UK) e il MRC (MR/N022556/1 (JWP, TK), UK). NOC e DDS riconoscere sostegno dalla nazionale fenotipica Screening Centre Phenomics scoperta iniziativa e Cancer Research UK (NOC)
Materiali
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin EDTA (1X) | Gibco | 25300-054 | |
| 12-Well Cell Culture Plate | Freiner Bio-One | 665-180 | |
| 1x PBS | Gibco | 14190-094 | |
| 2-mercaptethanol | Sigma | M6250-10ML | |
| 5mL Plystyrene Round-Bottom Tube | FALCON | 352054 | |
| 96-Well Cell Culture Plate (Round Bottom ) | Costar | 3799 | Co-culture of CD8+T cells with sorted myeloid cells |
| 96-well plate (Flat bottom) | Nunc | 165305 | Co-culture of CD8+T cells with target cells for cytotoxicity assay |
| AF647 anti-mouse F4/80 Antibody | BIO-RAD | MCA497A647 | Clone: CIA3-1, Lot#: 1707, 2 μL/1x10^6 cells |
| AlexaFluor700 anti-mouse CD8 Antibody | Biolegend | 100730 | Clone: 53-6.7, Lot#: B205738, 0.5 μL/1x10^6 cells |
| anti-mouse CD28 Antibody | Biolegend | 102111 | Activation of isolated CD8+ T cells, Clone: 37.51, Lot#: B256340 |
| anti-mouse CD3e Antibody | Biolegend | 100314 | Activation of isolated CD8+ T cells, Clone: 145-2C11, Lot#: B233720 |
| APC anti-mouse CD3 Antibody | Biolegend | 100236 | Clone: 17A2, Lot#: B198730, 0.5 μL/1x10^6 cells |
| APC/Cy7 anti-mouse Ly6C Antibody | Biolegend | 128026 | Clone: HK1.4, Lot#: B248351, 1 μL/1x10^6 cells |
| Bovine Serum Albmin | Sigma | A1470-100G | |
| Cell Strainer (100μm Nylon) | FALCON | 352360 | To smash the spleen |
| Cell Strainer (40μm Nylon) | FALCON | 352340 | To filter the lung digestion |
| DAPI | Biolegend | 422801 | |
| Dulbecco′s Modified Eagle′s Medium | Gibco | 41966-029 | |
| EasySep Mouse CD8+ T Cell Isolation Kit | StemCell Technologies | 19853 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FITC anti-mouse CD4 Antibody | Biolegend | 100406 | Clone: GK1.5, Lot#: B179194, 0.5 μL/1x10^6 cells |
| Geltrex Ready-to-Use | Gibco | A1596-01 | Coating the 96-well plates for cytotoxicity assay |
| IncuCyte NucLight Red Lentivirus Reagent | Essen BioScience | 4476 | Lenti viral particules encoding mKate2 |
| IncuCyte ZOOM | Essen BioScience | Detector (fluorescence microscope) | |
| IncuCyte ZOOM 2018A | Essen BioScience | Analysis software | |
| L-Glutamine (100X) | Gibco | A2916801 | |
| Lung Dissociation Kit | Miltenyi | 130-095-927 | Preparation of single cell suspension from the tumor-bearing lung |
| MycoAlert Mycoplasma Detection Kit | Lonza | LT07-318 | |
| Non-essential amino acid (100X) | Gibco | 11140-035 | |
| NucView488 | Biotium | 10403 | Fluoregenic caspase-3 substrate |
| PE anti-mouse Ly6G Antibody | Biolegend | 127607 | Clone: 1A8, Lot#: B258704, 0.5 μL/1x10^6 cells |
| PE/Cy7 anti-mouse CD11b Antibody | Biolegend | 101216 | Clone: M1/70, Lot#: B249268, 0.5 μL/1x10^6 cells |
| Pen Strep | Gibco | 15140-122 | Penicillin Streptomycin for primary culture of cells |
| PerCP/Cy5.5 anti-mouse CD45 Antibody | Biolegend | 103132 | Clone: 30-F11, Lot#: B249564, 0.5 μL/1x10^6 cells |
| Polybrene (Hexadimethrine bromide) | Sigma | H9268 | |
| Puromycin | Gibco | A11138-03 | |
| RBC Lysis Buffer (10X) | Biolegend | 420301 | |
| Recombinant murine IL-2 | Peprotech | 212-12 | Activation of isolated CD8+ T cells |
| Sodium pyruvate (100X) | Gibco | 11360-070 | |
| TruStain fcX (anti-mouse CD16/32) Antibody | Biolegend | 101320 | |
| : Nikon 10X objective (resolution 1.22 µm) : Green channel excitation: 440 - 480 nm : Green channel emission: 504 - 544 nm : Red channel excitation: 565-605 nm : Red channel emission: 625 - 705 nm | |||
Riferimenti
- Barry, M., Bleackley, R. C. Cytotoxic T lymphocytes: all roads lead to death. Nature Reviews in Immunology. 2, 401-409 (2002).
- Durgeau, A., Virk, Y., Corgnac, S., Mami-Chouaib, F. Recent advances in targeting CD8 T-cell immunity for more effective cancer immunotherapy. Frontiers in Immunology. 9. , 14(2018).
- Tanaka, A., Sakaguchi, S. Regulatory T cells in cancer immunotherapy. Cell Research. 27, 109-118 (2017).
- Fleming, V., et al. Targeting myeloid-derived suppressor cells to bypass tumor-induced immunosuppression. Frontiers in Immunology. 9, 398(2018).
- Cassetta, L., Kitamura, T. Macrophage targeting: opening new possibilities for cancer immunotherapy. Immunology. 155, 285-293 (2018).
- Chahroudi, A., Silvestri, G., Feinberg, M. B. Measuring T cell-mediated cytotoxicity using fluorogenic caspase substrates. Methods. 31, 120-126 (2003).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Review of Vaccines. 9, 601-616 (2010).
- Azimi, M., et al. Identification, isolation, and functional assay of regulatory T Cells. Immunological Investigation. 45, 584-602 (2016).
- Bruger, A. M., et al. How to measure the immunosuppressive activity of MDSC: assays, problems and potential solutions. Cancer Immunology Immunotherapy. , (2018).
- Qian, B., et al. A distinct macrophage population mediates metastatic breast cancer cell extravasation, establishment and growth. PLoS One. 4, e6562(2009).
- Kitamura, T., et al. Monocytes differentiate to immune suppressive precursors of metastasis-associated macrophages in mouse models of metastatic breast cancer. Frontiers in Immunology. 8, 2004(2018).
- Bronte, V., et al. Recommendations for myeloid-derived suppressor cell nomenclature and characterization standards. Nature Communications. 7, 12150(2016).
- Kitamura, T., et al. CCL2-induced chemokine cascade promotes breast cancer metastasis by enhancing retention of metastasis-associated macrophages. Journal of Experimental Medicine. 212, 1043-1059 (2015).
- Ewens, A., Mihich, E., Ehrke, M. J. Distant metastasis from subcutaneously grown E0771 medullary breast adenocarcinoma. AnticancerResearch. 25, 3905-3915 (2005).
- Choppa, P. C., et al. Multiplex PCR for the detection of Mycoplasma fermentans, M. hominisandM. penetransin cell cultures and blood samples of patients with chronic fatigue syndrome. Molecular and Cellular Probes. 12, 301-308 (1998).
- Strober, W. Trypan blue exclusion test of cell viability. Current protocols in immunology. , Appendix 3:Appendix 3B (2001).
- Koyanagi, M., Kawakabe, S., Arimura, Y. A comparative study of colorimetric cell proliferation assays in immune cells. Cytotechnology. 68, 1489-1498 (2016).
- Gabrilovich, D. I., Nagaraj, S. Myeloid-derived-suppressor cells as regulators of the immune system. Nature Reviews in Immunology. 9, 162-174 (2009).
- Cassetta, L., et al. Isolation of mouse and human tumor-associated macrophages. Advances in Experimental Medicine and Biology. 899. 899, 211-229 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon