Method Article
Режиме реального времени обнаружения в апоптоз клеток in Vitro опухоли индуцированные CD8 клетки+ T для изучения подавляющей иммунные функции проникновения опухоли миелоидных клеток
* Эти авторы внесли равный вклад
В этой статье
Резюме
Мы здесь описать протокол расследовать цитотоксичность предварительно активированные CD8 клетки+ T против раковых клеток путем обнаруживать apoptotic раковых клеток через реальном времени микроскопии. Этот протокол можно изучить механизмы за подавление миелоидных клеток индуцированной Т-клеток и оценивать соединений, направленных на пополнение T клетки через блокады иммунной подавляющих миелоидных клеток.
Аннотация
Потенцирование опухоль убийство способности CD8+ T клеток в опухоли, а также их эффективного опухолевого инфильтрата, является ключевым элементом успешной immunotherapies. Несколько исследований показали, что инфильтрирующие миелоидных клеток опухоли (например, клетки миелоидного производные супрессор (MDSCs) и опухольассоциированных макрофагов (ТАМС)) подавить цитотоксичность CD8+ T-клеток в микроокружения опухоли и что ориентация Эти нормативные миелоидных клеток может улучшить immunotherapies. Здесь мы представляем в пробирке пробирного системы для оценки иммунного подавляющее воздействие, monocytic-MDSCs и ТАМС на способность опухоли убийство CD8+ T клетки. С этой целью мы впервые культивировали наивно селезеночной CD8+ T клетки с анти CD3/CD28 активация антител в присутствии или отсутствии клеток супрессоров, а затем совместно культивируемых предварительно активированных Т-клеток с цели раковых клеток в присутствии fluorogenic Субстрат каспазы-3. Флуоресценции от субстрата в раковых клетках был обнаружен в режиме реального времени флуоресцентной микроскопии как показатель Т-клеток индуцированной апоптоза клеток опухоли. В этот assay, мы можем успешно обнаружить увеличение апоптоз клеток опухоли, CD8+ T клетки и его подавления предварительно культуры с ТАМС или MDSCs. Этот функциональный assay полезен для расследования CD8+ T мобильных подавления механизмов регулирования миелоидных клеток и выявления druggable цели преодолеть его через показ высокой пропускной способности.
Введение
Известно, что CD8+ T клетки могут устранить опухолевых клеток, когда они оказывают их полной цитотоксичности. После активации Т-клеточных рецепторов (TCR), CD8+ T клетки размножаются и дифференцироваться в цитотоксических эффекторных клеток. Расширенный и активированные CD8+ T клетки выделяют цитотоксические гранул, включая Перфорины и granzymes, который переводятся в клетки-мишени и инициировать различные литические пути, такие как каспазы-3 при посредничестве апоптоз1. CD8+ T клетки можно также вызвать апоптоз клеток опухоли, активировав рецепторов на клетки-мишени, таких как приемные устройства для α фактор некроза опухоли (ФНО α), первый апоптоз сигнал лиганда (FasL), или ФНО связанных лигандов индуцировать апоптоз (TRAIL). Кроме того активированные CD8+ T клетки секретируют интерферона гамма (ИФН γ), можно подавлять пролиферацию опухолевых клеток и повысить чувствительность клеток опухоли CD8+ T-клеток через вверх регулирование FasL приемного устройства1. Учитывая потенциал для CD8+ T были созданы опухоли убийство способности, несколько стратегий для повышения их цитотоксичности (например, контрольно-пропускной пункт ингибиторы, вакцинация рака и приемным передачи химерных антигена рецепторов (автомобиль) выражая Т-клетки) и показали значительный терапевтический эффект на некоторые виды рака2. Однако, накапливая доказательства предполагает, что проникновения опухоли иммунной клетки таких нормативных Т-клеток, миелоидной производные подавитель клетки (MDSCs), и опухольассоциированных макрофагов (ТАМС) можно подавить CD8+ T мобильных функций и ограничивают эффективность 3,immunotherapies4,5. Для улучшения такой immunotherapies, важно понять как иммунной супрессоров клетки предел CD8+ Т клеточной цитотоксичности. Идентификацию из CD8 клетки T+ механизмы подавления, а также druggable цели, чтобы преодолеть его, потребует разработки и использования в пробирке анализов.
Золотой стандарт метод измерения CD8+ цитотоксичность клеток T является пробирного выпуска хрома, в котором выпуска радиоактивных зонд (51Cr), от целевой ячейки, лизированы, CD8+ T клетки, определяется6. Однако этот assay имеет ряд недостатков, в том числе относительно низкая чувствительность, высокий фон, неспособность обнаруживать ранние apoptotic события, проблемы утилизации опасных и ограниченная совместимость с автоматизированной обработки жидких и обнаружения для поддержки выше производительность приложения. Еще одним распространенным методом является анализ гранулярных потоков, в которых обнаруживается annexin V привязки7апоптоз опухолевых клеток-мишеней. В этот assay это можно обнаружить другие параметры, такие как целевой клеточной смерти с помощью пропидий йодидом (PI) или 7-aminoactinomycin D (7-AAD) и активации эффекторных клеток обозначается CD107a или CD69 выражения, в дополнение к apoptosis в клетки-мишени7 . Однако этот assay требует большого числа клеток супрессоров, по сравнению с Пробирной выпуска хрома. Он также требует отряда и дезагрегирования адэрентных целевых клеток, и это может исказить результаты. Действительно, хром релиз анализа или анализа потока гранулярных обычно не используются для расследования подавитель клеточные эффекты на функции Т-клеток. Вместо этого, измерение Т-клеточной пролиферации, указывается путем разбавления флуоресцентные краски (например, CFSE), предварительно загружаются в Т-клетки часто используется для оценки ингибирование CD8+ Т-клеток функции клеток супрессоров. Обнаружение ИФН γ производства от культивируемых клеток T является другой стандартный метод для оценки воздействия клеток супрессоров на Т-клеток активации8,9. Однако результаты этих анализов не обязательно коррелирует целевой ячейке убийство способности CD8+ T клетки.
Мы представляем здесь альтернативные функциональные assay оценить эффекты подавитель клеток, особенно макрофаги в метастатические опухоли, на цитотоксичность CD8+ T клетки. Этот метод определяет цитотоксичность CD8+ T клетки, предварительно культивируемых с или без клетки подавитель присутствии активирующих антител анти CD3/CD28, путем обнаружения апоптоза клеток опухоли, обозначается флуоресценции от fluorogenic каспазы-3 Субстрат6 с помощью автоматизированных покадровой микроскопии (рис. 1). Этот протокол имеет ряд преимуществ по сравнению с другими методами; Он требует только небольшое количество клеток, позволяет обнаружение гибели адэрентных опухолевых клеток с высокой чувствительностью, могут изображений в реальном времени эффекторных цель взаимодействия и поддаются скрининга высокой пропускной способности.
В этом протоколе связанные с метастазированием макрофагов (MAMs) и их предшественники monocytic-MDSCs (M-MDSCs) изолированный от метастатических опухолей у мышей используются как клетки супрессоры. В моделях мыши метастатическим раком молочной железы, собственный населения макрофагов характеризуется как F4/80высокогоLy6G–CD11bвысокойLy6Cнизкой накапливается в легких, содержащий метастатические опухоли. Это население макрофагов редко найти в обычных легких и таким образом называется метастазированием связанные макрофагов (MAMs)10. В этих моделях мыши, другой миелоидных клеток населения, определяется как F4/80высокогоLy6G–CD11bвысокойLy6Cвысокий, также накапливается преимущественно в метастатических легких, где она рождает MAMs11. На основе их характеристик, CD11bвысокойLy6Cвысокой MAM клетки-предшественники могут представлять М-MDSCs12.
протокол
Все процедуры, связанные с мышей были проведены в соответствии с лицензией разрешение от UK Home Office (P526C60B3). Информация о коммерческих реагенты и оборудование, перечислены в Таблице материалов.
1. Подготовка клеток-мишеней, которые выражают Красного флуоресцирующего белка в их ядрах
- Получите целевой мыши рака клеток линии от соответствующего источника.
Примечание: В настоящем Протоколе, используются высоко метастатического производное E0771 мыши молочной опухолевых клеток (E0771-LG)13 . Родительский E0771 клетки происходят из мышей C57BL/614. - Размораживание и поддерживать флакон клеток E0771-LG с Дульбекко изменение орлы среднего (DMEM) включая 10% (v/v) плода бычьим сывороточным (ФБС) в инкубатор культуры клеток при 37 ° C, влажность 95% и 5% CO2.
Примечание: Это должно быть подтверждено, что клетки являются негативными для микоплазмы. С этой целью культура клетки E0771 (или клетки, чтобы быть проверены) для 2-3 дней, как описано выше (при отсутствии антибиотики и противогрибковые), собрать 500 мкл питательной среды. Центрифуга для среднего на 12,419 x g для 60 s для ликвидации ячейки мусор и передачи супернатант в новой трубы. Определить загрязнение микоплазмы, использование коммерчески доступных микоплазмы испытательный комплект (см. Таблицу материалов) и/или ПЦР15 следуя инструкциям производителя. - Семена 5 x 103 E0771-LG клеток на колодец в 12-ну пластины и культура клетки с 10% (v/v) FBS-DMEM ночь в инкубаторе при 37 ° C, влажность 95% и 5% CO2.
Примечание: Если низкий уровень распространения клеток-мишеней (население более чем 36 ч время удвоения), количество клеток может быть увеличена до 1 x 10-4. - Заменить средний 1 мл 10% (v/v) FBS-DMEM, включая 10 мкг/мл Полибрен и добавить 25 мкл лентивирусные частиц (1 х 106 ту/мл) кодирования ядерной ограничено красных флуоресцентных белков (mKate2, обратитесь к Таблице материалов).
- Культура клетки для 24 h в инкубаторе при 37 ° C, влажность 95% и 5% CO2.
- Замените 10% (v/v) FBS-DMEM среднего и культура клетки за 24-48 ч в инкубаторе при 37 ° C, влажность 95% и 5% CO2.
- Замените носитель с 10% (v/v) FBS-DMEM, включая 1 мкг/мл puromycin, когда клетки начинают выражать красных флуоресцентных белков и культура клетки, пока они не 80-90% притока.
Примечание: Концентрация puromycin будет отличаться между целевых типов клеток и должны быть оптимизированы с помощью ООН transfected клеток. - Субкультура живых клеток для 1-3 места с 10% (v/v) FBS-DMEM, включая 1 мкг/мл puromycin и криоконсервировать запасов в системе хранения фазы пара жидкого азота до использования.
2. изоляция клетки Супрессоры опухолей у мышей
Примечание: В настоящем Протоколе, подавитель клетки (то есть, MAMs и M-MDSCs) изолированы от легких, содержащий метастатические опухоли, установленных E0771-LG клетки. Условия для ткани диссоциации и сортировки клеток должны быть оптимизированы для изоляции клетки различных тканей.
- Inject 1 х 106 раковых клеток (E0771-LG) в Вену хвост сингенных (C57BL/6), женщина, 7-10 неделе старых мышей.
- После 14 дней изолировать содержащие метастатические опухоли легких и подготовить одноклеточных суспензий из перфузии легких посредством ферментативного пищеварения как описано11.
Примечание: В настоящем Протоколе, четыре мыши вводят раковых клеток и их метастазами легкие объединяются для получения достаточных клеток супрессоров. - Инкубировать одноклеточного суспензий с анти мыши CD16/CD32 антитела для 30 минут на льду и пятно с флуоресцентных антител к CD45, F4/80, CD11b, Ly6C и Ly6G (см. Таблицу материалов) для еще 30 мин10,11 , 13.
- Мойте окрашенных клеток с 1 мл раствора PBS, содержащий 2% (w/v), бычьим сывороточным альбумином (БСА) и вновь приостановить клетки лепешка с PBS, содержащий 2% (w/v) BSA мкл 500-1000.
- Добавить 3 мкм DAPI и сортировки M-MDSCs (CD45 DAPI–+F4/80+Ly6G–CD11bвысокойLy6Cвысокий) и MAMs (CD45 DAPI–+F4/80+Ly6G–CD11bвысокой Ly6Cнизкий) с использованием клеток сортировщик (дополнительный рис. 1).
Примечание: Порог уровня Ly6C различать MAMs (Ly6Cнизкая) и М-MDSCs (Ly6Cвысокой) основана на что резидентов альвеолярных макрофагов (RMAC). Чистоту сортировки клеток измеряется через проточной цитометрии с ожидаемым чистотой более 90%. - Ресуспензируйте сортировки клеток с 400 мкл DMEM, содержащих 20% (v/v) FBS, пенициллин 1% (v/v) / стрептомицина, 2 мм L-глютамином, 1% (v/v) несущественные аминокислот, пируват натрия 1 мм и 50 Нм 2-меркаптоэтанол (так называемый обогащенный DMEM, E-DMEM).
- Подсчитать количество живых клеток, используя Трипановый синий исключения метод16 и приспособиться к 2 х 106 клеток/мл с E-DMEM.
- Держите клетки на льду до использования.
3. изоляция CD8 клетки+ T из селезенки мышей
- Изолировать хандры от мыши, сингенных целевой рак клеток линии (т.е., мышей C57BL/6 в этом протоколе) следующим образом:
- Усыпить животных вдыханием CO2 .
- Поместите животное на доске чистой диссекции и протрите кожу с 70% (v/v) этанола.
- Вырезать брюшной кожу с помощью ножниц выставить селезенки
- Изолировать селезенки, который расположен ниже желудка, и поместите его в пробирку, содержащую 5 мл ледяной PBS.
- Используя внутренний поршень 5 мл стерильного шприца, шлифуют селезенки на 100 мкм клеток стрейнер на тюбик 50 мл.
- Клетки проходят через фильтр, с помощью всего 10 мл ФСБ.
- Центрифуга суспензию клеток в 337 x g 5 минут и удалить супернатант.
- Ресуспензируйте Пелле клеток в 1 мл PBS, содержащие ЭДТА 2 мм и 0,5% (w/v) BSA (работает буфер) и процеживают через сито клеток 40 мкм.
- Подсчет количества живых клеток и приспособиться к 1 x 108 кл/мл, используя идущий буфер.
Примечание: Держите небольшой аликвота клеток как образец предварительного обогащения для проверки чистоты. - Обогатить для CD8+ T клетки, используя набор негативный выбор и магнитные сортировщик (см. Таблицу материалов).
- Передача 1 x 10-8 (1 мл) splenocytes клеток в 5 мл трубку из полистирола раунд снизу.
- Добавьте 50 мкл биотинилированным антител и инкубации при комнатной температуре в течение 10 мин.
- Добавить 125 мкл стрептавидина конъюгированных магнитные бусы и инкубации при комнатной температуре в течение 5 мин.
- Добавьте 1.325 мл работает буфер и осторожно перемешать, закупорить.
- Положите трубку в магнит и инкубации при комнатной температуре в течение 2,5 мин.
- Подобрать магнит и вылить суспензию обогащенных клеток в новой трубки.
- Ресуспензируйте обогащенных клеток с 200 мкл E-DMEM (т.е.., DMEM, содержащий 20% (v/v) FBS, 1% (v/v) пенициллина/стрептомицина, 2 мм L-глютамином, 1% (v/v) несущественные аминокислот, пируват натрия 1 мм и 50 Нм 2-меркаптоэтанол).
- Подсчитать количество живых клеток и приспособиться к 2 х 106 клеток/мл с E-DMEM. Держите клетки при 37 ° C в CO2 инкубатора до использования.
Примечание: Держите небольшой аликвота клеток как образец после обогащения для проверки чистоты. - Определить чистоту CD8 клетки+ T подачей cytometry следующим образом:
- 1 х 104 клетки от предварительного обогащения (шаг 3,6) или после обогащения (шаг 3.9) образцов и отрегулировать общий объем каждого до 100 мкл, используя идущий буфер.
- Инкубировать одноклеточного суспензий с анти мыши CD16/CD32 антитела для 30 минут на льду и пятно с флуоресцентных антител к CD45, CD3, CD4 и CD8 (см. Таблицу материалов) для еще 30 мин.
- Мойте окрашенных клеток с 500 мкл PBS, содержащий 2% (w/v) BSA и вновь приостановить клетки лепешка с PBS, содержащий 2% (w/v) BSA мкл 500-1000.
- Добавить 3 мкм DAPI и определить процент CD3+CD4–CD8+ клетки в целом CD45+ клеток населения.
4. Активизация и расширение изолированных CD8+ T клетки
- Аликвота 1 x 105 клеток 50 мкл CD8+ T клетки (подготовленных на шаге 3.9) в скважины U-дно 96-луночных плиты.
- Добавить 1 х 105 клеток на 50 мкл клетки подавитель (подготовленных на шаге 2.7) или 50 мкл E-DMEM в скважины.
- Подготовка среднего активации, который состоит из E-DMEM, 4 x 104 ед/мл колониестимулирующий фактор 1 (РСУ-1), 240 ед/мл интерлейкин-2 (IL-2), 8 мкг/мл анти мыши CD3ε антител и 16 мкг/мл анти мыши CD28 антитела.
Примечание: РСУ-1 не требуется для активации клеток T, но имеет важное значение для выживания клетки подавитель в настоящем Протоколе (то есть, MAMs и M-MDSCs). Таким образом он сохраняется в сотрудничестве культуре Т-клеток с цели раковых клеток для поддержания согласованности в условиях культуры. Так как РСУ-1 находится в нано молярной концентрации во всех тканях и не требуется для моноцитов/макрофагов жизнеспособность в естественных условиях, это физиологические контекст для этих клеток. - Добавьте 50 мкл активации среды (шаг 4.3) и 50 мкл E-DMEM с или без реагентов для проверки.
- Установите пластину в инкубаторе при 37 ° C, влажность 95% и 5% CO2 и культура клетки на 4 дня.
5. Настройка совместного культуры целевой ячейки с предварительно активированные CD8+ T клетки
- Добавьте 30 мкл разбавленного фактор роста снижение растворимых базальной мембраны матрицы масштаба 1: 100 (Таблица материалов) в скважины плоская 96-луночных днище подходит для микроскопии и инкубировать при 37 ° C в CO2 инкубатора для по крайней мере 1 час.
- Подготовка клетки-мишени (т.е., E0771-LG клетки, выражая-ограниченных Красного флуоресцирующего белка).
- Инкубации клеток-мишеней с 1 мл 0,05% трипсина/ЭДТА при комнатной температуре в течение 1 мин и урожай клетки, нежный закупорить.
- Добавить 9 мл DMEM, включая 10% (v/v) FBS и центрифуги суспензию клеток в 337 x g за 5 мин.
- Вновь приостановить клетки с 500 мкл E-DMEM и подсчитать количество живых клеток.
Примечание: Прежде чем подсчет клеток-мишеней, фильтр клетки через сито 40μm клеток для производства одноклеточного подвеска. - Регулировка плотности до 2 х 104 клеток/мл (= 1 х 103 клеток 50 мкл), добавив E-DMEM и сохранить клетки на льду.
- Подготовить эффекторные клетки (то есть, предварительно активированные CD8+ T клетки).
- Ресуспензируйте клетки в хорошо 96-луночных плиты (шаг 4.5) тщательно закупорить и передачи плавающей CD8+ T клетки в новой 1,5 мл трубку.
Примечание: MAMs и M-MDSCs жестко придерживаться хорошо и не отсоединяется, закупорить. - Чтобы собрать оставшиеся клетки, добавить 200 мкл PBS в колодец и передачи в трубу на шаге 5.3.1.
- Вымыть клетки с 1 мл E-DMEM раз (центрифуги на 337 x g) за 5 мин, аспирационная и удалить супернатант) и Ресуспензируйте их с 100 мкл E-DMEM.
- Подсчитать количество живых клеток (с помощью метода исключение Трипановый синий), регулировка плотности до 1,6 x 105 клеток/мл (= 4 x 103 клеток/25 мкл) и сохранить клетки на льду.
- Ресуспензируйте клетки в хорошо 96-луночных плиты (шаг 4.5) тщательно закупорить и передачи плавающей CD8+ T клетки в новой 1,5 мл трубку.
- Аспирационная базальной мембраны матрица от каждой скважины пластины в шаге 5.1.
- Добавить 1 x 103 клеток/50 мкл клеток-мишеней (шаг 5.2.4) в каждой скважине и хорошо перемешать.
Примечание: Чтобы избежать краевых эффектов из-за испарения средний, только внутренний 60 скважин 96 хорошо плиты должны использоваться для анализа. - Добавьте 25 мкл E-DMEM, включая3 Ил-2 ед/мл 4 x 10 и 10 мкм fluorogenic каспазы-3 субстрата (см. Таблицу материалов).
- Добавить 4 x 103 клеток/25 мкл CD8+ T клетки (шаг 5.3.4) в соответствующие скважин и хорошо перемешать.
Примечание: Наличие слишком много клеток в хорошо затрудняет анализ. В этой модели, эффекторные 4:1: целевой коэффициент (ячейке номер 5 x 103 клеток/хорошо) был оптимальным, но коэффициент 8:1 неоптимальной. Уэллс, содержащий следующие четыре элемента управления необходимы для оказания помощи с анализом данных: целевые клетки при плотности используется для совместного культуры скважин (1 х 103 клеток/а) в среде с и без каспазы-3 субстрата, эффекторные клетки (1 х 103 / а) в среде с и без подложки каспазы-3. - Добавьте 200 мкл PBS или стерильной воды во всех пустых скважин (особенно скважин на периферии пластины) для уменьшения испарения среды от экспериментальной скважины.
- Установите пластину в замедленной флуоресценции Микроскоп, который поддерживается при 37 ° C, влажность 95% и 5% CO2.
Примечание: Shake пластину в кросс шаблон для равномерно распределить все ячейки, а затем позволить пластину оставаться при комнатной температуре на плоской поверхности на 10-20 мин до перевода в инкубаторе.
6. imaging клеток
Примечание: Подробные изображения приобретение настройки будет меняться с микроскопом и флуорофоров используется; следующие параметры общие приобретения должны быть использованы для достижения оптимальных результатов.
- Используя соответствующие автофокусом рутину на микроскопе, получить изображения, охватывающего по меньшей мере 25% от общей площади поверхности в каждой экспериментальной скважины 96-луночных пластины.
- Набор Микроскоп, чтобы приобрести изображений в фазового контраста, а также флуоресцентных канал подходит для ядерной ограничено Красного флуоресцирующего белка (mKate2) и флуоресцентные канал подходит для зеленого fluorogenic активирован субстрата каспазы-3 (с возбуждение в 488 нм) (Рисунок 2).
- Захват изображения в экспериментальной скважины в Фазовый контраст и 2 люминесцентных каналы каждые 1-3 ч в течение 72 часов.
7. изображения анализ, используя программное обеспечение для анализа изображений
Примечание: Параметры анализа подробные изображения будут зависеть от используемого программного обеспечения (см. Таблицу материалов); в следующих процедурах общего анализа должны быть использованы для достижения оптимальных результатов.
- Определить, является ли спектральных снимите смешивания требуется отделить флуоресцентные сигнал, излучаемый целевой клеточных ядер от излучаемой apoptotic ядра, если требуется, настройте протокол анализа для этого;
- Просмотр элемент управления также содержит только клетки-мишени (mkate2-меченых) в среде без каспазы-3 субстрат в Зелёный флуоресцентный канал.
- Наблюдаем ли Зеленая Флуоресценция испускается красных ядер (ядер появляются зеленые)
- Если зеленая Флуоресценция проявляется в ядрах, спектральные unmixing контроль изображений программного обеспечения доступа и увеличения доли красного, удалены от зеленого до тех пор, пока зеленый сигнал исчезает (по нашему опыту, это обычно 6-7% для ярких mKate2 флуоресценции).
- Если зеленая Флуоресценция проявляется не в любых ядер, не спектральных расслоение необходимым.
Примечание: Этот спектральный unmixing коррекции тест может также осуществляться с помощью хорошо целевых клеток в среде, содержащей субстрата каспазы-3. Однако это обычно очень низкий уровень спонтанного апоптоза в клетки-мишени (менее 10%), что приводит к несколько целевых клеточных ядер, излучающие зеленый флуоресценции за активацию caspase-3, вместо того, чтобы флуоресценции кровотечение через. Истинный флуоресценции кровотечение через очевидна в этих условиях, когда зеленая Флуоресценция проявляется во всех ядрах. - Просмотр элемента управления, также содержащий только эффекторных клеток (без маркировки ядер) в среде без каспазы-3 субстрата в канале красного и зеленого индивидуально.
- Наблюдаем ли зеленой или красной флуоресценцией испускается ядер. Если ни красным, ни зеленый флуоресценции проявляется в отдельные каналы не спектральных расслоение необходимым.
Примечание: В нашем опыте, мыши CD8+ T клетки не авто люминесцентные и таким образом не спектральных расслоение необходимые для этих клеток. Этот спектральный unmixing коррекции тест может также осуществляться с помощью хорошо эффекторных клеток в среде, содержащей субстрата каспазы-3. Однако существует, как правило, некоторый уровень спонтанного апоптоза, в результате чего эффекторные клеточных ядер, излучающие зеленый флуоресценции за активацию caspase-3. Истинный флуоресценции кровотечение через очевидна в этих условиях, когда зеленая Флуоресценция проявляется во всех ядрах.
- Используйте метод вычитания флуоресценции фона (например, шляпе), с соответствующими параметрами для образца, для разрешения флуоресцентных объектов в обоих каналах флуоресцентные.
Примечание: В зелёном канале мы использовали шляпе (ядер радиус = 10.0 мкм, зеленая Флуоресценция порог = 0,7 зеленый калибровки единицы). В красный канал мы использовали шляпе (ядер радиус = 10.0 мкм, красной флуоресценцией порог = 0,5 единиц красный калибровки). - Используйте соответствующие параметры для колки края для устранения отдельных флуоресцентные ядер.
Примечание: Мы не использовали края расщепления в зеленой или красной флуоресценцией канале. - Использование изображений в красный канал из скважин, содержащие только клеток-мишеней (с caspase субстрата) для определения минимального размера целевой ядер.
Примечание: Мы использовали 80 мкм2. - Использование изображений в зелёном канале из скважин, содержащие только эффекторных клеток (с caspase субстрата) для определения среднего размера apoptotic эффекторных ядер.
Примечание: Один apoptotic ядра эффекторных колебалась в пределах 40-80 мкм2 в этих экспериментах. - Настройка процедуры анализа для определения числа флуоресцентные целевой клеточных ядер с помощью соответствующего минимального размера ограничения (например, минимальная площадь, минимальный диаметр) (Рисунок 2, цели обнаружения маска).
Примечание: Мы использовали зона минимального ядра (красной флуоресценцией) = 80 мкм2. - Настройка процедуры анализа для подсчета количества apoptotic ядра, которые больше, чем средний размер apoptotic эффекторных ядер (рис 2, размер ограничен апоптоз маска).
Примечание: Размер фильтр был установлен в 80 мкм2 (то есть, только области зеленой флуоресценцией превышает этот размер были подсчитаны, таким образом исключая одного apoptotic эффекторных ядер). С помощью этих параметров увеличивает точность анализа в подсчет apoptotic целевой клеточных ядер, хотя могут учитываться некоторые агрегаты apoptotic клеток-эффекторов. - Настройка процедуры анализа для подсчета количества apoptotic клеток-мишеней , подсчитывая ядер где красный флуоресцентного сигнала (от шага 7.6) и ограниченный размер флуоресцентный зеленый сигнал (из шага 7.7) значительно совместно локализации (рис. 2, R Параметр маска перекрытия).
Примечание: Соответствующие Сопредседатель локализации может варьироваться от 30% до 100% от среднего размера целевой ядер. Перекрытие размер фильтр был установлен до 40 мкм2. - Определите количество apoptotic целевой клеточных ядер, а также количество целевых клеточных ядер в скважинах для каждого экспериментальные условия в течение всего времени.
8. анализ данных с помощью вычисления и графические программного обеспечения
- Граф количество apoptotic целевой клеточных ядер, полученный на шаге 7.9 для экспериментальной скважины в течение всего времени. Если несколько скважин были использованы для каждого экспериментальные условия, графически представить результаты как означает ± стандартное отклонение.
- Вычислить apoptotic долю населения целевых ячеек путем деления числа apoptotic клеток в каждой скважине на количество клеток-мишеней в каждой скважине в каждый момент времени.
- Граф результаты, полученные на шаге 8.2.
- Определите площадь под кривой (AUC) для каждой кривой. Пик apoptotic долю населения для каждой кривой также могут быть определены как момент времени, на котором происходит пик, при желании. Определите, являются ли АУК, определяется для экспериментальных условиях значительно отличаются, с использованием надлежащих статистических тестов.
Примечание: Непарных t тест с коррекцией Уэлча был применен к результатам АУК.
Результаты
Этот метод основан на простой Сопредседатель культуру целевых раковых клеток с эффекторных CD8+ T клетки, которые были предварительно культивируемых с или без клетки подавитель присутствии активирующих антител анти CD3/CD28. Он обнаруживает CD8 Т клеток индуцированного рака апоптоз клеток со временем после совместного культуры, таким образом позволяя оценки воздействия на цитотоксичность CD8 клетки подавитель+ + T клетки.
Как правило, раковые клетки увеличение зеленого флуоресценции в их ядрах после активации биосенсора caspase-таргетинг, при эти клетки вступить в контакт с CD8 клетки+ T, активируются предварительно антител в отсутствие (клетки супрессоры Рисунок 3; Дополнительные фильм 1). Обнаружен для по крайней мере 15 h зеленой флуоресценцией от субстрата caspase был после того, как была начата апоптоз. Некоторые спонтанного апоптоза эффекторных CD8+ T клетки также было отмечено со временем, даже если эти клетки были культивировали в изоляции (рис. 4; Дополнительные фильм 2). Однако размеры ядер CD8+ T клетки меньше, чем у раковых клеток и таким образом клетки apoptotic «эффекторных» могут быть исключены из apoptotic клеток «целевой» размер ограничения изображения анализа методом (рис. 2 и рис. 4). Хотя некоторые целевой раковые клетки показывают небольшой округлой формы, без зеленой флуоресценцией, это не влияет на анализ как эти клетки проходят митоз, вместо того, чтобы апоптоз (дополнительные 3 фильма) и таким образом исключаются из apoptotic «целевой» клетки подсчитывает, красный/зеленый перекрытия маски (дополнительный рисунок 2). Спонтанного апоптоза раковых клеток-мишеней иногда найти даже в одной культуре (дополнительные 3 фильма). Однако, Сопредседатель культуры целевой рака клеток с предварительно активированные CD8 клетки+ T рост опухолевых клеток апоптоз выше уровня спонтанного апоптоза в монокультуре раковых клеток (рис. 4). Как правило при использовании оптимальное соотношение раковых клеток-мишеней для эффекторных клеток, пик в количество apoptotic целевой раковые клетки могут наблюдаться (Рисунок 5A). Этот пик является более очевидной, когда данных выражается в виде дроби apoptotic клеток населения (Рисунок 5B). В этом эксперименте базальной апоптоз опухолевых клеток-мишеней достиг 24 h (с долей apoptotic = 0,08), но CD8+ Т клеток индуцированного апоптоза достигла максимального уровня в 17 h (с долей apoptotic = 0,66).
Мы также обнаружили, что CD8+ T клетки, предварительно инкубировали с MAMs или M-MDSCs можно сделать контакт с целевой раковые клетки, но этот контакт, как представляется, привести к меньше случаев апоптоза клеток рака, по сравнению с CD8+ T клетки активируются предварительно без подавитель клеток (рис. 3 и рис. 4; Дополнительные фильм 4 и дополнительные фильм 5). Хотя CD8+ T клетки, предварительно инкубировали с миелоидных клеток иногда индуцированного апоптоза клеток рака, было также некоторые распространения целевой раковые клетки, которые стимулировали не проходят apoptosis в течение времени эксперимент (Дополнительные фильм 6). В соответствии с этими выводами, культивированный пик фракция апоптоза раковых клеток с CD8+ T клетки предварительно инкубировали с миелоидных клеток (фракция apoptotic = 0,38 в 23 h MDSC-E и 0,25 в 20 ч для мам-E) был значительно ниже, чем у раковых клеток культивируемых с CD8+ T клетки, которые не были предварительно инкубируют с супрессорной клеток (рис. 6).
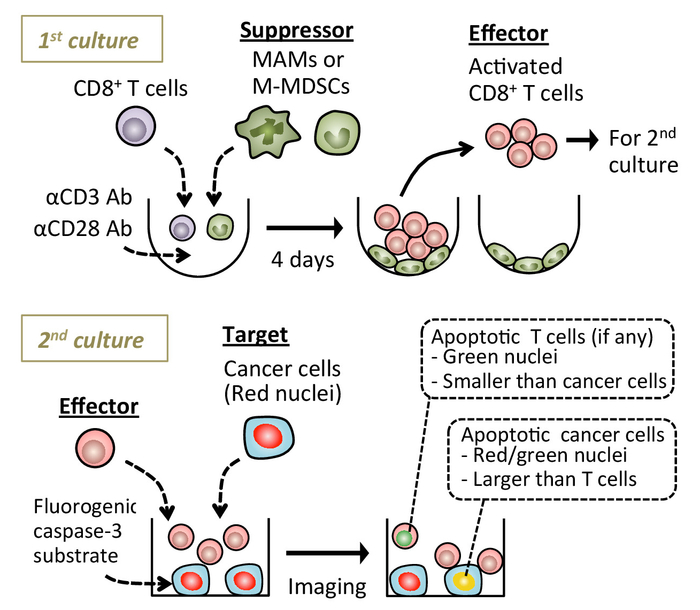
Рисунок 1: схема показаны экспериментальной процедуры. Наивный селезеночной CD8+ T клетки культивировали с активирующей антител анти CD3/CD28 с или без метастазов связанные макрофагов (MAMs) или monocytic миелоидного производные подавитель клетки (M-MDSCs). После 4 дней, плавающие CD8+ T клетки собираются и совместно культивируемых с цели раковых клеток в присутствии fluorogenic каспазы-3 субстрата. Apoptotic раковые клетки обнаружены в реальном времени флуоресцентной микроскопии. Изображения показаны были приобретены с использованием живой клетки изображений платформы (см. Таблицу материалов). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: определение apoptotic клеток-мишеней отличается от apoptotic клеток-эффекторов. Верхний ряд: изображение приобретения красного канала позволяет идентифицировать целевой клеточных ядер, обнаружения цели (розовый анализ маска). Средний ряд: изображения, полученные в зелёном канале указывают apoptotic эффекторных и целевых ячеек. Маска Asize ограничены апоптоз (чирок анализ маска; больше чем 80 мкм2) позволяет один apoptotic клеток-эффекторов будут исключены из анализа. Нижняя строка: композитных изображений Объединенные красный и зеленый каналы с фазы контраст изображения (слева) или красный/зеленый перекрытия маски (справа). Идентификация совместно локализованных, ограниченный размер зеленый флуоресценции с красной флуоресценцией (желтый анализ маска), позволяет более точное обнаружение apoptotic целевой ядер (желтая стрелка), исключая агрегатов apoptotic эффекторных клеток (белая наконечники стрел). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
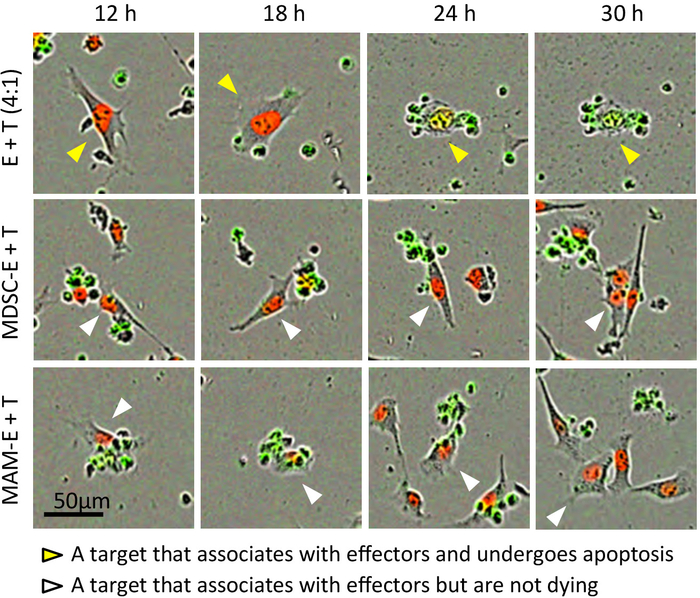
Рисунок 3: Взаимодействие между CD8+ T клетки и клетки рака. Кадры из представительных покадровой фильмов совместно культивируемых с эффекторных CD8 клетки-мишени E0771-LG_NLR (T)+ T клетки (E) в соотношении 4:1 эффекторных/цель. MDSC-E и МВС-E указывают эффекторных клеток предварительно инкубировали с M-MDSCs и MAMs соответственно. Показаны составные изображения (включая образы из фазы контраст, красный и зеленый каналы). Наконечники стрел отслеживание же клетки через различные поля и моменты времени. Желтые стрелки: цель, которая связывает с эффекторы и подвергается апоптоза, белый стрелок: цель, которая связывает с эффекторы, но не проходят apoptosis. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: обнаружение apoptotic клеток рака. Представитель поля, извлеченные из покадровой фильмы в 18 ч после съемки. Композитные изображения (слева; фаза контраст, красный и зеленый каналы) и изображения от красного канала без (в середине) или с перекрытием (справа) красный/зеленый отображаются маски (желтый). Желтые точки в правой колонке представляют apoptotic клетки рака. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
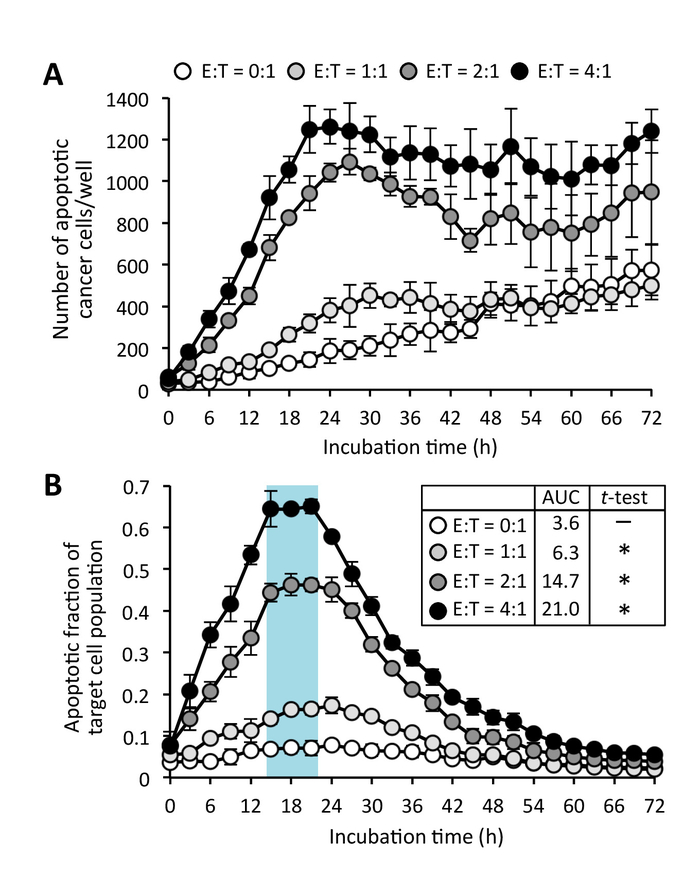
Рисунок 5: CD8+ Т клеток индуцированного рака апоптоза клеток. (A) количество apoptotic раковые клетки культивировали с эффекторных C8+ T-клеток на различных эффекторных целевой соотношение (E:T). доля Apoptotic (B) в целевой популяции клеток. Данные являются средства ± SD. средняя площадь под кривой (AUC) также показано. Непарные t-тест с коррекцией Уэлч была использована для анализа АУК. * P < 0,0001, по сравнению с E:T = 0:1. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
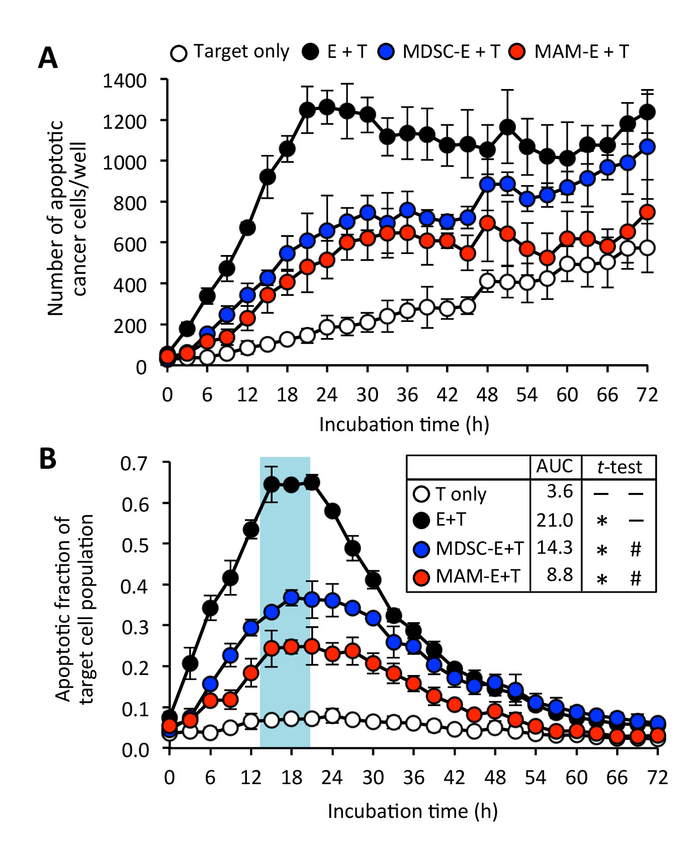
Рисунок 6: Последствия проникновения опухоли миелоидных клеток на цитотоксичность CD8+ T клетки. (A) количество апоптоза раковых клеток (Цель: T) культивируемых с C8+ T клетки (эффекторных: E) 4:1 коэффициента E:T. CD8+ T клетки были предварительно культивировали в отсутствие (черный кружок) или наличие клеток monocytic миелоидного производные супрессор (MDSC-E: синий круг) или связанные с метастазами макрофагов (MAM-E: красный круг). Данные являются средством ± SD. (B) Apoptotic часть целевой популяции клеток. Данные являются средства ± SD. означает АУК также показано. Непарные t-тест с коррекцией Уэлч была использована для анализа АУК. * P < 0,0001 по сравнению с T только, #P < 0,0001, по сравнению с E + T. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Дополнительная цифра 1. Шлюзовые стратегия изолировать подавитель клетки метастатических легких. (A) представитель точка участков изолировать monocytic миелоидной производные подавитель клетки (M-MDSCs) и связанные с метастазами макрофагов (MAMs). Порогового уровня Ly6C различать MAMs (Ly6Cнизкая) и М-MDSCs (Ly6Cвысокой) основана на резидентов альвеолярных макрофагов (RMAC). (B) чистоту отсортированный M-MDSCs (CD45+Ly6G–CD11b+Ly6Cвысокий) и MAMs (CD45+Ly6G–CD11b+Ly6Cнизкой). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительная цифра 2. Представитель образы митотическая целевых ячеек. Кадры из представительных покадровой фильмы целевых E0771-LG_NLR клеток моно-культуры. Вверху: композитных изображений, включая изображения из фазы контраст, красный и зеленый каналы. Внизу: композитных изображений (красный и зеленый каналы) с красным/зеленым светом перекрытия маски. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительная цифра 3. Последствия проникновения опухоли миелоидных клеток на распространение CD8+ клетки Т. (A) представитель гистограммы показаны разрежения люминесцентные маркировки с CFSE в CD8+ T клетки. Наивный селезеночной CD8+ T клетки были изолированы, как описано в протоколе-3 и помечены 5 мкм CFSE при 37 ° C 15 мин. Обозначение Т-клетки были культивировали в присутствии IL-2 и анти CD3/CD28 активации антител с или без миелоидных клеток, как описано в Протоколе 4. После 4 дней проточный цитометр был обнаружен зеленый флуоресценции в Т-клеток. (B) Отдел индекс CD8+ T клетки рассчитывается как описано17. Данные являются средства ± SEM. * P < 0,01 по сравнению с контролем, #P < 0,05, по сравнению с αCD3/CD28 Ab. пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительные фильм 1. Фильм рисунки 3 и 4; E + т. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительные фильм 2. Фильм рисунки 3 и 4; Эффектор (E). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительные фильм 3. Фильм рисунки 3 и 4; Мишень (T). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительные фильм 4. Фильм рисунки 3 и 4; MDSC-E + т. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительные фильм 5. Фильм рисунки 3 и 4; МВС E + т. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительные фильм 6. Фильм рисунки 3 и 4; МВС-E + T (распространения). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Этот метод основан на двух отдельных совместно культуры шаги: совместного культивирования CD8 клетки+ T с потенциальными клетки подавитель, и совместного культивирования «предварительно кондиционером» CD8+ T клетки с целевой опухолевых клеток (рис. 1). Первым этапом совместного культуры довольно похож на CD8+ T мобильных распространения анализов, обычно используется для определения влияния клетки супрессоры CD8+ функции Т-клеток. Однако пролиферацию клеток T не всегда коррелирует с их цитотоксичности. Например, мы обнаружили, что Сопредседатель культура с M-MDSCs или MAMs увеличилась, а не снижение количества CD8+ T-клеток присутствии CD3/CD28 активации антител (дополнительный рис. 3), тогда как эти предварительно кондиционером CD8+ Т-клетки продемонстрировали снижение цитотоксичность против целевой раковые клетки (рис. 4, Рисунок 5, Рисунок 6). Эти результаты подчеркивают важность оценки функциональной активности, подтверждается целевой рак клеток апоптоза, предлагаемые этой CD8 assay цитотоксичности клетки T+ .
В этот assay, мы определили что CD8+ T клетки требует приблизительно 15 h совместно культуры с целью побудить максимальная апоптоз клеток молочной железы опухоль E0771-LG мыши (рис. 5). Эта задержка может быть из-за запаздывания между первоначальный контакт эффекторных клеток с целей и сопровождающих формирование иммунной синапса, а также время, необходимое для побудить apoptotic сигналов в цели, как измеряется активацию caspase-3 (Дополнительные фильм 1 ). Мы также определили которые количество apoptotic опухолевых клеток достигли плато через 24 часа, который, вероятно, из-за ликвидации целей Т-клеток и/или потеря флуоресцентного сигнала от мертвых клеток. Эта возможность определить время пик апоптоз является одним из основных преимуществ этого анализа, поскольку определение оптимального времени точки имеет важное значение для соответствующих сопоставлений между различными условиями. В нашем случае например, разница в цитотоксичности между управления CD8+ T клетки и CD8 MDSC/MAM-образование+ T клетки была гораздо больше, в 15-18 ч, по сравнению с 72 h (рис. 5), и таким образом конечную экспериментировать с использованием 72 h инкубационный период принесет заблуждение результаты.
Этот метод также позволяет визуализации реального времени эффекторных в целевой ячейке взаимодействия, которая обеспечит большее понимание механизм, лежащие в основе ограниченных цитотоксичность CD8+ T клетки предварительно инкубировали с супрессорной клеток. Например, мы наблюдали что CD8+ T клетки, предварительно инкубировали с M-MDSCs или MAMs столкнулся и взаимодействовали с целевой опухолевых клеток, но не всегда вызывает апоптоз (Дополнительные фильм 4, дополнительные фильм 5, дополнительные фильм 6). Хотя мы не сделали количественно это событие, было бы целесообразно и интересным для количественной оценки и сравнения доля встречи и время их взаимодействия в корреляции с индукции апоптоза. Другим большим преимуществом является, что этот метод требует небольшое количество клеток (например, 1 x 103 цели) и 4 x 103 клеток-эффекторов за хорошо. В самом деле этот протокол может далее миниатюрных для формат пластины 384-ну при желании. Таким образом этот assay подходит для высокой пропускной способности скрининг и экспериментов где числа клеток являются ограниченными, такие, как в vitro тестирования с использованием драгоценных клеток, полученных от в естественных условиях или ex vivo образцы.
С другой стороны ограничение текущего анализа является наличие значительного числа погибших эффекторных клеток в некоторых условиях. Для того, чтобы повысить точность в распознавании апоптоз раковых клеток-мишеней, эффекторные CD8+ T клеток, ядер цели, которыми помечены клетки и ядер, что ограничение на размер (что исключает эффекторных клеток) применяется для анализа данных в этой проба (рис. 2). Однако есть некоторые случаи, где оверлея агрегатов (зеленый) apoptotic CD8+ T клетки на не apoptotic целевой раковые клетки, которые могут сбить с толку результаты. Это ограничение может быть смягчены путем использования столбца удаления мертвых клеток на эффекторные клетки перед культуры совместно с целевой опухолевых клеток, предполагая, что достаточное количество клеток-эффекторов доступны. С более сложными системами микроскопии, он также может быть возможным сократить ложный положительный сигнал, снабдив эффекторных CD8+ T-клеток с Флюорофор отличается от целевой клеточных ядер и субстрата fluorogenic каспазы-3.
До настоящего времени этот протокол был использован расследовать активации неспецифических антигена CD8+ T клетки. Хотя MDSCs и ТАМС в микроокружения опухоли подавить функций клеток T через антиген неспецифических механизмов, MDSCs в периферических лимфоидных тканей подавить Т-клеток ответов в антиген конкретным образом18. Расследовать подавляющей иммунные функции таких типов клеток, в пробирке распространения assay с помощью CD8+ T клетки от ОП-1 обычно используется трансгенных мышей. В этот assay, OT-1 Т-клетки (выражая овальбумина (OVA) конкретные Т-клеточный рецептор) совместно культивируемых с супрессорной MDSCs присутствии OVA пептиды, которая применима для первой культуры в нашей цитотоксичность assay (т.е.., активация Т-клеток в наличие или отсутствие супрессоров). Это также возможно для манипулирования целевой раковые клетки выразить OVA, которые могут вызвать рак антиген специфические клетки убийства OT-1 Т-клеток. Таким образом assay позволит также расследование подавления мам/MDSC-опосредованной активации антиген специфические Т-клеток. Это также можно применять assay расследовать человеческих клеток, как активация антител против человека CD3 и CD28 коммерчески доступных, и протокол изолировать человека ТАМС из клинических образцов был установленным19.
Коллективно этот assay довольно универсальна и может использоваться для изучения цитотоксичность других типов иммунных клеток. В настоящее время в наших лабораториях, он расширяется для изучения цитотоксичность антиген зависимой ячейки в различных условиях и является также разрабатывается для высокой пропускной способности скрининга.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была поддержана от грантов от Уэллком траст (101067/Z/13/Z (СПР), 109657/Z/15/Z (ТЗ), 615KIT/J22738 (ТЗ), Великобритания) и MRC (MR/N022556/1 (СПР, ТЗ), Великобритания). НОК и DDS признать поддержки со стороны национальных фенотипические скрининг центр Phenomics обнаружения инициативу и Великобритании исследования рака (NOC)
Материалы
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin EDTA (1X) | Gibco | 25300-054 | |
| 12-Well Cell Culture Plate | Freiner Bio-One | 665-180 | |
| 1x PBS | Gibco | 14190-094 | |
| 2-mercaptethanol | Sigma | M6250-10ML | |
| 5mL Plystyrene Round-Bottom Tube | FALCON | 352054 | |
| 96-Well Cell Culture Plate (Round Bottom ) | Costar | 3799 | Co-culture of CD8+T cells with sorted myeloid cells |
| 96-well plate (Flat bottom) | Nunc | 165305 | Co-culture of CD8+T cells with target cells for cytotoxicity assay |
| AF647 anti-mouse F4/80 Antibody | BIO-RAD | MCA497A647 | Clone: CIA3-1, Lot#: 1707, 2 μL/1x10^6 cells |
| AlexaFluor700 anti-mouse CD8 Antibody | Biolegend | 100730 | Clone: 53-6.7, Lot#: B205738, 0.5 μL/1x10^6 cells |
| anti-mouse CD28 Antibody | Biolegend | 102111 | Activation of isolated CD8+ T cells, Clone: 37.51, Lot#: B256340 |
| anti-mouse CD3e Antibody | Biolegend | 100314 | Activation of isolated CD8+ T cells, Clone: 145-2C11, Lot#: B233720 |
| APC anti-mouse CD3 Antibody | Biolegend | 100236 | Clone: 17A2, Lot#: B198730, 0.5 μL/1x10^6 cells |
| APC/Cy7 anti-mouse Ly6C Antibody | Biolegend | 128026 | Clone: HK1.4, Lot#: B248351, 1 μL/1x10^6 cells |
| Bovine Serum Albmin | Sigma | A1470-100G | |
| Cell Strainer (100μm Nylon) | FALCON | 352360 | To smash the spleen |
| Cell Strainer (40μm Nylon) | FALCON | 352340 | To filter the lung digestion |
| DAPI | Biolegend | 422801 | |
| Dulbecco′s Modified Eagle′s Medium | Gibco | 41966-029 | |
| EasySep Mouse CD8+ T Cell Isolation Kit | StemCell Technologies | 19853 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FITC anti-mouse CD4 Antibody | Biolegend | 100406 | Clone: GK1.5, Lot#: B179194, 0.5 μL/1x10^6 cells |
| Geltrex Ready-to-Use | Gibco | A1596-01 | Coating the 96-well plates for cytotoxicity assay |
| IncuCyte NucLight Red Lentivirus Reagent | Essen BioScience | 4476 | Lenti viral particules encoding mKate2 |
| IncuCyte ZOOM | Essen BioScience | Detector (fluorescence microscope) | |
| IncuCyte ZOOM 2018A | Essen BioScience | Analysis software | |
| L-Glutamine (100X) | Gibco | A2916801 | |
| Lung Dissociation Kit | Miltenyi | 130-095-927 | Preparation of single cell suspension from the tumor-bearing lung |
| MycoAlert Mycoplasma Detection Kit | Lonza | LT07-318 | |
| Non-essential amino acid (100X) | Gibco | 11140-035 | |
| NucView488 | Biotium | 10403 | Fluoregenic caspase-3 substrate |
| PE anti-mouse Ly6G Antibody | Biolegend | 127607 | Clone: 1A8, Lot#: B258704, 0.5 μL/1x10^6 cells |
| PE/Cy7 anti-mouse CD11b Antibody | Biolegend | 101216 | Clone: M1/70, Lot#: B249268, 0.5 μL/1x10^6 cells |
| Pen Strep | Gibco | 15140-122 | Penicillin Streptomycin for primary culture of cells |
| PerCP/Cy5.5 anti-mouse CD45 Antibody | Biolegend | 103132 | Clone: 30-F11, Lot#: B249564, 0.5 μL/1x10^6 cells |
| Polybrene (Hexadimethrine bromide) | Sigma | H9268 | |
| Puromycin | Gibco | A11138-03 | |
| RBC Lysis Buffer (10X) | Biolegend | 420301 | |
| Recombinant murine IL-2 | Peprotech | 212-12 | Activation of isolated CD8+ T cells |
| Sodium pyruvate (100X) | Gibco | 11360-070 | |
| TruStain fcX (anti-mouse CD16/32) Antibody | Biolegend | 101320 | |
| : Nikon 10X objective (resolution 1.22 µm) : Green channel excitation: 440 - 480 nm : Green channel emission: 504 - 544 nm : Red channel excitation: 565-605 nm : Red channel emission: 625 - 705 nm | |||
Ссылки
- Barry, M., Bleackley, R. C. Cytotoxic T lymphocytes: all roads lead to death. Nature Reviews in Immunology. 2, 401-409 (2002).
- Durgeau, A., Virk, Y., Corgnac, S., Mami-Chouaib, F. Recent advances in targeting CD8 T-cell immunity for more effective cancer immunotherapy. Frontiers in Immunology. 9. , 14(2018).
- Tanaka, A., Sakaguchi, S. Regulatory T cells in cancer immunotherapy. Cell Research. 27, 109-118 (2017).
- Fleming, V., et al. Targeting myeloid-derived suppressor cells to bypass tumor-induced immunosuppression. Frontiers in Immunology. 9, 398(2018).
- Cassetta, L., Kitamura, T. Macrophage targeting: opening new possibilities for cancer immunotherapy. Immunology. 155, 285-293 (2018).
- Chahroudi, A., Silvestri, G., Feinberg, M. B. Measuring T cell-mediated cytotoxicity using fluorogenic caspase substrates. Methods. 31, 120-126 (2003).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Review of Vaccines. 9, 601-616 (2010).
- Azimi, M., et al. Identification, isolation, and functional assay of regulatory T Cells. Immunological Investigation. 45, 584-602 (2016).
- Bruger, A. M., et al. How to measure the immunosuppressive activity of MDSC: assays, problems and potential solutions. Cancer Immunology Immunotherapy. , (2018).
- Qian, B., et al. A distinct macrophage population mediates metastatic breast cancer cell extravasation, establishment and growth. PLoS One. 4, e6562(2009).
- Kitamura, T., et al. Monocytes differentiate to immune suppressive precursors of metastasis-associated macrophages in mouse models of metastatic breast cancer. Frontiers in Immunology. 8, 2004(2018).
- Bronte, V., et al. Recommendations for myeloid-derived suppressor cell nomenclature and characterization standards. Nature Communications. 7, 12150(2016).
- Kitamura, T., et al. CCL2-induced chemokine cascade promotes breast cancer metastasis by enhancing retention of metastasis-associated macrophages. Journal of Experimental Medicine. 212, 1043-1059 (2015).
- Ewens, A., Mihich, E., Ehrke, M. J. Distant metastasis from subcutaneously grown E0771 medullary breast adenocarcinoma. AnticancerResearch. 25, 3905-3915 (2005).
- Choppa, P. C., et al. Multiplex PCR for the detection of Mycoplasma fermentans, M. hominisandM. penetransin cell cultures and blood samples of patients with chronic fatigue syndrome. Molecular and Cellular Probes. 12, 301-308 (1998).
- Strober, W. Trypan blue exclusion test of cell viability. Current protocols in immunology. , Appendix 3:Appendix 3B (2001).
- Koyanagi, M., Kawakabe, S., Arimura, Y. A comparative study of colorimetric cell proliferation assays in immune cells. Cytotechnology. 68, 1489-1498 (2016).
- Gabrilovich, D. I., Nagaraj, S. Myeloid-derived-suppressor cells as regulators of the immune system. Nature Reviews in Immunology. 9, 162-174 (2009).
- Cassetta, L., et al. Isolation of mouse and human tumor-associated macrophages. Advances in Experimental Medicine and Biology. 899. 899, 211-229 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены