Method Article
Echtzeit-Erkennung von In Vitro Tumor Zelle Apoptose induziert durch CD8+ T-Zellen, unterdrückende Immunfunktionen Tumor infiltrieren myeloische Zellen zu studieren
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Wir beschreiben hier ein Protokoll zur Zytotoxizität von pre-activated CD8 untersuchen+ T-Zellen gegen Krebszellen durch das Erkennen von apoptotischen Krebs Zellen über Echtzeit-Mikroskopie. Dieses Protokoll kann Mechanismen hinter myeloische Zellen-induzierte T-Zell-Unterdrückung untersuchen und zu bewerten Verbindungen auffüllen T Zellen durch Blockade von Immunzellen suppressive myeloische abzielen.
Zusammenfassung
Potenzierung der Tumor-Tötung-Fähigkeit der CD8+ T Zellen in Tumoren, zusammen mit ihre effiziente Tumor Infiltration, ist ein zentrales Element der erfolgreichen Immuntherapien. Mehrere Studien haben gezeigt, dass eindringende myeloische Tumorzellen (z. B. myeloische abgeleitet Suppressor-Zellen (MDSCs) und Tumor-assoziierten Makrophagen (TAMs)) Zytotoxizität von CD8 unterdrücken+ T-Zellen im Tumor Mikroumgebung und das targeting Diese regulatorischen myeloischen Zellen können Immuntherapien verbessern. Hier präsentieren wir eine in-vitro-Testsystem um immun unterdrückende Wirkung von monozytären MDSCs und TAMs auf die Tumor-Tötung-Fähigkeit der CD8 bewerten+ T Zellen. Zu diesem Zweck kultiviert wir zunächst naiv Milz CD8+ T-Zellen mit Anti-CD3/CD28 aktivierende Antikörper in das Vorhandensein oder Fehlen von Suppressor-Zellen und dann Co kultiviert die voraktivierten T-Zellen mit Krebszellen in Anwesenheit eines Fluorogenic Caspase-3 Substrat. Fluoreszenz vom Substrat in Krebszellen wurde durch Echtzeit-Fluoreszenz-Mikroskopie als Indikator für T-Zellen induziert Tumor Zellapoptose gefunden. In diesem Test können wir erfolgreich die Erhöhung der Tumor Zelle Apoptose durch CD8 erkennen+ T Zellen und ihre Unterdrückung durch Vorkultur mit TAMs oder MDSCs. Diese funktionelle Assay eignet sich für die Untersuchung von CD8+ T Zelle Unterdrückungsmechanismen durch regulatorische myeloische Zellen und identifizierenden druggable Ziele, sie über Hochdurchsatz-Screening zu überwinden.
Einleitung
Es ist bekannt, dass CD8+ T Zellen können Tumorzellen zu beseitigen, wenn sie ihre volle Zytotoxizität ausüben. Nach der Aktivierung der T-Zell-Rezeptor (TCR), CD8+ T Zellen vermehren und zytotoxische Effektorzellen differenzieren. Die erweiterte und aktivierte CD8+ T Zellen sezernieren zytotoxischen Granulat, einschließlich Perforin und Granzyme, die in Zielzellen überführt und verschiedene lytische Wege zu initiieren, wie z. B. Caspase-3 vermittelte Apoptose1. CD8+ T Zellen können auch induzieren Tumor Zelle Apoptosis durch die Aktivierung der Rezeptoren auf den Zielzellen, wie Rezeptoren für Tumor-Nekrose-Faktor-α (TNF-α), erste Apoptose signal Liganden (FasL) oder TNF-related Apoptose induzierenden Liganden (TRAIL). Darüber hinaus die aktivierte CD8+ T Zellen sezernieren Interferon-γ (IFN-γ), die Tumor-Zell-Proliferation zu unterdrücken und erhöhen die Empfindlichkeit der Tumorzellen zu CD8+ T-Zellen über die Up-Verordnung FasL Rezeptor1. Angesichts des Potenzials für CD8+ T Tumor Tötung Fähigkeit, mehrere Strategien zur Förderung ihrer Zytotoxizität (z. B. Checkpoint-Inhibitoren, Krebs-Impfung und Adoptiveltern Übertragung von Chimären Antigen-Rezeptor (Auto) mit dem Ausdruck T-Zellen) haben sich etabliert und gezeigte signifikante therapeutische Wirkung auf bestimmte Arten von Krebs2. Sammeln Beweise zeigen jedoch, dass Tumor infiltrieren wie regulatorische T-Zellen Immunzellen, myeloische abgeleitet Suppressor Zellen (MDSCs) und Tumor-assoziierten Makrophagen (TAMs) können CD8 unterdrücken+ T Handy-Funktionen und Wirksamkeit einschränken Immuntherapien3,4,5. Um solche Immuntherapien zu verbessern, ist es wichtig zu verstehen, wie immun Suppressor Zellen Grenze CD8+ T-Zell-Zytotoxizität. Die Identifizierung von CD8+ T Zelle Unterdrückungsmechanismen sowie druggable Ziele zu überwinden erfordert die Entwicklung und Nutzung von in-vitro-Untersuchungen.
Der Gold-Standard-Methode zur Messung der CD8+ T-Zell-Zytotoxizität ist Chrom Release Assays in die Zellen die Freisetzung von radioaktiven Sonde (51Cr), vom Ziel, sind durch CD8 lysiert+ T-Zellen, ist bestimmt6. Dieser Test hat jedoch mehrere Nachteile einschließlich relativ geringe Empfindlichkeit, hohe Hintergrund, Unfähigkeit zur Erkennung von frühen Apoptotic Ereignisse, gefährliche Entsorgungsprobleme und begrenzte Kompatibilität mit automatisierten Handhabung von Flüssigkeiten und Erkennung zu unterstützen Anwendungen mit höheren Durchsatz. Eine weitere gängige Methode ist Flow durchflusszytometrischen Analyse in die Apoptose von Tumorzellen Ziel von annexin V verbindlich7erkannt wird. In diesem Test ist es möglich, andere Parameter wie Ziel Zelltod mit Propidium Jodid (PI) oder 7-Aminoactinomycin D (7-AAD) und Effektor-Zell-Aktivierung von CD107a oder CD69 Ausdruck, neben der Apoptose in Zielzellen7 angegebenen erkennen . Dieser Assay erfordert jedoch eine große Anzahl von Suppressor-Zellen im Vergleich zu der Chrom-Release-Assay. Es erfordert auch die Ablösung und Aufschlüsselung der anhaftende Zielzellen und dies kann die Ergebnisse beeinflussen. In der Tat, das Chrom release Assay oder Fluss durchflusszytometrischen Assay werden nicht häufig verwendet, um Suppressor Cell Effekte auf T-Zell-Funktionen zu untersuchen. Stattdessen die Messung der T-Zell-Proliferation gekennzeichnet durch Verdünnung von einem Fluoreszenzfarbstoff (z. B. CFSE) vorinstalliert in T-Zellen häufig verwendet wird, um die Hemmung der CD8 bewerten+ T-Zellfunktion durch Suppressor-Zellen. Nachweis von IFN-γ Produktion von kultivierten T-Zellen ist ein weiterer standard-Methode zur Bewertung der Auswirkungen von Suppressor-Zellen auf T-Zell-Aktivierung-8,-9. Jedoch die Ergebnisse aus diesen Tests nicht unbedingt der Zielzelle töten Fähigkeit der CD8 korrelieren+ T Zellen.
Wir stellen Ihnen hier einen alternative funktionelle Assay zur Bewertung der Auswirkungen von Suppressor-Zellen, vor allem Makrophagen im metastasierten Tumoren auf die Zytotoxizität von CD8+ T Zellen. Diese Methode bestimmt Zytotoxizität von CD8+ T Zellen, Pre kultiviert mit oder ohne die Suppressor-Zellen in Anwesenheit von Anti-CD3/CD28 aktivierende Antikörper, durch das Erkennen von Tumor Zelle Apoptosis, gekennzeichnet durch Fluoreszenz von einem Fluorogenic Caspase-3 Substrat mit6 automatisierten Zeitraffer-Mikroskopie (Abbildung 1). Dieses Protokoll hat mehrere Vorteile gegenüber anderen Methoden; Es erfordert nur eine kleine Anzahl von Zellen, ermöglicht eine Erfassung von anhaftenden Tumor Zelltod mit hoher Empfindlichkeit, kann Bild Echtzeit-Effektor-to-Target-Interaktion und ist offen für Hochdurchsatz-Screening.
In diesem Protokoll sind Metastasen-assoziierten Makrophagen (MAMs) und ihre Vorläuferzellen monozytären-MDSCs (M-MDSCs) von metastatischen Tumoren in Mäusen isoliert als Suppressor-Zellen verwendet. In Maus-Modellen von metastasierendem Brustkrebs, eine eindeutige Bevölkerung von Makrophagen gekennzeichnet als F4/80hochLy6G–CD11bhoheLy6Cniedrigen reichert sich in der Lunge mit metastasierten Tumoren. Diese Makrophagen Bevölkerung ist selten in der normalen Lunge gefunden und so genannte Metastasen-assoziierten Makrophagen (MAMs)10. In diese Maus-Modellen anderen myeloischen Zelle Bevölkerung, definiert als F4/80hochLy6G–CD11bhoheLy6Chohe, auch sammelt sich überwiegend in der Metastasen Lunge, wo es gibt Anlass zu MAMs11. Basierend auf ihre Eigenschaften, können die CD11bhoheLy6Chohe MAM Vorläuferzellen M-MDSCs12darstellen.
Protokoll
Alle Verfahren, die mit Mäusen durchgeführt wurden, in Übereinstimmung mit lizenzierten Erlaubnis aus UK Home Office (P526C60B3). Informationen über kommerzielle Reagenzien und Geräte sind in der Tabelle der Materialienaufgeführt.
1. Vorbereitung der Zielzellen, die rot fluoreszierenden Proteins in ihren Kernen ausdrücken
- Erhalten Sie eine Ziellinie Maus Krebs Zelle von einer entsprechenden Quelle.
Hinweis: In diesem Protokoll ein hoch metastatischen Derivat E0771 Maus Milch-Tumor Zellen (E0771-LG)13 dienen. Elterliche E0771 Zellen stammen aus C57BL/6 Mäusen14. - Auftauen lassen und ein Fläschchen mit E0771-LG Zellen mit Dulbeccos geändert Eagles Medium (DMEM) inklusive 10 % (V/V) fetalen bovine Serum (FBS) in eine Zelle Kultur Inkubator bei 37 ° C, Luftfeuchtigkeit von 95 % und 5 % CO2zu erhalten.
Hinweis: Es sollte bestätigt werden, dass Zellen negativ für Mykoplasmen sind. Zu diesem Zweck Kultur E0771 Zellen (oder getestet werden) für ca. 2-3 Tage wie oben beschrieben (in Abwesenheit von Antibiotika und Antimykotika), sammle 500 μL Kulturmedium. Zentrifugieren Sie das Medium an 12.419 X g für 60 s zu beseitigen Zellenrückstand und überstand in neue Schläuche zu übertragen. Mykoplasmen Kontamination mit einem handelsüblichen Mykoplasma-Test-Kit zu bestimmen (siehe Tabelle der Materialien) und/oder PCR15 nach den Anweisungen des Herstellers. - 5 x 103 E0771-LG Samenzellen pro Bohrloch in einer 12-Well-Platte und die Kultur, die die Zellen mit 10 % (V/V) FBS-DMEM über Nacht im Brutschrank bei 37 ° C, Luftfeuchtigkeit von 95 % und 5 % CO2.
Hinweis: Wenn die Proliferationsrate der Zielzellen niedrig ist (Bevölkerung Verdopplungszeit größer als 36 h), die Anzahl der Zellen kann auf 1 x 104erhöht werden. - Ersetzen Sie das Medium mit 1 mL 10 % (V/V) FBS-DMEM mit 10 μg/mL Polybrene und addieren 25 μL der Lentivirale Partikel (1 x 106 TU/mL) Codierung einer nuklearen rotes fluoreszierendes Protein beschränkt (mKate2, siehe Tabelle of Materials).
- Kultur der Zellen für 24 Std. im Brutschrank bei 37 ° C, Luftfeuchtigkeit von 95 % und 5 % CO2.
- Ersetzen Sie das Medium mit 10 % (V/V) FBS-DMEM und Kultur der Zellen für 24-48 h in einem Inkubator bei 37 ° C, Luftfeuchtigkeit von 95 % und 5 % CO2.
- Ersetzen Sie das Medium mit 10 % (V/V) FBS-DMEM einschließlich 1 μg/mL Puromycin, wenn Zellen beginnen sich zu express rotes fluoreszierendes Protein und Kulturzellen bis sie 80-90 % Zusammenfluss sind.
Hinweis: Konzentration von Puromycin wird zwischen Ziel Zelltypen unterschiedlich sein und sollten mit UN-transfizierten Zellen optimiert werden. - Subkultur der Überlebenden Zellen für 1-3 Durchgänge mit 10 % (V/V) FBS-DMEM einschließlich 1 μg/mL Puromycin und Tiefgefrieren Bestände in einem Flüssigstickstoff-Speichersystem für Dampf-Phase bis zur Verwendung.
2. Isolierung von Suppressor-Zellen von Tumoren in Mäusen
Hinweis: In diesem Protokoll sind Suppressor-Zellen (d. h. MAMs und M-MDSCs) aus der Lunge mit metastasierten Tumoren festgelegten E0771-LG Zellen isoliert. Bedingungen für Gewebe Dissoziation und Zellsortierung sollte optimiert werden, um die Zellen aus verschiedenen Geweben zu isolieren.
- 1 x 106 Krebszellen (E0771-LG) in die Vene der Schweif von Phänomen (C57BL/6), Weiblich, 7 – 10 Wochen alten Mäusen zu injizieren.
- Nach 14 Tagen die Lunge mit metastasierten Tumoren zu isolieren und einzellige Suspensionen aus der perfundierten Lunge durch enzymatische Verdauung als zuvor beschriebenen11vorbereiten.
Hinweis: In diesem Protokoll sind vier Mäuse mit Krebszellen injiziert und ihre metastasierendem Lungen werden kombiniert, um ausreichende Suppressor-Zellen zu erhalten. - Die einzelne Zellensuspensionen mit Anti-Maus CD16/CD32 Antikörper für 30 min auf Eis brüten, und Färben mit fluoreszierenden Antikörpern CD45 F4/80, CD11b, Ly6C und Ly6G (siehe Tabelle der Materialien) für eine weitere 30 min10,11 , 13.
- Waschen Sie die gefärbten Zellen einmal mit 1 mL PBS mit 2 % (w/V) Rinderserumalbumin (BSA) und erneut aussetzen der Zelle Pellet mit 500-1000 μl PBS mit 2 % (w/V) BSA.
- 3 μM DAPI hinzufügen und sortieren Sie M-MDSCs (CD45 DAPI–+F4/80+Ly6G–CD11bhoheLy6Chohe) und MAMs (CD45 DAPI–+F4/80+Ly6G–CD11bhoch Ly6Cniedrig) mit einer Zelle Sorter (ergänzende Abbildung1).
Hinweis: Die Schwelle der Ly6C Ebene zu unterscheiden, MAMs (Ly6Cniedrig) und M-MDSCs (Ly6Choch) basiert auf dem von resident alveolären Makrophagen (RMAC). Die Reinheit der sortierten Zellen wird mit einer erwarteten Reinheit von mehr als 90 % über Durchflusszytometrie gemessen. - Aufschwemmen der sortierten Zellen mit 400 μl DMEM mit 20 % (V/V) FBS, 1 % (V/V) Penicillin/Streptomycin, 2 mM L-Glutamin, 1 % (V/V) nicht-essentielle Aminosäure, 1 mM Natrium Pyruvat und 50 nM 2-Mercaptoethanol (so genannte bereichert-DMEM, E-DMEM).
- Die Anzahl der lebenden Zellen verwenden Trypan blau Ausgrenzung Methode16 und 2 x 106 Zellen/mL mit E-DMEM passen.
- Halten Sie die Zellen auf dem Eis bis zur Verwendung.
3. Isolation der CD8+ T-Zellen aus der Milz von Mäusen
- Isolieren Sie die Milz von einer Maus, das Phänomen auf die Ziel-Krebs-Zell-Linie (d. h. C57BL/6 Mäusen in diesem Protokoll) wie folgt:
- Einschläfern des Tieres durch CO2 einatmen.
- Legen Sie das Tier auf einem Brett sauber Dissektion und wischen Sie die Haut mit 70 % (V/V) Ethanol.
- Schneiden Sie die Bauchhaut mit einer Schere die Milz aussetzen
- Isolieren Sie die Milz, die schlechter als der Magen befindet, und legen Sie sie in ein Röhrchen mit 5 mL eiskaltem PBS.
- Verwenden den inneren Kolben einer sterilen 5 mL Spritze, Mahlen Sie die Milz auf einem 100 μm Zelle Sieb legen auf eine 50 mL-Tube.
- Der Filter mit insgesamt 10 mL PBS durchlaufen Sie die Zellen.
- Zentrifugieren Sie die Zellsuspension bei 337 X g für 5 min und aspirieren Sie überstand.
- Aufschwemmen der Zelle Pellet in 1 mL PBS mit 2 mM EDTA und 0,5 % (w/V) BSA (mit Puffer) und durch ein Sieb 40 μm Zelle filtern.
- Die live Zelle Anzahl und 1 x 108 Zellen/ml mit der laufenden Puffer anpassen.
Hinweis: Halten Sie eine kleine aliquoten Zellen als eine Voranreicherung Probe für einen Check-Reinheit. - Für CD8 bereichern+ T-Zellen mit einer negativen Auslese-Kit und einen magnetischen Sorter (siehe Tabelle der Materialien).
- Übertragen Sie 1 x 108 (1 mL) der Splenocyten Zellen auf ein 5 mL Polystyrol Rundboden Rohr.
- Fügen Sie 50 μL Biotinylierte Antikörper und bei Raumtemperatur für 10 min inkubieren.
- Fügen Sie 125 μL der magnetischen Beads Streptavidin konjugiert und in 5 min bei Raumtemperatur inkubieren.
- 1,325 mL Puffer läuft hinzugeben und vorsichtig mischen durch pipettieren.
- Legen Sie das Rohr in den Magneten und bei Raumtemperatur für 2,5 min inkubieren.
- Abholen des Magnets, und gießen Sie die angereicherten Zellsuspension in einen neuen Schlauch.
- Aufschwemmen der angereicherten Zellen mit 200 μL des E-DMEM (dh., DMEM mit 20 % (V/V) FBS, 1 % (V/V) Penicillin/Streptomycin, 2 mM L-Glutamin, 1 % (V/V) nicht-essentielle Aminosäure, 1 mM Natrium Pyruvat und 50 nM 2-Mercaptoethanol).
- Die Anzahl der lebenden Zellen und 2 x 106 Zellen/mL mit E-DMEM passen. Halten Sie die Zellen bei 37 ° C in einer CO2 Inkubator bis zur Verwendung.
Hinweis: Halten Sie eine kleine aliquoten von Zellen als Post-Anreicherung Probe für einen Check-Reinheit. - Bestimmen Sie die Reinheit der CD8+ T-Zellen durch Durchflusszytometrie wie folgt:
- Nehmen Sie 1 x 10-4 -Zellen von Voranreicherung (Schritt 3.6) oder Post-Anreicherung (Schritt 3,9) Proben und passen Sie Gesamtvolumen von jeweils 100 μL mit laufenden Puffer an.
- Die einzelne Zellensuspensionen mit Anti-Maus CD16/CD32 Antikörper für 30 min auf Eis brüten, und Färben mit fluoreszierenden Antikörpern gegen CD45, CD3 CD4 und CD8 (siehe Tabelle der Materialien) für weitere 30 Minuten.
- Waschen Sie die gefärbten Zellen mit 500 μl PBS mit 2 % (w/V) BSA und erneut aussetzen der Zelle Pellet mit 500-1000 μl PBS mit 2 % (w/V) BSA.
- Hinzufügen 3 μM DAPI, und bestimmen Sie den Prozentsatz der CD3+CD4–CD8 Zellen+ in der gesamten CD45+ Zelle Bevölkerung.
(4) Aktivierung und Erweiterung des isolierten CD8+ T Zellen
- Aliquoten 1 x 105 Zellen pro 50 μL CD8+ T Zellen (vorbereitet in Schritt 3,9) in Vertiefungen einer U-Boden-96-Well-Platte.
- Fügen Sie 1 x 105 Zellen pro 50 μL-Suppressor-Zellen (in Schritt 2.7 vorbereitet) oder 50 μL der E-DMEM in die Vertiefungen.
- Bereiten Sie Aktivierungs-Medium, das von E-DMEM, 4 x 104 U/mL Kolonie-stimulierende Faktor 1 (CSF-1) 240 U/mL Interleukin-2 (IL-2), 8 μg/mL Anti-Maus CD3ε Antikörper und 16 μg/mL Anti-Maus CD28 Antikörper besteht.
Hinweis: CSF-1 für T-Zell-Aktivierung ist nicht erforderlich, aber ist essentiell für das Überleben von Suppressor-Zellen in diesem Protokoll (d. h. MAMs und M-MDSCs). So bleibt es in der Kokultur von T-Zellen mit Krebszellen um Konsistenz in Kulturbedingungen. Da die CSF-1 findet sich in Nano-Molaren Konzentrationen in allen Geweben und ist erforderlich für Monocyte/Makrophagen Lebensfähigkeit in-vivo, handelt es sich um einen physiologischen Kontext für diese Zellen. - Fügen Sie 50 μL der Aktivierung Medium (Schritt 4.3) und 50 μL der E-DMEM mit oder ohne Reagenzien getestet werden.
- Legen Sie die Platte in einem Inkubator bei 37 ° C, Luftfeuchtigkeit von 95 % und 5 % CO2 und die Kultur der Zellen für 4 Tage.
5. Setup der Kokultur des Ziels mit voraktivierten CD8 Zellen+ T Zellen
- Fügen Sie 30 μl 1: 100 verdünnten Wachstumsfaktor reduziert lösliche Basalmembran Matrix (Table of Materials) in die Vertiefungen der Flachboden-96-Well-Platte geeignet für Mikroskopie und Inkubation bei 37 ° C in einem CO-2 -Inkubator für mindestens 1 h.
- Bereiten Sie die Zielzellen (z.B. E0771-LG Zellen mit dem Ausdruck ihrer nuklearen eingeschränkt roten fluoreszierenden Proteins).
- Die Zielzellen mit 1 mL Trypsin/EDTA-0,05 % bei Raumtemperatur für 1 min inkubieren und Ernten der Zellen durch sanfte pipettieren.
- 9 mL DMEM mit 10 % (V/V) FBS hinzugeben und die Zellsuspension bei 337 X g für 5 min zentrifugieren.
- Die Zellen mit 500 μL des E-DMEM wieder anhalten und die Anzahl der lebenden Zellen.
Hinweis: Vor der Zählung der Zielzellen, Filtern Sie die Zellen durch ein 40μm Zelle Sieb, einzelne Zellsuspension zu produzieren. - Passen Sie die Dichte bis 2 x 104 Zellen/mL (= 1 x 103 Zellen pro 50 μL) durch Zugabe von E-DMEM, und halten Sie die Zellen auf dem Eis.
- Vorbereiten der Effektorzellen (d. h. voraktivierte CD8+ T Zellen).
- Aufschwemmen der Zellen in einem Brunnen der 96-Well-Platte (Schritt 4.5) gründlich durch pipettieren und Übertragung der schwimmenden CD8+ T-Zellen in eine neue 1,5 mL Tube.
Hinweis: MAMs und M-MDSCs fest halten gut und sind nicht losgelöst von der pipettieren. - Verbleibende Zellen zu sammeln, fügen Sie 200 μl PBS in den Brunnen und in das Rohr im Schritt 5.3.1 übertragen.
- Waschen Sie die Zellen mit 1 mL E-DMEM einmal (Zentrifugieren bei 337 X g) für 5 min, Aspirieren und überstand verwerfen), und sie mit 100 μL des E-DMEM aufzuwirbeln.
- Die Anzahl der lebenden Zellen (mit der Trypan blau-Ausschluss-Methode), passen Sie die Dichte auf 1,6 x 105 Zellen/mL (= 4 x 103 Zellen/25 μL) und halten die Zellen auf dem Eis.
- Aufschwemmen der Zellen in einem Brunnen der 96-Well-Platte (Schritt 4.5) gründlich durch pipettieren und Übertragung der schwimmenden CD8+ T-Zellen in eine neue 1,5 mL Tube.
- Aspirieren Sie die Basalmembran Matrix aus jedem Brunnen der Platte im Schritt 5.1.
- 1 x 103 Zellen/50 μL der Zielzellen (Schritt 5.2.4) in jede Vertiefung hinzufügen und gut verrühren.
Hinweis: Um Randeffekte durch Verdunstung des Mediums, nur die innere 60 Brunnen 96 gut zu vermeiden sollten Platte für die Analyse verwendet werden. - Fügen Sie 25 μL der E-DMEM einschließlich 4 x 103 U/mL IL-2 und 10 μM Fluorogenic Caspase-3 Substrat (siehe Tabelle der Materialien).
- 4 x 103 Zellen/25 μL der CD8 hinzufügen+ T Zellen (Schritt 5.3.4) in geeigneten Brunnen und gut mischen.
Hinweis: Das Vorhandensein von zu viele Zellen in einem Brunnen erschwert die Analyse. In diesem Modell ein 4:1-Effektor: Zielquote (Ergebniszelle Anzahl 5 x 103 Zellen/Na) war optimal, aber ein 8:1-Verhältnis war suboptimal. Brunnen, enthält die folgenden vier Kontrollen sind notwendig, um mit der Datenanalyse Hilfe: Zellen an der Dichte verwendet für die Kokultur Brunnen (1 x 103 Zellen/Na) im Medium mit und ohne Caspase-3 Substrat Effektorzellen (1 x 103 / gut) im Medium mit und ohne Substrat Caspase-3. - Fügen Sie 200 μl PBS oder sterilem Wasser in alle leeren Brunnen (besonders Brunnen am Rande der Platte), um Verdunstung des Mediums aus experimentellen Brunnen zu reduzieren.
- Legen Sie die Platte in ein Time-Lapse Fluoreszenzmikroskop, die bei 37 ° C, Luftfeuchtigkeit von 95 % und 5 % CO2gehalten wird.
Hinweis: Schütteln Sie die Platte in einem Kreuz-Muster, alle Zellen gleichmäßig zu verteilen, und lassen Sie die Platte weiterhin bei Raumtemperatur auf eine Ebene Fläche für 10-20 min vor der Übertragung in den Inkubator.
6. Bildgebung der Zellen
Hinweis: Detaillierte Bildeinstellungen Erwerb variiert mit dem Mikroskop und Fluorophore verwendet; die folgenden allgemeinen Aufnahmeparameter sollte für ein optimales Ergebnis eingesetzt werden.
- Verwenden eine entsprechende Autofokus-Routine auf dem Mikroskop, Abrufen von Bildern über mindestens 25 % der Gesamtfläche in jede experimentelle Brunnen der 96-Well-Platte.
- Stellen Sie das Mikroskop Bilder im Phasenkontrast sowie einen fluoreszierenden Kanal für das nukleare eingeschränkt rot fluoreszierende Protein (mKate2) zu erwerben und ein fluoreszierender Kanal für die grünen Fluorogenic aktiviert Caspase-3 Substrat (mit Erregung bei 488 nm) (Abbildung 2).
- Die Aufnahmen Sie in experimentellen Brunnen im Phasenkontrast und 2 Leuchtstoffröhren Kanäle alle 1 bis 3 Std. mindestens 72 h.
(7) Bildanalyse mit Bildanalyse-software
Hinweis: Detaillierte Analyse Bildeinstellungen variiert mit der Software verwendet (siehe Tabelle der Materialien); für optimale Ergebnisse sollte die folgende allgemeine Analyse-Verfahren eingesetzt werden.
- Bestimmen, ob spektrale un-Mischen ist erforderlich, um das Fluoreszenzsignal Ziel Zellkerne von emittierten trennen von Apoptotic Kerne emittiert und bei Bedarf Sie ein Analyse-Protokoll richten dazu;
- Ansicht eines Steuerelements gut, nur Zielzellen (mkate2-beschriftet) im Medium ohne Caspase-3 Substrat in der grüne fluoreszierende Kanal enthält.
- Beobachten Sie, ob grüne Fluoreszenz durch den roten Kernen emittiert wird (Kerne erscheinen grün)
- Wenn grüne Fluoreszenz in den Kernen hervorgeht, die spectral unmixing Zutrittskontrolle in der imaging-Software und Erhöhung des Anteils der rot von Grün entfernt, bis das grüne Signal verschwindet (nach unserer Erfahrung, dies ist in der Regel ca. 6-7 % für helle mKate2 Fluoreszenz).
- Wenn grün fluoreszieren in alle Kerne nicht hervorgeht, ist es notwendig, keine spektralen entmischen.
Hinweis: Diese spectral unmixing Korrektur-Test kann auch durchgeführt werden mit einem Brunnen der Zielzellen in Caspase-3 Substrat-haltigem Medium. Allerdings gibt es in der Regel einem sehr niedrigen Niveau von spontanen Apoptose in Zielzellen (weniger als 10 %), was zu ein paar Ziel Zellkerne emittierenden grünen Fluoreszenz durch Aktivierung von Caspase-3 anstatt Fluoreszenz bluten durch. Wahre Fluoreszenz bluten durch wird deutlich unter diesen Bedingungen, wenn grün fluoreszieren in allen Kernen hervorgeht. - Zeigen Sie ein Steuerelement, das einzige Effektorzellen (Kerne ungekennzeichnet) gut enthält in Medium ohne Caspase-3 Substrat in den roten und grünen Kanal einzeln an.
- Beobachten Sie, ob durch die Kerne entweder grüne oder rote Fluoreszenz emittiert wird. Wenn weder rot noch grün Fluoreszenz deutlich in den einzelnen Kanälen ist keine spektralen entmischen notwendig.
Hinweis: In unserer Erfahrung, die Maus CD8+ T Zellen sind nicht Auto-fluoreszierende und somit keine spektralen entmischen ist notwendig für diese Zellen. Diese spectral unmixing Korrektur-Test kann auch mit einem Brunnen der Effektorzellen in Caspase-3 Substrat-haltigem Medium durchgeführt werden. Allerdings gibt es in der Regel gewisse spontanen Apoptose führt Effektor Zellkerne emittierenden grünen Fluoreszenz durch Aktivierung von Caspase-3. Wahre Fluoreszenz bluten durch wird deutlich unter diesen Bedingungen, wenn grün fluoreszieren in allen Kernen hervorgeht.
- Verwenden Sie eine Fluoreszenz Hintergrund Subtraktion Methode (z. B. TopHat) mit relevanten Parameter für die Probe, um die fluoreszierende Objekte in beiden fluoreszierenden Kanälen zu lösen.
Hinweis: In der Grünkanal verwendet wir TopHat (Kerne Radius = 10,0 µm, grüne Fluoreszenz Schwelle = 0,7 grüne Kalibrierung Einheiten). Im roten Kanal verwendet wir TopHat (Kerne Radius = 10,0 µm, rote Fluoreszenz Schwelle = 0,5 Einheiten der roten Kalibrierung). - Verwenden Sie geeignete Parameter für Rand-splitting, um einzelne fluoreszierende Kernen zu lösen.
Hinweis: Wir haben nicht Rand Spaltung in die grüne oder rote Fluoreszenz-Kanal benutzt. - Verwenden Sie Bilder in den Rot-Kanal aus dem Brunnen, enthält nur die Zielzellen (mit Caspase-Substrat) um festzustellen, die minimale Größe des Ziel-Kerne.
Hinweis: Wir haben 80 µm2verwendet. - Verwenden Sie Bilder in den Grün-Kanal aus dem Brunnen, enthält nur Effektorzellen (mit Caspase-Substrat) um festzustellen, die durchschnittliche Größe der Apoptotic Effektor Kerne.
Hinweis: Einzelne Apoptotic Effektor Kerne reichten von 40 – 80 µm2 in diesen Experimenten. - Ein Analyseverfahren eingerichtet, um die Anzahl der Zellkerne fluoreszierende Ziel mit einer entsprechenden Mindestgröße Einschränkung (z. B. Mindestfläche, Mindestdurchmesser) (Abbildung 2, Ziel-Erkennung-Maske).
Hinweis: Wir haben einen minimale Kerne Bereich (rote Fluoreszenz) = 80 µm2. - Ein Analyseverfahren für die Anzahl der Apoptotic Kerne, die größer sind als die mittlere Größe der Apoptotic Effektor Kerne (Abbildung 2, Größe eingeschränkt Apoptose Maske) eingerichtet.
Hinweis: Größe Filter wurde gegründet um 80 µm2 (d. h. nur Bereiche der grünen Fluoreszenz größer als dieser Größe wurden gezählt, also ohne einzigen Apoptotic Effektor Kerne). Mit Hilfe dieser Parameter erhöht die Genauigkeit der Analyse Apoptotic Ziel Zellkerne zu zählen, obwohl einige Aggregate von apoptotischen Effektorzellen gezählt werden können. - Richten Sie ein Analyseverfahren, die Anzahl der Apoptotic Zellen durch Kerne zählen wo Co lokalisieren rote Fluoreszenzsignal (aus Schritt 7,6) und Größe eingeschränkt grünes Fluoreszenzsignal (aus Schritt 7,7) deutlich (Abbildung 2, R / G Überlappung Maske).
Hinweis: Eine entsprechende Co Lokalisierung reichen von 30 % bis 100 % der mittleren Größe der Ziel-Kerne. Überlappung Größe Filter wurde auf 40 µm2festgelegt. - Bestimmen Sie die Anzahl der Apoptotic Ziel Zellkerne sowie die Anzahl der Ziel-Zellkerne in den Vertiefungen für jede Versuchsbedingung, Laufe die ganze Zeit.
(8) Datenanalyse mit Berechnung und Grafik-software
- Graph die Anzahl der Apoptotic Ziel Zellkerne im Schritt 7,9 Laufe die ganze Zeit für die experimentelle Brunnen gewonnen. Wenn mehrere Brunnen für jede experimentelle Bedingung verwendet wurden, präsentieren Sie grafisch die Ergebnisse als ± Standardabweichung bedeuten.
- Berechnen Sie die Apoptotic Bruchteil der Bevölkerung der Zielzellen dividiert die Anzahl der Apoptotic Zellen in jede Vertiefung durch die Anzahl der Zielzellen in jede Vertiefung zu jedem Zeitpunkt.
- Grafische Darstellung der Ergebnisse in Schritt 8.2.
- Die Fläche unter der Kurve (AUC) für jede Kurve zu bestimmen. Der Gipfel Apoptotic Bruchteil der Bevölkerung für jede Kurve kann auch ermittelt werden sowie der Zeitpunkt, an dem die Spitze auftritt, falls gewünscht. Bestimmen Sie, ob die AUC bestimmt für den experimentellen Bedingungen unterscheiden sich wesentlich unter Verwendung geeigneter statistischer Tests.
Hinweis: Der ungepaarte t-Test mit Welch es Korrektur wurde auf die AUC Ergebnisse angewendet.
Ergebnisse
Diese Methode basiert auf einfachen Kokulturen von Krebszellen mit Effektor CD8+ T Zellen, die mit oder ohne Suppressor-Zellen in Anwesenheit von Anti-CD3/CD28 aktivierende Antikörper bereits kultiviert wurde. Es erkennt CD8+ T-Zell-induzierten Krebs Zelle Apoptose im Laufe der Zeit folgende Kokultur, wodurch die Bewertung der Auswirkungen von Suppressor-Zellen auf die Zytotoxizität von CD8+ T Zellen.
Krebszellen erhöhen in der Regel grün fluoreszieren in ihren Kernen nach der Aktivierung einer nuklearen Zielversionen Caspase-Biosensor, wenn diese Zellen nehmen Sie Kontakt mit CD8+ T Zellen, werden durch Antikörper in der Abwesenheit von Suppressor-Zellen (Pre aktiviert Abbildung 3; Ergänzende Film 1). Grüne Fluoreszenz vom Substrat Caspase war nachweisbar mindestens 15 h nach Apoptose initiiert wurde. Einige spontane Apoptose von Effektor CD8+ T Zellen wurde auch im Laufe der Zeit beobachtet, auch wenn diese Zellen gezüchtet wurden, isoliert (Abbildung 4; Ergänzende Film 2). Jedoch Kerne Größen der CD8+ T Zellen sind kleiner als die von Krebszellen und somit apoptotische "Effektorzellen" von apoptotischen 'Ziel' Zelle zählt durch eine Größe Beschränkung Bild Analysemethode (Abbildung 2 und Abbildung 4) ausgeschlossen werden können. Obwohl einige Krebszellen eine kleine abgerundete Form ohne grüne Fluoreszenz zeigen, berührt dies nicht die Analyse wie diese Zellen sind in der Mitose anstatt Apoptose (ergänzende Movie 3) und sind somit von Apoptotic 'Target' ausgeschlossen Zelle zählt durch eine rot/grün Überlappung Maske (ergänzende Abbildung2). Spontanen Apoptose von Krebszellen ist gelegentlich auch in die einzige Kultur (ergänzende Movie 3) gefunden. Jedoch der Kokultur Ziel Krebs Zellen mit voraktivierten CD8+ T Zellen erhöhte Tumor Zellapoptose über dem Niveau der spontanen Apoptose in Monokultur von Krebszellen (Abbildung 4). Im Allgemeinen kann bei der Verwendung von eines optimalen Verhältnis von Krebszellen Effektor Zellen ein Höhepunkt in der Reihe von apoptotischen Krebszellen (Abb. 5A) beobachtet werden. Dieser Gipfel ist stärker ausgeprägt, wenn die Daten als apoptotische Bruchteil der Zelle Zielpopulation (Abbildung 5 b) ausgedrückt werden. In diesem Experiment der basalen Apoptose von Tumorzellen Ziel erreichte bei 24 h (mit Apoptotic Bruch = 0,08), aber CD8+ T-Zell-induzierten Apoptose erreicht ein Maximum um 17 Uhr (mit Apoptotic Bruch = 0,66).
Weiter fanden wir, dass CD8+ T Zellen inkubiert Pre mit MAMs oder M-MDSCs machen konnte Kontakt mit Krebszellen, aber dieser Kontakt schien weniger Fälle von Krebs Zelle Apoptose im Vergleich zu CD8 führen+ T Zellen aktiviert Pre ohne Suppressor-Zellen (Abbildung 3 und Abbildung 4; " Ergänzende Film 4 und ergänzende Film 5). Obwohl die CD8+ T Zellen bereits gelegentlich mit der myeloischen Zellen inkubiert induzierte Zellapoptose Krebs, gab es auch einige Vermehrung von Krebszellen, die nicht in dem zeitlichen Verlauf der Apoptose angeregt wurden die Experiment (ergänzende Film 6). Im Einklang mit diesen Erkenntnissen, der Spitze Anteil der Apoptotic Zellen kultiviert mit CD8+ T Zellen vorab mit myeloische Zellen inkubiert (Apoptotic Bruchteil = 0,38 um 23 Uhr für MDSC-E und 0,25 um 20 Uhr für MAM-E) war deutlich geringer als die von Krebszellen kultivierte mit CD8 Zellen+ T, die nicht vorab inkubierten mit den Suppressor-Zellen (Abbildung 6) waren.
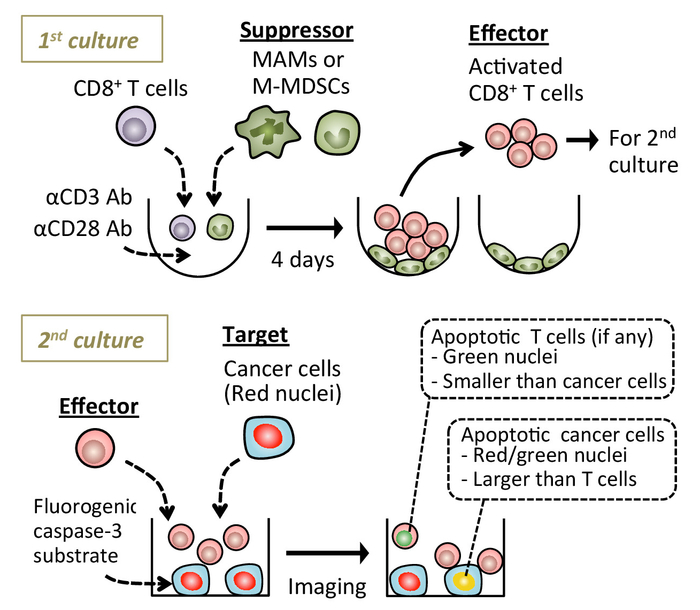
Abbildung 1: ein Schema zeigt die Versuchsdurchführung. Naive Milz CD8+ T Zellen sind mit Anti-CD3/CD28 aktivierende Antikörper mit oder ohne Metastasen-assoziierten Makrophagen (MAMs) kultiviert oder monozytären myeloische-abgeleitete Suppressor Zellen (M-MDSCs). Nach 4 Tagen, schwimmende CD8+ T Zellen werden gesammelt und gemeinsam mit Krebszellen in Anwesenheit von Fluorogenic Caspase-3 Substrat kultiviert. Apoptotische Zellen werden unter Echtzeit-Fluoreszenzmikroskopie erkannt. Gezeigten Bilder wurden mit Hilfe einer live Cell Imaging Plattform erworben (siehe Tabelle der Materialien). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Identifizierung der Apoptotic Zellen unterscheidet sich von apoptotischen Effektorzellen. Obere Reihe: Bildaufnahme im roten Kanal ermöglicht die Identifikation von Ziel Zellkerne von Ziel-Erkennung-Maske (rosa Analyse Maske). Mittlere Reihe: Bilder erwarb der Grünkanal zeigen Apoptotic Zellen Effektor und Ziel. Asize eingeschränkte Apoptose Maske (Teal Analyse Maske; größer 80 µm2) können einzelne Apoptotic Effektorzellen aus der Analyse ausgeschlossen werden. Untere Reihe: zusammengesetzte Bilder zusammengeführten roten und grünen Kanäle mit Phase Kontrast Bild (links) oder rot/grün überlappen Maske (rechts). Identifizierung der Co lokalisierte, Größe eingeschränkt grün fluoreszieren mit rote Fluoreszenz (gelbe Analyse Maske), ermöglicht genauere Erkennung des apoptotischen Ziel Kerne (gelbe Pfeilspitze) durch den Ausschluss der Aggregate des apoptotischen Effektorzellen (weiß Pfeilspitzen). Bitte klicken Sie hier für eine größere Version dieser Figur.
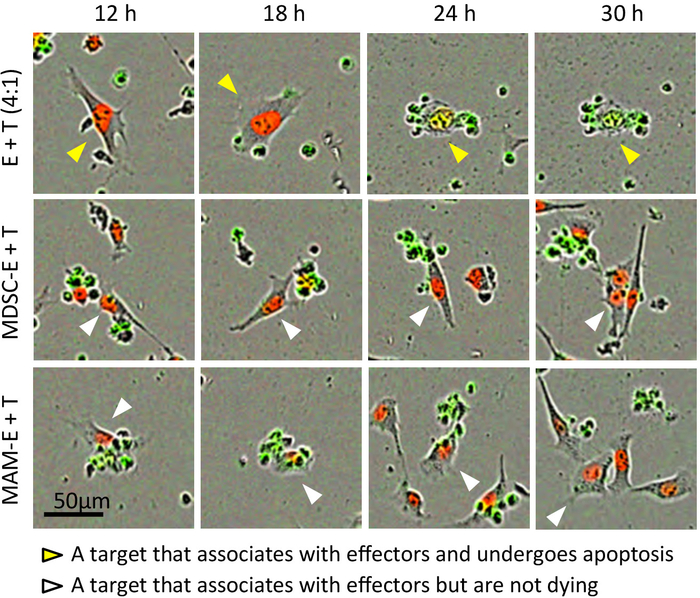
Abbildung 3: Interaktion zwischen CD8+ T Zellen und Krebszellen. Stills aus repräsentativen Zeitraffer-Filme von E0771-LG_NLR Zielzellen (T) Zusammenarbeit mit Effektor CD8 kultiviert+ T Zellen (E) im Verhältnis 4:1 Effektor/Target. MDSC-E und MAM-E zeigen Effektorzellen mit M-MDSCs und MAMs bzw. vorab inkubiert. Zusammengesetzte Bilder (einschließlich Bilder aus Phase Kontrast, rot und grün) angezeigt werden. Pfeilspitzen verfolgen die gleichen Zellen durch die verschiedenen Felder und Zeitpunkten. Gelbe Pfeilspitzen: ein Ziel, das verbindet mit Effektoren und Apoptose, weiße Pfeilspitzen erfährt: ein Ziel, das verbindet mit Effektoren aber nicht Apoptose. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4: Nachweis von Krebszellen Apoptotic. Repräsentativen Bereichen von Zeitraffer-Filme um 18 Uhr nach dem Imaging extrahiert. Zusammengesetzte Bilder (links; Phase Kontrast, rot und grün-Kanäle) und Bilder aus roten Kanal ohne (Mitte) oder mit (rechts) rot/grün Überlappung Maske (gelb) angezeigt werden. Gelbe Punkte in der rechten Spalte darstellen Apoptose von Krebszellen. Bitte klicken Sie hier für eine größere Version dieser Figur.
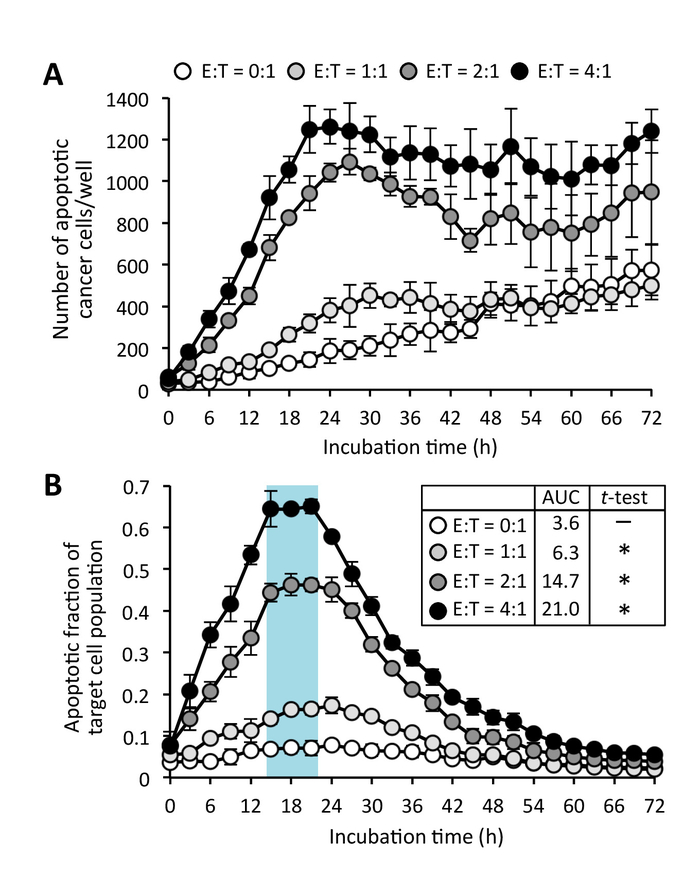
Abbildung 5: CD8+ T-Zell-induzierten Krebs Zelle Apoptose. (A) Anzahl der Apoptotic Zellen kultiviert mit Effektor C8+ T-Zellen bei verschiedenen Effektor Ziel-Verhältnis (E:T). (B) apoptotische Bruchteil der Ziel-Zell-Population. Daten sind Mittel ± SD Mean Fläche unter der Kurve (AUC) auch gezeigt wird. Ungepaarten t-Test mit Welch es Korrektur wurde verwendet, um die AUC zu analysieren. * P < 0,0001 im Vergleich zu E:T = 0:1. Bitte klicken Sie hier für eine größere Version dieser Figur.
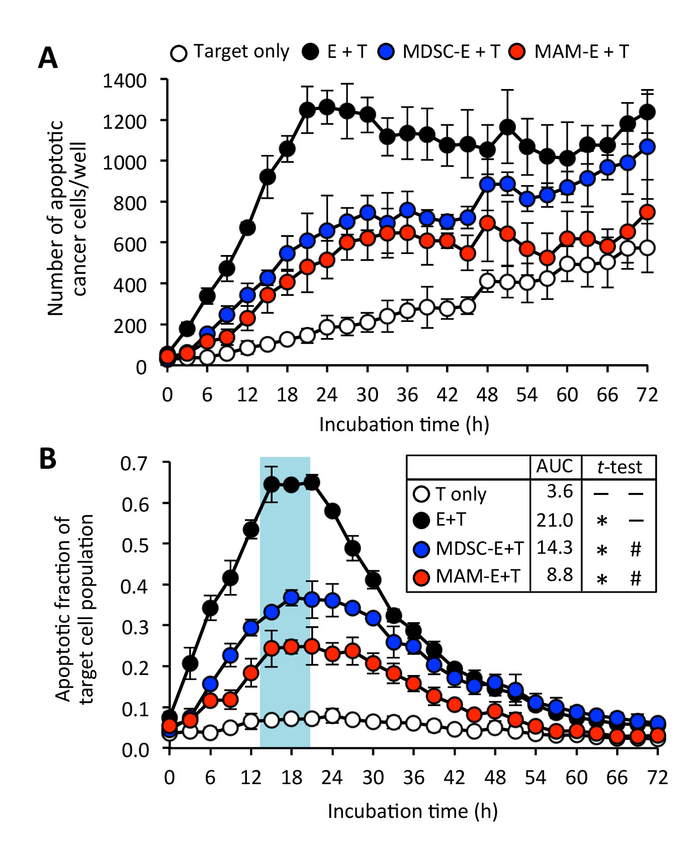
Abbildung 6: Auswirkungen der Tumor infiltrieren myeloische Zellen auf die Zytotoxizität von CD8+ T Zellen. (A) Anzahl der Apoptose von Krebszellen (Ziel: T) kultiviert mit C8+ T Zellen (Effektor: E) mit 4:1 der E:T Verhältnis. CD8+ T Zellen wurden vorab in Abwesenheit (schwarzer Kreis) oder Vorhandensein von monozytären myeloische-abgeleitete Suppressor-Zellen kultiviert (MDSC-E: blauer Kreis) oder Metastasen-assoziierten Makrophagen (MAM-e: roter Kreis). Daten sind Mittel ± SD (B) apoptotische Bruchteil der Ziel-Zell-Population. Daten sind Mittel ± SD bedeuten AUC auch gezeigt wird. Ungepaarten t-Test mit Welch es Korrektur wurde verwendet, um die AUC zu analysieren. * P < 0,0001 im Vergleich zu T nur, #P < 0,0001 im Vergleich zu E + T. Bitte klicken Sie hier für eine größere Version dieser Figur.
Ergänzende Abbildung 1. Gating Strategie, Suppressor-Zellen von metastasierendem Lungenkrebs zu isolieren. (A) repräsentativen Punkt Grundstücke, monozytären myeloische abgeleitet Suppressor-Zellen (M-MDSCs) und Metastasen-assoziierten Makrophagen (MAMs) zu isolieren. Die Schwelle der Ly6C Ebene zu unterscheiden, MAMs (Ly6Cniedrig) und M-MDSCs (Ly6Choch) basiert auf dem Wohnsitz alveolären Makrophagen (RMAC). (B) Reinheit sortiert M-MDSCs (CD45+Ly6G–CD11b+Ly6Choch) und MAMs (CD45+Ly6G–CD11b+Ly6Cniedrig). Bitte klicken Sie hier, um diese Datei herunterladen.
Ergänzende Abbildung 2. Repräsentative Bilder der mitotischen Zellen. Stills aus repräsentativen Zeitraffer-Filme von Ziel E0771-LG_NLR Mono-Zellkultur. Oben: zusammengesetzte Bilder einschließlich Bilder von Phase Kontrast, rot und grün-Kanäle. Unten: zusammengesetzte Bilder (roten und grünen Kanäle) mit rot/grün überlappen Maske. Bitte klicken Sie hier, um diese Datei herunterladen.
Ergänzende Abbildung 3. Beeinflussung der Tumor infiltrieren myeloische Zellen Proliferation von CD8+ T-Zellen. (A) repräsentative Histogramme zeigen Verdünnung der fluoreszierenden Beschriftung mit CFSE in CD8+ T Zellen. Naive Milz CD8+ T Zellen wurden isoliert, wie in Protokoll Nr. 3 beschrieben und mit 5 µM von CFSE bei 37 ° C für 15 min gekennzeichnet. Die beschrifteten T-Zellen wurden in Anwesenheit von IL-2 kultiviert und Anti-CD3/CD28 Antikörper mit oder ohne myeloische Zellen zu aktivieren, wie im Protokoll Nr. 4 beschrieben. Nach 4 Tagen wurde grün fluoreszieren in T-Zellen durch Durchflusszytometer gefunden. (B) Division Index der CD8+ T Zellen als zuvor beschriebenen17berechnet. Daten sind Mittel ± SEM. * P < 0,01 im Vergleich um zu kontrollieren, #P < 0,05 im Vergleich zu αCD3/CD28 ab. Bitte klicken Sie hier, um diese Datei herunterladen.
Ergänzende Film 1. Film der Figuren 3 und 4; E + T. Bitte klicken Sie hier, um diese Datei herunterladen.
Ergänzende Film 2. Film der Figuren 3 und 4; Effektor (E). Klicken Sie bitte hier, um diese Datei herunterzuladen.
Ergänzende Film 3. Film der Figuren 3 und 4; Ziel (T). Klicken Sie bitte hier, um diese Datei herunterzuladen.
Ergänzende Film 4. Film der Figuren 3 und 4; MDSC-E + T. Bitte klicken Sie hier, um diese Datei herunterladen.
Ergänzende Film 5. Film der Figuren 3 und 4; MAM-E + T. Bitte klicken Sie hier, um diese Datei herunterladen.
Ergänzende Film 6. Film der Figuren 3 und 4; MAM-E + T (Proliferation). Bitte klicken Sie hier, um diese Datei herunterladen.
Diskussion
Diese Methode basiert auf zwei separaten Kokultur Schritten: Co Kultivierung CD8-+ T Zellen mit potenziellen Suppressor-Zellen und Co Kultivierung der "Pre-bedingt" CD8-+ T Zellen mit Tumor Zielzellen (Abbildung 1). Der erste Kokultur Schritt ist ganz ähnlich wie für CD8+ T Zell-Proliferation Assays häufig verwendet, um die Auswirkungen von Suppressor-Zellen auf CD8 ermitteln+ T-Zell-Funktion. T-Zell-Proliferation korreliert jedoch nicht immer mit ihrer Zytotoxizität. Zum Beispiel haben wir gefunden, dass Kokultur mit M-MDSCs oder MAMs erhöht anstatt reduzierte Proliferation von CD8+ T-Zellen in Anwesenheit von CD3/CD28 aktivieren Antikörper (ergänzende Abbildung 3), während diese CD8 Pre konditioniert+ T-Zellen nachgewiesen reduziert Zytotoxizität gegen Krebszellen (Abbildung 4, Bild 5, Bild 6). Diese Ergebnisse unterstreichen die Bedeutung der Bewertung der funktionelle Aktivität, belegt durch Ziel Krebs Zelle Apoptosis, angeboten von diesem CD8+ T-Zell-Zytotoxizität-Assay.
In diesem Test, wir haben festgestellt, dass CD8+ T Zellen erfordert ca. 15 h Kokultur um maximale Apoptose der E0771-LG Maus Mamma Tumorzellen (Abbildung 5) zu induzieren. Diese Verzögerung möglicherweise aufgrund der Verzögerung zwischen Erstkontakt der Effektorzellen mit Ziele sowie begleitende immun Synapse Bildung und Zeitaufwand induzieren Apoptotic Signale in Ziele gemessen durch Aktivierung von Caspase-3 (ergänzende Movie 1 ). Wir auch identifiziert, die die Anzahl der apoptotischen Tumorzellen nach 24 h, ein Plateau erreicht, das ist wahrscheinlich durch die Beseitigung der Ziele von T-Zellen und/oder Verlust von Fluoreszenzsignal aus abgestorbenen Zellen. Diese Fähigkeit, die Zeit der Höhepunkt Apoptose zu identifizieren ist ein großer Vorteil von diesem Test, da Bestimmung einer optimalen Zeitpunkt für entsprechende Vergleiche zwischen verschiedenen Bedingungen wichtig. In unserem Fall zum Beispiel der Unterschied in der Zytotoxizität zwischen Steuerung CD8+ T Zellen und CD8 MDSC/MAM-gebildete+ T Zellen war viel größer im Vergleich zu 72 h (Abbildung 5) 15-18 Uhr, und so ein Endpunkt experimentieren mit einem 72 h Inkubationszeit würden zu irreführende Ergebnissen führen.
Diese Methode ermöglicht auch die Visualisierung der Echtzeit-Effektor-Zielzelle Interaktion, die bessere Einblicke in den Mechanismus begrenzt Zytotoxizität von CD8 bieten würde+ T Zellen vorab mit Suppressor-Zellen inkubiert. Zum Beispiel, wir beobachtet, dass CD8+ T Zellen, die bereits mit M-MDSCs oder MAMs inkubiert begegnet und interagiert mit Ziel Tumorzellen aber nicht immer induzieren Apoptose (ergänzende Movie 4, ergänzende Film 5 ergänzende Film 6). Obwohl wir dieses Ereignis nicht quantifizieren, wäre es möglich und interessant zu quantifizieren und den Anteil von Begegnungen und ihre Interaktionszeit im Zusammenhang mit Apoptose-Induktion zu vergleichen. Ein weiterer großer Vorteil ist, dass diese Methode eine kleine Anzahl von Zellen (z.B. 1 x 103 des Ziels) und 4 x 103 Effektor Zellen pro Bohrloch erfordert. In der Tat kann dieses Protokoll für das 384-Well-Plattenformat weiter miniaturisiert werden, falls gewünscht. Daher eignet sich dieser Assay für Hochdurchsatz-Screening und Experimente wo Zellzahlen sind beschränkt, wie z. B. in-vitro- Tests mit kostbaren Zellen von in-vivo und ex Vivo Proben abgeleitet.
Auf der anderen Seite ist eine Einschränkung des aktuellen Tests das Vorhandensein einer beträchtlichen Anzahl von Toten Effektorzellen in einigen Bedingungen. Zur Erhöhung der Genauigkeit bei der Unterscheidung von Apoptose von Krebszellen von der Effektor CD8+ T-Zellen, die Kerne des Ziels, die Zellen gekennzeichnet sind und eine Zellkerne, die Datenanalyse in diesem Größenbeschränkung (das schließt Effektorzellen) beantragt wird Assay (Abbildung 2). Es gibt jedoch einige Fälle wo Überlagerung der Aggregate (grün) apoptotische CD8+ T auf Zielzellen Krebs-apoptotische Zellen, die die Ergebnisse verwirren kann. Diese Einschränkung kann entgegengewirkt werden, indem Verwendung eine tote Zelle entfernen Spalte auf Effektor Zellen vor dem Co Kultur mit Ziel Tumorzellen, vorausgesetzt, dass Effektorzellen in ausreichender Zahl zur Verfügung stehen. Bei komplexer Mikroskopiesysteme, kann es auch sein kann das falsche positive Signal durch Kennzeichnung der Effektor CD8+ T-Zellen mit einem Fluorophor unterscheidet sich von der Ziel-Zellkerne und das Fluorogenic Caspase-3 Substrat.
So weit, dieses Protokoll verwendet worden, um die Antigen-spezifische Aktivierung des CD8 untersuchen+ T Zellen. Obwohl MDSCs und TAMs in den Tumor Mikroumgebung T Zellfunktionen durch Antigen-spezifische Mechanismen unterdrücken, unterdrücken MDSCs in den peripheren lymphatischen Geweben T-Zell-Antworten in ein Antigen spezifisch18. Zu unterdrückende Immunfunktionen solche Zelltypen, untersuchen, eine in-vitro-Vermehrung-Assay mit CD8 Zellen+ T von OT-1 transgene Mäuse wird häufig verwendet. In diesem Test die OT-1 T-Zellen (Ausdruck von Ovalbumin (OVA)-spezifischen T-Zell-Rezeptor) Co kultiviert mit Suppressor MDSCs in Anwesenheit von OVA Peptide, das gilt für die erste Kultur in unseren Zytotoxizität Assay (dh., Aktivierung der T-Zellen das Vorhandensein oder Fehlen der Unterdrücker). Es ist auch möglich, manipulieren Krebszellen auszudrücken, OVA, die Antigen-spezifische Krebs Zelle Tötung von OT-1 T-Zellen induzieren können. Daher wird der Test auch Untersuchung der MAM/MDSC-vermittelten Unterdrückung der Antigen-spezifischen T-Zell-Aktivierung aktiviert werden. Es ist auch möglich, die Probe um menschliche Zellen zu untersuchen, wie Aktivierung Antikörper gegen menschliche CD3 und CD28 im Handel erhältlich sind, und ein Protokoll zum menschlichen TAMs von klinischen Proben isolieren etablierten19 wurdeanzuwenden.
Kollektiv, dieser Assay ist sehr vielseitig und kann verwendet werden, um die Zytotoxizität von anderen Immunzellen Arten zu untersuchen. Derzeit in unseren Labors, es wird erweitert um Zelle Antigen-abhängige Zytotoxizität unter verschiedenen Bedingungen zu untersuchen und durchleuchtet auch für hohen Durchsatz entwickelt.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde unterstützt durch Zuschüsse aus dem Wellcome Trust (101067/Z/13/Z (JWP), 109657/Z/15/Z (TK), 615KIT/J22738 (TK), UK) und der MRC (MR/N022556/1 (JWP, TK), UK). NOC und DDS anerkennen, Unterstützung durch die nationalen phänotypische Screening-Zentrum Phenomics Entdeckung Initiative und Cancer Research UK (NOC)
Materialien
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin EDTA (1X) | Gibco | 25300-054 | |
| 12-Well Cell Culture Plate | Freiner Bio-One | 665-180 | |
| 1x PBS | Gibco | 14190-094 | |
| 2-mercaptethanol | Sigma | M6250-10ML | |
| 5mL Plystyrene Round-Bottom Tube | FALCON | 352054 | |
| 96-Well Cell Culture Plate (Round Bottom ) | Costar | 3799 | Co-culture of CD8+T cells with sorted myeloid cells |
| 96-well plate (Flat bottom) | Nunc | 165305 | Co-culture of CD8+T cells with target cells for cytotoxicity assay |
| AF647 anti-mouse F4/80 Antibody | BIO-RAD | MCA497A647 | Clone: CIA3-1, Lot#: 1707, 2 μL/1x10^6 cells |
| AlexaFluor700 anti-mouse CD8 Antibody | Biolegend | 100730 | Clone: 53-6.7, Lot#: B205738, 0.5 μL/1x10^6 cells |
| anti-mouse CD28 Antibody | Biolegend | 102111 | Activation of isolated CD8+ T cells, Clone: 37.51, Lot#: B256340 |
| anti-mouse CD3e Antibody | Biolegend | 100314 | Activation of isolated CD8+ T cells, Clone: 145-2C11, Lot#: B233720 |
| APC anti-mouse CD3 Antibody | Biolegend | 100236 | Clone: 17A2, Lot#: B198730, 0.5 μL/1x10^6 cells |
| APC/Cy7 anti-mouse Ly6C Antibody | Biolegend | 128026 | Clone: HK1.4, Lot#: B248351, 1 μL/1x10^6 cells |
| Bovine Serum Albmin | Sigma | A1470-100G | |
| Cell Strainer (100μm Nylon) | FALCON | 352360 | To smash the spleen |
| Cell Strainer (40μm Nylon) | FALCON | 352340 | To filter the lung digestion |
| DAPI | Biolegend | 422801 | |
| Dulbecco′s Modified Eagle′s Medium | Gibco | 41966-029 | |
| EasySep Mouse CD8+ T Cell Isolation Kit | StemCell Technologies | 19853 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FITC anti-mouse CD4 Antibody | Biolegend | 100406 | Clone: GK1.5, Lot#: B179194, 0.5 μL/1x10^6 cells |
| Geltrex Ready-to-Use | Gibco | A1596-01 | Coating the 96-well plates for cytotoxicity assay |
| IncuCyte NucLight Red Lentivirus Reagent | Essen BioScience | 4476 | Lenti viral particules encoding mKate2 |
| IncuCyte ZOOM | Essen BioScience | Detector (fluorescence microscope) | |
| IncuCyte ZOOM 2018A | Essen BioScience | Analysis software | |
| L-Glutamine (100X) | Gibco | A2916801 | |
| Lung Dissociation Kit | Miltenyi | 130-095-927 | Preparation of single cell suspension from the tumor-bearing lung |
| MycoAlert Mycoplasma Detection Kit | Lonza | LT07-318 | |
| Non-essential amino acid (100X) | Gibco | 11140-035 | |
| NucView488 | Biotium | 10403 | Fluoregenic caspase-3 substrate |
| PE anti-mouse Ly6G Antibody | Biolegend | 127607 | Clone: 1A8, Lot#: B258704, 0.5 μL/1x10^6 cells |
| PE/Cy7 anti-mouse CD11b Antibody | Biolegend | 101216 | Clone: M1/70, Lot#: B249268, 0.5 μL/1x10^6 cells |
| Pen Strep | Gibco | 15140-122 | Penicillin Streptomycin for primary culture of cells |
| PerCP/Cy5.5 anti-mouse CD45 Antibody | Biolegend | 103132 | Clone: 30-F11, Lot#: B249564, 0.5 μL/1x10^6 cells |
| Polybrene (Hexadimethrine bromide) | Sigma | H9268 | |
| Puromycin | Gibco | A11138-03 | |
| RBC Lysis Buffer (10X) | Biolegend | 420301 | |
| Recombinant murine IL-2 | Peprotech | 212-12 | Activation of isolated CD8+ T cells |
| Sodium pyruvate (100X) | Gibco | 11360-070 | |
| TruStain fcX (anti-mouse CD16/32) Antibody | Biolegend | 101320 | |
| : Nikon 10X objective (resolution 1.22 µm) : Green channel excitation: 440 - 480 nm : Green channel emission: 504 - 544 nm : Red channel excitation: 565-605 nm : Red channel emission: 625 - 705 nm | |||
Referenzen
- Barry, M., Bleackley, R. C. Cytotoxic T lymphocytes: all roads lead to death. Nature Reviews in Immunology. 2, 401-409 (2002).
- Durgeau, A., Virk, Y., Corgnac, S., Mami-Chouaib, F. Recent advances in targeting CD8 T-cell immunity for more effective cancer immunotherapy. Frontiers in Immunology. 9. , 14(2018).
- Tanaka, A., Sakaguchi, S. Regulatory T cells in cancer immunotherapy. Cell Research. 27, 109-118 (2017).
- Fleming, V., et al. Targeting myeloid-derived suppressor cells to bypass tumor-induced immunosuppression. Frontiers in Immunology. 9, 398(2018).
- Cassetta, L., Kitamura, T. Macrophage targeting: opening new possibilities for cancer immunotherapy. Immunology. 155, 285-293 (2018).
- Chahroudi, A., Silvestri, G., Feinberg, M. B. Measuring T cell-mediated cytotoxicity using fluorogenic caspase substrates. Methods. 31, 120-126 (2003).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Review of Vaccines. 9, 601-616 (2010).
- Azimi, M., et al. Identification, isolation, and functional assay of regulatory T Cells. Immunological Investigation. 45, 584-602 (2016).
- Bruger, A. M., et al. How to measure the immunosuppressive activity of MDSC: assays, problems and potential solutions. Cancer Immunology Immunotherapy. , (2018).
- Qian, B., et al. A distinct macrophage population mediates metastatic breast cancer cell extravasation, establishment and growth. PLoS One. 4, e6562(2009).
- Kitamura, T., et al. Monocytes differentiate to immune suppressive precursors of metastasis-associated macrophages in mouse models of metastatic breast cancer. Frontiers in Immunology. 8, 2004(2018).
- Bronte, V., et al. Recommendations for myeloid-derived suppressor cell nomenclature and characterization standards. Nature Communications. 7, 12150(2016).
- Kitamura, T., et al. CCL2-induced chemokine cascade promotes breast cancer metastasis by enhancing retention of metastasis-associated macrophages. Journal of Experimental Medicine. 212, 1043-1059 (2015).
- Ewens, A., Mihich, E., Ehrke, M. J. Distant metastasis from subcutaneously grown E0771 medullary breast adenocarcinoma. AnticancerResearch. 25, 3905-3915 (2005).
- Choppa, P. C., et al. Multiplex PCR for the detection of Mycoplasma fermentans, M. hominisandM. penetransin cell cultures and blood samples of patients with chronic fatigue syndrome. Molecular and Cellular Probes. 12, 301-308 (1998).
- Strober, W. Trypan blue exclusion test of cell viability. Current protocols in immunology. , Appendix 3:Appendix 3B (2001).
- Koyanagi, M., Kawakabe, S., Arimura, Y. A comparative study of colorimetric cell proliferation assays in immune cells. Cytotechnology. 68, 1489-1498 (2016).
- Gabrilovich, D. I., Nagaraj, S. Myeloid-derived-suppressor cells as regulators of the immune system. Nature Reviews in Immunology. 9, 162-174 (2009).
- Cassetta, L., et al. Isolation of mouse and human tumor-associated macrophages. Advances in Experimental Medicine and Biology. 899. 899, 211-229 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten