このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
世代、増幅、および組換え呼吸器合胞体ウイルスの滴定
要約
生成する方法について述べる、RSVs の呼吸器合胞体ウイルス (RSVs) と最適化されたプラクの試金を変更遺伝子を増幅します。RSV レプリケーションの定量化しライブ RSV 封入体と顆粒の封入体のダイナミクスの分析、それぞれ 2 つの組換えウイルスを作成することによってこのプロトコルを示しています。
要約
組換えウイルスの使用は、基礎、応用のウイルス学で非常に重要になっています。逆遺伝学は、ウイルスの複製メカニズムを解読してする研究抗ウイルス薬やワクチンの開発プラットフォームを提供する両方の非常に強力な技術を実証されています。構築とマイナス鎖 RNA ウイルス呼吸器合胞体ウイルス (RSV) などの逆遺伝学的システムの操作ただし、微妙なまま、特別なノウハウが必要です。RSV ゲノム ウイルス RNA 複製と転写の両方のテンプレートとして機能する約 15 kb の一本鎖、否定的な感覚の RNA であります。私たちリバース ・ ジェネティクス システムは、人間の RSV 長い株ゲノム (HRSV) の cDNA コピーを使用します。この cDNA、Cdna 複雑なポリメラーゼのウイルス蛋白質 (L、P、N、および M2 1) と同様は、T7 ポリメラーゼ制御シーケンスの下の個々 の表現のベクトルに配置されます。T7 ポリメラーゼを安定して表現、BSR T7/5 細胞でこれらの要素のトランスフェクションにより細胞質の複製と遺伝子組換えの RSV の転写遺伝子組み換えウイルス粒子に上昇を与えます。ウイルスの増幅の HEp 2 細胞に感染する細胞表面の BSRT7/5 の培養上清中に存在である新しい RSV が収集されます。増幅の 2 つまたは 3 つのラウンドは、1 x 106 1 x 107プラーク形成単位 (PFU) を含むウイルス株を入手する必要が/mL。最適な収穫、凍結、及びウイルス株の滴定の方法は詳細のとおりです。私たちはそれぞれ無料緑色蛍光タンパク質 (GFP) (rs ウイルス ・ GFP) を表現する 2 つの遺伝子組換えウイルスを作成することによってここに示されるプロトコルを説明またはウイルス M2 1 GFP (RSV M2 1 GFP) の融合。RSV のレプリケーションおよびビデオ顕微鏡技術を用いた生細胞におけるウイルス タンパク質ダイナミクスと同様、ウイルスの構造を視覚化する RSV M2 1 GFP を定量化する rs ウイルス ・ GFP を使用する方法を示します。
概要
人間 RSV は、幼児の世界1入院急性上気道感染症の主要な原因です。また、RSV は成人インフルエンザ、ほとんどの入院および死亡率の負担で高齢者2と同等の実質的な疾病に関連付けられます。ないワクチンまたは特定の抗ウイルス薬まだ rsv、しかし、有望な新薬は、開発3,4。複雑さと RSV の乗算の定量化技術の重さは、抗ウイルス剤やワクチンは現在相当な努力にもかかわらずの検索を妨げます。RSV 乗算体外の定量化は一般的に骨の折れる、時間がかかり、高価なメソッドで、顕微鏡、染色、プラーク除去アッセイ、定量的細胞変性効果の解析を中心に構成に基づいてください。逆転写酵素 (qRT)-ポリメラーゼの連鎖反応 (PCR)、酵素抗体アッセイのテスト。変更されたゲノムなどのレポーター遺伝子発現とウイルスは、GFP のコーディング、そのようなスクリーニングに適しています。自動プレート リーダーの使用を組み合わせることで、レポーター遺伝子組換えウイルスの遺伝子を運ぶことができますこれらの試標準化と高スループットのために適して。
RSV はエンベロープ、処理負センス RNA ウイルスPneumoviridae家族、順序モノネガ ウイルス目5のOrthopneumovirus属に属するです。RSV ゲノム リーダーとトレーラーと 10 転写ユニット 11 タンパク質をエンコードと呼ばれる 3' と 5' の四肢の非翻訳領域を含む約 15 kb の一本鎖、否定的な感覚の RNA であります。遺伝子の順序: 3'-NS1、NS2、N、P、M、SH、G、F、M2 (M2 1 そして M2 2 蛋白質のためエンコード)、L-5'。ゲノム RNA はしっかり蛋白テンプレートとして N を使用以上のゲノム RNA によってパッケージ化、ウイルスの RNA 依存した RNA ポリメラーゼ (RdRp) は転写とウイルス RNA の複製になります。ウイルスの酵素はヌクレオチド合成酵素活性をそれ自体運ぶ大きい蛋白質 L から成る、その必須の補酵素 P リン蛋白質およびウイルスの転写として機能する M2 1 蛋白質因子6。感染した細胞は、RSV は封入体 (IBs) と呼ばれる細胞質包有物の形成を誘導します。いくつかモノネガ ウイルス目7,8,9,10の類似した形態の細胞質包有物が観察されています。狂犬病ウイルス、水胞性口炎ウイルス (VSV)、エボラ ウイルス、ibs は、みなすことができる従ってウイルス工場8,9,11,ウイルスの RNA 合成が発生することを示した RSV に関する最近の研究12. ウイルス工場 RNA のウイルスの RNA 合成に必要なウイルス蛋白質の集中、また細胞蛋白質13,14,15,16,を含む17. IBs 展示集中する IB 関連顆粒 (IBAGs) と呼ばれる、機能班、新しく synthetized M2 1 蛋白質と共に新生ウイルス mRNA。ゲノム RNA と L、P、および N は、IBAGs では検出されません。IBAGs は、液体細胞小器官12の性質を示す IBs の中小さな動的球形構造です。ウイルスの増殖に IBs の中心的役割にもかかわらず自然、内部構造、形成、およびこれらのウイルスの工場の操作についてほとんど知られています。
CDNA からポリオ ウイルスのゲノムの発現には、1981年18で最初の感染ウイルスのクローンの生産が可能。一本鎖マイナス RNA ウイルスだった 1994 年まで次のプラスミドのトランスフェクション細胞19に最初の狂犬病ウイルスの生産が行われたこと。最初プラスミドを用いた逆遺伝システム RSV は 1995年20に掲載されました。逆遺伝学ウイルス学の分野に大きな進歩をもたらした。ウイルスのゲノムに特定の変更を導入する可能性は、レプリケーションおよび RNA ウイルスの病因に重要な洞察力を提供しています。この技術も大幅変更の対象となる一連の特定の減衰によりワクチンの開発を促進しています。大きく急速なウイルスの増殖の定量化を許可するゲノムの変更が改善されたは、抗ウイルスのスクリーニングとアクションの彼らのモードの研究.
説明したが微妙なまま遺伝子組み換え RSVs を取得します。ここでは、我々 はそれぞれ表現 RSV GFP や RSV M2 1 GFP 遺伝子組換えの HRSV の 2 種類を作成するためのプロトコルを詳しく説明します。このプロトコルでは高価、再現性のある実験に適したウイルス株を取得する彼らの増幅と同様、新しい遺伝子組換えウイルスを救出するために必要なトランスフェクション条件について述べる。逆遺伝学のベクトルの建設自体がないここで説明します。最適な収穫・ ウイルス株の凍結方法について述べること。ウイルスの感染性粒子を定量化する最も正確な方法のままプラクの試金。細胞分析の懸濁液のシリアル希薄に感染して、培養上清で無料のウイルス粒子の拡散を禁止するオーバーレイを使って。このような条件でセルごとの初期感染粒子の「プラーク」を形成はウイルスに感染のみ。従来の RSV 滴定分析では、プラクは免疫染色によって明らかに、顕微鏡下でカウントします。このメソッドは高価で時間がかかるです。ここで我々 は肉眼に目に見えないプラークの形成を可能にする微結晶性セルロースのオーバーレイを使用して RSV プラクの試金のための非常に単純なプロトコルを説明します。RSV レプリケーションを測定して、したがって、する、RSV GFP を使用する方法を示す抗ウイルス剤の影響を定量化します。逆遺伝学、ライブ イメージング技術を組み合わせて、RSV M2 1 GFP により生細胞における M2 1 を視覚化し、IBs などの細胞内のウイルス構造のダイナミクスに従うの科学者、方法を紹介します。
プロトコル
1 材料の準備
- 携帯メディアを購入 (減らされた血清メディア、最低限不可欠なメディア [MEM]、MEM、およびダルベッコ x 10 のイーグル培地 [DMEM] を更新)、トランスフェクション試薬と微結晶セルロース (材料の表を参照)。
- 次ベクトル逆遺伝学: ゲノムの vector(s) と N 蛋白質およびポリメラーゼ複合タンパク質をエンコード表現のベクトル。ゲノムのベクトルは、バクテリオファージ T7 RNA ポリメラーゼ (T7 pol) プロモーターから完全 cDNA ゲノム RSV GFP (p ・ rs ウイルス ・ GFP) と RSV-M2-1GFP (p-RSV-M2-1GFP) 下流を含まれます。表現のベクトル (p として指定された-N、P、p-L と p-M2-1) T7 ポルには下流の N、P、L、または m 2 1 のコードの配列が含まれて (Rincheval ら12と Rameix ウェルティら21プラスミド コンストラクトの詳細についてを参照してください)。
- 無菌環境での細胞培養とトランスフェクションと感染メディアを準備します。2 mM L-グルタミンを使用 DMEM 補足 10% 牛胎児血清 (FCS)、1,000 単位/ml ペニシリンとストレプトマイシン 1 mg/mL (または抗生物質なし) であり、2 ミリメートル L グルタミンと MEM 0%、2%、または 10 %fcs, 1,000 単位/ml ペニシリン 1 mg/mL と補足ストレプトマイシン、次のプロトコルの「完全な媒体」として指定します。
- BSRT7/522セルを 10% ジメチルスルホキシド (DMSO) 1 ~ 2 x 106セル/mL の完全培の株式を利用しています。液体窒素で細胞株を節約します。HEp 2 セルを取得します。文化 BSRT7/5 セル完全な DMEM に、無菌環境で CO2を 37 ° C、5% で完全な MEM の HEp 2 セル。
- 準備 10 x RSV 保全ソリューション (0.5 M HEPES と 1 M MgSO4 [pH 7.5] 水) 無菌環境で。
- GFP 蛍光測定と互換性があり感染症を監視する必要がある場合、ライブ イメージングと互換性のある倒立蛍光顕微鏡を入手します。RSV GFP レプリケーションでの定量の GFP 蛍光測定と互換性のあるマイクロ プレート リーダーを取得します。
2 救助および組換えウイルスの最初の一節
注:クラス II の安全キャビネットを用いた無菌環境で次のすべての手順を実行します。
- トランスフェクション、前日は完全培地に 5 × 105セル/mL で BSRT7/5 セル行の懸濁液を作る。6 ウェル プレートのウェルあたり細胞懸濁液 2 mL を配布します。ネガティブ コントロールに救出されることを行くウイルスごと 1 つの井戸と 1 つ追加を準備します。37 ° C と 5% の CO2でプレートを孵化させなさい。セルに次の日 80%-90% の合流点であることを確認します。
- 逆遺伝学 (ステップ 1.2) からベクトル p-rs ウイルス ・ GFP および p を解除-RSV-M2-1-GFP、p だけでなく、-N、P、p-L と p-M2-1。ウイルスごとに 1 μ g の p N、P、p の 0.5 μ g を救出するためのミックス-p の 0.25 μ g L-M2-1、および p-RSV (GFP または M2 1 GFP) 管内の 1.25 μ g。
注:N、P、L、および m 2 1 の異なる表現のベクトルを使用可能性があります。ただし、蛋白質間の比率は維持されます。P RSV ベクターを空のベクターに置き換えることによって否定的な制御を行います。 -
トランスフェクション、トランスフェクション試薬製造元のプロトコルを次に進む (材料の表を参照してください)。
- 減らされた血清中の 250 μ L を混合ベクトルに追加します。別の管で希釈減少血清中の 250 μ L のトランスフェクション試薬を 10 μ l 添加します。優しく渦両方チューブ、ミックス両方の内容管、室温で 20 分待って 5 分待ちます。
- 減少血清培地 1 ml BSRT7/5 セルを洗浄し、抗生物質もあたりなし 10 %fcs と MEM の 1.5 mL を配布します。必要に応じて、手順 2.3.1 孵化が完了するまで 37 ° C、5% CO2で孵化させなさい。
- 500 μ L の 20 分インキュベーション時間が終わったらよく 2.3.1 手順で準備トランスフェクション ミックスを追加します。3 日間で 37 ° C、5% CO2インキュベーターにセルを配置します。遺伝子導入中に細胞の培養液を変更しないでください。
- 20 倍の倍率 1 で倒立蛍光顕微鏡下での GFP 蛍光 (488 nm で励起) と 515-535 nm の発光を観察救助の効率を監視する一日あたりの倍、GFP を使用してフィルターを適用します。
- 後 2 日目、救出のウイルスの最初の一節の細胞を播きます。HEp 2 5 x 105セル/mL の完全培地で細胞の懸濁液を準備します。6 ウェル プレート (救助と 1 つの負の制御するウイルスあたり 1 つの井戸) の井戸あたり細胞懸濁液 2 mL を配布します。
- トランスフェクション transfected BSRT7/5 6 ウェル プレートの各ウェルにスクラッチ セルの 3 日目に各ウェルに異なるスクレーパーを使用します。滅菌 2 mL 遠心チューブにそれぞれよくコンテンツ (セルと上清) を転送します。各渦管精力的に少なくとも 30 の細胞膜から救助されたウイルスを解放します。
注:これは救助されたウイルス (図 1) の通過 0 (P0) に対応しています。 -
新鮮なウイルス P0 懸濁液を使用して、救助されたウイルスの最初の増幅を行います。
- HEp 2 6 ウェル プレートから培播種前日に削除 (手順 2.5 参照) ウェルあたり (からステップ 2.6) P0 懸濁液 500 μ L をすぐに追加し、。2 h のソフト撹拌用シーソー ロッカーの 37 ° C で HEp 2 プレートを配置します。
- 削除し、破棄 500 μ L 接種の 2% の FCS と MEM の 2 mL を加えます。3 日間の 37 ° C および 5% の CO2でプレートを孵化させなさい。これは救助されたウイルス (図 1) の最初の一節 (P1) が生成されます。
- (ステップ 2.6) から懸濁液残り P0 に 10 x RSV 保全ソリューション (0.5 M HEPES と 1 M MgSO4 [pH 7.5]) の体積の 1/10 を追加します。渦 5 s と因数は積極的にチューブ極低温の管の内容耐アルコールのタグが付いています。アルコール冷却-80 ° c で少なくとも 1 h 管を浸すし、-80 ° C で保存
- P0 株式を滴定しなさい (手順 2.6 参照) 各救助されたウイルス (結晶セルロース滴定のセクション 4 を参照)。
- 感染症の監視に 1 日あたり 1 x 20 倍の倍率で倒立蛍光顕微鏡下で P0 懸濁液に感染して HEp 2 セルの GFP 蛍光 (488 nm で励起) と 515-535 nm の発光を観察します。小さな両の外観を明視野顕微鏡下で観察して細胞の剥離 RSV した細胞変性効果 (CPE) を反映する (図 2参照)。
- 2-3 日後、蛍光も CPE が表示されて場合に救助が失敗したことに注意してください。
- 日 3 または 4 2.6 の手順で説明されているように最初の一節 (P1) を収集します。簡単に言えば、細胞をこすり、細胞及び上澄み、一緒にサンプル、2.8、分注の手順で説明されているように保全ソリューションを追加し、それを凍結する渦を収集します。
- (滴定試金のためのセクション 4 を参照) を滴定し、最初の一節 (増幅は、セクション 3 を参照してください) を増幅します。
3. 救助されたウイルスの増幅
注:次のプロトコルでは、75 cm2フラスコで救助されたウイルスの増幅について説明します。必要なボリュームにフラスコ サイズと感染症 (MOI) の必要な多様性に適応します。表 1は、異なるフラスコのボリュームを示します。クラス II の安全キャビネットで無菌環境ですべての次の手順を実行します。
- 増幅前日 HEp 2 5 x 105セル/mL の完全培地で細胞の懸濁液を準備します。75 cm2フラスコあたり細胞懸濁液 15 mL を配布し、37 ° C、5% CO2でフラスコを孵化させなさい。増幅するウイルスあたり 1 つのフラスコを準備します。
- 培養開始の翌日は、セルが合流 80-100% であることを確認します。
- MEM 50,000 PFU/mL (0.01 PFU/セルの MOI に対応) の懸濁液 3 mL を取得する FCS なしの 2.12 手順からウイルスの懸濁液を希釈します。
- メディアを削除し、すぐに 3 mL ウイルス懸濁液を追加します。37 ° C 2 時間ソフト撹拌用シーソー ロッカーにフラスコを置きなさい。
- 削除し接種を破棄し、2% の FCS と MEM の 15 mL を追加します。37 ° C と 5% の CO2の 2-4 日間インキュベートします。
- ウイルスを収穫する正しい時を推定するために細胞の形態と 20 倍の倍率で倒立蛍光顕微鏡下での GFP 蛍光 (488 nm で励起) と 515-535 nm の発光を確認します。これは通常 48 および 72 h 感染後 (探偵) 間で発生する RSV CPE のため HEp 2 細胞層の 50-80% をデタッチするときであることに注意してください (図 3参照)。
- 細胞スクレーパーを使用してすべてのセルをこすり。セルと上澄みの両方を一緒に収集し、50 mL の遠心管に転送。
- RSV 保全ソリューション (0.5 M HEPES と 1 M MgSO4 [pH 7.5]) x 10 の量の 1/10 を追加します。渦 5 は積極的にチューブ s 200 x gで 5 分遠心分離によって懸濁液を明らかにします。
- 50 mL のチューブに上清を転送します。渦を簡潔にそして因数クライオ チューブ耐アルコール タグでラベルのサスペンション。少なくとも 1 時間冷却-80 ° C アルコールで管を浸すし、-80 ° C で保存
- 1 つのウイルスの懸濁液 (セクション 4 を参照) を滴定する因数をフリーズ解除します。
4. プラークアッセイ滴定
- 滴定滴定分析を実行する前に日 12 ウェルのプレートを準備 (六つの井戸はウイルスの 1 つの管を滴定する必要があります)。HEp 2 5 x 105セル/mL の完全培地で細胞の 1 mL と井戸をシードします。
-
次の日の準備 (2.4% [w/v] 水) 懸濁液滅菌微結晶セルロース (材料の表を参照してください)。
- 100 mL の蒸留水、粉 (通常 4-12 h) の完全解散まで標準電磁攪拌機を使用しての微結晶セルロース粉末の 2.4 g を分散させます。オートクレーブ 121 ° C、20 分で中断し、使用前に常温で保存します。
注:このような条件の下で、サスペンションは、1 年間安定しました。 - 無菌環境で、ソリューションを開くと後に、、4 ° C で 6 ヶ月間保管ください。常にそれが均一かどうかを確認する (によって手が震えてまたはボルテックス) 使用前に懸濁液をミックスします。
- 100 mL の蒸留水、粉 (通常 4-12 h) の完全解散まで標準電磁攪拌機を使用しての微結晶セルロース粉末の 2.4 g を分散させます。オートクレーブ 121 ° C、20 分で中断し、使用前に常温で保存します。
- 準備、2 x の無菌環境で MEM。商業 MEM 10 を希釈滅菌水で x と L グルタミン、1,000 単位/ml ペニシリンとストレプトマイシン 1 mg/mL 追加。希釈を活発に揺すり、4 ° C で保存
注:クラス II の安全キャビネットを用いた無菌環境で 4.4-4.10 の手順に従います。 - 6 管 900 μ L FCS なし MEM の滴定にウイルス/を含む (滴定管) を準備します。ウイルス因数を解凍 5 s、および最初の滴定へ転送 100 μ L は積極的にそれらの管の渦。
- 10 倍希釈 6 を実行 x、次のようにします。初の管中の 900 μ L にウイルスの 100 μ L、チューブにキャップを置くし、数秒間ボルテックスによってその内容をミックスを追加します。ピペットの先端を変更、最初の希釈の 100 μ L を 2 番目の管中の 900 μ L に追加、管と渦にキャップを置きます。6 管まで手順を繰り返します。
注:各希釈のためのヒントを変更する非常に重要です。 - HEp 2 12 ウェル プレートに名前と倍希釈ウイルスを書きます。(ステップ 4.9) を染色中にそれぞれ分けられる可能性がありますので、プレートとカバーを一致するようにマークを追加します。プレートからメディアを削除し、400 μ L/ウェル 1 希釈を配布します。ウイルス吸着のための 2 h の 37 ° C で版を孵化させなさい。
注:各接種間ピペット チップを変更または最下位から同じチップで最高濃度に進みます。同時に細胞の乾燥を避けるためにプレート (1 に 2) の限られたシリーズを接種します。 -
ウイルス吸着 (その場しのぎの準備) の中に微結晶性セルロースのオーバーレイを準備します。オーバーレイの 100 mL を得るためには、懸濁液 2.4% 微結晶性セルロース、MEM、× 2 の 10 mL と 2% の FCS と MEM の 80 mL の 10 mL を混ぜます。
- 2 の pH 調整次のカラー インジケーターには約 7.2 7.5% 重炭酸ナトリウム滅菌溶液と MEM x。セルロース微結晶懸濁液および MEM を加え、精力的に混ぜます。
- 2 時間培養末接種を削除せず 12 ウェル プレートの各ウェルにオーバーレイの 2 に 3 mL を追加します。ウイルス力価の高い乳酸菌と隣接する井戸の汚染を避けるために注意してください。6 日間の 37 ° C および 5% の CO2でプレートを孵化させなさい。プレートを移動せず、潜伏中にインキュベーターを動かさないでください。
-
クリスタル ・ バイオレット液 (8% クリスタル バイオレット [v]、2% のホルムアルデヒド v/v と 20% エタノール水. [v]) を使用して、セルを染色に進みます。
- バイオ セーフティ キャビネット (クリスタル バイオレットは強く表面色) シートの作業面を保護します。
- 微結晶性セルロース オーバーレイ離陸するプレートを軽く振る。培養上清を取り外して洗浄セル 2 リン酸緩衝生理食塩水 (PBS) x 1 x。細胞の乾燥を避けるためにプレート 1 つずつを処理します。クリスタル バイオレット溶液 1-2 mL を加えて 10-15 分削除その後プレートを汚すため再利用できるソリューションを待ちます。
- 数秒間板と新鮮な漂白剤で蓋を浸すし、水道水で徹底的に洗います。版およびカバーは、漂白剤による浄化に注意してください。
- ペーパー タオルの上プレートと蓋を入れ、乾燥させます。水洗浄後に周囲温度でプレートを乾燥し、室温で保存します。長い保存期間 (ヶ月)、色を守るため、光から保護プレートを保つため。その場合はセルを失う彼らの発色と、汚すことができる再びクリスタル バイオレットによる注意してください。
- ウイルス力価を計算します。肉眼に目に見える乾燥板の井戸の中斑を数えます。異なる希釈率の斑の数がコヒーレント (ファクター 10 各希釈間) であることを確認します。井戸、斑が最も簡単なカウントを選択します。接種量と希釈対斑の数を評価します。
注:図 4に示した例にある上 21 斑が 10-5希釈でカウントされます。これらの抗体に対応します。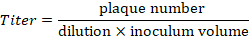
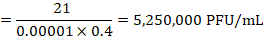
5. 小さい干渉の RNA や抗ウイルス剤で治療細胞におけるウイルス増殖を監視する HRSV GFP 遺伝子組換えウイルスの使用
注:クラス II の安全キャビネットを用いた無菌環境で 5.1 および 5.2.5 を除くすべての手順を実行します。
-
細胞遺伝子サイレンシングの rs ウイルス増殖に対する効果を監視
注: トランスフェクション プロトコルによって異なります試薬 (材料の表を参照してください)。- GFP 測定の 96 ウェルのプレートを準備します。2 日前に、試金小さい干渉の RNA (siRNA) 与えられた 100 の濃度で siRNA を含む減少血清メディアのソリューションを準備 nM と 1/500 希釈 siRNA トランスフェクション試薬。室温で 30 分のためのソリューションを孵化させなさい。
- 5.1.1 (3 通) での準備板の井戸にソリューションの 25 μ L を追加します。シード 4 x 105セル/mL の完全培地 3 × 105セル/mL の濃度が最後のセルを抗生物質なしで A549 細胞の懸濁液の 75 μ L で井戸。37 ° C、5% CO2で 48 時間プレートを孵化させなさい。
注:最終的な siRNA 濃度が 25 nM と最終的なトランスフェクション試薬量が 0.5 μ L/ウェル)。 - とおり、細胞に感染します。井戸からメディアを削除します。50,000 Pfu/ml RSV GFP 懸濁液 100 μ L を追加し、37 ° C、5% CO2で 2 時間インキュベートします。ウイルスの懸濁液を削除し、2% の FCS とフェノールレッド DMEM を 100 μ l 添加します。37 ° C と 5% の CO2でプレートを孵化させなさい。
- 24 時間と 48 時間の探偵、蛍光測定、それぞれ 488、520 nm の励起・発光波長に設定、蛍光を使用して (蛍光は相対的な蛍光単位で表される)。蛍光とバック グラウンド レベルの基準としていない A549 細胞を使用します。
注:セルは、プレート カバーなしそれらを計測する前に 4% パラホルムアルデヒド (PFA) を修正する必要があります。
-
RSV GFP を用いた薬物抑制の評価
- GFP 測定の 96 ウェルのプレートを準備します。アッセイ、前日はシード フェノールレッドなし完全培地に 5 × 105セル/ml で HEp 2 細胞の懸濁液を 100 μ l 添加の井戸です。
- 準備テストの連続希釈薬剤のほか、2% の FCS と抗生物質 (50 μ L/ウェル) MEM (この例では AZ4316)。間質血管因子 (SVF) とフェノール レッド (50 μ L/ウェル) なしウイルス サスペンションで MEM で 10,000 PFU/mL を準備します。
- 96 ウェルの HEp 2 からメディアを取り出してプレートし、薬剤の懸濁液を 50 μ l 添加し (3 通) にウイルス懸濁液 50 μ L を追加。コントロールとして模擬感染を並列に実行します。
注:薬剤希釈しウイルスの懸濁液を細胞にそれらを追加する前に混合する可能性があります。 または順番に追加できます。 - 37 ° C、5% CO2で 48 時間プレートを孵化させなさい。
- 5.1.4 の手順で説明するように、蛍光を使用して蛍光を測定します。蛍光バック グラウンド レベルの基準として模擬感染 HEp 2 セルを使用します。
6. RSV M2 1 GFP 遺伝子組換えウイルスと生体内における M2 1 局在化の特性
注:クラス II の安全キャビネットを用いた無菌環境で 6.1 と 6.2 の手順に従います。
- HEp 2 5 x 105セル/mL の完全培地で細胞の懸濁液を準備します。種 35 mm ペトリ皿を CO2側の透過物とバリアフリーの細胞懸濁液 1.5 mL のライブ イメージング。
- 3.3-3.5 の手順の説明に従って感染 MOI 1 で RSV M2 1 GFP ウイルスに播種後日を実行 (メディアを取り出して、菌の 1 mL を 500 μ L を追加し 2 時間ゆっくり振りながら 37 ° C でサンプルをインキュベート; 削除接種および 2 と MEM の 1.5 mL を追加%FCS)。37 ° C と 5% の CO2のセル (IBs は 10 h 探偵から表示されるように開始されます) 希望の時間孵化させなさい。
- ステージ上の感染した細胞を含むペトリ皿を配置する前に、37 ° C で 100 x 目標 40 x を搭載した倒立顕微鏡の孵化室を予熱します。CO2供給を開き、フォーカスの安定化を待ちます。
- 光毒性を最小限にする (1 分あたり 0.1 イメージ) から低励起強度およびイメージ周波数の下での GFP と互換性のあるフィルターとイメージングを実行します。
結果
この作品では、(図 2) の蛍光蛋白を発現する組換えの RSV ウイルスを生成する詳細なプロトコルについて説明しました。PRSV GFP、GFP 遺伝子は前述の過去に発表された21の桜遺伝子の P および M 遺伝子の間導入されました。PRSV-M2-1-GFP で M2 遺伝子は手つかずに残されたし、SH G 遺伝子12間挿入された M2 1 GFP の追加?...
ディスカッション
ここで 5 つのプラスミドから組換え RSVs の救助の方法とその増幅を提案します。ウイルスのゲノムを操作する機能の突然変異をテストし、追加の遺伝子やタグ ウイルスの蛋白質を表現するウイルス学革命をもたらしました。RSV について説明し、この記事の例はレポーターの遺伝子、RSV GFP (未発表)、M2 1 タンパク質 GFP タグ12融合した表現を発現するウイルスとして使用しま?...
開示事項
著者が明らかに何もありません。
謝辞
著者は、AZD4316 医薬品を提供するためアストラゼネカ ・ R & D ボストン、マサチューセッツ州、米国から博士秦湯に感謝します。著者、Cymages プラットフォームを ScanR オリンパス顕微鏡へのアクセスに感謝してこれに支えられ地域イル (薄暗い 1 つ健康) から助成金します。著者は、INSERM とベルサイユ サンカンタンにある大学からのサポートを認めます。
資料
| Name | Company | Catalog Number | Comments |
| 35 mm µ dish for live cell imaging | Ibidi | 81156 | |
| A549 | ATCC | ATCC CCL-185 | |
| Avicel RC-591 | FMC BioPolymer | Avicel RC-591 | Technical and other information on Avicels is available at http://www.fmcbiopolymer.com. Store at room temperature. Protocol in step 4 is optimized for this reagent. |
| BSRT7/5 | not commercially available | See reference 22. Buchholz et al. 1999 | |
| Crystal violet solution | Sigma | HT90132 | |
| Fluorescence microscope for observations | Olympus | IX73 Olympus microscope | |
| Fluorescence microscope for videomicroscopy | Olympus | ScanR Olympus microscope | |
| HEp-2 | ATCC | ATCC CCL-23 | |
| HEPES ≥99.5% | Sigma | H3375 | |
| L-Glutamine (200 mM) | ThermoFisher Scientific | 25030024 | |
| LIPOFECTAMINE 2000 REAGENT | ThermoFisher Scientific | 11668019 | Protocol in step 2.3. is optimized for this reagent. |
| MEM (10x), no glutamine | ThermoFisher Scientific | 11430030 | |
| MEM, GlutaMAX Supplement | ThermoFisher Scientific | 41090-028 | |
| MgSO4 ReagentPlus, ≥99.5% | Sigma | M7506 | |
| Opti-MEM I Reduced Serum Medium | ThermoFisher Scientific | 51985-026 | |
| Paraformaldehyde Aqueous Solution, 32%, EM Grade | Electron Microscopy Sciences | 15714 | |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140122 | |
| Plasmids | not commercially available | See reference 21. Rameix-Welti et al. 2014 | |
| See Saw Rocker | VWR | 444-0341 | |
| Si RNA GAPDH | Dharmacon | ON-TARGETplus siRNA D-001810-10-05 | SMARTpool and 3 of 4 individual siRNAs designed by Dharmacon. |
| Si RNA IMPDH2 | Dharmacon | ON-TARGETplus siRNA IMPDH2 Pool- Human L-004330-00-0005 | SMARTpool of 4 individual siRNAs designed by Dharmacon. Individual references and sequences J-004330-06: GGAAAGUUGCCCAUUGUAA; J-004330-07: GCACGGCGCUUUGGUGUUC; J-004330-08: AAGGGUCAAUCCACAAAUU; J-004330-09: GGUAUGGGUUCUCUCGAUG; |
| Si RNA RSV N | Dharmacon | ON-TARGETplus custom siRNA | UUCAGAAGAACUAGAGGCUAU and UUUCAUAAAUUCACUGGGUUA |
| SiRNA NT | Dharmacon | ON-TARGETplus Non-targeting Pool | |
| SiRNA transfection reagent | Dharmacon | DharmaFECT 1 Ref: T-2001-03 | Protocol in steps 5.1.and 5.1.2 are optimized for this reagent. |
| Sodium Bicarbonate 7.5% solution | ThermoFisher Scientific | 25080094 | |
| Spectrofluorometer | Tecan | Tecan infinite M200PRO |
参考文献
- Shi, T., et al. Global, regional, and national disease burden estimates of acute lower respiratory infections due to respiratory syncytial virus in young children in 2015: a systematic review and modelling study. The Lancet. 390 (10098), 946-958 (2017).
- Falsey, A. R., Hennessey, P. A., Formica, M. A., Cox, C., Walsh, E. E. Respiratory Syncytial Virus Infection in Elderly and High-Risk Adults. The New England Journal of Medicine. 352 (17), 1749-1759 (2005).
- DeVincenzo, J. P., et al. Activity of Oral ALS-008176 in a Respiratory Syncytial Virus Challenge Study. The New England Journal of Medicine. 373 (21), 2048-2058 (2015).
- DeVincenzo, J. P., et al. Oral GS-5806 Activity in a Respiratory Syncytial Virus Challenge Study. The New England Journal of Medicine. 371 (8), 711-722 (2014).
- Afonso, C. L., et al. Taxonomy of the order Mononegavirales: update 2016. Archives of Virology. 161 (8), 2351-2360 (2016).
- Collins, P. L., Hill, M. G., Cristina, J., Grosfeld, H. Transcription elongation factor of respiratory syncytial virus, a nonsegmented negative-strand RNA virus. Proceedings of the National Academy of Sciences of the United States of America. 93 (1), 81-85 (1996).
- Hoenen, T., et al. Inclusion bodies are a site of ebolavirus replication. Journal of Virology. 86 (21), 11779-11788 (2012).
- Heinrich, B. S., Cureton, D. K., Rahmeh, A. A., Whelan, S. P. Protein expression redirects vesicular stomatitis virus RNA synthesis to cytoplasmic inclusions. PLoS Pathogens. 6 (6), e1000958 (2010).
- Lahaye, X., et al. Functional Characterization of Negri Bodies (NBs) in Rabies Virus-Infected Cells: Evidence that NBs Are Sites of Viral Transcription and Replication. Journal of Virology. 83 (16), 7948-7958 (2009).
- Kolesnikova, L., Mühlberger, E., Ryabchikova, E., Becker, S. Ultrastructural organization of recombinant Marburg virus nucleoprotein: comparison with Marburg virus inclusions. Journal of Virology. 74 (8), 3899-3904 (2000).
- Dolnik, O., Stevermann, L., Kolesnikova, L., Becker, S. Marburg virus inclusions: A virus-induced microcompartment and interface to multivesicular bodies and the late endosomal compartment. European Journal of Cell Biology. 94 (7-9), 323-331 (2015).
- Rincheval, V., et al. Functional organization of cytoplasmic inclusion bodies in cells infected by respiratory syncytial virus. Nature Communications. 8 (1), 563 (2017).
- Santangelo, P. J., Bao, G. Dynamics of filamentous viral RNPs prior to egress. Nucleic Acids Research. 35 (11), 3602-3611 (2007).
- Lifland, A. W., et al. Human Respiratory Syncytial Virus Nucleoprotein and Inclusion Bodies Antagonize the Innate Immune Response Mediated by MDA5 and MAVS. Journal of Virology. 86 (15), 8245-8258 (2012).
- Garcia, J., Garcia-Barreno, B., Vivo, A., Melero, J. A. Cytoplasmic inclusions of respiratory syncytial virus-infected cells: formation of inclusion bodies in transfected cells that coexpress the nucleoprotein, the phosphoprotein, and the 22K protein. Virology. 195 (1), 243-247 (1993).
- Brown, G., et al. Evidence for an association between heat shock protein 70 and the respiratory syncytial virus polymerase complex within lipid-raft membranes during virus infection. Virology. 338 (1), 69-80 (2005).
- Radhakrishnan, A., et al. Protein analysis of purified respiratory syncytial virus particles reveals an important role for heat shock protein 90 in virus particle assembly. Molecular & Cellular Proteomics. 9 (9), 1829-1848 (2010).
- Racaniello, V. R., Baltimore, D. Cloned poliovirus complementary DNA is infectious in mammalian cells. Science. 214 (4523), 916-919 (1981).
- Schnell, M. J., Mebatsion, T., Conzelmann, K. K. Infectious rabies viruses from cloned cDNA. The EMBO Journal. 13 (18), 4195-4203 (1994).
- Collins, P. L., et al. Production of infectious human respiratory syncytial virus from cloned cDNA confirms an essential role for the transcription elongation factor from the 5' proximal open reading frame of the M2 mRNA in gene expression and provides a capability for vaccine. Proceedings of the National Academy of Sciences of the United States of America. 92 (25), 11563-11567 (1995).
- Rameix-Welti, M. -. A., et al. Visualizing the replication of respiratory syncytial virus in cells and in living mice. Nature Communications. 5, 5104 (2014).
- Buchholz, U. J., Finke, S., Conzelmann, K. K. Generation of bovine respiratory syncytial virus (BRSV) from cDNA: BRSV NS2 is not essential for virus replication in tissue culture, and the human RSV leader region acts as a functional BRSV genome promoter. Journal of Virology. 73 (1), 251-259 (1999).
- Cianci, C., Meanwell, N., Krystal, M. Antiviral activity and molecular mechanism of an orally active respiratory syncytial virus fusion inhibitor. Journal of Antimicrobial Chemotherapy. 55 (3), 289-292 (2005).
- Derscheid, R. J., et al. Human respiratory syncytial virus memphis 37 grown in HEp-2 cells causes more severe disease in lambs than virus grown in vero cells. Viruses. 5 (11), 2881-2897 (2013).
- McKimm-Breschkin, J. L. A simplified plaque assay for respiratory syncytial virus - direct visualization of plaques without immunostaining. Journal of Virological Methods. 120, 113-117 (2004).
- Matrosovich, M., Matrosovich, T., Garten, W., Klenk, D. New low-viscosity overlay medium for viral plaque assays. Virology Journal. 7, 1-7 (2006).
- Novina, C. D., Sharp, P. A. The RNAi revolution. Nature. 430 (6996), 161-164 (2004).
- Sintchak, M. D., Nimmesgern, E. The structure of inosine 5'-monophosphate dehydrogenase and the design of novel inhibitors. Immunopharmacology. 47 (2-3), 163-184 (2000).
- Beaucourt, S., Vignuzzi, M. Ribavirin: A drug active against many viruses with multiple effects on virus replication and propagation. Molecular basis of ribavirin resistance. Current Opinion in Virology. 8, 10-15 (2014).
- Hruska, J. F., Bernstein, J. M., Douglas, R. G., Hall, C. B. Effects of Ribavirin on Respiratory Syncytial Virus in vitro. Antimicrobial Agents and Chemotherapy. 17 (5), 770-775 (1980).
- Simões, E. A. F., et al. Past, Present and Future Approaches to the Prevention and Treatment of Respiratory Syncytial Virus Infection in Children. Infectious Diseases and Therapy. 7 (1), 87-120 (2018).
- Alvarez, R., et al. RNA interference-mediated silencing of the respiratory syncytial virus nucleocapsid defines a potent antiviral strategy. Antimicrobial Agents and Chemotherapy. 53 (9), 3952-3962 (2009).
- DeVincenzo, J., et al. A randomized, double-blind, placebo-comtrolled study of an RNAi-based therapy directed against respiratory syncytial virus. Proceedings of the National Academy of Sciences of the United States of America. 107 (19), 8800-8805 (2010).
- Zhou, Y., et al. High-throughput screening of a CRISPR/Cas9 library for functional genomics in human cells. Nature. 509 (7501), 487-491 (2014).
- Nikolic, J., et al. Negri bodies are viral factories with properties of liquid organelles. Nature Communications. 8 (1), 58 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved