このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ポリマードロップレット生成装置によるメチル化特異的多重ドロップレットPCR
要約
エピジェネティックマーカーは、DNAメチル化パターンの定量化を通じて白血球(WBC)のサブタイピングに使用されます。このプロトコルは、熱可塑性エラストマー(TPE)ベースのマイクロ流体デバイスを使用した多重液滴ポリメラーゼ連鎖反応(mdPCR)法を提示し、WBC差動度数の正確かつ多重化メチル化特異的ターゲット定量を可能にする液滴生成を行う。
要約
多重液滴PCR(mdPCR)ワークフローとエピジェネティックベースの白血球(WBC)微分カウントを決定するための詳細なプロトコルが、熱可塑性エラストマー(TPE)マイクロ流体液滴生成装置と共に記載されている。エピジェネティックマーカーは、異なる疾患における重要な予後値であるWBCサブタイピングに使用されます。これは、ゲノム中の特定のCGリッチ領域(CpG loci)のDNAメチル化パターンの定量化を通じて達成される。本論文では、末梢血単核細胞(PBMCs)の亜硫酸水素塩処理DNAを、WBC亜集団と相関するCpG遺伝子座に特異的なプライマーおよび加水分解蛍光プローブを含むmdPCR試薬を用いて液滴に封入する。マルチプレックスアプローチは、別々のmdPCR反応を必要とせずに多くのCpG遺伝子座の尋問を可能にし、メチル化部位のエピジェネティック解析を用いたWBC亜集団のより正確なパラメトリック決定を可能にする。この精密な定量はさまざまな適用に拡張することができ、臨床診断とその後の予後のための利点を強調する。
概要
白血球(WbCs)組成物の分析は、血液学的診断において最も頻繁に要求される検査検査の一つです。▲微分白血球数は、感染症、炎症、貧血、白血病などの疾患のスペクトルの指標として機能し、他のいくつかの条件の初期予後バイオマーカーとして調査中である。WBCサブタイピングにおけるゴールドスタンダードは、高価で不安定な蛍光抗体を必要とする免疫染色および/またはフローサイトメトリーを含み、サンプル調製におけるオペレータの熟練度に大きく依存することが多い。さらに、この方法は、出荷または後の分析のためにサンプルを凍結することができないような新鮮な血液サンプルにのみ適用されます。
エピジェネティックマーカーは、表現型のバリエーションの研究のための強力な分析ツールとして最近登場しています。その後、ヒト白血球集団は、WBCサブセットの正確な特徴付けを可能にする細胞系DNAメチル化パターンを有することが示されている。エピジェネティックマーカーに基づくサブタイプは、新鮮な血液サンプル採取や高価な抗体に依存せず、疾患発症および感受性11、2、3、4、52,のバイオマーカーとして利用できる有望な代替手段を提供する。3,4,5
ゲノムワイド研究は、白血球サブタイプにおけるゲノム(CpG島)におけるメチル化された特定のCGリッチ領域の広範なマッピングに対して行われ、白血球サブタイプに特異的なエピジェネティックマーカー候補を同定する。PCRプロトコルは、メチル化遺伝子領域、例えばCD3ZおよびFOXP3、CD3+T細胞およびCD4+CD25+調節性T細胞(T-Regs)+にそれぞれ対応する理由から開発された。Wienckeらは、T細胞のエピジェネティックサブタイピングに対する二重液滴PCRの有用性を実証し、フロー活性化細胞選別(FACS)解析6と高い相関を持つ結果を生じる。この定量的遺伝子解析法は、鋳型核酸分子およびPCR試薬を、マイクロ流体によって可能,な油中水乳液を用いて、ゼロ、1つ以上の標的核酸コピーを含む数千個の離散、体積的に定義されたサブナノリットルサイズの液滴に分割することに依存している。PCR増幅は、個々の液滴内で行われ、各液滴のエンドポイント蛍光強度が測定され、サンプル中に存在する標的の絶対定量が可能となる。液滴PCRは、標準のqPCRよりも正確で正確で技術的に簡単なように確立されており、T細胞の臨床評価に適したDNAメチル化ベースの方法となっています。急速に出現するサブタイピング方法論であるものの、様々なメチル化CpG領域を同時に探査するエピジェネティック解析の多重化は欠けている。これは、定期的な白血球の差動度数に必要です。
本明細書において、熱可塑性エラストマー(TPE)液滴微小流体装置が提示され、メチル化特異的多重液滴PCR(mdPCR)に用いられた。この技術は、細胞系DNAメチル化パターン、すなわちCD3ZおよびFOXP3 CpG領域のエピジェネティック変異に基づいて、特定の白血球サブタイプ、CD3+T細胞およびCD4+CD25+T-Regsをそれぞれ説明するために使用されてきた。+ +DNA抽出、亜硫酸水素変換およびmdPCRのための詳細なプロトコルは、TPE液滴生成装置の製造方法と協調して説明される。この方法の代表的な結果は、提案されたアプローチの有用性を強調する免疫蛍光染色のものと比較される。
プロトコル
ヒトサンプルを含むこの研究で行われたすべての実験は、NRCの倫理委員会によって承認され、適用される研究ガイドラインに従い、カナダのケベック州の法律に準拠している人間の被験者を支配するNRCの方針に従って行われました。
1. 細胞の調製
- 凍結したヒト末梢血単核細胞(PBMC)を、凍結した凍結した血液単核細胞(PBMC)を、水浴中に凍結槽を5分間37°Cで置いてすぐに解凍する。
- 細胞を穏やかに再懸濁し、1 mLピペットを使用して細胞懸濁液を15 mL円錐形チューブに移すために、2回クライオビアルを反転させます。
- PBMCsを含む15mLチューブに10%のウシ血清(RPMI-1640 +10%FBS)を添加した10mLの事前温めた(37°C)成長培地を加えます。
- 急速加速で10分間、高いブレーキで330×gの速度で室温で振るバケット遠心分離g機でセルサスペンションを遠心分離します。
- スピンが終わったら、上清を慎重にデカントします。リン酸緩衝生理食塩水(PBS)pH 7.2の3mLで細胞ペレットを再懸濁し、チューブの側面をタップして2mMエチレンジアミネトラ酢酸(EDTA)を含む。
- キャップをしっかりと閉じた状態でチューブを反転して細胞を混ぜます。
- 2つの1.5 mLマイクロチューブを調製し、各チューブに1.5mLの細胞懸濁液のピペットアリコートを使用し、そのうちの1つは後続の免疫蛍光染色に使用され、もう1つはDNA抽出に使用されます。
2. 免疫蛍光染色・イメージングプロトコル
- 0.1%のアジドナトリウムと2%FBSを含むPBSバッファーの200 μLで細胞を再懸濁し、細胞懸濁液の最終濃度を最大2 x 107細胞 /mLに調整します。
- 100 μLの体積を2つの別々の1.5 mLマイクロチューブにピペット処理して、細胞懸濁液を分割します。
- フルオレセイン・イソチオシアネート(FITC)とフィコエリスリン(PE)と共役した抗Hu CD3/CD4の20μLの体積を1つのチューブに加え、FITCとPEと共役した抗Hu CD4/CD25( 材料表を参照)を2番目のチューブに加えます。
- 各チューブに青色蛍光生細胞染色( 材料表を参照)を1滴加えます。
- チューブ回転器を2時間使用して室温でインキュベートする。光から守る。
- 急速加速と高いブレーキで10分間、室温でセルサスペンションを10分間遠心します。
- 上清をデカントし、チューブをタップして細胞ペレットを慎重に再懸濁します。2 mM EDTA を含む PBS、pH 7.2 を 1 mL 追加します。キャップがしっかりと閉じられていることを確認し、チューブ2xを反転させることによって細胞を混合する。
- 手順 2.6 と 2.7 を 3 回繰り返します。
- 2 mM EDTAを含む20 μLのPBS pH 7.2で細胞を再懸濁する。
- ピペット10μLの細胞懸濁液をホウケイ酸顕微鏡スライドに落とし、細胞が滴下までゆっくりと沈降するまで2分待ちます。
- 顕微鏡スライドの上にガラスカバースリップを慎重に置き、反転した顕微鏡のステージにスライドを置きます。
- 両方の細胞懸濁液サンプルのフルオロフォアごとに、10倍の目的とEMCCDカメラを使用して、細胞の画像を記録します。
- 蛍光標識された細胞を手動でカウントします(生データの 補足情報 を参照)。
- DAPI染色細胞に対する抗胡CD3および抗Hu CD4/CD25標識細胞の比率をとり、CD3+T細胞およびCD4+CD25+T-Regsの比率を+全白血球細胞に求める。
3. DNA抽出と亜硫酸塩変換
- DNA抽出
注: 第 1 項で作成した PBMC から、磁性 DNA 精製キット ( 材料表を参照) を使用して、製造者が提供する手順に従って DNA を抽出します。- 1.5 mLチューブでは、PBSの100 μLで細胞を懸濁し、20 μLのプロテイナーゼKと400 μLのリシス/結合バッファーを追加します。10倍のアップをピペットで混ぜ、室温で5分間インキュベーションを行います。
- チューブを磁気ラックに1〜2分間置き、上澄み剤を慎重に取り出して捨てて、DNAビーズ複合体を捕獲します。
- DNAビーズ複合体を含むチューブを磁気ラックから取り出し、600 μLのウォッシュバッファ#1でビーズを再中断して、非特異的な結合を洗い流します。
- チューブを磁気ラックに再度置き、上清を慎重に取り外して捨てます。
- 600 μL のウォッシュバッファ #2で、ステップ 3.1.3 と 3.1.4 を繰り返します。
- チューブを1分間空乾燥したままにします。
- 磁性ラックからチューブを取り出し、100 μLの溶出バッファーを分配し、DNA/ビーズ複合体を上下に20倍にピペット処理してDNAを溶出します。
- 溶出したDNAを含むチューブを再び磁気ラックに置き、1〜2分間インキュベートして、溶出したDNAから磁気ビーズを分離します。
- 溶出精製されたDNA溶液を新しいクリーンチューブに移します。
- 分光光度計を用いて260nmの吸光度を測定して、精製されたDNAサンプルの濃度を評価する。
- バイサルファイト変換
注:製造業者が提供する手順に従って、メチル化キット( 材料表を参照)を使用して精製されたDNAに対してバイサルファイト変換を行います。- PCRチューブ中のDNAサンプル(200~500 ng)を20μLに、130μLの変換試薬を加えます。よく混ぜて、簡単にスピンダウンします。
- PCRチューブをサーマルサイクラーに移し、サイクリングプロトコルを実行します: 98 °C 8分間;54°Cで60分間、4°Cで保持します。
- 結合バッファーの 600 μL を、コレクションチューブに配置されたイオンクロマトグラフィー (IC) カラムに追加します。
- 結合バッファーを含む IC カラムに DNA サンプルを加え、チューブを数回反転して混合します。全速力で30sの遠心分離機。収集したフロースルーを破棄します。
- このコラムに、100 μL のウォッシュバッファを追加します。ステップ 3.2.4 で説明したように遠心分離を行い、フロースルーを破棄します。
- 200 μlの脱スルバッファーを加え、室温で15~20分間インキュベーションを行います。遠心分離機と上記の手順で説明したようにフロースルーを破棄します。
- 200 μL のウォッシュバッファーをカラムに追加します。30 sの全速速度で遠心分離機し、流れスルーを捨てます。
- ステップ 3.2.7 を繰り返します。
- カラムを新しい1.5 mLのコレクションチューブに移し、カラムの膜に100 μLのPCRグレードの水を加えます。DNAを溶出するために1分間全速力で遠心分離機。
- 分光光度計を用いて260nmの吸光度を測定することにより、二亜硫酸塩変換DNAサンプルの濃度を評価します。
メモ:260 nm = 1.0の吸光度には40 μg/mLの値を使用してください。 - DNAは、長期保存のために-20°C、長期保存のために-70°Cで保存します。
4. 液滴生成装置の製造
メモ: 液滴生成に使用されるマイクロ流体デバイス( 補足情報に記載されているCADファイル)は、次のプロトコルで生成された熱エンボスを使用して、熱可塑性エラストマー( 材料表を参照)のクリーンルーム(クラス1,000)環境で製造されました。
- SU-8金型製作
- 以下に詳述する標準的なフォトリソグラフィを使用して、6インチシリコンウエハでSU-8金型を準備します。
- 500 W の酸素プラズマを使用して 6 インチシリコンウエハーを 10 s 洗浄します。
- スピンコートSU-8は、40sの900 rpmでシリコンウエハに抵抗し、全膜厚100μmを達成します。
- ウエハーをホットプレートに置き、65°Cで15分間予焼し、続いて95°Cで2時間焼きます。
- 1,000 mJ/cm2の露光線量を用いて高精細透過光マスクを介して365nm(Hg i線2)でUV光に曝露する。
- ウエハースをホットプレートに置き、65°Cで15分間ポストベークし、続いて95°Cで40分焼きます。
- プロピレングリコールモノメチルエーテルアセテート(PGMEA)を5分間浸漬して開発。
- PGMEAとイソプロパノールでリンスし、窒素ガスの流れで乾燥させます。
- ウエハーをホットプレートに置き、135°Cで2時間ハードベークします。
- シラナイジング剤(トリクロロペルフルオロオクチルシラン)を2時間隣接するガラス顕微鏡スライド上に置いた一滴のシラナイズ剤を含む真空デシケータ内のウエハをシラナイズする。
注: これは、S-8 マスターの表面にシランが単層を形成するために行われます。トリコロペルフルオロオクチルシランは、常に煙のフードで処理し、水源から遠ざける必要があります。
- ポリジメチルシロキサン(PDMS)レプリカ
- プラスチックカップ中の硬化剤に対するエラストマーベースの10:1比でPDMSの液体プレポリマー( 材料表を参照)を調製します。
- カップを惑星遠心式真空ミキサーに入れ、PDMS混合物を混合して脱気します。
- PDMS混合物をカスタムメタルホルダーに入れた金型に注ぎ、樹脂の漏れを防ぎ、65°Cで2時間硬化します。
- ピンセットを使用して、SU-8マスターからPDMS金型を慎重に剥がします。
- エポキシモールド
メモ:エポキシモールドは、PDMSとの中間複製プロセスを使用してSU-8/シリコンマスターから製造されました。- エポキシ樹脂( 材料表参照)を樹脂/硬化剤の100/83 w/w比で調製します。
- 30分間真空乾燥オーブンを使用して減圧下で混合物を脱気する。
- PDMSレプリカの上に樹脂を注ぎ、80°Cで12時間硬化します。
- PDMSレプリカから硬化したエポキシモールドを取り出し、ホットプレートに置き、120°Cで2時間ハードベークします。
- TPE デバイス
- TPEの押し出しペレット( 材料表を参照)は、厚さ2.0mm、長さ7インチの幅シートで165°Cで、将来の使用のためにロールとして保管してください。
- はさみを使用してロールからTPEシートを7"正方形に切ります。
- エポキシモールドと非パターン化されたシリコンウェーハの間にTPEシートを配置します(ウエハシラ化手順についてはステップ4.1.10を参照)。
- 125 °Cの温度でホットエンボス加工、10 kNの加圧、10分の10-2 mbarの圧力を行います。
- メタノールスプレーを使用して室温で慎重にデモルドし、エンボス加工されたTPEをシリコンウエハとエポキシモールドから分離します。
- TPEの別の7"平方シートをカットし、2つの非パターンのシラナイズシリコンウエハースの間に置きます。
- 140 °Cの温度でホットエンボス加工、10 kNの加圧、10分間の10-2 mbarの圧力を行い、チャネルを閉じてデバイスを密閉するための平面を形成します。
- メタノールスプレーを使用して室温で慎重にデボルドし、エンボス加工されたTPEを2つのシリコンウェーハから分離します。
- エンボス加工されたTPEシートを、医師のブレードを使用してデバイスサイズに切ります。
- プランジャー付きの1mm生検パンチ針を使用して、構造化デバイスの入口および出口チャネルのアクセスホールをパンチします。
- 平坦な TPE デバイスを室温でチャネルに直接接触させることにより、チャネルを囲みます。
- 必要に応じて、デバイスの結合を促進するために2時間70°Cでオーブンに入れます。
- 使い捨て可能な流体チューブ(I.D. 0.25 mm、O.D. 0.8 mm)でアクセスホールをフィットさせます。エポキシ接着剤を使用してジョイントをシールし、漏れ防止操作を確実にします。
5. 液滴の生成とPCR
注: 表1 は、脱メチル化遺伝子標的の多重増幅に必要なC-LESS、CD3ZおよびFoxp3遺伝子の二重急行加水分解プローブと共に、前方および逆プライマーに関する情報を概説する。
- 表 2に示すように、マスター ミックスを準備します。
- 酵素ミックスを除くマスターミックスのすべての成分を解凍します。アップダウンしてマスターミックスを完全に混ぜ、短くスピンダウンします。
- PCRチューブに適切な量(1μL)のバイサルファイト変換DNA(セクション3.2から)を加えて、マスターミックスを加えます。アップダウンして反応を混ぜ、短時間スピンダウンします。
- 使い捨て可能な流体チューブ(I.D. 0.25 mm、O.D. 1.6 mm)を、PEEKの継手を使用して2つの精密ガラスシリンジ(250 μL体積)に接続します。
- 5%フルオロ界面活性剤を含むキャリアオイルの250 μLで1精密ガラスシリンジをプレフィル。
- 別の精密ガラスシリンジに50 μLのキャリアオイルをプレフィルしてから、100 μLのPCRミックスをロードして、乳化中のサンプル体積全体の分配を確実にします。
- 高速カメラを搭載した直立型光学顕微鏡のステージに液滴マイクロ流体装置を設置し、リアルタイムで液滴形成を観察し記録します。
- 事前充填されたシリンジをプログラム可能なシリンジポンプに置き、PEEKユニオンを継ぎ手と一緒に使用し( 材料表を参照)、注射器のチューブを液滴マイクロ流体デバイスのそれぞれの入口チャネルのチューブに接続します。
- 液滴発生器の出口からチューブを0.5 mLのPCRチューブの内部に入れる。
- シリンジポンプの流量を2μL/minに調整し、液滴サイズが安定してからエマルジョンを収集します。
- エマルジョンを収集し、75 μLを0.2 mLのPCRチューブに移してサーマルサイクリングを行います。
- PCRチューブ内の油分が、熱サイクル中の液滴の合体を防ぐために、分散相の体積と密接に一致することを確認します。
- 0.2 mL PCRチューブをサーマルサイクラーに入れ、サイクリングプロトコルを実行します:95°Cで5分間予熱し、95°Cで45サイクルの変性を15s、60°Cで30sのアニーリング/延長を行います。
- 残りのエマルジョンを使用して、ボロケイ酸キャピラリーチューブ(深さ100μm)を矩形プロファイルで満たし、液滴を画像化し、液滴径を評価します。
- エマルジョンを充填したホウケイ酸チューブを顕微鏡スライドに置きます。EMCCDカメラと10倍の目的を搭載した反転顕微鏡を使用して、液滴の明るいフィールド画像を記録します。
- 以下の説明に従って、画像解析ソフトウェアを使用して液滴径を測定します。
- [分析] ボタンを選択し、[スケールを設定] を選択して、画像のピクセル数に対応する既知の距離のスケールをミクロン単位で設定します。
- イメージをグレースケールに変換するには、[イメージ] ボタンをクリックし、 'と入力します。必要に応じて明るさとコントラストを調整します。[イメージ] ボタンを選択し、[しきい値の調整] を選択して円を描き、塗りつぶす手動しきい値を設定します。
- [ パーティクルの解析 ] ボタンを選択し、円度を 0.75 ~ 1 に設定して、パーティクルを解析します。
- ソフトウェアに自動的に表示される測定液滴の結果の面積と直径を取得します。
- 平均液滴径を計算し、球形の液滴を仮定して、絶対目標濃度の計算に使用されるパーティション体積を推定します。
- 液滴径(<3%)に対する平均値(k =1)に対する標準偏差の比として取られる変動係数(CV)を分析して、液滴が単分散していることを確認します。
6. 蛍光イメージングと画像解析
- 蛍光イメージング
- 増幅後、PCRエマルションを矩形プロファイルを持つホウケイ酸キャピラリーチューブ(深さ50μm)に移し、液滴を近いパックされた単層に配置してイメージングします。
- 充填した毛細血管を顕微鏡スライドに固定し、UVアクリル接着剤を使用して両側を密封します。サンプルの漂白を避けるためにエマルジョンを照らさないように気をつけてUV接着剤にUV光源を適用します。
- EMCCDカメラと10倍の目的を備えた反転顕微鏡にガラススライドを積み込みます。
- 顕微鏡イメージングソフトウェアを使用して、[ 取得する |ライブ - 高速 でリアルタイムのカメラ取得を開始し、サンプルを観察し、毛細血管の幅がキャプチャされていることを確認します。
- 3.5 Vで、ダイアスコピック照明用の明視野ランプを設定します。
- 20%の強度で、エピスコピック照明用の広域LED蛍光灯を設定します。
- キャリブレーションを選択して、すべての波長(明視野、FAM、HEXおよびCy5)のキャプチャ設定を手動で調整 する |イメージング ソフトウェアの [光学式構成] コマンド。各蛍光色素については、対応する蛍光フィルターキューブを手動で切り替える必要があります。明視野イメージング用のフィルタキューブは、同じ光路を維持するために使用する必要があります。
- 取得 |表 3に要約した各フルオロフォアのカメラ設定コマンド。ソフトウェアの [キャプチャ設定] メニューで、読み出しモード EM ゲイン 17 MHz を 16 ビットに設定し、ゲイン乗数を 100 に設定します。
- ソフトウェアのLUTウィンドウで、送信信号が設定された範囲内に包含されるようにLUTのスケールを設定する。この実験では、スケールは500から約12,000まで設定されました。
- XYスキャンと複数波長のオプションを指定された順序で使用して、マルチポイント取得プログラムを使用してキャプチャを自動化します。ステージが初期位置に移動し、すべての異なる波長をキャプチャしてから、次の位置に進みます。
- まず、XY スキャン プロファイルをソフトウェアの XY スキャン メニューでカスタマイズして、XY スキャンをセットアップします。'カスタムマルチポイント定義'で、大きな画像定義ボックスを選択し、それを約40.0 x 1.0 mm(エマルジョン充填の長さ)に設定します。1% のオーバーラップを使用します。
- [フォーカスサーフェスを使用]オプションを有効にし、顕微鏡のフォーカス ノブを使用してサンプル上の異なるポイントでフォーカス平面を調整して、フォーカス サーフェス カーブを設定します。
- 次に、スキャンタブを選択して複数の波長スキャンを設定します。各波長に対して、ステップ 6.1.7 で作成した光学構成をそれぞれ追加します。
- ステージの移動時やフィルタの変更中にアクティブなシャッターを閉じるオプションをクリックして、サンプルの漂白を避け、'Start Run'ボタンを押して取得を実行します。取得フレームを tiff ファイルにエクスポートし、複数ファイルの分割オプションを使用して、保存された LUT の設定を適用して、各チャネルを分離ファイルに分割します。ポイント名とチャンネル名オプションを使用して、各画像ファイルを簡単に区別できます。
- 画像解析
- 取得したすべての画像を明視野フィルターと蛍光フィルタでソートし、オープンソースの画像解析ソフトウェアにアップロードします。
- 画像解析ソフトウェアを使用して、明視野画像を使用してすべての液滴を識別し、関連する蛍光滴の強度を測定するためにパイプラインを作成します。
- パイプラインをパイプラインにアップロードするには、明視野と蛍光のtiff画像をアップロードし、モジュール'ColorToGray'、'プライマリオブジェクトを識別する'、'MeasureObjectIntensity '、および'ExportToSpreadsheet'を追加します。MeasureObjectIntensity明視野の液滴画像を使用してオブジェクトを識別し、オブジェクトをマスクとして使用して蛍光画像の強度を測定します。
- 選択したtiff画像でパイプラインを実行し、蛍光滴画像の平均蛍光強度を抽出します。分析のために~5,000液滴からなる各セットで、三重で実験を行います。
- 'definetherain' アルゴリズム (http://definetherain.org.uk/) を適用して、正と負の液滴クラスタを識別します。正は平均の標準偏差の3以内にする必要があります。これは、カウントに使用される正の液滴のしきい値強度を決定します。
- 再度画像解析ソフトウェアを使用して、各遺伝子ターゲットの蛍光閾値が前のステップで定義されているように設定される新しいパイプラインを実装します。
- 明視野画像と蛍光画像をパイプラインにアップロードします。モジュール 'ColorToGray'、'再スケール強度'、'しきい値'、'識別プライマリオブジェクト'、'メジャーオブジェクトサイズシェイプ'、'フィルタオブジェクト'、および'エクスポートスプレッドシート'を追加します。明視野画像と各蛍光フィルター用のユニークなモジュールを作成します。
- 各蛍光画像群の画像の強度を 0 から 1 に変更します。次に、しきい値を設定して、設定されたしきい値を超えるオブジェクトを識別してカウントします。必要に応じて、ExpandOrShrinkObjects' モジュールを追加してオブジェクトを縮小し、明視野内の液滴のカウントと識別を容易にします。
- 選択したサイズの20〜30ピクセル内のオブジェクトのみを識別し、特定の直径(すなわち、直径75μmの範囲の液滴)と0.5以下の丸い球面偏心を持つオブジェクトのみを保持するように、カウントされたオブジェクトをフィルタリングします。
- 結果を、明視野画像からの総液滴数と、使用されるすべての蛍光チャネルの液滴数をリストした表にエクスポートします。すなわち、Cy5はC-LESS遺伝子、メチル化されたCD3Z遺伝子のHEX、およびメチル化されたFOXP3遺伝子のFAM(提示されたmdPCRアッセイのために得られた生実験データの 補足情報 を参照してください)。
- 各遺伝子標的の負の液滴の比率を計算し、ポアソン分布を適用して、方程式1を使用して各液滴当たりのコピー(CPD)を得る。
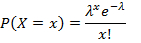
ここで、xは0、1、2以上の分子を含む液滴の数を表し、λはCPD値を表す。 - 計算する、式2でステップ5.20で得られたCPD値と液滴体積の比を取ることによって絶対目標濃度を算出する:
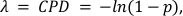
ここで、値 (1-p) は負の液滴の割合を表します。 - メチル化 CD3Z および FOXP3 遺伝子のそれぞれの CPD 値を C-LESS または総細胞 - CPD 値で除算して、CD3+ T 細胞および CD4 +CD25 + T-Regs の割合を計算します (生データからの CPD 計算の 補足情報 を参照)。
- これらのパーセント値を、CD3+ T細胞およびCD4+ CD25+ CD25+ T-Regカウント用抗体+を用いて免疫蛍光イメージングから得られた値と比較します。+
結果
TPEベースのマイクロ流体液滴発生装置は、図1に示すように記載されたプロトコルを用いて製造した。透明マスクをフォトリソグラフィに使用し、シリコン(Si)マスターを得る。柔らかいリソグラフィは、次いでエポキシ型を製造するために使用されたSiマスターの逆PDMSレプリカを得るために行った。エポキシ前駆体をPDMS上に注ぎ、架橋して硬化させた。この金型は、Si?...
ディスカッション
提示された実験的なプロトコルおよび方法は作られたTPEの液滴発生器、熱サイクラーおよび蛍光顕微鏡を使用して社内mdPCRを可能にする。柔らかいTPEからTPEへの結合を使用して製造された装置は、最終的な装置が液滴発生器としてその後使用するために表面処理を必要としないように、すべてのチャネル壁にわたって均一である疎水性表面特性を与える。この材料は、高スループット製造...
開示事項
宣言する競合はありません。
謝辞
著者らは、カナダ国立研究評議会からの財政的支援を認めている。
資料
| Name | Company | Catalog Number | Comments |
| Bio-Rad, Mississauga, ON | TFI0201 | PCR tube | |
| RAN Biotechnologies, Beverly, MA | 008-FluoroSurfactant | Fluoro-surfactant | |
| Silicon Quest International, Santa Clara, CA | |||
| Oxford Instruments, Abingdon, UK | EMCCD camera | ||
| Thermo Fisher Scientific, Waltham, MA | MA5-16728 | ||
| Thermo Fisher Scientific, Waltham, MA | 22-8425-71 | ||
| CellProfiler | Used for fluorescence image analysis | ||
| Nikon, Japan | 10x objective | ||
| American Type Culture Collection (ATCC), Manassas, VA | PCS-800-011 | ||
| Ramé-Hart Instrument Co. (Netcong, NJ) | p/n 200-U1 | ||
| Fisher, Canada | |||
| Vitrocom, NJ, USA | 5015 and 5010 | Borosilicate capilary tube | |
| (http://definetherain.org.uk/) | |||
| Hamamatsu, Japan | LC-L1V5 | DEL UV light source | |
| Dolomite | 3200063 | Disposable fluidic tubing | |
| Dolomite | 3200302 | Disposable fluidic tubing | |
| IDT, Coralville, IA | |||
| Nikon, Melville, NY | Upright light microscope | ||
| Cytec Industries, Woodland Park, NJ | |||
| EV Group, Schärding, Austria | |||
| Zymo Research, Irvine, CA | D5030 | ||
| Photron, San Diego, CA | |||
| IDT, Coralville, IA | |||
| Gersteltec, Pully, Switzerland | SU-8 photoresist | ||
| Fineline Imaging, Colorado Springs, CO | |||
| Qiagen, Hilden, Germany | 203603 | ||
| Image J | Used to assess droplet diameter | ||
| Anachemia, Montreal, QC | |||
| Excelitas, MA, USA | Broad-spectrum LED fluorescent lamp | ||
| Galenvs Sciences Inc., Montreal, QC | DE1010 | ||
| Hexpol TPE, Åmål, Sweden | Thermoplastic elastomer (TPE) | ||
| Thermo Fisher Scientific, Waltham, MA | 13-400-518 | ||
| Nikon, Japan | Used for image acquisition | ||
| 3M, St Paul, MN | Carrier Oil | ||
| Thermo Fisher Scientific, Waltham, MA | R37605 | Blue fluorescent live cell stain (DAPI) | |
| IDEX Health & Science, Oak Harbor, WA | P-881 | PEEK fittings | |
| Sigma-Aldrich, Oakville, ON | 806552 | ||
| Dow Corning, Midland, MI | |||
| ThinkyUSA, CA, USA | ARV 310 | ||
| Ihc world, Maryland, USA | IW-125-0 | ||
| Zinsser NA, Northridge, CA | 2607808 | ||
| Cetoni GmbH, Korbussen, Germany | |||
| Sigma-Aldrich, Oakville, ON | 484431 | ||
| Bio-Rad, Mississauga, ON | 1861096 | ||
| Hitachi High-Technologies, Mississauga, ON | |||
| Nikon, Melville, NY | Inverted microscope | ||
| Nikon, Japan | |||
| Loctite | AA 352 |
参考文献
- Teitell, M., Richardson, B. DNA methylation in the immune system. Clinical Immunology. 109 (1), 2-5 (2003).
- Suarez-Alvarez, B., Rodriguez, R. M., Fraga, M. F., López-Larrea, C. DNA methylation: A promising landscape for immune system-related diseases. Trends in Genetics. 28 (10), 506-514 (2012).
- Suárez-Álvarez, B., Raneros, A. B., Ortega, F., López-Larrea, C. Epigenetic modulation of the immune function: A potential target for tolerance. Epigenetics. 8 (7), 694-702 (2013).
- Kondilis-Mangum, H. D., Wade, P. A. Epigenetics and the adaptive immune response. Molecular Aspects of Medicine. 34 (4), 813-825 (2013).
- Zouali, M. . The Autoimmune Diseases. , (2014).
- Wiencke, J. K., et al. A comparison of DNA methylation specific droplet digital PCR (mdPCR) and real time qPCR with flow cytometry in characterizing human T cells in peripheral blood. Epigenetics. 9 (10), 1360-1365 (2014).
- Hindson, B. J., et al. High-throughput droplet digital PCR system for absolute quantitation of DNA copy number. Analytical Chemistry. 83 (22), 8604-8610 (2011).
- Pinheiro, L. B., et al. Evaluation of a droplet digital polymerase chain reaction format for DNA copy number quantification. Analytical Chemistry. 84 (2), 1003-1011 (2012).
- Roy, E., Galas, J. C., Veres, T. Thermoplastic elastomers for microfluidics: Towards a high-throughput fabrication method of multilayered microfluidic devices. Lab on a Chip. 11 (18), 3193-3196 (2011).
- Roy, E., et al. From cellular lysis to microarray detection, an integrated thermoplastic elastomer (TPE) point of care Lab on a Disc. Lab on a Chip. 15 (2), 406-416 (2015).
- Malic, L., et al. Epigenetic subtyping of white blood cells using a thermoplastic elastomer-based microfluidic emulsification device for multiplexed, methylation-specific digital droplet PCR. Analyst. 44 (22), 6541-6553 (2019).
- Malic, L., et al. Polymer-based microfluidic chip for rapid and efficient immunomagnetic capture and release of Listeria monocytogenes. Lab Chip. 15 (20), 3994-4007 (2015).
- Malic, L., Morton, K., Clime, L., Veres, T. All-thermoplastic nanoplasmonic microfluidic device for transmission SPR biosensing. Lab Chip. 13 (5), 798-810 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved