Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hematolojik Tanı için Polimer Damlacık Jeneratör Cihazı ile Metilasyona Özgü Multipleks Damlacık PCR
Bu Makalede
Özet
Epigenetik belirteçler beyaz kan hücresi (WBC) DNA metilasyon desenleri nicelik selektib yoluyla subtyping için kullanılır. Bu protokol, WBC diferansiyel sayımlarının hassas ve çok katlı metilasyona özgü hedef nicelemesine olanak sağlayan damlacık üretimi için termoplastik elastomer (TPE) tabanlı mikroakışkan bir cihaz kullanılarak çok katlı damlacık polimeraz zincir reaksiyonu (mdPCR) yöntemi ni sunar.
Özet
Çok katlı damlacık PCR (mdPCR) iş akışı ve epigenetik tabanlı beyaz kan hücresi (WBC) diferansiyel sayımının belirlenmesi için ayrıntılı protokol, termoplastik elastomer (TPE) mikroakışkan damlacık üretim cihazı ile birlikte tanımlanmıştır. Epigenetik belirteçler farklı hastalıklarda önemli prognostik değeri olan WBC subtyping için kullanılır. Bu, genomdaki (CpG loci) belirli CG açısından zengin bölgelerin DNA metilasyon paternlerinin ölçülmesi ile elde edilir. Bu yazıda, periferik kan mononükleer hücrelerinden (PBMCs) bisülfit le tedavi DNA' sı, WBC alt popülasyonları ile ilişkili CpG loci'ne özgü astarlar ve hidroliz floresan probları da dahil olmak üzere mdPCR reaktifleri ile damlacıklarda kapsüllenmiştir. Multipleks yaklaşımı, ayrı mdPCR reaksiyonlarına gerek kalmadan birçok CpG loci'nin sorgulanmasını sağlayarak, metilasyon alanlarının epigenetik analizini kullanarak WBC alt popülasyonlarının daha doğru parametrik belirlenmesini sağlar. Bu kesin nicelik farklı uygulamalara genişletilebilir ve klinik tanı ve sonraki prognoz için yararları vurgulamaktadır.
Giriş
Beyaz kan hücreleri (WBCs) bileşiminin analizi hematolojik tanılarda en sık istenen laboratuvar testleri arasındadır. Diferansiyel lökosit sayısı enfeksiyon, inflamasyon, anemi ve lösemi gibi hastalıkların bir spektrum için bir gösterge olarak hizmet vermektedir, ve diğer birçok durum için erken prognostik biyomarker olarak soruşturma altında da. WBC subtyping altın standart immünboyama ve / veya akış sitometri her ikisi de pahalı gerektiren içerir, kararsızlığa eğilimli floresan antikorlar ve genellikle son derece örnek hazırlanmasında operatör yeterlilik bağlıdır. Ayrıca, bu yöntem sadece taze kan örnekleri için geçerlidir, böylece numuneler sevkiyat veya daha sonra analiz için dondurulamaz.
Epigenetik belirteçler son zamanlarda fenotibik varyasyonların incelenmesi için güçlü analitik araçlar olarak ortaya çıkmıştır. Daha sonra, insan lökosit popülasyonları WBC alt kümelerinin kesin karakterizasyonu için izin hücre soyundan DNA metilasyon desenleri olduğu gösterilmiştir. Epigenetik belirteçlere dayalı subtipleme taze kan örneği toplama veya pahalı antikorlar bağlı değildir ve hastalık başlangıcı ve duyarlılık1,2,,3,4,5için bir biyomarker olarak istismar edilebilir umut verici bir alternatif sağlar.
Lökosit alt tiplerinde genom (CpG adaları) metillenmiş spesifik CG açısından zengin bölgelerin lökosit alt tiplerine özgü aday epigenetik belirteçleri belirlemek için genomda (CpG adaları) kapsamlı haritalama çalışmaları yapılmıştır. PCR protokolleri, cd3+ T-Cells ve CD4+ CD25+ Regulatory T-Cells (T-Regs) ile karşılık gelen metilasyonlu gen bölgeleri, örneğin CD3Z ve FOXP3 için bu nedenle geliştirilmiştir. Wiencke ve ark. T-Hücrelerinin epigenetik subtyping için dupleks damlacık PCR yarar göstermiştir, son derece akış aktif hücre sıralama (FACS)analizi6 ile ilişkili sonuçlar elde . Bu kantitatif genetik analiz yöntemi, şablon nükleik asit molekülleri ve PCR reaktiflerinin mikroakışkanlar tarafından etkin leştirilmiş su-in-oil emülsiyonları kullanılarak sıfır, bir veya daha7,fazla hedef nükleik asit kopyaları içeren binlerce ayrık, hacimsel olarak tanımlanmış, nanolitre altı boyutlu damlacıklara bölünmesinedayanır. PCR amplifikasyon her bir damlacık içinde gerçekleştirilir ve her damlacık uç nokta floresan yoğunluğu ölçülür, örnekmevcut hedeflerin mutlak nicelik sağlar. Damlacık PCR standart qPCR daha hassas, doğru ve teknik olarak basit olarak kurulmuştur, T-Hücrelerinin klinik değerlendirilmesi için daha olumlu bir DNA metilasyon tabanlı yöntem yapma. Hızla ortaya çıkan bir alt tipleme metodolojisi olmasına rağmen, aynı anda çeşitli metillenmiş CpG bölgeleri için araştırmak için çok katlı epigenetik analiz eksiktir. Bu rutin lökosit diferansiyel sayımları için gereklidir.
Burada, bir termoplastik elastomer (TPE) damlacık mikroakışkan cihaz sunulmaktadır ve metilasyona özgü multipleks damlacık PCR (mdPCR) için istihdam. Bu teknoloji, hücre soyundan dna metilasyon desenlerine, yani CD3Z ve FOXP3 CpG bölgelerinin epigenetik varyasyonuna göre spesifik lökosit alt tipleri, CD3+ T-Cells ve CD4+ CD25+ T-Regs'i belirlemek için kullanılmıştır. DNA ekstraksiyonu, bisülfit dönüşümü ve mdPCR için ayrıntılı bir protokol, TPE damlacık üretim cihazı için bir üretim yöntemi ile uyumlu olarak tanımlanmıştır. Yöntemin temsili sonuçları, önerilen yaklaşımın yararını vurgulayan immünoresans boyama sonuçlarıyla karşılaştırılır.
Protokol
İnsan örneklerini içeren bu çalışmada yapılan tüm deneyler NRC Etik Kurulu tarafından onaylandı ve NRC'nin yürürlükteki araştırma yönergelerine uygun ve Québec, Kanada'daki yasalara uygun insan deneklerini yöneten politikalarına göre yapıldı.
1. Hücre hazırlama
- Dondurulmuş insan periferik kan mononükleer hücreleri (PBMCs) hemen 5 dakika için 37 °C'de bir su banyosunda cryovial yerleştirerek çözültün.
- Hücreleri yavaşça yeniden askıya almak ve 1 mL pipet kullanmak için cryovial'ı iki kez ters çevirin ve 1 mL pipet kullanarak hücre süspansiyonuna 15 mL konik tüpe aktarın.
- PBMC'leri içeren 15 mL tüpe %10 fetal sığır serumu (RPMI-1640 + %10 FBS) ile takviye edilmiş önceden ısıtılmış (37 °C) büyüme ortamının 10 mL'sini ekleyin.
- Hızlı hızlanma ve yüksek fren ile 10 dakika için 330 x g hızda oda sıcaklığında bir sallanan kova santrifüj hücre süspansiyon santrifüj.
- Dönüş bittikten sonra, supernatant'ı dikkatlice decant. Tüplerin yan tarafına dokunarak 2 mM ethylenediamminetetraasetik asit (EDTA) içeren fosfat tamponlu salin (PBS) pH 7.2 3 mL'lik hücre peletini yeniden askıya alın.
- Kapağı sıkıca kapalı tüp ters çevirerek hücreleri karıştırın.
- İki adet 1,5 mL mikrotüp hazırlayın ve her tüpteki hücre süspansiyonunun 1,5 mL'lik pipet aliquot'u kullanarak bunlardan biri sonraki immünfloresans boyama ve diğeri DNA ekstraksiyonu için kullanılır.
2. İmmünofluoresans boyama ve görüntüleme protokolü
- Hücreleri (1.7'den) %0.1 sodyum azit ve %2 FBS içeren 200 μL PBS tamponunda yeniden askıya alın ve hücre süspansiyonunun son konsantrasyonu maksimum 2 x 107 hücre/mL'ye ayarlayın.
- Hücre süspansiyonuna 100 μL hacmini iki ayrı 1,5 mL mikrotüp halinde boruile tutarak bölün.
- Bir tüpe floresan izotiyoyanat (FITC) ve Phycoerythrin (PE) ile konjuge 20 μL anti-Hu CD3/CD4 hacmini fitc ve PE (bkz. Malzeme Tablosu)ile ikinci tüpe ekleyin.
- Her tüpe 1 damla mavi floresan canlı hücre lekesi ekleyin (Bkz. Malzemeler Tablosu).
- 2 saat boyunca bir tüp rotator kullanarak oda sıcaklığında kuluçka. Işıktan koruyun.
- Hızlı ivme ve yüksek fren ile 10 dakika için 330 x g oda sıcaklığında hücre süspansiyon santrifüj.
- Supernatant decant ve dikkatle tüp dokunarak hücre pelet resuspend. 1 mL PBS, pH 7.2 içeren 2 mM EDTA ekleyin. Kapağın sıkıca kapatılmasını sağlayarak, tüpü 2kat ters çevirerek hücreleri karıştırın.
- 2.6 ve 2.7 adımlarını üç kez tekrarlayın.
- 2 mM EDTA içeren 20 μL PBS pH 7.2'deki hücreleri yeniden askıya alın.
- Pipet 10 μL hücre süspansiyon bir borosilikat mikroskop slayt üzerine damla ve hücrelerin yavaşça damla altına tortu için 2 dakika bekleyin.
- Dikkatle mikroskop slayt üstüne bir cam kapak kayma yerleştirin ve ters bir mikroskop sahnesine slayt yerleştirin.
- Her iki hücre süspansiyon numunesi için her bir florofor için mikroskoba bağlı bir 10x nesnel ve bir EMCCD kamera kullanarak hücrelerin görüntülerini kaydedin.
- Floresan olarak etiketlenmiş hücreleri el ile sayın (ham veriler için Ek Bilgiler'e bakın).
- Anti-Hu CD3 ve anti-Hu CD4/CD25 etiketli hücrelerin DAPI lekeli hücrelere oranını alıp CD3+ T-Cells ve CD4+ CD25+ T-Regs oranlarını toplam lökosite alın.
3. DNA çıkarma ve bisülfit dönüşüm
- DNA ekstraksiyonu
NOT: Bölüm 1'de manyetik DNA arınma kiti (bkz.- 1.5 mL'lik bir tüpte 100 μL PBS'deki hücreleri askıya alın ve 20 μL Proteinaz K ve 400 μL lik Lysis/Binding tamponekleyin. Yukarı-aşağı 10x pipetting tarafından karıştırın, sonra 5 dakika oda sıcaklığında kuluçka gerçekleştirin.
- 1-2 dakika boyunca bir manyetik raf üzerine tüp yerleştirerek DNA-boncuk kompleksi yakalamak, sonra dikkatle kaldırmak ve supernatant atın.
- DNA-boncuk kompleksini içeren tüpü manyetik raftan çıkarın ve boncukları 600 μL'lik Yıkama Tamponu #1 yeniden askıya alın ve spesifik olmayan herhangi bir bağlayıcılığı temizlenin.
- Tüpü tekrar manyetik rafa yerleştirin ve supernatant'ı dikkatlice çıkarın ve atın.
- Yıkama Tampon #2 600 μL ile 3.1.3 ve 3.1.4 adımlarını tekrarlayın.
- Tüpü 1 dakika boyunca hava kurumaya bırakın.
- Tüpü manyetik raftan çıkarın ve 100 μL Elütion Tamponu dağıtarak ve DNA/boncuk kompleksini 20 kat aşağı borulayarak DNA'yı uzaklaştırın.
- Eluted DNA içeren tüp tekrar manyetik raf ve inkübatiçin 1-2 dakika için eluted DNA manyetik boncukayırmak için yerleştirin.
- Eluted saflaştırılmış DNA çözeltisini yeni bir temiz tüpe aktarın.
- Bir spektrofotometre kullanarak 260 nm'deki emiciliği ölçerek saflaştırılmış DNA örneğinin konsantrasyonunu değerlendirin.
- Bisülfit dönüşüm
NOT: Üretici tarafından sağlanan prosedürleri izleyerek bir metilasyon kiti (bkz. Malzemeler Tablosu)kullanarak saflaştırılmış DNA üzerinde bisülfit dönüşüm gerçekleştirin.- Bir PCR tüpteki 20 μL DNA örneğine (200-500 ng) 130 μL Dönüşüm Reaktifi ekleyin. İyice karıştırın ve kısa bir süre aşağı dön.
- PCR tüpünü bir termal döngüce aktarın ve bisiklet protokolünü aşağıdaki gibi uygulayın: 8 dk için 98 °C; 60 dk için 54 °C ve 4 °C'de tutun.
- Toplama tüpüne yerleştirilen iyon kromatografisi (IC) sütununa Bağlama arabelleğine 600 μL ekleyin.
- DNA örneğini, bağlayıcı arabelleği içeren IC sütununa ekleyin ve tüpü birkaç kez ters çevirerek karıştırın. Tam hızda 30 s için santrifüj. Toplanan akışı atın.
- Sütuna şimdi 100 μL Yıkama Arabelleği ekleyin. 3.2.4 adımında açıklandığı gibi santrifüj gerçekleştirin ve akışı atın.
- Desülfür buffer 200 μl ekleyin ve 15-20 dakika oda sıcaklığında kuluçka gerçekleştirin. Yukarıdaki adımlarda açıklandığı gibi akışı önsandır ve atın.
- Sütuna 200 μL Yıkama Tamponu ekleyin. 30 s için tam hızda santrifüj ve akış atmak.
- Adımı 3.2.7'yi tekrarlayın.
- Sütunu yeni bir 1,5 mL toplama tüpüne aktarın ve sütunun zarına 100 μL PCR sınıfı su ekleyin. DNA'yı elemek için 1 dk tam hızda santrifüj.
- Bir spektrofotometre kullanarak 260 nm'de emiciliği ölçerek bisülfitle dönüştürülmüş DNA örneğinin konsantrasyonunu değerlendirin.
NOT: 260 nm = 1.0'da absorbans için 40 μg/mL değeri kullanın. - DNA'yı kısa süreli depolama için -20 °C'de veya uzun süreli depolama için -70 °C'de saklayın.
4. Damlacık üretim cihazı imalatı
NOT: Damlacık üretimi için kullanılan bir mikroakışkan cihaz (Ek Bilgilerdesağlanan CAD dosyası) aşağıdaki protokol tarafından oluşturulan sıcak kabartma kullanılarak termoplastik elastomerde temiz bir odada (sınıf 1.000) ortamda imal edilmiştir ( Malzeme Tablosunabakınız)..
- SU-8 kalıp imalatı
- Aşağıda açıklandığı gibi standart fotolitografi kullanarak 6" silikon gofret üzerinde bir SU-8 kalıbı hazırlayın.
- 10 s için 500 W oksijen plazma kullanarak 6 "silikon gofret temizleyin.
- Spin-coat SU-8, 100 μm toplam film kalınlığı elde etmek için 40 s için 900 rpm silikon gofret üzerine direnmek.
- Gofret sıcak bir tabağa yerleştirin ve 65 °C'de 15 dakika önceden pişirin, ardından 95 °C'de 2 saat pişirin.
- 1.000 mJ/cm2pozlama dozu kullanarak yüksek tanımlı şeffaflık fotomaskesi ile 365 nm (Hg i-line) uv ışığına maruz.
- Gofret sıcak bir tabağa yerleştirin ve 65 °C'de 15 dakika fırından sonra, ardından 95 °C'de 40 dk.
- 5 dakika boyunca propilen glikol monometil eter asetat (PGMEA) daldırma tarafından geliştirin.
- PGMEA ve isopropanol ile durulayın ve azot gazı akışı ile kurulayın.
- Gofret sıcak bir tabak ve sert fırında 2 saat 135 °C'de yerleştirin.
- 2 saat boyunca bitişik cam mikroskop slayt üzerine yerleştirilen silanizing ajan (tricholoro perfluorooctyl silane) bir damla içeren vakum desiccator gofret silanize.
NOT: Bu silanes SU-8 ana yüzeyinde bir monolayer oluşturmak yapmak için yapılır. Tricholoro perfluorooctyl silane her zaman duman kaputunda ele alınmalıdır ve su kaynaklarından uzak tutulmalıdır.
- Polidimethylsiloxane (PDMS) replikasyonu
- PDMS'nin sıvı prepolimerlerini (Bkz. Malzeme Tablosu)10:1 oranına göre elastomer tabanıw/w'dan plastik bir kaptaki kürleme maddesine hazırlayın.
- PHMS karışımını karıştırmak ve gazdan arındırmak için bardağı gezegensel bir santrifüj vakum mikserine yerleştirin.
- PDMS karışımını, reçine sızıntısını önleyen özel metal tutucuya yerleştirilen kalıbın üzerine dökün ve 65 °C'de 2 saat boyunca kür edin.
- Cımbız kullanarak, SU-8 ustasından PDMS kalıbını dikkatlice soyun.
- Epoksi kalıp
NOT: SU-8/silicon master'dan PDMS ile ara replikasyon işlemi kullanılarak epoksi kalıp üretildi.- Epoksi reçinesini (bkz. Malzemeler Tablosu)100/83 w/w reçine/sertleştirici oranı yla hazırlayın.
- 30 dk için bir vakum kurutma fırını kullanarak azaltılmış basınç altında karışımı degas.
- PDMS çoğaltma üzerine reşin dökün ve 12 saat için 80 °C'de tedavi.
- PDMS çoğaltma dan kürlenmiş epoksi kalıp çıkarın, bir sıcak plaka ve sert fırında 2 saat için 120 °C.
- TPE cihazı
- TPE ekstrüzyon peletleri (bkz. Malzeme Tablosu)165 °C kalınlığında 2,0 mm kalınlığında ve 7" genişliğinde birkaç metre uzunluğunda yapraklar ve ileride kullanılmak üzere rulo olarak saklayın.
- 7 "kare içine makas kullanarak rulo TPE levha kesin.
- Epoksi kalıp ve desensiz silanized silikon gofret arasına TPE levha yerleştirin (gofret silanizasyon prosedürü için adım 4.1.10 bakınız).
- 125 °C sıcaklıkta, 10 kN'lik bir kuvvette ve 10 dakika boyunca 10-2 mbar basınçta sıcak kabartma yapın.
- Kabartmalı TPE'yi silikon gofret ve epoksi kalıptan ayırmak için metanol spreyi kullanarak oda sıcaklığında dikkatlice kalıplayın.
- TPE başka bir 7 "kare levha kesin ve iki desensiz silanized silikon gofret arasında yerleştirin.
- 140 °C sıcaklıkta sıcak kabartma, 10 kN'lik bir kuvvet ve 10 dk için 10-2 mbar basınçla kanalları kapatmak ve cihazı kapatmak için düzlemsel bir yüzey oluşturmak için sıcak kabartma yapın.
- Demold dikkatle iki silikon gofret kabartmalı TPE ayırmak için metanol sprey kullanarak oda sıcaklığında.
- Kabartmalı TPE levhaların her birini doktor bıçağı kullanarak cihaz boyutuna kesin.
- Bir piston lu 1 mm biyopsi zımba iğnesi kullanarak yapılandırılmış cihazdaki giriş ve çıkış kanallarının giriş deliklerini delin.
- Oda sıcaklığında kanallarla doğrudan temas halinde düzlemsel bir TPE cihazı yerleştirerek kanalları içine alayın.
- İsteğe bağlı olarak, cihaz yapıştırma teşvik etmek için 2 saat için 70 °C'de bir fırına yerleştirin.
- Erişim deliklerini tek kullanımlık akışkan bir tüple (I.D. 0.25 mm, O.D. 0.8 mm) töbeble tonuyla töfordur. Sızdırmaz manipülasyon sağlamak için bir epoksi tutkal kullanarak eklemleri mühür.
5. Damlacık üretimi ve PCR
NOT: Tablo 1, demethylated gen hedeflerinin çokkatlı amplifikasyonu için gerekli olan C-LESS, CD3Z ve Foxp3 genleri için çift sıkılmış hidroliz probları ile birlikte ileri ve ters astarlar hakkında bilgi özetlemektedir.
- Tablo 2'deaçıklandığı gibi ana karışımı hazırlayın.
- Enzim karışımı dışında ana karışımın tüm bileşenlerini eritin. Ana karışımı yukarı-aşağı boruile iyice karıştırın ve kısa bir süre aşağı döndürün.
- Bir PCR tüpünde ana karışıma uygun bisülfit dönüştürülmüş DNA'yı (bölüm 3.2)'e ekleyin. Yukarı-aşağı borulama ve kısa bir süre aşağı spin tarafından reaksiyon karıştırın.
- Peek bağlantı parçaları kullanarak tek kullanımlık akışkan boruları (I.D. 0.25 mm, O.D. 1.6 mm) iki hassas cam şırıngaya (250°L hacim) bağlayın.
- %5 floro-yüzey aktif madde içeren 250 μL taşıyıcı yağ ile bir hassas cam şırınga ön doldurun.
- Emülsifikasyon sırasında tüm numune hacminin dağıtılmasını sağlamak için 100 μL PCR karışımını yüklemeden önce başka bir hassas cam şırıngasını 50°L taşıyıcı yağile önceden doldurun.
- Gerçek zamanlı olarak damlacık oluşumunu gözlemlemek ve kaydetmek için yüksek hızlı bir kamera ile donatılmış dik ışık mikroskobun sahnesine bir damlacık mikroakışkan cihaz ayarlayın.
- Önceden doldurulmuş şırıngaları programlanabilir şırınga pompasına yerleştirin ve bağlantı parçalarıyla PEEK birliğini kullanarak (Bkz. Malzeme Tablosu),şırıngaların tüpünü damlacık mikroakışkan cihazın ilgili giriş kanallarının borularına bağlayın.
- Damlacık jeneratörünün çıkışından boruyu 0,5 mL PCR borunun içine yerleştirin.
- Şırınga pompasının akış hızını 2 μL/dk'ya ayarlayın ve elde edilen emülsiyon toplanmadan önce damlacık boyutunun stabilize olmasını bekleyin.
- Emülsiyon toplayın ve termal bisiklet için 0,2 mL PCR tüpe 75 μL aktarın.
- PCR tüpündeki yağ içeriğinin, termal bisiklet sırasında damlacıkların birleşmesini önlemek için dağılmış fazın hacmiyle yakından eşleştiğinden emin olun.
- 0,2 mL PCR tüpünü termal döngüye yerleştirin ve bisiklet protokolünü aşağıdaki gibi uygulayın: 95 °C'de 5 dk, sonra 95 °C'de 45 döngü denatürasyon 15 s ve annealing/extension 30 s için 60 °C'de.
- Damlacıkları görüntülemek ve damlacık çapını değerlendirmek için bir borosilikat kapiller tüp (100 μm derinlik) dikdörtgen bir profil ile doldurmak için kalan emülsiyon kullanın.
- Emülsiyon la dolu borosilikat tüpü mikroskop slaytına yerleştirin. Damlacıkların parlak alan görüntülerini kaydetmek için EMCCD kamera ve 10x hedefi yle donatılmış ters bir mikroskop kullanın.
- Damlacık çapını aşağıda ayrıntılı olarak belirtildiği gibi bir görüntü analiz yazılımı kullanarak ölçün.
- 'Analyze' butonunu ve ardından 'Set Ölçeği' ni seçerek görüntüdeki piksel sayısına karşılık gelen mikronlarda bilinen uzaklık ölçeğini ayarlayın.
- 'Image' butonunu ve ardından 'Type' seçeneğini seçerek görüntüyü gri tonlama ya dönüştürün. Gerekirse parlaklığı ve kontrastı ayarlayın. 'Image' düğmesini ve ardından 'Eşik'i Ayarla' düğmesini seçerek daireleri belirlemek ve doldurmak için bir el ile eşlemi ayarlayın.
- 'Parçacıkları analizet' düğmesini seçerek ve daireselliği 0,75 -1'e ayarlayarak parçacıkları analiz edin.
- Ortaya çıkan alanı ve otomatik olarak yazılımda görüntülenen ölçülen damlacıkların çapını elde edin.
- Ortalama damlacık çapını hesaplayın ve küresel bir damlacık varsayarsak, mutlak hedef konsantrasyonunu hesaplamak için kullanılacak olan bölme hacmini tahmin edin.
- Damlacıkların, damlacık çapı (< %3) için standart sapmaların ortalama değerlereoranı olarak alınan varyasyon katsayısı (CV) analiz edilerek monodisperse edildiğinden emin olun.
6. Floresan görüntüleme ve görüntü analizi
- Floresan görüntüleme
- Amplifikasyondan sonra, pcr emülsiyonunu dikdörtgen profille borosilikat kapiller tüpe (50 μm derinlikte) aktarArak damlacıkları görüntüleme için yakın paketlenmiş tek katmanlı bir katmana yerleştirin.
- Bir mikroskop slayt üzerinde dolu kılcal giderin ve uv akrilik yapıştırıcı kullanarak her iki tarafı mühür. Örneğin beyazlatma önlemek için emülsiyon aydınlatmak için dikkatli olmak UV yapıştırıcı bir UV ışık kaynağı uygulayın.
- Cam kaydırağı EMCCD kamera ve 10x objektifi ile donatılmış ters bir mikroskoba yükleyin.
- Mikroskop görüntüleme yazılımLarını kullanarak, Edinme | Canlı - Hızlı gerçek zamanlı kamera edinimi başlatmak için, örnek gözlemlemek ve kılcal genişlik yakalanan olduğundan emin olun.
- Parlak alan lambasını diaskobik aydınlatma için 3,5 V olarak ayarlayın.
- Episkopik aydınlatma için geniş spektrumlu LED floresan lambayı %20 yoğunlukta ayarlayın.
- Kalibrasyon ' u seçerek tüm dalga boyları (Parlak alan, FAM, HEX ve Cy5) için yakalama ayarını el ile ayarlayın | Görüntüleme yazılımında Optik Yapılandırmalar komutu. Her florofor için, ilgili floresan filtre küpü el ile değiştirilmesi gerekir. Aynı optik yolu korumak için parlak alan görüntüleme için bir filtre küpü kullanılmalıdır.
- Görüntü edinilmeden önce pozlama süresini el ile değiştirin | Tablo 3'teözetlendiği gibi her bir florofor için Kamera Ayarları komutu . Okuma modunu ayarlayın EM, yazılımın 'Capture Settings'menüsünde 100 kazanç çarpanı ile 16 bit'te 17 MHz kazanın.
- Yazılımın LUT penceresinde, LUTs ölçeğini iletim sinyalinin ayar aralığı içinde kaplanmış olması için ayarlayın. Bu deneyde, ölçek yaklaşık olarak 500'den 12.000'e ayarlandı.
- Bu özel sırada hem XY tarama hem de birden çok dalga boyu seçeneğini kullanarak çok noktalı bir satın alma programını kullanarak yakalamayı otomatikleştirin. Sahnenin ilk konuma geçtiğinden emin olun, tüm farklı dalga boylarını yakalayın ve bir sonraki konuma ilerleyin.
- İlk olarak, yazılımın XY taramayı menüsünde XY taramayı özelleştirerek XY taramayı ayarlayın. 'Özel Çok Noktalı Tanım'da, büyük görüntü tanım kutusunu seçin ve yaklaşık 40,0 x 1,0 mm (emülsiyon dolum uzunluğu) olarak ayarlayın. %1 çakışma kullanın.
- 'Odak Yüzeyini Kullan' seçeneğini etkinleştirin ve mikroskoptaki odak topuzunu kullanarak numunenin farklı noktalarındaodak düzlemini ayarlayarak odak yüzey eğrisini ayarlayın.
- İkinci olarak, tarama sekmesini seçerek çoklu dalga boyu tonu tonu düzenle. Her dalga boyu için adım 6.1.7'de oluşturulan optik yapılandırmaların her birini ekleyin.
- Aşama hareketi sırasında ve filtre değişikliği sırasında etkin deklanşörü kapatma seçeneğini tıklatın ve'Başlat Çalıştır' düğmesine basarak satın almayı çalıştırın. Her edinme çerçevesini tiff dosyalarına dışa aktarın ve her kanalı bölünmüş birden çok dosya seçeneğini kullanarak ve kaydedilmiş LUTs ayarlarını uygulayarak ayrı bir dosyaya bölün. Her resim dosyasını kolayca ayırt etmek için nokta adı ve kanal adı seçeneğini kullanın.
- Görüntü analizi
- Elde edilen tüm görüntüleri açık kaynak görüntü analizi yazılımına yüklemek için brightfield ve floresan filtrelere göre sıralayın.
- Brightfield görüntülerini kullanarak tüm damlacıkları tanımlamak ve ardından ilişkili floresan damlacıkların yoğunluğunu ölçmek için bir boru hattı oluşturmak için görüntü analizi yazılımını kullanın.
- Boru hattı için, brightfield ve floresan tiff görüntüleri yükleyin sonra modülleri ekleyin 'ColorToGray', 'IdentifyPrimaryObjects', 'MeasureObjectIntensity', ve 'ExportToSheet'. Nesneleri tanımlamak için brightfield damlacık görüntülerini kullanın, ardından floresan görüntülerin yoğunluğunu ölçmek için maske olarak nesneleri kullanın.
- Floresan damlacık görüntülerinin ortalama floresan yoğunluğunu çıkarmak için seçilen tiff görüntüleriyle boru hattını çalıştırın. Deneyi, analiz için ~5.000 damlacıktan oluşan her setle triplicate olarak gerçekleştirin.
- Pozitif ve negatif damlacık kümelerini tanımlamak için 'definetherain' algoritmasını (http://definetherain.org.uk/) uygulayın. Pozitif ortalamanın 3 standart sapma içinde olmalıdır. Bu, sayım için kullanılacak pozitif damlacıkların eşik yoğunluğunu belirler.
- Yine her gen hedefi için floresan eşiğinin önceki adımda tanımlandığı şekilde ayarlandığı yeni bir ardışık yol üzerinde çalışmak için görüntü analizi yazılımını kullanın.
- Brightfield ve floresan görüntüleri boru hattına yükleyin. 'ColorToGray', 'RescaleIntensity', 'Threshold', 'IdentifyPrimaryObjects', 'MeasureObjectSizeShape', 'FilterObjects', ve 'ExportToSheet' modülleri ekleyin. Brightfield görüntüleri ve damlacıklar için her floresan filtresi için benzersiz modüller oluşturun.
- Her floresan görüntü grubu için görüntü yoğunluğu ölçeğini 0'dan 1'e yeniden ölçeklendirin. Ardından, nesneleri belirlenen eşiğin üzerinde tanımlamak ve saymak için eşiği ayarlayın. Gerekirse, brightfield damlacıkların sayma ve tanımlanmasını kolaylaştırmak için nesneleri küçültmek için 'ExpandOrShrinkObjects' modülünü ekleyin.
- Yalnızca 20-30 piksel seçili boyuttaki nesneleri tanımlayın ve sayılan nesneleri yalnızca belirli bir çapa (yani, 75 m çapındaki damlacıklar) ve 0,5 ve altındaki yuvarlak küresel eksantriklikteki nesneleri korumak için filtreleyin.
- Sonuçları, brightfield görüntülerinden gelen toplam damlacık sayısını ve kullanılan tüm floresan kanallarının damlacık sayılarını listeleyen bir tabloya dışa aktarın; c-LESS geni için yani Cy5, metilasyonlu CD3Z geni için HEX ve metillenmiş FOXP3 geni için FAM (sunulan mdPCR testi için elde edilen ham deneysel veriler için Ek Bilgilere bakınız).
- Her gen hedefi için negatif damlacıkların oranını hesaplayın ve Denklem 1'i kullanarak damlacık başına ilgili kopyaları (CPD) elde etmek için Poisson dağılımını uygulayın:
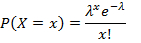
x, 0, 1, 2 veya daha fazla molekül içeren damlacık sayısını, λ ise CPD değerini temsil eder. - Hesaplamak, Denklem 2 ile adım 5.20 elde edilen CPD değeri ve damlacık hacmi oranı alarak mutlak hedef konsantrasyonu:
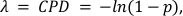
değeri (1-p) negatif damlacıkların kısmını temsil eder. - CD3+ T-Cells ve CD4+ CD25+ T-Regs yüzdesini, metillenmiş CD3Z ve FOXP3 genlerinin ilgili CPD değerlerini C-LESS veya toplam hücre - CPD değerine bölerek hesaplayın (ham verilerden CPD hesaplamaları için Ek Bilgiler'e bakın).
- Cd3+ T-Cell ve CD4+ CD25+ T-Reg sayımı için antikorlar kullanarak immünoresans görüntülemeelde edilenlerle bu yüzde lik değerleri karşılaştırın.
Sonuçlar
TPE tabanlı mikroakışkan damlacık jeneratör cihazı Şekil 1'degösterildiği gibi açıklanan protokol kullanılarak üretılmıştır. Fotolitografide silikon (Si) ustası elde etmek için saydamlık maskesi kullanılmıştır. Yumuşak litografi daha sonra epoksi kalıp imal etmek için kullanılan Si master ters BIR PDMS kopyasını elde etmek için yapıldı. Epoksi öncül PDMS üzerine dökülür ve çapraz bağlantı ve sertleşmek için tedavi edildi. Si ustasının tam kopyas?...
Tartışmalar
Sunulan deneysel protokol ve yöntemler, fabrikasyon TPE damlacık jeneratörü, termal çevrimleyici ve floresan mikroskobu kullanarak şirket içi mdPCR'ye olanak sağlar. TPE yapıştırma yumuşak TPE kullanarak fabrikasyon cihaz tüm kanal duvarları boyunca düzgün hidrofobik yüzey özellikleri sağlar, bu nedenle son cihaz bir damlacık jeneratör olarak sonraki kullanım için herhangi bir yüzey işleme gerektirmez. Bu malzeme rutin yüksek iş üretimi9,10,...
Açıklamalar
Bildirecek çakışma yok.
Teşekkürler
Yazarlar Kanada Ulusal Araştırma Konseyi mali destek kabul.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Bio-Rad, Mississauga, ON | TFI0201 | PCR tube | |
| RAN Biotechnologies, Beverly, MA | 008-FluoroSurfactant | Fluoro-surfactant | |
| Silicon Quest International, Santa Clara, CA | |||
| Oxford Instruments, Abingdon, UK | EMCCD camera | ||
| Thermo Fisher Scientific, Waltham, MA | MA5-16728 | ||
| Thermo Fisher Scientific, Waltham, MA | 22-8425-71 | ||
| CellProfiler | Used for fluorescence image analysis | ||
| Nikon, Japan | 10x objective | ||
| American Type Culture Collection (ATCC), Manassas, VA | PCS-800-011 | ||
| Ramé-Hart Instrument Co. (Netcong, NJ) | p/n 200-U1 | ||
| Fisher, Canada | |||
| Vitrocom, NJ, USA | 5015 and 5010 | Borosilicate capilary tube | |
| (http://definetherain.org.uk/) | |||
| Hamamatsu, Japan | LC-L1V5 | DEL UV light source | |
| Dolomite | 3200063 | Disposable fluidic tubing | |
| Dolomite | 3200302 | Disposable fluidic tubing | |
| IDT, Coralville, IA | |||
| Nikon, Melville, NY | Upright light microscope | ||
| Cytec Industries, Woodland Park, NJ | |||
| EV Group, Schärding, Austria | |||
| Zymo Research, Irvine, CA | D5030 | ||
| Photron, San Diego, CA | |||
| IDT, Coralville, IA | |||
| Gersteltec, Pully, Switzerland | SU-8 photoresist | ||
| Fineline Imaging, Colorado Springs, CO | |||
| Qiagen, Hilden, Germany | 203603 | ||
| Image J | Used to assess droplet diameter | ||
| Anachemia, Montreal, QC | |||
| Excelitas, MA, USA | Broad-spectrum LED fluorescent lamp | ||
| Galenvs Sciences Inc., Montreal, QC | DE1010 | ||
| Hexpol TPE, Åmål, Sweden | Thermoplastic elastomer (TPE) | ||
| Thermo Fisher Scientific, Waltham, MA | 13-400-518 | ||
| Nikon, Japan | Used for image acquisition | ||
| 3M, St Paul, MN | Carrier Oil | ||
| Thermo Fisher Scientific, Waltham, MA | R37605 | Blue fluorescent live cell stain (DAPI) | |
| IDEX Health & Science, Oak Harbor, WA | P-881 | PEEK fittings | |
| Sigma-Aldrich, Oakville, ON | 806552 | ||
| Dow Corning, Midland, MI | |||
| ThinkyUSA, CA, USA | ARV 310 | ||
| Ihc world, Maryland, USA | IW-125-0 | ||
| Zinsser NA, Northridge, CA | 2607808 | ||
| Cetoni GmbH, Korbussen, Germany | |||
| Sigma-Aldrich, Oakville, ON | 484431 | ||
| Bio-Rad, Mississauga, ON | 1861096 | ||
| Hitachi High-Technologies, Mississauga, ON | |||
| Nikon, Melville, NY | Inverted microscope | ||
| Nikon, Japan | |||
| Loctite | AA 352 |
Referanslar
- Teitell, M., Richardson, B. DNA methylation in the immune system. Clinical Immunology. 109 (1), 2-5 (2003).
- Suarez-Alvarez, B., Rodriguez, R. M., Fraga, M. F., López-Larrea, C. DNA methylation: A promising landscape for immune system-related diseases. Trends in Genetics. 28 (10), 506-514 (2012).
- Suárez-Álvarez, B., Raneros, A. B., Ortega, F., López-Larrea, C. Epigenetic modulation of the immune function: A potential target for tolerance. Epigenetics. 8 (7), 694-702 (2013).
- Kondilis-Mangum, H. D., Wade, P. A. Epigenetics and the adaptive immune response. Molecular Aspects of Medicine. 34 (4), 813-825 (2013).
- Zouali, M. . The Autoimmune Diseases. , (2014).
- Wiencke, J. K., et al. A comparison of DNA methylation specific droplet digital PCR (mdPCR) and real time qPCR with flow cytometry in characterizing human T cells in peripheral blood. Epigenetics. 9 (10), 1360-1365 (2014).
- Hindson, B. J., et al. High-throughput droplet digital PCR system for absolute quantitation of DNA copy number. Analytical Chemistry. 83 (22), 8604-8610 (2011).
- Pinheiro, L. B., et al. Evaluation of a droplet digital polymerase chain reaction format for DNA copy number quantification. Analytical Chemistry. 84 (2), 1003-1011 (2012).
- Roy, E., Galas, J. C., Veres, T. Thermoplastic elastomers for microfluidics: Towards a high-throughput fabrication method of multilayered microfluidic devices. Lab on a Chip. 11 (18), 3193-3196 (2011).
- Roy, E., et al. From cellular lysis to microarray detection, an integrated thermoplastic elastomer (TPE) point of care Lab on a Disc. Lab on a Chip. 15 (2), 406-416 (2015).
- Malic, L., et al. Epigenetic subtyping of white blood cells using a thermoplastic elastomer-based microfluidic emulsification device for multiplexed, methylation-specific digital droplet PCR. Analyst. 44 (22), 6541-6553 (2019).
- Malic, L., et al. Polymer-based microfluidic chip for rapid and efficient immunomagnetic capture and release of Listeria monocytogenes. Lab Chip. 15 (20), 3994-4007 (2015).
- Malic, L., Morton, K., Clime, L., Veres, T. All-thermoplastic nanoplasmonic microfluidic device for transmission SPR biosensing. Lab Chip. 13 (5), 798-810 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır