このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
経皮的僧帽弁修復時のエコー誘導のステップワイズアプローチ
要約
このプロトコルは経カテーテル僧帽弁修理の間にリアルタイムの心エコーの指導を行う方法を詳しく示す。基本的な見解と必要な測定値は、手順の各段階について説明されています。
要約
僧帽弁の経皮経皮的な経カテーテルの端から端への再建は、外科的リスクの高い患者における重度の症候性僧帽弁逆流に対する安全で確立された治療法である。透視法に加えて心エコーのガイダンスは、標準であり、標準化された技術を使用して行われるべきである。
この記事では、ビュー、測定、および手順中に発生する可能性のある困難を強調するステップエコーカルディオガイドによる再現可能なステップを説明します。
この記事では、手順の各ステップ、特に2Dと3Dイメージングの間の好みについて、詳細で時系列の心エコービューを提供します。必要に応じて、脈波、連続波および色ドップラー測定が記載される。さらに、経皮的エッジツーエッジ修復手順の間に僧帽弁逆流の定量化に関する公式な勧告がないため、僧帽リーフレットとデバイス展開後の心エコー定量のためのアドバイスも含まれています。さらに、この記事では、処置中に合併症の可能性を予防し、対処するための重要な心エコービューを扱っています。
経カテーテル僧帽弁修復中の心エコーガイダンスは必須です。構造化されたアプローチは、介入者とイメージャーのコラボレーションを改善し、安全で効果的な手順のために不可欠です。
概要
僧帽弁逆流(MR)は、ヨーロッパで弁の手術のための2番目に頻繁な適応症である 1.治療を受けていないと、重度の心不全や生活の質が低下する可能性があります2,3,4.経皮的僧帽弁修復(PMVR)はカテーテルベースの技術であり、A2とP2ホタテ5を接続して僧帽修復するアルフィエリステッチの外科方法を模倣する。高い外科的リスクを有する患者に対して、この技術は、重度のMR.いくつかのレジストリからのデータを治療するための低侵襲的アプローチを提供し、試験は、MitraClip手順、経カテーテル僧帽弁修復療法、効果的かつ安全な方法6、7、8、9であることを示している。2019年には、同様の装置であるPASCAL経カテーテル弁修理システムが市場に導入されました。これは、重症MR10患者の治療における実現可能性と許容可能な安全性を示している。PMVRの持続時間と成功は、個々のオペレータのスキルと経験11に依存します。透視検査のみで行うことができる経皮的経弁置換術(TAVR)のような他の経皮的技術とは対照的に、PMVRは心エコーガイダンス12、13を必要とする。
この記事では、測定、MRの手続き内定量化の提案、手順ごとの合併症を防ぐための重要な見解など、PMVR中の心エコーのアプローチを段階的に説明します。
Access restricted. Please log in or start a trial to view this content.
プロトコル
このプロトコルは、当社の機関の人間研究倫理委員会のガイドラインに従っています。
1. 介入前の評価
- 経中隔穿刺前の心膜滲出を除外する。小さい心膜滲出液が存在する場合、右心室(RV)、中食右心室流出図、および長軸(LAX)ビューに焦点を当てた4チャンバー(4Ch)ビューの最大エンド拡張期エコールセント空間を測定する。
- 左上肺静脈(LUPV)の脈波ドップラー(PW)を用いて肺静脈流れパターンを評価し、左心房付属物(LAA)の血栓形成を除外する。LAAに焦点を当てた短軸(SAX)ビューを表示し、40〜60°でスイープし、プローブを反時計回りに回転させてLUPVを表示します。右上肺静脈(RUPV)の流れを90~110°で掃引して評価する(図1および補足図1)。
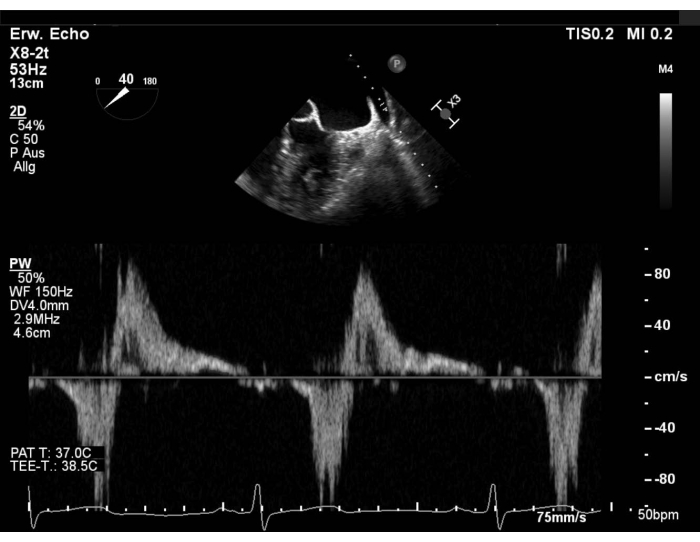
図1: 修正されたSAXビュー: 左上肺静脈のPWフロー この図の大きなバージョンを表示するには、ここをクリックしてください.
- 手順前および手続き後の評価中に、血行力学的状態が同じであることを確認します。
注:MRは動的弁疾患であるため、逆流は全身麻酔下でそれほど重症ではないようです。この場合、オペレータに相談し、後負荷やプリロードを増やしてください。 - 最高の通信間ビュー(50〜70°)を見つけます。カラードップラーの有無にかかわらず、3つのセグメントで垂直なビュー(X平面)を取り、後部僧帽リーフレット(PML)の長さを測定します。次に、リーフレットの形態を再度確認します(図2と補足図2)。

図2:色ドップラーを持つMVの2Dバイプラナービュー:内側不全ジェット この図のより大きなバージョンを表示するには、ここをクリックしてください。
- 長い軸のビュー(120-140°)の連続波ドップラー(CW)を用いて、透過性圧力勾配を評価します。
注: 平均圧力勾配 (MPG) > 5 mmHg は PMVR の相対的な禁忌です。 - カラードップラーまたはワイドセクターズーム画像を持つ3Dデータセットをカラーで取り、3D-vena contracta(3D-VCA)を測定します(図3)。
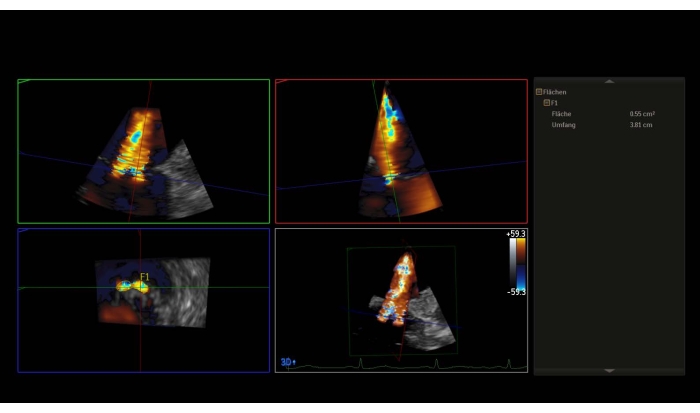
図3:色ドップラーを持つ3Dデータセットのマルチプラナ再構築:3D-Vena contracta この図のより大きなバージョンを表示するには、ここをクリックしてください。
- 色を使用しない場合、3D ボリュームを使用して僧帽弁領域(MVA)を測定します(補足図 3)。
注:4cm2<領域は相対的な禁忌であり、3cm2<の領域は、手順を実行するための絶対的な禁忌です。それ以外の場合は、経胃基底SAXビューでMVAを評価します。 - 僧帽弁の3Dエンフェイス手術心房図(12時の大動脈弁)を表示する。
注: バルブのセグメントは、セグメント 1 の場合は「横」、セグメント 3 の「内側」という名前が付けられます。エンフェイス外科ビューにおけるセグメントの配列は、コミュラルビューにおける配列に反する。3Dエンフェイスの外科ビュー(6時の大動脈弁)に180°時計回りに回転を行うと、両方のビューで等しいシーケンスのセグメントが得られます(図4および図5)。
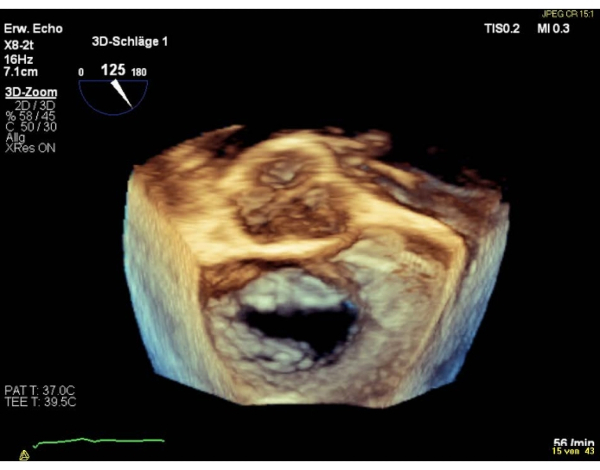
図4:ワイドセクターズーム画像:3D en-face外科用心房ビュー(12時の大動脈弁) この図の大きなバージョンを表示するには、ここをクリックしてください。
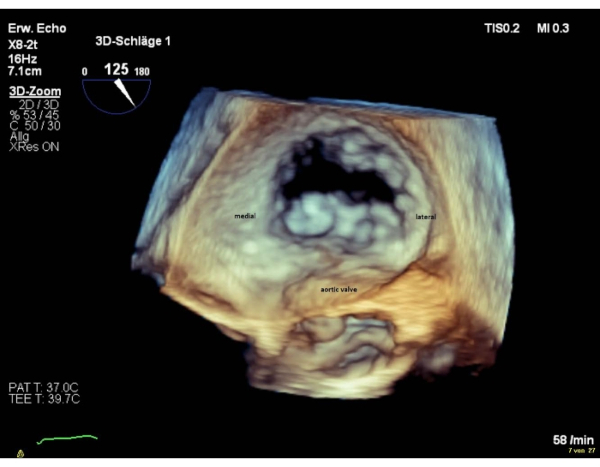
図5:ワイドセクターズーム画像:3Dの顔の心房ビュー(6時の大動脈弁) この図の大きなバージョンを表示するには、ここをクリックしてください。
- 最後に、X面で二大筋ビュー(90-110°)を取り、経皮穿刺に対して大動脈弁(AV)を示す。
2. 戦略
- ステアリングガイドカテーテル(SGC)とクリップデリバリーシステム(CDS)を左心房に挿入する前に、オペレータと戦略について話し合ってください。
- オリフィスが幅1cm<場合は1つのデバイス戦略を評価し、オリフィスが円形の場合はクリップを逆流ジェットの真上に配置します。
- 大きな楕円または複数のジェットの場合、≥2クリップの注入を評価します。逆流オリフィスの内側を開始する装置を移植し、第2の装置の位置決めは、第1の装置が横方向に開始した後ではなく、この方法で移植された場合にしばしば容易である(補足図4)。
3. 経中隔穿刺
- SAX ビューと組み合わせた二大的ビューを表示します。大動脈損傷を避けるために、AVが目に見えるようにしてください。
- 穿刺部位がわずかに優れている、後部であることを確認してください(図6)。
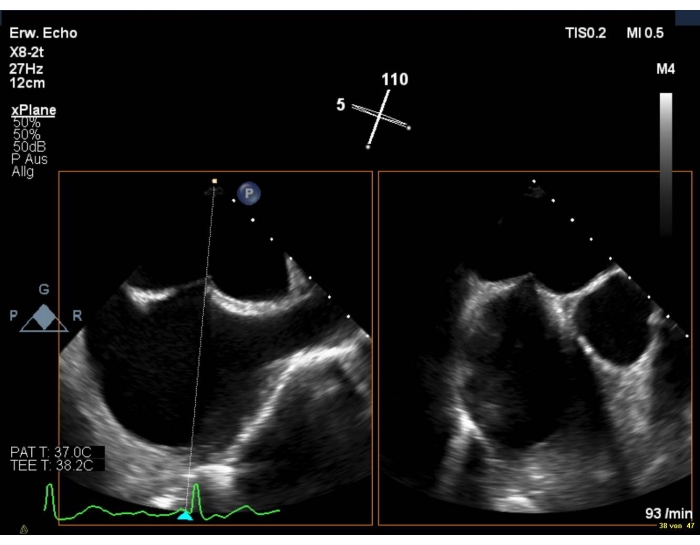
図6:2Dバイプラナービュー:経中隔穿刺 ここをクリックして、この図のより大きなバージョンを表示してください。
- 退行MR(例えば、脱出)の場合には4〜5cmの穿刺高さ、および機能的MRの>3.5を選択してください。
- 経中隔針が心房中隔のテンティングに繋がったら、収縮期の4Chビューで穿刺高さを測定する(補助図5)。
注:大きな心房を有する患者では、穿刺部位が後部である場合、テンティングは4Chビューで視覚化することができません。この場合、レトロフレックスと食道に深くプローブを挿入します。 - 経皮穿刺後、常に4Chビューで心膜滲出を除外する。
- LAAと肺静脈に焦点を当てたSAXビューを表示して、LUPVへの硬いガイドワイヤーの侵入を視覚化します。
4. LAへのSGCの導入
- 左心房壁への損傷を避けるために、連続的な2D心エコーと透視的ガイダンスを備えたSAXビューで、ディレーターによるSGCのテンティングと進歩を視覚化します。
注: SGC の先端は、放射不透明とエコー明るい二重リングによって定義されます (補助図 6)。 - 左心室(LV)の方向にSGCを配置するために、SAXビューとビカバルビュー(90-120°)をオペレータに表示します。
5. CDSのLAへの進出
- 心房中隔、左横尾根、MVを含む3D容積を取り、CDSの突起部が一般的であるため、左横尾根が見えるようにする(図7)。

図7:ワイドセクターズーム画像:LAのSGC(中隔、左横尾根、MVを含む) は、この図のより大きなバージョンを表示するにはここをクリックしてください。
- それ以外の場合は、SAX ビューと LAX ビュー(X 平面)を選択して、CDS がリッジと LA 壁と接触していないことを確認します。
注:オペレータは、イメージャーに対して、心間隔壁を表示し、SGCを数ミリメートル引き戻して尾根をバイパスするように依頼することができます。3D のダブルリングを視覚化できない場合は、2D に切り替えて SAX ビューに SGC を表示します。
- 正確な軌道を保証するために、CDS がコアプテーション線に垂直に配置されていることを確認します。
- CA. 60°で 2D で通信間ビューを表示して、内側 - 横面と LAX ビューを 120-140° で表示して、MVの前 - 後面を識別します (補足図 7)。
- あるいは、3DエンフェイスビューでCDSの内側、側面、前部、および後方位置を最適化する(補足図8)。
6. MVの上下のデバイスの向き
- 3D の面表示を使用して、コアプテーション ラインに対する腕の垂直位置を表示します。
- 画質が悪い場合は、LAX ビューと組み合わせた通信間ビューを表示します (図 8および図 9)。
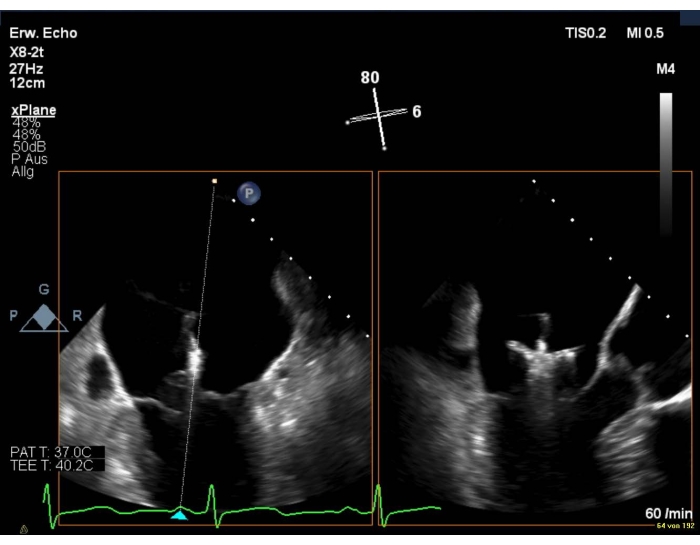
図8:MVの2Dバイプラナービュー:僧帽弁の上にデバイスの位置を配置 するには、この図のより大きなバージョンを表示するには、ここをクリックしてください。
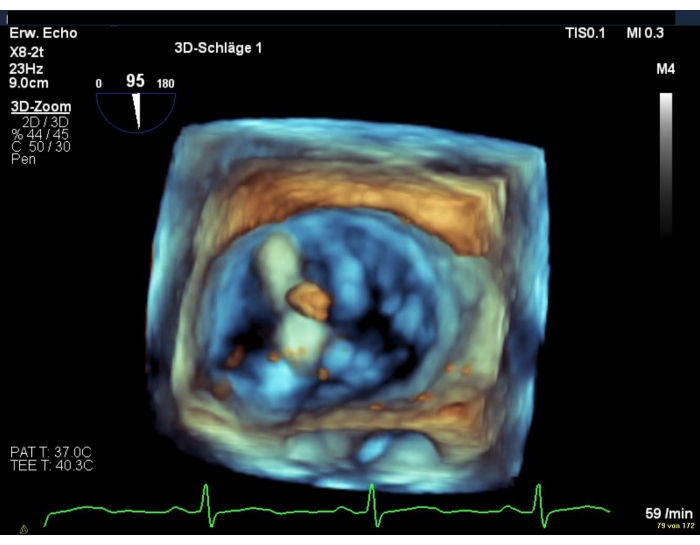
図9:ワイドセクターズーム画像:僧帽弁の上にデバイスの位置を指定 するには、この図の大きなバージョンを表示するには、ここをクリックしてください。
注: クリップアームは LAX ビューでのみ表示されます。
- 内側と横に配置されたデバイスの相互視点角を調整して、両腕の全長を視覚化します。内側位置付けデバイスの場合は30~45°、横に配置されたデバイス用のca. 70~90°でスイープします。
- LAXビューと組み合わせた通信間ビューを選択して、CDSのLVへの進出を視覚化します。
- CDSがMVのほんの数ミリメートル下に配置されていることを確認します。
- 3D エンフェイスビューで、バルブを横切る間のクリップの回転が頻繁に行われるため、クリップアームが計画された位置に残っていることを確認します。
注: クリップアームの位置が変更された場合、左右対称の把握を得るために時計回りまたは反時計回りの回転が実行されます。この操縦の間に、弦と脊節の絡み合いを最小限に抑えるように注意してください。 - デバイスの大きな方向を変更する必要がある場合は、X平面で通信間ビューを表示して、LA に取得されるクリップの反転を視覚化します。
7. クリップ展開前後の僧帽弁リーフレットの把握とMRの評価
- LAX ビュー(X 平面)と組み合わせた通信間ビューまたは LAX ビューのみでリーフレットの把握を記録します (補助図 9)。
- 麻酔科医に、換気中のシフトを減らし、リーフレットの把握を容易にするために、息を止める操縦を行うよう依頼してください。
- リーフレットや脊索の転がりを避けるために、リーフレット挿入の継続的な視覚化を確保します。
注:ロールされたリーフレットまたはコーダをつかむと、部分的なリーフレットの剥離やMRの悪化が生じる場合があります。 - クリップ展開前に逆流低減を慎重に評価します。オペレータとイメージャーの両方がこの重要なステップを分析することを確認してください。
- TEEプローブを内側に横方向に回転させるか、カラードップラー付きのXプレーンを使用してクリップの近くでエキセントリックジェットを見つけます(補足図10)。
注: MR の CDS の過小評価によって発生するシャドウアーティファクトが原因で発生する可能性があります。プローブを食道に深く挿入するか、経胃ビューを表示して、アーティファクトを影付けすることなく残りの不全ジェットを視覚化します。 - 肺静脈のPW流れを評価する。
注: 以前の収縮期流の反転が収縮期優位パターンに変化した場合、おそらく関連する減少が起こりました。 - 僧帽弁を横切ってMPGを測定します。
注: 5 mmHg >勾配は、クリップ展開の相対的な禁忌です (補足図 11および補足図 12)。 - MV の 3D エンフェース ビューまたは MV の経胃 SAX ビューを使用して、二重オリフィスを表示します (図 10)。
- TEEプローブを内側に横方向に回転させるか、カラードップラー付きのXプレーンを使用してクリップの近くでエキセントリックジェットを見つけます(補足図10)。

図10:ワイドセクターズームイメージ:デバイス展開後のMVの二重オリフィス この図の大きなバージョンを表示するには、ここをクリックしてください。
- 最後に、結果が満足のいく場合は、2Dでリーフレットの挿入を確認します。
- CDS からクリップを放した後、最後の 5 つの手順を繰り返します。
メモ:MV上のシステムの張力のために、デバイスを解放した後の残留不全ジェットが悪化する可能性があります。 - X面とのLAXビューでSGCから送達カテーテル先端が取り出された場合を示し、スパイクがLAとの接触を避けることを確認する(補足図13)。
8. 最終MR評価
- 存在する場合は、残留不全ジェットで垂直X面と組み合わせて色ドップラーとの相互のビューを表示します。
- 3D-VCA を 3D ボリュームで計算します。注: 通常、オリフィスは同じ平面にありません。この場合、適切な平面内の各オリフィスの分離された平面を測定する(補助図14)。
- もう一度肺静脈の流れと僧帽弁を横切る平均勾配を評価します。
注:連続的なLA圧力モニタリングは経カテーテル僧帽弁の修理の間に有用な用具かもしれない。 - 最後に、僧帽弁の3Dエンフェイスビューを表示します。
9. 追加装置の移植
- MR 削減が十分であることを確認します。
注:結果が満足できない場合は、追加のデバイスの移植を評価してください。 - 追加のデバイスが左心室に飛び込む埋め込みデバイスに接触しないことを確認します。
注:クリップ間の実際の距離を示すためには、透視検査が不可欠です。 - 最初のクリップの埋め込み後に遅延する可能性があるため、3D en-face ビューを表示して、コミュラル ラインを視覚化します。
- ポイント7.4で説明した5つのステップを繰り返して、追加のクリップでリーフレットをつかんだ後にMRを評価します。
Access restricted. Please log in or start a trial to view this content.
結果
経皮的な端から端への弁の修理は、症候性の重篤なMRを有する手術の対象外の患者における外科弁の修復または置換に代わるものである。MitraClipの最初の臨床応用は、血管内弁エッジツーエッジ修復研究I(EVERESTI)14試験で調査された。他の多くの試験は、症状の改善だけでなく、病院の死亡率および有害事象(アクセスEU、TRAMI、EVERESTII)15、16、17
Access restricted. Please log in or start a trial to view this content.
ディスカッション
PMVRのエコーガイダンスは安全な方法です。心エコー検査による合併症は起こり得るが、重大な損傷を引き起こすことはほとんどない。それにもかかわらず、食道病変は経食道心エコー検査を行った後に可能である。この発生率は、介入34の短い期間で減少する。それどころか、経カテーテルのエッジツーエッジ僧帽弁修復に関連するいくつかの合併症は、35,36
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは開示するものは何もない。
謝辞
ドロテア・シューレン氏の技術ビデオサポートに感謝します。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| EPIQ 7 Ultrasound System | Philips | US218B0542 | Cardiac Ultrasound Machine |
| X8-2t xMATRIX 3D-TEE probe | Philips | B34YYK | TEE-probe |
| Sheath 6F 25 cm | Merit Medical | B60N25AQ | Sheath |
| Dilator 16 F | Abbott | 405544 | Dilator |
| BRK-1 transseptal needle 71 cm | St. Jude Medical | ABVA407201 | Transseptal Needle |
| Swartz Lamp 90° | St. Jude Medical | 407356 | Transseptal Guiding Introducer Sheath |
| Amplatz super stiff | Kook Medical | 46509 | Wire |
| Steerable Guide Catheter | Abbott | SGC0302 | Steerable Guide Catheter |
| MitraClip NTR Delivery System | Abbott | CDS0602-NTR | Clip Delivery System |
| MitraClip NTR Bundle | Abbott | MSK0602-NTR | Device |
参考文献
- Iung, B., et al. A prospective survey of patients with valvular heart disease in Europe: The Euro Heart Survey on Valvular Heart Disease. European Heart Journal. 24 (13), 1231-1243 (2003).
- Hauptman, P. J., Rector, T. S., Wentworth, D., Kubo, S. Quality of life in advanced heart failure: role of mitral regurgitation. American Heart Journal. 151 (1), 213-218 (2006).
- Lewis, E. F. Assessing the impact of heart failure therapeutics on quality of life and functional capacity. Current Treatment Options in Cardiovascular Medicine. 15 (4), 425-436 (2013).
- Vaishnava, P., Lewis, E. F. Assessment of quality of life in severe heart failure. Current Heart Failure Reports. 4 (3), 170-177 (2007).
- Feldman, T., et al. Percutaneous repair or surgery for mitral regurgitation. New England Journal of Medicine. 364 (15), 1395-1406 (2011).
- Feldman, T., et al. Percutaneous mitral repair with the MitraClip system: safety and midterm durability in the initial EVEREST (Endovascular Valve Edge-to-Edge REpair Study) cohort. Journal of the American College of Cardiology. 54 (8), 686-694 (2009).
- Whitlow, P. L., et al. Acute and 12-month results with catheter-based mitral valve leaflet repair: the EVEREST II (Endovascular Valve Edge-to-Edge Repair) High Risk Study. Journal of the American College of Cardiology. 59 (2), 130-139 (2012).
- Baldus, S., et al. MitraClip therapy in daily clinical practice: initial results from the German transcatheter mitral valve interventions (TRAMI) registry. European Journal of Heart Failure. 14 (9), 1050-1055 (2012).
- Stone, G. W., et al. Transcatheter Mitral-Valve Repair in Patients with Heart Failure. New England Journal of Medicine. 379 (24), 2307-2318 (2018).
- Lim, D. S., et al. Transcatheter Valve Repair for Patients With Mitral Regurgitation: 30-Day Results of the CLASP Study. JACC: Cardiovascular Interventions. 12 (14), 1369-1378 (2019).
- Schillinger, W., et al. Impact of the learning curve on outcomes after percutaneous mitral valve repair with MitraClip and lessons learned after the first 75 consecutive patients. European Journal of Heart Failure. 13 (12), 1331-1339 (2011).
- Katz, W. E., Conrad Smith, A. J., Crock, F. W., Cavalcante, J. L. Echocardiographic evaluation and guidance for MitraClip procedure. Cardiovascular Diagnosis and Therapy. 7 (6), 616-632 (2017).
- Altiok, E., et al. Optimized guidance of percutaneous edge-to edge repair of the mitral valve using real-time 3-D transesophageal echocardiography. Clinical Research in Cardiology. 100 (8), 675-681 (2011).
- Feldman, T., et al. Percutaneous mitral valve repair using the edge-to-edge technique: six-month results of the EVEREST Phase I Clinical Trial. Journal of the American College of Cardiology. 46 (11), 2134-2140 (2005).
- Maisano, F., et al. Percutaneous mitral valve interventions in the real world: early and 1-year results from the ACCESS-EU, a prospective, multicenter, nonrandomized post-approval study of the MitraClip therapy in Europe. Journal of the American College of Cardiology. 62 (12), 1052-1061 (2013).
- Kalbacher, D., et al. Long-term outcome, survival and predictors of mortality after MitraClip therapy: Results from the German Transcatheter Mitral Valve Interventions (TRAMI) registry. International Journal of Cardiology. 277, 35-41 (2019).
- Glower, D. D., et al. Percutaneous mitral valve repair for mitral regurgitation in high-risk patients: results of the EVEREST II study. Journal of the American College of Cardiology. 64 (2), 172-181 (2014).
- Baumgartner, H., et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. European Heart Journal. 38 (36), 2739-2791 (2017).
- Obadia, J. F., et al. MITRA-FR Investigators. Percutaneous Repair or Medical Treatment for Secondary Mitral Regurgitation. New England Journal of Medicine. 379 (24), 2297-2306 (2018).
- Stone, G. W., et al. COAPT Investigators. Transcatheter Mitral-Valve Repair in Patients with Heart Failure. New England Journal of Medicine. 379 (24), 2307-2318 (2018).
- Vahanian, A., et al. Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC); European Association for Cardio-Thoracic Surgery (EACTS), Guidelines on the management of valvular heart disease (version 2012). European Heart Journal. 33 (19), 2451-2496 (2012).
- American College of Cardiology/American Heart Association Task Force on Practice Guidelines; Society of Cardiovascular Anesthesiologists; Society for Cardiovascular Angiography and Interventions. ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 114 (5), 84(2006).
- Praz, F., et al. Compassionate use of the PASCAL transcatheter mitral valve repair system for patients with severe mitral regurgitation: a multicentre, prospective, observational, first-in-man study. Lancet. 390 (10096), 773-780 (2017).
- McCarthy, K. P., Ring, L., Rana, B. S. Anatomy of the mitral valve: understanding the mitral valve complex in mitral regurgitation. European Journal of Echocardiography. 11 (10), 3-9 (2010).
- Zoghbi, W. A., et al. Recommendations for Noninvasive Evaluation of Native Valvular Regurgitation: A Report from the American Society of Echocardiography Developed in Collaboration with the Society for Cardiovascular Magnetic Resonance. Journal of the American Society of Echocardiography. 30 (4), 303-371 (2017).
- Zoghbi, W. A., et al. Guidelines for the Evaluation of Valvular Regurgitation Percutaneous Valve Repair or Replacement: A Report from the American Society of Echocardiography Developed in Collaboration with the Society for Cardiovascular Angiography and Interventions, Japanese Society of Echocardiography, and Society for Cardiovascular Magnetic Resonance. Journal of the American Society of Echocardiography. 32 (4), 431-475 (2019).
- Abudiab, M. M., Chao, C. J., Liu, S., Naqvi, T. Z. Quantitation of valve regurgitation severity by three-dimensional vena contracta area is superior to flow convergence method of quantitation on transesophageal echocardiography. Echocardiography. 34 (7), 992-1001 (2017).
- Dietl, A., et al. 3D vena contracta area after MitraClip procedure: precise quantification of residual mitral regurgitation and identification of prognostic information. Cardiovasc Ultrasound. 16 (1), 1(2018).
- Ikenaga, H., et al. Usefulness of Intraprocedural Pulmonary Venous Flow for Predicting Recurrent Mitral Regurgitation and Clinical Outcomes After Percutaneous Mitral Valve Repair With the MitraClip. JACC: Cardiovascular Interventions. 12 (2), 140-150 (2019).
- Tang, G. H. L., et al. Continuous invasive hemodynamic monitoring using steerable guide catheter to optimize mitraclip transcatheter mitral valve repair: A multicenter, proof-of-concept study. Journal of Interventional Cardiology. 31 (6), 907-915 (2018).
- Maor, E., et al. Acute Changes in Left Atrial Pressure After MitraClip Are Associated With Improvement in 6-Minute Walk Distance. Circulation: Cardiovascular Interventions. 10 (4), 004856(2017).
- Kuwata, S., et al. Continuous Direct Left Atrial Pressure: Intraprocedural Measurement Predicts Clinical Response Following MitraClip Therapy. JACC: Cardiovascular Interventions. 12 (2), 127-136 (2019).
- Corrigan, F. E., et al. Pulmonary Venous Waveforms Predict Rehospitalization and Mortality After Percutaneous Mitral Valve Repair. JACC Cardiovasc Imaging. 12 (10), 1905-1913 (2019).
- Ruf, T. F., et al. ELMSTREET (Esophageal Lesions during MitraClip uSing TRansEsophageal Echocardiography Trial. EuroIntervention. 13 (12), 1444-1451 (2017).
- Eggebrecht, H., et al. Risk and outcomes of complications during and after MitraClip implantation: Experience in 828 patients from the German TRAnscatheter mitral valve interventions (TRAMI) registry. Catheterization and Cardiovascular Interventions. 86 (4), 728-735 (2015).
- von Bardeleben, R. S., et al. Incidence and in-hospital safety outcomes of patients undergoing percutaneous mitral valve edge-to-edge repair using MitraClip: five-year German national patient sample including 13,575 implants. EuroIntervention. 14 (17), 1725-1732 (2019).
- Généreux, P., et al. Incidence, predictors, and prognostic impact of late bleeding complications after transcatheter aortic valve replacement. Journal of the American College of Cardiology. 64 (24), 2605-2615 (2014).
- Benito-González, T., Estévez-Loureiro, R., Gualis, J. Chordal Rupture Following MitraClip Implantation Resulting in Massive Mitral Regurgitation. Journal of Invasive Cardiology. 27 (10), 224-225 (2015).
- Kaneko, H., Neuss, M., Weissenborn, J., Butter, C. Impact of residual mitral regurgitation after MitraClip implantation. International Journal of Cardiology. 227, 813-819 (2017).
- Buzzatti, N., et al. What is a "good" result after transcatheter mitral repair? Impact of 2+ residual mitral regurgitation. Journal of Thoracic and Cardiovascular Surgery. 151 (1), 88-96 (2016).
- Feldman, T., Guerrero, M. Assessing the Balance Between Less Mitral Regurgitation and More Residual Transmitral Pressure Gradient After MitraClip. JACC: Cardiovascular Interventions. 10 (9), 940-941 (2017).
- Neuss, M., et al. Elevated Mitral Valve Pressure Gradient After MitraClip Implantation Deteriorates Long-Term Outcome in Patients With Severe Mitral Regurgitation and Severe Failure. JACC: Cardiovascular Interventions. 10 (9), 931-939 (2017).
- Katz, W. E., Conrad Smith, A. J., Crock, F. W., Cavalcante, J. L. Echocardiographic evaluation and guidance for MitraClip procedure. Cardiovascular Diagnosis and Therapy. 7 (6), 616-632 (2017).
- Labrousse, L., et al. Guidance of the MitraClip procedure by 2D and 3D imaging. Archives of Cardiovascular Diseases. 111 (6-7), 432-440 (2018).
- Khalique, O. K., Hahn, R. T. Percutaneous Mitral Valve Repair: Multi-Modality Cardiac Imaging for Patient Selection and Intra-Procedural Guidance. Frontiers in Cardiovascular Medicine. 6, 142(2019).
- Bushari, L. I., et al. Percutaneous Transcatheter Edge-to-Edge MitraClip Technique: A Practical "Step-by-Step" 3-Dimensional Transesophageal Echocardiography Guide. Mayo Clinic Proceedings. 94 (1), 89-102 (2019).
- Sherif, M. A., et al. MitraClip step by step; how to simplify the procedure. Netherlands Heart Journal. 25 (2), 125(2017).
- Guarracino, F., et al. Transesophageal echocardiography during MitraClip procedure. Anesthesia & Analgesia. 118 (6), 1188-1196 (2014).
- Avenatti, E., et al. Diagnostic Value of 3-Dimensional Vena Contracta Area for the Quantification of Residual Mitral Regurgitation After MitraClip Procedure. JACC: Cardiovascular Interventions. 12 (6), 582-591 (2019).
- Altiok, E., et al. Analysis of procedural effects of percutaneous edge-to-edge mitral valve repair by 2D and 3D echocardiography. Circulation: Cardiovascular Imaging. 5 (6), 748-755 (2012).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved