Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein vereinfachter schrittweiser Ansatz zur Echoführung während der perkutanen Mitralklappenreparatur
In diesem Artikel
Zusammenfassung
Dieses Protokoll zeigt detailliert, wie eine echokardiographische Echtzeitführung während der Transkatheter-Mitralklappenreparatur durchgeführt werden kann. Die grundlegenden Ansichten und die notwendigen Messungen werden für jede Phase des Verfahrens beschrieben.
Zusammenfassung
Die perkutane Transkatheter-Kanten-zu-Rand-Rekonstruktion der Mitralklappe ist eine sichere und etablierte Therapie für schwere symptomatische Mitralinsuffizienz bei Patienten mit hohem Operationsrisiko. Die echokardiographische Führung zusätzlich zur Fluoroskopie ist der Goldstandard und sollte mit einer standardisierten Technik durchgeführt werden.
Dieser Artikel besteht in unserer reproduzierbaren Schritt-für-Schritt-Echokardiographie-Anleitung mit Ansichten, Messungen sowie der Hervorhebung möglicher Schwierigkeiten, die während des Eingriffs auftreten können.
Dieser Artikel bietet detaillierte und chronologische echokardiographische Ansichten für jeden Schritt des Verfahrens, insbesondere Präferenzen zwischen 2D- und 3D-Bildgebung. Bei Bedarf werden Pulswellen-, Dauerwellen- und Farbdopplermessungen beschrieben. Da es darüber hinaus keine offiziellen Empfehlungen für die Quantifizierung der Mitralinsuffizienz während des perkutanen Edge-to-Edge-Reparaturverfahrens gibt, sind auch Ratschläge zur echokardiographischen Quantifizierung nach dem Greifen der Mitralblättchen und nach dem Geräteeinsatz enthalten. Darüber hinaus befasst sich der Artikel mit wichtigen echokardiographischen Ansichten, um mögliche Komplikationen während des Eingriffs zu verhindern und zu behandeln.
Echokardiographische Führung während der Transkatheter-Mitralklappenreparatur ist obligatorisch. Ein strukturiertes Vorgehen verbessert die Zusammenarbeit zwischen Interventionist und Imager und ist für ein sicheres und effektives Vorgehen unerlässlich.
Einleitung
Mitralinsuffizienz (MR) ist die zweithäufigste Indikation für Klappenchirurgie in Europa1. Unbehandelt kann es zu schwerer Herzinsuffizienz und verminderter Lebensqualität führen2,3,4. Die perkutane Mitralklappenreparatur (PMVR) ist eine katheterbasierte Technik, die die Alfieri-Stich-Operationsmethode zur Mitralreparatur nachahmt, indem die A2- und P2-Jakobsmuscheln5verbunden werden. Für Patienten mit hohem Operationsrisiko bietet diese Technik einen minimalinvasiven Ansatz zur Behandlung schwerer MR. Daten aus mehreren Registern und Studien haben gezeigt, dass das MitraClip-Verfahren, eine Transkatheter-Mitralklappenreparaturtherapie, eine wirksame und sichere Methode ist6,7,8,9. Im Jahr 2019 wurde ein ähnliches Gerät, das PASCAL Transkatheterventil-Reparatursystem, auf den Markt gebracht. Es hat Machbarkeit und akzeptable Sicherheit bei der Behandlung von Patienten mit schwerem MR10gezeigt. Die Dauer und der Erfolg des PMVR hängen von den Fähigkeiten und Erfahrungen des einzelnen Bedienersab 11. Im Gegensatz zu anderen perkutanen Techniken, wie dem perkutanen transvalvulären Ersatz (TAVR), der nur mit Fluoroskopie durchgeführt werden kann, erfordert PMVR eine echokardiographische Führung12,13.
Dieser Artikel beschreibt Schritt für Schritt den echokardiographischen Ansatz während der PMVR, einschließlich Messungen, Vorschlägen zur intraprozeduralen Quantifizierung der MR und wichtigen Ansichten zur Vermeidung periprozeduraler Komplikationen.
Protokoll
Das Protokoll folgt den Richtlinien der Ethikkommission für Humanforschung unserer Institution.
1. Bewertung vor der Intervention
- Perikarderguss vor der transseptalen Punktion ausschließen. Wenn ein kleiner Perikarderguss vorhanden ist, messen Sie den maximalen enddiastolischen echoluzenten Raum in einer Vierkammeransicht (4Ch) mit Fokus auf den rechten Ventrikel (RV), eine mittelösophageale rechtsventrikuläre Zufluss-Ausfluss-Ansicht und eine Langachsenansicht (LAX).
- Bewerten Sie das pulmonale venöse Strömungsmuster mit Pulswellendoppler (PW) in der linken oberen Lungenvene (LUPV) und schließen Sie die Thrombusbildung im linken Vorhofflied (LAA) aus. Zeigen Sie die Kurzachsenansicht (SAX) mit Fokus auf die LAA, streichen Sie dann um 40-60° und drehen Sie die Sonde gegen den Uhrzeigersinn, um den LUPV anzuzeigen. Beurteilen Sie den Fluss in der rechten oberen Lungenvene (RUPV) durch Kehren bei 90-110° (Abbildung 1 und ergänzende Abbildung 1).
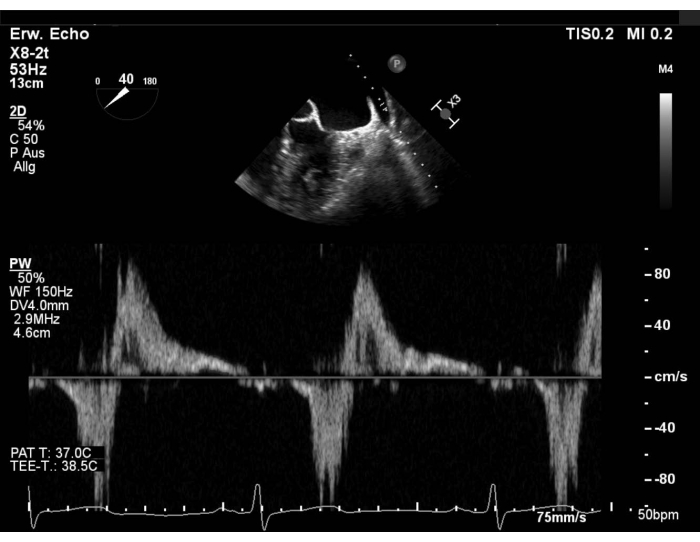
Abbildung 1: Modifizierte SAX-Ansicht: PW-Fluss in der linken oberen Lungenvene Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Stellen Sie sicher, dass der hämodynamische Zustand während der vor- und nachmodernen Bewertung gleich ist.
HINWEIS: DA MR eine dynamische Klappenerkrankung ist, kann Regurgitation unter Vollnarkose weniger schwerwiegend erscheinen. Konsultieren Sie in diesem Fall den Bediener und erhöhen Sie die Nach- und/oder Vorspannung. - Finden Sie die beste Intercommissural-Ansicht (50-70°). Nehmen Sie eine senkrechte Ansicht (X-Ebene) in den drei Segmenten mit und ohne Farbdoppler und messen Sie die Länge des hinteren Mitralblättchens (PML). Überprüfen Sie dann erneut die Morphologie der Packungsbeilage (Abbildung 2 und ergänzende Abbildung 2).

Abbildung 2: 2D biplanare Ansicht der MV mit Farbdoppler: medialer Insuffizienzstrahl Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Beurteilen Sie den Übertragungsdruckgradienten mit Dauerwellendoppler (CW) in der Langachsenansicht (120-140°).
HINWEIS: Ein mittlerer Druckgradient (MPG) > 5 mmHg ist eine relative Kontraindikation für PMVR. - Nehmen Sie einen 3D-Datensatz mit Farbdoppler oder ein Weitwinkel-Zoombild mit Farbe auf und messen Sie die 3D-Vena-Kontraktion (3D-VCA) (Abbildung 3).
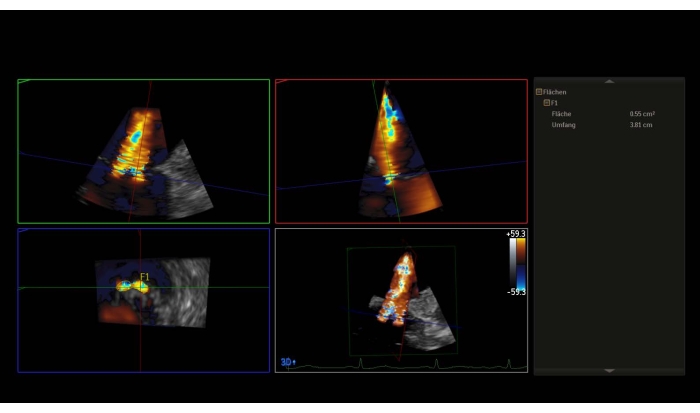
Abbildung 3: Multiplanare Rekonstruktion des 3D-Datensatzes mit Farbdoppler: 3D-Vena contracta Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Verwenden Sie ohne Farbe das 3D-Volumen, um die Mitralklappenfläche (MVA) zu messen (Ergänzende Abbildung 3).
HINWEIS: Eine Fläche < 4 cm2 ist eine relative Kontraindikation, eine Fläche < 3 cm2 eine absolute Kontraindikation für die Durchführung des Verfahrens. Ansonsten beurteilen Sie die MVA in der transgastrischen basalen SAX-Ansicht. - Zeigen Sie die chirurgische 3D-Vorhoffnungsansicht (Aortenklappe bei 12 Uhr) der Mitralklappe.
HINWEIS: Die Segmente des Ventils werden für die Segmente 1 "lateral" und für die Segmente 3 "medial" genannt. Die Reihenfolge der Segmente in der chirurgischen Ansicht ist umgekehrt zur Sequenz in der kommissuralen Ansicht. Führen Sie eine Drehung um 180° im Uhrzeigersinn in die chirurgische 3D-Ansicht (Aortenklappe bei 6 Uhr) durch, die zu einer gleichen Abfolge von Segmenten in beiden Ansichten führt (Abbildung 4 und Abbildung 5).
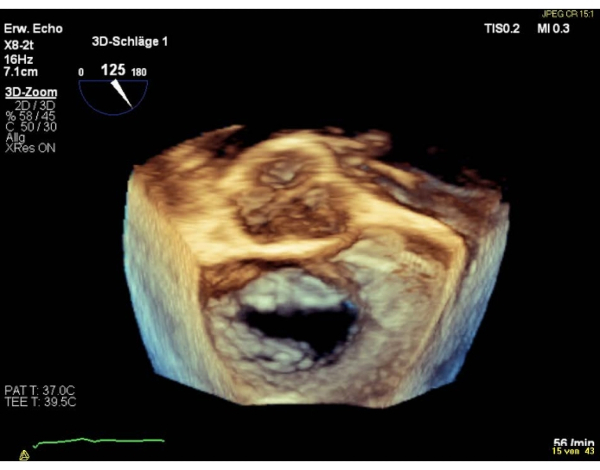
Abbildung 4: Wide Sector Zoom Bild: Chirurgische Vorhoffnungsansicht in 3D (Aortenklappe bei 12 Uhr) Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
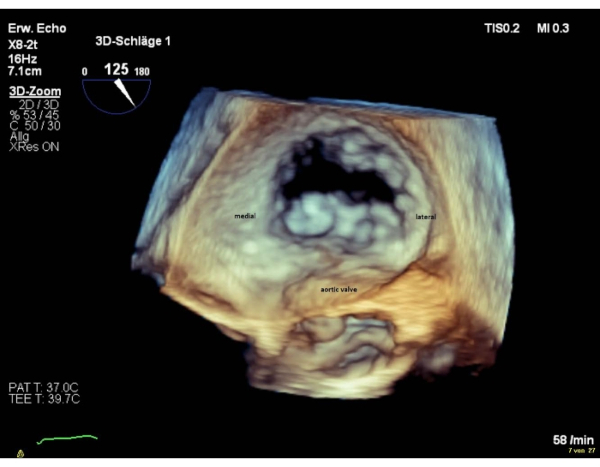
Abbildung 5: Wide Sector Zoom Bild: 3D en-face Vorraumansicht (Aortenklappe bei 6 Uhr) Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Nehmen Sie schließlich eine bicavale Ansicht (90-110°) mit X-Ebene, um die Aortenklappe (AV) für die transseptale Punktion zu zeigen.
2. Strategie
- Besprechen Sie die Strategie mit dem Bediener, bevor Sie den lenkbaren Führungskatheter (SGC) und das Clip-Delivery-System (CDS) in das linke Vorhof einführen.
- Bewerten Sie eine Ein-Geräte-Strategie, wenn die Öffnung < 1 cm breit ist, und positionieren Sie den Clip direkt über dem Aufstoßenstrahl, wenn die Öffnung kreisförmig ist.
- Bewerten Sie die Implantation von ≥ 2 Clips bei großen elliptischen oder mehreren Düsen. Implantieren Sie das Gerät medial von der Regurgitantenöffnung, da die Positionierung eines zweiten Geräts oft einfacher ist, wenn das erste auf diese Weise implantiert wurde, anstatt nach dem seitlichen Start (Ergänzende Abbildung 4).
3. Transseptale Punktion
- Zeigen Sie eine Bicaval-Ansicht in Kombination mit einer SAX-Ansicht an. Stellen Sie sicher, dass der AV sichtbar ist, um Aortenverletzungen zu vermeiden.
- Stellen Sie sicher, dass die Einstichstelle etwas überlegen und posterior ist (Abbildung 6).
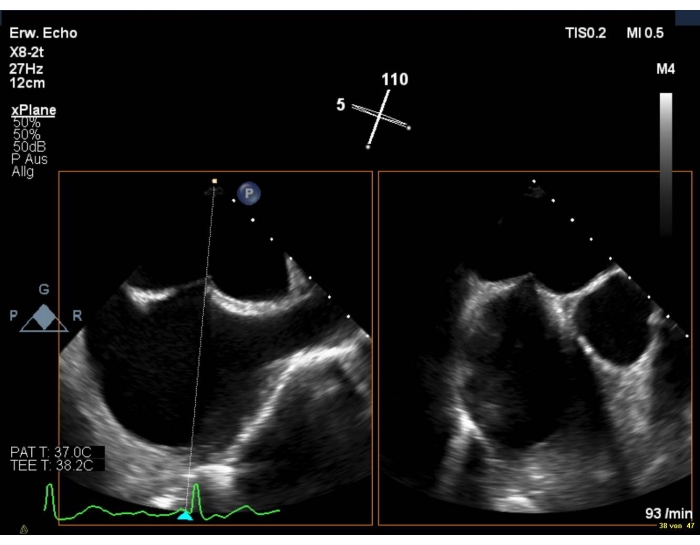
Abbildung 6: Biplanare 2D-Ansicht: transseptale Punktion Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Wählen Sie eine Punktionshöhe von 4-5 cm bei degenerativer MR (z.B. Prolaps) und von > 3,5 bei funktioneller MR. Vermeiden Sie ein patentiertes Foramen ovale, da der Eintrag viel zu vorder ist.
- Sobald die transseptale Nadel zum Zelten des interatrialen Septums führt, messen Sie die Punktionshöhe in der 4Ch-Ansicht in der mittleren Systole (Ergänzende Abbildung 5).
HINWEIS: Bei Patienten mit großen Vorhöfen kann das Zelt in der 4Ch-Ansicht nicht sichtbar gemacht werden, wenn die Einstichstelle zu hinter liegt. In diesem Fall retroflex und die Sonde tiefer in die Speiseröhre einführen. - Nach der transseptalen Punktion immer perikardialen Erguss in der 4Ch-Ansicht ausschließen.
- Zeigen Sie eine SAX-Ansicht mit Fokus auf laA und Lungenvene, um das Eindringen des steifen Führungsdrahtes in den LUPV zu visualisieren.
4. Einführung des SGC in die LA
- Visualisieren Sie das Zelten und Vorankommen des SGC mit dem Dilatator in einer SAX-Ansicht mit kontinuierlicher 2D-Echokardiographie und fluoroskopischer Führung, um Verletzungen an der linken Vorhoffwand zu vermeiden.
HINWEIS: Die Spitze des SGC wird durch einen röntgenbemalten und echohellen Doppelring definiert (Ergänzende Abbildung 6). - Zeigen Sie dem Bediener die SAX-Ansicht und die Bicaval-Ansicht (90-120°), um den SGC in Richtung des linken Ventrikels (LV) zu positionieren.
5. Weiterentwicklung des CDS in die LA
- Nehmen Sie ein 3D-Volumen einschließlich des Interatrialseptums, des linken Seitenkamms und des MV und stellen Sie sicher, dass der linke seitenförmige Grat sichtbar ist, da ein Vorsprung des CDS üblich ist (Abbildung 7).

Abbildung 7: Wide Sector Zoom Bild: SGC in der LA einschließlich des Interatrialseptums, des linken Seitenkamms und der MV Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Ansonsten wählen Sie die SAX-Ansicht und die LAX-Ansicht (X-Ebene), um sicherzustellen, dass das CDS keinen Kontakt mit dem Grat und der LA-Wand hat.
HINWEIS: Der Bediener kann den Imager bitten, das interatriale Septum anzuzeigen und den SGC einige Millimeter zurückzuziehen, um den Grat zu umgehen. Wenn der Doppelring in 3D nicht visualisiert werden kann, wechseln Sie zu 2D und zeigen Sie den SGC in der SAX-Ansicht an.
- Überprüfen Sie, ob das CDS senkrecht zur Koaptationslinie positioniert ist, um eine korrekte Flugbahn zu gewährleisten.
- Zeigen Sie die interkommissurale Ansicht in 2D bei ca. 60° zur Darstellung der medialen - seitlichen Ebene und die LAX-Ansicht bei 120-140° zur Identifizierung der vorderen - hinteren Ebene der MV (Ergänzende Abbildung 7).
- Alternativ können Sie die mediale, laterale, vordere und hintere Positionierung des CDS in der 3D-En-Face-Ansicht optimieren (Ergänzende Abbildung 8).
6. Ausrichtung des Gerätes über und unter dem MV
- Nehmen Sie die 3D-En-Face-Ansicht, um eine senkrechte Positionierung der Arme zur Koaptationslinie zu zeigen.
- Bei schlechter Bildqualität eine intercommissurale Ansicht in Kombination mit einer LAX-Ansicht zeigen (Abbildung 8 und Abbildung 9).
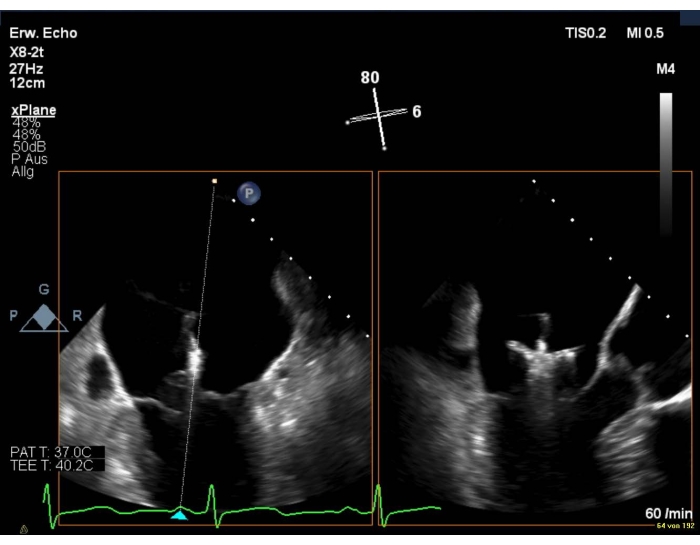
Abbildung 8: Biplanare 2D-Ansicht des MV: Positionierung des Geräts über dem Mitralventil Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
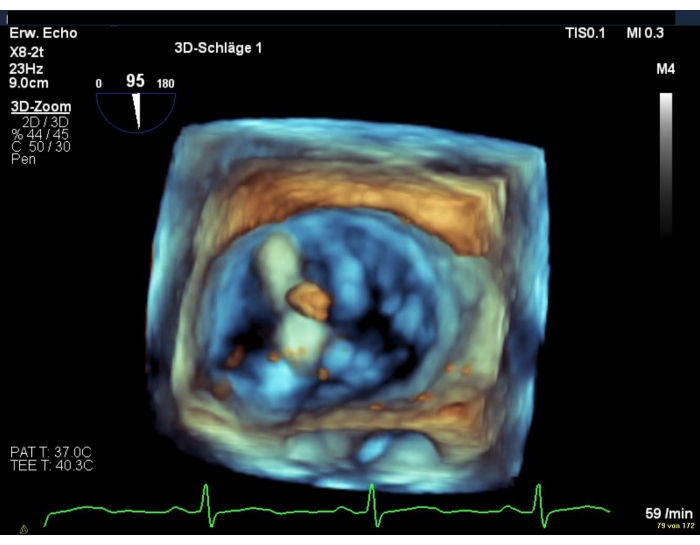
Abbildung 9: Wide Sector Zoom Bild: Positionierung des Geräts über dem Mitralventil Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
HINWEIS: Die Cliparme sind nur in der LAX-Ansicht sichtbar.
- Stellen Sie den intercommissuralen Blickwinkel für medial und seitlich positionierte Geräte ein, um die gesamte Länge beider Arme zu visualisieren. Sweep bei ca. 30-45° für medial positionierte Geräte und ca. 70-90° für seitlich positionierte Geräte.
- Wählen Sie die intercommissurale Ansicht in Kombination mit einer LAX-Ansicht, um das Vorrücken des CDS in das LV zu visualisieren.
- Stellen Sie sicher, dass das CDS nur wenige Millimeter unter dem MV platziert ist.
- Überprüfen Sie in der 3D-En-Face-Ansicht, dass sich die Cliparme noch in der geplanten Position befinden, da eine Drehung des Clips beim Überqueren des Ventils häufig ist.
HINWEIS: Wenn sich die Position der Cliparme geändert hat, wird eine Drehung im oder gegen den Uhrzeigersinn durchgeführt, um ein symmetrisches Greifen zu erhalten. Seien Sie bei diesem Manöver vorsichtig, um Akkord- und subchordale Verschränkungen zu minimieren. - Wenn eine grobe Neuausrichtung des Geräts erforderlich ist, zeigen Sie die interkommissurale Ansicht mit X-Ebene, um die Inversion des Clips zu visualisieren, der in den LA abgerufen wird.
7. Greifen der Mitralblättchen und Beurteilung der MR vor und nach dem Clipeinsatz
- Erfassen Sie das Greifen der Prospekte in der Intercommissuralansicht in Kombination mit der LAX-Ansicht (X-Ebene) oder nur in der LAX-Ansicht (Ergänzende Abbildung 9).
- Bitten Sie den Anästhesisten, ein Atemnotgriffmanöver durchzuführen, um das Verschieben während der Beatmung zu reduzieren und das Greifen der Blättchen zu erleichtern.
- Stellen Sie eine kontinuierliche Visualisierung des Einlegens der Packungsbeilage sicher, um ein Rollen der Blättchen oder der Chordae zu vermeiden.
HINWEIS: Das Greifen eines gerollten Blättchens oder einer Chorda kann zu einer teilweisen Ablösung der Blättchen und/oder einer Verschlimmerung der MR führen. - Bewerten Sie die Regurgitationsreduzierung vor der Clip-Bereitstellung sorgfältig. Stellen Sie sicher, dass sowohl Bediener als auch Imager diesen entscheidenden Schritt analysieren.
- Drehen Sie die TEE-Sonde medial und seitlich zum Clip oder verwenden Sie die X-Ebene mit Farbdoppler, um exzentrische Düsen in der Nähe des Clips zu finden (Ergänzende Abbildung 10).
HINWEIS: Aufgrund von Schattenartefakten, die durch das CDS verursacht werden, kann es zu einer Unterschätzung des MR kommen. Setzen Sie die Sonde tiefer in die Speiseröhre ein oder zeigen Sie die transgastrische Ansicht, um die verbleibenden Insuffizienzstrahlen zu visualisieren, ohne Artefakte zu beschatten. - Bewerten Sie den PW-Fluss in den Lungenvenen.
HINWEIS: Wenn sich eine vorherige systolische Flussumkehr in ein systolisches dominantes Muster verwandelt, ist wahrscheinlich eine relevante Reduktion aufgetreten. - Messen Sie das MPG über die Mitralklappe.
HINWEIS: Ein Gradient > 5 mmHg ist eine relative Kontraindikation für die Clip-Bereitstellung (Ergänzende Abbildung 11 und Ergänzende Abbildung 12). - Verwenden Sie die 3D-En-Face-Ansicht des MV oder eine transgastrische SAX-Ansicht des MV, um die Doppelöffnung anzuzeigen (Abbildung 10).
- Drehen Sie die TEE-Sonde medial und seitlich zum Clip oder verwenden Sie die X-Ebene mit Farbdoppler, um exzentrische Düsen in der Nähe des Clips zu finden (Ergänzende Abbildung 10).

Abbildung 10: Wide Sector Zoom Bild: doppelte Öffnung der MV nach Gerätebereitstellung Klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Schließlich, wenn das Ergebnis zufriedenstellend ist, überprüfen Sie das Einsetzen der Packungsbeilage in 2D.
- Nachdem Sie den Clip vom CDS freigegeben haben, wiederholen Sie die letzten fünf Schritte.
HINWEIS: Aufgrund der Spannung des Systems auf dem MV können sich die Restinsuffizienzdüsen nach dem Loslassen des Geräts verschlimmern. - Zeigen Sie an, wann die Lieferkatheterspitze in der LAX-Ansicht mit X-Ebene aus dem SGC entnommen wird, und stellen Sie sicher, dass die Spitze den Kontakt mit dem LA vermeidet (Ergänzende Abbildung 13).
8. Abschließende MR-Bewertung
- Zeigen Sie die Intercommissuralansicht mit Farbdoppler in Kombination mit senkrechten X-Ebenen in den Restinsuffizienzdüsen, falls vorhanden.
- Berechnen Sie den 3D-VCA in einem 3D-Volumen. HINWEIS: Normalerweise befinden sich die Öffnungen nicht in derselben Ebene. In diesem Fall messen Sie getrennte Planimetrien jeder Öffnung in den entsprechenden Ebenen (Ergänzende Abbildung 14).
- Bewerten Sie erneut den Lungenvenenfluss und den mittleren Gradienten über die Mitralklappe.
HINWEIS: Die kontinuierliche LA-Drucküberwachung kann ein nützliches Werkzeug während der Reparatur der Transkatheter-Mitralklappe sein. - Zeigen Sie schließlich die 3D-Gesichtsansicht der Mitralklappe.
9. Implantation zusätzlicher Geräte
- Stellen Sie sicher, dass die MR-Reduktion ausreichend ist.
HINWEIS: Wenn das Ergebnis nicht zufriedenstellend ist, bewerten Sie die Implantation zusätzlicher Geräte. - Stellen Sie sicher, dass das zusätzliche Gerät nicht mit dem implantierten Gerät in Kontakt kommt, das in den linken Ventrikel eintaucht.
HINWEIS: Die Durchleuchtung ist unerlässlich, um den tatsächlichen Abstand zwischen den Clips zu zeigen. - Zeigen Sie die 3D-Gesichtsansicht, um die Kommissurallinie zu visualisieren, da sie nach der Implantation des ersten Clips verschoben werden kann.
- Wiederholen Sie die fünf Schritte wie in Punkt 7.4 beschrieben, um mr mr zu bewerten, nachdem Sie die Packungsbeilagen mit dem zusätzlichen Clip ergriffen haben.
Ergebnisse
Die perkutane Kantenreparatur ist eine Alternative zur chirurgischen Klappenreparatur oder zum Ersatz von Klappen bei Patienten, die nicht für eine Operation mit symptomatischer schwerer MR in Frage kommen. Die erste klinische Anwendung des MitraClip wurde in der Endovascular Valve Edge-to-Edge Repair Study I (EVEREST I)14 Studie untersucht. Viele andere Studien haben die Wirksamkeit des Verfahrens mit einer Verbesserung der Symptome sowie niedrigen Krankenhaussterblichkeitsraten und unerwünscht...
Diskussion
Die Echoführung für den PMVR ist eine sichere Methode. Komplikationen aufgrund der Echokardiographie können auftreten, führen aber selten zu signifikanten Schäden. Dennoch sind Ösophagusläsionen nach der Durchführung einer transösophagealen Echokardiographie möglich. Diese Inzidenz wird mit einer kürzeren Dauer der Intervention reduziert34. Im Gegenteil, mehrere Komplikationen im Zusammenhang mit der Transkatheter-Kanten-zu-Rand-Mitralklappenreparatur werden beschrieben
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Wir danken Frau Dorothea Scheurlen für die technische Videounterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| EPIQ 7 Ultrasound System | Philips | US218B0542 | Cardiac Ultrasound Machine |
| X8-2t xMATRIX 3D-TEE probe | Philips | B34YYK | TEE-probe |
| Sheath 6F 25 cm | Merit Medical | B60N25AQ | Sheath |
| Dilator 16 F | Abbott | 405544 | Dilator |
| BRK-1 transseptal needle 71 cm | St. Jude Medical | ABVA407201 | Transseptal Needle |
| Swartz Lamp 90° | St. Jude Medical | 407356 | Transseptal Guiding Introducer Sheath |
| Amplatz super stiff | Kook Medical | 46509 | Wire |
| Steerable Guide Catheter | Abbott | SGC0302 | Steerable Guide Catheter |
| MitraClip NTR Delivery System | Abbott | CDS0602-NTR | Clip Delivery System |
| MitraClip NTR Bundle | Abbott | MSK0602-NTR | Device |
Referenzen
- Iung, B., et al. A prospective survey of patients with valvular heart disease in Europe: The Euro Heart Survey on Valvular Heart Disease. European Heart Journal. 24 (13), 1231-1243 (2003).
- Hauptman, P. J., Rector, T. S., Wentworth, D., Kubo, S. Quality of life in advanced heart failure: role of mitral regurgitation. American Heart Journal. 151 (1), 213-218 (2006).
- Lewis, E. F. Assessing the impact of heart failure therapeutics on quality of life and functional capacity. Current Treatment Options in Cardiovascular Medicine. 15 (4), 425-436 (2013).
- Vaishnava, P., Lewis, E. F. Assessment of quality of life in severe heart failure. Current Heart Failure Reports. 4 (3), 170-177 (2007).
- Feldman, T., et al. Percutaneous repair or surgery for mitral regurgitation. New England Journal of Medicine. 364 (15), 1395-1406 (2011).
- Feldman, T., et al. Percutaneous mitral repair with the MitraClip system: safety and midterm durability in the initial EVEREST (Endovascular Valve Edge-to-Edge REpair Study) cohort. Journal of the American College of Cardiology. 54 (8), 686-694 (2009).
- Whitlow, P. L., et al. Acute and 12-month results with catheter-based mitral valve leaflet repair: the EVEREST II (Endovascular Valve Edge-to-Edge Repair) High Risk Study. Journal of the American College of Cardiology. 59 (2), 130-139 (2012).
- Baldus, S., et al. MitraClip therapy in daily clinical practice: initial results from the German transcatheter mitral valve interventions (TRAMI) registry. European Journal of Heart Failure. 14 (9), 1050-1055 (2012).
- Stone, G. W., et al. Transcatheter Mitral-Valve Repair in Patients with Heart Failure. New England Journal of Medicine. 379 (24), 2307-2318 (2018).
- Lim, D. S., et al. Transcatheter Valve Repair for Patients With Mitral Regurgitation: 30-Day Results of the CLASP Study. JACC: Cardiovascular Interventions. 12 (14), 1369-1378 (2019).
- Schillinger, W., et al. Impact of the learning curve on outcomes after percutaneous mitral valve repair with MitraClip and lessons learned after the first 75 consecutive patients. European Journal of Heart Failure. 13 (12), 1331-1339 (2011).
- Katz, W. E., Conrad Smith, A. J., Crock, F. W., Cavalcante, J. L. Echocardiographic evaluation and guidance for MitraClip procedure. Cardiovascular Diagnosis and Therapy. 7 (6), 616-632 (2017).
- Altiok, E., et al. Optimized guidance of percutaneous edge-to edge repair of the mitral valve using real-time 3-D transesophageal echocardiography. Clinical Research in Cardiology. 100 (8), 675-681 (2011).
- Feldman, T., et al. Percutaneous mitral valve repair using the edge-to-edge technique: six-month results of the EVEREST Phase I Clinical Trial. Journal of the American College of Cardiology. 46 (11), 2134-2140 (2005).
- Maisano, F., et al. Percutaneous mitral valve interventions in the real world: early and 1-year results from the ACCESS-EU, a prospective, multicenter, nonrandomized post-approval study of the MitraClip therapy in Europe. Journal of the American College of Cardiology. 62 (12), 1052-1061 (2013).
- Kalbacher, D., et al. Long-term outcome, survival and predictors of mortality after MitraClip therapy: Results from the German Transcatheter Mitral Valve Interventions (TRAMI) registry. International Journal of Cardiology. 277, 35-41 (2019).
- Glower, D. D., et al. Percutaneous mitral valve repair for mitral regurgitation in high-risk patients: results of the EVEREST II study. Journal of the American College of Cardiology. 64 (2), 172-181 (2014).
- Baumgartner, H., et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. European Heart Journal. 38 (36), 2739-2791 (2017).
- Obadia, J. F., et al. MITRA-FR Investigators. Percutaneous Repair or Medical Treatment for Secondary Mitral Regurgitation. New England Journal of Medicine. 379 (24), 2297-2306 (2018).
- Stone, G. W., et al. COAPT Investigators. Transcatheter Mitral-Valve Repair in Patients with Heart Failure. New England Journal of Medicine. 379 (24), 2307-2318 (2018).
- Vahanian, A., et al. Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC); European Association for Cardio-Thoracic Surgery (EACTS), Guidelines on the management of valvular heart disease (version 2012). European Heart Journal. 33 (19), 2451-2496 (2012).
- American College of Cardiology/American Heart Association Task Force on Practice Guidelines; Society of Cardiovascular Anesthesiologists; Society for Cardiovascular Angiography and Interventions. ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 114 (5), 84 (2006).
- Praz, F., et al. Compassionate use of the PASCAL transcatheter mitral valve repair system for patients with severe mitral regurgitation: a multicentre, prospective, observational, first-in-man study. Lancet. 390 (10096), 773-780 (2017).
- McCarthy, K. P., Ring, L., Rana, B. S. Anatomy of the mitral valve: understanding the mitral valve complex in mitral regurgitation. European Journal of Echocardiography. 11 (10), 3-9 (2010).
- Zoghbi, W. A., et al. Recommendations for Noninvasive Evaluation of Native Valvular Regurgitation: A Report from the American Society of Echocardiography Developed in Collaboration with the Society for Cardiovascular Magnetic Resonance. Journal of the American Society of Echocardiography. 30 (4), 303-371 (2017).
- Zoghbi, W. A., et al. Guidelines for the Evaluation of Valvular Regurgitation Percutaneous Valve Repair or Replacement: A Report from the American Society of Echocardiography Developed in Collaboration with the Society for Cardiovascular Angiography and Interventions, Japanese Society of Echocardiography, and Society for Cardiovascular Magnetic Resonance. Journal of the American Society of Echocardiography. 32 (4), 431-475 (2019).
- Abudiab, M. M., Chao, C. J., Liu, S., Naqvi, T. Z. Quantitation of valve regurgitation severity by three-dimensional vena contracta area is superior to flow convergence method of quantitation on transesophageal echocardiography. Echocardiography. 34 (7), 992-1001 (2017).
- Dietl, A., et al. 3D vena contracta area after MitraClip procedure: precise quantification of residual mitral regurgitation and identification of prognostic information. Cardiovasc Ultrasound. 16 (1), 1 (2018).
- Ikenaga, H., et al. Usefulness of Intraprocedural Pulmonary Venous Flow for Predicting Recurrent Mitral Regurgitation and Clinical Outcomes After Percutaneous Mitral Valve Repair With the MitraClip. JACC: Cardiovascular Interventions. 12 (2), 140-150 (2019).
- Tang, G. H. L., et al. Continuous invasive hemodynamic monitoring using steerable guide catheter to optimize mitraclip transcatheter mitral valve repair: A multicenter, proof-of-concept study. Journal of Interventional Cardiology. 31 (6), 907-915 (2018).
- Maor, E., et al. Acute Changes in Left Atrial Pressure After MitraClip Are Associated With Improvement in 6-Minute Walk Distance. Circulation: Cardiovascular Interventions. 10 (4), 004856 (2017).
- Kuwata, S., et al. Continuous Direct Left Atrial Pressure: Intraprocedural Measurement Predicts Clinical Response Following MitraClip Therapy. JACC: Cardiovascular Interventions. 12 (2), 127-136 (2019).
- Corrigan, F. E., et al. Pulmonary Venous Waveforms Predict Rehospitalization and Mortality After Percutaneous Mitral Valve Repair. JACC Cardiovasc Imaging. 12 (10), 1905-1913 (2019).
- Ruf, T. F., et al. ELMSTREET (Esophageal Lesions during MitraClip uSing TRansEsophageal Echocardiography Trial. EuroIntervention. 13 (12), 1444-1451 (2017).
- Eggebrecht, H., et al. Risk and outcomes of complications during and after MitraClip implantation: Experience in 828 patients from the German TRAnscatheter mitral valve interventions (TRAMI) registry. Catheterization and Cardiovascular Interventions. 86 (4), 728-735 (2015).
- von Bardeleben, R. S., et al. Incidence and in-hospital safety outcomes of patients undergoing percutaneous mitral valve edge-to-edge repair using MitraClip: five-year German national patient sample including 13,575 implants. EuroIntervention. 14 (17), 1725-1732 (2019).
- Généreux, P., et al. Incidence, predictors, and prognostic impact of late bleeding complications after transcatheter aortic valve replacement. Journal of the American College of Cardiology. 64 (24), 2605-2615 (2014).
- Benito-González, T., Estévez-Loureiro, R., Gualis, J. Chordal Rupture Following MitraClip Implantation Resulting in Massive Mitral Regurgitation. Journal of Invasive Cardiology. 27 (10), 224-225 (2015).
- Kaneko, H., Neuss, M., Weissenborn, J., Butter, C. Impact of residual mitral regurgitation after MitraClip implantation. International Journal of Cardiology. 227, 813-819 (2017).
- Buzzatti, N., et al. What is a "good" result after transcatheter mitral repair? Impact of 2+ residual mitral regurgitation. Journal of Thoracic and Cardiovascular Surgery. 151 (1), 88-96 (2016).
- Feldman, T., Guerrero, M. Assessing the Balance Between Less Mitral Regurgitation and More Residual Transmitral Pressure Gradient After MitraClip. JACC: Cardiovascular Interventions. 10 (9), 940-941 (2017).
- Neuss, M., et al. Elevated Mitral Valve Pressure Gradient After MitraClip Implantation Deteriorates Long-Term Outcome in Patients With Severe Mitral Regurgitation and Severe Failure. JACC: Cardiovascular Interventions. 10 (9), 931-939 (2017).
- Katz, W. E., Conrad Smith, A. J., Crock, F. W., Cavalcante, J. L. Echocardiographic evaluation and guidance for MitraClip procedure. Cardiovascular Diagnosis and Therapy. 7 (6), 616-632 (2017).
- Labrousse, L., et al. Guidance of the MitraClip procedure by 2D and 3D imaging. Archives of Cardiovascular Diseases. 111 (6-7), 432-440 (2018).
- Khalique, O. K., Hahn, R. T. Percutaneous Mitral Valve Repair: Multi-Modality Cardiac Imaging for Patient Selection and Intra-Procedural Guidance. Frontiers in Cardiovascular Medicine. 6, 142 (2019).
- Bushari, L. I., et al. Percutaneous Transcatheter Edge-to-Edge MitraClip Technique: A Practical "Step-by-Step" 3-Dimensional Transesophageal Echocardiography Guide. Mayo Clinic Proceedings. 94 (1), 89-102 (2019).
- Sherif, M. A., et al. MitraClip step by step; how to simplify the procedure. Netherlands Heart Journal. 25 (2), 125 (2017).
- Guarracino, F., et al. Transesophageal echocardiography during MitraClip procedure. Anesthesia & Analgesia. 118 (6), 1188-1196 (2014).
- Avenatti, E., et al. Diagnostic Value of 3-Dimensional Vena Contracta Area for the Quantification of Residual Mitral Regurgitation After MitraClip Procedure. JACC: Cardiovascular Interventions. 12 (6), 582-591 (2019).
- Altiok, E., et al. Analysis of procedural effects of percutaneous edge-to-edge mitral valve repair by 2D and 3D echocardiography. Circulation: Cardiovascular Imaging. 5 (6), 748-755 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten