Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une approche simplifiée par étapes du guidage de l’écho lors de la réparation de la valve mitrale percutanée
Dans cet article
Résumé
Ce protocole présente en détail comment effectuer un guidage échocardiographique en temps réel lors de la réparation de la valve mitrale transcathéter. Les vues fondamentales et les mesures nécessaires sont décrites pour chaque étape de la procédure.
Résumé
La reconstruction transcathéter percutanée bord à bord de la valve mitrale est un traitement sûr et bien établi pour la régurgitation mitrale symptomatique sévère chez les patients présentant un risque chirurgical élevé. Le guidage échocardiographique en plus de la fluoroscopie est la norme d’or et doit être effectué à l’aide d’une technique standardisée.
Cet article présente notre guide échocardiographique reproductible étape par étape comprenant des vues, des mesures ainsi que la mise en évidence des difficultés possibles pouvant survenir au cours de la procédure.
Cet article fournit des vues échocardiographiques détaillées et chronologiques pour chaque étape de la procédure, en particulier les préférences entre l’imagerie 2D et 3D. Si nécessaire, des mesures d’ondes d’impulsion, d’ondes continues et de Doppler de couleur sont décrites. En outre, comme il n’existe pas de recommandations officielles pour la quantification de la régurgitation mitrale pendant la procédure percutanée de réparation bord à bord, des conseils sont également inclus pour la quantification échocardiographique après la saisie des folioles mitrales et après le déploiement du dispositif. En outre, l’article traite des vues échocardiographiques importantes pour prévenir et traiter les complications possibles pendant la procédure.
Le guidage échocardiographique lors de la réparation de la valve mitrale transcathéter est obligatoire. Une approche structurée améliore la collaboration entre l’interventionniste et l’imageur et est indispensable pour une procédure sûre et efficace.
Introduction
La régurgitation mitrale (RM) est la deuxième indication la plus fréquente pour la chirurgie valvulaire en Europe1. Non traitée, elle peut entraîner une insuffisance cardiaque sévère et une qualité de vie réduite2,3,4. La réparation de la valve mitrale percutanée (PMVR) est une technique basée sur un cathéter, qui imite la méthode chirurgicale du point Alfieri à la réparation mitrale en connectant les pétoncles A2 et P25. Pour les patients présentant un risque chirurgical élevé, cette technique offre une approche mini-invasive pour le traitement de la RM sévère. Les données de plusieurs registres et essais ont montré que la procédure MitraClip, une thérapie de réparation de la valve mitrale transcathéter, est une méthode efficace et sûre6,7,8,9. En 2019, un dispositif similaire, le système de réparation de valve transcathéter PASCAL, a été introduit sur le marché. Il a démontré la faisabilité et l’innocuité acceptable dans le traitement des patients atteints de MR10sévère . La durée et le succès du PMVR dépendent des compétences et de l’expérience de chaque opérateur11. Contrairement à d’autres techniques percutanées, comme le remplacement transvalvulaire percutané (TAVR), qui peut être effectué uniquement par fluoroscopie, le PMVR nécessite un guidage échocardiographique12,13.
Cet article décrit étape par étape l’approche échocardiographique pendant la RVPM, y compris les mesures, les suggestions de quantification intraprocédurale de la RM et les vues importantes pour prévenir les complications périprocédurales.
Access restricted. Please log in or start a trial to view this content.
Protocole
Le protocole suit les lignes directrices du comité d’éthique de la recherche humaine de notre établissement.
1. Évaluation avant intervention
- Exclure l’épanchement péricardique avant la ponction transseptale. Si un petit épanchement péricardique est présent, mesurez l’espace écholucide diastolique final maximal dans une vue à quatre chambres (4Ch) avec un foyer sur le ventricule droit (RV), une vue d’entrée-sortie ventriculaire droite de l’œsophage et une vue à axe long (LAX).
- Évaluer le schéma d’écoulement veineux pulmonaire avec doppler à ondes de pouls (PW) dans la veine pulmonaire supérieure gauche (LUPV) et exclure la formation de thrombus dans l’appendice auriculaire gauche (LAA). Affichez la vue à axe court (SAX) avec mise au point sur le LAA, balayez ensuite à 40-60 ° et faites pivoter la sonde dans le sens inverse des aiguilles d’une montre pour afficher le LUPV. Évaluer l’écoulement dans la veine pulmonaire supérieure droite (RUPV) en balayant à 90-110°(Figure 1 et Figure supplémentaire 1).
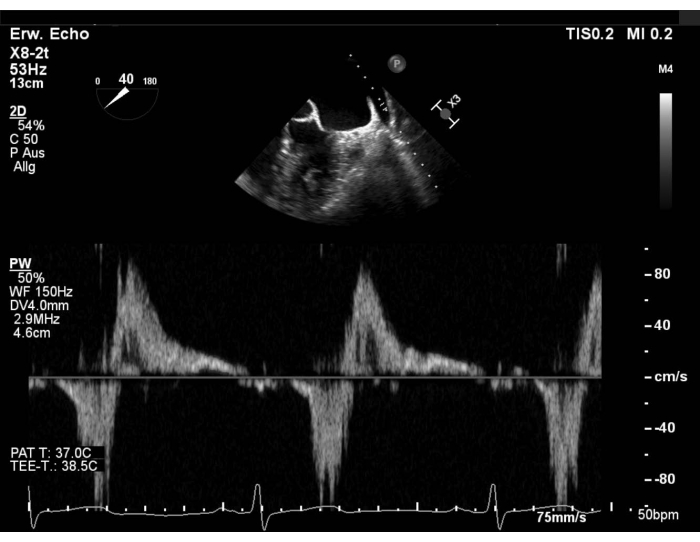
Figure 1: Vue SAX modifiée : Écoulement pw dans la veine pulmonaire supérieure gauche Veuillez cliquer ici pour afficher une version agrandie de cette figure.
- Assurez-vous que l’état hémodynamique est le même pendant l’évaluation pré et post-procédurale.
REMARQUE: Comme la RM est une maladie valvulaire dynamique, la régurgitation peut sembler moins grave sous anesthésie générale. Dans ce cas, consultez l’opérateur et augmentez la postcharge et/ou la précharge. - Trouvez la meilleure vue intercommissurale (50-70°). Prenez une vue perpendiculaire (plan X) dans les trois segments avec et sans doppler de couleur et mesurez la longueur de la feuillet mitral postérieure (LEMP). Ensuite, vérifiez à nouveau la morphologie de la feuillet (Figure 2 et Figure supplémentaire 2).

Figure 2: Vue biplanaire 2D du MV avec Doppler couleur : jet d’insuffisance médiale Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Évaluez le gradient de pression transmitrale avec le Doppler à ondes continues (CW) dans la vue à long axe (120-140°).
REMARQUE: Un gradient de pression moyen (MPG) > 5 mmHg est une contre-indication relative pour pmVR. - Prenez un jeu de données 3D avec Doppler couleur ou une image zoom à grand secteur avec couleur et mesurez le contracta 3D-vena (3D-VCA) (Figure 3).
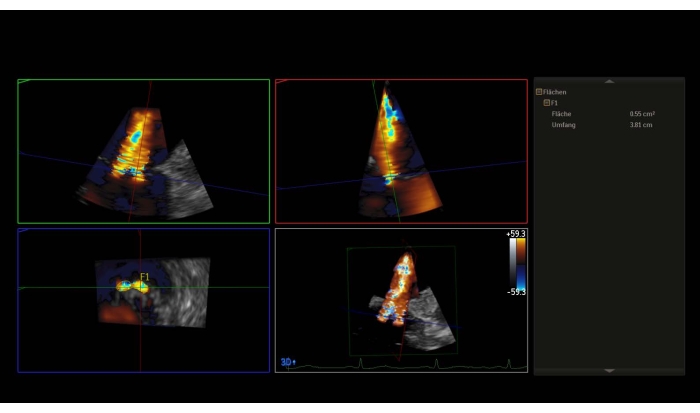
Figure 3: Reconstruction multiplanaire du jeu de données 3D avec doppler couleur : 3D-Vena contracta Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Sans couleur, utilisez le volume 3D pour mesurer la surface de la valve mitrale (MVA) (Figure supplémentaire 3).
REMARQUE: Une zone < 4 cm2 est une contre-indication relative, une zone < 3 cm2 une contre-indication absolue pour effectuer la procédure. Sinon, évaluez le MVA dans la vue SAX basale transgastrique. - Montrez la vue auriculaire chirurgicale 3D en face (valve aortique à 12 heures) de la valve mitrale.
REMARQUE: Les segments de la vanne sont nommés « latéraux » pour les segments 1 et « médial » pour les segments 3. La séquence des segments dans la vue chirurgicale en face est inverse à la séquence dans la vue commissurale. Effectuez une rotation de 180° dans le sens des aiguilles d’une montre dans la vue chirurgicale 3D (valve aortique à 6 heures), qui se traduira par une séquence égale de segments dans les deux vues(Figure 4 et Figure 5).
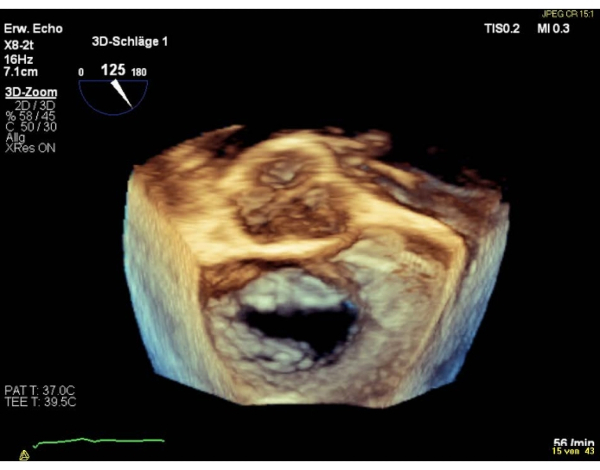
Figure 4: Image zoom à large secteur : vue auriculaire chirurgicale 3D en face (valve aortique à 12 heures) Veuillez cliquer ici pour voir une version agrandie de cette figure.
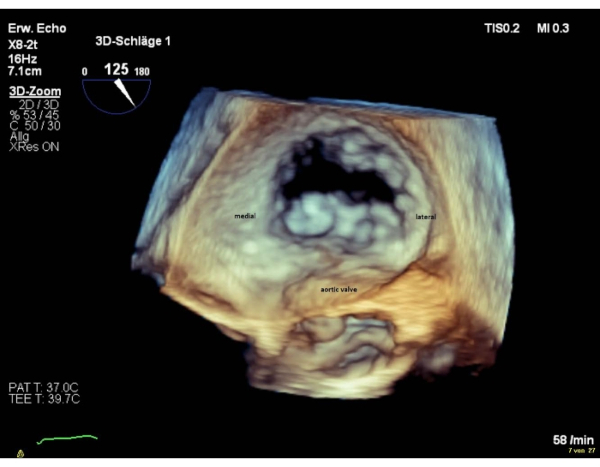
Figure 5: Image à zoom à large secteur : vue auriculaire 3D (valve aortique à 6 heures) Veuillez cliquer ici pour l’agrandir.
- Enfin, prenez une vue bicaval (90-110°) avec le plan X, pour montrer la valve aortique (AV), pour la ponction transseptale.
2. Stratégie
- Discutez de la stratégie avec l’opérateur avant d’insérer le cathéter guide orientable (SGC) et le système de distribution de clip (CDS) dans l’oreillette gauche.
- Évaluez une stratégie à un seul appareil si l’orifice est < 1 cm de large et placez le clip directement au-dessus du jet de régurgitation si l’orifice est circulaire.
- Évaluer l’implantation de ≥ 2 clips en cas de grands jets elliptiques ou multiples. Implantez le dispositif en commençant médialement de l’orifice régurgitant, car le positionnement d’un deuxième dispositif est souvent plus facile lorsque le premier a été implanté de cette manière, plutôt qu’après avoir commencé latéralement (Figure supplémentaire 4).
3. Ponction transseptale
- Affichez une vue bicaval combinée à une vue SAX. Assurez-vous que l’AV est visible, pour éviter les blessures aortiques.
- Assurez-vous que le site de ponction est légèrement supérieur et postérieur(Figure 6).
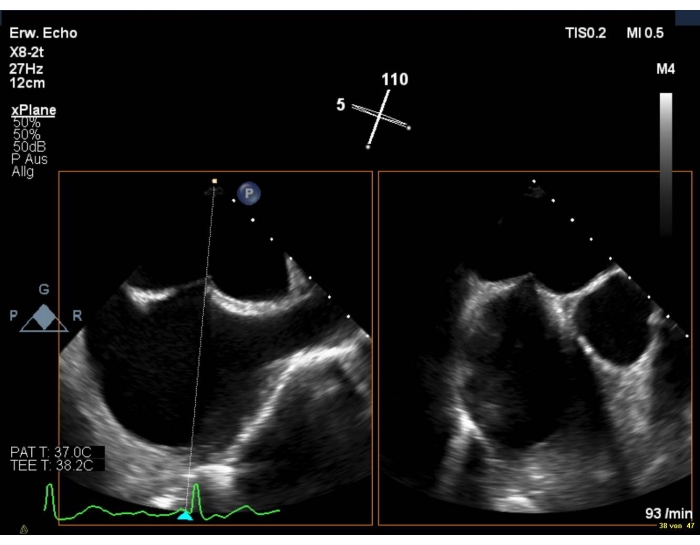
Figure 6: Vue biplanaire 2D : ponction transseptale Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Choisissez une hauteur de ponction de 4-5 cm en cas d’IRM dégénérative (par exemple, prolapsus) et de > 3,5 en RM fonctionnelle. Évitez un foramen ovale patent, car l’entrée est beaucoup trop antérieure.
- Une fois que l’aiguille transseptale conduit à la tente du septum interauriculaire, mesurez la hauteur de ponction dans la vue 4Ch dans la systole moyenne (Figure supplémentaire 5).
REMARQUE: Chez les patients atteints de gros atriums, si le site de ponction est trop postérieur, la tente ne peut pas être visualisée dans la vue 4Ch. Dans ce cas, rétroflexe et insérez la sonde plus profondément dans l’œsophage. - Après une ponction transseptale, excluez toujours l’épanchement péricardique dans la vue 4Ch.
- Affichez une vue SAX en mettant l’accent sur le LAA et la veine pulmonaire pour visualiser l’entrée du fil guide rigide dans le LUPV.
4. Introduction du SGC dans l’A.A.
- Visualisez la tente et l’avancement du SGC avec le dilatateur dans une vue SAX avec échocardiographie 2D continue et guidage fluoroscopique pour éviter les blessures à la paroi auriculaire gauche.
REMARQUE: La pointe du SGC est définie par un double anneau radio-père et écho lumineux (Figure supplémentaire 6). - Montrez à l’opérateur la vue SAX et la vue bicaval (90-120°) pour positionner le SGC dans la direction du ventricule gauche (LV).
5. Avancement du CEMD dans l’A.A.
- Prenez un volume 3D comprenant le septum interauriculaire, la crête latérale gauche et le MV et assurez-vous que la crête latérale gauche est visible car la saillie du CDS est courante(Figure 7).

Figure 7: Image zoom à large secteur : SGC dans le LA, y compris le septum interauriculaire, la crête latérale gauche et le MV Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Sinon, choisissez la vue SAX et la vue LAX (plan X) pour vous assurer que le CDS n’a pas de contact avec la crête et la paroi LA.
REMARQUE: L’opérateur peut demander à l’imageur de montrer le septum interauriculaire et de retirer le SGC de quelques millimètres pour contourner la crête. Si le double anneau en 3D ne peut pas être visualisé, passez en 2D et affichez le SGC dans la vue SAX.
- Vérifiez que le CDS est positionné perpendiculairement à la ligne de coaptation pour garantir une trajectoire correcte.
- Affichez la vue intercommissurale en 2D à environ 60° pour afficher le plan médial - latéral et la vue LAX à 120-140° pour identifier le plan antérieur - postérieur du MV (Figure supplémentaire 7).
- Vous pouvez également optimiser le positionnement médial, latéral, antérieur et postérieur du CDS dans la vue 3D en face(Figure supplémentaire 8).
6. Orientation de l’appareil au-dessus et au-dessous du MV
- Prenez la vue en face 3D pour montrer un positionnement perpendiculaire des bras à la ligne de coaptation.
- En cas de mauvaise qualité d’image, affichez une vue intercommissurale combinée à une vue LAX (Figure 8 et Figure 9).
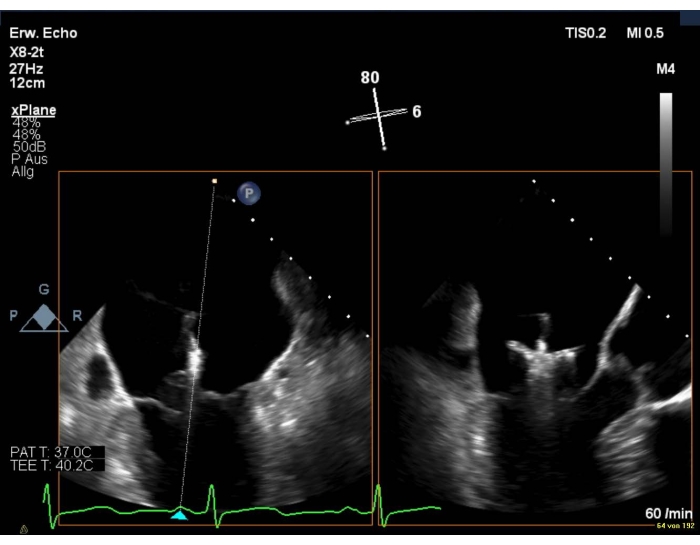
Figure 8: Vue biplanaire 2D du MV : positionnement de l’appareil sur la valve mitrale Veuillez cliquer ici pour voir une version agrandie de cette figure.
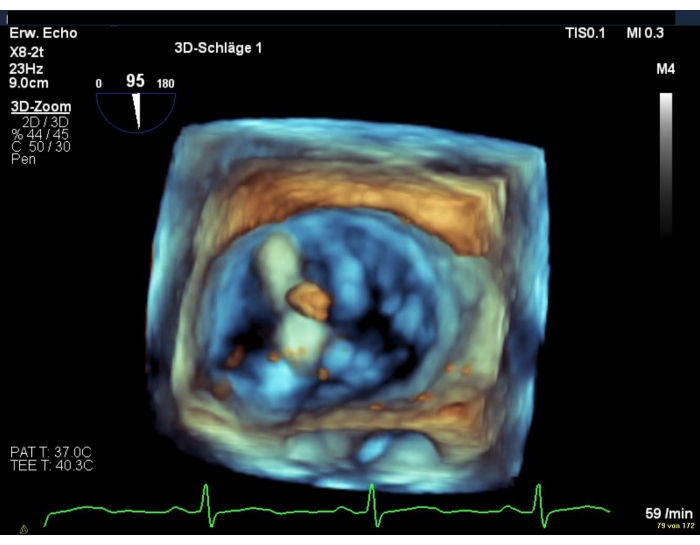
Figure 9: Image zoom à large secteur : positionnement de l’appareil au-dessus de la valve mitrale Veuillez cliquer ici pour agrandir cette figure.
REMARQUE : Les bras de clip ne sont visibles que dans la vue LAX.
- Ajustez l’angle de vue intercommissural pour les dispositifs positionnés médialement et latéralement afin de visualiser toute la longueur des deux bras. Balayage à environ 30-45° pour les dispositifs positionnés médialement et à environ 70-90° pour les dispositifs positionnés latéralement.
- Choisissez la vue intercommissurale combinée à une vue LAX pour visualiser l’avancement du CDS dans le LV.
- Assurez-vous que le CDS est placé à quelques millimètres sous le MV.
- Vérifiez dans la vue frontale 3D que les bras du clip sont toujours dans la position prévue, car une rotation du clip lors de la traversée de la vanne est fréquente.
REMARQUE: Si la position des bras de clip a changé, une rotation dans le sens des aiguilles d’une montre ou dans le sens inverse des aiguilles d’une montre sera effectuée pour obtenir une préhension symétrique. Soyez prudent lors de cette manœuvre pour minimiser l’enchevêtrement chordal et sous-chordal. - Si une réorientation grossière de l’appareil est nécessaire, affichez la vue intercommissurale avec le plan X pour visualiser l’inversion du clip qui sera récupéré dans le LA.
7. Saisie des feuillets mitraux et évaluation de la RM avant et après le déploiement du clip
- Enregistrez la saisie des folioles dans la vue intercommissurale combinée à la vue LAX (plan X) ou dans la vue LAX uniquement (Figure supplémentaire 9).
- Demandez à l’anesthésiste d’effectuer une manœuvre de maintien de la respiration pour réduire les changements de vitesse pendant la ventilation et faciliter la préhension des folioles.
- Assurer une visualisation continue de l’insertion des folioles pour éviter le roulement des folioles ou des chordes.
REMARQUE: La saisie d’une feuillet roulée ou d’une chorde peut entraîner un détachement partiel de la foliole et / ou une aggravation de la RM. - Évaluez soigneusement la réduction de la régurgitation avant le déploiement du clip. Assurez-vous que l’opérateur et l’imageur analysent cette étape cruciale.
- Faites pivoter la sonde TEE médialement et latéralement vers le clip ou utilisez le plan X avec doppler couleur pour trouver des jets excentriques à proximité du clip (Figure supplémentaire 10).
REMARQUE: En raison de l’ombrage, des artefacts causés par la sous-estimation du CDS du MR peuvent se produire. Insérez la sonde plus profondément dans l’œsophage ou montrez la vue transgastrique pour visualiser les jets d’insuffisance résiduelle sans ombrage des artefacts. - Évaluer le débit PW dans les veines pulmonaires.
REMARQUE: si une inversion de flux systolique antérieure se transforme en un modèle dominant systolique, une réduction pertinente s’est probablement produite. - Mesurez le MPG à travers la valve mitrale.
REMARQUE : Une pente > 5 mmHg est une contre-indication relative au déploiement du clip(figure supplémentaire 11 et figure supplémentaire 12). - Utilisez la vue frontale 3D du MV ou une vue SAX transgastrique du MV pour montrer le double orifice (Figure 10).
- Faites pivoter la sonde TEE médialement et latéralement vers le clip ou utilisez le plan X avec doppler couleur pour trouver des jets excentriques à proximité du clip (Figure supplémentaire 10).

Figure 10: Image de zoom à grand secteur : double orifice du MV après le déploiement de l’appareil Veuillez cliquer ici pour afficher une version agrandie de cette figure.
- Enfin, si le résultat est satisfaisant, vérifiez l’insertion de la notice en 2D.
- Après avoir sorti le clip du CDS, répétez les cinq dernières étapes.
REMARQUE: En raison de la tension du système sur le MV, les jets d’insuffisance résiduelle après la libération de l’appareil peuvent être aggravés. - Montrez quand l’embout du cathéter d’administration est récupéré du SGC dans la vue LAX avec le plan X et assurez-vous que la pointe évite tout contact avec le LA (Figure supplémentaire 13).
8. Évaluation finale de la RM
- Affichez la vue intercommissurale avec doppler couleur en combinaison avec des plans X perpendiculaires dans les jets d’insuffisance résiduelle, le cas échéant.
- Calculez le VCA 3D dans un volume 3D. REMARQUE: généralement les orifices ne sont pas dans le même plan. Dans ce cas, mesurer les planimétries séparées de chaque orifice dans les plans appropriés (Figure supplémentaire 14).
- Évaluez à nouveau le flux de la veine pulmonaire et le gradient moyen à travers la valve mitrale.
REMARQUE: la surveillance continue de la pression LA peut être un outil utile lors de la réparation de la valve mitrale transcathéter. - Enfin, montrez la vue frontale 3D de la valve mitrale.
9. Implantation de dispositifs supplémentaires
- Assurez-vous que la réduction de la RM est suffisante.
REMARQUE: Si le résultat n’est pas satisfaisant, évaluer l’implantation de dispositifs supplémentaires. - Assurez-vous que le dispositif supplémentaire n’entre pas en contact avec le dispositif implanté plongeant dans le ventricule gauche.
REMARQUE: la fluoroscopie est essentielle pour montrer la distance réelle entre les clips. - Affichez la vue en face 3D pour visualiser la ligne de commissurale, car elle peut être différée après l’implantation du premier clip.
- Répétez les cinq étapes comme expliqué au point 7.4 pour évaluer la RM après avoir saisi les feuillets avec le clip supplémentaire.
Access restricted. Please log in or start a trial to view this content.
Résultats
La réparation valvulaire percutanée bord à bord est une alternative à la réparation ou au remplacement chirurgical de la valve chez les patients non admissibles à une chirurgie avec IRM sévère symptomatique. La première application clinique du MitraClip a été étudiée dans l’essai Everest I (Endovascular Valve Edge-to-Edge Repair Study I)14. De nombreux autres essais ont prouvé l’efficacité de la procédure avec une amélioration des symptômes ainsi que de faibles taux de mortal...
Access restricted. Please log in or start a trial to view this content.
Discussion
L’écho-guidage pour le PMVR est une méthode sûre. Des complications dues à l’échocardiographie peuvent survenir, mais entraînent rarement des dommages importants. Néanmoins, des lésions œsophagiennes sont possibles après avoir effectué une échocardiographie transœsophagienne. Cette incidence est réduite avec une durée d’intervention plus courte34. Au contraire, plusieurs complications associées à la réparation de la valve mitrale transcathéter bord à bord sont décrites
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions Mme Dorothea Scheurlen pour son soutien technique vidéo.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| EPIQ 7 Ultrasound System | Philips | US218B0542 | Cardiac Ultrasound Machine |
| X8-2t xMATRIX 3D-TEE probe | Philips | B34YYK | TEE-probe |
| Sheath 6F 25 cm | Merit Medical | B60N25AQ | Sheath |
| Dilator 16 F | Abbott | 405544 | Dilator |
| BRK-1 transseptal needle 71 cm | St. Jude Medical | ABVA407201 | Transseptal Needle |
| Swartz Lamp 90° | St. Jude Medical | 407356 | Transseptal Guiding Introducer Sheath |
| Amplatz super stiff | Kook Medical | 46509 | Wire |
| Steerable Guide Catheter | Abbott | SGC0302 | Steerable Guide Catheter |
| MitraClip NTR Delivery System | Abbott | CDS0602-NTR | Clip Delivery System |
| MitraClip NTR Bundle | Abbott | MSK0602-NTR | Device |
Références
- Iung, B., et al. A prospective survey of patients with valvular heart disease in Europe: The Euro Heart Survey on Valvular Heart Disease. European Heart Journal. 24 (13), 1231-1243 (2003).
- Hauptman, P. J., Rector, T. S., Wentworth, D., Kubo, S. Quality of life in advanced heart failure: role of mitral regurgitation. American Heart Journal. 151 (1), 213-218 (2006).
- Lewis, E. F. Assessing the impact of heart failure therapeutics on quality of life and functional capacity. Current Treatment Options in Cardiovascular Medicine. 15 (4), 425-436 (2013).
- Vaishnava, P., Lewis, E. F. Assessment of quality of life in severe heart failure. Current Heart Failure Reports. 4 (3), 170-177 (2007).
- Feldman, T., et al. Percutaneous repair or surgery for mitral regurgitation. New England Journal of Medicine. 364 (15), 1395-1406 (2011).
- Feldman, T., et al. Percutaneous mitral repair with the MitraClip system: safety and midterm durability in the initial EVEREST (Endovascular Valve Edge-to-Edge REpair Study) cohort. Journal of the American College of Cardiology. 54 (8), 686-694 (2009).
- Whitlow, P. L., et al. Acute and 12-month results with catheter-based mitral valve leaflet repair: the EVEREST II (Endovascular Valve Edge-to-Edge Repair) High Risk Study. Journal of the American College of Cardiology. 59 (2), 130-139 (2012).
- Baldus, S., et al. MitraClip therapy in daily clinical practice: initial results from the German transcatheter mitral valve interventions (TRAMI) registry. European Journal of Heart Failure. 14 (9), 1050-1055 (2012).
- Stone, G. W., et al. Transcatheter Mitral-Valve Repair in Patients with Heart Failure. New England Journal of Medicine. 379 (24), 2307-2318 (2018).
- Lim, D. S., et al. Transcatheter Valve Repair for Patients With Mitral Regurgitation: 30-Day Results of the CLASP Study. JACC: Cardiovascular Interventions. 12 (14), 1369-1378 (2019).
- Schillinger, W., et al. Impact of the learning curve on outcomes after percutaneous mitral valve repair with MitraClip and lessons learned after the first 75 consecutive patients. European Journal of Heart Failure. 13 (12), 1331-1339 (2011).
- Katz, W. E., Conrad Smith, A. J., Crock, F. W., Cavalcante, J. L. Echocardiographic evaluation and guidance for MitraClip procedure. Cardiovascular Diagnosis and Therapy. 7 (6), 616-632 (2017).
- Altiok, E., et al. Optimized guidance of percutaneous edge-to edge repair of the mitral valve using real-time 3-D transesophageal echocardiography. Clinical Research in Cardiology. 100 (8), 675-681 (2011).
- Feldman, T., et al. Percutaneous mitral valve repair using the edge-to-edge technique: six-month results of the EVEREST Phase I Clinical Trial. Journal of the American College of Cardiology. 46 (11), 2134-2140 (2005).
- Maisano, F., et al. Percutaneous mitral valve interventions in the real world: early and 1-year results from the ACCESS-EU, a prospective, multicenter, nonrandomized post-approval study of the MitraClip therapy in Europe. Journal of the American College of Cardiology. 62 (12), 1052-1061 (2013).
- Kalbacher, D., et al. Long-term outcome, survival and predictors of mortality after MitraClip therapy: Results from the German Transcatheter Mitral Valve Interventions (TRAMI) registry. International Journal of Cardiology. 277, 35-41 (2019).
- Glower, D. D., et al. Percutaneous mitral valve repair for mitral regurgitation in high-risk patients: results of the EVEREST II study. Journal of the American College of Cardiology. 64 (2), 172-181 (2014).
- Baumgartner, H., et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. European Heart Journal. 38 (36), 2739-2791 (2017).
- Obadia, J. F., et al. MITRA-FR Investigators. Percutaneous Repair or Medical Treatment for Secondary Mitral Regurgitation. New England Journal of Medicine. 379 (24), 2297-2306 (2018).
- Stone, G. W., et al. COAPT Investigators. Transcatheter Mitral-Valve Repair in Patients with Heart Failure. New England Journal of Medicine. 379 (24), 2307-2318 (2018).
- Vahanian, A., et al. Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC); European Association for Cardio-Thoracic Surgery (EACTS), Guidelines on the management of valvular heart disease (version 2012). European Heart Journal. 33 (19), 2451-2496 (2012).
- American College of Cardiology/American Heart Association Task Force on Practice Guidelines; Society of Cardiovascular Anesthesiologists; Society for Cardiovascular Angiography and Interventions. ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 114 (5), 84(2006).
- Praz, F., et al. Compassionate use of the PASCAL transcatheter mitral valve repair system for patients with severe mitral regurgitation: a multicentre, prospective, observational, first-in-man study. Lancet. 390 (10096), 773-780 (2017).
- McCarthy, K. P., Ring, L., Rana, B. S. Anatomy of the mitral valve: understanding the mitral valve complex in mitral regurgitation. European Journal of Echocardiography. 11 (10), 3-9 (2010).
- Zoghbi, W. A., et al. Recommendations for Noninvasive Evaluation of Native Valvular Regurgitation: A Report from the American Society of Echocardiography Developed in Collaboration with the Society for Cardiovascular Magnetic Resonance. Journal of the American Society of Echocardiography. 30 (4), 303-371 (2017).
- Zoghbi, W. A., et al. Guidelines for the Evaluation of Valvular Regurgitation Percutaneous Valve Repair or Replacement: A Report from the American Society of Echocardiography Developed in Collaboration with the Society for Cardiovascular Angiography and Interventions, Japanese Society of Echocardiography, and Society for Cardiovascular Magnetic Resonance. Journal of the American Society of Echocardiography. 32 (4), 431-475 (2019).
- Abudiab, M. M., Chao, C. J., Liu, S., Naqvi, T. Z. Quantitation of valve regurgitation severity by three-dimensional vena contracta area is superior to flow convergence method of quantitation on transesophageal echocardiography. Echocardiography. 34 (7), 992-1001 (2017).
- Dietl, A., et al. 3D vena contracta area after MitraClip procedure: precise quantification of residual mitral regurgitation and identification of prognostic information. Cardiovasc Ultrasound. 16 (1), 1(2018).
- Ikenaga, H., et al. Usefulness of Intraprocedural Pulmonary Venous Flow for Predicting Recurrent Mitral Regurgitation and Clinical Outcomes After Percutaneous Mitral Valve Repair With the MitraClip. JACC: Cardiovascular Interventions. 12 (2), 140-150 (2019).
- Tang, G. H. L., et al. Continuous invasive hemodynamic monitoring using steerable guide catheter to optimize mitraclip transcatheter mitral valve repair: A multicenter, proof-of-concept study. Journal of Interventional Cardiology. 31 (6), 907-915 (2018).
- Maor, E., et al. Acute Changes in Left Atrial Pressure After MitraClip Are Associated With Improvement in 6-Minute Walk Distance. Circulation: Cardiovascular Interventions. 10 (4), 004856(2017).
- Kuwata, S., et al. Continuous Direct Left Atrial Pressure: Intraprocedural Measurement Predicts Clinical Response Following MitraClip Therapy. JACC: Cardiovascular Interventions. 12 (2), 127-136 (2019).
- Corrigan, F. E., et al. Pulmonary Venous Waveforms Predict Rehospitalization and Mortality After Percutaneous Mitral Valve Repair. JACC Cardiovasc Imaging. 12 (10), 1905-1913 (2019).
- Ruf, T. F., et al. ELMSTREET (Esophageal Lesions during MitraClip uSing TRansEsophageal Echocardiography Trial. EuroIntervention. 13 (12), 1444-1451 (2017).
- Eggebrecht, H., et al. Risk and outcomes of complications during and after MitraClip implantation: Experience in 828 patients from the German TRAnscatheter mitral valve interventions (TRAMI) registry. Catheterization and Cardiovascular Interventions. 86 (4), 728-735 (2015).
- von Bardeleben, R. S., et al. Incidence and in-hospital safety outcomes of patients undergoing percutaneous mitral valve edge-to-edge repair using MitraClip: five-year German national patient sample including 13,575 implants. EuroIntervention. 14 (17), 1725-1732 (2019).
- Généreux, P., et al. Incidence, predictors, and prognostic impact of late bleeding complications after transcatheter aortic valve replacement. Journal of the American College of Cardiology. 64 (24), 2605-2615 (2014).
- Benito-González, T., Estévez-Loureiro, R., Gualis, J. Chordal Rupture Following MitraClip Implantation Resulting in Massive Mitral Regurgitation. Journal of Invasive Cardiology. 27 (10), 224-225 (2015).
- Kaneko, H., Neuss, M., Weissenborn, J., Butter, C. Impact of residual mitral regurgitation after MitraClip implantation. International Journal of Cardiology. 227, 813-819 (2017).
- Buzzatti, N., et al. What is a "good" result after transcatheter mitral repair? Impact of 2+ residual mitral regurgitation. Journal of Thoracic and Cardiovascular Surgery. 151 (1), 88-96 (2016).
- Feldman, T., Guerrero, M. Assessing the Balance Between Less Mitral Regurgitation and More Residual Transmitral Pressure Gradient After MitraClip. JACC: Cardiovascular Interventions. 10 (9), 940-941 (2017).
- Neuss, M., et al. Elevated Mitral Valve Pressure Gradient After MitraClip Implantation Deteriorates Long-Term Outcome in Patients With Severe Mitral Regurgitation and Severe Failure. JACC: Cardiovascular Interventions. 10 (9), 931-939 (2017).
- Katz, W. E., Conrad Smith, A. J., Crock, F. W., Cavalcante, J. L. Echocardiographic evaluation and guidance for MitraClip procedure. Cardiovascular Diagnosis and Therapy. 7 (6), 616-632 (2017).
- Labrousse, L., et al. Guidance of the MitraClip procedure by 2D and 3D imaging. Archives of Cardiovascular Diseases. 111 (6-7), 432-440 (2018).
- Khalique, O. K., Hahn, R. T. Percutaneous Mitral Valve Repair: Multi-Modality Cardiac Imaging for Patient Selection and Intra-Procedural Guidance. Frontiers in Cardiovascular Medicine. 6, 142(2019).
- Bushari, L. I., et al. Percutaneous Transcatheter Edge-to-Edge MitraClip Technique: A Practical "Step-by-Step" 3-Dimensional Transesophageal Echocardiography Guide. Mayo Clinic Proceedings. 94 (1), 89-102 (2019).
- Sherif, M. A., et al. MitraClip step by step; how to simplify the procedure. Netherlands Heart Journal. 25 (2), 125(2017).
- Guarracino, F., et al. Transesophageal echocardiography during MitraClip procedure. Anesthesia & Analgesia. 118 (6), 1188-1196 (2014).
- Avenatti, E., et al. Diagnostic Value of 3-Dimensional Vena Contracta Area for the Quantification of Residual Mitral Regurgitation After MitraClip Procedure. JACC: Cardiovascular Interventions. 12 (6), 582-591 (2019).
- Altiok, E., et al. Analysis of procedural effects of percutaneous edge-to-edge mitral valve repair by 2D and 3D echocardiography. Circulation: Cardiovascular Imaging. 5 (6), 748-755 (2012).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon