É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Uma abordagem simplificada de stepwise para orientação de eco durante o reparo da válvula mitral percutânea
Neste Artigo
Resumo
Este protocolo apresenta em detalhes como realizar orientação ecocardiográfica em tempo real durante o reparo da válvula mitral transcateter. As visões fundamentais e as medidas necessárias são descritas para cada etapa do procedimento.
Resumo
A reconstrução transcateter percatesa da válvula mitral é uma terapia segura e bem estabelecida para regurgitação mitral sintomática grave em pacientes com alto risco cirúrgico. A orientação ecocardiográfica, além da fluoroscopia, é o padrão-ouro e deve ser realizada utilizando uma técnica padronizada.
Este artigo apresenta nosso guia ecocardiográfico passo a passo reprodutível, incluindo pontos de vista, medidas, além de destacar possíveis dificuldades que possam surgir durante o procedimento.
Este artigo fornece visões ecocardiográficas detalhadas e cronológicas para cada etapa do procedimento, especialmente preferências entre imagens 2D e 3D. Se necessário, são descritas as medidas de onda de pulso, onda contínua e doppler de cor. Além disso, como não há recomendações oficiais para a quantificação da regurgitação mitral durante o procedimento percutâneo de reparação de borda a borda, também está incluído conselhos para quantificação ecocardiográfica após a apreensão dos folhetos mitral e após a implantação do dispositivo. Além disso, o artigo trata de importantes visões ecocardiográficas para prevenir e lidar com possíveis complicações durante o procedimento.
A orientação ecocardiográfica durante o reparo da válvula mitral transcateter é obrigatória. Uma abordagem estruturada melhora a colaboração entre intervencionista e imager e é indispensável para um procedimento seguro e eficaz.
Introdução
A regurgitação mitral (MR) é a segunda indicação mais frequente para cirurgia de válvula na Europa1. Não tratada, pode levar a insuficiência cardíaca grave e redução da qualidade de vida2,3,4. O reparo percutâneo da válvula mitral (PMVR) é uma técnica baseada em cateter, que imita o método cirúrgico de ponto Alfieri para reparar mitral conectando as vieiras A2 e P25. Para pacientes com alto risco cirúrgico, esta técnica oferece uma abordagem minimamente invasiva para o tratamento de RM grave. Dados de diversos registros e ensaios mostraram que o procedimento MitraClip, uma terapia de reparação da válvula mitral transcateter, é um método eficaz e seguro6,7,8,9. Em 2019, um dispositivo semelhante, o sistema de reparo de válvulas transcateter PASCAL, foi introduzido no mercado. Demonstrou viabilidade e segurança aceitável no tratamento de pacientes com MR10grave . A duração e o sucesso do PMVR dependem da habilidade e experiência do operador individual11. Ao contrário de outras técnicas percutâneas, como a substituição transvalvular percutânea (TAVR), que pode ser feita apenas com fluoroscopia, o PMVR requer orientação ecocardiográfica12,13.
Este artigo descreve passo a passo a abordagem ecocardiográfica durante o PMVR, incluindo medições, sugestões de quantificação intraprocedural do RM e pontos de vista importantes para prevenir complicações periprocais.
Access restricted. Please log in or start a trial to view this content.
Protocolo
O protocolo segue as diretrizes do comitê de ética em pesquisa humana da nossa instituição.
1. Avaliação antes da intervenção
- Exclua a derrame pericárdio antes da punção transsepcional. Se houver um pequeno derrame pericárdico, meça o espaço ecolúcido final-diastólico máximo em uma visão de quatro câmaras (4Ch) com foco no ventrículo direito (RV), uma visão de saída de saída ventricular direita do esôfago médio e uma visão de saída de fluxo de longo eixo (LAX).
- Avalie o padrão de fluxo venoso pulmonar com doppler de onda de pulso (PW) na veia pulmonar superior esquerda (LUPV) e exclua a formação de trombos no apêndice atrial esquerdo (LAA). Mostre a visão do eixo curto (SAX) com foco no LAA, varre em seguida 40-60° e gire a sonda no sentido anti-horário para mostrar o LUPV. Avalie o fluxo na veia pulmonar superior direita (RUPV) varrendo a 90-110°(Figura 1 e Figura Suplementar 1).
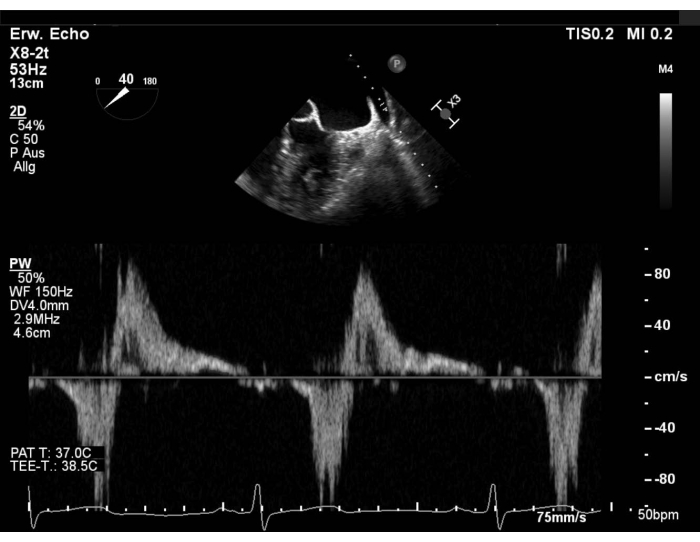
Figura 1: Visualização sax modificada: fluxo PW na veia pulmonar superior esquerda Clique aqui para ver uma versão maior desta figura.
- Garantir que o estado hemodinâmico seja o mesmo durante a avaliação pré e pós-processual.
NOTA: Como o MR é uma doença de válvula dinâmica, a regurgitação pode parecer menos grave sob anestesia geral. Neste caso, consulte o operador e aumente a carga posterior e/ou a pré-carga. - Encontre a melhor vista intercomissural (50-70°). Pegue uma visão perpendicular (X-plane) nos três segmentos com e sem doppler de cor e meça o comprimento do folheto mitral posterior (PML). Em seguida, verifique novamente a morfologia do folheto(Figura 2 e Figura Suplementar 2).

Figura 2: Visão biplanar 2D do MV com doppler de cor: jato de insuficiência medial Clique aqui para ver uma versão maior desta figura.
- Avalie o gradiente de pressão transmissão com doppler de onda contínua (CW) na visão do eixo longo (120-140°).
NOTA: Um gradiente de pressão média (MPG) > 5 mmHg é uma contraindicação relativa para PMVR. - Pegue um conjunto de dados 3D com doppler de cor ou uma imagem de zoom de setor amplo com cor e meça a 3D-vena contracta (3D-VCA)(Figura 3).
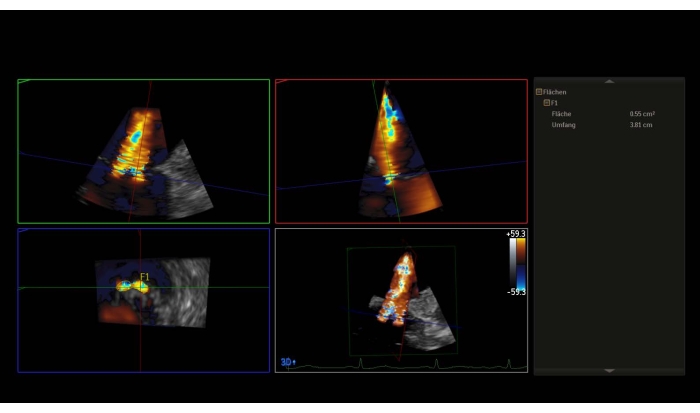
Figura 3: Reconstrução multiplanar do conjunto de dados 3D com doppler de cor: 3D-Vena contracta Por favor clique aqui para ver uma versão maior desta figura.
- Sem cor, utilize o volume 3D para medir a área da válvula mitral (MVA) (Figura Suplementar 3).
NOTA: Uma área < 4 cm2 é uma contraindicação relativa, uma área < 3 cm2 uma contraindicação absoluta para realizar o procedimento. De outra forma, avalie o MVA na visão basal transgásttrica do SAX. - Mostre a visão atrial cirúrgica 3D en-face (válvula aórtica às 12 horas) da válvula mitral.
NOTA: Os segmentos da válvula são denominados "laterais" para os segmentos 1 e "medial" para os segmentos 3. A sequência dos segmentos na visão cirúrgica en-face, é inversa à sequência na visão comissural. Realize uma rotação de 180° no sentido horário na visão cirúrgica en-face 3D (válvula aórtica às 6 horas), o que resultará em uma sequência igual de segmentos em ambas as visualizações(Figura 4 e Figura 5).
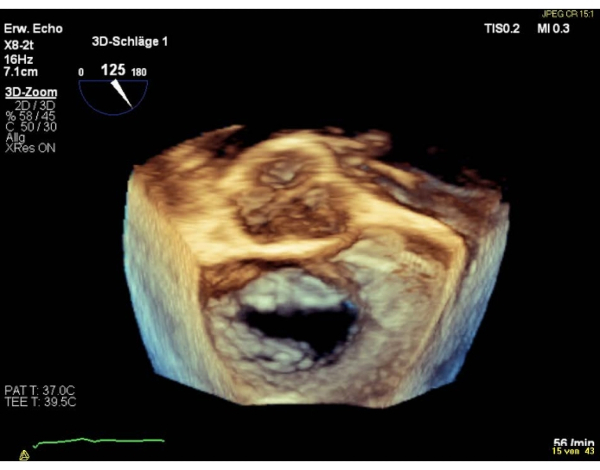
Figura 4: Imagem de zoom do setor amplo: visão atrial cirúrgica 3D en-face (válvula aórtica às 12 horas) Clique aqui para ver uma versão maior desta figura.
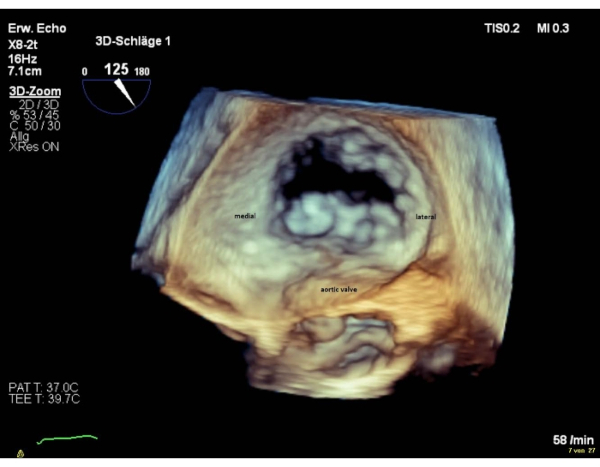
Figura 5: Imagem de zoom do setor amplo: visão atrial en-face 3D (válvula aórtica às 6 horas) Clique aqui para ver uma versão maior desta figura.
- Por fim, faça uma vista bicaval (90-110°) com X-plane, para mostrar a válvula aórtica (AV), para a punção transsepcional.
2. Estratégia
- Discuta a estratégia com o operador antes de inserir o cateter guia direcional (SGC) e o sistema de entrega de clipes (CDS) no átrio esquerdo.
- Avalie uma estratégia de um dispositivo se o orifício estiver < 1 cm de largura e posicione o clipe diretamente acima do jato de regurgitação se o orifício for circular.
- Avalie a implantação de ≥ 2 clipes em caso de grandes jatos elípticos ou múltiplos. Implante o dispositivo iniciando medianamente do orifício regurgitante, pois o posicionamento de um segundo dispositivo é muitas vezes mais fácil quando o primeiro foi implantado desta forma, em vez de depois de iniciar lateralmente(Figura Suplementar 4).
3. Punção transsepcional
- Mostre uma visão bicaval combinada com uma vista SAX. Certifique-se de que o AV está visível, para evitar lesões aórticas.
- Certifique-se de que o local da punção seja ligeiramente superior e posterior(Figura 6).
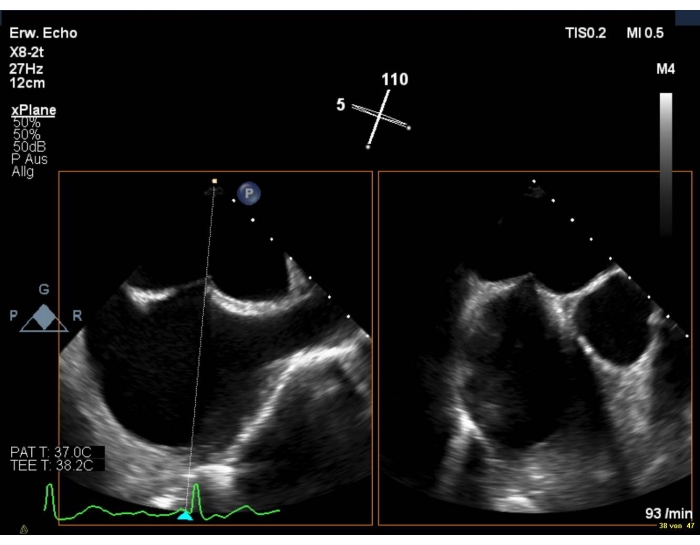
Figura 6: Visão biplanar 2D: punção transsepcional Clique aqui para ver uma versão maior desta figura.
- Escolha uma altura de punção de 4-5 cm em caso de MR degenerativo (por exemplo, prolapso) e de > 3,5 em MR funcional. Evite uma patente foramen ovale, pois a entrada é muito anterior.
- Uma vez que a agulha transsepcional leve à tenda do septo interatrial, meça a altura da punção na vista de 4Ch em meio ao sístole(Figura Suplementar 5).
NOTA: Em pacientes com atria grande, se o local de punção for muito posterior, a tenda não pode ser visualizada na vista de 4Ch. Neste caso, retroflexe e insira a sonda mais profundamente no esôfago. - Após punção transsepcional, exclua sempre a derrame pericárdia na vista de 4Ch.
- Mostre uma vista sax com foco no LAA e veia pulmonar para visualizar a entrada do fio-guia rígido no LUPV.
4. Introdução do SGC no LA
- Visualize a tenda e o avanço do SGC com o dilatador em uma visão SAX com ecocardiografia 2D contínua e orientação fluoroscópica para evitar ferimentos na parede atrial esquerda.
NOTA: A ponta do SGC é definida por um anel duplo radiopaque e eco brilhante(Figura Suplementar 6). - Mostre ao operador a visão sax e a visão bicaval (90-120°) para posicionar o SGC na direção do ventrículo esquerdo (LV).
5. Avanço do CDS para o LA
- Pegue um volume 3D incluindo o septo interarial, o cume lateral esquerdo e o MV e certifique-se de que a crista lateral esquerda seja visível porque a saliência do CDS é comum(Figura 7).

Figura 7: Imagem de zoom de setor amplo: SGC no LA incluindo o septo interatorial, o cume lateral esquerdo e o MV Por favor clique aqui para ver uma versão maior desta figura.
- Caso contrário, escolha a vista SAX e a vista LAX (X-plane) para garantir que o CDS não tenha contato com o cume e a parede LA.
NOTA: O operador pode pedir ao imager para mostrar o septo interatrial e puxar para trás o SGC alguns milímetros para contornar o cume. Se o anel duplo em 3D não puder ser visualizado, mude para 2D e mostre o SGC na exibição SAX.
- Verifique se o CDS está posicionado perpendicularmente à linha de coaptation para garantir uma trajetória correta.
- Mostre a visão intercomissural em 2D em ca. 60° para exibir o plano medial - lateral e a vista LAX em 120-140° para identificar o plano anterior - posterior do MV (Figura Suplementar 7).
- Alternativamente, otimize o posicionamento medial, lateral, anterior e posterior do CDS na visão presencial 3D(Figura Complementar 8).
6. Orientação do dispositivo acima e abaixo do MV
- Leve a visão 3D en-face para mostrar um posicionamento perpendicular dos braços para a linha de coaptation.
- Em caso de má qualidade de imagem, mostre uma visão intercomissural combinada com uma visão LAX(Figura 8 e Figura 9).
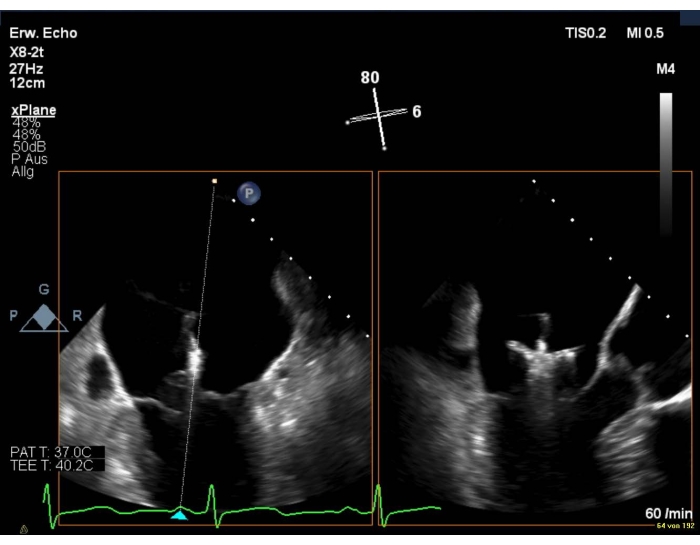
Figura 8: Visão biplanar 2D do MV: posicionamento do dispositivo sobre a válvula mitral Clique aqui para ver uma versão maior desta figura.
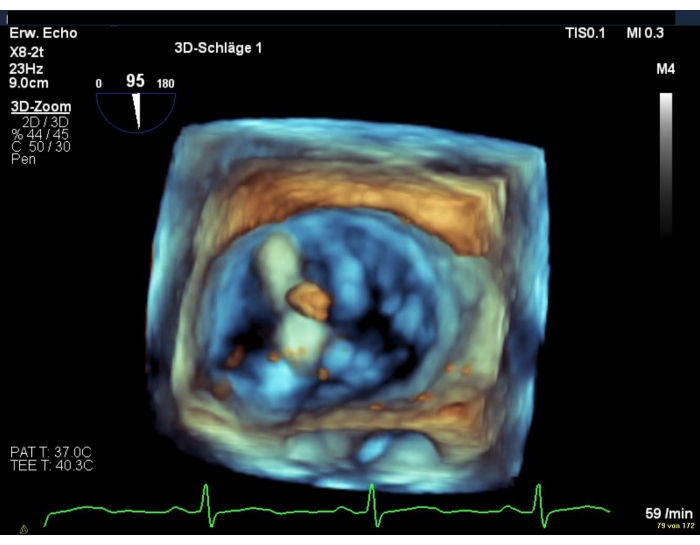
Figura 9: Imagem de zoom do setor amplo: posicionamento do dispositivo sobre a válvula mitral Clique aqui para ver uma versão maior desta figura.
NOTA: Os braços do clipe são visíveis apenas na visão LAX.
- Ajuste o ângulo de visão intercomissural para dispositivos posicionados de forma medial e lateral para visualizar o comprimento completo de ambos os braços. Varrer em ca. 30-45° para dispositivos posicionados com medial e ca. 70-90° para dispositivos posicionados lateralmente.
- Escolha a visão intercomissural combinada com uma visão LAX para visualizar o avanço do CDS para o LV.
- Certifique-se de que o CDS está colocado apenas alguns milímetros abaixo do MV.
- Verifique na visão 3D en-face que os braços do clipe ainda estão na posição planejada, pois uma rotação do clipe durante o cruzamento da válvula é frequente.
NOTA: Se a posição dos braços do clipe tiver sido alterada, será realizada a rotação no sentido horário ou anti-horário para obter apreensão simétrica. Tenha cuidado durante esta manobra para minimizar o emaranhado de coro e subchordal. - Se for necessária uma reorientação grosseira do dispositivo, mostre a visão intercomissural com X-plane para visualizar a inversão do clipe que será recuperado no LA.
7. Apreensão dos folhetos mitral e avaliação do MR antes e depois da implantação do clipe
- Regissumentar a apreensão dos folhetos na visão intercomissural combinada com a vista LAX (X-plane) ou somente na vista LAX(Figura Suplementar 9).
- Peça ao anestesista para realizar uma manobra de respiração para reduzir a mudança durante a ventilação e facilitar a apreensão dos folhetos.
- Certifique-se de visualização contínua da inserção de folhetos para evitar o rolamento dos folhetos ou do chordae.
NOTA: A apreensão de um folheto enrolado ou de uma chorda pode resultar em um desprendimento parcial do folheto e/ou um agravamento do MR. - Avalie cuidadosamente a redução da regurgitação antes da implantação do clipe. Certifique-se de que ambos, operador e imager analisem esta etapa crucial.
- Gire a sonda TEE mediada e lateralmente para o clipe ou use X-plane com doppler colorido para encontrar jatos excêntricos perto do clipe(Figura Suplementar 10).
NOTA: Devido à sombra, podem ocorrer artefatos de sombra causados pela subestimação do CDS do MR. Insira a sonda mais profundamente no esôfago ou mostre a visão transgástrica para visualizar os jatos de insuficiência residual sem sombrear artefatos. - Avalie o fluxo de PW nas veias pulmonares.
NOTA: se uma reversão de fluxo sistólica anterior se transformar em um padrão dominante sistólico, provavelmente ocorreu uma redução relevante. - Meça o MPG através da válvula mitral.
NOTA: Um gradiente > 5 mmHg é uma contraindicação relativa para implantação de clipe (Figura Suplementar 11 e Figura Suplementar 12). - Use a visão en-face 3D do MV ou uma visão sax transgástrica do MV para mostrar o orifício duplo(Figura 10).
- Gire a sonda TEE mediada e lateralmente para o clipe ou use X-plane com doppler colorido para encontrar jatos excêntricos perto do clipe(Figura Suplementar 10).

Figura 10: Imagem de zoom de setor amplo: orifício duplo do MV após a implantação do dispositivo Clique aqui para ver uma versão maior desta figura.
- Por fim, se o resultado for satisfatório, verifique a inserção do folheto em 2D.
- Depois de lançar o clipe do CDS, repita os últimos cinco passos.
NOTA: Devido à tensão do sistema no MV, os jatos de insuficiência residual após a liberação do dispositivo podem ser agravados. - Mostre quando a ponta do cateter de entrega é recuperada do SGC na vista LAX com X-plane e certifique-se de que o pico evita contato com o LA(Figura Suplementar 13).
8. Avaliação final do MR
- Mostre a visão intercomissural com doppler de cor em combinação com x-planes perpendiculares nos jatos de insuficiência residual, se presente.
- Calcule o VCA 3D em um volume 3D. NOTA: geralmente os orifícios não estão no mesmo plano. Neste caso, meçam planimetries separados de cada orifício nos planos apropriados(Figura Complementar 14).
- Avalie mais uma vez o fluxo da veia pulmonar e o gradiente médio através da válvula mitral.
NOTA: O monitoramento contínuo da pressão de LA pode ser uma ferramenta útil durante o reparo da válvula mitral transcateter. - Por fim, mostre a visão 3D en-face da válvula mitral.
9. Implantação de dispositivos adicionais
- Certifique-se de que a redução do MR é suficiente.
NOTA: Se o resultado não for satisfatório, avalie a implantação de dispositivos adicionais. - Certifique-se de que o dispositivo adicional não entre em contato com o dispositivo implantado mergulhando no ventrículo esquerdo.
NOTA: a fluoroscopia é essencial para mostrar a distância real entre os clipes. - Mostre a visão facial 3D para visualizar a linha comissural, pois pode ser adiada após a implantação do primeiro clipe.
- Repita os cinco passos conforme explicado no ponto 7.4 para avaliar mr depois de agarrar os folhetos com o clipe adicional.
Access restricted. Please log in or start a trial to view this content.
Resultados
O reparo percutâneo da válvula de borda a borda é uma alternativa ao reparo ou substituição da válvula cirúrgica em pacientes não elegíveis para cirurgia com ressonância magnética grave sintomática. A primeira aplicação clínica do MitraClip foi investigada no estudo de reparo endovascular edge-to-edge da válvula de borda a borda I (EVEREST I)14. Muitos outros estudos comprovaram a eficácia do procedimento com melhora dos sintomas, bem como baixas taxas de mortalidade hospitalar e ...
Access restricted. Please log in or start a trial to view this content.
Discussão
A orientação ecológica para o PMVR é um método seguro. Complicações devido à ecocardiografia podem ocorrer, mas raramente levam a danos significativos. No entanto, lesões esofágicas são possíveis após a realização da ecocardiografia transesofágica. Essa incidência é reduzida com menor duração da intervenção34. Pelo contrário, várias complicações associadas ao reparo da válvula mitral de borda a borda do transcateter são descritas35,
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos à Sra. Dorothea Scheurlen pelo suporte técnico em vídeo.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| EPIQ 7 Ultrasound System | Philips | US218B0542 | Cardiac Ultrasound Machine |
| X8-2t xMATRIX 3D-TEE probe | Philips | B34YYK | TEE-probe |
| Sheath 6F 25 cm | Merit Medical | B60N25AQ | Sheath |
| Dilator 16 F | Abbott | 405544 | Dilator |
| BRK-1 transseptal needle 71 cm | St. Jude Medical | ABVA407201 | Transseptal Needle |
| Swartz Lamp 90° | St. Jude Medical | 407356 | Transseptal Guiding Introducer Sheath |
| Amplatz super stiff | Kook Medical | 46509 | Wire |
| Steerable Guide Catheter | Abbott | SGC0302 | Steerable Guide Catheter |
| MitraClip NTR Delivery System | Abbott | CDS0602-NTR | Clip Delivery System |
| MitraClip NTR Bundle | Abbott | MSK0602-NTR | Device |
Referências
- Iung, B., et al. A prospective survey of patients with valvular heart disease in Europe: The Euro Heart Survey on Valvular Heart Disease. European Heart Journal. 24 (13), 1231-1243 (2003).
- Hauptman, P. J., Rector, T. S., Wentworth, D., Kubo, S. Quality of life in advanced heart failure: role of mitral regurgitation. American Heart Journal. 151 (1), 213-218 (2006).
- Lewis, E. F. Assessing the impact of heart failure therapeutics on quality of life and functional capacity. Current Treatment Options in Cardiovascular Medicine. 15 (4), 425-436 (2013).
- Vaishnava, P., Lewis, E. F. Assessment of quality of life in severe heart failure. Current Heart Failure Reports. 4 (3), 170-177 (2007).
- Feldman, T., et al. Percutaneous repair or surgery for mitral regurgitation. New England Journal of Medicine. 364 (15), 1395-1406 (2011).
- Feldman, T., et al. Percutaneous mitral repair with the MitraClip system: safety and midterm durability in the initial EVEREST (Endovascular Valve Edge-to-Edge REpair Study) cohort. Journal of the American College of Cardiology. 54 (8), 686-694 (2009).
- Whitlow, P. L., et al. Acute and 12-month results with catheter-based mitral valve leaflet repair: the EVEREST II (Endovascular Valve Edge-to-Edge Repair) High Risk Study. Journal of the American College of Cardiology. 59 (2), 130-139 (2012).
- Baldus, S., et al. MitraClip therapy in daily clinical practice: initial results from the German transcatheter mitral valve interventions (TRAMI) registry. European Journal of Heart Failure. 14 (9), 1050-1055 (2012).
- Stone, G. W., et al. Transcatheter Mitral-Valve Repair in Patients with Heart Failure. New England Journal of Medicine. 379 (24), 2307-2318 (2018).
- Lim, D. S., et al. Transcatheter Valve Repair for Patients With Mitral Regurgitation: 30-Day Results of the CLASP Study. JACC: Cardiovascular Interventions. 12 (14), 1369-1378 (2019).
- Schillinger, W., et al. Impact of the learning curve on outcomes after percutaneous mitral valve repair with MitraClip and lessons learned after the first 75 consecutive patients. European Journal of Heart Failure. 13 (12), 1331-1339 (2011).
- Katz, W. E., Conrad Smith, A. J., Crock, F. W., Cavalcante, J. L. Echocardiographic evaluation and guidance for MitraClip procedure. Cardiovascular Diagnosis and Therapy. 7 (6), 616-632 (2017).
- Altiok, E., et al. Optimized guidance of percutaneous edge-to edge repair of the mitral valve using real-time 3-D transesophageal echocardiography. Clinical Research in Cardiology. 100 (8), 675-681 (2011).
- Feldman, T., et al. Percutaneous mitral valve repair using the edge-to-edge technique: six-month results of the EVEREST Phase I Clinical Trial. Journal of the American College of Cardiology. 46 (11), 2134-2140 (2005).
- Maisano, F., et al. Percutaneous mitral valve interventions in the real world: early and 1-year results from the ACCESS-EU, a prospective, multicenter, nonrandomized post-approval study of the MitraClip therapy in Europe. Journal of the American College of Cardiology. 62 (12), 1052-1061 (2013).
- Kalbacher, D., et al. Long-term outcome, survival and predictors of mortality after MitraClip therapy: Results from the German Transcatheter Mitral Valve Interventions (TRAMI) registry. International Journal of Cardiology. 277, 35-41 (2019).
- Glower, D. D., et al. Percutaneous mitral valve repair for mitral regurgitation in high-risk patients: results of the EVEREST II study. Journal of the American College of Cardiology. 64 (2), 172-181 (2014).
- Baumgartner, H., et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. European Heart Journal. 38 (36), 2739-2791 (2017).
- Obadia, J. F., et al. MITRA-FR Investigators. Percutaneous Repair or Medical Treatment for Secondary Mitral Regurgitation. New England Journal of Medicine. 379 (24), 2297-2306 (2018).
- Stone, G. W., et al. COAPT Investigators. Transcatheter Mitral-Valve Repair in Patients with Heart Failure. New England Journal of Medicine. 379 (24), 2307-2318 (2018).
- Vahanian, A., et al. Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC); European Association for Cardio-Thoracic Surgery (EACTS), Guidelines on the management of valvular heart disease (version 2012). European Heart Journal. 33 (19), 2451-2496 (2012).
- American College of Cardiology/American Heart Association Task Force on Practice Guidelines; Society of Cardiovascular Anesthesiologists; Society for Cardiovascular Angiography and Interventions. ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 114 (5), 84(2006).
- Praz, F., et al. Compassionate use of the PASCAL transcatheter mitral valve repair system for patients with severe mitral regurgitation: a multicentre, prospective, observational, first-in-man study. Lancet. 390 (10096), 773-780 (2017).
- McCarthy, K. P., Ring, L., Rana, B. S. Anatomy of the mitral valve: understanding the mitral valve complex in mitral regurgitation. European Journal of Echocardiography. 11 (10), 3-9 (2010).
- Zoghbi, W. A., et al. Recommendations for Noninvasive Evaluation of Native Valvular Regurgitation: A Report from the American Society of Echocardiography Developed in Collaboration with the Society for Cardiovascular Magnetic Resonance. Journal of the American Society of Echocardiography. 30 (4), 303-371 (2017).
- Zoghbi, W. A., et al. Guidelines for the Evaluation of Valvular Regurgitation Percutaneous Valve Repair or Replacement: A Report from the American Society of Echocardiography Developed in Collaboration with the Society for Cardiovascular Angiography and Interventions, Japanese Society of Echocardiography, and Society for Cardiovascular Magnetic Resonance. Journal of the American Society of Echocardiography. 32 (4), 431-475 (2019).
- Abudiab, M. M., Chao, C. J., Liu, S., Naqvi, T. Z. Quantitation of valve regurgitation severity by three-dimensional vena contracta area is superior to flow convergence method of quantitation on transesophageal echocardiography. Echocardiography. 34 (7), 992-1001 (2017).
- Dietl, A., et al. 3D vena contracta area after MitraClip procedure: precise quantification of residual mitral regurgitation and identification of prognostic information. Cardiovasc Ultrasound. 16 (1), 1(2018).
- Ikenaga, H., et al. Usefulness of Intraprocedural Pulmonary Venous Flow for Predicting Recurrent Mitral Regurgitation and Clinical Outcomes After Percutaneous Mitral Valve Repair With the MitraClip. JACC: Cardiovascular Interventions. 12 (2), 140-150 (2019).
- Tang, G. H. L., et al. Continuous invasive hemodynamic monitoring using steerable guide catheter to optimize mitraclip transcatheter mitral valve repair: A multicenter, proof-of-concept study. Journal of Interventional Cardiology. 31 (6), 907-915 (2018).
- Maor, E., et al. Acute Changes in Left Atrial Pressure After MitraClip Are Associated With Improvement in 6-Minute Walk Distance. Circulation: Cardiovascular Interventions. 10 (4), 004856(2017).
- Kuwata, S., et al. Continuous Direct Left Atrial Pressure: Intraprocedural Measurement Predicts Clinical Response Following MitraClip Therapy. JACC: Cardiovascular Interventions. 12 (2), 127-136 (2019).
- Corrigan, F. E., et al. Pulmonary Venous Waveforms Predict Rehospitalization and Mortality After Percutaneous Mitral Valve Repair. JACC Cardiovasc Imaging. 12 (10), 1905-1913 (2019).
- Ruf, T. F., et al. ELMSTREET (Esophageal Lesions during MitraClip uSing TRansEsophageal Echocardiography Trial. EuroIntervention. 13 (12), 1444-1451 (2017).
- Eggebrecht, H., et al. Risk and outcomes of complications during and after MitraClip implantation: Experience in 828 patients from the German TRAnscatheter mitral valve interventions (TRAMI) registry. Catheterization and Cardiovascular Interventions. 86 (4), 728-735 (2015).
- von Bardeleben, R. S., et al. Incidence and in-hospital safety outcomes of patients undergoing percutaneous mitral valve edge-to-edge repair using MitraClip: five-year German national patient sample including 13,575 implants. EuroIntervention. 14 (17), 1725-1732 (2019).
- Généreux, P., et al. Incidence, predictors, and prognostic impact of late bleeding complications after transcatheter aortic valve replacement. Journal of the American College of Cardiology. 64 (24), 2605-2615 (2014).
- Benito-González, T., Estévez-Loureiro, R., Gualis, J. Chordal Rupture Following MitraClip Implantation Resulting in Massive Mitral Regurgitation. Journal of Invasive Cardiology. 27 (10), 224-225 (2015).
- Kaneko, H., Neuss, M., Weissenborn, J., Butter, C. Impact of residual mitral regurgitation after MitraClip implantation. International Journal of Cardiology. 227, 813-819 (2017).
- Buzzatti, N., et al. What is a "good" result after transcatheter mitral repair? Impact of 2+ residual mitral regurgitation. Journal of Thoracic and Cardiovascular Surgery. 151 (1), 88-96 (2016).
- Feldman, T., Guerrero, M. Assessing the Balance Between Less Mitral Regurgitation and More Residual Transmitral Pressure Gradient After MitraClip. JACC: Cardiovascular Interventions. 10 (9), 940-941 (2017).
- Neuss, M., et al. Elevated Mitral Valve Pressure Gradient After MitraClip Implantation Deteriorates Long-Term Outcome in Patients With Severe Mitral Regurgitation and Severe Failure. JACC: Cardiovascular Interventions. 10 (9), 931-939 (2017).
- Katz, W. E., Conrad Smith, A. J., Crock, F. W., Cavalcante, J. L. Echocardiographic evaluation and guidance for MitraClip procedure. Cardiovascular Diagnosis and Therapy. 7 (6), 616-632 (2017).
- Labrousse, L., et al. Guidance of the MitraClip procedure by 2D and 3D imaging. Archives of Cardiovascular Diseases. 111 (6-7), 432-440 (2018).
- Khalique, O. K., Hahn, R. T. Percutaneous Mitral Valve Repair: Multi-Modality Cardiac Imaging for Patient Selection and Intra-Procedural Guidance. Frontiers in Cardiovascular Medicine. 6, 142(2019).
- Bushari, L. I., et al. Percutaneous Transcatheter Edge-to-Edge MitraClip Technique: A Practical "Step-by-Step" 3-Dimensional Transesophageal Echocardiography Guide. Mayo Clinic Proceedings. 94 (1), 89-102 (2019).
- Sherif, M. A., et al. MitraClip step by step; how to simplify the procedure. Netherlands Heart Journal. 25 (2), 125(2017).
- Guarracino, F., et al. Transesophageal echocardiography during MitraClip procedure. Anesthesia & Analgesia. 118 (6), 1188-1196 (2014).
- Avenatti, E., et al. Diagnostic Value of 3-Dimensional Vena Contracta Area for the Quantification of Residual Mitral Regurgitation After MitraClip Procedure. JACC: Cardiovascular Interventions. 12 (6), 582-591 (2019).
- Altiok, E., et al. Analysis of procedural effects of percutaneous edge-to-edge mitral valve repair by 2D and 3D echocardiography. Circulation: Cardiovascular Imaging. 5 (6), 748-755 (2012).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados