Method Article
急性マウス膵臓組織スライスにおけるカルシウム動態の共焦点レーザー走査顕微鏡
要約
我々は、急性膵臓組織スライスの調製と共焦点レーザー走査顕微鏡におけるそれらの使用を提示し、多数の生細胞において、長期間にわたり、高い時空間分解能でカルシウム動態を同時に研究する。
要約
急性マウス膵臓組織スライスは、細胞間通信および組織アーキテクチャが保存されたユニークなin situ製剤であり、典型的なin vitro研究に記載されている単離された膵島、アシニ、ダクト、または分散細胞よりも有意に少ない調製誘発変化を伴う。急性膵臓組織スライスを共焦点レーザー走査顕微鏡(CLSM)における生細胞カルシウムイメージングと組み合わせることにより、カルシウムシグナルを多数の内分泌細胞および外分泌細胞で同時に、単一細胞または細胞内分解能で研究することができる。感度は変化の検出を可能にし、細胞間波動および機能的連結性の研究、ならびに膵島内でのそれらの局在化および他の細胞とのパラクリン関係に対する細胞の生理学的応答の依存性の研究を可能にする。最後に、動物福祉の観点から、一度に多数の細胞からの信号を記録することは、実験に必要な動物の数を減らし、3Rの置換、減少、および改良の原則に寄与する。
概要
哺乳類の膵臓は大きな外分泌腺と内分泌腺です。外分泌部分は、膵臓の総体積の96〜99%を占め、腺房および管からなる。内分泌部は、膵臓総体積1の残りの1〜4%を占める多数のランゲルハンス島からなる。外分泌部は、食物中のエネルギーに富むポリマーを分解する主要な消化酵素、ならびに重炭酸塩が豊富な液体を分泌し、これは他の胃腸分泌物と組み合わせて酵素の作用に適した環境を提供する。内分泌部は、エネルギーに富む栄養素の食後の分布、貯蔵、食間放出を調節するホルモンを分泌します。外分泌組織は比較的未発達であり、内分泌は出生時に比較的よく発達しているが、前者は離乳時に後者を急速に増殖させる2,3,4。膵臓機能の初期の研究は現代の生理学の誕生をマークし、この分野における主要な方法論的進歩に続いて主要な科学的ブレークトラフが続いています5。膵臓との協働は、腺の複雑な構造のために技術的に困難ですが、膵臓癌、膵炎、糖尿病など、公衆衛生に大きな脅威をもたらし、新しい治療アプローチが必要な疾患のためにも大きな動機です。
単離された膵島6、腺房7、8、および乳管断片は、細胞株および一次分散内分泌細胞、腺房細胞、および乳管細胞9,10と比較してそれらの利点のために、ゴールドスタンダード法として何十年もの間開発され、使用されてきた。単離された細胞集合体の機能が著しく改善されたにもかかわらず、これらの方法は依然としてかなりの機械的および酵素的ストレスを伴い、周囲の組織から細胞を単離し、したがってパラクリン相互作用および機械的支持を欠いており、そして最も重要なことに、正常な生理学への有意な変化を伴う11,12,13。.急性マウス膵臓組織スライスは、保存された細胞間接触、パラクリン相互作用、間葉、および組織構造を有する脳、下垂体、および副腎スライスに似た実験プラットフォームを開発する必要性が認識された必要性から、ならびに当時の膵島研究におけるゴールドスタンダード法の最も重要な欠点のいくつかなしに、2001年に開発された - 単離された膵島12、14。これらの欠点の中には、最外層の損傷、コア膵島領域のアクセシビリティの欠如、および細胞の同一性および生理機能におそらく重要な影響を及ぼす培養の必要性が含まれる12,15。さらに、組織スライス法は、膵島を単離することが不可能な場合、または従来の単離によって膵島収量が極端に低い場合、ひどく狂った膵島構造を有する動物モデルの研究を可能にする16、17、18、19、20、21。
さらに、このスライスは、例えば、組織全体のより良い概観を可能にし、地域差の研究とも両立するため、糖尿病および膵炎の発症中の形態学的変化を研究するのにより適している。重要なことに、内分泌部分への早期の焦点にもかかわらず、組織スライス法は、本質的に、外分泌成分9、22、23の研究を可能にする。その導入後の最初の10年間、この方法は、ベータ14、24、25、26、27、28、29およびα30,31細胞の電気生理学的研究ならびに膵臓の形態学的および機能的成熟を調べるために採用された2,3.10年後の2013年、この方法は、蛍光カルシウム色素と膜電位色素34を組み合わせることにより、グルコース32に対する応答、それらの機能的連結性パターン33、および膜電位と細胞内カルシウムとの関係を特徴付けるために、CLSMを用いた膵島細胞の生細胞カルシウムイメージングに成功しました。同年後半に、この方法は、腺房細胞におけるカルシウム動態を評価するためにも使用された22,35。その後の数年間にわたり、膵臓組織スライスは、多数の異なる研究において使用され、ブタおよびヒト組織9、36、37、38、39、40、41に首尾よく適合してきた。しかし、まとめると、カルシウムイメージングは、マウス膵臓組織スライス全般、特に膵島において、依然としてほとんどがこのグループによって行われている。この主な理由の1つは、技術的に困難な組織スライス調製、共焦点顕微鏡の必要性、およびかなり複雑なデータ分析の組み合わせにある可能性があります。この論文の主な目的は、この強力な方法を他の潜在的なユーザーがよりアクセスしやすくすることです。
組織スライスの調製および構造および分泌研究のためのスライスの使用を詳細に扱う優れた方法論的論文はすでにいくつかあるが、共焦点カルシウムイメージングについてはそうではない9,42,43。したがって、このホワイトペーパーでは、スライスの準備中のいくつかの追加のヒントとコツ、染料ローディング、画像取得を成功させるために重要なステップ、および基本的なカルシウムデータ分析の主なステップに焦点を当てます。したがって、この貢献は、上記の方法の代替としてではなく、補完的であると考えるべきである。同様に、マウス膵臓組織スライスにおけるカルシウムイメージングは、特定の質問に答えるために使用される実験的アプローチとして見なされるものとし、したがって、単離された管またはアシニ、単離された膵島、オルガノイド、眼の前房に移植された膵島などの膵生理学における他のカルシウムイメージングアプローチの絶対的な代替手段ではなく、 11、44、45、46、47、48のインビボでの記録を含む。マウス膵臓組織スライスにおけるカルシウムイメージングの有望性は、周皮細胞49およびマクロファージ50などの膵島間葉系細胞、ならびに乳管細胞23におけるカルシウム動態の最近の成功した記録によって最もよく示されている。
プロトコル
注:すべての実験は、研究における動物の世話と使用に関する機関のガイドラインに厳密に従って実施されました。このプロトコルは、スロベニア共和国食品安全、獣医部門および植物保護のための管理局によって承認されました(許可番号:34401-35-2018/2)。
1. 膵臓組織スライスの調製
注:CLSMを用いたカルシウムイメージング用の急性マウス膵臓組織スライスの調製は、多数の器具、異なる溶液を必要とし、 図1 に概略的に提示され、以下に詳述される一連の重要なステップで進行する。
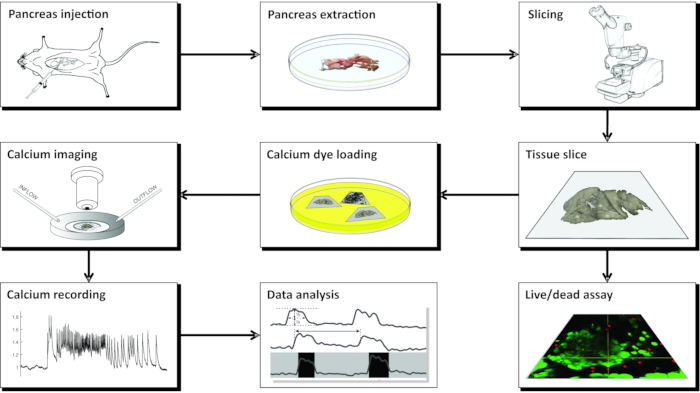
図1:ワークフロー図膵臓組織スライス調製の過程におけるすべてのステップの概略図は、総胆管へのアガロースの注入から始まり、続いて膵臓の抽出およびスライスによって開始される。調製されたスライスは、Live/Deadキットで組織の生存率を評価するために、またはカルシウムセンサーで染色するために使用することができる。染色されると、イメージングの準備が整います。その後、イメージングプロセスから得られた記録は、データ分析に使用されます。この図の拡大版を表示するには、ここをクリックしてください。
- 溶液の調製
注:すべての溶液は事前に準備する必要があり、4〜8°Cの冷蔵庫に最大1ヶ月間保存することができます。組織スライスの調製および保存のためには、6mMグルコースおよび0.3Lの4-(2-ヒドロキシエチル)-1-ピペラジンエタンスルホン酸(HEPES)緩衝液を含む約0.5Lの細胞外溶液(ECS)が必要である。1~2mL/分の流速に設定した周囲融合システムによる1日間のカルシウムイメージングでは、約0.5LのECSが必要です。- 6 mM グルコースを含む細胞外溶液
- 125 mM NaCl、26 mM NaHCO 3、6 mM グルコース、6 mM 乳酸、3 mM ミオイノシトール、2.5 mM KCl、2 mM Naピルビン酸、2 mM CaCl 2、1.25 mM NaH 2 PO4、1 mM MgCl2、および 0.5 mM アスコルビン酸を含む 1L の ECS を調製します。すべての成分が完全に溶解するまで十分に混合する。50 μLのECSを0.5 mLの微量遠心チューブに入れ、製造元の指示に従って浸透圧計の上に置き、浸透圧を確認してください。
注:浸透圧は300-320 mOsmでなければなりません。ベータ細胞の刺激のために、より高いグルコース濃度の溶液を使用する。スライスおよび実験中に生理学的pH値が7.4であることを保証するために、気圧下でカルボゲン(すなわち、95%O2 および5%CO2の混合ガス)でECSを絶えずバブリングする。簡単なバブリングシステムは、5mmシリコンチューブの一方の端をカルボゲンの供給源(すなわち、加圧ガスボンベ)に取り付け、チューブの他端をECSを含むボトルに直接取り付けることによってセットアップすることができる。 - あるいは、1250 mM NaCl、260 mM NaHCO3、30 mM ミオイノシトール、25 mM KCl、20 mM Naピルビン酸、12.5 mM NaH2PO4、および 5 mM アスコルビン酸を含む 10x ストックを調製します。6 mM グルコースを含む ECS が必要な場合は、100 mL のストックを 2 mL の 1 M CaCl 2、1 mL の 1 M MgCl 2、0.455 mL の13.2 M 乳酸、および 1.08 g のグルコースと混合し、1 L までの二重蒸留水で満たします。必要に応じて、異なる量のグルコースを使用して、他のグルコース濃度を得る。
- 125 mM NaCl、26 mM NaHCO 3、6 mM グルコース、6 mM 乳酸、3 mM ミオイノシトール、2.5 mM KCl、2 mM Naピルビン酸、2 mM CaCl 2、1.25 mM NaH 2 PO4、1 mM MgCl2、および 0.5 mM アスコルビン酸を含む 1L の ECS を調製します。すべての成分が完全に溶解するまで十分に混合する。50 μLのECSを0.5 mLの微量遠心チューブに入れ、製造元の指示に従って浸透圧計の上に置き、浸透圧を確認してください。
- 6 mM グルコースを含む HEPES緩衝液
- 150 mM NaCl、10 mM HEPES、6 mM グルコース、5 mM KCl、2 mM CaCl 2、および 1 mM MgCl2 を含む 0.5 L の HEPES 緩衝溶液 (HBS) を調製する。1 M NaOHでpH=7.4に滴定する。
メモ: carbogen が使用できない場合は、ECS の代わりにこのバッファをすべてのステップに使用できます。
- 150 mM NaCl、10 mM HEPES、6 mM グルコース、5 mM KCl、2 mM CaCl 2、および 1 mM MgCl2 を含む 0.5 L の HEPES 緩衝溶液 (HBS) を調製する。1 M NaOHでpH=7.4に滴定する。
- アガロース (1.9% w/w)
- 水浴を40°Cに予備加温する。
- 0.475gの低融点アガロースおよび6mMグルコースを含むECS25mLを三角フラスコに加え、フラスコを最大電力で電子レンジに入れ、沸騰し始めるまで数秒間置く。オーブンからフラスコを取り出し、アガロースが完全に溶解するまで数回旋回させる。液体アガロースの入ったフラスコを40°Cの予温水浴に移し、アガロースを所望の温度に冷却し、注射まで液体に保つ。フラスコを安定化リードリングで固定します。
注:アガロースは事前に準備し、冷蔵庫に保管することができます。使用前に、電子レンジでアガロースを液化するまで加温し、三角フラスコを40°Cに予備加温した水浴に移した。 アガロースは最大5倍まで再利用できます。5倍を超えて再利用すると、密度が高くなり、注入が難しくなります。
- 6 mM グルコースを含む細胞外溶液
- アガロースによる膵臓の注射
注:セクション1.2および1.3では、カルシウムイメージング、電気生理学、免疫組織化学、分泌研究、構造/微小解剖学的研究などのさまざまな実験目的に使用できる組織スライスの調製について説明します。- ステップ1.1.3.2の水浴中の三角フラスコからの液体アガロースで5mLシリンジを満たし、気泡を除去し、30G針を取り付ける。針をキャップで保護し、充填されたシリンジを水浴に戻し、針を下向きにし、アガロースの全量を水面下に置きます。リングがシリンジを水浴の壁に押し付けるように、シリンジを安定化リードリングで固定します。
注:アガロースはすぐに固まって針をふさぐので、針に押し込まないように注意してください。室温が低く、注射が経験の浅い人によって行われる場合は、水浴の温度を42°Cまで上げて、注射のための追加の時間を得る。 - アイスバケツに氷を入れ、ECSの入ったボトルを入れます。ECSを気圧と室温でカーボーゲンで常に1.5mL/minでバブリングして、酸素化とpH7.4を確保します。
- 高濃度のCO2 を投与してマウスを屠殺し、続いて子宮頸部脱臼を行う。動物の苦しみを最小限に抑えるためにあらゆる努力をしてください。
- 実体顕微鏡下で作業し、開腹術を介して腹部にアクセスする(図2A)。(マウスの解剖学的観点から)マウスの左側に腸を静かに反転させて、総胆管を露出させる。鉗子を使用して十二指腸部分をわずかに持ち上げ、Vaterの主要な十二指腸乳頭 - 乳頭を見つけます。止血剤(図2B、C)を使用して十二指腸乳頭の総胆管をクランプし、ダクトから十二指腸へのアガロースの漏れを防ぎます。
注:十二指腸へのアガロースの漏れを防ぎ、さらに胃腸管内で上下に、乳頭から近位および遠位の両方で十二指腸をクランプするように止血剤を配置します。この目的のために湾曲した止血剤を使用するのが最善です。 - 小さな鋭い鉗子で、総胆管の下に到達し、管を膵臓組織に付着させる膜を壊す。より良い視覚的制御とより簡単な注射のために、できるだけ多くの脂肪と結合組織をダクトから取り除きます。
- ダクトを大きな鉗子の上に垂直に置き(図2D)、調製した液体アガロースを総胆管の近位部分に注入する(図2D)。アガロースは粘性があるので、シリンジを強く絞ってください。膵臓が白っぽくわずかに外れるまで、または少なくとも20〜30秒間、膵臓を満たし続けます。
メモ: これは、スライスの準備において最も重要なステップです。膵臓の管の木にねじれがある場合は、膵臓を静かに上昇させるか、注射器から引き離して平らにします。注射点の逆流および十二指腸への前方漏出は、典型的には膵臓の管状木に注入された体積よりもはるかに高いので、注射器から注入された体積に基づいて注射を停止する時期を決定しないでください。重要なことに、成功した注射は、注射器容積の実質的に目立たない変化で行うことができる。 - シリンジを取り出し、20mLの泡立てた氷冷ECSをボトルから膵臓に0〜4°Cでゆっくりと注ぎ、組織を冷却し、アガロースを硬化させる。
- 鉗子と細かい丈夫なはさみを使って膵臓を優しく抽出します。抽出した膵臓を、約40mLの氷冷ECSを含む100mmのペトリ皿に入れ、静かに動かして洗浄する。膵臓を、約40mLの氷冷ECSを含む新鮮な100mmペトリ皿に移す。
- 白っぽく見える膵臓のよく注入された部分から(図3A)、鉗子と丈夫な切断はさみを使用して、0.1〜0.2cm3の大きさの組織の6ブロックまで切断する。結合組織や脂肪組織を取り除いてください。
- 35mmの非粘着性の底部シャーレに約5mLの液体アガロースを40°Cで満たし、組織ブロックをその中に移し、すぐにペトリ皿を氷の上に置き、冷却してアガロースを硬化させる。
注:膵臓のブロックがアガロースに閉じ込められる方法は、スライス中に切断される方法を決定します。経験豊富な実験家は、氷の上に置かれたときにアガロースが固まる前の数瞬の間にブロックの位置を微調整しようとすることができます。 - 組織ブロックの付いたアガロースが固まったら、100mmのシャーレの蓋などの平らな滑らかな面にペトリ皿を逆さまにし、カミソリの刃の半分でペトリ皿の側壁とアガロースの間の隙間に軽く切ってアガロースを取り除きます。カミソリの刃で、それぞれが1つの組織ブロックを含む個々のアガロース立方体を切り取り、各組織ブロックがアガロースに囲まれるように注意する。アガロースブロックをシアノアクリレート接着剤でビブラトームのサンプルプレートに接着する(図3B)。
- ステップ1.1.3.2の水浴中の三角フラスコからの液体アガロースで5mLシリンジを満たし、気泡を除去し、30G針を取り付ける。針をキャップで保護し、充填されたシリンジを水浴に戻し、針を下向きにし、アガロースの全量を水面下に置きます。リングがシリンジを水浴の壁に押し付けるように、シリンジを安定化リードリングで固定します。
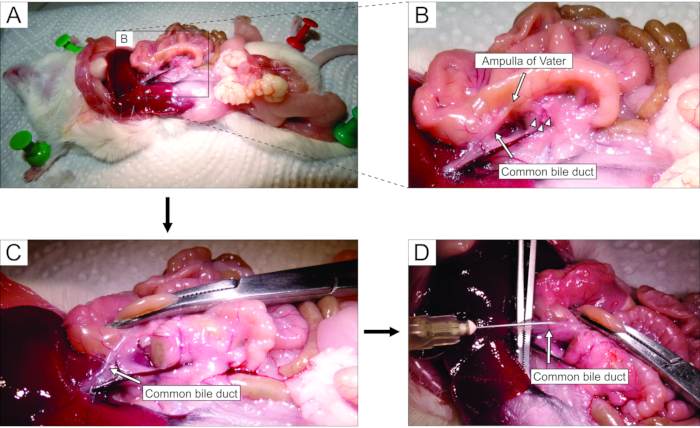
図2:総胆管へのアガロースの注射 (A)腹腔を開き、腹腔内の器官を露出させる。(B)パネル Aの長方形で囲まれた領域の拡大部分。十二指腸の白い斑点(矢印で示す)は、Vaterのアンプラを示しています。ランゲルハンス島は矢じりで示されています。(C)湾曲した止血剤でVaterのアンプラをクランプし、それをわずかに上げて露出させ、総胆管を静かに伸ばす(矢印)。(d)総胆管の開頭および5mLシリンジおよび30G針を用いた1.9%アガロース溶液の注射。 この図の拡大版を表示するには、ここをクリックしてください。
- スライス
- ビブラートームの切断チャンバを〜0.15Lの氷冷ECSで満たし、カルボゲンで絶えず泡立てる。切断チャンバを氷で囲み、6mMグルコースを含むECS製の2つのアイスキューブ(それぞれ約10mL)を切断チャンバに加える。切断用のカミソリの刃をビブラトームに取り付け、サンプルプレートをアガロースブロックで所定の位置にネジ固定します。
- アガロースブロックを0.05~1mm/s、70Hzで切断し、表面積20~100mm2の厚さ140μmのスライスにスライサーをセットします。スライサーの設定については、製造元の指示に従います。
- 各切断ステップの直後に、スライサーを一時停止し、細かいペイントブラシでスライスを静かに収集し、室温で6mMグルコースを含む40mLのHEPES緩衝液で満たされた100mmシャーレに移す(図3C)。
メモ: スライスは室温の HEPESバッファーに少なくとも 12 時間保管でき、バッファーは 2 時間ごとに交換する必要があります。
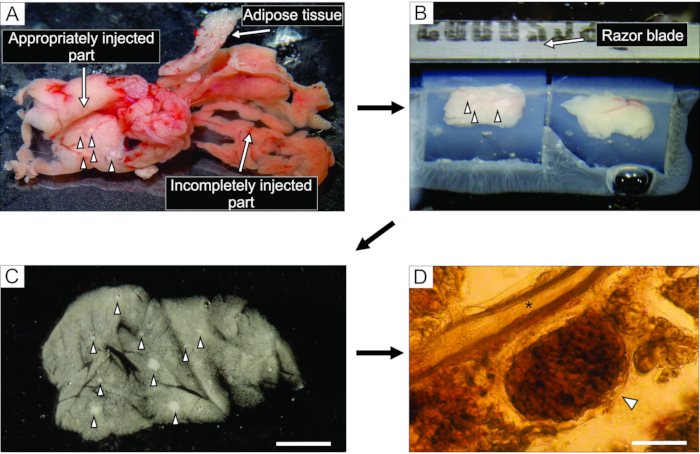
図3:膵臓組織調製およびスライス。左側の白い組織は、よく注入された部分(十二指腸部分)を示し、右側のより赤みを帯びた部分は、膵臓の不十分な注入部分(脾臓部分)を示す。(b)アガロースに埋め込まれた膵臓組織の2ブロックのビブラトームスライス。(c)矢じりで示されたランゲルハンスの膵島を有する急性膵臓組織切片。(D)ランゲルハンス膵島を有する光学顕微鏡下の急性膵臓組織スライスは矢印で示し、アスタリスクは膵管を示す。スケール バー = 100 μm。この図の拡大版を表示するには、ここをクリックしてください。
2. 哺乳類細胞に対するLIVE/DEAD生存率/細胞毒性キットを用いた生/死アッセイ
注:一部の実験では、スライス内の細胞の生存率(図4)を以下のように生/死アッセイによって確認することが有用である。
- 製造元の指示に従って、LIVE/DEAD生存率/細胞毒性キットの試薬でバイアルを解凍し、使用直前にカルセインAMの作業溶液を調製します。1日以内にソリューションを使用してください。
- 15 mL 遠沈管で、5 μL の 4 mM カルセイン AM (成分 A)、20 μL の 2 mM エチジウムホモダイマー-1 (EthD-1、成分 B)、および 10 mL のダルベッコリン酸緩衝生理食塩水 (D-PBS) を混合して、約 2 μM カルセイン AM および 4 μM EthD-1 を含む作業溶液を調製します。徹底的に渦。
- 細かいペイントブラシを使用して、組織スライスを新鮮なHEPES緩衝液で3mLのシャーレに静かに移し、血清エステラーゼ活性を希釈する。HEPESバッファーを除去し、スライスをステップ2.2の作業溶液の100〜200μL(または必要に応じてそれ以上)で覆う。
- スライスを密閉シャーレ中で室温で30〜45分間インキュベートする。製造元の推奨に従って励起/発光フィルターを使用して組織スライスを画像化します。
3. カルシウム染料ローディング
注:蛍光色素は、色素の調製および装填の全プロセス中、ならびに染色された組織スライスの取り扱い中に、光曝露から遮蔽されるべきである。スズ箔は、カルシウム染料を含むチューブまたはペトリ皿を覆うために使用することができる。
- 染料調製
- 細胞透過性Ca2+指示色素(励起/発光495/523nm ; 材料表参照)、ジメチルスルホキシド(DMSO)7.5μL、およびポラクサマー2.5μL(DMSO中の20%溶液; 材料表)6.667mLのHBSを15mLスクリューキャップチューブに6mMグルコースを含む。
注:この最終溶液には、6μMのCa2+ 指示色素、0.11%DMSO、および0.037%ポラクサマーが含まれています。 - スクリューキャップチューブ内の溶液をピペットで20秒間繰り返し吸引して排出する。可溶化を改善するために、チューブを超音波浴槽に30秒間、渦を30秒間浸漬する。ステップ3.1.1で調製した最終Ca2+ 指示色素溶液のアリコート3.333 mLを5 mLペトリ皿にアリコートする。
- 細胞透過性Ca2+指示色素(励起/発光495/523nm ; 材料表参照)、ジメチルスルホキシド(DMSO)7.5μL、およびポラクサマー2.5μL(DMSO中の20%溶液; 材料表)6.667mLのHBSを15mLスクリューキャップチューブに6mMグルコースを含む。
- 染料ローディング
- HBSで調製した組織スライスを60mLシャーレから色素溶液で満たされた5mLシャーレに移し、薄くて柔らかいペイントブラシを用いて各組織スライスを静かに持ち上げ、それを色素溶液に入れる。ペトリ皿あたり最大10個の組織スライスをインキュベートする。
- スライスを載せたペトリ皿を、毎分40ターンで軌道運動するように設定された室温のオービタルシェーカー上に50分間置く。スライスを室温で周囲空気に曝した色素溶液中でインキュベートするが、ペトリ皿を錫箔で覆うことによって光から遮蔽する。
- スライスの保存
- 染色した組織スライスを5mLのシャーレから、色素を含まないHBSで満たされた60mLのシャーレに、細かく柔らかいペイントブラシを使用して静かに持ち上げることによって移す。ペトリ皿あたり最大20スライスを保管してください。
メモ:この時点でイメージングには、組織スライスを使用してください。組織スライスは、Ca2+ 指示色素を数時間保持する。スライスの生存率および染料の保持は、氷に囲まれた断熱容器にペトリ皿を置くことによって改善することができる。これは、染料を装填したスライスを輸送する場合に特に重要です。さらに、HBS を 2 時間ごとに交換します。
- 染色した組織スライスを5mLのシャーレから、色素を含まないHBSで満たされた60mLのシャーレに、細かく柔らかいペイントブラシを使用して静かに持ち上げることによって移す。ペトリ皿あたり最大20スライスを保管してください。
4. カルシウムイメージング
- 共焦点顕微鏡のセットアップ
- 研究の関心に応じて適切な目的倍率を選択します。20x と 25x (開口数 [NA] 0.77-1.00) を選択して、膵島全体、複数のアシニを同時に、またはより大きなダクトを視覚化します。細胞内ダイナミクスを研究するためにより高い倍率を選択してください。
- タイムラプスイメージングの集録モード( タイムラプス、xyt、または同様のモードなど)を選択します。ピンホールを100~200μmに設定します。
- 緑色蛍光色素分子の光路を 488 nm で励起し、500 ~ 700 nm で発光の収集を設定します。好ましくは、光電子増倍管検出器よりも高い量子効率を有する検出器(例えば、リン化ガリウム砒素)を選択する。
- 記録チャンバとペリフュージョンシステムのセットアップ
- 記録チャンバを顕微鏡の温度制御ステージとペリフュージョンシステム(重力供給またはペリスタルティックポンプベースのセットアップ、容量1mL)に取り付けます。チャンバー内の灌流液が蛇行しないように、入口と出口を記録チャンバーの遠端に配置し、流入と流出を等しい値(1~2mL/分)に設定します。液体メニスカスの高さと末葉液中の液滴の漂流を避けてください。
- ペリフュージョンシステムの温度制御を37°Cに設定し、非刺激溶液でペリフュージョンを開始し、刺激溶液を準備する。電動バルブを介して、またはペリフュージョンシステムに供給するソリューションを手動で切り替えて、ソリューションを変更します。
- カルシウムダイナミクスを記録する
- 単一の組織スライスを記録チャンバに移す。組織スライスを、張り詰めたナイロンメッシュ(例えば、ナイロンストッキングから)を有するU字型の白金重量で固定化する。ナイロン糸を目的の構造の上に配置しないでください。
- 明視野オプションを使用して、膵島/アシヌス/ダクトを見つけます。ライブイメージングを実行して、調査した構造物を視野に配置し、イメージングパラメータを設定します。レーザー出力、検出器増幅、ライン平均化/ビニングを調整して信号対雑音比を最適化し、レーザー出力を最小限に抑えながらセルを視覚化できるようにします。
- 記録の焦点面を切断面から約15 μm下(図5)に調整して、切断面で損傷する可能性のある細胞からの記録を避けます。
- 画像を取得します。サンプリング周波数を1~2Hzに設定して個々の振動を最初に検出し、高速ライン平均化(8~20)が可能な共振スキャナをより高い集録レート(>10Hz)で使用して細胞内のCa2+ ([Ca2+]IC)活動を記録します。光毒性を防ぐために、連続する点照明間の間隔(例えば、総サンプリング時間の30%)を許可する。時系列取得の前に高解像度画像(例えば、1024×1024ピクセル、線平均化>50)を記録する(セクション5参照)。
注:1~2Hzのサンプリング周波数は、ほとんどのセルの集録周波数のナイキスト基準を下回っており、信号の形状はデフォルトでアンダーサンプリングされます。 - オンラインチャート(イメージングソフトウェアで利用可能な場合)を参照して、試料作製応答、過照度、フォトブリーチング、および機械的ドリフトに関する即時フィードバックを取得します。集録中に漂白率が高い場合は、記録を停止してレーザー出力を下げながら、検出器のゲインを増やして信号対雑音比を維持します。機械的ドリフトの場合は、チューブ/ケーブルと顕微鏡ステージ間の張力、液体漏れ、記録チャンバ内の体積変化を確認してください。必要に応じて、集録中のドリフトを手動で補正してみてください。ただし、これは本質的に限られた結果しか得られないことに注意してください。
注:内分泌細胞は、閾値に近い濃度で非常に不均一である。個々の細胞における活性化/不活性化遅延の範囲を検出するには、十分な長さの刺激が必要である。これは、高刺激プロトコルに従ったオフ応答の正確な検出に特に重要です。 - カルシウムイメージングを使用して、エンドオクリン細胞と外分泌細胞を機能的に区別します(図6)。アクティブ化および非アクティブ化中の一時的なアクティビティを記録するには、記録を停止せずに刺激を適用します。
- 実験終了後にデータを保存します (自動保存機能の使用を検討してください)。シャットダウン手順中にレーザーを損傷しないように、レーザー電源をオフにする前に冷却期間を空けてください。
5. データの分析
- タイムラプスビデオを再生して、記録を定性的に視覚的に検査します。視野または光学面からのセルドリフトを確認します。光学面内にドリフトが発生した場合は、ImageJのドリフト補正プラグインを使用します。
- 顕微鏡ソフトウェアまたはサードパーティ製ソフトウェアを使用して、関心領域(ROI)を選択します。高解像度の画像、最大投影、またはフレーム平均を基準として使用して、ROI を選択します。タイムラプスイメージングを再生して、参照画像には見えない応答細胞を視覚化します。ROI間のシグナルクロストークを避けるために、ROIの選択された領域が隣接するセルと重ならないようにROIを配置します。
- 時系列データをフレームあたりのROI平均値としてエクスポートします。ROI 座標をエクスポートします。
- 漂白のための時系列データ(図7A)を補正するには、指数適合と線形適合の組み合わせを採用します。
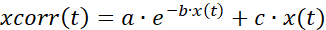 (1)
(1)
ここで、x(t)は、ある時点での蛍光シグナルを示す。xcorr(t) 対応する時点で補正された信号。a、b、および c は、corr(t) と x(t) の間の最小平方和として計算された適合のパラメータです。 - 応答の活性化フェーズと非アクティブ化フェーズを分析します(図7B)。時系列データの一次微分を計算し、活性化と非活性化に対応する微分の天頂と天底をそれぞれ求めます。または、段階的増加の開始を手動で選択します。アクティブ化/非アクティブ化時間と対応するセル座標を保存してエクスポートします。
- プラトー相を分析します(図7C)。生データをしきい値にするか、時系列データの一次微分をしきい値にして、個々の振動を検出します。個々の振動の開始と終了を、振動の半振幅に対応する時間として定義します。
- 各セルの個々の振動の持続時間と周波数を計算します。スパイク間間隔の逆値を計算します (通常のアクティビティ パターンに適しています)。あるいは、振動数をレコードの時間間隔で割る(不規則なアクティビティパターンに適しています)。
- アクティブ時間を計算します。アクティブな時間を期間の合計として表し、この値を時間間隔で割ります。または、振動に対応する周波数と持続時間を乗算します。
注: 期間の合計を時間間隔で割ると、堅牢な結果が得られますが、セルごとに 1 つのデータ ポイントが得られるため、統計的な識別は低くなります。振動の周波数と持続時間を乗算すると、振動から振動への時間分解能が得られます。
結果
膵管へのアガロース溶液の注入は、膵臓組織スライス調製において最も重要なステップである。成功した注射は、 図3Aの左側に見られるように、膵臓組織の白化によって認識され、膵臓の不完全な注入部分は 図3Aの右側に提示される。ランゲルハンスの膵島は肉眼または実体顕微鏡下で認識することができ、これはその後のアガロースブロックへの埋め込みのために膵臓の適切な部分を切断するのに役立つ(図3B)。新しく切断されたマウス膵臓組織スライスにおいて、ランゲルハンスの膵島は、実体顕微鏡下での白い斑点(図3C)または光学顕微鏡下での茶色がかった構造(図3D)として、周囲の外分泌組織および間葉と容易に区別することができる。膵臓組織スライスは、スライス後少なくとも12時間、異なるタイプの実験に使用することができる。実体顕微鏡、光学顕微鏡、およびカルシウムイメージング中の細胞の機能応答下での肉眼的形態学的評価に加えて、膵組織スライスの生存率を評価することができる(図4)。
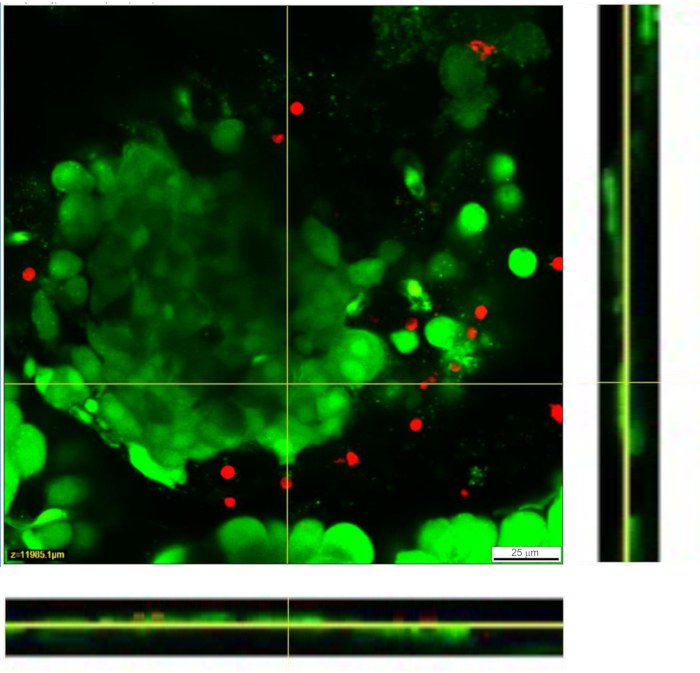
図4:組織スライス内の細胞の生存率。 細胞の生存率は、Live/Deadアッセイで決定した。生細胞はカルセインAM(緑色で表示)で染色され、死細胞はエチジウムホモダイマー-1(赤色で表示)で染色されます。黄色の線は、下部と右側に表示されるZスタックのX-Y断面の位置を示します。Zスタックの全深度は88μmです 。この図の拡大版を見るには、ここをクリックしてください。
カルシウムイメージング実験では、蛍光カルシウムインジケータが数層の細胞を貫通する必要があります。図5Aは、個々の膵島および腺房細胞が認識され得る膵臓組織スライスへの細胞透過性Ca2+指示色素の良好な装填を提示する。対照的に、図5B-Dのスライスは、色素の浸透に失敗したこと(図5B)、膵島細胞の欠如(図5C)、および表面に多くの壊死組織(図5D)のために最適ではない。このようなスライスは、廃棄したり、よりよく切断または染色された追加の膵島の存在をチェックしたり(トラブルシューティングについては表1を参照)、または外分泌細胞の応答を記録するために使用することができる。
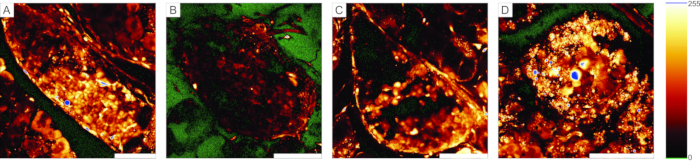
(A)ランゲルハンス島内のよく染色された細胞、ならびに乳管細胞および周囲の腺房組織を有する膵臓組織スライスの調製に成功した例。(b)染色不良の組織スライスの一例。(C)構造的な断絶を伴うランゲルハンス島の例。(D)多くの死細胞と多くの破片を含むランゲルハンス島の例。右側の「グローオーバー、グローアンダー」ルックアップテーブルには、緑で0強度、青で彩度が表示されます。スケール バー = 100 μm。この図の拡大版を表示するには、ここをクリックしてください。
細胞透過性Ca2+ 指示色素を用いたカルシウムイメージングからの代表的な結果を 図6に示す。 図6Aでは、ランゲルハンスの膵島、腺房組織、および膵管を含む膵臓組織スライスの高解像度画像が提示される。より良い区別のために、 図6A に提示された膵臓組織スライスの内分泌、外分泌、および乳管部分は 、図6Bに着色されている。適切な刺激を用いて、異なる膵島細胞間、または膵島細胞と非膵島細胞51とを機能的に区別することができる。ベータ細胞は、典型的には、グルコースによる二乗パルス刺激に応答し、[Ca2+]IC の一時的な増加に続いて、持続的なプラトー上での速いカルシウム振動が続く(図6C、上パネル)。
すべてのベータ細胞は単一の大きな機能的なシンシチウムに結合されているため、これらの振動は、[Ca2+]IC波32、34、52、53、54を広げることによって、異なる細胞間で非常によく同期しています(図7C)。5〜15分の周期でより遅い[Ca2+]IC発振は、高速振動の根底にあるか、または応答55,56の支配的なタイプであることさえあり得る。同じ単純なプロトコルは、特に膵島の周辺で、他のタイプの応答を明らかにする可能性がある(図6C、下パネル)。これらの細胞はベータ細胞と同期しておらず、低グルコース条件下で既に存在する、または活性の低下を伴うより速く、より不規則な振動で応答するので、そのような応答は、非ベータ細胞を強く示唆する21、32、57、58。しかし、それらの決定的な機能的特性評価には、以下で説明する追加の刺激ステップまたは代替アプローチを備えたより複雑なプロトコルが必要です。腺房細胞および乳管細胞の典型的な応答を、それぞれ図6Dおよび図6Eに提示する。腺房および乳管細胞の詳細については文献を参照されたい22,23,35。
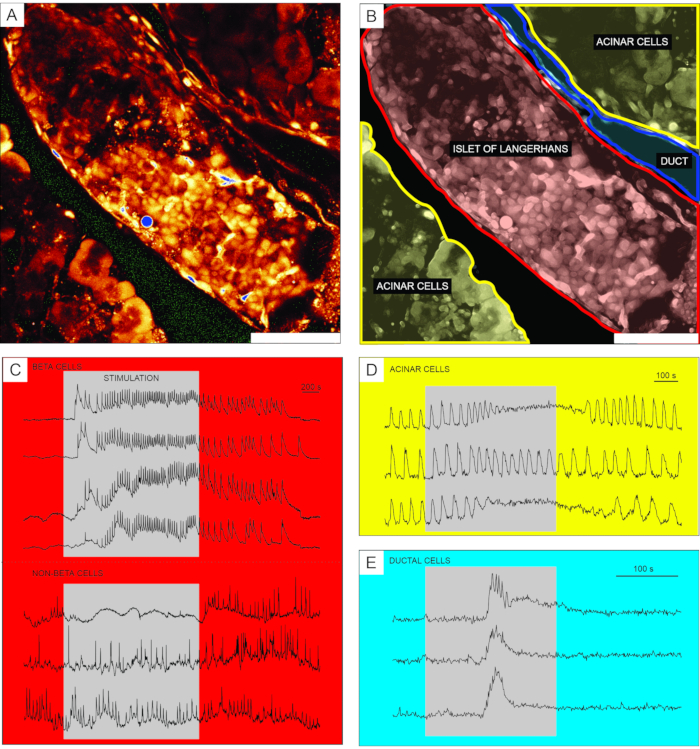
図6:異なるタイプの膵臓細胞におけるカルシウム動態の代表的な結果。 (A)ランゲルハンス島の周囲組織との高解像度画像。(B)黄色で示された腺房組織、赤で示されたランゲルハンスの島、および青で示された管状木のセグメントを有する膵臓組織の別個の部分の描写。スケールバー = 100 μm. (C) 12 mM グルコースによる刺激中のベータおよび推定非ベータ細胞におけるカルシウム動態の典型的な痕跡;3mMグルコースを非刺激条件に使用した。非ベータ細胞のより具体的な識別に使用できるプロトコルは、議論のセクションで説明されています。(D)25nMアセチルコリンによって刺激された腺房細胞のカルシウム動態の典型的な痕跡。(E)1mMケノデオキシコール酸によって刺激された乳管細胞のカルシウム動態の典型的な痕跡。 この図の拡大版を表示するには、ここをクリックしてください。
カルシウムイメージングが成功すると、データは最初にエクスポートされ、プロトコルのセクションで説明したように、指数関数と線形適合の組み合わせによって漂白用に補正されます。漂白補正前後の時系列を図7Aに示す。その後、応答の活性化および不活性化段階ならびにプラトー相におけるいくつかのパラメータを分析することができる。刺激後の[Ca2+]IC増加の開始の遅延は、図7Bの遅延Aおよび個々の細胞間の遅延の不均一性(遅延A1)によって表されるように測定することができる。同じパラメータ(遅延Dおよび遅延D1)を使用して、非アクティブ化フェーズを記述することができます。最初の一過性の[Ca2+]ICの増加に続いて、膵島内のほとんどの膵臓ベータ細胞におけるプラトー期は、比較的規則的な高周波[Ca2+]IC振動によって特徴付けられる。プラトー位相は、古典的な関数パラメータを分析することによって記述することができる。[Ca2+]IC発振の持続時間、周波数、およびアクティブ時間の割合の概略図を図7Cに示します。10Hzより高い取得率のカルシウムイメージングでは、膵島全体に繰り返し広がるカルシウム波もはっきりと認識できます(図7C)。
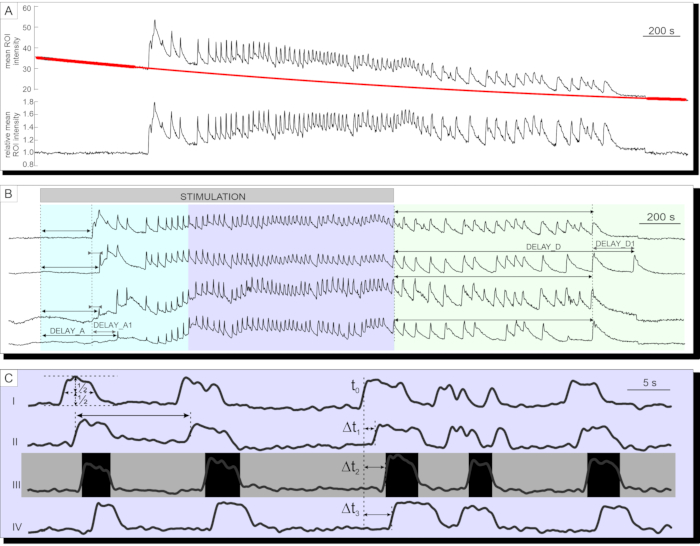
図7:時系列データの解析 。(A)フォトブリーチングのための時系列データの補正(b)12mMグルコースによる刺激の停止後の活性化および停止後の失活への遅延の解析。刺激の持続時間は、画像内の薄い灰色の陰影付きバーで示される。(C)プラトー位相のいくつかのパラメータの分析:I)半高さで決定された振動の持続時間、II)振動間間隔によって決定される振動の周波数。III)振動の周波数と持続時間の積としての活動時間。I-IV)ランゲルハンス島全体に広がる振動の任意の所与の波における振動間の遅延は、単一の細胞が振動の半分の高さに達する時間の遅延(Δt)によって決定される。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
膵臓組織スライス法は、より保存されたin situ調製において、膵臓の内分泌および外分泌部分の形態および生理学を研究するための迅速な実験方法である。利点の多くは、すでに序論で指摘されています。一般的に(すなわち、カルシウムイメージングだけでなく)、膵臓生理学を研究するためのスライスアプローチは、単離後の回復期間を伴わないため、時間を節約することを指摘する価値があります。後者は、異なる種からの単離された膵島のすべてのタイプの実験および使用において絶対に必要ではないが、典型的には、純度を高め、生存率および機能を回復させ、時にはいくつかのドナーから膵島を収集するために用いられる59、60、61、62、63、64.しかしながら、カルシウムイメージングの文脈において、ベータ細胞応答は培養期間および条件に依存することが見出されており、これは単離された膵島を使用する際に考慮されるべきである重要な変動源である15,65。組織スライスの長期培養が将来広く使用される選択肢になる場合、同じ問題が考慮されるべきである22,36。組織スライス法はまた、高い収量を有し、したがって潜在的に動物の苦しみを軽減し、統計的検出力を増加させる。さらに、1匹の動物からできるだけ多くのスライスを調製することができ、スライスが長期間生存するため、実験群および対照群の両方で同じ動物または同じ膵島を含むことが実現可能となる。
元のアーキテクチャおよび細胞間通信が保存され、かつ多数の構造解析、電気生理学的、イメージング法、およびホルモン分泌アッセイと互換性があるため、この方法は、個々の細胞間の妨害されない相互作用に依存する膵臓機能、例えば、分泌促進物に対する感受性、パラクリンおよび異なる細胞型間の免疫相互作用を研究するのに特に有用であり、 電気的活動のパターン、カルシウム動態の特性、および異なるホルモンの分泌。特にカルシウムイメージングの場合、スライスを使用する主な利点は、膵島コアの露出と、多くの異なる細胞型からのシグナルを高解像度で取得する可能性です。実験の要件および動物の年齢に応じて、厚さを変化させたり、スライスをトランスフェクトしたり、遺伝的にコードされたレポーターを有する動物から得ることができる。以下でより詳細に説明するように、後者の2つのアプローチはまた、非ベータ細胞 31、66からの応答の特異的な機能的同定および特徴付けを可能にする。さらに、器官の明確に定義された部分からの膵島は、疾患に対する応答性または感受性の違いについて研究することができる。それらは回復潜伏期間を必要としないが、それらは異なる薬理学的薬剤、脂肪酸、高グルコース、およびサイトカインと共に容易にインキュベートすることができる。
最も重要なことは、高分解能が単一細胞または細胞内分解能と組み合わせて達成可能であるため、スライスにおける共焦点カルシウムイメージングは、カルシウム波、機能的連結性、および膵島の別個の部分における細胞の異なる機能的役割を分析するための最も適切な方法の1つである54,67。多くの利点にもかかわらず、組織スライスアプローチには重要な限界があります。第一に、特に切断面では、膵島および外分泌構造に少なくとも部分的に破壊的であり、さらなる機械的および内因性酵素的損傷を防ぐために、調製中に低温、頻繁な溶液交換、穏やかで迅速な操作などの予防措置が必要である。第二に、栄養素および分泌促進剤送達のパターンは、in vivo経路よりも依然として劣っており、調製物は全身神経支配から切り離され、膵島とその標的組織との間のような器官間フィードバックは、in vivoアプローチとは対照的に不可能である。第三に、最大スライス厚さは、酸素化、栄養素送達、および〜200μm9でのpH調節によって制限される。さらに、スライスの調製とイメージングの両方に多くのトレーニングが必要であり、長い時系列および多くの細胞からのカルシウムデータの詳細な分析には、古典的な生理学者のツールキットに含まれていない専門知識が必要であり、物理学者またはデータサイエンティストの助けが必要です。ホモおよびヘテロタイプの相互作用が保存されるという利点は、関心領域内の他の細胞からのシグナルの存在のためにサンプルの分析を複雑にすることもできる。プロトコールに応じて、他の細胞の活性化は、観察された細胞の間接的な追加の刺激または阻害をもたらし得る。
これは、デコンボリューションアプローチ、間接効果の一部をブロックする物質を含むより複雑な刺激プロトコル、特定のノックアウト動物の使用、およびより還元主義的な方法論を採用した他の研究の結果との慎重な比較によってのみ、決定的に解決することができる。さらに、分泌測定が必要な場合は、一部のスライスには膵島が不足している可能性があり、1つのスライス内の内分泌組織の総質量は通常低いことに留意する必要があります。イメージング用の急性膵臓組織スライスの調製には、以下のセクションで説明し、 表1に要約したいくつかの重要なステップが含まれ、読者はトラブルシューティングのための短いが重要なヒントを見つけることもできます。第1に、アガロース溶液を調製するとき、アガロース粉末は完全に溶解しなければならず、さもなければ未溶解粒子は注射を妨げ得る。均質なアガロース溶液を37〜45°Cに保ち、一方では温度が低すぎることによるアガロースの硬化を防ぎ、他方では高温すぎることによる組織損傷を防止する。使用後、残りのアガロースは4°Cで保存して再加熱することができますが、再加熱を繰り返すと水分蒸発による密度が上昇し、最終的に注入が困難または不可能になる可能性があります。
準備の次の重要なステップは、主要な十二指腸乳頭を正しくクランプすることです。十二指腸上の白い斑点は、総胆管と十二指腸の接合部を示す。クランプを近づけすぎると、共通ダクトの側方膵臓枝が閉塞し、これらの部分の注入が無効になりますが、遠位に配置されすぎると、アガロースが低抵抗経路を通って十二指腸に直接漏れます。総胆管のカニューレの前に、周囲の脂肪組織を慎重に除去して、管の視覚化を改善し、注射中の制御を強化することができます。周囲の組織の除去中の精度が不十分であると、ダクトの穿孔をもたらす可能性がある。アガロース注射に使用する針径の選択も重要である。マウスでは、30G針が好ましく用いられる。より小さい(32または33G)針は、アガロース溶液の粘度が高いため、より多くの労力を必要とし、閉塞しやすくなります。しかし、低密度のアガロース溶液と組み合わせて使用すると、より小さなマウス系統や若い動物に非常に役立ちます。出生後の最初の日には、アガロースを管内ではなく嚢下注射することもできます2。マウスでより大きな直径の針を使用すると、おそらく総胆管を損傷することになります。これは正しい針の直径でも起こり得、鉗子は注射中に針を所定の位置に保つのに役立ちます。ラットに見られるように、より大きなダクトの場合、より大きな直径の針が唯一の解決策であり得る。針が狭すぎて、バックリークを防ぐタイトなシールを確保できない場合は、ダクトへの進入に成功したときに合字を周囲に配置することができます。
アガロース注射は溶液の粘度のためにいくらかの労力を要し、注射プロセスが開始されると、低融点アガロース溶液が注射が完了する前に針または管状木の大部分で固化する可能性があるため、中断してはならない。これにより、切断中の組織浸透性が低下し、サポートが悪化します。ダクトは、左肝管と嚢胞管が結合して共通胆管を形成する点で常にカニューレ処理されるべきである。総胆管が穿孔された場合は、十二指腸の近くでカニューレを繰り返してみてください。膵臓をアガロース溶液で十分に安定化し、腹腔から抽出すると、よく注入された組織の小片が切断される。それらをアガロースに埋め込む前に、それらの残留物がスライスをより困難にするので、すべての脂肪組織および結合組織を除去することが重要である。同じことが血管およびダクト残渣にも当てはまるが、それらが実験の焦点である場合を除いては。この場合、所望の断面が得られるようにそれらを配置してください。組織をアガロースに埋め込むときは、温度が適切(37°C)であり、ビブラートームスライス中の力がアガロースブロックから膵臓組織を裂く可能性があるため、組織がアガロースによって完全に囲まれていることを確認してください。
紙ティッシュの上に短時間置いてアガロースに入れる前に、組織ブロックを素早く乾燥させることで、このステップ中の組織とアガロースの接触不良を防ぐことができます。アガロースブロックの固化中は、シャーレを水平に置き、膵臓組織とペトリ皿の底との接触を防ぎます。膵臓が完全に注入されていない場合、切断プロセスは困難になります。そこで、切断速度を下げて組織スライスを得ようとする。ビブラートームスライス中の細胞損傷を最小限に抑えるには、スライスチャンバ内のECS(およびECS製のアイスキューブ)を定期的に交換してください。後者は、スライス中に腺房組織から放出される膵酵素の活性を低下させる。スライスの厚さも非常に重要です。カルシウム動態および電気生理学的実験のために、140μmのスライスは通常切断される。しかし、研究の目的によると、スライスの厚さは90μmから200μmの範囲であり得る。厚いスライスでは、酸素と栄養素の拡散は制限されますが、より多くの組織が含まれることに注意してください。さらに、切断されていない膵島の割合は、スライスの厚さの増加とともに増加することが予想される。スライスは、室温で定期的に交換されたECSで数時間保存することも、適切な細胞培地で数日間培養することもできます。しかしながら、これは最終的に正常な膵島細胞生理機能に影響を与える可能性がある3、22。
染料溶液を調製するときは、すべての成分を慎重に混合し、周囲光にさらさないでください。膵臓スライスは多くの細胞層から構成され、カルシウム色素の取り込みは、単離された膵島58、68、および下垂体スライス69について先に説明したように、最初のいくつかの最も表在的な細胞層に限定される。しかし、周囲のカプセルおよび外側の細胞層がより深い層への色素の浸透を妨げる単離された膵島とは対照的に、組織スライスは膵島の断面表面全体へのアクセスを可能にし、膵島のすべての層からの数百の細胞におけるカルシウム動態の同時測定を可能にする。蛍光Ca2+インジケータは、カルシウムダイナミクスの測定に最も広く使用されており、CLSMとともに、数百ヘルツに達する高い時間分解能での記録を可能にします。最も適切な蛍光Ca2+指示薬を選択する際には、細胞負荷法、測定モード(定性的または定量的)、および解離定数(Kd)に影響を与え、目的のCa2+濃度範囲にある必要があり、pH、温度、Mg2+および他のイオンの存在に依存する指示薬の形態を含むさまざまな要因を考慮し、 タンパク質結合と同様に。細胞のCa2+シグナルは通常一過性であるため、Ca2+結合速度定数も考慮されるべきである。膵臓細胞における[Ca2+]ICダイナミクスの測定のために、本グループは、細胞自己蛍光が通常問題が少なく、励起光のエネルギーが低く、細胞光損傷の可能性を低減するスペクトルにおける発光波長を有する長波長指示薬であるため、本プロトコール(材料表)に記載されている細胞透過性Ca2+指示色素を主に使用する。この色素は低Ca2+濃度で蛍光性であるため、ベースライン[Ca2+]ICの決定が容易になり、刺激前の細胞の可視性が向上します。Ca2+結合後、色素の蛍光強度は14倍に増加し、[Ca2+]ICのわずかな変化も検出できます。
生細胞カルシウムイメージングを成功させるには、プロトコルのセクションで説明したように、いくつかの重要なハードウェアパラメータを考慮する必要があります。シグナル振幅が低く、光毒性の可能性が高い生細胞イメージングでは、NAの高い対物レンズを使用して、試料からより多くの光を収集することが望ましい。カルシウムダイナミクスを高い時間分解能で記録する必要がある場合は、線形ガルバノメータの代わりに共振スキャナを使用してください。適切な目的を選択するだけでなく、レーザー出力の少ないハイブリッド検出器などの高感度検出器を使用すると、光毒性や光退色を回避できます。これは、長持ちするカルシウムイメージングにとって特に重要です。カルシウムイメージングにおける他の重要なステップは、時系列取得のための画質のパラメータ設定である。最も重要なのは、時間的および空間的分解能です。カルシウムダイナミクス自体が許容可能な最低時間分解能を決定するため、信号を検出するにはサンプリングレートが予想信号周波数の少なくとも2倍高く、信号の形状を確実に検出するには10倍も高くする必要があります。急性膵臓組織スライスでは、カルシウム動態は数百の細胞で同時に測定できるため、空間分解能も重要です。これは、ピクセル数を増やすか、ライブ集録中のライン平均化を増やすことで強化できます。ただし、空間分解能と時間分解能の間には逆の関係があるため、両方の設定の間にトレードオフが必要です。
膵臓内の特定の細胞集団においてカルシウムイメージングを行う必要がある場合は、スライス内の細胞を機能的に分化させることができる刺激が必要である。高グルコースは、ベータ細胞を、上昇したカルシウムレベルに重畳され、膵島32、58、70内のすべての細胞間で高度に同期される振動パターンに確実かつ迅速に活性化する。ベータ細胞は、膵島内で最も多数の細胞型であり、マウスの膵島コアにほとんど位置している。同じ刺激プロトコルは減少し、アルファ細胞30、32、58、70、71、72におけるバーストを顕著に変化させないこともある。アルファ細胞を機能的に識別するために、低(3mM)グルコース、グルタミン酸またはアドレナリンを使用して、それらの頻度または基礎[Ca2+]IC21、72、73、74、75を増加させることができる。それらは膵島細胞の10〜20%を表し、膵島周辺1で検出されるであろう。デルタ細胞は末梢にも見られる。それらは、膵島内の内分泌細胞の総数の〜5%しか構成せず、典型的には6mMグルコース中で活性であり、ベースラインからの不規則な破裂活性の増加またはわずかに上昇したカルシウムレベルでグルコース刺激に応答する1,32,71,76。グレリンは、カルシウムイメージング実験におけるデルタ細胞21、77、78、79の特異的刺激に使用することができる。しかしながら、PPおよびイプシロン細胞の特定の機能的同定のためのプロトコルは、まだ定義されていない。さらに、25nMアセチルコリンは、腺房細胞を確実に活性化して破裂活性35、80、81にする。さらに、セルレイン、コレシストキニン、およびカルバミルコリンなどの他の多くの分泌促進剤を使用して、腺房細胞におけるカルシウム応答を呼び起こすことができる22、40、82、83。
最後に、1mMのケノデオキシコール酸は、組織スライス中の乳管細胞においてカルシウム応答を確実に呼び起こす。アンジオテンシンII、ATP、およびいくつかの他の分泌促進剤も使用することができる11、23、84、85。特定の分泌促進剤および阻害剤に対する特徴的な応答に基づく機能的同定が十分でないときはいつでも、遺伝的に標識された動物31、形質移入細胞73、または免疫細胞化学を、異なる細胞型の同定に用いることができる9、22、71、86.過去数年間、組織スライス法はヒト組織にうまく適応され、外分泌41および内分泌生理学9、36、37、39の両方で多くの新しい重要な研究道を開いた。興味深いことに、ヒトの膵島におけるカルシウム動態の詳細な評価は困難であることで知られており、まだより詳細に調査されていない87。高度な共焦点顕微鏡と組み合わせることで、膵臓組織スライス法はマウスのカルシウム動態に関する多くの新しい洞察を可能にし、うまくいけばヒト組織でも同じことをするでしょう。
開示事項
著者らは、この研究が商業的または財政的利益なしに行われたことを宣言する。
謝辞
この研究で発表された研究は、スロベニア研究庁(研究コア資金番号。P3-0396およびI0-0029、ならびに研究プロジェクト番号。J3-9289、N3-0048、およびN3-0133)およびオーストリア科学基金/Fonds zur Förderung der Wissenschaftlichen Forschung(二国間助成金I3562--B27およびI4319--B30)。マルシャ・ロシェル、マシャ・チャター、ルディ・ムラカールの優れた技術支援に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Analytical balance KERN ALJ 120-4 | KERN & SOHN GmbH | ALJ 160-4A | |
| Confocal microscope Leica TCS SP5 II Upright setup | Leica | 5100001578 | |
| Confocal microscope Leica TCS SP5 AOBS Tandem II setup | Leica | ||
| Cork pad 15 cm x 15 cm | |||
| Corning 15 mL centrifuge tubes | Merck KGaA, Darmstadt, Germany | CLS430790 | |
| Corning Round Ice Bucket with Lid, 4 L | Fischer Scientific, Leicestershire, UK | 432124 | |
| Double edge razor blade | Personna, USA | ||
| Dumont #5 - Fine Forceps | FST, Germany | 11254-20 | |
| Eppendorf Safe-Lock Tubes 0.5 mL | Eppendorf | 0030 121.023 | |
| Erlenmeyer flask 200 mL | IsoLab, Germany | 027.01.100 | |
| Fine Scissors - ToughCut | FST, Germany | 14058-11 | |
| Flat orbital shaker IKA KS 260 basic | IKA | Ident. No.: 0002980200 | |
| Glass lab bottle 1000 mL | IsoLab, Germany | 091.01.901 | |
| Hartman Hemostat, curved | FST, Germany | 13003-10 | |
| HCX APO L 20x/1.00 W HCX APO L (water immersion objective, 20x, NA 1.0) | Leica | 15507701 | |
| Measuring cylinder 25 mL | IsoLab, Germany | 015.01.025 | |
| Micromanipulator Control box SM-7, Keypad SM-7 | Luigs & Neumann | 200-100 900 7311, 200-100 900 9050 | |
| Microwave owen | Gorenje, Slovenia | MO20MW | |
| Osmometer Gonotec 010 | Gonotec, Berlin, Germany | OSMOMAT 010 Nr. 01-02-20 | |
| Paint brush | Faber-Castell, No.2 | Any thin soft round paint brush No.2, preferably black | |
| Paper towels | |||
| Perifusion pumps | Ismatec | ISM 827 | Reglo Analog MS - 4/8 |
| Petri dish 100/20 mm | Sarstedt | 83.3902 | |
| Petri dish 35/10 mm | Greiner bio-one | 627102 | |
| Petri dish 35 x 10 mm Nunclon Delta | Thermo Fischer Scientific, Waltham, MA USA | 153066 | NON-STICKY for agarose blocks |
| pH meter inoLab pH Level 1 | WTW, Weilheim, Germany | E163694 | |
| Pipette 1000 mL | Eppendorf | 3121 000.120 | |
| Pipette 50 mL | Eppendorf | 3121 000.066 | |
| Push pins 23 mm | Deli, Ningbo, China | E0021 | |
| Screw cap tube, 15 mL | Sarstedt | 62.554.502 | |
| Semken Forceps | FST, Germany | 11008-13 | |
| Stabilizing ring for Erlenmeyer flask | IsoLab, Germany | 027.11.048 | |
| Stereomicroscope Nikon SMZ 745 | Nikon, Melville, NY USA | ||
| Syringe Injekt Solo 5 mL | Braun, Melsungen, Germany | 4606051V | |
| Syringe needle 0.30 x 12 mm (30 G x 1/2") | Braun, Melsungen, Germany | 4656300 | |
| Temperature controller | Luigs & Neumann | 200-100 500 0150, 200-150-500-145 | Slice mini chamber, Temperature controller TC 07 |
| Tubings for perifusion system | Ismatec | SC0310 | Ismatec Pharmed 1.14 mm(ID) + silicone tubing 1.0 (ID) x 1.8 mm(OD) |
| Ultrasonic bath Studio GT-7810A | Globaltronics | ||
| Vibrotome Leica VT 1000 S | Leica, Nussloch, Germany | 14047235613 | |
| Volumetric flask 1000 mL | IsoLab, Germany | 013.01.910 | |
| Vortex mixer Neolab 7-2020 | Neolab | 7-2020 | |
| Water bath Thermo Haake open-bath circulator | Thermo Fisher Scientific | Z527912 | |
| Material/Reagent | |||
| Calcium chloride dihydrate - CaCl2.2H2O | Sigma Aldrich, Germany | C5080-500G | |
| D-(+)-glucose | Sigma Aldrich, Germany | G8270-1KG | |
| Dimethyl sulfoxide | Sigma Aldrich | D4540-100ML | |
| DL-lactic acid | Sigma Aldrich, Germany | L1250-500ML | |
| Dulbecco’s Phosphate Buffered Saline | Merck KGaA, Darmstadt, Germany | D8662-500ML | |
| Gas mixture containing 95% O2 and 5% CO2 at barometric pressure | |||
| Glue Wekem sekundenkleber WK-110 | Wekem GmbH, Bergkamen, Germany | WK 110-020 | |
| HEPES | Sigma Aldrich, Germany | H3375-250G | |
| L-(+)-ascorbic acid | Sigma Aldrich, Germany | A9,290-2 | |
| LIVE/DEAD Viability/Cytotoxicity Kit, for mammalian cells | Thermo Fischer Scientific, Waltham, MA USA | L3224 | |
| Magnesium chloride hexahydrate - MgCl2.2H2O | Sigma Aldrich, Germany | M2670-500G | |
| Myo-inositol | Sigma Aldrich, Germany | I5125-100G | |
| Oregon Green 488 BAPTA-1, AM | Invitrogen (Thermo FisherScientific) | O6807 | cell-permeable Ca2+ indicator (excitation/emission: 495/523 nm) |
| Pluronic F-127 (20% Solution in DMSO) | Invitrogen (Thermo Fisher Scientific) | P3000MP | polaxamer: nonionic triblock copolymer |
| Potassium chloride - KCl | Sigma Aldrich, Germany | 31248 | |
| SeaPlaque GTG agarose | Lonza, Rockland, USA | 50111 | |
| Sodium bicarbonate - NaHCO3 | Honeywell, Germany | 31437-500G | |
| Sodium chloride - NaCl | Honeywell, Germany | 31434-1KG | |
| Sodium hydroxide - NaOH | Sigma Aldrich, Germany | 30620 | |
| Sodium phosphate monobasic- NaH2PO4 | Sigma Aldrich, Germany | S0751-500G | |
| Sodium pyruvate | Sigma Aldrich, Germany | 15990-100G | |
| Software | |||
| FIJI | FIJI is an open source project | ||
| LASAF | Leica microsystems, Inc. | ||
| Matlab | Mathworks | ||
| Python | Python Software Foundation | Python is an open source project |
参考文献
- Dolensek, J., Rupnik, M. S., Stozer, A. Structural similarities and differences between the human and the mouse pancreas. Islets. 7 (1), e1024405(2015).
- Meneghel-Rozzo, T., Rozzo, A., Poppi, L., Rupnik, M. In vivo and in vitro development of mouse pancreatic ß-cells in organotypic slices. Cell and Tissue Research. 316 (3), 295-303 (2004).
- Rozzo, A., Meneghel-Rozzo, T., Delakorda, S. L., Yang, S. B., Rupnik, M. Exocytosis of insulin: in vivo maturation of mouse endocrine pancreas. Annals of the New York Academy of the Sciences. 1152, 53-62 (2009).
- Dolenšek, J., Pohorec, V., Rupnik, M. S., Stožer, A. Pancreas physiology, challenges in pancreatic pathology. IntechOpen. Seicean, A. , (2017).
- Williams, J. A. The nobel pancreas: a historical perspective. Gastroenterology. 144 (6), 1166-1169 (2013).
- Lacy, P. E., Kostianovsky, M. Method for the isolation of intact islets of Langerhans from the rat pancreas. Diabetes. 16 (1), 35-39 (1967).
- Williams, J. A., Korc, M., Dormer, R. L. Action of secretagogues on a new preparation of functionally intact, isolated pancreatic acini. American Journal of Physiology. 235 (5), 517-524 (1978).
- Peikin, S. R., Rottman, A. J., Batzri, S., Gardner, J. D. Kinetics of amylase release by dispersed acini prepared from guinea pig pancreas. American Journal of Physiology. 235 (6), E743-E749 (1978).
- Marciniak, A., et al. Using pancreas tissue slices for in situ studies of islet of Langerhans and acinar cell biology. Nature Protocols. 9 (12), 2809-2822 (2014).
- Skelin, M., Rupnik, M., Cencic, A. Pancreatic beta cell lines and their applications in diabetes mellitus research. Altex-Alternatives to Animal Experimentation. 27 (2), 105-113 (2010).
- Molnar, R., et al. Mouse pancreatic ductal organoid culture as a relevant model to study exocrine pancreatic ion secretion. Laboratory Investigation. 100 (1), 84-97 (2020).
- Rupnik, M. The physiology of rodent beta-cells in pancreas slices. Acta Physiologica (Oxford, England). 195 (1), 123-138 (2009).
- Blinman, T. A., et al. Activation of pancreatic acinar cells on isolation from tissue: cytokine upregulation via p38 MAP kinase. American Journal of Physiology. Cell Physiology. 279 (6), C1993-C2003 (2000).
- Speier, S., Rupnik, M. A novel approach to in situ characterization of pancreatic ß-cells. Pflügers Archive: European Journal of Physiology. 446 (5), 553-558 (2003).
- Gilon, P., Jonas, J., Henquin, J. Culture duration and conditions affect the oscillations of cytoplasmic calcium concentration induced by glucose in mouse pancreatic islets. Diabetologia. 37 (10), 1007-1014 (1994).
- Huang, C., Gu, G. Effective isolation of functional islets from neonatal mouse pancreas. Journal of Visualized Experiments: JoVE. (119), e55160(2017).
- Szot, G. L., Koudria, P., Bluestone, J. A. Murine pancreatic islet isolation. Journal of Visualized Experiments: JoVE. (7), e255(2007).
- Qi, M., et al. Human pancreatic islet isolation: Part I: digestion and collection of pancreatic tissue. Journal of Visualized Experiments: JoVE. (27), e1125(2009).
- Qi, M., et al. Human pancreatic islet isolation: Part II: purification and culture of human islets. Journal of Visualized Experiments: JoVE. (27), e1343(2009).
- Stull, N. D., Breite, A., McCarthy, R., Tersey, S. A., Mirmira, R. G. Mouse islet of Langerhans isolation using a combination of purified collagenase and neutral protease. Journal of Visualized Experiments: JoVE. (67), e4137(2012).
- Hamilton, A., Vergari, E., Miranda, C., Tarasov, A. I. Imaging calcium dynamics in subpopulations of mouse pancreatic islet cells. Journal of Visualized Experiments: JoVE. (153), (2019).
- Marciniak, A., Selck, C., Friedrich, B., Speier, S. Mouse pancreas tissue slice culture facilitates long-term studies of exocrine and endocrine cell physiology in situ. PLoS ONE. 8 (11), e78706(2013).
- Gal, E., et al. A Novel in situ approach to studying pancreatic ducts in mice. Frontiers in Physiology. 10, 938(2019).
- Speier, S., Yang, S. B., Sroka, K., Rose, T., Rupnik, M. KATP-channels in beta-cells in tissue slices are directly modulated by millimolar ATP. Molecular and Cellular Endocrinology. 230 (1-2), 51-58 (2005).
- Speier, S., Gjinovci, A., Charollais, A., Meda, P., Rupnik, M. Cx36-mediated coupling reduces β-cell heterogeneity, confines the stimulating glucose concentration range, and affects insulin release kinetics. Diabetes. 56 (4), 1078-1086 (2007).
- Rose, T., Efendic, S., Rupnik, M. Ca2+-secretion coupling is impaired in diabetic Goto Kakizaki rats. The Journal of General Physiology. 129 (6), 493-508 (2007).
- Paulmann, N., et al. Intracellular serotonin modulates insulin secretion from pancreatic β-cells by protein serotonylation. PLoS Biology. 7 (10), e1000229(2009).
- Mandic, S. A., et al. Munc18-1 and Munc18-2 proteins modulate β-cell Ca2+ sensitivity and kinetics of insulin exocytosis differently. Journal of Biological Chemistry. 286 (32), 28026-28040 (2011).
- Dolensek, J., Skelin, M., Rupnik, M. S. Calcium dependencies of regulated exocytosis in different endocrine cells. Physiological Research. 60, S29-S38 (2011).
- Huang, Y. C., Rupnik, M., Gaisano, H. Y. Unperturbed islet α-cell function examined in mouse pancreas tissue slices. Journal of Physiology. 589 (2), 395-408 (2011).
- Huang, Y. C., et al. In situ electrophysiological examination of pancreatic α cells in the streptozotocin-induced diabetes model, revealing the cellular basis of glucagon hypersecretion. Diabetes. 62 (2), 519-530 (2013).
- Stožer, A., Dolenšek, J., Rupnik, M. S. Glucose-stimulated calcium dynamics in islets of Langerhans in acute mouse pancreas tissue slices. PLoS ONE. 8 (1), e54638(2013).
- Stožer, A., et al. Functional connectivity in islets of Langerhans from mouse pancreas tissue slices. PLoS Computational Biology. 9 (2), e1002923(2013).
- Dolenšek, J., Stožer, A., Skelin Klemen, M., Miller, E. W., Slak Rupnik, M. The relationship between membrane potential and calcium dynamics in glucose-stimulated beta cell syncytium in acute mouse pancreas tissue slices. PLoS ONE. 8 (12), e82374(2013).
- Perc, M., Rupnik, M., Gosak, M., Marhl, M. Prevalence of stochasticity in experimentally observed responses of pancreatic acinar cells to acetylcholine. Chaos. 19 (3), 037113(2009).
- Qadir, M. M. F., et al. Long-term culture of human pancreatic slices as a model to study real-time islet regeneration. Nature Communications. 11 (1), 3265-3265 (2020).
- Panzer, J. K., et al. Pancreas tissue slices from organ donors enable in situ analysis of type 1 diabetes pathogenesis. JCI Insight. 5 (8), e134525(2020).
- Cohrs, C. M., et al. Vessel network architecture of adult human islets promotes distinct cell-cell interactions in situ and is altered after transplantation. Endocrinology. 158 (5), 1373-1385 (2017).
- Cohrs, C. M., et al. Dysfunction of persisting beta cells is a key feature of early type 2 diabetes pathogenesis. Cell Reports. 31 (1), 107469(2020).
- Dolai, S., et al. Pancreatitis-induced depletion of syntaxin 2 promotes autophagy and increases basolateral exocytosis. Gastroenterology. 154 (6), 1805-1821 (2018).
- Liang, T., et al. Ex vivo human pancreatic slice preparations offer a valuable model for studying pancreatic exocrine biology. Journal of Biological Chemistry. 292 (14), 5957-5969 (2017).
- Panzer, J. K., Cohrs, C. M., Speier, S. Using pancreas tissue slices for the study of islet physiology. Methods in Molecular Biology. 2128, 301-312 (2020).
- Klemen, M., Dolenšek, J., Stožer, A., Rupnik, M. Exocytosis Methods. Thorn, P. 7, Humana Press. 127-146 (2014).
- Speier, S. Experimental approaches for high-resolution in vivo imaging of islet of Langerhans biology. Current Diabetes Reports. 11 (5), 420-425 (2011).
- Leibiger, I. B., Berggren, P. O. Intraocular in vivo imaging of pancreatic islet cell physiology/pathology. Molecular Metabolism. 6 (9), 1002-1009 (2017).
- Reissaus, C. A., et al. A Versatile, portable intravital microscopy platform for studying beta-cell biology in vivo. Scientific Reports. 9 (1), 8449(2019).
- Jacob, S., et al. In vivo Ca(2+) dynamics in single pancreatic beta cells. FASEB Journal. 34 (1), 945-959 (2020).
- Fernandez, J., Valdeolmillos, M. Synchronous glucose-dependent [Ca2+]i oscillations in mouse pancreatic islets of Langerhans recorded in vivo. FEBS Letters. 477 (1-2), 33-36 (2000).
- Almaca, J., Weitz, J., Rodriguez-Diaz, R., Pereira, E., Caicedo, A. The pericyte of the pancreatic islet regulates capillary diameter and local blood flow. Cell Metabolism. 27 (3), 630-644 (2018).
- Weitz, J. R., et al. Mouse pancreatic islet macrophages use locally released ATP to monitor beta cell activity. Diabetologia. 61 (1), 182-192 (2018).
- Tian, G., Sandler, S., Gylfe, E., Tengholm, A. Glucose- and hormone-induced cAMP oscillations in α- and β-cells within intact pancreatic islets. Diabetes. 60 (5), 1535-1543 (2011).
- Benninger, R. K., Zhang, M., Head, W. S., Satin, L. S., Piston, D. W. Gap junction coupling and calcium waves in the pancreatic islet. Biophysical Journal. 95 (11), 5048-5061 (2008).
- Santos, R. M., et al. Widespread synchronous Ca oscillations due to bursting electrical activity in single pancreatic islets. Pflügers Archive: European Journal of Physiology. 418 (4), 417-422 (1991).
- terk, M., et al. Assessing the origin and velocity of Ca2+ waves in three-dimensional tissue: Insights from a mathematical model and confocal imaging in mouse pancreas tissue slices. Communications in Nonlinear Science and Numerical Simulation. 93, 105495(2021).
- Gosak, M., et al. Critical and supercritical spatiotemporal calcium dynamics in beta cells. Frontiers in Physiology. 8, 1106(2017).
- Satin, L. S., Butler, P. C., Ha, J., Sherman, A. S. Pulsatile insulin secretion, impaired glucose tolerance and type 2 diabetes. Molecular Aspects in Medicine. 42, 61-77 (2015).
- Tengholm, A., Gylfe, E. Oscillatory control of insulin secretion. Molecular and Cellular Endocrinology. 297 (1-2), 58-72 (2009).
- Quesada, I., et al. Glucose induces opposite intracellular Ca2+ concentration oscillatory patterns in identified α- and β-cells within intact human islets of Langerhans. Diabetes. 55 (9), 2463-2469 (2006).
- Ferguson, J., Allsopp, R. H., Taylor, R. M., Johnston, I. D. Isolation and long term preservation of pancreatic islets from mouse, rat and guinea pig. Diabetologia. 12 (2), 115-121 (1976).
- Andersson, A. Isolated mouse pancreatic islets in culture: effects of serum and different culture media on the insulin production of the islets. Diabetologia. 14 (6), 397-404 (1978).
- Ramirez-Dominguez, M. Isolation of mouse pancreatic islets of Langerhans. Advances in Experimental Medicine and Biology. 938, 25-34 (2016).
- Carter, J., Dula, S., Corbin, K., Wu, R., Nunemaker, C. A practical guide to rodent islet isolation and assessment. Biological Procedures Online. 11 (1), 3-31 (2009).
- Daoud, J., Rosenberg, L., Tabrizian, M. Pancreatic islet culture and preservation strategies: advances, challenges, and future outlook. Cell Transplantation. 19 (12), 1523-1535 (2010).
- Zawalich, W. S., Yamazaki, H., Zawalich, K. C. Biphasic insulin secretion from freshly isolated or cultured, perifused rodent islets: comparative studies with rats and mice. Metabolism. 57 (1), 30-39 (2008).
- Roe, M. W., et al. Absence of effect of culture duration on glucose-activated alterations in intracellular calcium concentration in mouse pancreatic islets. Diabetologia. 38, 876-877 (1995).
- Shuai, H., Xu, Y., Yu, Q., Gylfe, E., Tengholm, A. Fluorescent protein vectors for pancreatic islet cell identification in live-cell imaging. Pflügers Archive. European Journal of Physiology. 468 (10), 1765-1777 (2016).
- Dolenšek, J., et al. Glucose-dependent activation, activity, and deactivation of beta cell networks in acute mouse pancreas tissue slices. bioRxiv. , (2020).
- QZhang, Q., et al. Cell coupling in mouse pancreatic beta-cells measured in intact islets of Langerhans. Philosophical Transactions. Series A, Mathematical, Physical, and Engineering Sciences. 366 (1880), 3503-3523 (2008).
- Sánchez-Cárdenas, C., Hernández-Cruz, A. GnRH-induced Ca2+-signalling patterns in mouse gonadotrophs recorded from acute pituitary slices in vitro. Neuroendocrinology. 91 (3), 239-255 (2010).
- Asada, N., Shibuya, I., Iwanaga, T., Niwa, K., Kanno, T. Identification of alpha- and beta-cells in intact isolated islets of Langerhans by their characteristic cytoplasmic Ca2+ concentration dynamics and immunocytochemical staining. Diabetes. 47 (5), 751-757 (1998).
- Nadal, A., Quesada, I., Soria, B. Homologous and heterologous asynchronicity between identified α-, β- and δ-cells within intact islets of Langerhans in the mouse. Journal of Physiology. 517 (1), 85-93 (1999).
- Shuai, H., Xu, Y., Yu, Q., Gylfe, E., Tengholm, A. Fluorescent protein vectors for pancreatic islet cell identification in live-cell imaging. Pflugers Archive: European Journal of Physiology. 468 (10), 1765-1777 (2016).
- Cabrera, O., et al. Glutamate is a positive autocrine signal for glucagon release. Cell Metabolism. 7 (6), 545-554 (2008).
- Li, J., et al. Submembrane ATP and Ca2+ kinetics in α-cells: unexpected signaling for glucagon secretion. FASEB Journal. 29 (8), 3379-3388 (2015).
- Hamilton, A., et al. Adrenaline stimulates glucagon secretion by Tpc2-dependent Ca(2+) mobilization from acidic stores in pancreatic α-cells. Diabetes. 67 (6), 1128-1139 (2018).
- Arrojo, E. D. R., et al. Structural basis for delta cell paracrine regulation in pancreatic islets. Nature Communications. 10 (1), (2019).
- DiGruccio, M. R., et al. Comprehensive alpha, beta and delta cell transcriptomes reveal that ghrelin selectively activates delta cells and promotes somatostatin release from pancreatic islets. Molecular Metabolism. 5 (7), 449-458 (2016).
- Adriaenssens, A. E., et al. Transcriptomic profiling of pancreatic alpha, beta and delta cell populations identifies delta cells as a principal target for ghrelin in mouse islets. Diabetologia. 59 (10), 2156-2165 (2016).
- Rorsman, P., Huising, M. O. The somatostatin-secreting pancreatic δ-cell in health and disease. Nature reviews. Endocrinology. 14 (7), 404-414 (2018).
- Petersen, C. C., Toescu, E. C., Petersen, O. H. Different patterns of receptor-activated cytoplasmic Ca2+ oscillations in single pancreatic acinar cells: dependence on receptor type, agonist concentration and intracellular Ca2+ buffering. The EMBO journal. 10 (3), 527-533 (1991).
- Thorn, P., Lawrie, A. M., Smith, P. M., Gallacher, D. V., Petersen, O. H. Local and global cytosolic Ca2+ oscillations in exocrine cells evoked by agonists and inositol trisphosphate. Cell. 74 (4), 661-668 (1993).
- Behrendorff, N., Floetenmeyer, M., Schwiening, C., Thorn, P. Protons released during pancreatic acinar cell secretion acidify the lumen and contribute to pancreatitis in mice. Gastroenterology. 139 (5), e1711-e1715 (2010).
- Criddle, D. N., et al. Cholecystokinin-58 and cholecystokinin-8 exhibit similar actions on calcium signaling, zymogen secretion, and cell fate in murine pancreatic acinar cells. American Journal of Physiology. Gastrointestinal and Liver Physiology. 297 (6), G1085-G1092 (2009).
- Venglovecz, V., et al. Effects of bile acids on pancreatic ductal bicarbonate secretion in guinea pig. Gut. 57 (8), 1468-3288 (2008).
- Maleth, J., Hegyi, P. Calcium signaling in pancreatic ductal epithelial cells: an old friend and a nasty enemy. Cell Calcium. 55 (6), 337-345 (2014).
- Nadal, A., Quesada, I., Soria, B. Homologous and heterologous asynchronicity between identified alpha-, beta- and delta-cells within intact islets of Langerhans in the mouse. Journal of Physiology. 517 (Pt 1), 85-93 (1999).
- Skelin Klemen, M., Dolenšek, J., Slak Rupnik, M., Stožer, A. The triggering pathway to insulin secretion: Functional similarities and differences between the human and the mouse β cells and their translational relevance. Islets. 9 (6), 109-139 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved