Method Article
급성 마우스 췌장 조직 조각에서 칼슘 역학의 공초점 레이저 스캐닝 현미경 검사
요약
우리는 급성 췌장 조직 조각의 준비와 공초점 레이저 스캐닝 현미경 검사에서의 사용을 제시하여 많은 수의 살아있는 세포, 오랜 기간 동안 그리고 높은 시공간 분해능으로 칼슘 역학을 동시에 연구합니다.
초록
급성 마우스 췌장 조직 슬라이스는 전형적인 시험관내 연구에서 기술된 단리된 섬, 아시니, 덕트 또는 분산된 세포보다 훨씬 적은 제제-유도된 변화를 수반하는 보존된 세포간 통신 및 조직 구조를 갖는 독특한 계내 제제이다. 공초점 레이저 스캐닝 현미경 (CLSM)에서 급성 췌장 조직 조각과 라이브 세포 칼슘 이미징을 결합함으로써 칼슘 신호는 단일 세포 또는 심지어 세포 내 분해능으로 많은 수의 내분비 및 외분비 세포에서 동시에 연구 될 수 있습니다. 민감도는 변화의 검출을 허용하고 세포 간 파동 및 기능적 연결성에 대한 연구뿐만 아니라 다른 세포와의 췌도 및 파라크린 관계 내에서 국소화에 대한 세포의 생리적 반응의 의존성에 대한 연구를 가능하게합니다. 마지막으로, 동물 복지의 관점에서 볼 때, 한 번에 많은 수의 세포로부터의 신호를 기록하면 실험에 필요한 동물의 수가 줄어들어 3R 대체, 감소 및 정제 원칙에 기여합니다.
서문
포유류 췌장은 큰 외분비 및 내분비선입니다. 외분비 부분은 전체 췌장 부피의 96-99 %를 차지하며 acini와 덕트로 구성됩니다. 내분비 부분은 전체 췌장 부피의 나머지 1-4 %를 차지하는 랑게르한의 많은 섬으로 구성됩니다1. 외분비 부분은 음식에서 에너지가 풍부한 폴리머를 분해하는 주요 소화 효소뿐만 아니라 다른 위장 분비물과 결합하여 효소의 작용에 적합한 환경을 제공하는 중탄산염이 풍부한 유체를 분비합니다. 내분비 부분은 식후 분배, 저장 및 에너지가 풍부한 영양소의 식간 방출을 조절하는 호르몬을 분비합니다. 외분비 조직은 상대적으로 저개발되고 내분비는 출생시 비교적 잘 발달되어 있지만, 전자는 이유식 2,3,4시 후자를 빠르게 자랍니다. 췌장 기능에 대한 초기 연구는 현대 생리학의 탄생을 표시했으며,이 분야의 주요 방법론 적 발전은 주요 과학적 파쇄기5로 이어졌습니다. 췌장과 함께 일하는 것은 땀샘의 복잡한 구조로 인해 기술적으로 도전적이지만 공중 보건에 큰 위협이되는 췌장암, 췌장염 및 당뇨병과 같은 질병으로 인해 큰 동기가되고 새로운 치료 접근법이 필요합니다.
분리된 췌도6, 아시니7,8 및 덕트 단편은 세포주 및 일차 분산된 내분비, 아시나, 및 덕트 세포(9,10)와 비교하여 그들의 장점 때문에 수십 년 동안 금 표준 방법으로 개발되고 사용되었다. 분리된 세포 집단의 현저하게 개선된 기능에도 불구하고, 이러한 방법들은 여전히 상당한 기계적 및 효소적 스트레스를 수반하고, 세포를 주변 조직으로부터 분리시키고, 따라서 파라크린 상호작용 및 기계적 지지가 부족하며, 가장 중요한 것은 정상 생리학에 대한 현저한 변화를 수반한다11,12,13 . 급성 마우스 췌장 조직 슬라이스는 2001년에 개발되어 세포간 접촉, 파라크린 상호작용, 중간엽 및 조직 구조를 보존한 뇌, 뇌하수체 및 부신 절편과 유사한 실험 플랫폼을 개발해야 할 필요성이 인식되었으며, 그 당시의 췌도 연구에서 황금 표준 방법의 가장 중요한 단점 중 일부도 없이 분리된 섬(12)을 개발했으며, 14. 이러한 단점 중에는 최외곽층의 손상, 핵심 섬 영역의 접근성 부족, 세포 정체성 및 생리학에 중요한 영향을 미칠 수있는 재배의 필요성12,15이 있습니다. 또한, 조직 슬라이스 방법은 섬을 분리하는 것이 불가능하거나 전통적인 격리 16,17,18,19,20,21에 의해 췌도 수율이 매우 낮은 경우 심하게 변형 된 섬 구조를 가진 동물 모델에 대한 연구를 가능하게합니다.
또한이 슬라이스는 당뇨병과 췌장염의 발달 과정에서 형태 학적 변화를 연구하는 데 더 적합합니다 (예 : 전체 조직에 대한 더 나은 개요를 가능하게하고 지역 차이를 연구하는 것과 호환되기 때문입니다). 중요하게도, 내분비 부분에 대한 초기 초점에도 불구하고, 조직 슬라이스 방법은 본질적으로 외분비 성분 9,22,23의 연구를 가능하게 한다. 도입 후 첫 10 년 동안이 방법은 베타 14,24,25,26,27,28,29 및 알파 30,31 세포의 전기 생리학 연구뿐만 아니라 췌장의 형태 학적 및 기능적 성숙을 조사하기 위해 사용되었습니다 2,3 . 10년 후인 2013년에, 이 방법은 CLSM을 사용하여 포도당 32에 대한 그들의 반응, 그들의 기능적 연결 패턴(33), 형광 칼슘 염료와 막 전위 염료(34)를 조합함으로써 막 전위와 세포내 칼슘 사이의 관계를 특성화하기 위해 CLSM을 사용하는 췌도 세포의 살아있는 세포 칼슘 이미징에 성공적으로 적응되었다. 같은 해 후반에, 이 방법은 또한 acinar 세포22,35에서 칼슘 역학을 평가하기 위해 사용되었다. 그 후 몇 년 동안, 췌장 조직 조각은 다수의 상이한 연구에 사용되어 왔으며 돼지 및 인간 조직9,36,37,38,39,40,41에 성공적으로 적응되었다. 그러나, 종합하면, 칼슘 이미징-마우스 췌장 조직 절편에서 일반적으로 및 특히 섬에서-이 그룹에 의해 여전히 대부분 수행된다. 이것의 주된 이유 중 하나는 기술적으로 까다로운 조직 조각 준비, 공초점 현미경의 필요성 및 다소 복잡한 데이터 분석의 조합에 있습니다. 본 논문의 주요 목표는이 강력한 방법을 다른 잠재적 인 사용자가보다 쉽게 접근 할 수있게하는 것입니다.
조직 슬라이스 준비 및 구조 및 분비 연구를위한 슬라이스 사용에 대해 자세히 다루는 우수한 방법론 적 기사가 이미 있지만 공초점 칼슘 이미징 9,42,43에는 적용되지 않습니다. 따라서이 백서에서는 슬라이스를 준비하는 동안 몇 가지 추가 팁과 트릭, 성공적인 염료 로딩, 이미지 획득에 중요한 단계 및 기본 칼슘 데이터 분석의 주요 단계에 중점을 둡니다. 따라서, 이러한 기여는 상기 언급된 방법에 대한 대안이라기보다는 상호보완적인 것으로 간주되어야 한다. 유사하게, 마우스 췌장 조직 조각에서의 칼슘 영상화는 특정 질문에 답하기 위해 사용되는 실험적 접근법으로 간주되어야 하며, 따라서 분리된 덕트 또는 아시니, 단리된 섬, 오가노이드, 눈의 전방 챔버에 이식된 섬과 같은 췌장 생리학에서 다른 칼슘 이미징 접근법에 대한 절대적인 대안이라기보다는 상보적이며, 및 생체내 기록 11,44,45,46,47,48. 마우스 췌장 조직 조각에서 칼슘 이미징의 약속은 아마도 연막세포(49) 및 대식세포(50)와 같은 췌도 중간엽 세포뿐만 아니라 덕트 세포(23)에서의 칼슘 역학의 최근 성공적인 기록에 의해 가장 잘 설명될 것이다.
프로토콜
참고 : 모든 실험은 연구에서 동물의 보살핌과 사용에 대한 제도적 지침을 엄격히 준수하여 수행되었습니다. 이 프로토콜은 슬로베니아 공화국 식품 안전, 수의학 부문 및 식물 보호를위한 행정부의 승인을 받았습니다 (허가 번호 : 34401-35-2018 / 2).
1. 췌장조직조각의 제조
참고: CLSM을 이용한 칼슘 이미징을 위한 급성 마우스 췌장 조직 슬라이스의 제조는 여러 가지 도구, 다양한 용액이 필요하며 그림 1 에 개략적으로 제시되고 아래에 자세히 설명된 일련의 중요한 단계로 진행됩니다.
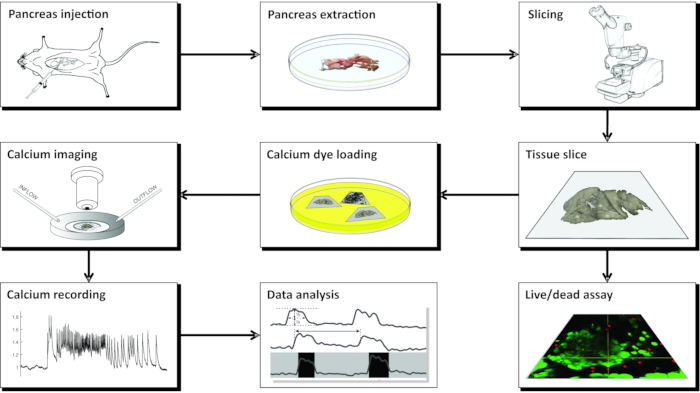
그림 1: 워크플로 다이어그램 췌장 조직 슬라이스 준비 과정에서 모든 단계의 개략적인 표현은 일반적인 담관에 아가로오스를 주사하는 것으로 시작하여 췌장의 추출과 슬라이싱이 뒤 따른다. 준비된 조각은 Live/Dead 키트로 조직의 생존력을 평가하거나 칼슘 센서로 염색하는 데 사용할 수 있습니다. 일단 얼룩이 묻으면 이미징 할 준비가됩니다. 이미징 과정에서 얻은 기록은 데이터 분석에 사용됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 용액의 제조
참고 : 모든 용액은 미리 준비해야하며 최대 한 달 동안 4-8 ° C의 냉장고에 보관할 수 있습니다. 조직 슬라이스의 제조 및 저장을 위해, 6 mM 글루코스와 0.3 L의 4-(2-하이드록시에틸)-1-피페라진에탄술폰산(HEPES) 완충액이 있는 약 0.5 L의 세포외 용액(ECS)이 필요하다. 1-2 mL/min 유량으로 설정된 주변 융합 시스템을 사용한 칼슘 이미징을 1일 동안 약 0.5L의 ECS가 필요합니다.- 6 mM 글루코스를 갖는 세포외 용액
- 125 mM NaCl, 26 mM NaHCO3, 6 mM 글루코스, 6 mM 젖산,3 mM 미오이노시톨, 2.5 mM KCl, 2 mM Na 피루베이트, 2 mM CaCl2,1.25 mM NaH2PO4, 1 mM MgCl2, 및 0.5 mM 아스코르브산을 함유하는 ECS 1 L를 제조하였다. 모든 재료가 완전히 녹을 때까지 철저히 혼합하십시오. 50 μL의 ECS를 0.5 mL 마이크로 원심분리 튜브에 넣고 제조업체의 지침에 따라 삼투압계 위에 놓고 삼투압을 확인합니다.
참고: 삼투압은 300-320mOsm이어야 합니다. 베타 세포의 자극을 위해, 더 높은 포도당 농도를 가진 해결책을 사용하십시오. 슬라이싱 및 실험 동안 7.4의 생리학적 pH 값을 보장하기 위해, 기압에서 ECS를 카르보겐(즉, 95%O2 및 5%CO2의 가스 혼합물)으로 지속적으로 버블링한다. 간단한 버블링 시스템은 5mm 실리콘 튜브의 한쪽 끝을 카르보겐 공급원(즉, 가압 가스 실린더)에 부착하고 튜브의 다른 쪽 끝을 ECS를 포함하는 병에 직접 배치하여 설정할 수 있습니다. - 대안적으로, 1250 mM NaCl, 260 mM NaHCO3,30 mM 미오이노시톨, 25 mM KCl, 20 mM Na 피루베이트, 12.5 mM NaH2PO4, 및 5 mM 아스코르브산을 함유하는10x 스톡을 제조하였다. 6 mM 글루코스를 함유하는 ECS가 필요할 때, 스톡 100 mL를 2 mL의 1 MCaCl2, 1 mL의 1 MMgCl2, 0.455 mL의 13.2 M 젖산, 및 1.08 g의 글루코스와 혼합하고, 1 L까지의 이중 증류수로 채운다. 필요한 경우 다른 양의 포도당을 사용하여 다른 포도당 농도를 얻으십시오.
- 125 mM NaCl, 26 mM NaHCO3, 6 mM 글루코스, 6 mM 젖산,3 mM 미오이노시톨, 2.5 mM KCl, 2 mM Na 피루베이트, 2 mM CaCl2,1.25 mM NaH2PO4, 1 mM MgCl2, 및 0.5 mM 아스코르브산을 함유하는 ECS 1 L를 제조하였다. 모든 재료가 완전히 녹을 때까지 철저히 혼합하십시오. 50 μL의 ECS를 0.5 mL 마이크로 원심분리 튜브에 넣고 제조업체의 지침에 따라 삼투압계 위에 놓고 삼투압을 확인합니다.
- 6 mM 글루코스를 갖는 HEPES 완충액
- 150 mM NaCl, 10 mM HEPES, 6 mM 글루코스, 5 mM KCl, 2 mM CaCl2 및 1 mM MgCl2를 함유하는 0.5 L HEPES 완충 용액 (HBS)을 제조하고; 1 M NaOH로 pH = 7.4로 적정한다.
참고: 카르보겐을 사용할 수 없는 경우 ECS 대신 모든 단계에 이 버퍼를 사용할 수 있습니다.
- 150 mM NaCl, 10 mM HEPES, 6 mM 글루코스, 5 mM KCl, 2 mM CaCl2 및 1 mM MgCl2를 함유하는 0.5 L HEPES 완충 용액 (HBS)을 제조하고; 1 M NaOH로 pH = 7.4로 적정한다.
- 아가로스 (1.9% 승/w)
- 수조를 40°C로 예열한다.
- 0.475g의 저융점 아가로스 및 6mM 글루코스를 함유하는 ECS 25 mL를 삼각 플라스크에 첨가하고, 플라스크를 끓기 시작할 때까지 몇 초 동안 최대 전력으로 전자레인지에 넣는다. 플라스크를 오븐에서 꺼내어 아가로스가 완전히 녹을 때까지 몇 번 소용돌이치십시오. 액체 아가로오스와 함께 플라스크를 40°C에서 예열된 수조로 옮기어 아가로스를 원하는 온도로 냉각시키고 주입될 때까지 액체를 유지한다. 안정화 리드 링으로 플라스크를 고정하십시오.
참고 : 아가로스는 미리 준비하고 냉장고에 보관할 수 있습니다. 사용 전에, 아가로스를 액화될 때까지 전자레인지에서 따뜻하게 하고, 삼각플라스크를 40°C로 예열된 수조로 옮긴다. 아가로스는 최대 5x까지 재사용 할 수 있습니다. 5x 이상으로 재사용하면 밀도가 높아지고 주입하기가 더 어려워집니다.
- 6 mM 글루코스를 갖는 세포외 용액
- 아가로스와 췌장 주사
참고: 섹션 1.2 및 1.3에서는 칼슘 이미징, 전기생리학, 면역조직화학, 분비 연구 및 구조적/미세해부학적 연구와 같은 다양한 실험 목적으로 사용할 수 있는 조직 조각의 제조에 대해 설명합니다.- 5 mL 주사기를 단계 1.1.3.2로부터의 수조에서 삼각 플라스크로부터의 액체 아가로오스로 채우고, 임의의 기포를 제거하고, 30 G 바늘을 장착한다. 뚜껑으로 바늘을 보호하고 채워진 주사기를 바늘이 아래쪽을 향하게하고 물 표면 아래의 아가로오스의 전체 부피를 수조에 다시 보관하십시오. 링이 수조의 벽에 대해 주사기를 누르는 방식으로 안정화 리드 링으로 주사기를 고정하십시오.
참고 : 바늘에 아가로스를 밀어 넣지 않도록주의하십시오.이 바늘은 빠르게 경화되어 바늘을 막습니다. 실내 온도가 낮 으면 경험이 적은 사람이 주사를 수행하는 경우 수조의 온도를 42 °C까지 높여 주사를위한 추가 시간을 확보하십시오. - 얼음통에 얼음을 채우고 ECS가 들어있는 병을 넣으십시오. ECS를 기압 및 실온에서 카르보겐으로 1.5mL/min으로 지속적으로 버블링하여 산소화와 7.4의 pH를 보장합니다.
- 고농도의CO2 를 투여하여 마우스를 희생시키고, 이어서 자궁경부 탈구를 실시한다. 동물의 고통을 최소화하기 위해 모든 노력을 기울이십시오.
- 입체 현미경으로 작업하면서 개복술을 통해 복부에 접근합니다 (그림 2A). 마우스의 왼쪽으로 장을 부드럽게 뒤집어 (마우스의 해부학 적 관점에서) 일반적인 담관을 노출시킵니다. 포셉을 사용하여 십이지장 부분을 약간 들어 올리고 Vater의 주요 십이지장 유두-유두를 찾으십시오. 지혈제를 사용하여 십이지장 유두에서 일반적인 담관을 클램프 (그림 2B, C)하여 덕트에서 십이지장으로 아가로오스가 누출되는 것을 방지하십시오.
참고 : 아가로스 누출이 십이지장으로 누출되는 것을 방지하고 위장관에서 위아래로 더 나아가 지혈제를 두드려 십이지장을 유두에서 근방과 원위 방향으로 고정시킵니다. 이 목적을 위해 곡선 지혈제를 사용하는 것이 가장 좋습니다. - 작은 날카로운 포셉으로 일반적인 담관 아래에 도달하고 덕트를 췌장 조직에 부착하는 막을 부러 뜨립니다. 더 나은 시각적 제어와 쉬운 주사를 위해, 덕트에서 가능한 한 많은 지방과 결합 조직을 제거하십시오.
- 덕트를 큰 포셉 위에 수직으로 놓고(그림 2D), 준비된 액체 아가로스를 일반적인 담관의 근위 부분에 주입합니다(그림 2D). 아가로스가 점성이 있으므로 주사기를 세게 짜내십시오. 췌장이 희끄무레하고 약간 흐트러질 때까지 또는 적어도 20-30 초 동안 계속 채우십시오.
참고: 이 단계는 슬라이스 준비에서 가장 중요한 단계입니다. 췌장의 덕트 나무에 꼬임이 있으면 췌장을 부드럽게 들어 올리거나 주사기에서 당겨 평평하게하십시오. 주사기로부터 주입된 부피에 기초하여 주사를 중단할 시기를 결정하지 않고 십이지장으로의 역류와 십이지장으로의 순방향 누출은 전형적으로 췌장의 덕트 트리에 주입된 부피보다 훨씬 높다. 중요하게도, 성공적인 주사는 주사기 부피의 실질적으로 눈에 띄지 않는 변화로 수행 될 수 있습니다. - 주사기를 제거하고, 병으로부터 0-4°C에서 버블링된 빙냉 ECS 20 mL를 췌장 상에 천천히 부어 조직을 냉각시키고 아가로스를 경화시킨다.
- 포셉과 미세한 터프 컷 가위를 사용하여 췌장을 부드럽게 추출하십시오. 추출한 췌장을 ~40 mL의 얼음처럼 차가운 ECS가 들어있는 100 mm 페트리 접시에 넣고 부드럽게 움직여 씻으십시오. 췌장을 ~ 40mL의 얼음처럼 차가운 ECS가 들어있는 신선한 100mm 페트리 접시에 담으십시오.
- 희끄무레 한 것처럼 보이는 췌장의 잘 주입 된 부분 (그림 3A)에서 포셉과 거친 절단 가위를 사용하여 0.1-0.2cm3 크기의 조직 6 블록까지 자릅니다. 결합 및 지방 조직을 제거하십시오.
- 35 mm 끈적임이 없는 바닥-페트리 접시에 40°C에서 약 5 mL의 액체 아가로스 접시를 채우고, 조직 블록을 그 안으로 옮기고, 즉시 페트리 접시를 얼음 위에 올려 놓고 그것을 식히고 아가로스를 경화시킨다.
참고 : 췌장 블록이 아가로스에 갇히는 방식은 슬라이스하는 동안 절단되는 방식을 결정합니다. 숙련 된 실험가들은 얼음 위에 놓일 때 아가로스가 굳어지기 몇 분 전에 블록의 위치를 미세 조정할 수 있습니다. - 조직 블록을 가진 아가로스가 굳어진 후, 페트리 접시를 거꾸로 뒤집어 100 mm 페트리 접시의 뚜껑과 같은 평평한 매끄러운 표면으로 돌리고, 면도날의 절반으로 부드럽게 절단하여 페트리 접시와 아가로스 사이의 여백으로 아가로스를 제거한다. 면도날로 각각 하나의 조직 블록을 포함하는 개별 아가로스 큐브를 자르고 각 조직 블록이 아가로스로 둘러싸여 있는지 확인하십시오. 시아노아크릴레이트 접착제로 비브라톰의 샘플 플레이트에 아가로스 블록을 붙입니다(그림 3B).
- 5 mL 주사기를 단계 1.1.3.2로부터의 수조에서 삼각 플라스크로부터의 액체 아가로오스로 채우고, 임의의 기포를 제거하고, 30 G 바늘을 장착한다. 뚜껑으로 바늘을 보호하고 채워진 주사기를 바늘이 아래쪽을 향하게하고 물 표면 아래의 아가로오스의 전체 부피를 수조에 다시 보관하십시오. 링이 수조의 벽에 대해 주사기를 누르는 방식으로 안정화 리드 링으로 주사기를 고정하십시오.
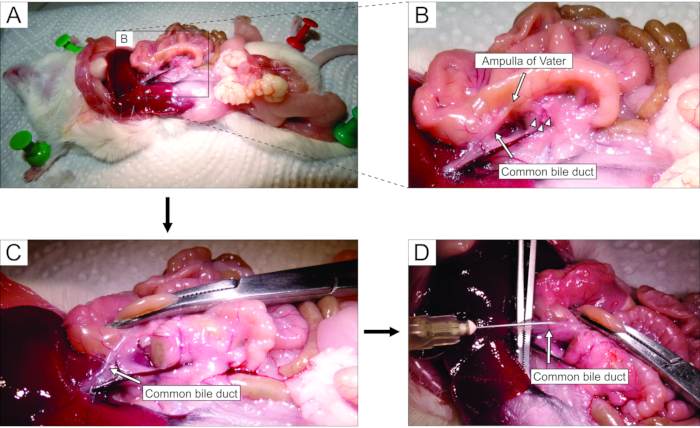
그림 2 : 일반적인 담관에 아가로오스를 주사하십시오. (A) 복강을 열고 복강에 장기를 노출시킵니다. (B) 패널 A의 사각형으로 둘러싸인 영역의 확대된 부분. 십이지장의 흰 점 (화살표로 표시됨)은 Vater의 ampulla를 나타냅니다. 랑게르한의 섬은 화살촉으로 표시되어 있습니다. (C) 곡선 지혈제에 의해 Vater의 ampulla를 고정하고, 그것을 약간 들어 올려 일반적인 담관 (화살표)을 노출시키고 부드럽게 스트레칭합니다. (d) 일반적인 담관의 캐뉼레이션 및 5 mL 주사기 및 30 G 바늘을 사용하여 1.9% 아가로스 용액을 주입한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 깔 끔 히
- 비브라톰의 절단실을 ~ 0.15L의 얼음처럼 차가운 ECS로 채우고 탄수화물로 끊임없이 거품을 일으 킵니다. 절단실을 얼음으로 감싸고 6 mM 포도당으로 ECS로 만든 2 개의 얼음 조각 (각각 ~ 10 mL)을 절단 챔버에 넣으십시오. 비브라톰에 절단하기 위해 면도날을 장착하고 아가로스 블록으로 샘플 플레이트를 제자리에 나사로 고정하십시오.
- 슬라이서를 설정하여 0.05 ~ 1 mm/s 및 70 Hz의 아가로스 블록을 표면적이 20-100mm2인 140 μm 두께의 슬라이스로 자릅니다. 슬라이서 설정의 경우 제조업체의 지침을 따르십시오.
- 각 절단 단계 직후에 슬라이서를 일시 중지하고 미세한 페인트 브러시로 슬라이스를 부드럽게 수집하여 실온에서 6mM 포도당으로 40mL의 HEPES 버퍼로 채워진 100mm 페트리 접시에 옮깁니다(그림 3C).
참고: 슬라이스는 실온에서 HEPES 버퍼에 최소 12시간 동안 보관할 수 있으며 버퍼는 2시간마다 교환해야 합니다.
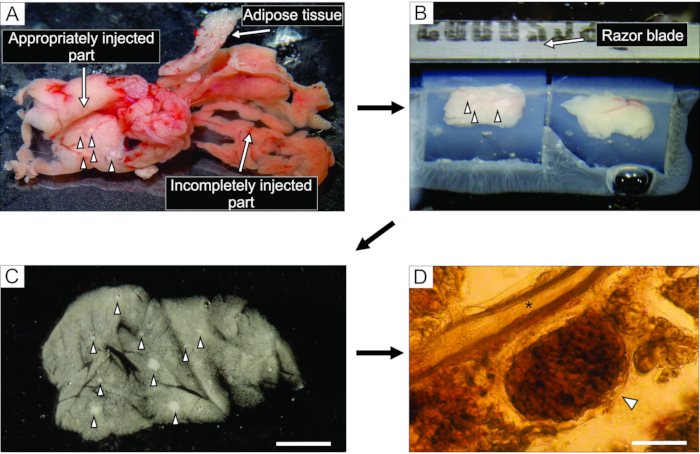
도 3: 췌장 조직 준비 및 슬라이스. (A) 아가로오스 주사 후 추출된 마우스 췌장. 왼쪽의 백색 조직은 잘 주입 된 부분 (십이지장 부분)을 나타내는 반면, 오른쪽의 더 붉은 부분은 췌장의 불충분하게 주입 된 부분 (비장 부분)을 보여줍니다. (B) 아가로스에 매립된 췌장 조직의 두 블록의 비브라톰(Vibratome) 슬라이싱. (C) 화살촉으로 표시된 랑게르한스 섬이 있는 급성 췌장 조직 조각. 스케일 바 = 3000 μm. (D) 랑게르한스의 섬이 화살촉으로 표시된 광현미경 하의 급성 췌장 조직 슬라이스, 별표는 췌장 덕트를 나타낸다. 배율 막대 = 100μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 포유류 세포에 대한 LIVE/DEAD 생존력/세포독성 키트를 사용한 라이브/데드 분석
참고: 일부 실험의 경우 다음과 같이 생/사각 분석을 통해 조각에 있는 세포의 생존력을 확인하는 것이 유용합니다(그림 4).
- 제조업체의 지침에 따라 LIVE/DEAD 생존력/세포독성 키트의 시약으로 바이알을 해동하고 사용 직전에 칼세인 AM의 작업 용액을 준비하십시오. 하루 안에 솔루션을 사용하십시오.
- 15 mL 원심분리 튜브에서, 5 μL의 4 mM 칼세인 AM (성분 A), 20 μL의 2 mM 에티듐 호모다이머-1 (EthD-1, 성분 B), 및 10 mL의 둘베코 포스페이트 완충 식염수 (D-PBS)를 혼합하여 대략 2 μM 칼세인 AM 및 4 μM EthD-1을 함유하는 작업 용액을 제조하였다. 철저하게 소용돌이.
- 미세한 페인트 브러시를 사용하여 조직 조각을 신선한 HEPES 버퍼가 있는 3mL 페트리 접시에 부드럽게 옮겨 혈청 에스테라제 활성을 희석합니다. HEPES 버퍼를 제거하고, 슬라이스를 단계 2.2에서 작업 용액의 100-200 μL (또는 필요한 경우 그 이상)로 덮는다.
- 슬라이스를 닫힌 페트리 접시에서 실온에서 30-45 분 동안 인큐베이션하십시오. 제조업체에서 권장하는 여기 / 방출 필터를 사용하여 조직 조각을 이미지화하십시오.
3. 칼슘 염료 로딩
참고 : 형광 염료는 염료의 준비 및 로딩의 전체 과정뿐만 아니라 염색 된 조직 조각을 취급하는 동안 빛 노출로부터 보호되어야합니다. 주석 호일은 칼슘 염료가 들어있는 튜브 또는 페트리 접시를 덮는 데 사용할 수 있습니다.
- 염료 준비
- 세포 투과성 Ca2+ 지시약 염료 (여기/방출 495/523 nm; 물표 참조), 7.5 μL의 디메틸설폭사이드(DMSO) 및 2.5 μL의 폴락사머(DMSO 중의 20% 용액; 물자 표) 6.667 mL의 HBS에서 6 mM 글루코스를 함유하는 15 mL 스크류 캡 튜브.
참고: 이 최종 용액은 6μM의Ca2+ 인디케이터 염료, 0.11% DMSO 및 0.037% 폴락사머를 함유한다. - 20초 동안 피펫으로 스크류 캡 튜브 내의 용액을 반복적으로 흡인하고 배출하는 단계; 튜브를 초음파 욕조 챔버에 30 초 동안 잠그고 30 초 동안 와류하여 가용화를 향상시킵니다. 단계 3.1.1에서 제조된 최종Ca2+ 지시약 염료 용액 3.333 mL를 분취량 5 mL 페트리 디쉬에 넣는다.
- 세포 투과성 Ca2+ 지시약 염료 (여기/방출 495/523 nm; 물표 참조), 7.5 μL의 디메틸설폭사이드(DMSO) 및 2.5 μL의 폴락사머(DMSO 중의 20% 용액; 물자 표) 6.667 mL의 HBS에서 6 mM 글루코스를 함유하는 15 mL 스크류 캡 튜브.
- 염료 로딩
- HBS가 있는 60 mL 페트리 접시에서 준비된 조직 조각을 얇고 부드러운 페인트 브러시를 사용하여 각 조직 조각을 부드럽게 들어 올려 염료 용액으로 채워진 5 mL 페트리 접시에 넣고 염료 용액에 넣습니다. 페트리 접시 당 최대 10 개의 조직 조각을 배양하십시오.
- 슬라이스가 장착된 페트리 접시를 분당 40턴으로 50분 동안 궤도 운동으로 설정된 실온에서 궤도 셰이커에 놓습니다. 실온에서 주위 공기에 노출된 염료 용액 내의 슬라이스를 인큐베이션하되, 페트리 접시를 주석 호일로 덮음으로써 빛으로부터 보호한다.
- 슬라이스 저장
- 염색된 조직 조각을 5 mL 페트리 접시에서 염료가 없는 HBS로 채워진 60 mL 페트리 접시에 옮기고, 미세하고 부드러운 페인트 브러시를 사용하여 부드럽게 들어 올린다. 페트리 접시 당 최대 20 조각까지 보관하십시오.
참고: 이 시점에서 이미징을 위해 조직 조각을 사용하십시오. 조직 절편은 몇 시간 동안Ca2+ 지시자 염료를 보유할 것이다. 조각의 생존과 염료의 보유는 얼음으로 둘러싸인 격리 된 용기에 Petri 접시를 놓음으로써 개선 될 수 있습니다. 이것은 염료가 로딩된 슬라이스가 수송되어야 하는 경우에 특히 중요하다. 또한 2시간마다 HBS를 교환하십시오.
- 염색된 조직 조각을 5 mL 페트리 접시에서 염료가 없는 HBS로 채워진 60 mL 페트리 접시에 옮기고, 미세하고 부드러운 페인트 브러시를 사용하여 부드럽게 들어 올린다. 페트리 접시 당 최대 20 조각까지 보관하십시오.
4. 칼슘 이미징
- 공초점 현미경의 설정
- 연구의 관심에 따라 적절한 목표 배율을 선택하십시오. 20x 및 25x(숫자 조리개 [NA] 0.77-1.00)를 선택하여 전체 섬, 여러 acini 동시에 또는 더 큰 덕트를 시각화합니다. 세포 내 역학을 연구하기 위해 더 높은 배율을 선택하십시오.
- 타임랩스 이미징을 위한 획득 모드(예: 타임랩스, xyt 또는 이와 유사한 모드)를 선택합니다. 핀홀을 100-200 μm로 설정하십시오.
- 녹색 형광단의 광 경로를 설정하십시오 : 488nm에서 여기, 500-700nm에서 방출 수집. 바람직하게는 광배수 검출기보다 높은 양자 효율(예를 들어, 갈륨 비소 포스피데)을 갖는 검출기를 선택한다.
- 기록 챔버 및 주변 시스템의 설치
- 기록 챔버를 현미경 및 주변 융합 시스템의 온도 제어 스테이지에 장착합니다(중력 공급 또는 연동 펌프 기반 설정, 부피 1mL). 챔버 내의 향수가 구불구불 액체 반월 연골 높이와 perifusate의 물방울이 표류하지 않도록하십시오.
- 주변 융합 시스템의 온도 제어를 37°C로 설정합니다.비자극 용액으로 주위융합을 시작하고 자극 용액을 준비합니다. 전동 밸브를 통해 또는 주변 시스템을 공급하는 솔루션을 수동으로 전환하여 솔루션을 변경하십시오.
- 칼슘 역학 기록
- 단일 조직 조각을 기록 챔버로 옮깁니다. 조직 조각을 U자형 백금 중량으로 타우트 나일론 메쉬(예: 나일론 스타킹으로부터)로 고정시킵니다. 나일론 스레드를 관심있는 구조 위에 배치하지 마십시오.
- brightfield 옵션을 사용하여 섬/acinus/덕트를 찾습니다. 라이브 이미징을 실행하여 연구된 구조물을 시야에 배치하고 이미징 파라미터를 설정합니다. 레이저 전력, 검출기 증폭 및 라인 평균화/비닝을 조정하여 신호 대 잡음비를 최적화하여 레이저 전력을 최소한으로 유지하면서 셀을 시각화할 수 있습니다.
- 절단면에서 잠재적으로 손상된 셀로부터 기록되지 않도록 기록의 초점면을 절단면 아래 ~15μm로 조정하십시오(그림 5).
- 이미지를 획득합니다. 샘플링 주파수를 1-2Hz로 설정하여 초기에 개별 진동을 감지하고, 더 높은 획득 속도(>10Hz)에서 빠른 회선 평균화(8-20)가 가능한 공진 스캐너를 사용하여 세포 내 Ca2+([Ca2+]IC) 활동을 기록합니다. 광독성을 방지하기 위해 연속적인 점 조명 사이의 간격(예를 들어, 전체 샘플링 시간의 30%)을 허용한다. 시계열 획득 전에 고해상도 이미지(예: 1024 x 1024 픽셀, 선 평균 > 50)를 기록합니다(섹션 5 참조).
참고: 1-2Hz의 샘플링 주파수는 대부분의 셀에서 획득 주파수에 대한 나이퀴스트 기준보다 낮으며 신호 모양은 기본적으로 언더샘플링됩니다. - 이미징 소프트웨어에서 사용 가능한 경우 온라인 차트를 참조하여 준비 응답, 과조명, 광표백 및 기계적 드리프트에 대한 즉각적인 피드백을 얻으십시오. 획득 중 표백 속도가 높은 경우, 기록을 중지하고 레이저 전력을 줄이면서 검출기 이득을 증가시켜 신호 대 잡음비를 유지하십시오. 기계적 드리프트의 경우, 튜브/케이블과 현미경 스테이지 사이의 장력과 액체 누출 또는 기록 챔버의 볼륨 변화를 확인하십시오. 선택적으로, 수동으로 획득하는 동안 드리프트를 수정하려고 시도; 그러나 이것은 본질적으로 제한된 결과를 산출한다는 점에 유의하십시오.
참고: 내분비 세포는 역치에 가까운 농도에서 매우 이질적입니다. 개별 세포에서 활성화/비활성화 지연의 범위를 검출하기 위해서는 충분한 자극 길이가 필요하다. 이는 매우 자극적인 프로토콜에 따른 오프 응답의 정확한 검출을 위해 특히 중요하다. - 칼슘 이미징을 사용하여 endo- 및 외분비 세포를 기능적으로 구별하십시오 (그림 6). 활성화 및 비활성화 중 일시적인 활동을 기록하려면 기록을 중지하지 않고 자극을 적용하십시오.
- 실험이 끝난 후 데이터를 저장합니다(자동 저장 기능 사용 고려). 셧다운 절차 중에 레이저가 손상되지 않도록 레이저 전원을 끄기 전에 냉각 기간을 허용하십시오.
5. 데이터 분석
- 타임랩스 비디오를 재생하여 녹화를 정성적으로 시각적으로 검사합니다. 시야각 또는 광학 평면에서 셀 드리프트를 확인합니다. 광학 평면 내에서 드리프트가 발생한 경우 ImageJ에서 드리프트 보정 플러그인을 사용합니다.
- 현미경 소프트웨어 또는 타사 소프트웨어를 사용하여 관심 지역(ROI)을 선택합니다. 고해상도 이미지, 최대 투영 또는 프레임 평균을 참조로 사용하여 ROI를 선택합니다. 타임랩스 이미징을 재생하여 참조 이미지에서 볼 수 없는 응답 셀을 시각화합니다. ROI의 선택된 영역이 이웃 셀과 겹치지 않도록 ROI를 배치하여 ROI 간의 신호 누화를 방지합니다.
- 시계열 데이터를 프레임당 ROI 평균값으로 내보냅니다. ROI 좌표를 내보냅니다.
- 에 설명된 대로 지수 및 선형 적합도의 조합을 사용하여 표백에 대한 시계열 데이터를 수정합니다(그림 7A).
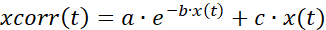 (1)
(1)
여기서 x(t) 는 시점 t에서의 형광 신호를 나타내고; xcorr(t) 해당 시점에서의 보정된 신호; 및 a, b 및 c 는 corr(t )와 x(t) 사이의 최소 제곱합으로 계산된 적합도의 파라미터이다. - 응답의 활성화 및 비활성화 단계를 분석합니다(그림 7B). 시계열 데이터의 첫 번째 미분을 계산하고, 활성화 및 비활성화에 대응하는 유도체의 정점 및 나디르를 각각 결정한다. 또는 phasic 증가의 시작을 수동으로 선택하십시오. 활성화/비활성화 시간과 해당 셀 좌표를 저장하고 내보냅니다.
- 고원상을 분석한다(도 7C). 원시 데이터를 임계값으로 지정하거나 시계열 데이터의 첫 번째 파생물을 임계값으로 설정하여 개별 진동을 감지합니다. 개별 진동의 시작과 끝을 진동의 절반 진폭에 해당하는 시간으로 정의합니다.
- 각 셀에 대한 개별 진동의 지속 시간과 빈도를 계산합니다. 인터스파이크 간격의 역값을 계산합니다(일반 활동 패턴에 적합). 또는 진동 수를 레코드의 시간 간격으로 나눕니다(불규칙한 활동 패턴에 적합).
- 활성 시간을 계산합니다. 활성 시간을 기간의 합계로 표현하고 이 값을 시간 간격으로 나눕니다. 또는 진동에 해당하는 주파수와 지속 시간을 곱합니다.
참고: 지속 시간의 합을 시간 간격으로 나누면 강력한 결과를 얻을 수 있지만 셀당 단일 데이터 요소가 얻어질 때 통계적 차별이 낮습니다. 발진의 주파수와 지속 시간을 곱하면 발진 대 발진 시간 분해능이 제공됩니다.
결과
췌장 덕트에 아가로스 용액을 주입하는 것은 췌장 조직 슬라이스 준비에서 가장 중요한 단계입니다. 성공적인 주사는 도 3A의 왼쪽에서 볼 수 있듯이 췌장 조직의 미백에 의해 인식 될 수 있으며, 불완전하게 주입 된 췌장 부분은 도 3A의 오른쪽에 제시됩니다. 랑게르한스의 섬은 육안 또는 입체 현미경으로 인식 할 수 있으며, 이는 아가로스 블록에 후속 임베딩을 위해 췌장의 적절한 부분을 절단하는 데 도움이됩니다 (그림 3B). 갓 자른 마우스 췌장 조직 슬라이스에서, 랑게르한스의 섬은 입체현미경 하에서 흰 반점(그림 3C) 또는 광현미경 하에서 갈색을 띤 구조로서 주위의 외분비 조직 및 중간엽과 쉽게 구별될 수 있다(도 3D). 췌장 조직 슬라이스는 슬라이스 후 적어도 12 h 동안 별개의 유형의 실험에 사용될 수 있다. 입체현미경, 광현미경 및 칼슘 영상화 동안의 세포의 기능적 반응에 의한 총체적 형태학적 평가 이외에도, 췌장 조직 절편의 생존력을 평가할 수 있다(도 4).
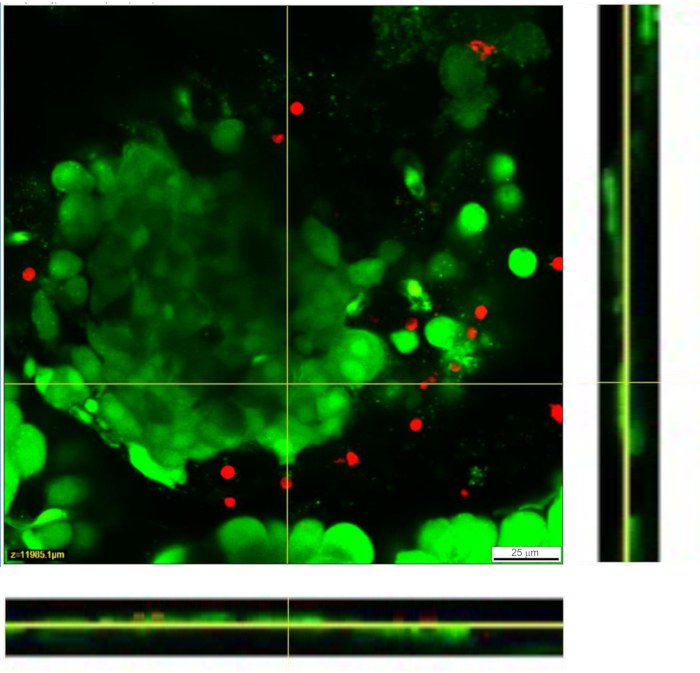
그림 4: 조직 슬라이스 내 세포의 생존력. 세포의 생존력은 라이브/데드 분석으로 결정하였다. 살아있는 세포는 Calcein AM (녹색으로 표시)으로 염색되는 반면, 죽은 세포는 에티듐 호모다이머-1 (빨간색으로 표시)으로 염색됩니다. 노란색 선은 아래쪽과 오른쪽에 표시되는 Z 스택의 X-Y 횡단면의 위치를 나타냅니다. Z-스택의 전체 깊이는 88μm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
칼슘 이미징 실험의 경우, 형광 칼슘 표시기는 몇 층의 세포를 관통해야합니다. 도 5A는 개별 췌도 및 acinar 세포가 인식될 수 있는 췌장 조직 슬라이스 내로의 세포 투과성Ca2+ 지시자 염료의 성공적인 로딩을 제시한다. 대조적으로, 도 5B-D의 절편은 염료의 실패한 침투 (도 5B), 췌도 세포의 부족 (도 5C), 및 표면에 많은 괴사 조직 (도 5D)으로 인해 최적이 아니다. 이러한 슬라이스는 폐기되거나, 더 잘 절단되거나 염색된 추가 섬이 있는지 확인하거나(문제 해결을 위해 표 1 참조), 외분비 세포의 반응을 기록하는 데 사용할 수 있습니다.
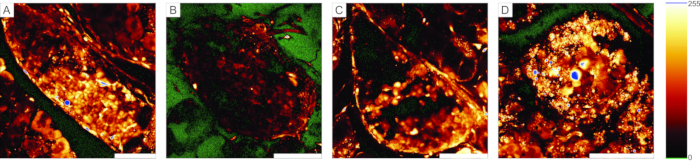
도 5: 사용 가능한 및 사용할 수 없는 제제의 예 . (A) 랑게르한스의 섬에서 잘 염색된 세포뿐만 아니라 덕트 세포 및 주변 아시나 조직으로 췌장 조직 조각의 성공적인 제조의 예. (b) 잘 염색되지 않은 조직 슬라이스의 예. (C) 구조적 단종을 가진 랑게르한스 섬의 예. (D) 많은 죽은 세포와 많은 파편을 포함하는 랑게르한스 섬의 예. 오른쪽의 "광선 오버, 광선 아래" 조회 테이블은 녹색으로 0 강도를, 파란색으로 채도를 표시합니다. 배율 막대 = 100μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
세포 투과성Ca2+ 지시약 염료를 이용한 칼슘 이미징의 대표적인 결과는 도 6에 나타내었다. 도 6A에서, 랑게르한스의 섬, acinar 조직, 및 췌장관을 함유하는 췌장 조직 슬라이스의 고해상도 이미지가 제시된다. 더 나은 구별을 위해, 도 6A 에 제시된 췌장 조직 절편의 내분비, 외분비 및 덕트 부분은 도 6B에서 착색된다. 적절한 자극을 사용하여 상이한 췌도 세포, 또는 췌도 세포와 비췌도 세포(51)를 기능적으로 구별할 수 있다. 베타 세포는 전형적으로 [Ca2+]IC 의 일시적인 증가와 함께 글루코스에 의한 사각 펄스 자극에 반응하고, 이어서 지속된 고원 상에서 빠른 칼슘 진동에 반응할 것이다(도 6C, 상부 패널).
모든 베타 세포가 단 일의 큰 기능적 동기로 결합됨에 따라, 이러한 진동은 또한 확산 [Ca2+]IC 파 동32,34,52,53,54를 통해 서로 다른 세포들 사이에서 매우 잘 동기화된다(도 7C). 5-15분의 기간을 갖는 느린 [Ca2+]IC 진동은 빠른 진동의 기초가 될 수도 있고, 심지어 레폰스(55,56)의 우세한 유형일 수도 있다. 동일한 간단한 프로토콜은 특히 섬의 주변에서 다른 유형의 반응을 나타낼 수 있습니다 (그림 6C, 하단 패널). 이들 세포는 베타 세포와 동기화되지 않고 낮은 글루코스 조건에서 또는 활성의 감소와 함께 이미 존재하는 더 빠르고 불규칙한 진동으로 반응하기 때문에, 그러한 반응은 베타가 아닌 세포21,32,57,58을 매우 암시한다. 그러나, 이들의 결정적인 기능적 특성화는 추가적인 자극 단계 또는 대안적인 접근법을 갖는 더 복잡한 프로토콜을 필요로 하며, 이는 아래에서 논의된다. acinar 및 ductal 세포의 전형적인 반응은 각각 도 6D 및 도 6E에 제시된다. acinar 및 ductal cells 22,23,35에 대한 자세한 내용은 문헌을 참조하십시오.
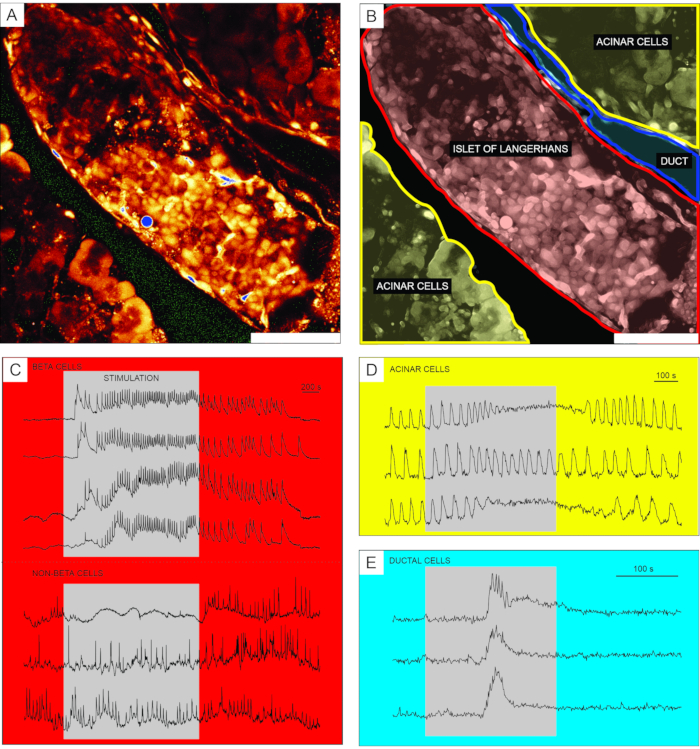
도 6: 뚜렷한 유형의 췌장 세포에서 칼슘 역학의 대표적인 결과 . (A) 주변 조직을 가진 랑게르한스 섬의 고해상도 이미지. 스케일 바 = 100 μm. (B) 노란색으로 표시된 아시나 조직을 갖는 췌장 조직의 뚜렷한 부분, 적색으로 표시된 랑게르한스의 섬, 및 청색으로 표시된 덕트 트리의 세그먼트를 묘사한다. 스케일 바 = 100 μm. (C) 12 mM 글루코스로 자극하는 동안 베타 및 추정성 비베타 세포에서 칼슘 역학의 전형적인 흔적; 3 mM 글루코스는 비자극성 조건을 사용하였다. 비베타 세포의 보다 구체적인 차별을 위해 사용될 수 있는 프로토콜은 토론 섹션에 기재되어 있다. (d) 25 nM 아세틸콜린에 의해 자극된 아시나 세포의 칼슘 역학의 전형적인 흔적. (e) 1 mM 케노데옥시콜산에 의해 자극된 덕트 세포의 칼슘 역학의 전형적인 흔적. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
성공적인 칼슘 이미징 후, 데이터는 먼저 프로토콜 섹션에 설명된 대로 지수 및 선형 적합도의 조합에 의해 표백을 위해 내보내지고 수정됩니다. 표백 보정 전후의 시계열이 그림 7A에 나와 있습니다. 그 후, 반응의 활성화 및 비활성화 단계 뿐만 아니라 고원층에서의 몇몇 파라미터가 분석될 수 있다. 자극 후 [Ca2+]IC 증가의 발병 지연은 도 7B의 지연A 및 개별 세포들 사이의 지연에서의 이질성(지연A1)으로 표현되는 것으로 측정될 수 있다. 동일한 파라미터들(지연D 및 지연D1)이 비활성화 단계를 기술하는데 사용될 수 있다. 초기 과도 [Ca2+]IC 증가에 이어서, 췌도에서 대부분의 췌장 베타 세포에서 고원상은 비교적 규칙적인 고주파 [Ca2+]IC 진동을 특징으로 한다. 고원상은 고전적인 기능적 파라미터를 분석함으로써 설명될 수 있다. [Ca2+]IC 진동 지속 시간, 주파수 및 활성 시간의 백분율의 개략적인 프리젠테이션이 도 7C에 제시되어 있다. 획득률이 10Hz보다 높은 칼슘 이미징에서는 췌도를 가로질러 반복적으로 퍼지는 칼슘파를 명확하게 인식할 수 있습니다(그림 7C).
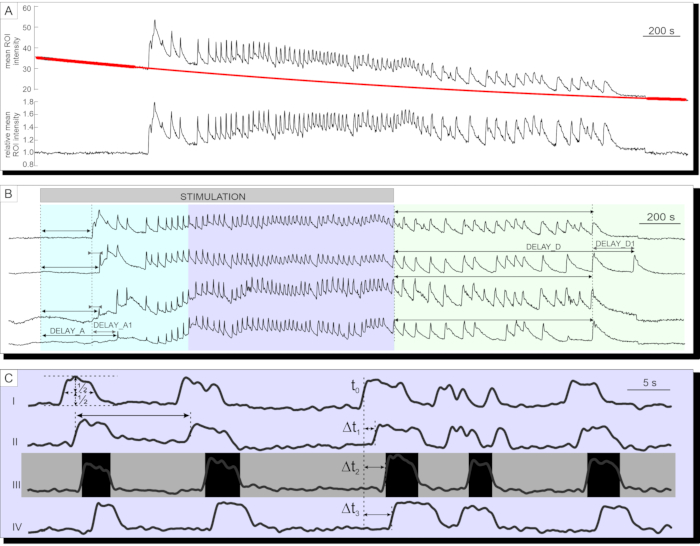
그림 7: 시계열 데이터 분석 . (A) 광표백을 위한 시계열 데이터의 보정. (b) 자극 후 활성화 및 12 mM 글루코스로 자극의 중단 후 비활성화까지의 지연의 분석. 자극의 지속 시간은 이미지에서 밝은 회색, 음영 처리 막대로 표시됩니다. (C) 고원 위상의 여러 파라미터 분석: I) 절반 높이에서 결정된 진동의 지속기간, II) 인터-발진 간격에 의해 결정된 진동의 주파수. III) 진동의 주파수와 지속 시간의 곱으로서의 활성 시간. I-IV) 단일 세포가 진동의 절반 높이에 도달하는 시간의 지연 (Δt)에 의해 결정되는 랑게르한스 섬을 가로 질러 확산되는 진동의 주어진 파동에서 진동 사이의 지연. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
췌장 조직 슬라이스 방법은 췌장의 내분비 및 외분비 부분의 형태 및 생리학을보다 보존되고 현장 준비로 연구하는 빠른 실험 방법입니다. 많은 장점이 이미 소개에서 지적되었습니다. 일반적으로 (즉, 칼슘 이미징뿐만 아니라) 췌장 생리학을 연구하기위한 슬라이스 접근법은 격리 후 회복 기간을 포함하지 않기 때문에 시간을 절약한다는 점을 지적 할 가치가 있습니다. 후자는 다른 종의 고립 된 섬의 모든 유형의 실험과 사용에 절대적으로 필요한 것은 아니지만 일반적으로 순도를 높이고 생존력과 기능을 복원하며 때로는 여러 기증자로부터 섬을 수집하기 위해 사용됩니다 59,60,61,62,63,64 . 그러나, 칼슘 이미징의 맥락에서, 베타 세포 반응은 배양 기간 및 조건에 의존하는 것으로 밝혀졌으며, 이것은 단리된 섬15,65를 사용할 때 고려해야 할 중요한 변이의 원천이다. 장기 배양이 향후22,36에서 널리 사용되는 옵션이되는 경우 조직 조각에 대해서도 동일한 문제를 고려해야합니다. 조직 슬라이스 방법은 또한 높은 수율을 가지며 따라서 잠재적으로 동물의 고통을 줄이고 통계적 힘을 증가시킵니다. 더욱이, 단일 동물로부터 많은 슬라이스가 제조될 수 있고 슬라이스가 장기간 생존하기 때문에, 동일한 동물 또는 심지어 동일한 췌도를 포함하여 실험 및 대조군 모두에서 실현이 가능해진다.
원래의 아키텍처 및 세포 간 통신이 보존되고 다수의 구조 분석, 전기 생리학, 이미징 방법 및 호르몬 분비 분석과 호환되기 때문에이 방법은 개별 세포 간의 방해받지 않는 상호 작용, 예를 들어 분비 촉진제, 파라크린 및 다른 세포 유형 간의 면역 상호 작용에 의존하는 췌장 기능을 연구하는 데 특히 유용합니다. 전기 활동의 패턴, 칼슘 역학의 특성 및 다른 호르몬의 분비. 특히 칼슘 이미징의 경우, 슬라이스 사용의 주요 장점은 췌도 코어의 노출과 고해상도로 다양한 세포 유형에서 신호를 획득 할 수 있다는 것입니다. 실험의 요구 사항 및 동물의 나이에 따라 두께가 달라질 수 있으며, 슬라이스를 형질감염시키거나 유전적으로 인코딩 된 리포터로 동물로부터 얻을 수 있습니다. 아래에서 더 상세히 설명되는 바와 같이, 후자의 두 접근법은 또한 비베타 세포(31,66)로부터의 반응의 특이적 기능적 동정 및 특성화를 가능하게 한다. 또한, 장기의 잘 정의 된 부분의 섬은 질병에 대한 반응성 또는 감수성의 차이에 대해 연구 될 수 있습니다. 그들은 회복 잠복기를 필요로하지 않지만, 다른 약리학 적 제제, 지방산, 고 글루코스 및 사이토 카인과 함께 쉽게 배양 될 수 있습니다.
가장 중요한 것은, 단일 세포 또는 심지어 세포 내 분해능과 함께 고분해능을 달성할 수 있기 때문에, 조각에서의 공초점 칼슘 이미징은 칼슘파, 기능적 연결성 및 췌도(54,67)의 별개의 부분에서 세포의 다양한 기능적 역할을 분석하는 데 가장 적합한 방법 중 하나이다. 다수의 이점에도 불구하고, 조직 슬라이스 접근법은 중요한 한계를 갖는다. 첫째, 특히 절단면에서 췌도 및 외분비 구조에 적어도 부분적으로 지장을 주며 추가적인 기계적 및 내인성 효소 손상을 방지하기 위해 준비 중에 저온, 빈번한 용액 교환 및 부드럽고 빠른 조작과 같은 예방 조치가 필요합니다. 둘째, 영양소 및 분비촉진 전달의 패턴은 생체내 경로보다 여전히 열등하며, 제제는 전신 신경과민으로부터 분리되고, 췌도와 그의 표적 조직 사이와 같은 기관 간 피드백은 생체내 접근법과는 대조적으로 불가능하다. 셋째, 최대 슬라이스 두께는 ~200μm9에서의 산소화, 영양소 전달 및 pH 조절에 의해 제한된다. 또한, 슬라이스의 준비와 이미징 모두 많은 훈련이 필요하며, 오랜 시계열과 많은 세포로부터의 칼슘 데이터에 대한 심층적 인 분석은 종종 고전 생리학자의 툴킷에 포함되지 않는 전문 지식이 필요하며 물리학자 또는 데이터 과학자의 도움이 필요합니다. 호모- 및 이형적 상호작용이 보존된다는 이점은 또한 관심 영역에 있는 다른 세포로부터의 신호의 존재로 인해 샘플의 분석을 복잡하게 할 수 있다. 프로토콜에 따라, 다른 세포의 활성화는 관찰된 세포의 간접적인 추가적인 자극 또는 억제를 유도할 수 있다.
이것은 디컨볼루션 접근법, 간접 효과의 일부를 차단하는 물질을 포함한보다 복잡한 자극 프로토콜, 특정 녹아웃 동물 사용, 그리고 더 많은 환원주의 방법론을 사용하는 다른 연구의 결과와 결과를 신중하게 비교함으로써 결정적으로 해결 될 수 있습니다. 또한, 분비 측정이 필요한 경우, 일부 슬라이스에는 섬이 부족할 수 있으며 단일 슬라이스에서 내분비 조직의 총 질량은 일반적으로 낮다는 것을 명심해야합니다. 이미징을위한 급성 췌장 조직 조각의 준비는 다음 섹션에서 논의되고 표 1에 요약 된 몇 가지 중요한 단계를 포함하며, 독자는 문제 해결을위한 짧지 만 중요한 팁을 찾을 수 있습니다. 첫째, 아가로스 용액을 준비 할 때, 아가로스 분말은 완전히 용해되어야하며, 그렇지 않으면 용해되지 않은 입자가 주입을 방해 할 수 있습니다. 균질한 아가로스 용액을 37-45°C로 유지하여 한편으로는 너무 낮은 온도로 인한 아가로오스의 경화를 방지하고 한편 너무 높은 온도로 인한 조직 손상을 방지한다. 사용 후, 남아있는 아가로스는 4°C에서 저장되고 재가열될 수 있지만, 반복적인 재가열은 물 증발로 인한 밀도 증가를 초래할 수 있지만, 결국 주입을 어렵거나 불가능하게 만든다.
준비의 다음 중요한 단계는 주요 십이지장 유두를 올바르게 클램핑하는 것입니다. 십이지장의 흰 반점은 일반적인 담관과 십이지장의 접합을 나타냅니다. 클램프를 너무 가까이 배치하면 공통 덕트의 일부 측면 췌장 가지가 막히게되어 이러한 부분의 주입이 비활성화되는 반면, 너무 원위 방향으로 배치 된 클램프는 아가로스가 하부 저항 경로를 통해 십이지장으로 직접 누출됩니다. 일반적인 담관의 cannulation 전에, 주위 지방 조직은 덕트의 더 나은 시각화와 주사 동안 더 큰 통제를 위해 조심스럽게 제거 될 수 있습니다. 주변 조직의 제거 동안 불충분 한 정밀도는 덕트의 천공을 초래할 수 있습니다. 아가로스 주사에 사용되는 바늘 직경의 선택 또한 중요하다. 마우스에서, 30 G 바늘이 바람직하게 사용된다; 더 작은 (32 또는 33G) 바늘은 아가로스 용액의 점도가 높기 때문에 더 많은 노력이 필요하며 방해가되기 쉽습니다. 그러나, 저밀도 아가로스 용액과 함께 사용한다면, 이들은 더 작은 마우스 균주 및 더 어린 동물에 매우 도움이 될 수 있다. 초기 산후 일 동안, 아가로오스는 대안적으로 도약내보다는 피막 하로 주사될 수 있다2. 마우스에서 직경이 큰 바늘을 사용하면 일반적인 담관이 손상 될 가능성이 큽니다. 이것은 또한 정확한 바늘 직경으로 발생할 수 있으며, 포셉은 주사 중에 바늘을 제자리에 유지하는 데 도움이 될 수 있습니다. 더 큰 직경의 바늘은 쥐에서 발견되는 것처럼 더 큰 덕트의 경우 유일한 해결책 일 수 있습니다. 바늘이 너무 좁아서 역누출을 방지하는 타이트한 씰을 보장하지 못하면 덕트에 성공적으로 진입 할 때 합자가 그 주위에 배치 될 수 있습니다.
Agarose 주입은 용액의 점도로 인해 약간의 노력이 필요하며, 일단 주입 과정이 시작되면 주입이 완료되기 전에 저융점 아가로스 용액이 바늘 또는 덕트 트리의 가장 큰 부분에서 응고 될 수 있으므로 중단되어서는 안됩니다. 이것은 절단 중에 조직 침투가 불량하고 지지력이 악화됩니다. 덕트는 왼쪽 간관과 낭성 덕트가 결합하여 공통 담관을 형성하는 지점에서 항상 캐뉼레이션되어야합니다. 일반적인 담관이 천공되면 십이지장에 더 가깝게 캐닝을 반복적으로 시도하십시오. 췌장이 아가로스 용액으로 충분히 안정화되고 복강에서 추출되면 잘 주입 된 조직의 작은 조각이 절단됩니다. 아가로스에 그들을 매립하기 전에, 그들의 잔류 물이 슬라이스를 더 어렵게 만들기 때문에 모든 지방 및 결합 조직을 제거하는 것이 중요합니다. 혈관과 덕트 잔류 물에도 동일하게 적용되며, 실험의 초점이 될 때를 제외하고는 마찬가지입니다. 이 경우 원하는 단면을 얻을 수 있도록 배치하십시오. 조직을 아가로스에 매립할 때, 온도가 적절한지(37°C), 그리고 조직이 아가로오스에 의해 완전히 둘러싸여 있는지, 비브라톰 슬라이싱 동안 힘으로 아가로스 블록으로부터 췌장 조직을 찢어낼 수 있는지 확인한다.
조직 블록을 아가로오스에 넣기 전에 신속하게 건조시켜 종이 조직 위에 간단히 올려 놓으면 이 단계 동안 조직과 아가로오스 사이의 불량한 접촉을 방지하는 데 도움이 될 수 있습니다. 아가로스 블록이 응고되는 동안 페트리 접시를 수평으로 놓고 췌장 조직과 페트리 접시의 바닥 사이의 접촉을 방지하십시오. 췌장이 완전히 주입되지 않으면 절단 과정이 어려울 것입니다. 따라서 조직 조각을 얻기 위해 절단 속도를 줄이십시오. 비브라톰 슬라이싱 중에 세포 손상을 최소화하려면 슬라이스 챔버의 ECS(및 ECS로 만든 얼음 조각)를 정기적으로 교체하십시오. 후자는 슬라이싱 동안 acinar 조직에서 방출되는 췌장 효소의 활성을 감소시킬 것이다. 조각의 두께 또한 매우 중요합니다. 칼슘 역학 및 전기 생리학 실험의 경우, 140 μm 슬라이스는 일반적으로 절단됩니다. 그러나 연구의 목적에 따르면 슬라이스 두께는 90 μm에서 200 μm 사이일 수 있습니다. 두꺼운 조각에서는 산소와 영양소의 확산이 제한되지만 더 많은 조직을 포함 할 것임을 명심하십시오. 또한, 절단되지 않은 섬의 비율은 슬라이스 두께가 증가함에 따라 증가 할 것으로 예상 될 수 있습니다. 슬라이스는 실온에서 정기적으로 교환된 ECS에 수 시간 동안 저장되거나 심지어 며칠 동안 적절한 세포 배지에서 배양될 수 있다; 그러나, 이것은 결국 정상적인 췌도 세포 생리학(3,22)에 영향을 미칠 수 있다.
염료 용액을 준비 할 때 모든 구성 요소를주의 깊게 혼합하고 주변 광에 노출되지 않도록하십시오. 췌장 슬라이스는 많은 세포층으로 구성되며, 칼슘 염료의 흡수는 단리된 섬(58,68) 및 뇌하수체 슬라이스(69)에 대해 이전에 기술된 바와 같이, 처음 몇 개의 가장 피상적인 세포층으로 제한된다. 그러나 주변 캡슐과 외부 세포층이 염료가 더 깊은 층으로 침투하는 것을 방해하는 고립 된 섬과는 달리, 조직 조각은 섬의 전체 단면 표면에 접근 할 수있게하여 섬의 모든 층에서 수백 개의 세포에서 칼슘 역학을 동시에 측정 할 수 있습니다. 형광 Ca2+ 지표는 칼슘 역학 측정에 가장 널리 사용되며 CLSM과 함께 수백 헤르츠에 달하는 높은 시간 분해능으로 녹음을 가능하게 합니다. 가장 적합한 형광 Ca2+ 지표를 선택할 때, 세포 로딩 방법, 측정 모드(정성적 또는 정량적) 및 Ca2+ 농도 범위에 있어야 하고 pH, 온도,Mg2+ 및 기타 이온의 존재에 의존하는 해리 상수(Kd)에 영향을 미치는 지표 형태를 포함한 다양한 요인을 고려하고, 뿐만 아니라 단백질 결합. 세포성 Ca2+ 신호가 일반적으로 일시적이기 때문에,Ca2+ 결합 속도 상수도 고려되어야 한다. 췌장 세포에서 [Ca2+]IC 역학을 측정하기 위해,이 그룹은 주로 세포 자기 형광이 일반적으로 덜 문제가되는 스펙트럼의 방출 파장을 가진 장파장 지표이기 때문에이 프로토콜 (표 of Materials)에 설명 된 세포 투과성 Ca2 + 지시 염료를 사용하며 여기 빛의 에너지가 낮기 때문에 세포 광손상의 가능성을 줄입니다. 이 염료는 낮은 Ca2+ 농도에서 형광이기 때문에, 이것은 기준선 [Ca2+]IC의 결정을 용이하게 하고 자극 전에 세포 가시성을 증가시킨다. Ca2+에 결합한 후, 염료의 형광 강도는 14배 증가하여, [Ca2+]IC의 약간의 변화도 검출할 수 있게 한다.
성공적인 라이브 셀 칼슘 이미징을 위해서는 프로토콜 섹션에 설명된 대로 몇 가지 중요한 하드웨어 파라미터를 고려해야 합니다. 신호 진폭이 낮고 광독성의 가능성이 높은 라이브 셀 이미징의 경우, 더 높은 NA를 갖는 목표물이 시편으로부터 더 많은 광을 수집하기 위해 바람직하게 사용된다. 칼슘 역학을 높은 시간 해상도로 기록해야 하는 경우 선형 갈바노미터 대신 공진 스캐너를 사용하십시오. 올바른 목표를 선택하는 것 외에도 레이저 전력이 덜 필요한 하이브리드 검출기와 같은 매우 민감한 검출기를 사용하면 광독성과 광표백을 피할 수 있습니다. 이것은 오래 지속되는 칼슘 이미징에 특히 중요합니다. 칼슘 이미징의 다른 중요한 단계는 시계열 수집을 위한 이미지 품질의 파라미터 설정입니다. 가장 중요한 것은 시간적 및 공간적 해상도입니다. 칼슘 역학 자체가 허용 가능한 가장 낮은 시간 분해능을 결정하기 때문에 샘플링 속도는 신호를 감지하기 위해 예상 신호 주파수보다 적어도 두 배 높거나 신호의 모양을 안정적으로 감지하려면 10 배 더 높아야합니다. 급성 췌장 조직 조각에서 칼슘 역학은 수백 개의 세포에서 동시에 측정 될 수 있으므로 공간 분해능 또한 중요합니다. 이는 픽셀 수를 늘리거나 라이브 획득 중에 평균 회선을 늘려 향상시킬 수 있습니다. 그러나 공간적 해상도와 시간 해상도 간의 역관계로 인해 두 설정 간의 트레이드오프가 필요합니다.
칼슘 이미징이 췌장 내의 특정 세포 집단에서 수행되어야하는 경우, 슬라이스 내에서 세포를 기능적으로 분화시킬 수있는 자극이 필요합니다. 높은 포도당은 베타 세포를 상승된 칼슘 수준에 겹쳐진 진동 패턴으로 안정적이고 신속하게 활성화시키고 췌도 32,58,70 내의 모든 세포들 사이에서 고도로 동기화된다. 베타 세포는 췌도 내에서 가장 많은 세포 유형이며 주로 마우스의 췌도 코어에 위치합니다. 동일한 자극 프로토콜이 감소하고 때로는 알파 세포 30,32,58,70,71,72에서 파열이 현저하게 변화하지 않는다. 알파 세포를 기능적으로 구별하기 위해, 낮은 (3 mM) 글루코스, 글루타메이트 또는 아드레날린을 사용하여 빈도 또는 기저 [Ca2+]IC 21,72,73,74,75를 증가시킬 수 있습니다. 그들은 췌도 세포의 10-20 %를 나타내며 췌도 주변부1에서 검출됩니다. 델타 세포는 주변에서도 발견됩니다. 그들은 췌도에서 내분비 세포의 총 수의 ~ 5 %만을 구성하며 일반적으로 6 mM 포도당에서 활동적이며 기준선에서 증가 된 불규칙한 파열 활성 또는 약간 상승 된 칼슘 수준 1,32,71,76으로 포도당 자극에 반응합니다. 그렐린은 칼슘 이미징 실험에서 델타 세포 21,77,78,79의 특이적 자극에 사용될 수 있다. 그러나, PP 및 엡실론 세포의 특정 기능적 확인을 위한 프로토콜은 여전히 정의되어야 한다. 또한, 25 nM 아세틸콜린은 아시나 세포를 파열 활성35,80,81로 안정적으로 활성화시킨다. 또한, 세룰린, 콜레시스토키닌 및 카르바밀콜린과 같은 다수의 다른 분비 촉진제는 아시나 세포22,40,82,83에서 칼슘 반응을 일으키기 위해 사용될 수 있다.
마지막으로, 1 mM 케노데옥시콜산은 조직 절편에서 덕트 세포에서 칼슘 반응을 확실하게 불러일으킨다; 안지오텐신 II, ATP 및 일부 다른 분비촉진제 또한 11,23,84,85를 사용할 수 있다. 특정 분비촉진제 및 억제제에 대한 특징적인 반응에 기초한 기능적 확인이 충분하지 않을 때마다, 유전적으로 표지된 동물(31), 형질감염된 세포(73), 또는 면역세포화학이 상이한 세포 유형(9,22,71,86)의 확인을 위해 이용될 수 있다. . 지난 몇 년 동안, 조직 슬라이스 방법은 인간 조직에 성공적으로 적응하여 외 분비41 및 내분비 생리학 9,36,37,39 모두에서 많은 새로운 중요한 연구 길을 열었습니다. 흥미롭게도, 인간 섬에서 칼슘 역학에 대한 상세한 평가는 악명 높게도 어려웠으며 더 자세히 조사되어야 할 것으로 남아 있습니다87. 고급 공초점 현미경 검사와 결합 된 췌장 조직 슬라이스 방법은 마우스의 칼슘 역학에 대한 많은 새로운 통찰력을 가능하게했으며 인간 조직에 대해서도 동일한 작업을 수행 할 수 있기를 바랍니다.
공개
저자들은 상업적 또는 재정적 이익이없는 상태에서 연구가 수행되었다고 선언합니다.
감사의 말
이 연구에서 발표 된 연구는 슬로베니아 연구 기관 (연구 핵심 자금 조달 번호)에 의해 재정적으로 지원되었습니다. P3-0396 및 I0-0029 및 연구 프로젝트 번호. J3-9289, N3-0048 및 N3-0133) 및 오스트리아 과학 기금 / Fonds zur Förderung der Wissenschaftlichen Forschung (양자 보조금 I3562--B27 및 I4319--B30). 우수한 기술 지원을 위해 Maruša Rošer, Maša Čater 및 Rudi Mlakar에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Analytical balance KERN ALJ 120-4 | KERN & SOHN GmbH | ALJ 160-4A | |
| Confocal microscope Leica TCS SP5 II Upright setup | Leica | 5100001578 | |
| Confocal microscope Leica TCS SP5 AOBS Tandem II setup | Leica | ||
| Cork pad 15 cm x 15 cm | |||
| Corning 15 mL centrifuge tubes | Merck KGaA, Darmstadt, Germany | CLS430790 | |
| Corning Round Ice Bucket with Lid, 4 L | Fischer Scientific, Leicestershire, UK | 432124 | |
| Double edge razor blade | Personna, USA | ||
| Dumont #5 - Fine Forceps | FST, Germany | 11254-20 | |
| Eppendorf Safe-Lock Tubes 0.5 mL | Eppendorf | 0030 121.023 | |
| Erlenmeyer flask 200 mL | IsoLab, Germany | 027.01.100 | |
| Fine Scissors - ToughCut | FST, Germany | 14058-11 | |
| Flat orbital shaker IKA KS 260 basic | IKA | Ident. No.: 0002980200 | |
| Glass lab bottle 1000 mL | IsoLab, Germany | 091.01.901 | |
| Hartman Hemostat, curved | FST, Germany | 13003-10 | |
| HCX APO L 20x/1.00 W HCX APO L (water immersion objective, 20x, NA 1.0) | Leica | 15507701 | |
| Measuring cylinder 25 mL | IsoLab, Germany | 015.01.025 | |
| Micromanipulator Control box SM-7, Keypad SM-7 | Luigs & Neumann | 200-100 900 7311, 200-100 900 9050 | |
| Microwave owen | Gorenje, Slovenia | MO20MW | |
| Osmometer Gonotec 010 | Gonotec, Berlin, Germany | OSMOMAT 010 Nr. 01-02-20 | |
| Paint brush | Faber-Castell, No.2 | Any thin soft round paint brush No.2, preferably black | |
| Paper towels | |||
| Perifusion pumps | Ismatec | ISM 827 | Reglo Analog MS - 4/8 |
| Petri dish 100/20 mm | Sarstedt | 83.3902 | |
| Petri dish 35/10 mm | Greiner bio-one | 627102 | |
| Petri dish 35 x 10 mm Nunclon Delta | Thermo Fischer Scientific, Waltham, MA USA | 153066 | NON-STICKY for agarose blocks |
| pH meter inoLab pH Level 1 | WTW, Weilheim, Germany | E163694 | |
| Pipette 1000 mL | Eppendorf | 3121 000.120 | |
| Pipette 50 mL | Eppendorf | 3121 000.066 | |
| Push pins 23 mm | Deli, Ningbo, China | E0021 | |
| Screw cap tube, 15 mL | Sarstedt | 62.554.502 | |
| Semken Forceps | FST, Germany | 11008-13 | |
| Stabilizing ring for Erlenmeyer flask | IsoLab, Germany | 027.11.048 | |
| Stereomicroscope Nikon SMZ 745 | Nikon, Melville, NY USA | ||
| Syringe Injekt Solo 5 mL | Braun, Melsungen, Germany | 4606051V | |
| Syringe needle 0.30 x 12 mm (30 G x 1/2") | Braun, Melsungen, Germany | 4656300 | |
| Temperature controller | Luigs & Neumann | 200-100 500 0150, 200-150-500-145 | Slice mini chamber, Temperature controller TC 07 |
| Tubings for perifusion system | Ismatec | SC0310 | Ismatec Pharmed 1.14 mm(ID) + silicone tubing 1.0 (ID) x 1.8 mm(OD) |
| Ultrasonic bath Studio GT-7810A | Globaltronics | ||
| Vibrotome Leica VT 1000 S | Leica, Nussloch, Germany | 14047235613 | |
| Volumetric flask 1000 mL | IsoLab, Germany | 013.01.910 | |
| Vortex mixer Neolab 7-2020 | Neolab | 7-2020 | |
| Water bath Thermo Haake open-bath circulator | Thermo Fisher Scientific | Z527912 | |
| Material/Reagent | |||
| Calcium chloride dihydrate - CaCl2.2H2O | Sigma Aldrich, Germany | C5080-500G | |
| D-(+)-glucose | Sigma Aldrich, Germany | G8270-1KG | |
| Dimethyl sulfoxide | Sigma Aldrich | D4540-100ML | |
| DL-lactic acid | Sigma Aldrich, Germany | L1250-500ML | |
| Dulbecco’s Phosphate Buffered Saline | Merck KGaA, Darmstadt, Germany | D8662-500ML | |
| Gas mixture containing 95% O2 and 5% CO2 at barometric pressure | |||
| Glue Wekem sekundenkleber WK-110 | Wekem GmbH, Bergkamen, Germany | WK 110-020 | |
| HEPES | Sigma Aldrich, Germany | H3375-250G | |
| L-(+)-ascorbic acid | Sigma Aldrich, Germany | A9,290-2 | |
| LIVE/DEAD Viability/Cytotoxicity Kit, for mammalian cells | Thermo Fischer Scientific, Waltham, MA USA | L3224 | |
| Magnesium chloride hexahydrate - MgCl2.2H2O | Sigma Aldrich, Germany | M2670-500G | |
| Myo-inositol | Sigma Aldrich, Germany | I5125-100G | |
| Oregon Green 488 BAPTA-1, AM | Invitrogen (Thermo FisherScientific) | O6807 | cell-permeable Ca2+ indicator (excitation/emission: 495/523 nm) |
| Pluronic F-127 (20% Solution in DMSO) | Invitrogen (Thermo Fisher Scientific) | P3000MP | polaxamer: nonionic triblock copolymer |
| Potassium chloride - KCl | Sigma Aldrich, Germany | 31248 | |
| SeaPlaque GTG agarose | Lonza, Rockland, USA | 50111 | |
| Sodium bicarbonate - NaHCO3 | Honeywell, Germany | 31437-500G | |
| Sodium chloride - NaCl | Honeywell, Germany | 31434-1KG | |
| Sodium hydroxide - NaOH | Sigma Aldrich, Germany | 30620 | |
| Sodium phosphate monobasic- NaH2PO4 | Sigma Aldrich, Germany | S0751-500G | |
| Sodium pyruvate | Sigma Aldrich, Germany | 15990-100G | |
| Software | |||
| FIJI | FIJI is an open source project | ||
| LASAF | Leica microsystems, Inc. | ||
| Matlab | Mathworks | ||
| Python | Python Software Foundation | Python is an open source project |
참고문헌
- Dolensek, J., Rupnik, M. S., Stozer, A. Structural similarities and differences between the human and the mouse pancreas. Islets. 7 (1), e1024405(2015).
- Meneghel-Rozzo, T., Rozzo, A., Poppi, L., Rupnik, M. In vivo and in vitro development of mouse pancreatic ß-cells in organotypic slices. Cell and Tissue Research. 316 (3), 295-303 (2004).
- Rozzo, A., Meneghel-Rozzo, T., Delakorda, S. L., Yang, S. B., Rupnik, M. Exocytosis of insulin: in vivo maturation of mouse endocrine pancreas. Annals of the New York Academy of the Sciences. 1152, 53-62 (2009).
- Dolenšek, J., Pohorec, V., Rupnik, M. S., Stožer, A. Pancreas physiology, challenges in pancreatic pathology. IntechOpen. Seicean, A. , (2017).
- Williams, J. A. The nobel pancreas: a historical perspective. Gastroenterology. 144 (6), 1166-1169 (2013).
- Lacy, P. E., Kostianovsky, M. Method for the isolation of intact islets of Langerhans from the rat pancreas. Diabetes. 16 (1), 35-39 (1967).
- Williams, J. A., Korc, M., Dormer, R. L. Action of secretagogues on a new preparation of functionally intact, isolated pancreatic acini. American Journal of Physiology. 235 (5), 517-524 (1978).
- Peikin, S. R., Rottman, A. J., Batzri, S., Gardner, J. D. Kinetics of amylase release by dispersed acini prepared from guinea pig pancreas. American Journal of Physiology. 235 (6), E743-E749 (1978).
- Marciniak, A., et al. Using pancreas tissue slices for in situ studies of islet of Langerhans and acinar cell biology. Nature Protocols. 9 (12), 2809-2822 (2014).
- Skelin, M., Rupnik, M., Cencic, A. Pancreatic beta cell lines and their applications in diabetes mellitus research. Altex-Alternatives to Animal Experimentation. 27 (2), 105-113 (2010).
- Molnar, R., et al. Mouse pancreatic ductal organoid culture as a relevant model to study exocrine pancreatic ion secretion. Laboratory Investigation. 100 (1), 84-97 (2020).
- Rupnik, M. The physiology of rodent beta-cells in pancreas slices. Acta Physiologica (Oxford, England). 195 (1), 123-138 (2009).
- Blinman, T. A., et al. Activation of pancreatic acinar cells on isolation from tissue: cytokine upregulation via p38 MAP kinase. American Journal of Physiology. Cell Physiology. 279 (6), C1993-C2003 (2000).
- Speier, S., Rupnik, M. A novel approach to in situ characterization of pancreatic ß-cells. Pflügers Archive: European Journal of Physiology. 446 (5), 553-558 (2003).
- Gilon, P., Jonas, J., Henquin, J. Culture duration and conditions affect the oscillations of cytoplasmic calcium concentration induced by glucose in mouse pancreatic islets. Diabetologia. 37 (10), 1007-1014 (1994).
- Huang, C., Gu, G. Effective isolation of functional islets from neonatal mouse pancreas. Journal of Visualized Experiments: JoVE. (119), e55160(2017).
- Szot, G. L., Koudria, P., Bluestone, J. A. Murine pancreatic islet isolation. Journal of Visualized Experiments: JoVE. (7), e255(2007).
- Qi, M., et al. Human pancreatic islet isolation: Part I: digestion and collection of pancreatic tissue. Journal of Visualized Experiments: JoVE. (27), e1125(2009).
- Qi, M., et al. Human pancreatic islet isolation: Part II: purification and culture of human islets. Journal of Visualized Experiments: JoVE. (27), e1343(2009).
- Stull, N. D., Breite, A., McCarthy, R., Tersey, S. A., Mirmira, R. G. Mouse islet of Langerhans isolation using a combination of purified collagenase and neutral protease. Journal of Visualized Experiments: JoVE. (67), e4137(2012).
- Hamilton, A., Vergari, E., Miranda, C., Tarasov, A. I. Imaging calcium dynamics in subpopulations of mouse pancreatic islet cells. Journal of Visualized Experiments: JoVE. (153), (2019).
- Marciniak, A., Selck, C., Friedrich, B., Speier, S. Mouse pancreas tissue slice culture facilitates long-term studies of exocrine and endocrine cell physiology in situ. PLoS ONE. 8 (11), e78706(2013).
- Gal, E., et al. A Novel in situ approach to studying pancreatic ducts in mice. Frontiers in Physiology. 10, 938(2019).
- Speier, S., Yang, S. B., Sroka, K., Rose, T., Rupnik, M. KATP-channels in beta-cells in tissue slices are directly modulated by millimolar ATP. Molecular and Cellular Endocrinology. 230 (1-2), 51-58 (2005).
- Speier, S., Gjinovci, A., Charollais, A., Meda, P., Rupnik, M. Cx36-mediated coupling reduces β-cell heterogeneity, confines the stimulating glucose concentration range, and affects insulin release kinetics. Diabetes. 56 (4), 1078-1086 (2007).
- Rose, T., Efendic, S., Rupnik, M. Ca2+-secretion coupling is impaired in diabetic Goto Kakizaki rats. The Journal of General Physiology. 129 (6), 493-508 (2007).
- Paulmann, N., et al. Intracellular serotonin modulates insulin secretion from pancreatic β-cells by protein serotonylation. PLoS Biology. 7 (10), e1000229(2009).
- Mandic, S. A., et al. Munc18-1 and Munc18-2 proteins modulate β-cell Ca2+ sensitivity and kinetics of insulin exocytosis differently. Journal of Biological Chemistry. 286 (32), 28026-28040 (2011).
- Dolensek, J., Skelin, M., Rupnik, M. S. Calcium dependencies of regulated exocytosis in different endocrine cells. Physiological Research. 60, S29-S38 (2011).
- Huang, Y. C., Rupnik, M., Gaisano, H. Y. Unperturbed islet α-cell function examined in mouse pancreas tissue slices. Journal of Physiology. 589 (2), 395-408 (2011).
- Huang, Y. C., et al. In situ electrophysiological examination of pancreatic α cells in the streptozotocin-induced diabetes model, revealing the cellular basis of glucagon hypersecretion. Diabetes. 62 (2), 519-530 (2013).
- Stožer, A., Dolenšek, J., Rupnik, M. S. Glucose-stimulated calcium dynamics in islets of Langerhans in acute mouse pancreas tissue slices. PLoS ONE. 8 (1), e54638(2013).
- Stožer, A., et al. Functional connectivity in islets of Langerhans from mouse pancreas tissue slices. PLoS Computational Biology. 9 (2), e1002923(2013).
- Dolenšek, J., Stožer, A., Skelin Klemen, M., Miller, E. W., Slak Rupnik, M. The relationship between membrane potential and calcium dynamics in glucose-stimulated beta cell syncytium in acute mouse pancreas tissue slices. PLoS ONE. 8 (12), e82374(2013).
- Perc, M., Rupnik, M., Gosak, M., Marhl, M. Prevalence of stochasticity in experimentally observed responses of pancreatic acinar cells to acetylcholine. Chaos. 19 (3), 037113(2009).
- Qadir, M. M. F., et al. Long-term culture of human pancreatic slices as a model to study real-time islet regeneration. Nature Communications. 11 (1), 3265-3265 (2020).
- Panzer, J. K., et al. Pancreas tissue slices from organ donors enable in situ analysis of type 1 diabetes pathogenesis. JCI Insight. 5 (8), e134525(2020).
- Cohrs, C. M., et al. Vessel network architecture of adult human islets promotes distinct cell-cell interactions in situ and is altered after transplantation. Endocrinology. 158 (5), 1373-1385 (2017).
- Cohrs, C. M., et al. Dysfunction of persisting beta cells is a key feature of early type 2 diabetes pathogenesis. Cell Reports. 31 (1), 107469(2020).
- Dolai, S., et al. Pancreatitis-induced depletion of syntaxin 2 promotes autophagy and increases basolateral exocytosis. Gastroenterology. 154 (6), 1805-1821 (2018).
- Liang, T., et al. Ex vivo human pancreatic slice preparations offer a valuable model for studying pancreatic exocrine biology. Journal of Biological Chemistry. 292 (14), 5957-5969 (2017).
- Panzer, J. K., Cohrs, C. M., Speier, S. Using pancreas tissue slices for the study of islet physiology. Methods in Molecular Biology. 2128, 301-312 (2020).
- Klemen, M., Dolenšek, J., Stožer, A., Rupnik, M. Exocytosis Methods. Thorn, P. 7, Humana Press. 127-146 (2014).
- Speier, S. Experimental approaches for high-resolution in vivo imaging of islet of Langerhans biology. Current Diabetes Reports. 11 (5), 420-425 (2011).
- Leibiger, I. B., Berggren, P. O. Intraocular in vivo imaging of pancreatic islet cell physiology/pathology. Molecular Metabolism. 6 (9), 1002-1009 (2017).
- Reissaus, C. A., et al. A Versatile, portable intravital microscopy platform for studying beta-cell biology in vivo. Scientific Reports. 9 (1), 8449(2019).
- Jacob, S., et al. In vivo Ca(2+) dynamics in single pancreatic beta cells. FASEB Journal. 34 (1), 945-959 (2020).
- Fernandez, J., Valdeolmillos, M. Synchronous glucose-dependent [Ca2+]i oscillations in mouse pancreatic islets of Langerhans recorded in vivo. FEBS Letters. 477 (1-2), 33-36 (2000).
- Almaca, J., Weitz, J., Rodriguez-Diaz, R., Pereira, E., Caicedo, A. The pericyte of the pancreatic islet regulates capillary diameter and local blood flow. Cell Metabolism. 27 (3), 630-644 (2018).
- Weitz, J. R., et al. Mouse pancreatic islet macrophages use locally released ATP to monitor beta cell activity. Diabetologia. 61 (1), 182-192 (2018).
- Tian, G., Sandler, S., Gylfe, E., Tengholm, A. Glucose- and hormone-induced cAMP oscillations in α- and β-cells within intact pancreatic islets. Diabetes. 60 (5), 1535-1543 (2011).
- Benninger, R. K., Zhang, M., Head, W. S., Satin, L. S., Piston, D. W. Gap junction coupling and calcium waves in the pancreatic islet. Biophysical Journal. 95 (11), 5048-5061 (2008).
- Santos, R. M., et al. Widespread synchronous Ca oscillations due to bursting electrical activity in single pancreatic islets. Pflügers Archive: European Journal of Physiology. 418 (4), 417-422 (1991).
- terk, M., et al. Assessing the origin and velocity of Ca2+ waves in three-dimensional tissue: Insights from a mathematical model and confocal imaging in mouse pancreas tissue slices. Communications in Nonlinear Science and Numerical Simulation. 93, 105495(2021).
- Gosak, M., et al. Critical and supercritical spatiotemporal calcium dynamics in beta cells. Frontiers in Physiology. 8, 1106(2017).
- Satin, L. S., Butler, P. C., Ha, J., Sherman, A. S. Pulsatile insulin secretion, impaired glucose tolerance and type 2 diabetes. Molecular Aspects in Medicine. 42, 61-77 (2015).
- Tengholm, A., Gylfe, E. Oscillatory control of insulin secretion. Molecular and Cellular Endocrinology. 297 (1-2), 58-72 (2009).
- Quesada, I., et al. Glucose induces opposite intracellular Ca2+ concentration oscillatory patterns in identified α- and β-cells within intact human islets of Langerhans. Diabetes. 55 (9), 2463-2469 (2006).
- Ferguson, J., Allsopp, R. H., Taylor, R. M., Johnston, I. D. Isolation and long term preservation of pancreatic islets from mouse, rat and guinea pig. Diabetologia. 12 (2), 115-121 (1976).
- Andersson, A. Isolated mouse pancreatic islets in culture: effects of serum and different culture media on the insulin production of the islets. Diabetologia. 14 (6), 397-404 (1978).
- Ramirez-Dominguez, M. Isolation of mouse pancreatic islets of Langerhans. Advances in Experimental Medicine and Biology. 938, 25-34 (2016).
- Carter, J., Dula, S., Corbin, K., Wu, R., Nunemaker, C. A practical guide to rodent islet isolation and assessment. Biological Procedures Online. 11 (1), 3-31 (2009).
- Daoud, J., Rosenberg, L., Tabrizian, M. Pancreatic islet culture and preservation strategies: advances, challenges, and future outlook. Cell Transplantation. 19 (12), 1523-1535 (2010).
- Zawalich, W. S., Yamazaki, H., Zawalich, K. C. Biphasic insulin secretion from freshly isolated or cultured, perifused rodent islets: comparative studies with rats and mice. Metabolism. 57 (1), 30-39 (2008).
- Roe, M. W., et al. Absence of effect of culture duration on glucose-activated alterations in intracellular calcium concentration in mouse pancreatic islets. Diabetologia. 38, 876-877 (1995).
- Shuai, H., Xu, Y., Yu, Q., Gylfe, E., Tengholm, A. Fluorescent protein vectors for pancreatic islet cell identification in live-cell imaging. Pflügers Archive. European Journal of Physiology. 468 (10), 1765-1777 (2016).
- Dolenšek, J., et al. Glucose-dependent activation, activity, and deactivation of beta cell networks in acute mouse pancreas tissue slices. bioRxiv. , (2020).
- QZhang, Q., et al. Cell coupling in mouse pancreatic beta-cells measured in intact islets of Langerhans. Philosophical Transactions. Series A, Mathematical, Physical, and Engineering Sciences. 366 (1880), 3503-3523 (2008).
- Sánchez-Cárdenas, C., Hernández-Cruz, A. GnRH-induced Ca2+-signalling patterns in mouse gonadotrophs recorded from acute pituitary slices in vitro. Neuroendocrinology. 91 (3), 239-255 (2010).
- Asada, N., Shibuya, I., Iwanaga, T., Niwa, K., Kanno, T. Identification of alpha- and beta-cells in intact isolated islets of Langerhans by their characteristic cytoplasmic Ca2+ concentration dynamics and immunocytochemical staining. Diabetes. 47 (5), 751-757 (1998).
- Nadal, A., Quesada, I., Soria, B. Homologous and heterologous asynchronicity between identified α-, β- and δ-cells within intact islets of Langerhans in the mouse. Journal of Physiology. 517 (1), 85-93 (1999).
- Shuai, H., Xu, Y., Yu, Q., Gylfe, E., Tengholm, A. Fluorescent protein vectors for pancreatic islet cell identification in live-cell imaging. Pflugers Archive: European Journal of Physiology. 468 (10), 1765-1777 (2016).
- Cabrera, O., et al. Glutamate is a positive autocrine signal for glucagon release. Cell Metabolism. 7 (6), 545-554 (2008).
- Li, J., et al. Submembrane ATP and Ca2+ kinetics in α-cells: unexpected signaling for glucagon secretion. FASEB Journal. 29 (8), 3379-3388 (2015).
- Hamilton, A., et al. Adrenaline stimulates glucagon secretion by Tpc2-dependent Ca(2+) mobilization from acidic stores in pancreatic α-cells. Diabetes. 67 (6), 1128-1139 (2018).
- Arrojo, E. D. R., et al. Structural basis for delta cell paracrine regulation in pancreatic islets. Nature Communications. 10 (1), (2019).
- DiGruccio, M. R., et al. Comprehensive alpha, beta and delta cell transcriptomes reveal that ghrelin selectively activates delta cells and promotes somatostatin release from pancreatic islets. Molecular Metabolism. 5 (7), 449-458 (2016).
- Adriaenssens, A. E., et al. Transcriptomic profiling of pancreatic alpha, beta and delta cell populations identifies delta cells as a principal target for ghrelin in mouse islets. Diabetologia. 59 (10), 2156-2165 (2016).
- Rorsman, P., Huising, M. O. The somatostatin-secreting pancreatic δ-cell in health and disease. Nature reviews. Endocrinology. 14 (7), 404-414 (2018).
- Petersen, C. C., Toescu, E. C., Petersen, O. H. Different patterns of receptor-activated cytoplasmic Ca2+ oscillations in single pancreatic acinar cells: dependence on receptor type, agonist concentration and intracellular Ca2+ buffering. The EMBO journal. 10 (3), 527-533 (1991).
- Thorn, P., Lawrie, A. M., Smith, P. M., Gallacher, D. V., Petersen, O. H. Local and global cytosolic Ca2+ oscillations in exocrine cells evoked by agonists and inositol trisphosphate. Cell. 74 (4), 661-668 (1993).
- Behrendorff, N., Floetenmeyer, M., Schwiening, C., Thorn, P. Protons released during pancreatic acinar cell secretion acidify the lumen and contribute to pancreatitis in mice. Gastroenterology. 139 (5), e1711-e1715 (2010).
- Criddle, D. N., et al. Cholecystokinin-58 and cholecystokinin-8 exhibit similar actions on calcium signaling, zymogen secretion, and cell fate in murine pancreatic acinar cells. American Journal of Physiology. Gastrointestinal and Liver Physiology. 297 (6), G1085-G1092 (2009).
- Venglovecz, V., et al. Effects of bile acids on pancreatic ductal bicarbonate secretion in guinea pig. Gut. 57 (8), 1468-3288 (2008).
- Maleth, J., Hegyi, P. Calcium signaling in pancreatic ductal epithelial cells: an old friend and a nasty enemy. Cell Calcium. 55 (6), 337-345 (2014).
- Nadal, A., Quesada, I., Soria, B. Homologous and heterologous asynchronicity between identified alpha-, beta- and delta-cells within intact islets of Langerhans in the mouse. Journal of Physiology. 517 (Pt 1), 85-93 (1999).
- Skelin Klemen, M., Dolenšek, J., Slak Rupnik, M., Stožer, A. The triggering pathway to insulin secretion: Functional similarities and differences between the human and the mouse β cells and their translational relevance. Islets. 9 (6), 109-139 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유