Method Article
Konfokale Laser-Scanning-Mikroskopie der Calciumdynamik in akuten Pankreasgewebeschnitten der Maus
In diesem Artikel
Zusammenfassung
Wir präsentieren die Herstellung von akuten Pankreasgewebeschnitten und deren Verwendung in der konfokalen Laser-Scanning-Mikroskopie, um die Calciumdynamik gleichzeitig in einer großen Anzahl lebender Zellen, über lange Zeiträume und mit hoher raumzeitlicher Auflösung zu untersuchen.
Zusammenfassung
Der akute Pankreasgewebeschnitt der Maus ist ein einzigartiges In-situ-Präparat mit erhaltener interzellulärer Kommunikation und Gewebearchitektur, das deutlich weniger präparationsinduzierte Veränderungen mit sich bringt als isolierte Inseln, Acini, Kanäle oder dispergierte Zellen, die in typischen In-vitro-Studien beschrieben werden. Durch die Kombination des akuten Pankreasgewebeschnitts mit der Lebendzell-Kalziumbildgebung in der konfokalen Laser-Scanning-Mikroskopie (CLSM) können Calciumsignale in einer großen Anzahl von endokrinen und exokrinen Zellen gleichzeitig mit einer Einzelzell- oder sogar subzellulären Auflösung untersucht werden. Die Empfindlichkeit ermöglicht die Detektion von Veränderungen und ermöglicht die Untersuchung von interzellulären Wellen und funktioneller Konnektivität sowie die Untersuchung der Abhängigkeit physiologischer Reaktionen von Zellen von ihrer Lokalisation innerhalb der Insel- und parakrinen Beziehung zu anderen Zellen. Aus Sicht des Tierschutzes senkt die Aufzeichnung von Signalen von einer großen Anzahl von Zellen gleichzeitig die Anzahl der Tiere, die in Versuchen benötigt werden, und trägt zum 3R-Ersatz-, Reduktions- und Verfeinerungsprinzip bei.
Einleitung
Die Bauchspeicheldrüse von Säugetieren ist eine große exokrine und endokrine Drüse. Der exokrine Teil macht 96-99% des gesamten Pankreasvolumens aus und besteht aus Acini und Kanälen. Der endokrine Teil besteht aus einer großen Anzahl von Langerhans-Inseln, die die restlichen 1-4% des gesamten Bauchspeicheldrüsenvolumensausmachen 1. Der exokrine Teil sondert wichtige Verdauungsenzyme ab, die energiereiche Polymere in Lebensmitteln abbauen, sowie eine bicarbonatreiche Flüssigkeit, die sich mit anderen gastrointestinalen Sekreten verbindet, um eine Umgebung zu schaffen, die für die Wirkung von Enzymen geeignet ist. Der endokrine Teil sondert Hormone ab, die die postprandiale Verteilung, Speicherung und interprandiale Freisetzung von energiereichen Nährstoffen regulieren. Obwohl das exokrine Gewebe bei der Geburt relativ unterentwickelt und das endokrine relativ gut entwickelt ist, überwuchert das erstere beim Absetzen schnell das letztere 2,3,4. Frühe Studien der Pankreasfunktion markierten die Geburt der modernen Physiologie, und auf große methodische Fortschritte auf diesem Gebiet folgten große wissenschaftliche Breaktroughs5. Die Arbeit mit der Bauchspeicheldrüse ist aufgrund der komplizierten Struktur der Drüse technisch anspruchsvoll, aber auch eine große Motivation aufgrund von Krankheiten wie Bauchspeicheldrüsenkrebs, Pankreatitis und Diabetes, die eine große Bedrohung für die öffentliche Gesundheit darstellen und für die neuartige therapeutische Ansätze erforderlich sind.
Isolierte Inseln6, Acini 7,8 und duktale Fragmente wurden aufgrund ihrer Vorteile gegenüber Zelllinien und primär dispergierten endokrinen, acinaren und duktalen Zellen jahrzehntelang als Goldstandardmethoden entwickelt und verwendet 9,10. Trotz der deutlich verbesserten Funktion isolierter Zellkollektive sind diese Methoden immer noch mit erheblichem mechanischem und enzymatischem Stress verbunden, isolieren Zellen aus dem umgebenden Gewebe und damit ohne parakrine Interaktionen und mechanische Unterstützung und gehen vor allem mit signifikanten Veränderungen der normalen Physiologie einher11,12,13 . Der akute Pankreasgewebeschnitt der Maus wurde 2001 aus der Notwendigkeit heraus entwickelt, eine experimentelle Plattform ähnlich wie Gehirn-, Hypophysen- und Nebennierenschnitte mit konservierten interzellulären Kontakten, parakrinen Interaktionen, Mesenchym und Gewebearchitektur zu entwickeln, sowie ohne einige der wichtigsten Mängel der Goldstandardmethode in der Inselforschung dieser Zeit - die isolierten Inseln12, 14. Zu diesen Mängeln gehören Schäden an den äußersten Schichten, mangelnde Zugänglichkeit der Kerninselbereiche und die Notwendigkeit einer Kultivierung mit möglicherweise wichtigen Auswirkungen auf die Zellidentität und Physiologie12,15. Darüber hinaus ermöglicht die Gewebeschnittmethode Studien an Tiermodellen mit stark gestörter Inselarchitektur, bei denen es unmöglich ist, Inseln zu isolieren, oder wenn die Inselausbeute durch traditionelle Isolierung extrem niedrig ist 16,17,18,19,20,21.
Darüber hinaus eignet sich die Scheibe besser für die Untersuchung morphologischer Veränderungen während der Entwicklung von Diabetes und Pankreatitis, da sie einen besseren Überblick über das gesamte Gewebe ermöglicht und auch mit der Untersuchung regionaler Unterschiede kompatibel ist. Wichtig ist, dass die Gewebeschnittmethode trotz des frühen Fokus auf den endokrinen Teil von Natur aus die Untersuchung der exokrinen Komponentenermöglicht 9,22,23. Im ersten Jahrzehnt nach ihrer Einführung wurde die Methode für elektrophysiologische Untersuchungen von Beta-14,24,25,26,27,28,29- und Alpha-30,31-Zellen sowie zur Untersuchung der morphologischen und funktionellen Reifung der Bauchspeicheldrüse eingesetzt 2,3 . Ein Jahrzehnt später, im Jahr2013, wurde die Methode erfolgreich für die Lebendzell-Kalziumbildgebung von Inselzellen unter Verwendung von CLSM angepasst, um ihre Reaktionen auf Glukose32, ihre funktionellen Konnektivitätsmuster 33 und die Beziehung zwischen Membranpotential und intrazellulärem Kalzium zu charakterisieren, indem ein fluoreszierender Kalziumfarbstoff mit einem Membranpotentialfarbstoff34 kombiniert wurde. Später im selben Jahr wurde die Methode auch zur Beurteilung der Kalziumdynamik in Acinarzellen 22,35 angewendet. In den folgenden Jahren wurden Pankreasgewebeschnitte in einer Reihe von verschiedenen Studien verwendet und erfolgreich an Schweine- und menschliches Gewebe angepasst 9,36,37,38,39,40,41. Zusammengenommen wird die Kalziumbildgebung - in Mäuse-Pankreasgewebeschnitten im Allgemeinen und in Inseln im Besonderen - jedoch immer noch hauptsächlich von dieser Gruppe durchgeführt. Einer der Hauptgründe dafür könnte in der Kombination aus einer technisch anspruchsvollen Gewebeschnittpräparation, der Notwendigkeit eines konfokalen Mikroskops und einer recht komplexen Datenanalyse liegen. Das Hauptziel des vorliegenden Papiers ist es, diese leistungsstarke Methode für andere potenzielle Benutzer zugänglicher zu machen.
Es gibt bereits einige ausgezeichnete methodische Artikel, die sich ausführlich mit der Vorbereitung von Gewebeschnitten und der Verwendung von Scheiben für Struktur- und Sekretionsstudien befassen, jedoch nicht für die konfokale Kalziumbildgebung 9,42,43. Daher konzentriert sich dieses Papier auf einige zusätzliche Tipps und Tricks bei der Herstellung von Scheiben, auf Schritte, die für eine erfolgreiche Farbstoffladung, Bildaufnahme sowie auf die Hauptschritte der grundlegenden Kalziumdatenanalyse entscheidend sind. Daher sollte dieser Beitrag als Ergänzung und nicht als Alternative zu der oben genannten Methode betrachtet werden. In ähnlicher Weise ist die Kalziumbildgebung in Gewebeschnitten der Maus als experimenteller Ansatz zur Beantwortung spezifischer Fragen zu betrachten und ist daher eher komplementär als eine absolute Alternative zu anderen Calcium-Bildgebungsansätzen in der Pankreasphysiologie wie isolierte Kanäle oder Acini, isolierte Inseln, Organoide, in die Vorderkammer des Auges transplantierte Inseln, und Aufnahmen in vivo 11,44,45,46,47,48. Das Versprechen der Kalziumbildgebung in Pankreasgewebeschnitten der Maus wird wahrscheinlich am besten durch jüngste erfolgreiche Aufzeichnungen der Kalziumdynamik in mesenchymalen Inselzellen wie Perizyten49 undMakrophagen 50 sowie in duktalen Zellen23 veranschaulicht.
Protokoll
HINWEIS: Alle Experimente wurden in strikter Übereinstimmung mit den institutionellen Richtlinien für die Pflege und Verwendung von Tieren in der Forschung durchgeführt. Das Protokoll wurde von der Verwaltung der Republik Slowenien für Lebensmittelsicherheit, Veterinärwesen und Pflanzenschutz genehmigt (Zulassungsnummer: 34401-35-2018/2).
1. Herstellung von Pankreasgewebeschnitten
HINWEIS: Die Herstellung von akuten Gewebeschnitten der Maus für die Kalziumbildgebung mit CLSM erfordert eine Reihe von Instrumenten, verschiedene Lösungen und verläuft in einer Reihe kritischer Schritte, die in Abbildung 1 schematisch dargestellt und im Folgenden ausführlich beschrieben werden.
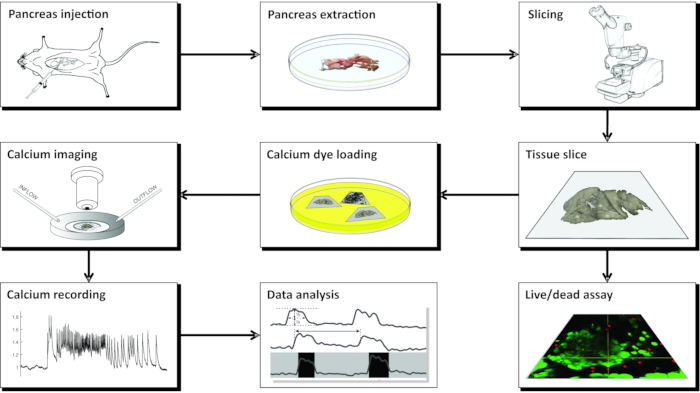
Abbildung 1: Workflowdiagramm Schematische Darstellung aller Schritte im Prozess der Vorbereitung der Pankreasgewebeschnitte, beginnend mit der Injektion von Agarose in den gemeinsamen Gallengang, gefolgt von der Extraktion der Bauchspeicheldrüse und dem Schneiden. Die vorbereiteten Scheiben können zur Beurteilung der Lebensfähigkeit des Gewebes mit einem Live/Dead-Kit verwendet oder mit einem Kalziumsensor angefärbt werden. Nach der Färbung sind sie bereit für die Bildgebung. Aufnahmen aus dem bildgebenden Verfahren werden dann für die Datenanalyse verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Vorbereitung von Lösungen
HINWEIS: Alle Lösungen sollten im Voraus vorbereitet werden und können bis zu einem Monat bei 4-8 °C im Kühlschrank aufbewahrt werden. Für die Herstellung und Lagerung von Gewebeschnitten werden ca. 0,5 l extrazelluläre Lösung (ECS) mit 6 mM Glucose und 0,3 L 4-(2-hydroxyethyl)-1-piperazinethansulfonsäure (HEPES) Puffer benötigt. Für 1 Tag Calcium-Bildgebung mit dem Perifusionssystem mit einer Durchflussrate von 1-2 ml/min werden ca. 0,5 l ECS benötigt.- Extrazelluläre Lösung mit 6 mM Glucose
- Es werden 1 l ECS mit 125 mM NaCl, 26 mMNaHCO 3, 6 mM Glucose, 6 mM Milchsäure, 3 mM Myo-Inositol, 2,5 mM KCl, 2 mM Na pyruvat, 2 mM CaCl 2, 1,25 mM NaH2 PO4, 1 mM MgCl2 und 0,5mM Ascorbinsäure hergestellt. Gründlich mischen, bis sich alle Zutaten vollständig aufgelöst haben. Nehmen Sie 50 μL ECS in ein 0,5 ml Mikrozentrifugenröhrchen, legen Sie es gemäß den Anweisungen des Herstellers auf das Osmometer und überprüfen Sie die Osmolarität.
HINWEIS: Die Osmolarität sollte 300-320 mOsm betragen. Zur Stimulation von Betazellen verwenden Sie Lösungen mit höheren Glukosekonzentrationen. Um einen physiologischen pH-Wert von 7,4 während des Schneidens und Experimentierens zu gewährleisten, blasen Sie das ECS ständig mit Carbogen (d. H. Ein Gasgemisch aus 95%O2 und 5% CO2) bei barometrischem Druck. Ein einfaches Sprudelnsystem kann eingerichtet werden, indem ein Ende eines 5-mm-Siliziumschlauchs an der Quelle des Carbogens (dh einer Druckgasflasche) befestigt wird und das andere Ende des Schlauches direkt in die Flasche mit ECS gelegt wird. - Alternativ können Sie eine 10-fache Brühe mit 1250 mM NaCl, 260 mM NaHCO3, 30 mM Myo-Inositol, 25 mM KCl, 20 mM Na Pyruvat, 12,5 mM NaH2PO4 und 5 mM Ascorbinsäure herstellen. Wenn das ECS mit 6 mM Glukose benötigt wird, mischen Sie 100 ml der Brühe mit 2 ml 1 M CaCl 2, 1 ml 1 M MgCl 2, 0,455 ml 13,2 M Milchsäure und 1,08 g Glukose und füllen Sie es mit doppelt destilliertem Wasser bis zu 1 L. Verwenden Sie bei Bedarf unterschiedliche Mengen an Glukose, um andere Glukosekonzentrationen zu erhalten.
- Es werden 1 l ECS mit 125 mM NaCl, 26 mMNaHCO 3, 6 mM Glucose, 6 mM Milchsäure, 3 mM Myo-Inositol, 2,5 mM KCl, 2 mM Na pyruvat, 2 mM CaCl 2, 1,25 mM NaH2 PO4, 1 mM MgCl2 und 0,5mM Ascorbinsäure hergestellt. Gründlich mischen, bis sich alle Zutaten vollständig aufgelöst haben. Nehmen Sie 50 μL ECS in ein 0,5 ml Mikrozentrifugenröhrchen, legen Sie es gemäß den Anweisungen des Herstellers auf das Osmometer und überprüfen Sie die Osmolarität.
- HEPES-Puffer mit 6 mM Glucose
- Es werden 0,5 l HEPES-gepufferte Lösung (HBS) hergestellt, die 150 mM NaCl, 10 mM HEPES, 6 mM Glukose, 5 mM KCl, 2 mM CaCl 2 und 1 mM MgCl2 enthält; Titration auf pH = 7,4 mit 1 M NaOH.
HINWEIS: Wenn carbogen nicht verfügbar ist, kann dieser Puffer für alle Schritte anstelle von ECS verwendet werden.
- Es werden 0,5 l HEPES-gepufferte Lösung (HBS) hergestellt, die 150 mM NaCl, 10 mM HEPES, 6 mM Glukose, 5 mM KCl, 2 mM CaCl 2 und 1 mM MgCl2 enthält; Titration auf pH = 7,4 mit 1 M NaOH.
- Agarose (1,9% w/w)
- Ein Wasserbad auf 40 °C vorwärmen.
- 0,475 g Agarose mit niedrigem Schmelzpunkt und 25 ml ECS mit 6 mM Glucose in einen Erlenmeyerkolben geben und den Kolben einige Sekunden lang mit maximaler Leistung in eine Mikrowelle stellen, bis er zu kochen beginnt. Nehmen Sie den Kolben aus dem Ofen und schwenken Sie ihn einige Male, bis sich die Agarose vollständig auflöst. Den Kolben mit der flüssigen Agarose bei 40 °C in das vorgewärmte Wasserbad geben, um die Agarose auf die gewünschte Temperatur abzukühlen und bis zur Injektion flüssig zu halten. Befestigen Sie den Kolben mit einem stabilisierenden Bleiring.
HINWEIS: Die Agarose kann im Voraus zubereitet und im Kühlschrank aufbewahrt werden. Vor Gebrauch die Agarose in der Mikrowelle erwärmen, bis sie sich verflüssigt, und den Erlenmeyerkolben in ein auf 40 °C vorgewärmtes Wasserbad geben. Die Agarose kann bis zu 5x wiederverwendet werden. Wenn es über das 5-fache hinaus wiederverwendet wird, wird es dicht und schwieriger zu injizieren.
- Extrazelluläre Lösung mit 6 mM Glucose
- Injektion der Bauchspeicheldrüse mit Agarose
HINWEIS: In den Abschnitten 1.2 und 1.3 wird die Herstellung von Gewebeschnitten erläutert, die für verschiedene experimentelle Zwecke wie Kalziumbildgebung, Elektrophysiologie, Immunhistochemie, Sekretionsstudien und strukturelle/mikroanatomische Studien verwendet werden können.- Füllen Sie eine 5-ml-Spritze mit der flüssigen Agarose aus dem Erlenmeyerkolben im Wasserbad aus Schritt 1.1.3.2, entfernen Sie alle Blasen und montieren Sie eine 30-G-Nadel. Schützen Sie die Nadel mit einer Kappe und halten Sie die gefüllte Spritze mit der Nadel nach unten und dem gesamten Agarosevolumen unter der Wasseroberfläche wieder im Wasserbad. Befestigen Sie die Spritze mit einem stabilisierenden Bleiring so, dass der Ring die Spritze gegen die Wand des Wasserbades drückt.
HINWEIS: Achten Sie darauf, keine Agarose in die Nadel zu drücken, da sie schnell aushärtet und die Nadel blockiert. Wenn die Raumtemperatur niedrig ist und die Injektion von einer weniger erfahrenen Person durchgeführt wird, erhöhen Sie die Temperatur des Wasserbades auf bis zu 42 ° C, um zusätzliche Zeit für die Injektion zu gewinnen. - Füllen Sie einen Eiseimer mit Eis und legen Sie die Flasche mit ECS hinein. Blasen Sie das ECS ständig bei 1,5 ml / min mit Carbogen bei Luftdruck und Raumtemperatur, um eine Sauerstoffversorgung und einen pH-Wert von 7,4 zu gewährleisten.
- Opfern Sie eine Maus, indem Sie eine hohe Konzentration von CO 2 verabreichen, gefolgt von einer Zervixdislokation. Bemühen Sie sich, das Leiden der Tiere so gering wie möglich zu halten.
- Wenn Sie unter einem Stereomikroskop arbeiten, greifen Sie über eine Laparotomie auf den Bauch zu (Abbildung 2A). Drehen Sie den Darm vorsichtig auf die linke Seite der Maus (aus der anatomischen Perspektive der Maus), um den gemeinsamen Gallengang freizulegen. Verwenden Sie eine Pinzette, um den Zwölffingerdarmteil leicht anzuheben, und finden Sie die große Zwölffingerdarm-Papille-Papille von Vater. Klemmen Sie den gemeinsamen Gallengang an der Zwölffingerdarmpapille mit einem Hämostat (Abbildung 2B, C), um ein Austreten von Agarose aus dem Kanal in den Zwölffingerdarm zu verhindern.
HINWEIS: Um ein Austreten von Agarose in den Zwölffingerdarm und weiter oben und unten im Magen-Darm-Trakt zu verhindern, platzieren Sie den Hämostat so, dass er auch den Zwölffingerdarm sowohl proximal als auch distal von der Papille klemmt. Es ist am besten, einen gekrümmten Hämostat für diesen Zweck zu verwenden. - Mit einer kleinen scharfen Pinzette unter den gemeinsamen Gallengang greifen und die Membran brechen, die den Kanal am Pankreasgewebe befestigt. Für eine bessere visuelle Kontrolle und einfachere Injektion entfernen Sie so viel Fett und Bindegewebe wie möglich aus dem Kanal.
- Setzen Sie den Kanal senkrecht auf große Pinzetten (Abbildung 2D) und injizieren Sie die vorbereitete flüssige Agarose in den proximalen Teil des gemeinsamen Gallengangs (Abbildung 2D). Achten Sie darauf, die Spritze fest zu drücken, da die Agarose viskos ist. Füllen Sie die Bauchspeicheldrüse weiter, bis sie weißlich und leicht aufgebläht wird oder für mindestens 20-30 s.
HINWEIS: Dies ist der kritischste Schritt bei der Scheibenvorbereitung. Wenn es irgendwelche Knicke im duktalen Baum der Bauchspeicheldrüse gibt, heben oder ziehen Sie die Bauchspeicheldrüse vorsichtig von der Spritze weg, um sie auszugleichen. Entscheiden Sie nicht, wann die Injektion auf der Grundlage des aus der Spritze injizierten Volumens abgebrochen werden soll, da der Rückfluss an der Injektionsstelle und die Vorwärtsleckage in den Zwölffingerdarm typischerweise viel höher sind als das Volumen, das in den duktalen Baum der Bauchspeicheldrüse injiziert wird. Wichtig ist, dass erfolgreiche Injektionen mit praktisch unmerklichen Veränderungen des Spritzenvolumens durchgeführt werden können. - Entfernen Sie die Spritze und gießen Sie langsam 20 ml des sprudelnden eiskalten ECS bei 0-4 ° C aus der Flasche auf die Bauchspeicheldrüse, um das Gewebe zu kühlen und die Agarose auszuhärten.
- Extrahieren Sie die Bauchspeicheldrüse vorsichtig mit einer Pinzette und einer feinen, zäh geschnittenen Schere. Legen Sie die extrahierte Bauchspeicheldrüse in eine 100 mm große Petrischale mit ~ 40 ml eiskaltem ECS und bewegen Sie sie vorsichtig, um sie zu waschen. Die Bauchspeicheldrüse in eine frische 100 mm Petrischale mit ~40 ml eiskaltem ECS geben.
- Aus dem gut injizierten Teil der Bauchspeicheldrüse, der weißlich erscheint (Abbildung 3A), schneiden Sie bis zu 6 Gewebeblöcke mit einer Größe von 0,1-0,2 cm3 mit einer Pinzette und einer hart geschnittenen Schere. Reinigen Sie sie von jeglichem Binde- und Fettgewebe.
- Füllen Sie eine 35 mm klebrige Boden-Petrischale mit ca. 5 ml flüssiger Agarose bei 40 °C, übertragen Sie die Gewebeblöcke hinein und legen Sie die Petrischale sofort auf Eis, um sie abzukühlen und die Agarose auszuhärten.
HINWEIS: Die Art und Weise, wie die Blöcke der Bauchspeicheldrüse in Agarose eingeschlossen sind, bestimmt die Art und Weise, wie sie während des Schneidens geschnitten werden. Erfahrene Experimentatoren können versuchen, die Position der Blöcke in den wenigen Momenten vor dem Aushärten der Agarose auf Eis zu verfeinern. - Nachdem die Agarose mit den Gewebeblöcken ausgehärtet ist, drehen Sie die Petrischale auf den Kopf gestellt auf eine flache, glatte Oberfläche wie den Deckel einer 100 mm Petrischale und entfernen Sie die Agarose, indem Sie sie vorsichtig mit einer Hälfte einer Rasierklinge in den Rand zwischen der Seitenwand der Petrischale und der Agarose schneiden. Schneiden Sie mit einer Rasierklinge einzelne Agarosewürfel, die jeweils einen Gewebeblock enthalten, und achten Sie darauf, dass jeder Gewebeblock von Agarose umgeben ist. Die Agaroseblöcke werden mit Cyanacrylatkleber auf die Probenplatte des Vibratoms geklebt (Abbildung 3B).
- Füllen Sie eine 5-ml-Spritze mit der flüssigen Agarose aus dem Erlenmeyerkolben im Wasserbad aus Schritt 1.1.3.2, entfernen Sie alle Blasen und montieren Sie eine 30-G-Nadel. Schützen Sie die Nadel mit einer Kappe und halten Sie die gefüllte Spritze mit der Nadel nach unten und dem gesamten Agarosevolumen unter der Wasseroberfläche wieder im Wasserbad. Befestigen Sie die Spritze mit einem stabilisierenden Bleiring so, dass der Ring die Spritze gegen die Wand des Wasserbades drückt.
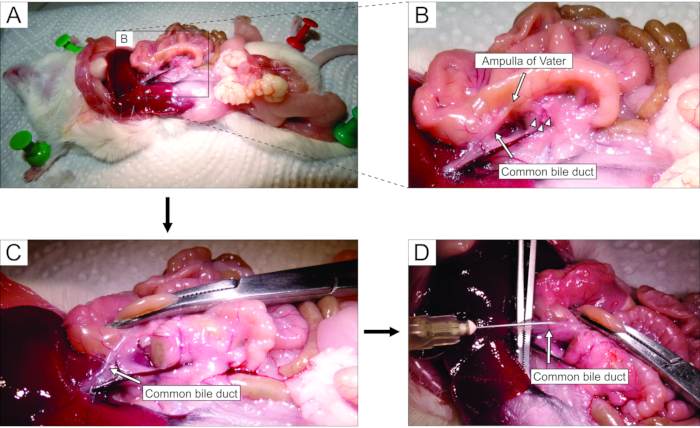
Abbildung 2: Injektion von Agarose in den gemeinsamen Gallengang . (A) Öffnen Sie die Bauchhöhle und legen Sie die Organe in der Peritonealhöhle frei. (B) Der vergrößerte Teil des Bereichs, der von dem Rechteck in Tafel A umgeben ist. Der weiße Fleck auf dem Zwölffingerdarm (gekennzeichnet durch den Pfeil) weist auf die Ampulle von Vater hin. Langerhans-Inseln sind mit Pfeilspitzen gekennzeichnet. (C) Klemmen Sie die Ampulle von Vater durch einen gekrümmten Hämostat und heben Sie sie leicht an, um den gemeinsamen Gallengang freizulegen und vorsichtig zu dehnen (Pfeil). (D) Kanülierung des gemeinsamen Gallengangs und Injektion einer 1,9%igen Agaroselösung mit einer 5-ml-Spritze und einer 30-G-Nadel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- In Scheiben schneidend
- Füllen Sie die Schneidkammer des Vibratoms mit ~0,15 L eiskaltem ECS und blasen Sie ständig mit Carbogen. Umgeben Sie die Schneidkammer mit Eis und fügen Sie 2 Eiswürfel (jeweils ~ 10 ml) aus ECS mit 6 mM Glukose in die Schneidkammer hinzu. Montieren Sie die Rasierklinge zum Schneiden auf das Vibratom und schrauben Sie die Probenplatte mit Agaroseblöcken an ihre Stelle.
- Stellen Sie den Slicer so ein, dass Agaroseblöcke mit 0,05 bis 1 mm/s und 70 Hz in 140 μm dicke Scheiben mit einer Oberfläche von 20-100 mm2 geschnitten werden. Befolgen Sie für die Slicer-Einstellungen die Anweisungen des Herstellers.
- Unmittelbar nach jedem Schneideschritt pausieren Sie den Slicer, sammeln Sie die Scheiben vorsichtig mit einem feinen Pinsel ein und geben Sie sie in eine 100 mm große Petrischale, die mit 40 ml HEPES-Puffer mit 6 mM Glukose bei Raumtemperatur gefüllt ist (Abbildung 3C).
HINWEIS: Die Scheiben können im HEPES-Puffer bei Raumtemperatur für mindestens 12 h aufbewahrt werden, und der Puffer sollte alle 2 h ausgetauscht werden.
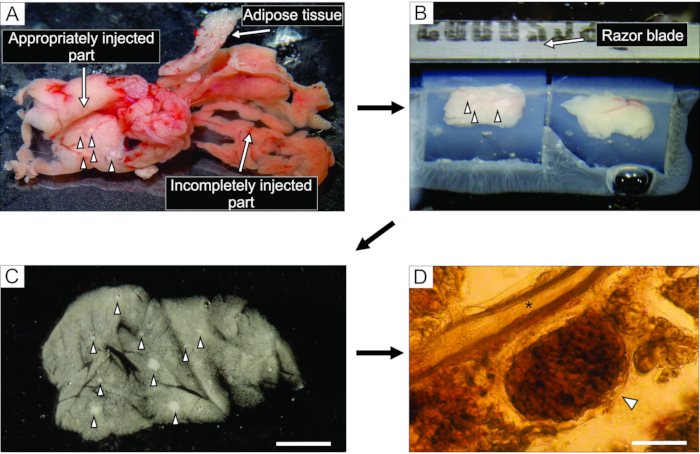
Abbildung 3: Vorbereitung und Schneiden von Pankreasgewebe . (A) Die extrahierte Bauchspeicheldrüse der Maus nach der Agaroseinjektion. Weißes Gewebe auf der linken Seite zeigt einen gut injizierten Teil (Zwölffingerdarmteil) an, während der rötlichere Teil auf der rechten Seite den unzureichend injizierten Teil der Bauchspeicheldrüse (Milzteil) zeigt. (B) Vibratom-Schneiden von zwei in Agarose eingebetteten Blöcken von Pankreasgewebe. (C) Akuter Pankreasgewebeschnitt mit Langerhans-Inselchen, gekennzeichnet durch Pfeilspitzen. Maßstabsleiste = 3000 μm. (D) Akuter Pankreasgewebeschnitt unter dem Lichtmikroskop mit der Langerhans-Insel, die durch eine Pfeilspitze gekennzeichnet ist, Sternchen zeigt einen Pankreasgang an. Maßstabsleiste = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
2. Lebend-/Totentest mit LIVE/DEAD Viability/Cytotoxicity Kit für Säugetierzellen
HINWEIS: Für einige Experimente ist es nützlich, die Lebensfähigkeit von Zellen in den Schnitten (Abbildung 4) durch den Lebend-/Totentest wie folgt zu überprüfen.
- Befolgen Sie die Anweisungen des Herstellers, um Fläschchen mit Reagenzien des LIVE/DEAD Viability/Cytotoxicity Kits aufzutauen, und bereiten Sie kurz vor der Verwendung Arbeitslösungen aus Calcein AM vor. Nutzen Sie die Lösungen innerhalb eines Tages.
- Mischen Sie in einem 15-ml-Zentrifugenröhrchen 5 μL 4 mM Calcein AM (Komponente A), 20 μL 2 mM Ethidiumhomodimer-1 (EthD-1, Komponente B) und 10 ml Dulbeccos phosphatgepufferte Kochsalzlösung (D-PBS), um eine Arbeitslösung herzustellen, die etwa 2 μM Calcein AM und 4 μM EthD-1 enthält. Vortex gründlich.
- Übertragen Sie die Gewebescheiben mit einem feinen Pinsel vorsichtig in eine 3-ml-Petrischale mit frischem HEPES-Puffer, um die Serumesteraseaktivität zu verdünnen. Entfernen Sie den HEPES-Puffer und bedecken Sie die Scheiben mit 100-200 μL (oder mehr, falls erforderlich) der Arbeitslösung aus Schritt 2.2.
- Die Scheiben 30-45 min bei Raumtemperatur in einer geschlossenen Petrischale ausbrüten. Stellen Sie die Gewebescheiben mit Erregungs- / Emissionsfiltern ab, wie vom Hersteller empfohlen.
3. Beladung von Kalziumfarbstoffen
HINWEIS: Fluoreszierende Farbstoffe sollten während des gesamten Prozesses der Zubereitung und Beladung des Farbstoffs sowie während der Handhabung der gefärbten Gewebescheiben vor Lichteinwirkung geschützt werden. Zinnfolie kann zum Abdecken von Röhrchen oder Petrischalen verwendet werden, die den Calciumfarbstoff enthalten.
- Farbstoffzubereitung
- Der Inhalt einer Durchstechflasche (50 μg) des zelldurchlässigen Indikatorfarbstoffs Ca 2+ (Anregung/Emission 495/523 nm; siehe Materialtabelle), 7,5 μL Dimethylsulfoxid (DMSO) und 2,5 μL Polaxamer (20%ige Lösung in DMSO; Tabelle der Materialien) in 6,667 ml HBS mit 6 mM Glucose in einem 15 mL Schraubverschlussrohr.
HINWEIS: Diese endgültige Lösung enthält 6 μM des Indikatorfarbstoffs Ca2+ , 0,11% DMSO und 0,037% Polaxamer. - Die Lösung im Schraubverschlussrohr wiederholt mit einer Pipette für 20 s absaugen und ausstoßen; Tauchen Sie das Rohr für 30 s in eine Ultraschall-Badkammer und 30 s in einen Wirbel, um die Solubilisierung zu verbessern. Aliquot 3,333 ml der endgültigen Ca2+ Indikatorfarbstofflösung, die in Schritt 3.1.1 zubereitet wurde, in 5 ml Petrischale.
- Der Inhalt einer Durchstechflasche (50 μg) des zelldurchlässigen Indikatorfarbstoffs Ca 2+ (Anregung/Emission 495/523 nm; siehe Materialtabelle), 7,5 μL Dimethylsulfoxid (DMSO) und 2,5 μL Polaxamer (20%ige Lösung in DMSO; Tabelle der Materialien) in 6,667 ml HBS mit 6 mM Glucose in einem 15 mL Schraubverschlussrohr.
- Farbstoffbelastung
- Übertragen Sie die vorbereiteten Gewebescheiben aus der 60 ml Petrischale mit HBS in 5 ml Petrischale, die mit der Farbstofflösung gefüllt sind, indem Sie jede Gewebescheibe vorsichtig mit einem dünnen, weichen Pinsel anheben und in die Farbstofflösung geben. Bis zu 10 Gewebescheiben pro Petrischale inkubieren.
- Legen Sie die mit Scheiben beladene Petrischale 50 Minuten lang bei Raumtemperatur auf einen Orbitalschüttler, der auf Orbitalbewegung mit 40 Umdrehungen pro Minute eingestellt ist. Inkubieren Sie die Scheiben in der Farbstofflösung, die der Umgebungsluft bei Raumtemperatur ausgesetzt ist, aber vor Licht geschützt ist, indem Sie die Petrischale mit Zinnfolie abdecken.
- Speichern von Slices
- Die gefärbten Gewebescheiben aus der 5 ml Petrischale in eine mit farbstofffreiem HBS gefüllte 60 ml Petrischale geben, indem man sie vorsichtig mit einem feinen, weichen Pinsel anhebt. Bis zu 20 Scheiben pro Petrischale aufbewahren.
HINWEIS: Verwenden Sie an dieser Stelle die Gewebeschnitte für die Bildgebung. Die Gewebescheiben behalten den Ca2+ Indikatorfarbstoff für mehrere Stunden. Das Überleben von Scheiben und das Zurückhalten des Farbstoffs können verbessert werden, indem die Petrischale in einen isolierten Behälter gelegt wird, der von Eis umgeben ist. Dies ist besonders wichtig, wenn die farbstoffbeladenen Scheiben transportiert werden sollen. Zusätzlich können Sie die HBS alle 2 Stunden austauschen.
- Die gefärbten Gewebescheiben aus der 5 ml Petrischale in eine mit farbstofffreiem HBS gefüllte 60 ml Petrischale geben, indem man sie vorsichtig mit einem feinen, weichen Pinsel anhebt. Bis zu 20 Scheiben pro Petrischale aufbewahren.
4. Kalzium-Bildgebung
- Aufbau des konfokalen Mikroskops
- Wählen Sie je nach Interesse der Studie eine geeignete objektive Vergrößerung. Wählen Sie 20x und 25x (numerische Apertur [NA] 0,77-1,00), um eine ganze Insel, mehrere Acini gleichzeitig oder größere Kanäle zu visualisieren. Wählen Sie höhere Vergrößerungen, um die intrazelluläre Dynamik zu untersuchen.
- Wählen Sie den Erfassungsmodus für die Zeitrafferbildgebung (z. B. Zeitraffer, xyt oder einen ähnlichen Modus). Stellen Sie das Loch auf 100-200 μm ein.
- Legen Sie den Lichtpfad für grüne Fluorophore fest: Anregung bei 488 nm und Ansammlung der Emission bei 500-700 nm. Vorzugsweise wählen Sie Detektoren mit einer hohen Quanteneffizienz (z. B. Galliumarsenidphosphid) gegenüber Photomultiplier-Detektoren.
- Aufbau der Aufnahmekammer und des Perifusionssystems
- Montieren Sie die Aufnahmekammer auf der temperaturgesteuerten Stufe des Mikroskops und des Perifusionssystems (entweder schwerkraftgespeister oder peristaltisch-pumpenbasierter Aufbau, Volumen 1 ml). Positionieren Sie den Einlass und den Auslass an den äußersten Rändern der Aufzeichnungskammer, um ein Mäandern des Perfusats innerhalb der Kammer zu vermeiden, und stellen Sie den Zu- und Abfluss auf gleiche Werte (1-2 ml/min) ein. Vermeiden Sie das Abdriften der Höhe des flüssigen Meniskus und der Tröpfchen im Perifusat.
- Stellen Sie die Temperaturregelung des Perifusionssystems auf 37 °C ein.Initiieren Sie die Perifusion mit der nicht-stimulierenden Lösung und bereiten Sie die stimulierenden Lösungen vor. Wechseln Sie die Lösungen über motorisierte Ventile oder durch manuelles Schalten der Lösungen, die das Perifusionssystem speisen.
- Calciumdynamik aufzeichnen
- Geben Sie eine einzelne Gewebescheibe in die Aufnahmekammer. Immobilisieren Sie die Gewebescheibe mit einem U-förmigen Platingewicht mit straffem Nylonnetz (z.B. aus Nylonstrümpfen). Vermeiden Sie es, Nylonfäden über der interessierenden Struktur zu positionieren.
- Suchen Sie eine Insel/einen Acinus/einen Kanal mit der Hellfeldoption. Führen Sie Live-Bildgebung durch, um die untersuchten Strukturen im Sichtfeld zu positionieren, und richten Sie die Bildgebungsparameter ein. Optimieren Sie das Signal-Rausch-Verhältnis, indem Sie die Laserleistung, die Detektorverstärkung und die Linienmittelung/-binning anpassen, um die Visualisierung der Zellen zu ermöglichen und gleichzeitig die Laserleistung minimal zu halten.
- Stellen Sie die Brennebene der Aufnahme auf ~15 μm unterhalb der Schnittfläche ein (Abbildung 5), um die Aufzeichnung von potenziell beschädigten Zellen an der Schnittfläche zu vermeiden.
- Erwerben Sie Bilder. Stellen Sie die Abtastfrequenz auf 1-2 Hz ein, um zunächst einzelne Schwingungen zu erkennen, und verwenden Sie einen Resonanzscanner, der in der Lage ist, die Mittelung (8-20) mit einer höheren Aufnahmerate (>10 Hz) zu beschleunigen, um die intrazelluläre Ca 2 + ([Ca2 +]IC) -Aktivität aufzuzeichnen. Lassen Sie ein Intervall (z. B. 30 % der gesamten Abtastzeit) zwischen aufeinanderfolgenden Punktbeleuchtungen ein, um Phototoxizität zu vermeiden. Nehmen Sie vor der Zeitreihenerfassung ein hochauflösendes Bild auf (z. B. 1024 x 1024 Pixel, Zeilendurchschnitt > 50) (siehe Abschnitt 5).
HINWEIS: Die Abtastfrequenz von 1-2 Hz liegt für die meisten Zellen unter dem Nyquist-Kriterium für die Erfassungsfrequenz, und die Form des Signals wird standardmäßig unterabgetastet. - Beziehen Sie sich auf ein Online-Diagramm, falls in der Bildgebungssoftware verfügbar, um sofortiges Feedback über die Vorbereitungsreaktion, Überbeleuchtung, Fotobleiche und mechanische Drift zu erhalten. Im Falle einer hohen Bleichrate während der Aufnahme stoppen Sie die Aufzeichnung und verringern Sie die Laserleistung, während Sie die Detektorverstärkung erhöhen, um das Signal-Rausch-Verhältnis aufrechtzuerhalten. Bei mechanischer Drift auf Spannung zwischen Schläuchen/Kabeln und der Mikroskopstufe sowie auf Flüssigkeitsleckagen oder Volumenänderungen in der Aufnahmekammer prüfen. Optional können Sie versuchen, die Drift während der Erfassung manuell zu korrigieren. Beachten Sie jedoch, dass dies von Natur aus zu begrenzten Ergebnissen führt.
HINWEIS: Endokrine Zellen sind bei nahezu schwellennahen Konzentrationen sehr heterogen. Eine ausreichende Stimulationsdauer ist erforderlich, um den Bereich der Aktivierungs- / Deaktivierungsverzögerungen in einzelnen Zellen zu erkennen. Dies ist besonders wichtig für die genaue Erkennung von Off-Responses nach hochstimulierenden Protokollen. - Verwenden Sie die Kalziumbildgebung, um funktionell zwischen endo- und exokrinen Zellen zu unterscheiden (Abbildung 6). Um die vorübergehende Aktivität während der Aktivierung und Deaktivierung aufzuzeichnen, wenden Sie Stimuli an, ohne die Aufzeichnung zu stoppen.
- Speichern Sie die Daten nach dem Ende des Experimentierens (erwägen Sie die Verwendung einer automatischen Speicherfunktion). Lassen Sie eine Abkühlzeit ein, bevor Sie die Laserleistung ausschalten, um die Laser während des Abschaltvorgangs nicht zu beschädigen.
5. Analyse der Daten
- Überprüfen Sie die Aufnahme visuell, indem Sie das Zeitraffervideo erneut abspielen. Überprüfen Sie, ob Zellen aus dem Sichtfeld oder der optischen Ebene abweichen. Wenn eine Drift innerhalb der optischen Ebene aufgetreten ist, verwenden Sie das Driftkorrektur-Plugin in ImageJ.
- Wählen Sie Regionen von Interesse (ROIs) mithilfe von Mikroskopsoftware oder Software von Drittanbietern aus. Verwenden Sie das hochauflösende Bild, die maximale Projektion oder den Rahmendurchschnitt als Referenz, um ROIs auszuwählen. Spielen Sie die Zeitrafferbildgebung erneut ab, um reagierende Zellen zu visualisieren, die in Referenzbildern nicht sichtbar sind. Positionieren Sie die ROIs so, dass sich der ausgewählte Bereich eines ROI nicht mit benachbarten Zellen überschneidet, um Signalübersprechen zwischen ROIs zu vermeiden.
- Exportieren Sie die Zeitreihendaten als ROI-Durchschnittswert pro Frame. ROI-Koordinaten exportieren.
- Korrigieren Sie die Zeitreihendaten für das Bleichen (Abbildung 7A), indem Sie eine Kombination aus exponentieller und linearer Anpassung verwenden, wie in
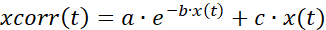 (1)
(1)
wobei x(t) das Fluoreszenzsignal zu einem Zeitpunkt t bezeichnet; xcorr(t) das korrigierte Signal zu den entsprechenden Zeitpunkten; und a, b und c die Parameter der Anpassung, berechnet als kleinste Summe von Quadraten zwischen Corr(t ) und X(T). - Analysieren Sie die Aktivierungs- und Deaktivierungsphase der Antwort (Abbildung 7B). Berechnen Sie die erste Ableitung der Zeitreihendaten und bestimmen Sie den Zenit und den Tiefpunkt der Ableitung, die der Aktivierung bzw. Deaktivierung entsprechen. Alternativ können Sie den Beginn der phasischen Erhöhung manuell auswählen. Speichern und exportieren Sie die Aktivierungs-/Deaktivierungszeiten und die entsprechenden Zellkoordinaten.
- Analysieren Sie die Plateauphase (Abbildung 7C). Erkennen Sie einzelne Schwingungen, indem Sie die Rohdaten oder die erste Ableitung der Zeitreihendaten schwellen. Definieren Sie den Beginn und das Ende einer einzelnen Schwingung als die Zeit, die der Halbamplitude der Schwingung entspricht.
- Berechnen Sie die Dauer und die Häufigkeit einzelner Schwingungen für jede Zelle. Berechnen Sie den inversen Wert des Interspike-Intervalls (geeignet für regelmäßige Aktivitätsmuster). Alternativ können Sie die Anzahl der Schwingungen durch das Zeitintervall des Datensatzes dividieren (geeignet für unregelmäßige Aktivitätsmuster).
- Berechnen Sie die aktive Zeit. Drücken Sie die aktive Zeit als Summe der Dauer aus und dividieren Sie diesen Wert durch das Zeitintervall. Alternativ multiplizieren Sie die Frequenz und die Dauer, die einer Schwingung entsprechen.
HINWEIS: Die Division der Summe der Dauer durch das Zeitintervall liefert robuste Ergebnisse, weist jedoch eine geringe statistische Diskriminierung auf, da ein einzelner Datenpunkt pro Zelle erhalten wird. Die Multiplikation der Frequenz und Dauer einer Schwingung ergibt eine zeitliche Auflösung von Oszillation zu Oszillation.
Ergebnisse
Die Injektion der Agaroselösung in den Pankreasgang ist der kritischste Schritt bei der Herstellung von Pankreasgewebeschnitten. Eine erfolgreiche Injektion kann an einer Aufhellung des Pankreasgewebes erkannt werden, wie auf der linken Seite von Abbildung 3A zu sehen ist, während ein unvollständig injizierter Teil der Bauchspeicheldrüse auf der rechten Seite von Abbildung 3A dargestellt ist. Die Langerhans-Inseln sind mit bloßem Auge oder unter einem Stereomikroskop zu erkennen, was dazu beiträgt, die entsprechenden Teile der Bauchspeicheldrüse für die anschließende Einbettung in Agaroseblöcke zu schneiden (Abbildung 3B). In einer frisch geschnittenen Mäuse-Pankreasgewebescheibe lassen sich Langerhans-Inseln leicht vom umgebenden exokrinen Gewebe und Mesenchym als weiße Flecken unter dem Stereomikroskop (Bild 3C) oder als bräunliche Strukturen unter dem Lichtmikroskop unterscheiden (Abbildung 3D). Die Pankreasgewebeschnitte können für verschiedene Arten von Experimenten für mindestens 12 h nach dem Schneiden verwendet werden. Neben der grobmorphologischen Beurteilung unter dem Stereomikroskop, dem Lichtmikroskop und den funktionellen Reaktionen der Zellen während der Kalziumbildgebung kann die Lebensfähigkeit der Pankreasgewebeschnitte beurteilt werden (Abbildung 4).
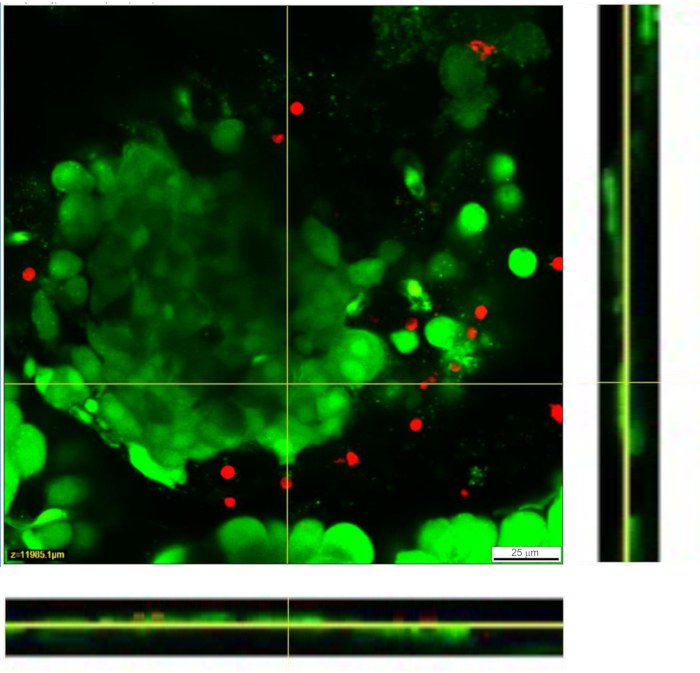
Abbildung 4: Lebensfähigkeit von Zellen innerhalb des Gewebeschnitts. Die Lebensfähigkeit der Zellen wurde mit dem Lebend-/Toten-Assay bestimmt. Lebende Zellen werden durch Calcein AM gefärbt (grün dargestellt), während tote Zellen mit Ethidium homodimer-1 (rot dargestellt) gefärbt sind. Gelbe Linien kennzeichnen die Position des X-Y-Querschnitts des unten und rechts angezeigten Z-Stacks. Die volle Tiefe des Z-Stacks beträgt 88 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Für Calcium-Imaging-Experimente muss der fluoreszierende Kalzium-Indikator durch einige Zellschichten eindringen. Abbildung 5A zeigt das erfolgreiche Laden des zelldurchlässigen Ca2+ Indikatorfarbstoffs in den Pankreasgewebeschnitt, in dem einzelne Insel- und Azinuszellen erkannt werden können. Im Gegensatz dazu sind die Scheiben in Abbildung 5B-D aufgrund des erfolglosen Eindringens des Farbstoffs (Abbildung 5B), des Fehlens von Inselzellen (Abbildung 5C) und einer Menge nekrotischem Gewebes auf der Oberfläche (Abbildung 5D) nicht optimal. Solche Scheiben können verworfen, auf das Vorhandensein zusätzlicher Inseln, die besser geschnitten oder gefärbt sind, überprüft werden (siehe Tabelle 1 zur Fehlerbehebung) oder zur Aufzeichnung der Reaktionen exokriner Zellen verwendet werden.
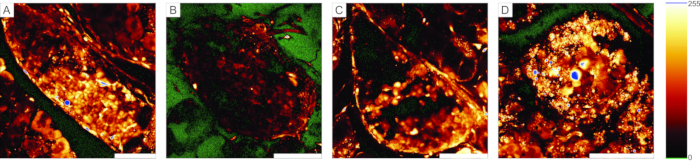
Abbildung 5: Beispiele für verwendbare und unbrauchbare Präparate . (A) Ein Beispiel für eine erfolgreiche Präparation des Pankreasgewebeschnitts mit gut gefärbten Zellen auf den Langerhans-Inseln sowie duktalen Zellen und umgebendem Acinargewebe. (B) Ein Beispiel für eine schlecht gefärbte Gewebescheibe. (C) Beispiel einer Langerhans-Insel mit strukturellen Abbrüchen. (D) Ein Beispiel für eine Langerhans-Insel, die viele abgestorbene Zellen und viele Trümmer enthält. Die Nachschlagetabelle "glow-over, glow-under" auf der rechten Seite zeigt 0 Intensität in Grün und Sättigung in Blau. Maßstabsleiste = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Repräsentative Ergebnisse der Kalziumbildgebung unter Verwendung des zelldurchlässigen Indikatorfarbstoffs Ca2+ sind in Abbildung 6 dargestellt. In Abbildung 6A ist ein hochauflösendes Bild einer Pankreasgewebescheibe dargestellt, die eine Langerhans-Insel, Acin-Gewebe und einen Pankreasgang enthält. Zur besseren Unterscheidung sind der in Abbildung 6A dargestellte endokrine, exokrine und duktale Teil der Pankreasgewebescheibe in Abbildung 6B eingefärbt. Die Verwendung geeigneter Reize kann funktionell zwischen verschiedenen Inselzellen oder Insel- und Nicht-Inselzellenunterscheiden 51. Betazellen reagieren typischerweise auf eine quadratische Pulsstimulation durch Glukose mit einem vorübergehenden Anstieg des [Ca2+]IC, gefolgt von schnellen Kalziumschwingungen auf einem anhaltenden Plateau (Abbildung 6C, oberes Panel).
Da alle Betazellen zu einem einzigen, großen, funktionellen Synzytium gekoppelt sind, sind diese Schwingungen auch zwischen verschiedenen Zellen sehr gut synchronisiert, indem sie [Ca2+]IC-Wellen 32,34,52,53,54 ausbreiten (Abbildung 7C). Langsamere [Ca2+]IC-Schwingungen mit einer Periode von 5-15 Minuten können den schnellen Schwingungen zugrunde liegen oder sogar die vorherrschende Art von Reponse55,56 sein. Das gleiche einfache Protokoll kann andere Arten von Antworten aufdecken, insbesondere an der Peripherie von Inseln (Abbildung 6C, unteres Bild). Da diese Zellen nicht mit Betazellen synchronisiert sind und mit schnelleren und unregelmäßigeren Schwingungen reagieren, die bereits unter Bedingungen mit niedriger Glukose oder mit einer Abnahme der Aktivität vorhanden sind, deuten solche Reaktionen stark auf Nicht-Beta-Zellenhin 21,32,57,58. Ihre endgültige funktionelle Charakterisierung erfordert jedoch komplexere Protokolle mit zusätzlichen Stimulationsschritten oder alternativen Ansätzen, die im Folgenden erläutert werden. Typische Reaktionen von Acinaren und duktalen Zellen sind in Abbildung 6D bzw. Abbildung 6E dargestellt. Weitere Informationen zu Acinar und duktalen Zellen finden Sie in der Literatur22,23,35.
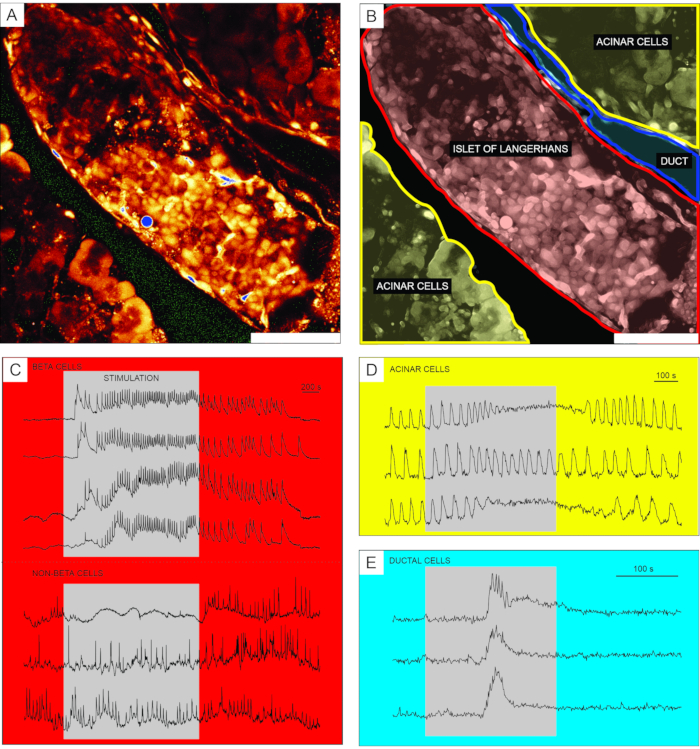
Abbildung 6: Repräsentative Ergebnisse der Calciumdynamik in verschiedenen Arten von Pankreaszellen . (A) Ein hochauflösendes Bild einer Langerhans-Insel mit umgebendem Gewebe. Maßstabsstab = 100 μm. (B) Abgrenzung verschiedener Teile des Pankreasgewebes mit Azinargewebe in Gelb, einer Langerhans-Insel in Rot und einem Segment des duktalen Baumes in Blau. Skalenbalken = 100 μm. (C) Typische Spuren der Calciumdynamik in Beta- und mutmaßlichen Nicht-Beta-Zellen während der Stimulation mit 12 mM Glukose; 3 mM Glukose wurde für nicht-stimulierende Bedingungen verwendet. Protokolle, die für eine spezifischere Unterscheidung von Nicht-Beta-Zellen verwendet werden können, werden im Diskussionsabschnitt beschrieben. (D) Eine typische Spur der Calciumdynamik von Acinarenzellen, die durch 25 nM Acetylcholin stimuliert wird. (E) Eine typische Spur der Calciumdynamik von duktalen Zellen, die durch 1 mM Chenodesoxycholsäure stimuliert wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Nach erfolgreicher Calciumbildgebung werden die Daten zunächst exportiert und für das Bleichen durch eine Kombination aus exponentieller und linearer Anpassung korrigiert, wie im Protokollabschnitt beschrieben. Eine Zeitreihe vor und nach der Bleichkorrektur ist in Abbildung 7A dargestellt. Danach können mehrere Parameter in der Aktivierungs- und Deaktivierungsphase der Antwort sowie der Plateauphase analysiert werden. Eine Verzögerung des Beginns des [Ca2+]IC-Anstiegs nach Stimulation kann gemessen werden, dargestellt durch VerzögerungA in Abbildung 7B und die Heterogenität der Verzögerungen zwischen einzelnen Zellen (VerzögerungA1). Die gleichen Parameter (VerzögerungD und VerzögerungD1) können verwendet werden, um die Deaktivierungsphase zu beschreiben. Nach dem anfänglichen transienten [Ca 2+]IC-Anstieg ist die Plateauphase in den meisten Betazellen der Bauchspeicheldrüse auf einer Insel durch relativ regelmäßige hochfrequente [Ca2+]IC-Schwingungen gekennzeichnet. Die Plateauphase kann durch Analyse der klassischen Funktionsparameter beschrieben werden. Die schematische Darstellung der [Ca2+]IC-Schwingungsdauer, -frequenz und des Prozentsatzes der aktiven Zeit ist in Abbildung 7C dargestellt. In der Kalziumbildgebung mit Aufnahmeraten von mehr als 10 Hz können auch Kalziumwellen, die sich wiederholt über die Insel ausbreiten, deutlich erkannt werden (Abbildung 7C).
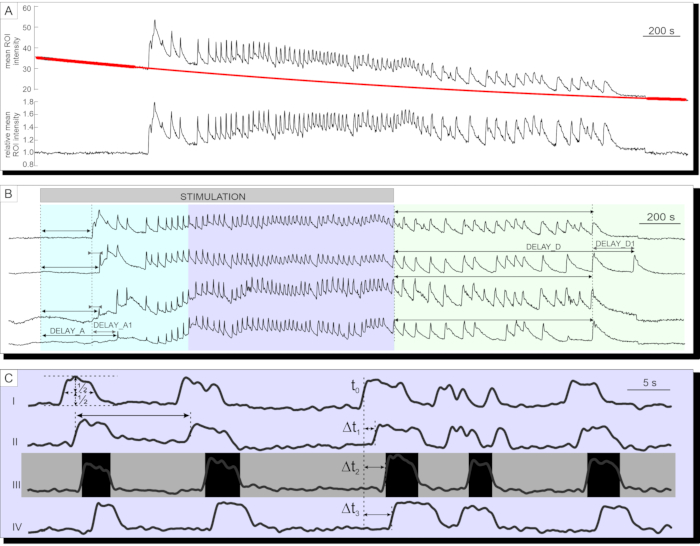
Abbildung 7: Analyse von Zeitreihendaten. (A) Korrektur von Zeitreihendaten für das Photobleichen. (B) Analyse von Verzögerungen bei der Aktivierung nach der Stimulation und der Deaktivierung nach Beendigung der Stimulation mit 12 mM Glukose. Die Dauer der Stimulation wird durch den hellgrauen, schattierten Balken im Bild angegeben. (C) Analyse mehrerer Parameter der Plateauphase: I) Dauer der Schwingung, bestimmt in halber Höhe, II) Frequenz der Schwingungen, bestimmt durch Interoszillationsintervalle. III) aktive Zeit als Produkt aus Häufigkeit und Dauer von Schwingungen. I-IV) Verzögerungen zwischen Schwingungen in einer gegebenen Welle von Schwingungen, die sich über die Langerhans-Insel ausbreiten, bestimmt durch die Verzögerungen (Δt) in der Zeit, in der eine einzelne Zelle die halbe Höhe der Schwingung erreicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Tabelle 1. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Die Pankreasgewebeschnittmethode ist eine schnelle experimentelle Methode, um die Morphologie und Physiologie der endokrinen und exokrinen Teile der Bauchspeicheldrüse in einer konservierteren In-situ-Präparation zu untersuchen. Viele der Vorteile wurden bereits in der Einleitung aufgezeigt. Es ist erwähnenswert, dass der Slice-Ansatz zur Untersuchung der Pankreasphysiologie im Allgemeinen (dh nicht nur für die Kalziumbildgebung) im Allgemeinen Zeit spart, da er keine Erholungsphase nach der Isolierung beinhaltet. Letzteres ist bei allen Arten von Experimenten und Verwendungen von isolierten Inseln verschiedener Arten nicht unbedingt erforderlich, wird aber typischerweise verwendet, um die Reinheit zu erhöhen, die Lebensfähigkeit und Funktionalität wiederherzustellen und manchmal Inseln von mehreren Spendern zu sammeln 59,60,61,62,63,64 . Im Zusammenhang mit der Kalziumbildgebung wurde jedoch festgestellt, dass Betazellantworten von der Kulturdauer und den Bedingungen abhängen, und dies ist eine wichtige Variationsquelle, die bei der Verwendung isolierter Inseln15,65 berücksichtigt werden sollte. Das gleiche Problem sollte für Gewebeschnitte in Betracht gezogen werden, wenn ihre Langzeitkultur in Zukunft eine weit verbreitete Option wird 22,36. Die Gewebeschnittmethode hat auch eine hohe Ausbeute und reduziert somit potenziell Tierleid und erhöht die statistische Aussagekraft. Da außerdem viele Scheiben von einem einzigen Tier zubereitet werden können und weil die Scheiben lange Zeit überleben, wird es machbar, dasselbe Tier oder sogar die gleiche Insel sowohl in der Versuchs- als auch in der Kontrollgruppe einzubeziehen.
Da die ursprüngliche Architektur und die Zell-zu-Zell-Kommunikation erhalten bleiben und mit einer Reihe von Strukturanalysen, elektrophysiologischen, bildgebenden Verfahren und Hormonsekretionsassays kompatibel sind, ist diese Methode besonders nützlich, um Pankreasfunktionen zu untersuchen, die von ungestörten Interaktionen zwischen einzelnen Zellen abhängen, z. B. Empfindlichkeit gegenüber Sekretagen, parakrinen und Immuninteraktionen zwischen verschiedenen Zelltypen. Muster der elektrischen Aktivität, Eigenschaften der Kalziumdynamik und die Sekretion verschiedener Hormone. Speziell für die Kalziumbildgebung sind die Hauptvorteile der Verwendung von Schnitten die Belichtung des Inselkerns und die Möglichkeit, Signale von vielen verschiedenen Zelltypen mit hoher Auflösung zu erfassen. Abhängig von den Anforderungen des Versuchs und dem Alter der Tiere kann die Dicke variiert werden, die Scheiben können transfiziert oder von Tieren mit genetisch kodierten Reportern gewonnen werden. Wie im Folgenden näher erläutert, ermöglichen die beiden letztgenannten Ansätze auch eine spezifische funktionelle Identifizierung und Charakterisierung von Reaktionen von Nicht-Beta-Zellen 31,66. Darüber hinaus können Inseln aus gut definierten Teilen des Organs auf Unterschiede in der Reaktionsfähigkeit oder Anfälligkeit für Krankheiten untersucht werden. Obwohl sie keine Erholungsinduzierungszeit benötigen, können sie leicht mit verschiedenen pharmakologischen Wirkstoffen, Fettsäuren, hoher Glukose und Zytokinen inkubiert werden.
Da eine hohe Auflösung in Kombination mit einer Einzelzell- oder sogar subzellulären Auflösung erreichbar ist, ist die konfokale Kalziumbildgebung in Scheiben eine der am besten geeigneten Methoden zur Analyse von Kalziumwellen, funktioneller Konnektivität und den verschiedenen funktionellen Rollen von Zellen in verschiedenen Teilen einer Insel54,67. Trotz einer Reihe von Vorteilen hat der Gewebeschnittansatz wichtige Einschränkungen. Erstens ist es immer noch zumindest teilweise störend für die Insel- und exokrine Architektur, insbesondere an der Schnittfläche, und Vorsichtsmaßnahmen wie niedrige Temperaturen, häufiger Austausch von Lösungen und sanfte und schnelle Manipulation sind während der Vorbereitung erforderlich, um zusätzliche mechanische und endogene enzymatische Schäden zu vermeiden. Zweitens sind die Muster der Nährstoff- und Sekretagogenabgabe dem In-vivo-Weg immer noch unterlegen, das Präparat löst sich von der systemischen Innervation und ein Feedback zwischen Organen, beispielsweise zwischen der Insel und ihren Zielgeweben, ist im Gegensatz zu In-vivo-Ansätzen unmöglich. Drittens ist die maximale Schichtdicke durch Sauerstoffversorgung, Nährstoffabgabe und pH-Regulierung bei ~ 200 μm9 begrenzt. Darüber hinaus erfordern sowohl die Herstellung von Schnitten als auch die Bildgebung viel Training, und eingehende Analysen von Kalziumdaten aus langen Zeitreihen und von vielen Zellen erfordern Spezialwissen, das oft nicht im Toolkit eines klassischen Physiologen enthalten ist und Hilfe von Physikern oder Datenwissenschaftlern erfordert. Der Vorteil, dass homo- und heterotypische Interaktionen erhalten bleiben, kann auch die Analyse von Proben aufgrund des Vorhandenseins von Signalen anderer Zellen in Regionen von Interesse erschweren. Je nach Protokoll kann die Aktivierung anderer Zellen zu einer indirekten zusätzlichen Stimulation oder Hemmung einer beobachteten Zelle führen.
Dies kann nur durch Dekonvolutionsansätze, durch komplexere Stimulationsprotokolle, einschließlich Substanzen, die einige der indirekten Effekte blockieren, durch die Verwendung spezifischer Knock-out-Tiere und durch einen sorgfältigen Vergleich der Ergebnisse mit Ergebnissen anderer Studien, die eher reduktionistische Methoden anwenden, abschließend gelöst werden. Wenn Sekretionsmessungen erforderlich sind, sollte außerdem beachtet werden, dass einigen Scheiben möglicherweise Inseln fehlen und die Gesamtmasse an endokrinem Gewebe in einer einzigen Scheibe typischerweise niedrig ist. Die Vorbereitung von akuten Pankreasgewebeschnitten für die Bildgebung umfasst mehrere kritische Schritte, die in den folgenden Abschnitten besprochen und in Tabelle 1 zusammengefasst sind, wo der Leser auch kurze, aber wichtige Tipps zur Fehlerbehebung finden kann. Zunächst muss sich bei der Herstellung der Agaroselösung das Agarosepulver vollständig auflösen, da sonst die ungelösten Partikel die Injektion behindern können. Halten Sie die homogene Agaroselösung bei 37-45 °C, um einerseits eine Verhärtung von Agarose durch zu niedrige Temperatur zu verhindern und andererseits Gewebeschäden durch zu hohe Temperaturen zu vermeiden. Nach Gebrauch kann die verbleibende Agarose bei 4 °C gelagert und wieder erwärmt werden, obwohl wiederholtes Wiedererhitzen zu einer erhöhten Dichte aufgrund der Wasserverdunstung führen kann, was die Injektion schließlich erschwert oder unmöglich macht.
Der nächste kritische Schritt in der Vorbereitung ist das richtige Klemmen der großen Zwölffingerdarmpapille. Ein weißer Fleck auf dem Zwölffingerdarm zeigt die Verbindung des gemeinsamen Gallengangs und des Zwölffingerdarms an. Eine zu nahe platzierte Klemme führt zu einer Obstruktion einiger lateraler Pankreaszweige des gemeinsamen Kanals, wodurch die Injektion dieser Teile deaktiviert wird, während eine zu distal platzierte Klemme dazu führt, dass Agarose durch den unteren Widerstandspfad direkt in den Zwölffingerdarm austritt. Vor der Kanülierung des gemeinsamen Gallengangs kann das umgebende Fettgewebe vorsichtig entfernt werden, um den Kanal besser sichtbar zu machen und die Kontrolle während der Injektion zu verbessern. Eine unzureichende Präzision bei der Entfernung des umgebenden Gewebes kann zu einer Perforation des Kanals führen. Die Auswahl des Nadeldurchmessers, der für die Agaroseinjektion verwendet wird, ist ebenfalls wichtig. Bei Mäusen wird vorzugsweise eine 30-G-Nadel verwendet; kleinere (32 oder 33 G) Nadeln erfordern aufgrund der hohen Viskosität der Agaroselösung mehr Aufwand und sind anfälliger für Obstruktionen. Wenn sie jedoch in Kombination mit einer Agaroselösung mit geringerer Dichte verwendet werden, können sie bei kleineren Mausstämmen und jüngeren Tieren sehr hilfreich sein. Während der ersten postnatalen Tage kann Agarose alternativ subkapsulär statt intraduktalinjiziert werden 2. Die Verwendung von Nadeln mit größerem Durchmesser bei Mäusen führt höchstwahrscheinlich zu einer Schädigung des gemeinsamen Gallengangs. Dies kann auch mit dem richtigen Nadeldurchmesser passieren, und eine Pinzette kann helfen, die Nadel während der Injektion an Ort und Stelle zu halten. Nadeln mit größerem Durchmesser können die einzige Lösung bei größeren Kanälen sein, wie sie bei Ratten gefunden werden. Wenn die Nadel zu schmal ist, um eine dichte Abdichtung zu gewährleisten, die eine Rückleckage verhindert, kann bei erfolgreichem Eintritt in den Kanal eine Ligatur um sie herum platziert werden.
Die Agaroseinjektion erfordert aufgrund der Viskosität der Lösung einige Anstrengungen, und sobald der Injektionsprozess begonnen hat, sollte er nicht unterbrochen werden, da die Agaroselösung mit niedrigem Schmelzpunkt in der Nadel oder den größten Teilen des duktalen Baumes erstarren kann, bevor die Injektion abgeschlossen ist. Dies führt zu einer schlechten Gewebepenetration und einer schlechteren Unterstützung während des Schneidens. Der Gang sollte immer an der Stelle kanüliert werden, an der sich der linke Lebergang und der Zystengang zum gemeinsamen Gallengang verbinden. Wenn der gemeinsame Gallengang perforiert wird, versuchen Sie wiederholt, näher am Zwölffingerdarm zu kanülieren. Wenn die Bauchspeicheldrüse ausreichend mit Agaroselösung stabilisiert und aus der Peritonealhöhle extrahiert wird, werden kleine Stücke gut injiziertes Gewebe geschnitten. Bevor sie in die Agarose eingebettet werden, ist es wichtig, alle Fett- und Bindegewebe zu entfernen, da ihre Rückstände das Schneiden schwieriger machen. Gleiches gilt für Blutgefäße und Kanalreste, es sei denn, sie stehen im Mittelpunkt des Experiments. Stellen Sie in diesem Fall sicher, dass Sie sie so positionieren, dass der gewünschte Querschnitt erhalten wird. Achten Sie beim Einbetten des Gewebes in Agarose darauf, dass die Temperatur angemessen ist (37 °C) und dass das Gewebe vollständig von Agarose umgeben ist, da Kräfte beim Vibratom-Schneiden das Bauchspeicheldrüsengewebe aus den Agaroseblöcken herausreißen können.
Das schnelle Trocknen der Gewebeblöcke, bevor Sie sie in Agarose legen, indem Sie sie kurz auf ein Papiertaschentuch legen, kann dazu beitragen, einen schlechten Kontakt zwischen Gewebe und Agarose während dieses Schritts zu vermeiden. Stellen Sie während der Erstarrung der Agaroseblöcke die Petrischale horizontal auf und verhindern Sie den Kontakt zwischen dem Bauchspeicheldrüsengewebe und dem Boden der Petrischale. Wenn die Bauchspeicheldrüse nicht vollständig injiziert wird, wird der Schneidprozess eine Herausforderung darstellen. Versuchen Sie daher, die Schnittgeschwindigkeit zu reduzieren, um Gewebeschnitte zu erhalten. Um Zellschäden beim Vibratom-Schneiden zu minimieren, tauschen Sie das ECS (und die Eiswürfel aus ECS) regelmäßig in der Schneidekammer aus. Letzteres reduziert die Aktivität von Pankreasenzymen, die während des Schneidens aus dem Acinargewebe freigesetzt werden. Auch die Dicke der Scheiben ist von entscheidender Bedeutung. Für Calciumdynamik und elektrophysiologische Experimente werden in der Regel 140 μm Scheiben geschnitten; Gemäß dem Ziel der Studie kann die Schichtdicke jedoch zwischen 90 μm und 200 μm liegen. Denken Sie daran, dass in dickeren Scheiben die Diffusion von Sauerstoff und Nährstoffen begrenzt ist, aber sie werden mehr Gewebe enthalten. Darüber hinaus ist zu erwarten, dass der Anteil der ungeschnittenen Inseln mit zunehmender Schichtdicke zunimmt. Scheiben können in einem regelmäßig ausgetauschten ECS bei Raumtemperatur für mehrere Stunden gelagert oder sogar in einem geeigneten Zellmedium für mehrere Tage kultiviert werden; Dies kann jedoch letztendlich die normale Physiologie der Inselzellenbeeinflussen 3,22.
Achten Sie bei der Herstellung der Farbstofflösung auf eine sorgfältige Mischung aller Komponenten und vermeiden Sie die Exposition gegenüber Umgebungslicht. Die Pankreasscheibe besteht aus vielen Zellschichten, und die Aufnahme von Kalziumfarbstoff ist auf die ersten oberflächlichsten Zellschichten beschränkt, wie zuvor für isolierte Inseln 58,68 und Hypophysenscheiben 69 beschrieben. Im Gegensatz zu isolierten Inseln, bei denen die umgebenden Kapsel- und äußeren Zellschichten das Eindringen des Farbstoffs in tiefere Schichten behindern, ermöglichen Gewebeschnitte jedoch den Zugang zur gesamten Querschnittsoberfläche der Insel, wodurch die gleichzeitige Messung der Kalziumdynamik in Hunderten von Zellen aus allen Schichten einer Insel ermöglicht wird. Fluoreszierende Ca2+ Indikatoren werden am häufigsten zur Messung der Kalziumdynamik verwendet und ermöglichen zusammen mit CLSM Aufnahmen mit hoher zeitlicher Auflösung, die mehrere hundert Hertz erreichen. Berücksichtigen Sie bei der Auswahl des am besten geeigneten fluoreszierenden Ca 2+-Indikators verschiedene Faktoren, einschließlich der Indikatorform, die die Zelllademethode beeinflusst, des Messmodus (qualitativ oderquantitativ) und der Dissoziationskonstante (K d), die im interessierenden Konzentrationsbereich von Ca 2+ liegen muss und vonpH-Wert, Temperatur, Vorhandensein von Mg2+ und anderen Ionen abhängt. sowie Proteinbindung. Da zelluläre Ca2+ Signale in der Regel transient sind, sollte auch die Ca2+ Bindungsratenkonstante berücksichtigt werden. Zur Messung der [Ca2+]IC-Dynamik in Pankreaszellen verwendet diese Gruppe hauptsächlich den in diesem Protokoll beschriebenen zelldurchlässigen Ca2+-Indikatorfarbstoff (Table of Materials), da es sich um einen langwelligen Indikator mit den Emissionswellenlängen im Spektrum handelt, in dem die zelluläre Autofluoreszenz normalerweise weniger problematisch ist und die Energie des Anregungslichts gering ist, was das Potenzial für zelluläre Photoschäden verringert. Da dieser Farbstoff bei niedrigen Ca 2+ Konzentrationen fluoreszierend ist, erleichtert dies die Bestimmung der Baseline [Ca2+]IC und erhöht die zelluläre Sichtbarkeit vor der Stimulation. Nach der Bindung von Ca 2+ erhöht sich die Fluoreszenzintensität des Farbstoffs um das 14-fache, so dass selbst geringfügige Änderungen in [Ca2+]IC nachgewiesen werden können.
Für eine erfolgreiche Lebendzell-Kalziumbildgebung müssen mehrere entscheidende Hardwareparameter berücksichtigt werden, wie im Protokollabschnitt beschrieben. Für die Lebendzellbildgebung, bei der die Signalamplituden niedrig und die Wahrscheinlichkeit einer Phototoxizität hoch sind, werden vorzugsweise Objektive mit einem höheren NA verwendet, um mehr Licht von der Probe zu sammeln. Wenn die Kalziumdynamik mit einer hohen zeitlichen Auflösung aufgezeichnet werden muss, verwenden Sie den Resonanzscanner anstelle von linearen Galvanometern. Neben der Wahl des richtigen Objektivs vermeidet die Verwendung hochempfindlicher Detektoren - wie Hybriddetektoren, die weniger Laserleistung benötigen - Phototoxizität und Photobleiche. Dies ist von besonderer Bedeutung für die langanhaltende Kalziumbildgebung. Weitere wichtige Schritte in der Kalziumbildgebung sind Parametereinstellungen der Bildqualität für Zeitreihenaufnahmen. Die wichtigsten sind die zeitliche und die räumliche Auflösung. Da die Kalziumdynamik per se die niedrigste akzeptable zeitliche Auflösung bestimmt, muss die Abtastrate mindestens doppelt so hoch sein wie die erwartete Signalfrequenz, um das Signal zu erkennen, oder sogar 10-mal höher, um die Form des Signals zuverlässig zu erkennen. In akuten Pankreasgewebeschnitten kann die Kalziumdynamik in Hunderten von Zellen gleichzeitig gemessen werden und daher ist auch die räumliche Auflösung wichtig. Dies kann durch Erhöhen der Anzahl der Pixel oder durch Erhöhen der Zeilenmittelung während der Live-Erfassung verbessert werden. Aufgrund der umgekehrten Beziehung zwischen der räumlichen und der zeitlichen Auflösung ist jedoch ein Kompromiss zwischen beiden Einstellungen erforderlich.
Wenn die Kalziumbildgebung in einer bestimmten Zellpopulation innerhalb der Bauchspeicheldrüse durchgeführt werden muss, ist ein Stimulus erforderlich, der in der Lage ist, die Zellen innerhalb der Scheibe funktionell zu differenzieren. Hohe Glukose aktiviert zuverlässig und schnell Betazellen zu einem oszillierenden Muster, das einem erhöhten Kalziumspiegel überlagert ist und zwischen allen Zellen innerhalb einer Insel 32,58,70 stark synchronisiert ist. Die Betazellen sind der zahlreichste Zelltyp innerhalb einer Insel und befinden sich bei Mäusen hauptsächlich im Inselkern. Das gleiche Stimulationsprotokoll nimmt ab und ändert manchmal nicht merklich das Platzen in Alphazellen 30,32,58,70,71,72. Um Alphazellen funktionell zu unterscheiden, können niedrige (3 mM) Glukose, Glutamat oder Adrenalin verwendet werden, um ihre Frequenz oder basale [Ca 2+]IC 21,72,73,74,75 zu erhöhen. Sie repräsentieren 10-20% der Inselzellen und werden an der Inselperipherie1 detektiert. Delta-Zellen befinden sich auch an der Peripherie. Sie machen nur ~ 5% der Gesamtzahl der endokrinen Zellen auf einer Insel aus und sind typischerweise in 6 mM Glukose aktiv und reagieren auf Glukosestimulation mit einer erhöhten unregelmäßigen Berstaktivität von der Grundlinie oder einem leicht erhöhten Kalziumspiegelvon 1,32,71,76. Ghrelin kann zur spezifischen Stimulation von Deltazellen 21,77,78,79 in Calcium-Bildgebungsexperimenten verwendet werden. Protokolle für die spezifische funktionelle Identifizierung von PP- und Epsilon-Zellen müssen jedoch noch definiert werden. Darüber hinaus aktiviert 25 nM Acetylcholin zuverlässig Acinzellen in die Berstaktivität 35,80,81. Darüber hinaus können eine Reihe anderer Sekretagogen, wie Cerulein, Cholecystokinin und Carbamycholin, verwendet werden, um Kalziumreaktionen in Acinzellen 22,40,82,83 hervorzurufen.
Schließlich ruft 1 mM Chenodesoxycholsäure zuverlässig Kalziumreaktionen in duktalen Zellen in Gewebeschnitten hervor; Angiotensin II, ATP und einige andere Secretagogues können auch verwendet werden 11,23,84,85. Wenn eine funktionelle Identifizierung auf der Grundlage charakteristischer Reaktionen auf bestimmte Sekretagogene und Inhibitoren nicht ausreicht, können genetisch markierte Tiere31, transfizierte Zellen 73 oder Immunzytochemie zur Identifizierung verschiedener Zelltypeneingesetzt werden 9,22,71,86 . In den letzten Jahren wurde die Gewebeschnittmethode erfolgreich an menschliches Gewebe angepasst und eröffnete viele neue wichtige Forschungswege sowohl in der exokrinen41 als auch in der endokrinen Physiologie 9,36,37,39. Interessanterweise war eine detaillierte Beurteilung der Kalziumdynamik in menschlichen Inseln notorisch schwierig und muss noch genauer untersucht werden87. In Kombination mit fortschrittlicher konfokaler Mikroskopie hat die Pankreasgewebeschnittmethode viele neue Einblicke in die Kalziumdynamik in Mäusen ermöglicht und wird hoffentlich dasselbe für menschliches Gewebe tun.
Offenlegungen
Die Autoren erklären, dass die Forschung ohne kommerzielles oder finanzielles Interesse durchgeführt wurde.
Danksagungen
Die in dieser Studie vorgestellte Arbeit wurde von der slowenischen Forschungsagentur finanziell unterstützt (Forschungskernfinanzierung Nr. P3-0396 und I0-0029, sowie Forschungsprojekte Nr. J3-9289, N3-0048 und N3-0133) und vom Fonds zur Förderung der Wissenschaftlichen Forschung (bilaterale Zuschüsse I3562--B27 und I4319--B30). Wir danken Maruša Rošer, Maša Čater und Rudi Mlakar für die hervorragende technische Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Analytical balance KERN ALJ 120-4 | KERN & SOHN GmbH | ALJ 160-4A | |
| Confocal microscope Leica TCS SP5 II Upright setup | Leica | 5100001578 | |
| Confocal microscope Leica TCS SP5 AOBS Tandem II setup | Leica | ||
| Cork pad 15 cm x 15 cm | |||
| Corning 15 mL centrifuge tubes | Merck KGaA, Darmstadt, Germany | CLS430790 | |
| Corning Round Ice Bucket with Lid, 4 L | Fischer Scientific, Leicestershire, UK | 432124 | |
| Double edge razor blade | Personna, USA | ||
| Dumont #5 - Fine Forceps | FST, Germany | 11254-20 | |
| Eppendorf Safe-Lock Tubes 0.5 mL | Eppendorf | 0030 121.023 | |
| Erlenmeyer flask 200 mL | IsoLab, Germany | 027.01.100 | |
| Fine Scissors - ToughCut | FST, Germany | 14058-11 | |
| Flat orbital shaker IKA KS 260 basic | IKA | Ident. No.: 0002980200 | |
| Glass lab bottle 1000 mL | IsoLab, Germany | 091.01.901 | |
| Hartman Hemostat, curved | FST, Germany | 13003-10 | |
| HCX APO L 20x/1.00 W HCX APO L (water immersion objective, 20x, NA 1.0) | Leica | 15507701 | |
| Measuring cylinder 25 mL | IsoLab, Germany | 015.01.025 | |
| Micromanipulator Control box SM-7, Keypad SM-7 | Luigs & Neumann | 200-100 900 7311, 200-100 900 9050 | |
| Microwave owen | Gorenje, Slovenia | MO20MW | |
| Osmometer Gonotec 010 | Gonotec, Berlin, Germany | OSMOMAT 010 Nr. 01-02-20 | |
| Paint brush | Faber-Castell, No.2 | Any thin soft round paint brush No.2, preferably black | |
| Paper towels | |||
| Perifusion pumps | Ismatec | ISM 827 | Reglo Analog MS - 4/8 |
| Petri dish 100/20 mm | Sarstedt | 83.3902 | |
| Petri dish 35/10 mm | Greiner bio-one | 627102 | |
| Petri dish 35 x 10 mm Nunclon Delta | Thermo Fischer Scientific, Waltham, MA USA | 153066 | NON-STICKY for agarose blocks |
| pH meter inoLab pH Level 1 | WTW, Weilheim, Germany | E163694 | |
| Pipette 1000 mL | Eppendorf | 3121 000.120 | |
| Pipette 50 mL | Eppendorf | 3121 000.066 | |
| Push pins 23 mm | Deli, Ningbo, China | E0021 | |
| Screw cap tube, 15 mL | Sarstedt | 62.554.502 | |
| Semken Forceps | FST, Germany | 11008-13 | |
| Stabilizing ring for Erlenmeyer flask | IsoLab, Germany | 027.11.048 | |
| Stereomicroscope Nikon SMZ 745 | Nikon, Melville, NY USA | ||
| Syringe Injekt Solo 5 mL | Braun, Melsungen, Germany | 4606051V | |
| Syringe needle 0.30 x 12 mm (30 G x 1/2") | Braun, Melsungen, Germany | 4656300 | |
| Temperature controller | Luigs & Neumann | 200-100 500 0150, 200-150-500-145 | Slice mini chamber, Temperature controller TC 07 |
| Tubings for perifusion system | Ismatec | SC0310 | Ismatec Pharmed 1.14 mm(ID) + silicone tubing 1.0 (ID) x 1.8 mm(OD) |
| Ultrasonic bath Studio GT-7810A | Globaltronics | ||
| Vibrotome Leica VT 1000 S | Leica, Nussloch, Germany | 14047235613 | |
| Volumetric flask 1000 mL | IsoLab, Germany | 013.01.910 | |
| Vortex mixer Neolab 7-2020 | Neolab | 7-2020 | |
| Water bath Thermo Haake open-bath circulator | Thermo Fisher Scientific | Z527912 | |
| Material/Reagent | |||
| Calcium chloride dihydrate - CaCl2.2H2O | Sigma Aldrich, Germany | C5080-500G | |
| D-(+)-glucose | Sigma Aldrich, Germany | G8270-1KG | |
| Dimethyl sulfoxide | Sigma Aldrich | D4540-100ML | |
| DL-lactic acid | Sigma Aldrich, Germany | L1250-500ML | |
| Dulbecco’s Phosphate Buffered Saline | Merck KGaA, Darmstadt, Germany | D8662-500ML | |
| Gas mixture containing 95% O2 and 5% CO2 at barometric pressure | |||
| Glue Wekem sekundenkleber WK-110 | Wekem GmbH, Bergkamen, Germany | WK 110-020 | |
| HEPES | Sigma Aldrich, Germany | H3375-250G | |
| L-(+)-ascorbic acid | Sigma Aldrich, Germany | A9,290-2 | |
| LIVE/DEAD Viability/Cytotoxicity Kit, for mammalian cells | Thermo Fischer Scientific, Waltham, MA USA | L3224 | |
| Magnesium chloride hexahydrate - MgCl2.2H2O | Sigma Aldrich, Germany | M2670-500G | |
| Myo-inositol | Sigma Aldrich, Germany | I5125-100G | |
| Oregon Green 488 BAPTA-1, AM | Invitrogen (Thermo FisherScientific) | O6807 | cell-permeable Ca2+ indicator (excitation/emission: 495/523 nm) |
| Pluronic F-127 (20% Solution in DMSO) | Invitrogen (Thermo Fisher Scientific) | P3000MP | polaxamer: nonionic triblock copolymer |
| Potassium chloride - KCl | Sigma Aldrich, Germany | 31248 | |
| SeaPlaque GTG agarose | Lonza, Rockland, USA | 50111 | |
| Sodium bicarbonate - NaHCO3 | Honeywell, Germany | 31437-500G | |
| Sodium chloride - NaCl | Honeywell, Germany | 31434-1KG | |
| Sodium hydroxide - NaOH | Sigma Aldrich, Germany | 30620 | |
| Sodium phosphate monobasic- NaH2PO4 | Sigma Aldrich, Germany | S0751-500G | |
| Sodium pyruvate | Sigma Aldrich, Germany | 15990-100G | |
| Software | |||
| FIJI | FIJI is an open source project | ||
| LASAF | Leica microsystems, Inc. | ||
| Matlab | Mathworks | ||
| Python | Python Software Foundation | Python is an open source project |
Referenzen
- Dolensek, J., Rupnik, M. S., Stozer, A. Structural similarities and differences between the human and the mouse pancreas. Islets. 7 (1), e1024405(2015).
- Meneghel-Rozzo, T., Rozzo, A., Poppi, L., Rupnik, M. In vivo and in vitro development of mouse pancreatic ß-cells in organotypic slices. Cell and Tissue Research. 316 (3), 295-303 (2004).
- Rozzo, A., Meneghel-Rozzo, T., Delakorda, S. L., Yang, S. B., Rupnik, M. Exocytosis of insulin: in vivo maturation of mouse endocrine pancreas. Annals of the New York Academy of the Sciences. 1152, 53-62 (2009).
- Dolenšek, J., Pohorec, V., Rupnik, M. S., Stožer, A. Pancreas physiology, challenges in pancreatic pathology. IntechOpen. Seicean, A. , (2017).
- Williams, J. A. The nobel pancreas: a historical perspective. Gastroenterology. 144 (6), 1166-1169 (2013).
- Lacy, P. E., Kostianovsky, M. Method for the isolation of intact islets of Langerhans from the rat pancreas. Diabetes. 16 (1), 35-39 (1967).
- Williams, J. A., Korc, M., Dormer, R. L. Action of secretagogues on a new preparation of functionally intact, isolated pancreatic acini. American Journal of Physiology. 235 (5), 517-524 (1978).
- Peikin, S. R., Rottman, A. J., Batzri, S., Gardner, J. D. Kinetics of amylase release by dispersed acini prepared from guinea pig pancreas. American Journal of Physiology. 235 (6), E743-E749 (1978).
- Marciniak, A., et al. Using pancreas tissue slices for in situ studies of islet of Langerhans and acinar cell biology. Nature Protocols. 9 (12), 2809-2822 (2014).
- Skelin, M., Rupnik, M., Cencic, A. Pancreatic beta cell lines and their applications in diabetes mellitus research. Altex-Alternatives to Animal Experimentation. 27 (2), 105-113 (2010).
- Molnar, R., et al. Mouse pancreatic ductal organoid culture as a relevant model to study exocrine pancreatic ion secretion. Laboratory Investigation. 100 (1), 84-97 (2020).
- Rupnik, M. The physiology of rodent beta-cells in pancreas slices. Acta Physiologica (Oxford, England). 195 (1), 123-138 (2009).
- Blinman, T. A., et al. Activation of pancreatic acinar cells on isolation from tissue: cytokine upregulation via p38 MAP kinase. American Journal of Physiology. Cell Physiology. 279 (6), C1993-C2003 (2000).
- Speier, S., Rupnik, M. A novel approach to in situ characterization of pancreatic ß-cells. Pflügers Archive: European Journal of Physiology. 446 (5), 553-558 (2003).
- Gilon, P., Jonas, J., Henquin, J. Culture duration and conditions affect the oscillations of cytoplasmic calcium concentration induced by glucose in mouse pancreatic islets. Diabetologia. 37 (10), 1007-1014 (1994).
- Huang, C., Gu, G. Effective isolation of functional islets from neonatal mouse pancreas. Journal of Visualized Experiments: JoVE. (119), e55160(2017).
- Szot, G. L., Koudria, P., Bluestone, J. A. Murine pancreatic islet isolation. Journal of Visualized Experiments: JoVE. (7), e255(2007).
- Qi, M., et al. Human pancreatic islet isolation: Part I: digestion and collection of pancreatic tissue. Journal of Visualized Experiments: JoVE. (27), e1125(2009).
- Qi, M., et al. Human pancreatic islet isolation: Part II: purification and culture of human islets. Journal of Visualized Experiments: JoVE. (27), e1343(2009).
- Stull, N. D., Breite, A., McCarthy, R., Tersey, S. A., Mirmira, R. G. Mouse islet of Langerhans isolation using a combination of purified collagenase and neutral protease. Journal of Visualized Experiments: JoVE. (67), e4137(2012).
- Hamilton, A., Vergari, E., Miranda, C., Tarasov, A. I. Imaging calcium dynamics in subpopulations of mouse pancreatic islet cells. Journal of Visualized Experiments: JoVE. (153), (2019).
- Marciniak, A., Selck, C., Friedrich, B., Speier, S. Mouse pancreas tissue slice culture facilitates long-term studies of exocrine and endocrine cell physiology in situ. PLoS ONE. 8 (11), e78706(2013).
- Gal, E., et al. A Novel in situ approach to studying pancreatic ducts in mice. Frontiers in Physiology. 10, 938(2019).
- Speier, S., Yang, S. B., Sroka, K., Rose, T., Rupnik, M. KATP-channels in beta-cells in tissue slices are directly modulated by millimolar ATP. Molecular and Cellular Endocrinology. 230 (1-2), 51-58 (2005).
- Speier, S., Gjinovci, A., Charollais, A., Meda, P., Rupnik, M. Cx36-mediated coupling reduces β-cell heterogeneity, confines the stimulating glucose concentration range, and affects insulin release kinetics. Diabetes. 56 (4), 1078-1086 (2007).
- Rose, T., Efendic, S., Rupnik, M. Ca2+-secretion coupling is impaired in diabetic Goto Kakizaki rats. The Journal of General Physiology. 129 (6), 493-508 (2007).
- Paulmann, N., et al. Intracellular serotonin modulates insulin secretion from pancreatic β-cells by protein serotonylation. PLoS Biology. 7 (10), e1000229(2009).
- Mandic, S. A., et al. Munc18-1 and Munc18-2 proteins modulate β-cell Ca2+ sensitivity and kinetics of insulin exocytosis differently. Journal of Biological Chemistry. 286 (32), 28026-28040 (2011).
- Dolensek, J., Skelin, M., Rupnik, M. S. Calcium dependencies of regulated exocytosis in different endocrine cells. Physiological Research. 60, S29-S38 (2011).
- Huang, Y. C., Rupnik, M., Gaisano, H. Y. Unperturbed islet α-cell function examined in mouse pancreas tissue slices. Journal of Physiology. 589 (2), 395-408 (2011).
- Huang, Y. C., et al. In situ electrophysiological examination of pancreatic α cells in the streptozotocin-induced diabetes model, revealing the cellular basis of glucagon hypersecretion. Diabetes. 62 (2), 519-530 (2013).
- Stožer, A., Dolenšek, J., Rupnik, M. S. Glucose-stimulated calcium dynamics in islets of Langerhans in acute mouse pancreas tissue slices. PLoS ONE. 8 (1), e54638(2013).
- Stožer, A., et al. Functional connectivity in islets of Langerhans from mouse pancreas tissue slices. PLoS Computational Biology. 9 (2), e1002923(2013).
- Dolenšek, J., Stožer, A., Skelin Klemen, M., Miller, E. W., Slak Rupnik, M. The relationship between membrane potential and calcium dynamics in glucose-stimulated beta cell syncytium in acute mouse pancreas tissue slices. PLoS ONE. 8 (12), e82374(2013).
- Perc, M., Rupnik, M., Gosak, M., Marhl, M. Prevalence of stochasticity in experimentally observed responses of pancreatic acinar cells to acetylcholine. Chaos. 19 (3), 037113(2009).
- Qadir, M. M. F., et al. Long-term culture of human pancreatic slices as a model to study real-time islet regeneration. Nature Communications. 11 (1), 3265-3265 (2020).
- Panzer, J. K., et al. Pancreas tissue slices from organ donors enable in situ analysis of type 1 diabetes pathogenesis. JCI Insight. 5 (8), e134525(2020).
- Cohrs, C. M., et al. Vessel network architecture of adult human islets promotes distinct cell-cell interactions in situ and is altered after transplantation. Endocrinology. 158 (5), 1373-1385 (2017).
- Cohrs, C. M., et al. Dysfunction of persisting beta cells is a key feature of early type 2 diabetes pathogenesis. Cell Reports. 31 (1), 107469(2020).
- Dolai, S., et al. Pancreatitis-induced depletion of syntaxin 2 promotes autophagy and increases basolateral exocytosis. Gastroenterology. 154 (6), 1805-1821 (2018).
- Liang, T., et al. Ex vivo human pancreatic slice preparations offer a valuable model for studying pancreatic exocrine biology. Journal of Biological Chemistry. 292 (14), 5957-5969 (2017).
- Panzer, J. K., Cohrs, C. M., Speier, S. Using pancreas tissue slices for the study of islet physiology. Methods in Molecular Biology. 2128, 301-312 (2020).
- Klemen, M., Dolenšek, J., Stožer, A., Rupnik, M. Exocytosis Methods. Thorn, P. 7, Humana Press. 127-146 (2014).
- Speier, S. Experimental approaches for high-resolution in vivo imaging of islet of Langerhans biology. Current Diabetes Reports. 11 (5), 420-425 (2011).
- Leibiger, I. B., Berggren, P. O. Intraocular in vivo imaging of pancreatic islet cell physiology/pathology. Molecular Metabolism. 6 (9), 1002-1009 (2017).
- Reissaus, C. A., et al. A Versatile, portable intravital microscopy platform for studying beta-cell biology in vivo. Scientific Reports. 9 (1), 8449(2019).
- Jacob, S., et al. In vivo Ca(2+) dynamics in single pancreatic beta cells. FASEB Journal. 34 (1), 945-959 (2020).
- Fernandez, J., Valdeolmillos, M. Synchronous glucose-dependent [Ca2+]i oscillations in mouse pancreatic islets of Langerhans recorded in vivo. FEBS Letters. 477 (1-2), 33-36 (2000).
- Almaca, J., Weitz, J., Rodriguez-Diaz, R., Pereira, E., Caicedo, A. The pericyte of the pancreatic islet regulates capillary diameter and local blood flow. Cell Metabolism. 27 (3), 630-644 (2018).
- Weitz, J. R., et al. Mouse pancreatic islet macrophages use locally released ATP to monitor beta cell activity. Diabetologia. 61 (1), 182-192 (2018).
- Tian, G., Sandler, S., Gylfe, E., Tengholm, A. Glucose- and hormone-induced cAMP oscillations in α- and β-cells within intact pancreatic islets. Diabetes. 60 (5), 1535-1543 (2011).
- Benninger, R. K., Zhang, M., Head, W. S., Satin, L. S., Piston, D. W. Gap junction coupling and calcium waves in the pancreatic islet. Biophysical Journal. 95 (11), 5048-5061 (2008).
- Santos, R. M., et al. Widespread synchronous Ca oscillations due to bursting electrical activity in single pancreatic islets. Pflügers Archive: European Journal of Physiology. 418 (4), 417-422 (1991).
- terk, M., et al. Assessing the origin and velocity of Ca2+ waves in three-dimensional tissue: Insights from a mathematical model and confocal imaging in mouse pancreas tissue slices. Communications in Nonlinear Science and Numerical Simulation. 93, 105495(2021).
- Gosak, M., et al. Critical and supercritical spatiotemporal calcium dynamics in beta cells. Frontiers in Physiology. 8, 1106(2017).
- Satin, L. S., Butler, P. C., Ha, J., Sherman, A. S. Pulsatile insulin secretion, impaired glucose tolerance and type 2 diabetes. Molecular Aspects in Medicine. 42, 61-77 (2015).
- Tengholm, A., Gylfe, E. Oscillatory control of insulin secretion. Molecular and Cellular Endocrinology. 297 (1-2), 58-72 (2009).
- Quesada, I., et al. Glucose induces opposite intracellular Ca2+ concentration oscillatory patterns in identified α- and β-cells within intact human islets of Langerhans. Diabetes. 55 (9), 2463-2469 (2006).
- Ferguson, J., Allsopp, R. H., Taylor, R. M., Johnston, I. D. Isolation and long term preservation of pancreatic islets from mouse, rat and guinea pig. Diabetologia. 12 (2), 115-121 (1976).
- Andersson, A. Isolated mouse pancreatic islets in culture: effects of serum and different culture media on the insulin production of the islets. Diabetologia. 14 (6), 397-404 (1978).
- Ramirez-Dominguez, M. Isolation of mouse pancreatic islets of Langerhans. Advances in Experimental Medicine and Biology. 938, 25-34 (2016).
- Carter, J., Dula, S., Corbin, K., Wu, R., Nunemaker, C. A practical guide to rodent islet isolation and assessment. Biological Procedures Online. 11 (1), 3-31 (2009).
- Daoud, J., Rosenberg, L., Tabrizian, M. Pancreatic islet culture and preservation strategies: advances, challenges, and future outlook. Cell Transplantation. 19 (12), 1523-1535 (2010).
- Zawalich, W. S., Yamazaki, H., Zawalich, K. C. Biphasic insulin secretion from freshly isolated or cultured, perifused rodent islets: comparative studies with rats and mice. Metabolism. 57 (1), 30-39 (2008).
- Roe, M. W., et al. Absence of effect of culture duration on glucose-activated alterations in intracellular calcium concentration in mouse pancreatic islets. Diabetologia. 38, 876-877 (1995).
- Shuai, H., Xu, Y., Yu, Q., Gylfe, E., Tengholm, A. Fluorescent protein vectors for pancreatic islet cell identification in live-cell imaging. Pflügers Archive. European Journal of Physiology. 468 (10), 1765-1777 (2016).
- Dolenšek, J., et al. Glucose-dependent activation, activity, and deactivation of beta cell networks in acute mouse pancreas tissue slices. bioRxiv. , (2020).
- QZhang, Q., et al. Cell coupling in mouse pancreatic beta-cells measured in intact islets of Langerhans. Philosophical Transactions. Series A, Mathematical, Physical, and Engineering Sciences. 366 (1880), 3503-3523 (2008).
- Sánchez-Cárdenas, C., Hernández-Cruz, A. GnRH-induced Ca2+-signalling patterns in mouse gonadotrophs recorded from acute pituitary slices in vitro. Neuroendocrinology. 91 (3), 239-255 (2010).
- Asada, N., Shibuya, I., Iwanaga, T., Niwa, K., Kanno, T. Identification of alpha- and beta-cells in intact isolated islets of Langerhans by their characteristic cytoplasmic Ca2+ concentration dynamics and immunocytochemical staining. Diabetes. 47 (5), 751-757 (1998).
- Nadal, A., Quesada, I., Soria, B. Homologous and heterologous asynchronicity between identified α-, β- and δ-cells within intact islets of Langerhans in the mouse. Journal of Physiology. 517 (1), 85-93 (1999).
- Shuai, H., Xu, Y., Yu, Q., Gylfe, E., Tengholm, A. Fluorescent protein vectors for pancreatic islet cell identification in live-cell imaging. Pflugers Archive: European Journal of Physiology. 468 (10), 1765-1777 (2016).
- Cabrera, O., et al. Glutamate is a positive autocrine signal for glucagon release. Cell Metabolism. 7 (6), 545-554 (2008).
- Li, J., et al. Submembrane ATP and Ca2+ kinetics in α-cells: unexpected signaling for glucagon secretion. FASEB Journal. 29 (8), 3379-3388 (2015).
- Hamilton, A., et al. Adrenaline stimulates glucagon secretion by Tpc2-dependent Ca(2+) mobilization from acidic stores in pancreatic α-cells. Diabetes. 67 (6), 1128-1139 (2018).
- Arrojo, E. D. R., et al. Structural basis for delta cell paracrine regulation in pancreatic islets. Nature Communications. 10 (1), (2019).
- DiGruccio, M. R., et al. Comprehensive alpha, beta and delta cell transcriptomes reveal that ghrelin selectively activates delta cells and promotes somatostatin release from pancreatic islets. Molecular Metabolism. 5 (7), 449-458 (2016).
- Adriaenssens, A. E., et al. Transcriptomic profiling of pancreatic alpha, beta and delta cell populations identifies delta cells as a principal target for ghrelin in mouse islets. Diabetologia. 59 (10), 2156-2165 (2016).
- Rorsman, P., Huising, M. O. The somatostatin-secreting pancreatic δ-cell in health and disease. Nature reviews. Endocrinology. 14 (7), 404-414 (2018).
- Petersen, C. C., Toescu, E. C., Petersen, O. H. Different patterns of receptor-activated cytoplasmic Ca2+ oscillations in single pancreatic acinar cells: dependence on receptor type, agonist concentration and intracellular Ca2+ buffering. The EMBO journal. 10 (3), 527-533 (1991).
- Thorn, P., Lawrie, A. M., Smith, P. M., Gallacher, D. V., Petersen, O. H. Local and global cytosolic Ca2+ oscillations in exocrine cells evoked by agonists and inositol trisphosphate. Cell. 74 (4), 661-668 (1993).
- Behrendorff, N., Floetenmeyer, M., Schwiening, C., Thorn, P. Protons released during pancreatic acinar cell secretion acidify the lumen and contribute to pancreatitis in mice. Gastroenterology. 139 (5), e1711-e1715 (2010).
- Criddle, D. N., et al. Cholecystokinin-58 and cholecystokinin-8 exhibit similar actions on calcium signaling, zymogen secretion, and cell fate in murine pancreatic acinar cells. American Journal of Physiology. Gastrointestinal and Liver Physiology. 297 (6), G1085-G1092 (2009).
- Venglovecz, V., et al. Effects of bile acids on pancreatic ductal bicarbonate secretion in guinea pig. Gut. 57 (8), 1468-3288 (2008).
- Maleth, J., Hegyi, P. Calcium signaling in pancreatic ductal epithelial cells: an old friend and a nasty enemy. Cell Calcium. 55 (6), 337-345 (2014).
- Nadal, A., Quesada, I., Soria, B. Homologous and heterologous asynchronicity between identified alpha-, beta- and delta-cells within intact islets of Langerhans in the mouse. Journal of Physiology. 517 (Pt 1), 85-93 (1999).
- Skelin Klemen, M., Dolenšek, J., Slak Rupnik, M., Stožer, A. The triggering pathway to insulin secretion: Functional similarities and differences between the human and the mouse β cells and their translational relevance. Islets. 9 (6), 109-139 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten