Method Article
Akut Fare Pankreas Doku Dilimlerinde Kalsiyum Dinamiğinin Konfokal Lazer Tarama Mikroskopisi
Bu Makalede
Özet
Akut pankreas doku dilimlerinin hazırlanmasını ve konfokal lazer tarama mikroskobunda kullanımını, kalsiyum dinamiklerini aynı anda çok sayıda canlı hücrede, uzun zaman periyotlarında ve yüksek uzaysal zamansal çözünürlükte incelemek için sunuyoruz.
Özet
Akut fare pankreas doku dilimi, tipik in vitro çalışmalarda tarif edilen izole adacıklardan, acini, kanallardan veya dağınık hücrelerden önemli ölçüde daha az preparat kaynaklı değişiklik gerektiren, korunmuş hücreler arası iletişim ve doku mimarisi ile benzersiz bir in situ preparattır. Konfokal lazer tarama mikroskobunda (CLSM) akut pankreas doku dilimini canlı hücreli kalsiyum görüntüleme ile birleştirerek, kalsiyum sinyalleri aynı anda çok sayıda endokrin ve ekzokrin hücrede, tek hücreli veya hatta hücre altı çözünürlükte incelenebilir. Duyarlılık, değişikliklerin tespitine izin verir ve hücreler arası dalgaların ve fonksiyonel bağlantının incelenmesinin yanı sıra, hücrelerin fizyolojik tepkilerinin adacık içindeki lokalizasyonlarına ve diğer hücrelerle parakrin ilişkilerine bağımlılığının incelenmesini sağlar. Son olarak, hayvan refahı perspektifinden, bir seferde çok sayıda hücreden gelen sinyallerin kaydedilmesi, deneylerde gerekli olan hayvan sayısını azaltarak 3R-değiştirme, azaltma ve arıtma ilkesine katkıda bulunur.
Giriş
Memeli pankreası büyük bir ekzokrin ve endokrin bezdir. Ekzokrin kısım toplam pankreas hacminin% 96-99'unu oluşturur ve acini ve kanallardan oluşur. Endokrin kısım, toplam pankreas hacmi1'in kalan% 1-4'ünü oluşturan çok sayıda Langerhans adacığından oluşur. Ekzokrin kısım, gıdalardaki enerji bakımından zengin polimerleri parçalayan başlıca sindirim enzimlerini ve ayrıca enzimlerin etkisine uygun bir ortam sağlamak için diğer gastrointestinal sekresyonlarla birleşen bikarbonat bakımından zengin bir sıvı salgılar. Endokrin kısım, enerji açısından zengin besinlerin postprandiyal dağılımını, depolanmasını ve interprandiyal salınımını düzenleyen hormonları salgılar. Ekzokrin doku nispeten az gelişmiş ve endokrin doğumda nispeten iyi gelişmiş olmasına rağmen, birincisi 2,3,4 sütten kesildikten sonra ikincisini hızla büyütür. Pankreas fonksiyonunun erken çalışmaları modern fizyolojinin doğuşuna işaret etmiştir ve alandaki başlıca metodolojik ilerlemeleri büyük bilimsel kırılma alanları izlemiştir5. Pankreasla çalışmak, bezin karmaşık yapısı nedeniyle teknik olarak zordur, ancak halk sağlığı için büyük tehditler oluşturan ve yeni terapötik yaklaşımlara ihtiyaç duyulan pankreas kanseri, pankreatit ve diyabet gibi hastalıklar nedeniyle de büyük bir motivasyondur.
İzole adacıklar6, acini7,8 ve duktal fragmanlar, hücre hatları ve primer dağılmış endokrin, asinar ve duktal hücreler 9,10 ile karşılaştırıldığında avantajları nedeniyle on yıllardır altın standart yöntemler olarak geliştirilmiş ve kullanılmıştır. İzole hücre kolektiflerinin belirgin şekilde geliştirilmiş fonksiyonuna rağmen, bu yöntemler hala önemli mekanik ve enzimatik stres içerir, hücreleri çevreleyen dokudan izole eder ve bu nedenle parakrin etkileşimlerinden ve mekanik destekten yoksundur ve en önemlisi, normal fizyolojide önemli değişiklikler eşlik eder11,12,13 . Akut fare pankreas doku dilimi, 2001 yılında, korunmuş hücreler arası temaslar, parakrin etkileşimleri, mezenkim ve doku mimarisi ile beyin, hipofiz ve adrenal dilimlere benzer deneysel bir platform geliştirme ihtiyacından ve aynı zamanda o zamanın adacık araştırmalarında altın standart yöntemin en önemli eksikliklerinden bazıları olmadan geliştirilmiştir - izole adacıklar12, 14. Bu eksiklikler arasında en dış katmanların zarar görmesi, çekirdek adacık alanlarının erişilememesi ve hücre kimliği ve fizyolojisi üzerinde muhtemelen önemli etkileri olan yetiştirme ihtiyacıbulunmaktadır 12,15. Ayrıca, doku dilimi yöntemi, adacıkları izole etmenin imkansız olduğu veya adacık veriminin geleneksel izolasyon 16,17,18,19,20,21 ile son derece düşük olduğu durumlarda, büyük ölçüde dengesiz adacık mimarisine sahip hayvan modelleri üzerinde çalışmalara olanak tanır.
Ek olarak, dilim, örneğin diyabet ve pankreatit gelişimi sırasında morfolojik değişiklikleri incelemek için daha uygundur, çünkü tüm dokuya daha iyi bir genel bakış sağlar ve ayrıca bölgesel farklılıkları incelemekle de uyumludur. Önemli olarak, endokrin kısma erken odaklanılmasına rağmen, doku dilimleme yöntemi doğal olarak ekzokrin bileşenlerin incelenmesini sağlar 9,22,23. Kullanılmaya başlanmasından sonraki ilk on yıl boyunca, yöntem beta 14,24,25,26,27,27,28,29 ve alfa 30,31 hücrelerinin elektrofizyolojik çalışmaları ve pankreasın morfolojik ve fonksiyonel olgunlaşmasını incelemek için kullanılmıştır 2,3 . On yıl sonra 2013 yılında, yöntem, glikoz32'ye yanıtlarını, fonksiyonelbağlantı modellerini 33 ve bir floresan kalsiyum boyasını membran potansiyel boya34 ile birleştirerek membran potansiyeli ile hücre içi kalsiyum arasındaki ilişkiyi karakterize etmek için CLSM kullanarak adacık hücrelerinin canlı hücre kalsiyum görüntülemesi için başarıyla uyarlanmıştır. Aynı yılın ilerleyen zamanlarında, yöntem22,35 asinar hücrelerinde kalsiyum dinamiklerini değerlendirmek için de kullanıldı. Takip eden yıllarda, pankreas dokusu dilimleri bir dizi farklı çalışmada kullanılmış ve domuz ve insan dokusuna başarıyla adapte edilmiştir 9,36,37,38,39,40,41. Bununla birlikte, birlikte ele alındığında, genel olarak fare pankreas dokusu dilimlerinde ve özellikle adacıklarda kalsiyum görüntüleme hala çoğunlukla bu grup tarafından gerçekleştirilmektedir. Bunun ana nedenlerinden biri, teknik olarak zorlu bir doku dilimi preparatının, konfokal mikroskop ihtiyacının ve oldukça karmaşık veri analizinin kombinasyonunda yatıyor olabilir. Bu makalenin temel amacı, bu güçlü yöntemi diğer potansiyel kullanıcılar için daha erişilebilir hale getirmektir.
Doku dilimi hazırlama ve yapısal ve sekresyon çalışmaları için dilimlerin kullanımı ile ilgili bazı mükemmel metodolojik makaleler zaten vardır, ancak konfokal kalsiyum görüntüleme 9,42,43 için değil. Bu nedenle, bu makale dilimlerin hazırlanması sırasında bazı ek ipuçları ve püf noktalarına, başarılı boya yüklemesi için kritik adımlara, görüntü elde etmeye ve ayrıca temel kalsiyum veri analizinin ana adımlarına odaklanmaktadır. Bu nedenle, bu katkı yukarıda belirtilen yönteme bir alternatif olarak değil, tamamlayıcı olarak görülmelidir. Benzer şekilde, fare pankreas dokusu dilimlerinde kalsiyum görüntüleme, belirli soruları cevaplamak için kullanılacak deneysel bir yaklaşım olarak görülmelidir ve bu nedenle pankreas fizyolojisindeki izole kanallar veya acini, izole adacıklar, organoidler, gözün ön odasına nakledilen adacıklar gibi diğer kalsiyum görüntüleme yaklaşımları için mutlak bir alternatif olmaktan ziyade tamamlayıcı niteliktedir. ve in vivo kayıtlar 11,44,45,46,47,48. Fare pankreas dokusu dilimlerinde kalsiyum görüntülemenin vaadi muhtemelen en iyi şekilde, perisitler49 ve makrofajlar50 gibi adacık mezenkimal hücrelerinde ve ayrıca duktal hücrelerde kalsiyum dinamiklerinin son zamanlarda başarılı bir şekilde kaydedilmesiyle gösterilmektedir23.
Protokol
NOT: Tüm deneyler, araştırmalarda hayvanların bakımı ve kullanımı için kurumsal kılavuzlara sıkı sıkıya bağlı kalınarak gerçekleştirilmiştir. Protokol, Slovenya Cumhuriyeti Gıda Güvenliği, Veterinerlik Sektörü ve Bitki Koruma İdaresi tarafından onaylanmıştır (izin numarası: 34401-35-2018/2).
1. Pankreas dokusu dilimlerinin hazırlanması
NOT: CLSM kullanılarak kalsiyum görüntüleme için akut fare pankreas doku dilimlerinin hazırlanması, bir dizi alet, farklı çözelti gerektirir ve şematik olarak Şekil 1'de sunulan ve aşağıda ayrıntılı olarak açıklanan bir dizi kritik adımda ilerler.
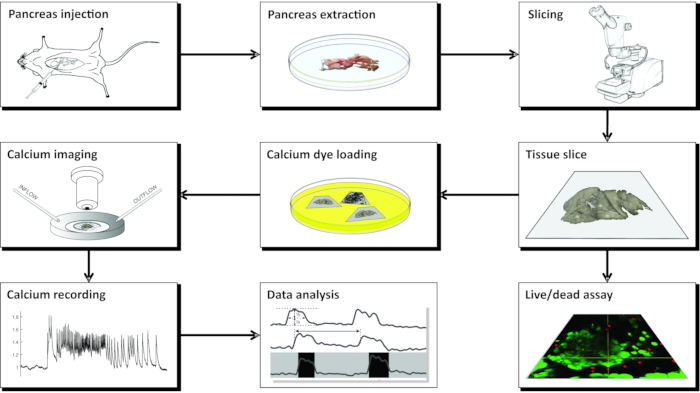
Şekil 1: İş akışı diyagramı. Pankreas dokusu dilimi hazırlama sürecindeki tüm adımların şematik gösterimi, agarozun ortak safra kanalına enjekte edilmesinden başlayarak, pankreasın çıkarılması ve dilimlenmesi ile takip edilir. Hazırlanan dilimler, Canlı / Ölü kiti ile dokunun canlılığını değerlendirmek veya bir kalsiyum sensörü ile boyanmak için kullanılabilir. Lekelendikten sonra görüntülemeye hazırdırlar. Görüntüleme işleminden elde edilen kayıtlar daha sonra veri analizi için kullanılır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Çözeltilerin hazırlanması
NOT: Tüm çözeltiler önceden hazırlanmalı ve buzdolabında 4-8 °C'de bir aya kadar saklanabilir. Doku dilimlerinin hazırlanması ve depolanması için, 6 mM glikoz ve 0.3 L 4-(2-hidroksietil)-1-piperazineetansülfonik asit (HEPES) tamponu ile yaklaşık 0.5 L hücre dışı çözelti (ECS) gereklidir. Perifüzyon sistemi 1-2 mL/dak debiye ayarlanmış 1 günlük kalsiyum görüntüleme için yaklaşık 0,5 L ECS gereklidir.- 6 mM glikozlu hücre dışı çözelti
- 125 mM NaCl, 26 mM NaHCO 3, 6 mM glikoz, 6 mM laktik asit,3 mM miyo-inositol, 2,5 mM KCl, 2 mM Na piruvat, 2 mM CaCl 2,1,25 mM NaH 2 PO4, 1 mM MgCl2ve 0,5 mM askorbik asit içeren 1 L ECS hazırlayın. Tüm malzemeler tamamen çözünene kadar iyice karıştırın. 0,5 mL'lik bir mikrosantrifüj tüpüne 50 μL ECS alın, üreticinin talimatlarına göre ozmometreye yerleştirin ve ozmolariteyi kontrol edin.
NOT: Ozmolarite 300-320 mOsm olmalıdır. Beta hücrelerinin uyarılması için, daha yüksek glikoz konsantrasyonlarına sahip çözeltiler kullanın. Dilimleme ve deneyler sırasında fizyolojik pH değerinin 7.4 olmasını sağlamak için, ECS'yi barometrik basınçta sürekli olarak karbojenle (yani,% 95O2 ve% 5 CO2'lik bir gaz karışımı) kabarcıklayın. Basit bir köpürme sistemi, 5 mm'lik bir silikon borunun bir ucunun karbonhidrat kaynağına (yani basınçlı bir gaz silindirine) ve borunun diğer ucunun doğrudan ECS içeren şişeye yerleştirilmesiyle kurulabilir. - Alternatif olarak, 1250 mM NaCl, 260 mM NaHCO3, 30 mM miyo-inositol, 25 mM KCl, 20 mM Na piruvat, 12,5 mM NaH2PO4 ve 5 mM askorbik asit içeren 10x stok hazırlayın. 6 mM glikoz içeren ECS'ye ihtiyaç duyulduğunda, stokun 100 mL'sini 2 mL 1 M CaCl 2, 1 mL'lik 1 M MgCl 2, 0.455 mL 13.2 M laktik asit ve 1.08 g glikoz ile karıştırın ve 1 L'ye kadar çift damıtılmış su ile doldurun. Gerekirse, diğer glikoz konsantrasyonlarını elde etmek için farklı miktarlarda glikoz kullanın.
- 125 mM NaCl, 26 mM NaHCO 3, 6 mM glikoz, 6 mM laktik asit,3 mM miyo-inositol, 2,5 mM KCl, 2 mM Na piruvat, 2 mM CaCl 2,1,25 mM NaH 2 PO4, 1 mM MgCl2ve 0,5 mM askorbik asit içeren 1 L ECS hazırlayın. Tüm malzemeler tamamen çözünene kadar iyice karıştırın. 0,5 mL'lik bir mikrosantrifüj tüpüne 50 μL ECS alın, üreticinin talimatlarına göre ozmometreye yerleştirin ve ozmolariteyi kontrol edin.
- 6 mM glikozlu HEPES tamponu
- 150 mM NaCl, 10 mM HEPES, 6 mM glikoz, 5 mM KCl, 2 mM CaCl 2 ve 1 mM MgCl2 içeren 0,5 L HEPES-tamponlu çözelti (HBS)hazırlayın; 1 M NaOH ile pH = 7.4'e titre eder.
NOT: Karbojen mevcut değilse, bu tampon ECS yerine tüm adımlar için kullanılabilir.
- 150 mM NaCl, 10 mM HEPES, 6 mM glikoz, 5 mM KCl, 2 mM CaCl 2 ve 1 mM MgCl2 içeren 0,5 L HEPES-tamponlu çözelti (HBS)hazırlayın; 1 M NaOH ile pH = 7.4'e titre eder.
- Agaroz (%1,9 w/w)
- Bir su banyosunu 40 ° C'ye ısıtın.
- Bir Erlenmeyer şişesine 0.475 g düşük erime noktalı agaroz ve 6 mM glikoz içeren 25 mL ECS ekleyin ve şişeyi kaynamaya başlayana kadar birkaç saniye boyunca maksimum güçte bir mikrodalga fırına yerleştirin. Şişeyi fırından çıkarın ve agaroz tamamen çözünene kadar birkaç kez döndürün. Şişeyi sıvı agaroz ile 40 ° C'de önceden ısıtılmış su banyosuna aktarın, agarozu istenen sıcaklığa soğutun ve enjeksiyona kadar sıvı halde tutun. Şişeyi stabilize edici bir kurşun halkayla sabitleyin.
NOT: Agaroz önceden hazırlanabilir ve buzdolabında saklanabilir. Kullanmadan önce, agarozu sıvılaşana kadar mikrodalga fırında ısıtın ve Erlenmeyer şişesini 40 ° C'ye kadar ısıtılmış bir su banyosuna aktarın. Agaroz 5x'e kadar tekrar kullanılabilir. 5x'in ötesinde tekrar kullanılırsa, yoğun hale gelir ve enjekte edilmesi zorlaşır.
- 6 mM glikozlu hücre dışı çözelti
- Agaroz ile pankreas enjeksiyonu
NOT: Bölüm 1.2 ve 1.3, kalsiyum görüntüleme, elektrofizyoloji, immünohistokimya, sekresyon çalışmaları ve yapısal/mikroanatomik çalışmalar gibi farklı deneysel amaçlar için kullanılabilecek doku dilimlerinin hazırlanmasını açıklamaktadır.- 5 mL'lik bir şırıngayı, 1.1.3.2 adımındaki su banyosundaki Erlenmeyer şişesinden sıvı agaroz ile doldurun, kabarcıkları çıkarın ve 30 G'lik bir iğne takın. İğneyi bir kapakla koruyun ve doldurulmuş şırıngayı su banyosunda, iğne aşağı bakacak şekilde ve su yüzeyinin altındaki tüm agaroz hacmi olacak şekilde saklayın. Şırıngayı, halkanın şırıngayı su banyosunun duvarına bastıracağı şekilde stabilize edici bir kurşun halka ile sabitleyin.
NOT: İğnenin içine herhangi bir agaroz itmemeye dikkat edin, çünkü hızlı bir şekilde sertleşir ve iğneyi tıkar. Oda sıcaklığı düşükse ve enjeksiyon daha az deneyimli bir kişi tarafından yapılırsa, enjeksiyon için biraz daha zaman kazanmak için su banyosunun sıcaklığını 42 ° C'ye kadar artırın. - Bir buz kovasını buzla doldurun ve içine ECS içeren şişeyi yerleştirin. Oksijenasyon ve 7,4 pH sağlamak için ECS'yi sürekli olarak 1,5 mL/dak'da barometrik basınçta ve oda sıcaklığında karbojenle kabarcıklayın.
- Yüksek konsantrasyonda CO2 uygulayarak ve ardından servikal çıkık uygulayarak bir fareyi feda edin. Hayvanların acı çekmesini en aza indirmek için tüm çabayı gösterin.
- Stereomikroskop altında çalışarak, laparotomi yoluyla karnına erişin (Şekil 2A). Ortak safra kanalını ortaya çıkarmak için bağırsağı yavaşça farenin sol tarafına (farenin anatomik perspektifinden) çevirin. Duodenal kısmı hafifçe kaldırmak için forseps kullanın ve Vater'in majör duodenal papilla-papilla'sını bulun. Agarozun kanaldan duodenuma sızmasını önlemek için bir hemostat kullanarak duodenal papilladaki ortak safra kanalını kelepçeleyin (Şekil 2B, C).
NOT: Duodenuma ve gastrointestinal sistemde daha yukarı ve aşağı agaroz sızıntısını önlemek için, hemostatı, duodenumu papilladan hem proksimal hem de distal olarak kelepçeleyecek şekilde yerleştirin. Bu amaçla kavisli bir hemostat kullanmak en iyisidir. - Küçük keskin forsepslerle, ortak safra kanalının altına ulaşın ve kanalı pankreas dokusuna bağlayan zarı kırın. Daha iyi görsel kontrol ve daha kolay enjeksiyon için, kanaldan mümkün olduğunca fazla yağ ve bağ dokusunu temizleyin.
- Kanalı dik olarak büyük forsepslere yerleştirin (Şekil 2D) ve hazırlanan sıvı agarozu ortak safra kanalının proksimal kısmına enjekte edin (Şekil 2D). Agaroz viskoz olduğu için şırıngayı sert bir şekilde sıktığınızdan emin olun. Pankreası beyazımsı ve hafifçe şişkin hale gelene kadar veya en az 20-30 s boyunca doldurmaya devam edin.
NOT: Bu, dilim hazırlamada en kritik adımdır. Pankreasın duktal ağacında herhangi bir kıvrılma varsa, pankreası düzleştirmek için şırıngadan yavaşça yükseltin veya çekin. Şırıngadan enjekte edilen hacme bağlı olarak enjeksiyonun ne zaman durdurulacağına karar vermeyin, çünkü enjeksiyon noktasındaki geri akış ve duodenuma ileri sızıntı tipik olarak pankreasın duktal ağacına enjekte edilen hacimden çok daha yüksektir. Önemli olarak, başarılı enjeksiyonlar, şırınga hacminde pratik olarak fark edilemeyen değişikliklerle gerçekleştirilebilir. - Şırıngayı çıkarın ve dokuyu soğutmak ve agarozu sertleştirmek için şişeden 0-4 ° C'de kabarcıklı buz gibi soğuk ECS'nin 20 mL'sini yavaşça pankreasın üzerine dökün.
- Forseps ve ince sert kesilmiş makas kullanarak pankreası nazikçe çıkarın. Çıkarılan pankreası ~ 40 mL buz gibi soğuk ECS içeren 100 mm'lik bir Petri kabına yerleştirin ve yıkamak için yavaşça hareket ettirin. Pankreası ~ 40 mL buz gibi soğuk ECS içeren taze bir 100 mm Petri kabına aktarın.
- Pankreasın beyazımsı görünen iyi enjekte edilmiş kısmından (Şekil 3A), forseps ve sert kesilmiş makas kullanarak 0.1-0.2cm3 büyüklüğünde 6 blok doku kesilir. Onları herhangi bir bağ ve yağ dokusundan temizleyin.
- 35 mm'lik yapışkan olmayan bir taban-Petri kabını 40 ° C'de yaklaşık 5 mL sıvı agaroz ile doldurun, doku bloklarını içine aktarın ve hemen Petri kabını soğutmak ve agarozu sertleştirmek için buzun üzerine koyun.
NOT: Pankreas bloklarının agarozda sıkışma şekli, dilimleme sırasında kesilme şeklini belirler. Deneyimli deneyciler, agarozun buz üzerine yerleştirildiğinde sertleşmesinden önceki birkaç dakika boyunca blokların konumuna ince ayar yapmayı deneyebilir ve ince ayar yapabilirler. - Doku blokları olan agaroz sertleştikten sonra, Petri kabını baş aşağı 100 mm'lik bir Petri kabının kapağı gibi düz pürüzsüz bir yüzeye çevirin ve Petri kabının yan duvarı ile agaroz arasındaki kenar boşluğuna bir tıraş bıçağının yarısı ile yavaşça keserek agarozu çıkarın. Bir tıraş bıçağı ile, her doku bloğunun agaroz ile çevrili olmasına dikkat ederek, her biri bir doku bloğu içeren ayrı ayrı agaroz küplerini kesin. Agaroz bloklarını vibratomun numune plakasına siyanoakrilat yapıştırıcı ile yapıştırın (Şekil 3B).
- 5 mL'lik bir şırıngayı, 1.1.3.2 adımındaki su banyosundaki Erlenmeyer şişesinden sıvı agaroz ile doldurun, kabarcıkları çıkarın ve 30 G'lik bir iğne takın. İğneyi bir kapakla koruyun ve doldurulmuş şırıngayı su banyosunda, iğne aşağı bakacak şekilde ve su yüzeyinin altındaki tüm agaroz hacmi olacak şekilde saklayın. Şırıngayı, halkanın şırıngayı su banyosunun duvarına bastıracağı şekilde stabilize edici bir kurşun halka ile sabitleyin.
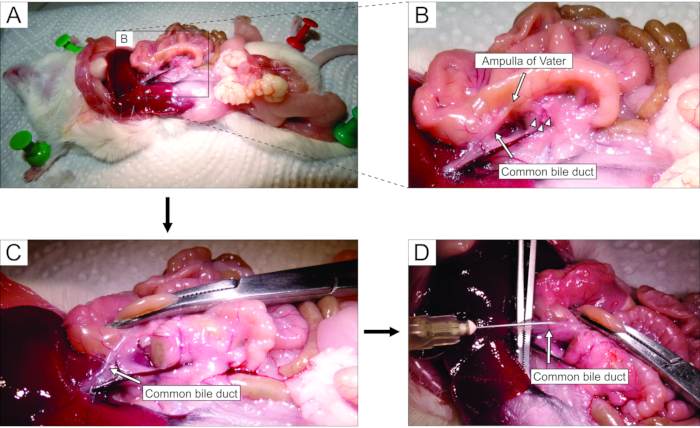
Şekil 2: Ortak safra kanalına agaroz enjeksiyonu . (A) Karın boşluğunu açın ve periton boşluğundaki organları açığa çıkarın. (B) A panelindeki dikdörtgenin çevrelediği alanın büyütülmüş kısmı. Duodenum üzerindeki beyaz nokta (okla gösterilir) Vater'in ampullasını gösterir. Langerhans adacıkları ok uçlarıyla gösterilir. (C) Vater'in ampullasını kavisli bir hemostatla kelepçeleyin ve ortak safra kanalını (ok) açığa çıkarmak ve hafifçe germek için hafifçe kaldırın. (D) Ortak safra kanalının kanülasyonu ve 5 mL'lik bir şırınga ve 30 G'lik bir iğne kullanılarak% 1.9 agaroz çözeltisinin enjeksiyonu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- Dilimleme
- Vibratomun kesme odasını ~ 0.15 L buz gibi soğuk ECS ile doldurun ve sürekli olarak karbonhidratla kabarcıklayın. Kesme odasını buzla çevreleyin ve kesme odasına 6 mM glikozlu ECS'den yapılmış 2 buz küpü (her biri ~ 10 mL) ekleyin. Vibratomu kesmek için tıraş bıçağını takın ve numune plakasını agaroz bloklarla yerine vidayla sabitleyin.
- Dilimleyiciyi, agaroz bloklarını 0,05 ila1 mm / s ve 70 Hz'de, yüzey alanı 20-100 mm2 olan 140 μm kalınlığında dilimler halinde kesmek üzere ayarlayın. Dilimleyici ayarları için üreticinin yönergelerini izleyin.
- Her kesme adımından hemen sonra, dilimleyiciyi duraklatın, dilimleri ince bir boya fırçasıyla nazikçe toplayın ve oda sıcaklığında 6 mM glikozlu 40 mL HEPES tamponu ile doldurulmuş 100 mm'lik bir Petri kabına aktarın (Şekil 3C).
NOT: Dilimler oda sıcaklığında HEPES tamponunda en az 12 saat tutulabilir ve tampon her 2 saatte bir değiştirilmelidir.
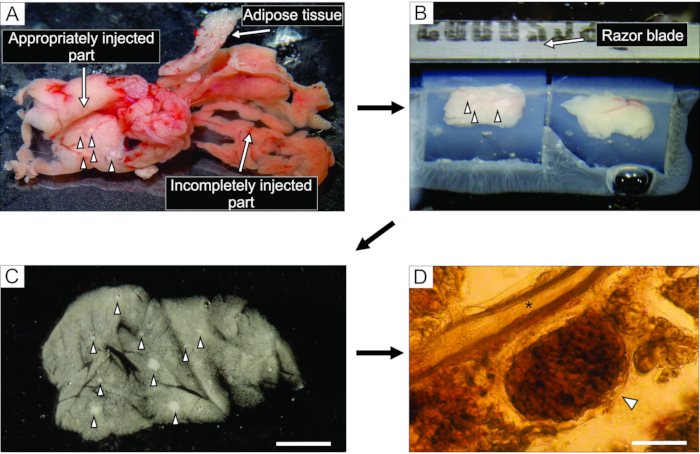
Şekil 3: Pankreas dokusunun hazırlanması ve dilimlenmesi . (A) Agaroz enjeksiyonundan sonra ekstrakte edilen fare pankreası. Soldaki beyaz doku iyi enjekte edilmiş bir kısmı (duodenum kısmı) gösterirken, sağdaki daha kırmızımsı kısım pankreasın yetersiz enjekte edilen kısmını (dalak kısmı) gösterir. (B) Agaroz içine gömülü iki pankreas dokusu bloğunun vibratom dilimlenmesi. (C) Ok uçlarıyla gösterilen Langerhans adacıkları ile akut pankreas dokusu dilimi. Ölçek çubuğu = 3000 μm. (D) Işık mikroskobu altında akut pankreas dokusu dilimi, Langerhans adacığı bir ok ucu ile gösterilir, yıldız işareti pankreas kanalını gösterir. Ölçek çubuğu = 100 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
2. Memeli hücreleri için CANLI / ÖLÜ Canlılık / Sitotoksisite Kiti kullanılarak canlı / ölü tahlil
NOT: Bazı deneyler için, dilimlerdeki hücrelerin yaşayabilirliğini (Şekil 4) canlı/ölü tahlili ile aşağıdaki gibi kontrol etmek yararlıdır.
- Şişeleri LIVE/DEAD Viability/Sitotoksisite Kitinin reaktifleri ile çözmek için üreticinin talimatlarını izleyin ve kullanımdan hemen önce kalsein'nin çalışma çözeltilerini hazırlayın. Çözümleri bir gün içinde kullanın.
- 15 mL'lik bir santrifüj tüpünde, yaklaşık 2 μM kalsürün ve 4 μM Kalsin (Bileşen A), 20 μL 2 mM ethidyum homodimer-1 (EthD-1, Bileşen B) ve 10 mL Dulbecco'nun Fosfat tamponlu Salinini (D-PBS) karıştırarak yaklaşık 2 μM kalsin ve 4 μM EthD-1 içeren bir çalışma çözeltisi hazırlayın. Vorteksi iyice girin.
- İnce bir boya fırçası kullanarak, serum esteraz aktivitesini seyreltmek için doku dilimlerini taze HEPES tamponlu 3 mL'lik bir Petri kabına nazikçe aktarın. HEPES tamponunu çıkarın ve dilimleri adım 2.2'den itibaren çalışma çözeltisinin 100-200 μL (veya gerekirse daha fazla) ile örtün.
- Dilimleri kapalı bir Petri kabında oda sıcaklığında 30-45 dakika boyunca inkübe edin. Doku dilimlerini, üretici tarafından önerilen uyarma/emisyon filtrelerini kullanarak görüntüleyin.
3. Kalsiyum boya yükleme
NOT: Floresan boyalar, boyanın hazırlanması ve yüklenmesi sürecinin tamamında ve ayrıca lekeli doku dilimlerinin işlenmesi sırasında ışığa maruz kalmaktan korunmalıdır. Kalay folyo, kalsiyum boyası içeren tüpleri veya Petri kaplarını örtmek için kullanılabilir.
- Boya hazırlama
- Hücre geçirgen Ca 2+ gösterge boyasının (uyarım/emisyon 495/523 nm; Malzeme Tablosuna bakınız), 7,5 μL dimetilsülfoksit (DMSO) ve polaksamerin 2,5 μL'sinin (DMSO'da% 20 çözelti) bir şişesinin (50 μg) içeriğini çözün; Malzeme Tablosu) 15 mL'lik vidalı kapak tüpünde 6 mM glikoz içeren 6.667 mL HBS'de.
NOT: Bu nihai çözelti 6 μM Ca2+ gösterge boyası, %0,11 DMSO ve %0,037 polaksamer içerir. - Vidalı kapak tüpündeki çözeltiyi 20 sn'lik bir pipetle tekrar tekrar aspire edin ve dışarı atın; Tüpü 30 s için ultrasonik bir banyo odasına batırın ve çözünürlüğü artırmak için 30 s için vorteks. 3.1.1 adımında 5 mL Petri kaplarına hazırlanan nihai Ca2+ gösterge boya çözeltisinin Aliquot 3.333 mL'si.
- Hücre geçirgen Ca 2+ gösterge boyasının (uyarım/emisyon 495/523 nm; Malzeme Tablosuna bakınız), 7,5 μL dimetilsülfoksit (DMSO) ve polaksamerin 2,5 μL'sinin (DMSO'da% 20 çözelti) bir şişesinin (50 μg) içeriğini çözün; Malzeme Tablosu) 15 mL'lik vidalı kapak tüpünde 6 mM glikoz içeren 6.667 mL HBS'de.
- Boya yükleme
- Hazırlanan doku dilimlerini HBS'li 60 mL Petri kabından ince, yumuşak bir boya fırçası kullanarak her doku dilimini nazikçe kaldırıp boya çözeltisine yerleştirerek boya çözeltisi ile doldurulmuş 5 mL Petri kaba aktarın. Petri kabı başına 10 doku dilimine kadar inkübe edin.
- Dilim yüklü Petri kabını, 50 dakika boyunca dakikada 40 dönüşte yörüngesel harekete ayarlanmış oda sıcaklığında bir yörüngesel çalkalayıcıya yerleştirin. Oda sıcaklığında ortam havasına maruz kalan boya çözeltisindeki dilimleri inkübe edin, ancak Petri kabını teneke folyo ile kaplayarak ışıktan koruyun.
- Dilimlerin saklanması
- Lekeli doku dilimlerini 5 mL Petri kabından ince, yumuşak bir boya fırçası kullanarak nazikçe kaldırarak boyasız HBS ile doldurulmuş 60 mL'lik bir Petri kabına aktarın. Petri kabı başına 20 dilime kadar saklayın.
NOT: Bu noktada görüntüleme için doku dilimlerini kullanın. Doku dilimleri Ca2+ gösterge boyasını birkaç saat boyunca koruyacaktır. Dilimlerin hayatta kalması ve boyanın tutulması, Petri kabının buzla çevrili yalıtımlı bir kaba yerleştirilmesiyle iyileştirilebilir. Bu, özellikle boya yüklü dilimlerin taşınması gerektiğinde önemlidir. Ek olarak, HBS'yi her 2 saatte bir değiştirin.
- Lekeli doku dilimlerini 5 mL Petri kabından ince, yumuşak bir boya fırçası kullanarak nazikçe kaldırarak boyasız HBS ile doldurulmuş 60 mL'lik bir Petri kabına aktarın. Petri kabı başına 20 dilime kadar saklayın.
4. Kalsiyum görüntüleme
- Konfokal mikroskopun kurulumu
- Çalışmanın ilgisine bağlı olarak uygun bir objektif büyütme seçin. Bütün bir adacığı, aynı anda birkaç acini veya daha büyük kanalları görselleştirmek için 20x ve 25x'i (sayısal diyafram açıklığı [NA] 0,77-1,00) seçin. Hücre içi dinamikleri incelemek için daha yüksek büyütmeler seçin.
- Hızlandırılmış görüntüleme için edinme modunu seçin (ör. hızlandırılmış, xyt veya benzeri mod). İğne deliğini 100-200 μm'ye ayarlayın.
- Yeşil floroforlar için ışık yolunu ayarlayın: 488 nm'de uyarma ve 500-700 nm'de emisyon toplama. Tercihen, fotoçarpan dedektörleri üzerinde yüksek kuantum verimliliğine (örneğin, galyum arsenit fosfit) sahip dedektörleri seçin.
- Kayıt odasının ve perifüzyon sisteminin kurulumu
- Kayıt odasını mikroskobun ve perifüzyon sisteminin sıcaklık kontrollü aşamasına monte edin (yerçekimi beslemeli veya peristaltik pompa tabanlı kurulum, hacim 1 mL). Giriş ve çıkışı, oda içinde perfüzyonun kıvrılmasını önlemek için kayıt odasının uzak kenarlarına yerleştirin ve giriş ve çıkışı eşit değerlere (1-2 mL / dak) ayarlayın. Sıvı menisküs yüksekliğinin ve perifusattaki damlacıkların sürüklenmesinden kaçının.
- Perifüzyon sisteminin sıcaklık kontrolünü 37 °C'ye ayarlayın.Perifüzyonu uyarıcı olmayan çözelti ile başlatın ve uyarıcı çözeltileri hazırlayın. Motorlu vanalarla veya perifüzyon sistemini besleyen çözeltileri manuel olarak değiştirerek çözeltileri değiştirin.
- Kalsiyum dinamiklerini kaydedin
- Tek bir doku dilimini kayıt odasına aktarın. Doku dilimini gergin naylon ağ ile U şeklinde bir platin ağırlıkla (örneğin, naylon çoraplardan) hareketsiz hale getirin. Naylon iplikleri ilgilenilen yapının üzerine yerleştirmekten kaçının.
- Brightfield seçeneğini kullanarak bir adacık/acinus/kanal bulun. İncelenen yapıları görüş alanına yerleştirmek için canlı görüntüleme çalıştırın ve görüntüleme parametrelerini ayarlayın. Lazer gücünü, dedektör amplifikasyonunu ve çizgi ortalamasını ayarlayarak sinyal-gürültü oranını optimize edin ve lazer gücünü minimumda tutarken hücrelerin görselleştirilmesine izin verin.
- Kesim yüzeyindeki potansiyel olarak hasar görmüş hücrelerden kayıt yapılmasını önlemek için kaydın odak düzlemini kesme yüzeyinin ~15 μm altına ayarlayın (Şekil 5).
- Görüntü alın. Başlangıçta bireysel salınımları algılamak için örnekleme frekansını 1-2 Hz'e ayarlayın ve hücre içi Ca 2+ ([Ca 2+]IC) aktivitesini kaydetmek için daha yüksek bir alım hızında (>10 Hz) hızlı çizgi ortalaması (8-20) yapabilen bir rezonans tarayıcısı kullanın. Fototoksisiteyi önlemek için ardışık nokta aydınlatmaları arasında bir aralık bırakın (örneğin, toplam örnekleme süresinin% 30'u). Zaman serisi alımından önce yüksek çözünürlüklü bir görüntü kaydedin (ör. 1024 x 1024 piksel, satır ortalaması > 50) (bkz. bölüm 5).
NOT: 1-2 Hz'lik örnekleme frekansı, çoğu hücre için edinme frekansı için Nyquist kriterinin altındadır ve sinyalin şekli varsayılan olarak az örneklenecektir. - Hazırlık yanıtı, aşırı aydınlatma, fotobeyazlatma ve mekanik sürüklenme hakkında anında geri bildirim almak için görüntüleme yazılımında varsa, çevrimiçi bir grafiğe bakın. Edinme sırasında yüksek oranda ağartma olması durumunda, sinyali / gürültü oranını korumak için dedektör kazancını artırırken kaydı durdurun ve lazer gücünü azaltın. Mekanik sapma durumunda, borular/kablolar ile mikroskop aşaması arasındaki gerilimin yanı sıra sıvı sızıntısı veya kayıt odasındaki ses seviyesindeki değişiklikleri kontrol edin. İsteğe bağlı olarak, edinme sırasında sapmayı manuel olarak düzeltmeye çalışın; ancak, bunun doğal olarak sınırlı sonuçlar vereceğini unutmayın.
NOT: Endokrin hücreler eşiğe yakın konsantrasyonlarda oldukça heterojendir. Tek tek hücrelerdeki aktivasyon / deaktivasyon gecikmelerinin aralığını tespit etmek için yeterli bir stimülasyon uzunluğu gereklidir. Bu, özellikle yüksek derecede uyarıcı protokolleri takiben tepkilerin doğru tespiti için önemlidir. - Endo ve ekzokrin hücreler arasında fonksiyonel olarak ayrım yapmak için kalsiyum görüntüleme kullanın (Şekil 6). Etkinleştirme ve devre dışı bırakma sırasında geçici etkinliği kaydetmek için, kaydı durdurmadan uyaranlar uygulayın.
- Denemenin bitiminden sonra verileri kaydedin (otomatik kaydetme işlevi kullanmayı düşünün). Kapatma prosedürü sırasında lazerlere zarar vermemek için lazer gücünü kapatmadan önce bir soğutma süresi bekleyin.
5. Verilerin analizi
- Hızlandırılmış videoyu yeniden oynatarak kaydı niteliksel olarak görsel olarak inceleyin. Görüş alanından veya optik düzlemden hücre sapmalarını kontrol edin. Optik düzlemde bir sapma meydana geldiyse, ImageJ'deki sürüklenme düzeltme eklentisini kullanın.
- Mikroskop yazılımı veya üçüncü taraf yazılımı kullanarak ilgi çekici bölgeleri (ROI) seçin. YG'leri seçmek için referans olarak yüksek çözünürlüklü görüntüyü, maksimum projeksiyonu veya kare ortalamasını kullanın. Referans görüntülerde görünmeyen yanıt veren hücreleri görselleştirmek için hızlandırılmış görüntülemeyi yeniden oynatın. Yatırım getirilerini, YG'ler arasındaki sinyal etkileşimini önlemek için bir YG'nin seçilen alanı komşu hücrelerle çakışmayacak şekilde konumlandırın.
- Zaman serisi verilerini kare başına YG ortalama değeri olarak dışa aktarın. Yatırım getirisi koordinatlarını dışa aktarın.
- Beyazlatma için zaman serisi verilerini düzeltin (Şekil 7A), üstel ve doğrusal uyumun bir kombinasyonunu kullanarak, aşağıdaki şekilde açıklandığı gibi:
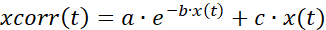 (1)
(1)
burada x(t), t zaman noktasındaki floresan sinyalini gösterir; xcorr(t) karşılık gelen zaman noktalarında düzeltilmiş sinyal; ve a, b ve c uyumunun parametreleri, corr( t) ve x(t) arasındaki karelerin en az toplamı olarak hesaplanır. - Yanıtın etkinleştirme ve devre dışı bırakma aşamasını analiz edin (Şekil 7B). Zaman serisi verilerinin ilk türevini hesaplayın ve sırasıyla etkinleştirme ve devre dışı bırakmaya karşılık gelen türevin zirvesini ve nadirini belirleyin. Alternatif olarak, fazik artışın başlangıcını manuel olarak seçin. Etkinleştirme/devre dışı bırakma sürelerini ve ilgili hücre koordinatlarını kaydedin ve dışa aktarın.
- Plato evresini analiz edin (Şekil 7C). Ham verileri eşik ederek veya zaman serisi verilerinin ilk türevini eşik ederek tek tek salınımları algılayın. Bireysel bir salınımın başlangıcını ve sonunu, salınımın yarım genliğine karşılık gelen zaman olarak tanımlayın.
- Her hücre için ayrı salınımların süresini ve sıklığını hesaplayın. Interspike aralığının ters değerini hesaplayın (düzenli aktivite kalıpları için uygundur). Alternatif olarak, salınım sayısını kaydın zaman aralığına bölün (düzensiz aktivite kalıpları için uygundur).
- Etkin süreyi hesaplayın. Etkin zamanı sürelerin toplamı olarak ifade edin ve bu değeri zaman aralığına bölün. Alternatif olarak, bir salınıma karşılık gelen frekansı ve süreyi çarpın.
NOT: Sürelerin toplamını zaman aralığına bölmek sağlam sonuçlar sağlar, ancak hücre başına tek bir veri noktası elde edildiğinden düşük istatistiksel ayrımcılığa sahiptir. Bir salınımın frekansını ve süresini çarpmak, salınımdan salınıma zamansal bir çözünürlük sağlar.
Sonuçlar
Agaroz çözeltisinin pankreas kanalına enjeksiyonu, pankreas dokusu dilimi hazırlığında en kritik adımdır. Başarılı bir enjeksiyon, Şekil 3A'nın sol tarafında görüldüğü gibi pankreas dokusunun beyazlatılmasıyla tanınabilirken, pankreasın eksik enjekte edilmiş bir kısmı Şekil 3A'nın sağ tarafında sunulmaktadır. Langerhans adacıkları çıplak gözle veya stereomikroskop altında tanınabilir ve bu, agaroz bloklarına daha sonra gömülmek üzere pankreasın uygun kısımlarının kesilmesine yardımcı olur (Şekil 3B). Taze kesilmiş bir fare pankreas dokusu diliminde, Langerhans adacıkları çevredeki ekzokrin doku ve mezenkimden stereomikroskop altında beyaz lekeler (Şekil 3C) veya ışık mikroskobu altında kahverengimsi yapılar olarak kolayca ayırt edilebilir (Şekil 3D). Pankreas dokusu dilimleri, dilimlemeden sonra en az 12 saat boyunca farklı deney türleri için kullanılabilir. Stereomikroskop, ışık mikroskobu ve kalsiyum görüntüleme sırasında hücrelerin fonksiyonel yanıtları altında yapılan brüt morfolojik değerlendirmeye ek olarak, pankreas dokusu dilimlerinin canlılığı da değerlendirilebilir (Şekil 4).
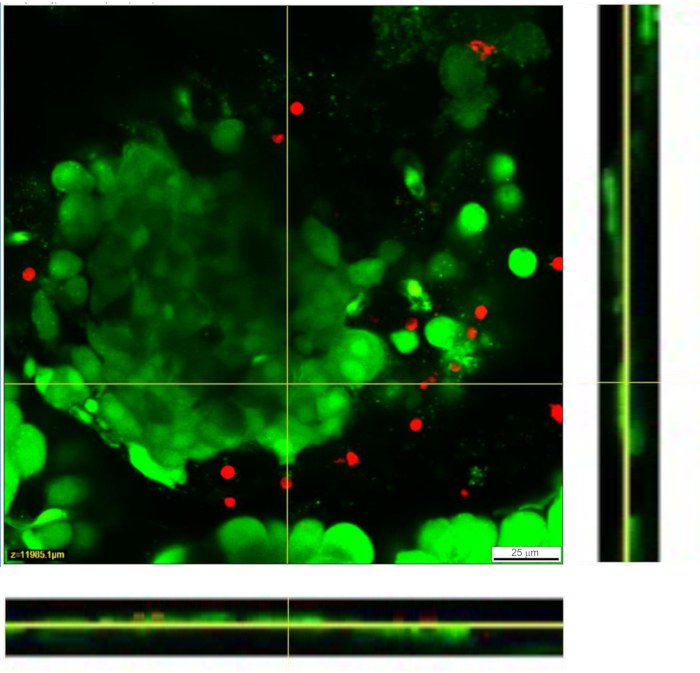
Şekil 4: Doku dilimi içindeki hücrelerin yaşayabilirliği. Canlı/Ölü testi ile hücrelerin canlılığı belirlendi. Canlı hücreler Calcein (yeşil renkle gösterilmiştir) tarafından boyanırken, ölü hücreler ethidium homodimer-1 (kırmızı ile gösterilmiştir) ile boyanır. Sarı çizgiler, altta ve sağda görüntülenen Z yığınının X-Y kesitinin konumunu gösterir. Z-yığınının tam derinliği 88 μm'dir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Kalsiyum görüntüleme deneyleri için, floresan kalsiyum göstergesinin birkaç hücre katmanından geçmesi gerekir. Şekil 5A, hücre geçirgen Ca2+ gösterge boyasının, bireysel adacık ve asinar hücrelerin tanınabileceği pankreas doku dilimine başarılı bir şekilde yüklenmesini göstermektedir. Buna karşılık, Şekil 5B-D'deki dilimler, boyanın başarısız penetrasyonu (Şekil 5B), adacık hücrelerinin eksikliği (Şekil 5C) ve yüzeydeki çok sayıda nekrotik doku (Şekil 5D) nedeniyle optimal değildir. Bu tür dilimler atılabilir, daha iyi kesilmiş veya lekelenmiş ek adacıkların varlığı kontrol edilebilir (sorun giderme için Tablo 1'e bakınız) veya ekzokrin hücrelerin yanıtlarını kaydetmek için kullanılabilir.
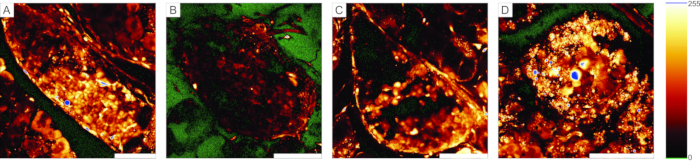
Şekil 5: Kullanılabilir ve kullanılamaz preparatlara örnekler . (A) Langerhans adacıklarında iyi boyanmış hücrelerle pankreas dokusu diliminin yanı sıra duktal hücreler ve çevresindeki asinar doku ile başarılı bir şekilde hazırlanmasına bir örnek. (B) Kötü lekelenmiş bir doku dilimi örneği. (C) Yapısal olarak durdurulan Langerhans adacığı örneği. (D) Birçok ölü hücre ve çok fazla enkaz içeren Langerhans adacığına bir örnek. Sağdaki "parıltılı, altta parıldayan" arama tablosu yeşilde 0 yoğunluk ve mavi renkte doygunluk gösterir. Ölçek çubuğu = 100 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Hücre geçirgen Ca2+ indikatör boyası kullanılarak kalsiyum görüntülemeden elde edilen temsili sonuçlar Şekil 6'da gösterilmiştir. Şekil 6A'da, Langerhans adacığı, asinar doku ve pankreas kanalı içeren bir pankreas dokusu diliminin yüksek çözünürlüklü bir görüntüsü sunulmuştur. Daha iyi bir ayrım için, Şekil 6A'da sunulan pankreas dokusu diliminin endokrin, ekzokrin ve duktal kısmı Şekil 6B'de renklendirilmiştir. Uygun uyaranların kullanılması, farklı adacık hücreleri veya adacık ve adacık olmayan hücreler arasında işlevsel olarak ayrım yapabilir51. Beta hücreleri tipik olarak [Ca2+] IC'de geçici bir artış ile glikoz tarafından kare darbeli bir stimülasyona cevap verecektir ve bunu sürekli bir plato üzerinde hızlı kalsiyum salınımları izleyecektir (Şekil 6C, üst panel).
Tüm beta hücreleri tek, büyük, fonksiyonel bir sinsityuma bağlandığından, bu salınımlar aynı zamanda [Ca 2+]IC dalgaları 32,34,52,53,54 yayılarak farklı hücreler arasında çok iyi senkronize edilir (Şekil 7C). 5-15 dakikalık bir periyotla daha yavaş [Ca2+] IC salınımları, hızlı salınımların altında yatabilir veya hatta 55,56'nın baskın tepki tipi olabilir. Aynı basit protokol, özellikle adacıkların çevresinde başka tepki türlerini de ortaya çıkarabilir (Şekil 6C, alt panel). Bu hücreler beta hücrelerle senkronize edilmediğinden ve düşük glikoz koşullarında zaten mevcut olan daha hızlı ve daha düzensiz salınımlarla veya aktivitede bir azalma ile yanıt verdiğinden, bu tür tepkiler beta olmayan hücreler 21,32,57,58'i oldukça düşündürmektedir. Bununla birlikte, kesin fonksiyonel karakterizasyonları, aşağıda tartışılan ek stimülasyon adımları veya alternatif yaklaşımlarla daha karmaşık protokoller gerektirir. Asinar ve duktal hücrelerin tipik yanıtları sırasıyla Şekil 6D ve Şekil 6E'de sunulmuştur. Asinar ve duktal hücreler hakkında daha fazla bilgi için literatüre bakınız22,23,35.
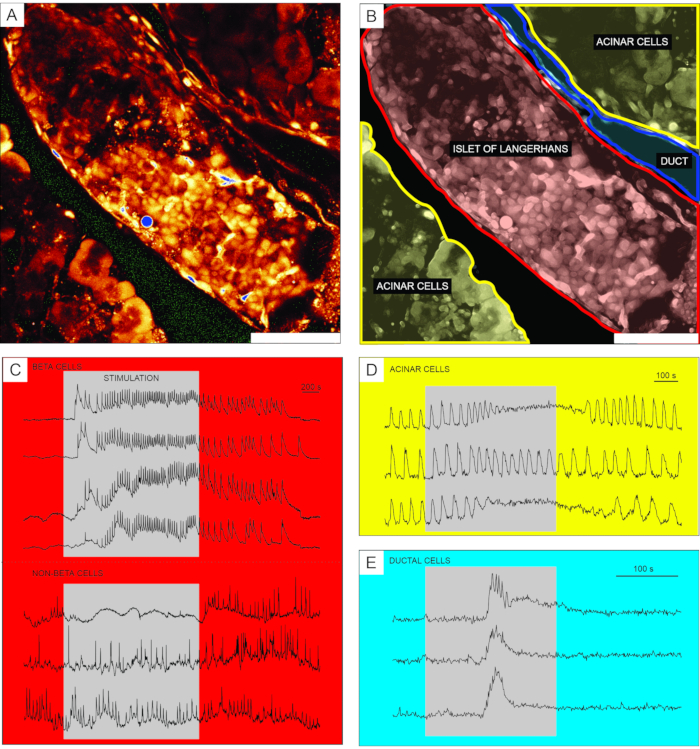
Şekil 6: Farklı pankreas hücresi tiplerinde kalsiyum dinamiğinin temsili sonuçları . (A) Langerhans adacığının çevreleyen dokuya sahip yüksek çözünürlüklü bir görüntüsü. Ölçek çubuğu = 100 μm. (B) Pankreas dokusunun farklı kısımlarının sarı renkte gösterilen asinar doku, kırmızı ile gösterilen Langerhans adacığı ve mavi renkte duktal ağacın bir segmenti ile tanımlanması. Ölçek çubuğu = 100 μm. (C) 12 mM glikoz ile stimülasyon sırasında beta ve varsayılan beta olmayan hücrelerdeki kalsiyum dinamiğinin tipik izleri; Uyarıcı olmayan durumlar için 3 mM glukoz kullanıldı. Beta olmayan hücrelerin daha spesifik ayrımcılığı için kullanılabilecek protokoller tartışma bölümünde açıklanmıştır. (D) 25 nM asetilkolin tarafından uyarılan asinar hücrelerin kalsiyum dinamiklerinin tipik bir izi. (E) 1 mM kenodeoksikolik asit tarafından uyarılan duktal hücrelerin kalsiyum dinamiklerinin tipik bir izi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Başarılı kalsiyum görüntülemeden sonra, veriler ilk önce protokol bölümünde açıklandığı gibi üstel ve doğrusal bir uyumun bir kombinasyonu ile beyazlatma için dışa aktarılır ve düzeltilir. Beyazlatma düzeltmesinden önce ve sonra bir zaman serisi Şekil 7A'da sunulmuştur. Bundan sonra, yanıtın aktivasyon ve deaktivasyon fazındaki ve plato fazındaki çeşitli parametreler analiz edilebilir. Stimülasyondan sonra [Ca2+]IC artışının başlangıcındaki gecikme, Şekil 7B'deki gecikmeA ve bireysel hücreler arasındaki gecikmelerdeki heterojenite (gecikmeA1) ile temsil edildiği gibi ölçülebilir. Aynı parametreler (gecikmeD ve gecikmeD1) devre dışı bırakma aşamasını tanımlamak için kullanılabilir. İlk geçici [Ca 2+]IC artışını takiben, bir adacıktaki çoğu pankreas beta hücresindeki plato fazı, nispeten düzenli yüksek frekanslı [Ca2+] IC salınımları ile karakterizedir. Plato evresi klasik fonksiyonel parametreler analiz edilerek tanımlanabilir. [Ca2+]IC salınımlarının süresi, sıklığı ve aktif zaman yüzdesinin şematik sunumu Şekil 7C'de sunulmuştur. Kazanım oranları 10 Hz'den yüksek olan kalsiyum görüntülemede, adacık boyunca tekrar tekrar yayılan kalsiyum dalgaları da net bir şekilde tanınabilir (Şekil 7C).
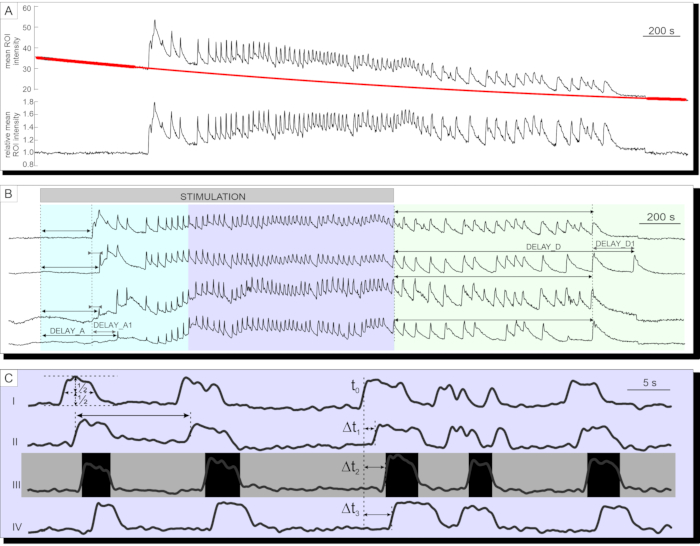
Şekil 7: Zaman serisi verilerinin analizi. (A) Fotobeyazlatma için zaman serisi verilerinin düzeltilmesi. (B) Stimülasyondan sonra aktivasyon ve 12 mM glikoz ile stimülasyonun kesilmesinden sonra deaktivasyon gecikmelerinin analizi. Stimülasyon süresi, görüntüdeki açık gri, gölgeli çubukla gösterilir. (C) Plato fazının çeşitli parametrelerinin analizi: I) Yarı yükseklikte belirlenen salınımın süresi, II) Salınımlar arası aralıklarla belirlenen salınımların sıklığı. III) frekansın bir ürünü olarak aktif zaman ve salınımların süresi. I-IV) Langerhans adacığı boyunca yayılan herhangi bir salınım dalgasındaki salınımlar arasındaki gecikmeler, tek bir hücrenin salınımın yarı yüksekliğine ulaştığı zamandaki gecikmeler (Δt) tarafından belirlenir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Pankreas doku dilimi yöntemi, pankreasın endokrin ve ekzokrin kısımlarının morfolojisini ve fizyolojisini daha korunmuş, in situ bir preparatta incelemek için hızlı bir deneysel yöntemdir. Avantajların birçoğu Giriş'te zaten belirtilmiştir. Genel olarak (yani, sadece kalsiyum görüntüleme için değil), pankreas fizyolojisini incelemek için dilim yaklaşımının zaman kazandırdığını belirtmek gerekir, çünkü izolasyondan sonra bir iyileşme süresi içermez. İkincisi, farklı türlerden izole adacıkların her türlü deneyi ve kullanımı ile kesinlikle gerekli değildir, ancak tipik olarak saflığı arttırmak, canlılığı ve işlevselliği geri kazanmak ve bazen birkaç bağışçıdan adacıkları toplamak için kullanılır 59,60,61,62,63,64 . Bununla birlikte, kalsiyum görüntüleme bağlamında, beta hücre yanıtlarının kültür süresine ve koşullarına bağlı olduğu bulunmuştur ve bu, izole adacıklar15,65 kullanılırken dikkate alınması gereken önemli bir varyasyon kaynağıdır. Aynı konu, doku dilimleri için de düşünülmelidir, eğer uzun süreli kültürleri gelecekte yaygın olarak kullanılan bir seçenek haline gelirse22,36. Doku dilimleme yöntemi de yüksek verime sahiptir ve bu nedenle potansiyel olarak hayvanların çektiği acıyı azaltır ve istatistiksel gücü arttırır. Ayrıca, tek bir hayvandan birçok dilim hazırlanabildiği için ve dilimler uzun süre hayatta kaldığından, hem deney hem de kontrol gruplarında aynı hayvan veya hatta aynı adacık da dahil olmak üzere uygulanabilir hale gelir.
Orijinal mimari ve hücreden hücreye iletişim korunduğundan ve bir dizi yapısal analiz, elektrofizyolojik, görüntüleme yöntemi ve hormon sekresyon tahlili ile uyumlu olduğundan, bu yöntem özellikle bireysel hücreler arasındaki bozulmamış etkileşimlere bağlı pankreas fonksiyonlarını incelemek için yararlıdır, örneğin, sekretagoglara duyarlılık, farklı hücre tipleri arasındaki parakrin ve bağışıklık etkileşimleri, elektriksel aktivite kalıpları, kalsiyum dinamiğinin özellikleri ve farklı hormonların salgılanması. Özellikle kalsiyum görüntüleme için, dilimleri kullanmanın temel avantajları, adacık çekirdeğinin maruz kalması ve yüksek çözünürlüklü birçok farklı hücre tipinden sinyal alma olasılığıdır. Deneyin gereksinimlerine ve hayvanların yaşına bağlı olarak, kalınlık değişebilir, dilimler transfekte edilebilir veya genetik olarak kodlanmış muhabirleri olan hayvanlardan elde edilebilir. Aşağıda daha ayrıntılı olarak açıklandığı gibi, son iki yaklaşım aynı zamanda beta olmayan hücrelerden gelen yanıtların spesifik fonksiyonel olarak tanımlanmasını ve karakterizasyonunu sağlar 31,66. Ayrıca, organın iyi tanımlanmış kısımlarından gelen adacıklar, hastalığa duyarlılık veya duyarlılıktaki farklılıklar açısından incelenebilir. İyileşme inkübasyon süresi gerektirmeseler de, farklı farmakolojik ajanlar, yağ asitleri, yüksek glikoz ve sitokinlerle kolayca inkübe edilebilirler.
En önemlisi, tek hücreli veya hatta hücre altı çözünürlükle kombinasyon halinde yüksek çözünürlük elde edilebildiğinden, dilimlerde konfokal kalsiyum görüntüleme, kalsiyum dalgalarını, fonksiyonel bağlantıyı ve bir adacığın farklı kısımlarındaki hücrelerin farklı fonksiyonel rollerini analiz etmek için en uygun yöntemlerden biridir54,67. Bir dizi avantaja rağmen, doku dilimi yaklaşımının önemli sınırlamaları vardır. İlk olarak, özellikle kesim yüzeyinde, adacık ve ekzokrin mimarisi için hala en azından kısmen bozucudur ve ek mekanik ve endojen enzimatik hasarı önlemek için hazırlık sırasında düşük sıcaklık, çözeltilerin sık değişimi ve nazik ve hızlı manipülasyon gibi önlemlere ihtiyaç vardır. İkincisi, besin ve sekretagog verme paternleri hala in vivo yoldan daha düşüktür, preparat sistemik innervasyondan ayrılır ve adacık ile hedef dokuları arasındaki gibi organlar arası geri bildirim, in vivo yaklaşımların aksine, imkansızdır. Üçüncüsü, maksimum dilim kalınlığı oksijenasyon, besin dağıtımı ve ~ 200 μm9'da pH regülasyonu ile sınırlıdır. Ayrıca, hem dilimlerin hazırlanması hem de görüntüleme çok fazla eğitime ihtiyaç duyar ve uzun zaman serilerinden ve birçok hücreden alınan kalsiyum verilerinin derinlemesine analizi, genellikle klasik bir fizyoloğun araç setine dahil edilmeyen ve fizikçilerden veya veri bilimcilerinden yardım gerektiren uzmanlık bilgisi gerektirir. Homo- ve heterotipik etkileşimlerin korunması avantajı, ilgilenilen bölgelerdeki diğer hücrelerden gelen sinyallerin varlığı nedeniyle numunelerin analizini de zorlaştırabilir. Protokollere bağlı olarak, diğer hücrelerin aktivasyonu, gözlemlenen bir hücrenin dolaylı olarak ek uyarılmasına veya inhibisyonuna yol açabilir.
Bu ancak dekonvolüsyon yaklaşımlarıyla, dolaylı etkilerin bazılarını bloke eden maddeler de dahil olmak üzere daha karmaşık stimülasyon protokolleriyle, spesifik nakavt hayvanları kullanarak ve sonuçların daha indirgemeci metodolojiler kullanan diğer çalışmalardan elde edilen sonuçlarla dikkatli bir şekilde karşılaştırılmasıyla kesin olarak çözülebilir. Ek olarak, sekresyon ölçümleri gerekliyse, bazı dilimlerin adacıklardan yoksun olabileceği ve tek bir dilimdeki toplam endokrin doku kütlesinin tipik olarak düşük olduğu akılda tutulmalıdır. Görüntüleme için akut pankreas dokusu dilimlerinin hazırlanması, aşağıdaki bölümlerde tartışılan ve okuyucunun sorun giderme için kısa ama önemli ipuçları bulabileceği Tablo 1'de özetlenen birkaç kritik adımı içerir. İlk olarak, agaroz çözeltisini hazırlarken, agaroz tozu tamamen çözünmelidir, aksi takdirde çözülmemiş parçacıklar enjeksiyonu engelleyebilir. Bir yandan çok düşük bir sıcaklık nedeniyle agarozun sertleşmesini önlemek ve diğer yandan çok yüksek sıcaklıklar nedeniyle doku hasarını önlemek için homojen agaroz çözeltisini 37-45 ° C'de tutun. Kullanımdan sonra, kalan agaroz 4 ° C'de saklanabilir ve yeniden ısıtılabilir, ancak tekrarlanan yeniden ısıtma, su buharlaşması nedeniyle yoğunluğun artmasına neden olabilir ve sonuçta enjeksiyonu zorlaştırır veya imkansız hale getirir.
Hazırlıktaki bir sonraki kritik adım, majör duodenal papillayı doğru bir şekilde sıkıştırmaktır. Duodenum üzerindeki beyaz bir nokta, ortak safra kanalının ve duodenumun birleşme noktasını gösterir. Çok yakına yerleştirilen bir kelepçe, ortak kanalın bazı lateral pankreas dallarının tıkanmasına neden olur ve bu parçaların enjeksiyonunu devre dışı bırakırken, çok distal olarak yerleştirilmiş bir kelepçe, agarozun alt direnç yolundan doğrudan duodenuma sızmasına neden olur. Ortak safra kanalının kanülasyonundan önce, kanalın daha iyi görselleştirilmesi ve enjeksiyon sırasında daha fazla kontrol için çevredeki yağ dokusu dikkatlice çıkarılabilir. Çevreleyen dokunun çıkarılması sırasında yetersiz hassasiyet, kanalın delinmesine neden olabilir. Agaroz enjeksiyonu için kullanılan iğne çapının seçimi de önemlidir. Farelerde, tercihen 30 G'lik bir iğne kullanılır; Daha küçük (32 veya 33 G) iğneler, agaroz çözeltisinin yüksek viskozitesi nedeniyle daha fazla çaba gerektirir ve tıkanmaya daha yatkındır. Bununla birlikte, daha düşük yoğunluklu bir agaroz çözeltisi ile birlikte kullanılırsa, daha küçük fare suşlarında ve genç hayvanlarda çok yardımcı olabilirler. İlk postnatal günlerde, agaroz alternatif olarak intraduktal2 yerine subkapsüler olarak enjekte edilebilir. Farelerde daha büyük çaplı iğneler kullanmak, büyük olasılıkla ortak safra kanalına zarar verecektir. Bu aynı zamanda doğru iğne çapı ile de olabilir ve forseps enjeksiyon sırasında iğnenin yerinde tutulmasına yardımcı olabilir. Sıçanlarda olduğu gibi daha büyük kanallar durumunda daha büyük çaplı iğneler tek çözüm olabilir. İğne, geri sızıntıyı önleyen sıkı bir sızdırmazlık sağlamak için çok darsa, kanala başarılı bir şekilde girdikten sonra etrafına bir bağ yerleştirilebilir.
Agaroz enjeksiyonu, çözeltinin viskozitesi nedeniyle biraz çaba gerektirir ve enjeksiyon işlemi başladıktan sonra, düşük erime noktalı agaroz çözeltisi, enjeksiyon tamamlanmadan önce iğnede veya duktal ağacın en büyük kısımlarında katılaşabileceğinden kesintiye uğramamalıdır. Bu, zayıf doku penetrasyonuna ve kesim sırasında daha kötü desteğe neden olacaktır. Kanal her zaman sol hepatik kanalın ve kistik kanalın birleşerek ortak safra kanalını oluşturduğu noktada kanüle edilmelidir. Ortak safra kanalı delinirse, tekrar tekrar duodenuma daha yakın kanülasyon yapmayı deneyin. Pankreas agaroz çözeltisi ile yeterince stabilize edildiğinde ve periton boşluğundan ekstrakte edildiğinde, iyi enjekte edilmiş küçük doku parçaları kesilir. Onları agarozun içine gömmeden önce, kalıntıları dilimlemeyi daha zor hale getirdiği için tüm yağ ve bağ dokularını çıkarmak çok önemlidir. Aynısı, deneyin odak noktası oldukları durumlar dışında, kan damarları ve kanal kalıntıları için de geçerlidir. Bu durumda, bunları istenen kesitin elde edileceği şekilde konumlandırdığınızdan emin olun. Dokuyu agaroza gömerken, sıcaklığın uygun olduğundan (37 ° C) ve dokunun tamamen agarozla çevrili olduğundan emin olun, çünkü vibratom dilimleme sırasındaki kuvvetler pankreas dokusunu agaroz bloklarından sökebilir.
Doku bloklarını agaroza yerleştirmeden önce kısa bir süre kağıt mendil üzerine yerleştirerek hızlı bir şekilde kurutmak, bu adımda doku ve agaroz arasındaki zayıf teması önlemeye yardımcı olabilir. Agaroz bloklarının katılaşması sırasında, Petri kabını yatay olarak yerleştirin ve pankreas dokusu ile Petri kabının dibi arasındaki teması önleyin. Pankreas tam olarak enjekte edilmezse, kesme işlemi zor olacaktır. Bu nedenle, doku dilimleri elde etmek için kesme hızını azaltmaya çalışın. Vibratom dilimleme sırasında hücre hasarını en aza indirmek için, dilimleme odasındaki ECS'yi (ve ECS'den yapılmış buz küplerini) düzenli olarak değiştirin. İkincisi, dilimleme sırasında asiner dokudan salınan pankreas enzimlerinin aktivitesini azaltacaktır. Dilimlerin kalınlığı da çok önemlidir. Kalsiyum dinamiği ve elektrofizyolojik deneyler için genellikle 140 μm dilimler kesilir; Bununla birlikte, çalışmanın amacına göre, dilim kalınlığı 90 μm ila 200 μm arasında değişebilir. Daha kalın dilimlerde, oksijen ve besin maddelerinin difüzyonunun sınırlı olacağını, ancak daha fazla doku içereceğini unutmayın. Ek olarak, kesilmemiş adacıkların oranının artan dilim kalınlığı ile artması beklenebilir. Dilimler, düzenli olarak değiştirilen bir ECS'de oda sıcaklığında birkaç saat saklanabilir veya hatta birkaç gün boyunca uygun bir hücre ortamında yetiştirilebilir; ancak bu durum sonunda normal adacık hücre fizyolojisini etkileyebilir 3,22.
Boya çözeltisini hazırlarken, tüm bileşenlerin dikkatli bir şekilde karıştırıldığından emin olun ve ortam ışığına maruz kalmaktan kaçının. Pankreas dilimi birçok hücre katmanından oluşur ve kalsiyum boyasının alımı, daha önce izole adacıklar58,68 ve hipofiz dilimleri 69 için tanımlandığı gibi, ilk birkaç en yüzeysel hücre tabakası ilesınırlıdır. Bununla birlikte, çevreleyen kapsül ve dış hücre katmanlarının boyanın daha derin katmanlara nüfuz etmesini engellediği izole adacıkların aksine, doku dilimleri adacığın tüm kesit yüzeyine erişime izin verir ve bir adacığın tüm katmanlarından yüzlerce hücrede kalsiyum dinamiklerinin eşzamanlı olarak ölçülmesini sağlar. Floresan Ca2+ göstergeleri, kalsiyum dinamiklerini ölçmek için en yaygın kullanılanlardır ve CLSM ile birlikte, birkaç yüz Hertz'e ulaşan yüksek zamansal çözünürlüklü kayıtlara olanak tanırlar. En uygun floresan Ca 2+ göstergesini seçerken, hücre yükleme yöntemini etkileyen gösterge formu, ölçüm modu (kalitatif veya kantitatif) ve Ca 2+ konsantrasyon aralığında olması gereken ve pH, sıcaklık, Mg 2+ ve diğer iyonların varlığına bağlı olan ayrışma sabiti (Kd) dahil olmak üzere farklı faktörleri göz önünde bulundurun. protein bağlanmasının yanı sıra. Hücresel Ca 2+ sinyalleri genellikle geçici olduğundan, Ca2+ bağlanma hızı sabiti de dikkate alınmalıdır. Pankreas hücrelerinde [Ca2+]IC dinamiklerini ölçmek için, bu grup esas olarak bu protokolde (Malzeme Tablosu) açıklanan hücre geçirgen Ca2 + gösterge boyasını kullanır, çünkü hücresel otofloresanın genellikle daha az sorunlu olduğu spektrumdaki emisyon dalga boylarına sahip uzun bir dalga boyu göstergesidir ve uyarma ışığının enerjisi düşüktür, bu da hücresel fotohasar potansiyelini azaltır. Bu boya düşük Ca 2 + konsantrasyonlarında floresan olduğundan, bu bazal [Ca2 +] IC'nin belirlenmesini kolaylaştırır ve stimülasyondan önce hücresel görünürlüğü arttırır. Ca 2+ bağlandıktan sonra, boyanın floresan yoğunluğu 14 kat artar ve [Ca2+]IC'deki küçük değişikliklerin bile algılanmasını sağlar.
Başarılı canlı hücre kalsiyum görüntülemesi için, protokol bölümünde açıklandığı gibi birkaç önemli donanım parametresinin dikkate alınması gerekir. Sinyal genliklerinin düşük ve fototoksisite şansının yüksek olduğu canlı hücre görüntülemesi için, numuneden daha fazla ışık toplamak için tercihen daha yüksek NA'lı hedefler kullanılır. Kalsiyum dinamiklerinin yüksek zamansal çözünürlükle kaydedilmesi gerekiyorsa, doğrusal galvanometreler yerine rezonans tarayıcısını kullanın. Doğru hedefi seçmenin yanı sıra, daha az lazer gücü gerektiren hibrit dedektörler gibi son derece hassas dedektörlerin kullanılması, fototoksisiteyi ve fotobeyazlatmayı önler. Bu, uzun süreli kalsiyum görüntüleme için özel bir öneme sahiptir. Kalsiyum görüntülemedeki diğer önemli adımlar, zaman serisi alımları için görüntü kalitesinin parametre ayarlarıdır. En önemlisi zamansal ve mekansal çözünürlüktür. Kalsiyum dinamiği kendi başına kabul edilebilir en düşük zamansal çözünürlüğü belirlediğinden, örnekleme hızının sinyali algılamak için beklenen sinyal frekansından en az iki kat daha yüksek olması veya sinyalin şeklini güvenilir bir şekilde algılamak için 10 kat daha yüksek olması gerekir. Akut pankreas doku dilimlerinde, kalsiyum dinamikleri aynı anda yüzlerce hücrede ölçülebilir ve bu nedenle mekansal çözünürlük de önemlidir. Bu, piksel sayısını artırarak veya canlı edinme sırasında çizgi ortalamasını artırarak geliştirilebilir. Bununla birlikte, uzamsal ve zamansal çözünürlük arasındaki ters ilişki nedeniyle, her iki ayar arasında bir denge gereklidir.
Kalsiyum görüntülemenin pankreas içindeki belirli bir hücre popülasyonunda yapılması gerekiyorsa, dilim içindeki hücreleri işlevsel olarak ayırt edebilen bir uyaran gereklidir. Yüksek glikoz, beta hücrelerini, yüksek bir kalsiyum seviyesine bindirilmiş ve bir adacık32,58,70 içindeki tüm hücreler arasında yüksek oranda senkronize olan salınımlı bir modele güvenilir ve hızlı bir şekilde aktive eder. Beta hücreleri, bir adacık içindeki en çok sayıda hücre tipidir ve çoğunlukla farelerde adacık çekirdeğinde bulunur. Aynı stimülasyon protokolü azalır ve bazen alfa hücrelerindeki patlamayı önemli ölçüde değiştirmez 30,32,58,70,71,72. Alfa hücrelerini fonksiyonel olarak ayırt etmek için, düşük (3 mM) glikoz, glutamat veya adrenalin, frekanslarını veya bazal [Ca 2+] IC 21,72,73,74,75'i arttırmak için kullanılabilir. Adacık hücrelerinin% 10-20'sini temsil ederler ve adacık çevresi1'de tespit edilirler. Delta hücreleri de çevrede bulunur. Bir adacıktaki toplam endokrin hücre sayısının sadece% ~% 5'ini oluştururlar ve tipik olarak 6 mM glikozda aktiftirler ve başlangıçtan itibaren düzensiz patlama aktivitesinin artması veya hafifçe yükselmiş bir kalsiyum seviyesi1,32,71,76 ile glikoz stimülasyonuna yanıt verirler. Ghrelin, kalsiyum görüntüleme deneylerinde delta hücrelerinin 21,77,78,79 spesifik uyarımı için kullanılabilir. Bununla birlikte, PP ve epsilon hücrelerinin spesifik fonksiyonel tanımlanması için protokoller tanımlanmaya devam etmektedir. Ayrıca, 25 nM asetilkolin, asinar hücreleri 35,80,81 patlama aktivitesine güvenilir bir şekilde aktive eder. Ek olarak, serulein, kolesistokinin ve karbamilkolin gibi bir dizi başka sekretagog, asinar hücrelerdekalsiyum yanıtlarını uyandırmak için kullanılabilir 22,40,82,83.
Son olarak, 1 mM kenodeoksikolik asit, doku dilimlerindeki duktal hücrelerde kalsiyum yanıtlarını güvenilir bir şekilde uyandırır; anjiyotensin II, ATP ve diğer bazı sekretagoglar da 11,23,84,85 kullanılabilir. Spesifik sekretagoglara ve inhibitörlere verilen karakteristik yanıtlara dayanan fonksiyonel bir tanımlama yeterli olmadığında, genetik olarak etiketlenmiş hayvanlar31, transfekte hücreler 73 veya immünositokimya, farklı hücre tiplerinin tanımlanması için kullanılabilir 9,22,71,86 . Son birkaç yılda, doku dilimleme yöntemi insan dokusuna başarıyla adapte olmuş ve hem ekzokrin41 hem de endokrin fizyolojisi 9,36,37,39'da birçok yeni önemli araştırma yolu açmıştır. İlginçtir ki, insan adacıklarındaki kalsiyum dinamiklerinin ayrıntılı bir değerlendirmesi oldukça zordur ve daha ayrıntılı olarak araştırılmaya devam etmektedir87. Gelişmiş konfokal mikroskopi ile birleştirildiğinde, pankreas dokusu dilimleme yöntemi, farelerdeki kalsiyum dinamikleri hakkında birçok yeni anlayış sağlamıştır ve umarım insan dokusu için de aynısını yapacaktır.
Açıklamalar
Yazarlar, araştırmanın herhangi bir ticari veya finansal çıkar olmaksızın yürütüldüğünü beyan ederler.
Teşekkürler
Bu çalışmada sunulan çalışma, Slovenya Araştırma Ajansı tarafından finansal olarak desteklenmiştir (araştırma çekirdek finansman no. P3-0396 ve I0-0029'un yanı sıra araştırma projeleri no. J3-9289, N3-0048 ve N3-0133) ve Avusturya Bilim Fonu / Fonds zur Förderung der Wissenschaftlichen Forschung (ikili hibeler I3562--B27 ve I4319--B30) tarafından. Mükemmel teknik yardım için Maruša Rošer, Maša Čater ve Rudi Mlakar'a teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Analytical balance KERN ALJ 120-4 | KERN & SOHN GmbH | ALJ 160-4A | |
| Confocal microscope Leica TCS SP5 II Upright setup | Leica | 5100001578 | |
| Confocal microscope Leica TCS SP5 AOBS Tandem II setup | Leica | ||
| Cork pad 15 cm x 15 cm | |||
| Corning 15 mL centrifuge tubes | Merck KGaA, Darmstadt, Germany | CLS430790 | |
| Corning Round Ice Bucket with Lid, 4 L | Fischer Scientific, Leicestershire, UK | 432124 | |
| Double edge razor blade | Personna, USA | ||
| Dumont #5 - Fine Forceps | FST, Germany | 11254-20 | |
| Eppendorf Safe-Lock Tubes 0.5 mL | Eppendorf | 0030 121.023 | |
| Erlenmeyer flask 200 mL | IsoLab, Germany | 027.01.100 | |
| Fine Scissors - ToughCut | FST, Germany | 14058-11 | |
| Flat orbital shaker IKA KS 260 basic | IKA | Ident. No.: 0002980200 | |
| Glass lab bottle 1000 mL | IsoLab, Germany | 091.01.901 | |
| Hartman Hemostat, curved | FST, Germany | 13003-10 | |
| HCX APO L 20x/1.00 W HCX APO L (water immersion objective, 20x, NA 1.0) | Leica | 15507701 | |
| Measuring cylinder 25 mL | IsoLab, Germany | 015.01.025 | |
| Micromanipulator Control box SM-7, Keypad SM-7 | Luigs & Neumann | 200-100 900 7311, 200-100 900 9050 | |
| Microwave owen | Gorenje, Slovenia | MO20MW | |
| Osmometer Gonotec 010 | Gonotec, Berlin, Germany | OSMOMAT 010 Nr. 01-02-20 | |
| Paint brush | Faber-Castell, No.2 | Any thin soft round paint brush No.2, preferably black | |
| Paper towels | |||
| Perifusion pumps | Ismatec | ISM 827 | Reglo Analog MS - 4/8 |
| Petri dish 100/20 mm | Sarstedt | 83.3902 | |
| Petri dish 35/10 mm | Greiner bio-one | 627102 | |
| Petri dish 35 x 10 mm Nunclon Delta | Thermo Fischer Scientific, Waltham, MA USA | 153066 | NON-STICKY for agarose blocks |
| pH meter inoLab pH Level 1 | WTW, Weilheim, Germany | E163694 | |
| Pipette 1000 mL | Eppendorf | 3121 000.120 | |
| Pipette 50 mL | Eppendorf | 3121 000.066 | |
| Push pins 23 mm | Deli, Ningbo, China | E0021 | |
| Screw cap tube, 15 mL | Sarstedt | 62.554.502 | |
| Semken Forceps | FST, Germany | 11008-13 | |
| Stabilizing ring for Erlenmeyer flask | IsoLab, Germany | 027.11.048 | |
| Stereomicroscope Nikon SMZ 745 | Nikon, Melville, NY USA | ||
| Syringe Injekt Solo 5 mL | Braun, Melsungen, Germany | 4606051V | |
| Syringe needle 0.30 x 12 mm (30 G x 1/2") | Braun, Melsungen, Germany | 4656300 | |
| Temperature controller | Luigs & Neumann | 200-100 500 0150, 200-150-500-145 | Slice mini chamber, Temperature controller TC 07 |
| Tubings for perifusion system | Ismatec | SC0310 | Ismatec Pharmed 1.14 mm(ID) + silicone tubing 1.0 (ID) x 1.8 mm(OD) |
| Ultrasonic bath Studio GT-7810A | Globaltronics | ||
| Vibrotome Leica VT 1000 S | Leica, Nussloch, Germany | 14047235613 | |
| Volumetric flask 1000 mL | IsoLab, Germany | 013.01.910 | |
| Vortex mixer Neolab 7-2020 | Neolab | 7-2020 | |
| Water bath Thermo Haake open-bath circulator | Thermo Fisher Scientific | Z527912 | |
| Material/Reagent | |||
| Calcium chloride dihydrate - CaCl2.2H2O | Sigma Aldrich, Germany | C5080-500G | |
| D-(+)-glucose | Sigma Aldrich, Germany | G8270-1KG | |
| Dimethyl sulfoxide | Sigma Aldrich | D4540-100ML | |
| DL-lactic acid | Sigma Aldrich, Germany | L1250-500ML | |
| Dulbecco’s Phosphate Buffered Saline | Merck KGaA, Darmstadt, Germany | D8662-500ML | |
| Gas mixture containing 95% O2 and 5% CO2 at barometric pressure | |||
| Glue Wekem sekundenkleber WK-110 | Wekem GmbH, Bergkamen, Germany | WK 110-020 | |
| HEPES | Sigma Aldrich, Germany | H3375-250G | |
| L-(+)-ascorbic acid | Sigma Aldrich, Germany | A9,290-2 | |
| LIVE/DEAD Viability/Cytotoxicity Kit, for mammalian cells | Thermo Fischer Scientific, Waltham, MA USA | L3224 | |
| Magnesium chloride hexahydrate - MgCl2.2H2O | Sigma Aldrich, Germany | M2670-500G | |
| Myo-inositol | Sigma Aldrich, Germany | I5125-100G | |
| Oregon Green 488 BAPTA-1, AM | Invitrogen (Thermo FisherScientific) | O6807 | cell-permeable Ca2+ indicator (excitation/emission: 495/523 nm) |
| Pluronic F-127 (20% Solution in DMSO) | Invitrogen (Thermo Fisher Scientific) | P3000MP | polaxamer: nonionic triblock copolymer |
| Potassium chloride - KCl | Sigma Aldrich, Germany | 31248 | |
| SeaPlaque GTG agarose | Lonza, Rockland, USA | 50111 | |
| Sodium bicarbonate - NaHCO3 | Honeywell, Germany | 31437-500G | |
| Sodium chloride - NaCl | Honeywell, Germany | 31434-1KG | |
| Sodium hydroxide - NaOH | Sigma Aldrich, Germany | 30620 | |
| Sodium phosphate monobasic- NaH2PO4 | Sigma Aldrich, Germany | S0751-500G | |
| Sodium pyruvate | Sigma Aldrich, Germany | 15990-100G | |
| Software | |||
| FIJI | FIJI is an open source project | ||
| LASAF | Leica microsystems, Inc. | ||
| Matlab | Mathworks | ||
| Python | Python Software Foundation | Python is an open source project |
Referanslar
- Dolensek, J., Rupnik, M. S., Stozer, A. Structural similarities and differences between the human and the mouse pancreas. Islets. 7 (1), e1024405(2015).
- Meneghel-Rozzo, T., Rozzo, A., Poppi, L., Rupnik, M. In vivo and in vitro development of mouse pancreatic ß-cells in organotypic slices. Cell and Tissue Research. 316 (3), 295-303 (2004).
- Rozzo, A., Meneghel-Rozzo, T., Delakorda, S. L., Yang, S. B., Rupnik, M. Exocytosis of insulin: in vivo maturation of mouse endocrine pancreas. Annals of the New York Academy of the Sciences. 1152, 53-62 (2009).
- Dolenšek, J., Pohorec, V., Rupnik, M. S., Stožer, A. Pancreas physiology, challenges in pancreatic pathology. IntechOpen. Seicean, A. , (2017).
- Williams, J. A. The nobel pancreas: a historical perspective. Gastroenterology. 144 (6), 1166-1169 (2013).
- Lacy, P. E., Kostianovsky, M. Method for the isolation of intact islets of Langerhans from the rat pancreas. Diabetes. 16 (1), 35-39 (1967).
- Williams, J. A., Korc, M., Dormer, R. L. Action of secretagogues on a new preparation of functionally intact, isolated pancreatic acini. American Journal of Physiology. 235 (5), 517-524 (1978).
- Peikin, S. R., Rottman, A. J., Batzri, S., Gardner, J. D. Kinetics of amylase release by dispersed acini prepared from guinea pig pancreas. American Journal of Physiology. 235 (6), E743-E749 (1978).
- Marciniak, A., et al. Using pancreas tissue slices for in situ studies of islet of Langerhans and acinar cell biology. Nature Protocols. 9 (12), 2809-2822 (2014).
- Skelin, M., Rupnik, M., Cencic, A. Pancreatic beta cell lines and their applications in diabetes mellitus research. Altex-Alternatives to Animal Experimentation. 27 (2), 105-113 (2010).
- Molnar, R., et al. Mouse pancreatic ductal organoid culture as a relevant model to study exocrine pancreatic ion secretion. Laboratory Investigation. 100 (1), 84-97 (2020).
- Rupnik, M. The physiology of rodent beta-cells in pancreas slices. Acta Physiologica (Oxford, England). 195 (1), 123-138 (2009).
- Blinman, T. A., et al. Activation of pancreatic acinar cells on isolation from tissue: cytokine upregulation via p38 MAP kinase. American Journal of Physiology. Cell Physiology. 279 (6), C1993-C2003 (2000).
- Speier, S., Rupnik, M. A novel approach to in situ characterization of pancreatic ß-cells. Pflügers Archive: European Journal of Physiology. 446 (5), 553-558 (2003).
- Gilon, P., Jonas, J., Henquin, J. Culture duration and conditions affect the oscillations of cytoplasmic calcium concentration induced by glucose in mouse pancreatic islets. Diabetologia. 37 (10), 1007-1014 (1994).
- Huang, C., Gu, G. Effective isolation of functional islets from neonatal mouse pancreas. Journal of Visualized Experiments: JoVE. (119), e55160(2017).
- Szot, G. L., Koudria, P., Bluestone, J. A. Murine pancreatic islet isolation. Journal of Visualized Experiments: JoVE. (7), e255(2007).
- Qi, M., et al. Human pancreatic islet isolation: Part I: digestion and collection of pancreatic tissue. Journal of Visualized Experiments: JoVE. (27), e1125(2009).
- Qi, M., et al. Human pancreatic islet isolation: Part II: purification and culture of human islets. Journal of Visualized Experiments: JoVE. (27), e1343(2009).
- Stull, N. D., Breite, A., McCarthy, R., Tersey, S. A., Mirmira, R. G. Mouse islet of Langerhans isolation using a combination of purified collagenase and neutral protease. Journal of Visualized Experiments: JoVE. (67), e4137(2012).
- Hamilton, A., Vergari, E., Miranda, C., Tarasov, A. I. Imaging calcium dynamics in subpopulations of mouse pancreatic islet cells. Journal of Visualized Experiments: JoVE. (153), (2019).
- Marciniak, A., Selck, C., Friedrich, B., Speier, S. Mouse pancreas tissue slice culture facilitates long-term studies of exocrine and endocrine cell physiology in situ. PLoS ONE. 8 (11), e78706(2013).
- Gal, E., et al. A Novel in situ approach to studying pancreatic ducts in mice. Frontiers in Physiology. 10, 938(2019).
- Speier, S., Yang, S. B., Sroka, K., Rose, T., Rupnik, M. KATP-channels in beta-cells in tissue slices are directly modulated by millimolar ATP. Molecular and Cellular Endocrinology. 230 (1-2), 51-58 (2005).
- Speier, S., Gjinovci, A., Charollais, A., Meda, P., Rupnik, M. Cx36-mediated coupling reduces β-cell heterogeneity, confines the stimulating glucose concentration range, and affects insulin release kinetics. Diabetes. 56 (4), 1078-1086 (2007).
- Rose, T., Efendic, S., Rupnik, M. Ca2+-secretion coupling is impaired in diabetic Goto Kakizaki rats. The Journal of General Physiology. 129 (6), 493-508 (2007).
- Paulmann, N., et al. Intracellular serotonin modulates insulin secretion from pancreatic β-cells by protein serotonylation. PLoS Biology. 7 (10), e1000229(2009).
- Mandic, S. A., et al. Munc18-1 and Munc18-2 proteins modulate β-cell Ca2+ sensitivity and kinetics of insulin exocytosis differently. Journal of Biological Chemistry. 286 (32), 28026-28040 (2011).
- Dolensek, J., Skelin, M., Rupnik, M. S. Calcium dependencies of regulated exocytosis in different endocrine cells. Physiological Research. 60, S29-S38 (2011).
- Huang, Y. C., Rupnik, M., Gaisano, H. Y. Unperturbed islet α-cell function examined in mouse pancreas tissue slices. Journal of Physiology. 589 (2), 395-408 (2011).
- Huang, Y. C., et al. In situ electrophysiological examination of pancreatic α cells in the streptozotocin-induced diabetes model, revealing the cellular basis of glucagon hypersecretion. Diabetes. 62 (2), 519-530 (2013).
- Stožer, A., Dolenšek, J., Rupnik, M. S. Glucose-stimulated calcium dynamics in islets of Langerhans in acute mouse pancreas tissue slices. PLoS ONE. 8 (1), e54638(2013).
- Stožer, A., et al. Functional connectivity in islets of Langerhans from mouse pancreas tissue slices. PLoS Computational Biology. 9 (2), e1002923(2013).
- Dolenšek, J., Stožer, A., Skelin Klemen, M., Miller, E. W., Slak Rupnik, M. The relationship between membrane potential and calcium dynamics in glucose-stimulated beta cell syncytium in acute mouse pancreas tissue slices. PLoS ONE. 8 (12), e82374(2013).
- Perc, M., Rupnik, M., Gosak, M., Marhl, M. Prevalence of stochasticity in experimentally observed responses of pancreatic acinar cells to acetylcholine. Chaos. 19 (3), 037113(2009).
- Qadir, M. M. F., et al. Long-term culture of human pancreatic slices as a model to study real-time islet regeneration. Nature Communications. 11 (1), 3265-3265 (2020).
- Panzer, J. K., et al. Pancreas tissue slices from organ donors enable in situ analysis of type 1 diabetes pathogenesis. JCI Insight. 5 (8), e134525(2020).
- Cohrs, C. M., et al. Vessel network architecture of adult human islets promotes distinct cell-cell interactions in situ and is altered after transplantation. Endocrinology. 158 (5), 1373-1385 (2017).
- Cohrs, C. M., et al. Dysfunction of persisting beta cells is a key feature of early type 2 diabetes pathogenesis. Cell Reports. 31 (1), 107469(2020).
- Dolai, S., et al. Pancreatitis-induced depletion of syntaxin 2 promotes autophagy and increases basolateral exocytosis. Gastroenterology. 154 (6), 1805-1821 (2018).
- Liang, T., et al. Ex vivo human pancreatic slice preparations offer a valuable model for studying pancreatic exocrine biology. Journal of Biological Chemistry. 292 (14), 5957-5969 (2017).
- Panzer, J. K., Cohrs, C. M., Speier, S. Using pancreas tissue slices for the study of islet physiology. Methods in Molecular Biology. 2128, 301-312 (2020).
- Klemen, M., Dolenšek, J., Stožer, A., Rupnik, M. Exocytosis Methods. Thorn, P. 7, Humana Press. 127-146 (2014).
- Speier, S. Experimental approaches for high-resolution in vivo imaging of islet of Langerhans biology. Current Diabetes Reports. 11 (5), 420-425 (2011).
- Leibiger, I. B., Berggren, P. O. Intraocular in vivo imaging of pancreatic islet cell physiology/pathology. Molecular Metabolism. 6 (9), 1002-1009 (2017).
- Reissaus, C. A., et al. A Versatile, portable intravital microscopy platform for studying beta-cell biology in vivo. Scientific Reports. 9 (1), 8449(2019).
- Jacob, S., et al. In vivo Ca(2+) dynamics in single pancreatic beta cells. FASEB Journal. 34 (1), 945-959 (2020).
- Fernandez, J., Valdeolmillos, M. Synchronous glucose-dependent [Ca2+]i oscillations in mouse pancreatic islets of Langerhans recorded in vivo. FEBS Letters. 477 (1-2), 33-36 (2000).
- Almaca, J., Weitz, J., Rodriguez-Diaz, R., Pereira, E., Caicedo, A. The pericyte of the pancreatic islet regulates capillary diameter and local blood flow. Cell Metabolism. 27 (3), 630-644 (2018).
- Weitz, J. R., et al. Mouse pancreatic islet macrophages use locally released ATP to monitor beta cell activity. Diabetologia. 61 (1), 182-192 (2018).
- Tian, G., Sandler, S., Gylfe, E., Tengholm, A. Glucose- and hormone-induced cAMP oscillations in α- and β-cells within intact pancreatic islets. Diabetes. 60 (5), 1535-1543 (2011).
- Benninger, R. K., Zhang, M., Head, W. S., Satin, L. S., Piston, D. W. Gap junction coupling and calcium waves in the pancreatic islet. Biophysical Journal. 95 (11), 5048-5061 (2008).
- Santos, R. M., et al. Widespread synchronous Ca oscillations due to bursting electrical activity in single pancreatic islets. Pflügers Archive: European Journal of Physiology. 418 (4), 417-422 (1991).
- terk, M., et al. Assessing the origin and velocity of Ca2+ waves in three-dimensional tissue: Insights from a mathematical model and confocal imaging in mouse pancreas tissue slices. Communications in Nonlinear Science and Numerical Simulation. 93, 105495(2021).
- Gosak, M., et al. Critical and supercritical spatiotemporal calcium dynamics in beta cells. Frontiers in Physiology. 8, 1106(2017).
- Satin, L. S., Butler, P. C., Ha, J., Sherman, A. S. Pulsatile insulin secretion, impaired glucose tolerance and type 2 diabetes. Molecular Aspects in Medicine. 42, 61-77 (2015).
- Tengholm, A., Gylfe, E. Oscillatory control of insulin secretion. Molecular and Cellular Endocrinology. 297 (1-2), 58-72 (2009).
- Quesada, I., et al. Glucose induces opposite intracellular Ca2+ concentration oscillatory patterns in identified α- and β-cells within intact human islets of Langerhans. Diabetes. 55 (9), 2463-2469 (2006).
- Ferguson, J., Allsopp, R. H., Taylor, R. M., Johnston, I. D. Isolation and long term preservation of pancreatic islets from mouse, rat and guinea pig. Diabetologia. 12 (2), 115-121 (1976).
- Andersson, A. Isolated mouse pancreatic islets in culture: effects of serum and different culture media on the insulin production of the islets. Diabetologia. 14 (6), 397-404 (1978).
- Ramirez-Dominguez, M. Isolation of mouse pancreatic islets of Langerhans. Advances in Experimental Medicine and Biology. 938, 25-34 (2016).
- Carter, J., Dula, S., Corbin, K., Wu, R., Nunemaker, C. A practical guide to rodent islet isolation and assessment. Biological Procedures Online. 11 (1), 3-31 (2009).
- Daoud, J., Rosenberg, L., Tabrizian, M. Pancreatic islet culture and preservation strategies: advances, challenges, and future outlook. Cell Transplantation. 19 (12), 1523-1535 (2010).
- Zawalich, W. S., Yamazaki, H., Zawalich, K. C. Biphasic insulin secretion from freshly isolated or cultured, perifused rodent islets: comparative studies with rats and mice. Metabolism. 57 (1), 30-39 (2008).
- Roe, M. W., et al. Absence of effect of culture duration on glucose-activated alterations in intracellular calcium concentration in mouse pancreatic islets. Diabetologia. 38, 876-877 (1995).
- Shuai, H., Xu, Y., Yu, Q., Gylfe, E., Tengholm, A. Fluorescent protein vectors for pancreatic islet cell identification in live-cell imaging. Pflügers Archive. European Journal of Physiology. 468 (10), 1765-1777 (2016).
- Dolenšek, J., et al. Glucose-dependent activation, activity, and deactivation of beta cell networks in acute mouse pancreas tissue slices. bioRxiv. , (2020).
- QZhang, Q., et al. Cell coupling in mouse pancreatic beta-cells measured in intact islets of Langerhans. Philosophical Transactions. Series A, Mathematical, Physical, and Engineering Sciences. 366 (1880), 3503-3523 (2008).
- Sánchez-Cárdenas, C., Hernández-Cruz, A. GnRH-induced Ca2+-signalling patterns in mouse gonadotrophs recorded from acute pituitary slices in vitro. Neuroendocrinology. 91 (3), 239-255 (2010).
- Asada, N., Shibuya, I., Iwanaga, T., Niwa, K., Kanno, T. Identification of alpha- and beta-cells in intact isolated islets of Langerhans by their characteristic cytoplasmic Ca2+ concentration dynamics and immunocytochemical staining. Diabetes. 47 (5), 751-757 (1998).
- Nadal, A., Quesada, I., Soria, B. Homologous and heterologous asynchronicity between identified α-, β- and δ-cells within intact islets of Langerhans in the mouse. Journal of Physiology. 517 (1), 85-93 (1999).
- Shuai, H., Xu, Y., Yu, Q., Gylfe, E., Tengholm, A. Fluorescent protein vectors for pancreatic islet cell identification in live-cell imaging. Pflugers Archive: European Journal of Physiology. 468 (10), 1765-1777 (2016).
- Cabrera, O., et al. Glutamate is a positive autocrine signal for glucagon release. Cell Metabolism. 7 (6), 545-554 (2008).
- Li, J., et al. Submembrane ATP and Ca2+ kinetics in α-cells: unexpected signaling for glucagon secretion. FASEB Journal. 29 (8), 3379-3388 (2015).
- Hamilton, A., et al. Adrenaline stimulates glucagon secretion by Tpc2-dependent Ca(2+) mobilization from acidic stores in pancreatic α-cells. Diabetes. 67 (6), 1128-1139 (2018).
- Arrojo, E. D. R., et al. Structural basis for delta cell paracrine regulation in pancreatic islets. Nature Communications. 10 (1), (2019).
- DiGruccio, M. R., et al. Comprehensive alpha, beta and delta cell transcriptomes reveal that ghrelin selectively activates delta cells and promotes somatostatin release from pancreatic islets. Molecular Metabolism. 5 (7), 449-458 (2016).
- Adriaenssens, A. E., et al. Transcriptomic profiling of pancreatic alpha, beta and delta cell populations identifies delta cells as a principal target for ghrelin in mouse islets. Diabetologia. 59 (10), 2156-2165 (2016).
- Rorsman, P., Huising, M. O. The somatostatin-secreting pancreatic δ-cell in health and disease. Nature reviews. Endocrinology. 14 (7), 404-414 (2018).
- Petersen, C. C., Toescu, E. C., Petersen, O. H. Different patterns of receptor-activated cytoplasmic Ca2+ oscillations in single pancreatic acinar cells: dependence on receptor type, agonist concentration and intracellular Ca2+ buffering. The EMBO journal. 10 (3), 527-533 (1991).
- Thorn, P., Lawrie, A. M., Smith, P. M., Gallacher, D. V., Petersen, O. H. Local and global cytosolic Ca2+ oscillations in exocrine cells evoked by agonists and inositol trisphosphate. Cell. 74 (4), 661-668 (1993).
- Behrendorff, N., Floetenmeyer, M., Schwiening, C., Thorn, P. Protons released during pancreatic acinar cell secretion acidify the lumen and contribute to pancreatitis in mice. Gastroenterology. 139 (5), e1711-e1715 (2010).
- Criddle, D. N., et al. Cholecystokinin-58 and cholecystokinin-8 exhibit similar actions on calcium signaling, zymogen secretion, and cell fate in murine pancreatic acinar cells. American Journal of Physiology. Gastrointestinal and Liver Physiology. 297 (6), G1085-G1092 (2009).
- Venglovecz, V., et al. Effects of bile acids on pancreatic ductal bicarbonate secretion in guinea pig. Gut. 57 (8), 1468-3288 (2008).
- Maleth, J., Hegyi, P. Calcium signaling in pancreatic ductal epithelial cells: an old friend and a nasty enemy. Cell Calcium. 55 (6), 337-345 (2014).
- Nadal, A., Quesada, I., Soria, B. Homologous and heterologous asynchronicity between identified alpha-, beta- and delta-cells within intact islets of Langerhans in the mouse. Journal of Physiology. 517 (Pt 1), 85-93 (1999).
- Skelin Klemen, M., Dolenšek, J., Slak Rupnik, M., Stožer, A. The triggering pathway to insulin secretion: Functional similarities and differences between the human and the mouse β cells and their translational relevance. Islets. 9 (6), 109-139 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır