このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
膨張したキチン発泡体の調製と水性銅の除去における使用
要約
本研究では、特殊な装置を必要としない化学的手法により、発泡体にチチンを拡大する方法を説明する。
要約
チチンは、不利用、自然に豊富、機械的に堅牢で化学的に耐性のあるバイオポリマーです。これらの性質は吸着剤に望ましいが、キチンは必要な比表面積を欠き、その修飾は特殊な技術および装置を含む。ここでは、エビ殻廃棄物に由来するチチンフレークを、より高い表面積を有する泡に拡大するための新しい化学的手順について説明する。このプロセスは、Chitinゲルに閉じ込められたNaHとの水の反応からH2 ガスの進化に依存しています。準備方法は特殊な装置を必要としない。粉末X線回折およびN2-physiorptionは、結晶子サイズが6.6nmから4.4nmに減少し、比表面積が12.6 ±から2.1m2/gに増加し、0.2m2/g±73.9に増加することを示しています。しかし、赤外分光法および熱重量分析は、このプロセスがキチンの化学的同一性を変えないことを示している。拡張キチンの特異的なCu吸着能力は、比表面積に比例して13.8±2.9mg/gから2.0mg/g±73.1に増加します。しかし、表面密度としてのCu吸着能力は、平均10.1±0.8原子/nm2で比較的一定であり、これは再びキチンの化学的同一性に変化がないことを示唆している。この方法は、その望ましい特性を犠牲にすることなく、より高い表面積材料にチチンを変換する手段を提供する。キチン発泡体は吸着剤としてここに記載されているが、触媒支持体、熱絶縁体、及び構造材料として構想することができる。
概要
チチンは機械的に堅牢で化学的に不活性な生体高分子であり、自然量1のセルロースに次ぐ。これは、節足動物の外骨格と真菌と酵母2の細胞壁における主要な成分です。キチンはセルロースに似ているが、各モノマーの1つのヒドロキシル基をアセチルアミン基に置換した(図1A、B)。この差は、隣接するポリマー鎖間の水素結合の強度を増加させ、その特徴的な構造的弾性と化学的不活性度2、3を与える。その特性と豊富さのために、チチンは重要な産業と学術的関心を集めています。組織成長4、5、6、複合材料7、8、9、10、11の成分、および吸着剤および触媒11、12、13、14のサポートとして研究されている。その化学的安定性は、特に、キチンを一般的な吸着剤14に不快な条件を伴う吸着用途にとって魅力的なものとする。また、アミン基の豊富さは、キチンを金属イオン15に対する効果的な吸着剤にする。しかし、酸性条件下でのアミン基のプロトネーションは、キチン16の金属吸着能を低下させる。成功した戦略は、プロトネーション17、18に対してより耐性の吸着部位を導入することです。代わりに、本明細書では、キチン中の吸着部位の数を増加させる単純な方法について説明する。
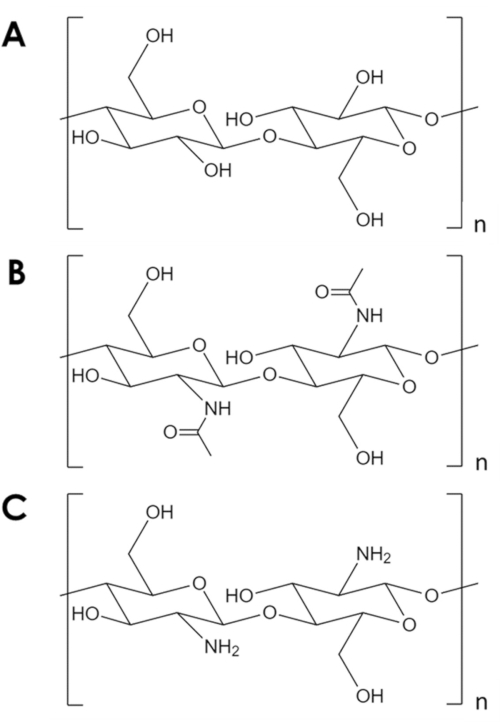
図 1.化学構造。 (A) セルロース、 (B) キチン, (C) キトサン. ここをクリックして、この図の大きなバージョンを表示してください。
その多くの潜在的な用途にもかかわらず、チチンは十分に利用されていない。キチン加工は、ほとんどの溶剤に対する溶解度が低いため、困難です。触媒および吸着におけるその使用の重要な制限は、その低比表面積である。典型的な炭素および金属酸化物支持体は、102-103 m2/gの順序で比表面積を有するが、商業キチンフレークは10m2/g 19、20、21の順序で表面積を有する。発泡体にキチンを拡大する方法は存在するが、それらは常に高温および圧力、強い酸および塩基、または重要な入り口の障壁5、21、22、23、24、25を表す特殊な装置に依存する。また、これらの方法はキトサンを形成するためにキチンを脱アセチル化する傾向がある(図1C)−より可溶性で反応性のバイオポリマー5、25、26。
本明細書において、キチンを固体発泡体に拡大し、その比表面積および吸着能力を高め、その化学的完全性を維持する方法について記載されている。この方法は、チチンゲル内からのガスの急速な進化に依存し、特殊な機器を必要としません。膨張したキチンの吸着能力の増大は、水性Cu2+-局所地下水26における一般的な汚染物質で実証される。
| 単位 | ニートフレーク | 焼き泡 | 凍結乾燥フォーム | |
| 結晶 | % | 88 | 74 | 58 |
| クリスタルサイズ | 海里 | 6.5 | 4.4 | 4.4 |
| 表面積 | m2/g | 12.6 ± 2.1 | 43.1 ± 0.2 | 73.9 ± 0.2 |
| キュ・テイク | mg/g | 13.8 ± 2.9 | 48.6 ± 1.9 | 73.1 ± 2.0 |
| キュ・テイク | 原子/nm2 | 10.5 ± 2.8 | 10.7 ± 0.4 | 9.4 ± 0.3 |
表 1.材料特性の概要。 チチン発泡体は、清楚なチチンフレークに対して結晶性と結晶サイズが低い。しかし、チチンフォームの比表面積とCu取り込みは、きちんとしたチチンフレークのそれよりも比例して高くなっています。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. 拡大したチチンの調製
- ジメチルアセトアミド(DMAc)で5重量%LiClの250 mL溶液を調製する
注意: 溶剤DMAcは、生殖能力を損ない、出生時欠損を引き起こす可能性のある可燃性刺激物です。皮膚や目との接触を避けるために、化学耐性手袋とゴーグルを使用してヒュームフードでDMAcを処理します。- 500 mLのエルレンマイヤーフラスコにLiClの15gと285g(268 mL)を加え、50mmポリテトラフルオロエチレン(PTFE)裏面の磁気攪拌棒を入れる。
- フラスコにゴム中隔をかぶり、加熱攪拌板に置きます。中隔を通して温度プローブを混合物に入れます。すべてのLiClが溶解するまで400 rpmと80°Cで混合物をかき混ぜる(〜4時間)
- オーブン乾燥したチチンフレークをLiCl/DMAc溶液に溶かし、ゾルゲルを形成する
- 80°Cのオーブンで少なくとも1.2gのチチンフレークを24時間乾燥させます。
- オーブン乾燥したチチンフレーク1.0g、5重量%LiCl/DMAc溶液250mLを500mL丸底フラスコに加えます。50 mm PTFE が並ぶ磁気攪拌棒を置きます。
- フラスコにゴム中隔をかぶり、攪拌熱ブロックに置きます。中隔を針で突き刺し、フラスコが通気できるようにしておきます。ブロックを80°Cに加熱し、すべてのチチンが溶解するまで400rpmで混合物をかき混ぜます(24-48時間)。
- 得られたチチンゾルゲルを、攪拌を続けながら室温までゆっくりと冷却します(〜1時間)。
- 室温に一度、氷浴中にチチンゾルゲルを含むフラスコを入れ、温度が安定するまで撹拌を続けます(〜20分)。
- DMAcでNaHの100 mLスラリーを準備します。
注意:水と接触しているNaHは、自発的に発火する可能性のある可燃性ガスを放出します。湿った空気との接触を制限するために、NaHは使用前に洗い流さなければならない鉱物油に貯蔵される。耐薬品性の手袋とゴーグルを使用して、ヒュームフードで注意して取り扱います。- ミネラルオイル貯蔵から約1gのNaHを取り出し、10mLのヘキサンで3回洗います。
- 250 mL のエルレンマイヤーフラスコに DMAC 100 mL を加え、洗浄した NaH の 0.82 g を加え、PTFE が並ぶ磁気攪拌棒を置きます。
- 混合物を旋回してNaH/DMAcスラリーを作ります。
注:NaHは完全に溶解しません。
- 全てのNaH/DMAcスラリーをチチンゾルゲルに加えて、チチンゲルを形成します。
- 冷却したゾルゲルをアンキャップし、激しくかき混ぜながらNaHスラリーをすべて加えます。キャップを交換し、72時間、またはフラスコにゲルが形成されるまで400rpmで混合物をかき混ぜ続けます。
- チチンゲルに水を加えて、チチンフォームを形成します。
- ゲルの形成後、フラスコを脱いで、100 mLの脱イオン化(DI)水を加えます。
注:プロセスはH2 ガスを進化させるので、ヒュームフードでこのステップを実行することが重要です。
- ゲルの形成後、フラスコを脱いで、100 mLの脱イオン化(DI)水を加えます。
- 分離し、水とメタノールでチチンフォームを洗浄し、DMAcと塩を除去します。
- フラスコから膨張したチチンフォームを取り出し、それを保持するのに十分な大きさの結晶化皿またはビーカーに入れ、1000mLのDI水を入れます。
注:チチンフォームは一枚で出てこなず、分割する必要があります。 - 500mLのDI水で、単離ゲルを3回リンスします。ゲルを1000mLのDI水に24時間浸し、その後500mLのメタノールに24時間、最後に24時間DI水1000mLに浸します。
- 水洗いからエキスパンドチチンフォームを取り出し、24〜48時間空気乾燥させます。
- フラスコから膨張したチチンフォームを取り出し、それを保持するのに十分な大きさの結晶化皿またはビーカーに入れ、1000mLのDI水を入れます。
- 洗浄したチチンゲルを乾燥させて固体フォームを形成し、次に粉末状に粉砕します。
- オーブン内で85°Cのオーブンで周囲の空気の下で48時間乾燥するか、-43°Cで凍結乾燥剤を乾燥させ、48時間乾燥させます。
- 乳鉢と害虫を使用して、乾燥したチチンフォームを細かい粉末に粉砕します。

図 2.発泡チチン発泡体の調製。 (A) LiCl/DMAc溶液中の初期のチチン。(B) NaH/DMAcスラリーの添加。(C)水を添加した後のチチンフォーム。(D)反応フラスコから抽出したチチン発泡体。(E)水洗い時にチチンフォーム。 この図の大きなバージョンを表示するには、ここをクリックしてください。
2. 吸着性の開発
- aqの500 mLストックソリューションを準備します。Cu2+(MW 63.5 g/mol)濃度で 50 mg/L, 100 mg/L, 200 mg/L, 300 mg/L, 400 mg/L, 450 mg/L.これを行うには、90 mg、180 mg、360 mg、540 mg、720 mg、および 810 mg の Cu(NO3)2·2.5 H2O (MW 232.6 g/mol) 6個の容器にそれぞれ。500mLの水を18MΩに加え、容器にキャップを入れ、揺して固形物を溶かします。
- 各ストック溶液の100mLに50mgのキチンを加え、pHを7に調整し、48時間平衡化します。
- ヘッドスペースを最小限に抑えられるように、各ストック溶液の100 mLを100 mLのコンテナに移します。各容器に50mgの挽いたチチンを加え、キャップします。
- 軌道シェーカーに容器を置き、60 rpmで30分間振ります。次に、軌道シェーカーからコンテナを取り出し、NH4HCO3 またはHNO3を使用してpHを7に調整します。
- コンテナを軌道シェーカーに戻し、60 rpmで一定の温度で48時間振ります。実験室を全体で18±2 °Cで維持する。
- 初期ストック溶液のCu濃度と、チチンを添加したもののCu濃度を測定します。着色二分性ニチンコニン酸法、着色度計、および事前測定試薬パケット27を使用する。
- 軌道シェーカーから容器を取り出し、混合物を最低30分間落ち着かせ、0.3 μmのガラスマイクロファイバーフィルターを取り付けた注射器で1mLアリコートを取ります。
- アリコートを250mLの容器に移し、18MΩの水で100mLに希釈します。
注:このステップは、測色計を使用してバイチンコニン酸法によるCu(5 mg/L)の検出の低い天井に必要です。 - 希釈したサンプルの10mLをキュベットに移します。キュベットを測色計に入れ、器具をゼロにします。
- キュベットの希釈サンプルに、あらかじめ測定されたCu試薬(ビチンチオン酸法)の1パケットを加え、キレート反応が完了するまで45s待ちます。ソリューションが紫色になるようにします。形成される色の強度はCu濃度に比例する。
- キュベットをカラーリメータに戻し、希釈したサンプルのCu濃度を測定します。希釈したサンプルの濃度に100を掛けて、元のサンプルの濃度を求めます。
- 吸着データから最大Cu取り込み値を抽出します。
- 式28を使用して、各平衡Cu濃度の各サンプルの取り込み量を計算します。

- サンプルの吸着取りと平衡濃度をプロットし、標準的なCu吸着吸着性を作製します。
- 線形化されたCu吸着アイゾルムを生成するために取り込みと平衡濃度に対する平衡濃度の比率をプロットする。
注: プロットは線形で、勾配の逆は Cu の最大取り込み値を表します。
- 式28を使用して、各平衡Cu濃度の各サンプルの取り込み量を計算します。
Access restricted. Please log in or start a trial to view this content.
結果
拡大されたチチンは、乾燥方法に関係なく同じ形態を示す。図3は、清楚なチチンフレーク(図3A1)、オーブン乾燥エキスパンドチチン(図3B1)、および凍結乾燥エキスパンドチチン(図3C3)の画像を示す。きちんとしたフレークは粗い砂の外観を持っていますが、膨張したキチンフォームはポップトウモロ?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
チチン発泡体製造のための提案された方法は、特殊な機器や技術を必要とせずに、このようなフォームの生産を可能にします。チチンフォームの製造は、チチンゾルゲル内の水素化ナトリウムの懸濁液に依存する。大気からの水との接触は、ヒチンマトリックスのゲル化と水素ガスの分解によって水素ガスの分解を誘導する。したがって、調製物の重要なステップは、ソルゲルの(1)形成、(2)?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは開示するものは何もない。
謝辞
研究は、戦闘能力開発司令部陸軍研究所(協力協定番号W911NF-15-2-0020)によって後援されました。この資料で表明された意見、調査結果、結論、または勧告は著者のものであり、必ずしも陸軍研究所の見解を反映しているわけではありません。
モンタナ工科大学先端材料加工センター(CAMP)に、本研究に必要な特殊な機器の一部を使用していただき、感謝します。また、ゲイリー・ワイス、ナンシー・オイヤー、リック・ラドゥーサー、ジョン・カートリー、キャサリン・ゾドローの技術支援と有益な議論に感謝します。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Ammonium bicarbonate | Sigma-Aldrich | 9830 | NH4HCO3, ≥99.5 % |
| Chitin | Sigma-Aldrich | C7170 | Pandalus borealis, practical grade |
| Colorimeter | Hanna Instruments | HI83399-01 | Photometer for wastewater analysis |
| Copper High Range Checker | Hanna Instruments | HI702 | Bicinchoninate colorimetric titration |
| Copper nitrate hydrate | Sigma-Aldrich | 223395 | Cu(NO3)2 · 2.5 H2O, 98 % |
| Dimethylacetamide (DMAc) | Sigma-Aldrich | 271012 | Anhydrous, 99.8 % |
| IR Spectrophotometer | Thermo Nicolet | Nexus 670 | Fitted with an ATR cell |
| Lithium chloride | Sigma-Aldrich | 310468 | LiCl, ≥99 % |
| N2 Physisorption Apparatus | Micromeritics | Tristar II | |
| Nitric acid | BDH | BDH7208-1 | HNO3, 0.1 N |
| Scanning electron microscope | Zeiss LEO | 1430 VP | 15 kV, secondary electron detector, 29-31 mm working distance |
| Sodium hydride | Sigma-Aldrich | 223441 | NaH, packed in mineral oil, 90 % |
| Thermogravimetric analyzer | TA Instruments | Q500 | 100 ml/min N2, 10 °C/min to 800 °C |
| Water Purification System | Millipore | Milli-Q | Type A water (18 MΩ) |
| X-Ray Diffractometer | Rigaku | Ultima IV | Cu K-α radiation, 8.04 keV |
参考文献
- Rinaudo, M. Chitin and chitosan: Properties and applications. Progress in Polymer Science. 31 (7), 603-632 (2006).
- Percot, A., Viton, C., Domard, A. Optimization of chitin extraction from shrimp shells. Biomacromolecules. 4 (1), 12-18 (2003).
- Austin, P. R. Chitin solvents and solubility parameters. Chitin, Chitosan, and Related Enzymes. , 227-237 (1984).
- Deepthi, S., Venkatesan, J., Kim, S. K., Bumgardner, J. D., Jayakumar, R. An overview of chitin or chitosan/nano ceramic composite scaffolds for bone tissue engineering. International Journal of Biological Macromolecules. 93, 1338-1353 (2016).
- Tao, F., et al. Applications of chitin and chitosan nanofibers in bone regenerative engineering. Carbohydrate Polymers. 230, 115658(2020).
- Zhao, L., et al. Regulation of the morphological and physical properties of a soft tissue scaffold by manipulating DD and DS of O-carboxymethyl chitin. ACS Applied Bio Materials. 3 (9), 6187-6195 (2020).
- Duan, Y., Freyburger, A., Kunz, W., Zollfrank, C. Cellulose and chitin composite materials from an ionic liquid and a green co-solvent. Carbohydrate Polymers. 192, 159-165 (2018).
- Kadokawa, J., Takegawa, A., Mine, S., Prasad, K. Preparation of chitin nanowhiskers using an ionic liquid and their composite materials with poly(vinyl alcohol). Carbohydrate Polymers. 84 (4), 1408-1412 (2011).
- Chen, Z., Wang, J., Qi, H. J., Wang, T., Naguib, H. E. Green and sustainable layered chitin-vitrimer composite with enhanced modulus, reprocessability, and smart actuator function. ACS Sustainable Chemistry and Engineering. 8 (40), 15168-15178 (2020).
- Zhang, Z., Lucia, L. A. Chitin-clay composite gels with enhanced thermal stability prepared in a green and facile approach. Journal of Materials Science. 56 (4), 3600-3611 (2021).
- Ahmed, M. J., Hameed, B. H., Hummadi, E. H. Review on recent progress in chitosan/chitin-carbonaceous material composites for the adsorption of water pollutants. Carbohydrate Polymers. 247, 116690(2020).
- Matsuoka, A., et al. Hydration of nitriles to amides by a chitin-supported ruthenium catalyst. RSC Advances. 5 (16), 12152-12160 (2015).
- Wang, Y., Li, Y., Liu, S., Li, B. Fabrication of chitin microspheres and their multipurpose application as catalyst support and adsorbent. Carbohydrate Polymers. 120, 53-59 (2015).
- Anastopoulos, I., Bhatnagar, A., Bikiaris, D., Kyzas, G. Chitin Adsorbents for Toxic Metals: A Review. International Journal of Molecular Sciences. 18 (1), 114(2017).
- Habiba, U., Afifi, A. M., Salleh, A., Ang, B. C. Chitosan/(polyvinyl alcohol)/zeolite electrospun composite nanofibrous membrane for adsorption of Cr6+, Fe3+ and Ni2+. Journal of Hazardous Materials. 322, 182-194 (2017).
- Kim, U. J., et al. Protein adsorption of dialdehyde cellulose-crosslinked chitosan with high amino group contents. Carbohydrate Polymers. 163, 34-42 (2017).
- He, Y., et al. Fabrication of PVA nanofibers grafted with octaamino-POSS and their application in heavy metal adsorption. Journal of Polymers and the Environment. , (2020).
- Tian, H., et al. Electrospinning of polyvinyl alcohol into crosslinked nanofibers: An approach to fabricate functional adsorbent for heavy metals. Journal of Hazardous Materials. 378, (2019).
- Meille, V. Review on methods to deposit catalysts on structured surfaces. Applied Catalysis A: General. 315, 1-17 (2006).
- Dotto, G. L., Cunha, J. M., Calgaro, C. O., Tanabe, E. H., Bertuol, D. A. Surface modification of chitin using ultrasound-assisted and supercritical CO2 technologies for cobalt adsorption. Journal of Hazardous Materials. 295, 29-36 (2015).
- Phongying, S., Aiba, S., Chirachanchai, S. Direct chitosan nanoscaffold formation via chitin whiskers. Polymer. 48 (1), 393-400 (2007).
- Tan, T. S., Chin, H. Y., Tsai, M. L., Liu, C. L. Structural alterations, pore generation, and deacetylation of α- and β-chitin submitted to steam explosion. Carbohydrate Polymers. 122, 321-328 (2015).
- Chang, F. S., Chin, H. Y., Tsai, M. L. Preparation of chitin with puffing pretreatment. Research on Chemical Intermediates. 44 (8), 4939-4955 (2018).
- Goodrich, J. D., Winter, W. T. α-Chitin Nanocrystals prepared from shrimp shells and their specific surface area measurement. Biomacromolecules. 8 (1), 252-257 (2007).
- Rolandi, M., Felts, J. Naturally sourced chitin foam. , US 2020/0239670 A1 (2020).
- McDermott, S., Hailer, M. K., Lead, J. R. Meconium identifies high levels of metals in newborns from a mining community in the U.S. Science of the Total Environment. 707, 135528(2020).
- Hach Handbook of Water Analysis. Copper, Bicinchoninate Method, Method 8506. Hach Handbook of Water Analysis. , (1979).
- Crittenden, J. C., Trusell, R. R., Hand, D. R., Howe, K. J., Tchbanoglous, G. Adsorption. MWH's Water Treatment. , 1117(2012).
- Focher, B., Beltrame, P. L., Naggi, A., Torri, G. Alkaline N-deacetylation of chitin enhanced by flash treatments. Reaction kinetics and structure modifications. Carbohydrate Polymers. 12 (4), 405-418 (1990).
- Scherrer, P. Determination of the size and the internal structure of colloidal particles by means of X-rays. News from the Society of Sciences in Göttingen, Mathematical- Physical Class. 2, 98-100 (1918).
- Brunauer, S., Emmett, P. H., Teller, E. Adsorption of gases in multimolecular layers. Journal of the American Chemical Society. 60 (2), 309-319 (1938).
- Sing, K. S. W. Adsorption methods for the characterization of porous materials. Advances in Colloid and Interface Science. 76-77, 3-11 (1998).
- Rouquerol, J., Llewellyn, P., Rouquerol, F. Is the bet equation applicable to microporous adsorbents. Studies in Surface Science and Catalysis. 160, 49-56 (2007).
- Vorokh, A. S. Scherrer formula: estimation of error in determining small nanoparticle size. Nanosystems: Physics, Chemistry, Mathematics. , 364-369 (2018).
- Labidi, A., Salaberria, A. M., Fernandes, S. C. M., Labidi, J., Abderrabba, M. Adsorption of copper on chitin-based materials: Kinetic and thermodynamic studies. Journal of the Taiwan Institute of Chemical Engineers. 65, 140-148 (2016).
- Tian, M., Zhao, T. Q., Chin, P. L., Liu, B. S., Cheung, A. S. -C. Methane and propane co-conversion study over zinc, molybdenum and gallium modified HZSM-5 catalysts using time-of-flight mass-spectrometry. Chemical Physics Letters. 592, 36-40 (2014).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved