É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Preparação de espumas de cebolinha expandidas e seu uso na remoção de cobre aquoso
Neste Artigo
Resumo
Este estudo descreve um método para expandir a quitina em uma espuma por técnicas químicas que não requerem equipamentos especializados.
Resumo
A quitina é um biopolímero pouco explorado, naturalmente abundante, mecanicamente robusto e quimicamente resistente. Essas qualidades são desejáveis em um adsorbent, mas a quitina não possui a área de superfície específica necessária, e sua modificação envolve técnicas e equipamentos especializados. Aqui é descrito um novo procedimento químico para a expansão de flocos de quitina, derivados de resíduos de casca de camarão, em espumas com área de superfície mais alta. O processo conta com a evolução do gás H2 a partir da reação da água com NaH preso em um gel de quitina. O método de preparação não requer nenhum equipamento especializado. Difração de raios-X em pó e N2-fissionação indicam que o tamanho da cristallite diminui de 6,6 nm para 4,4 nm e a área de superfície específica aumenta de 12,6 ± 2,1 m2/g para 73,9 ± 0,2 m2/g. No entanto, espectroscopia infravermelha e análise termogravitamétrica indicam que o processo não altera a identidade química da quitina. A capacidade específica de adsorção de da quitina expandida aumenta em proporção a área de superfície específica de 13,8 ± 2,9 mg/g para 73,1 ± 2,0 mg/g. No entanto, a capacidade de adsorção de como densidade superficial permanece relativamente constante a uma média de 10,1 ± 0,8 átomo/nm2,o que novamente sugere nenhuma mudança na identidade química da quitina. Este método oferece os meios para transformar a quitina em um material de área de superfície superior sem sacrificar suas propriedades desejáveis. Embora a espuma de quitin seja descrita aqui como um adsorbente, ela pode ser imaginada como um suporte catalisador, isolador térmico e material estrutural.
Introdução
A quittina é um biopolímero mecanicamente robusto e quimicamente inerte, perdendo apenas para a celulose em abundância natural1. É o principal componente no exoesqueleto de artrópodes e nas paredes celulares de fungos eleveduras 2. A quitina é semelhante à celulose, mas com um grupo hidroxílico de cada monômero substituído por um grupo de amina acetil(Figura 1A, B). Essa diferença aumenta a força da ligação de hidrogênio entre as cadeias de polímeros adjacentes e dá à chitina sua resiliência estrutural característica e inerte química2,3. Devido às suas propriedades e abundância, a quitina tem atraído interesse industrial e acadêmico significativo. Tem sido estudado como um andaime para o crescimento tecidual4,5,6, como componente em materiais compostos7,8,9,10,11, e como suporte para adsorbents e catalisadores11,12,13,14. Sua estabilidade química, em particular, torna a quittina atraente para aplicações de adsorção que envolvem condições inóspitas aos adsorventes comuns14. Além disso, a abundância de grupos de amina tornam a quitina um adsorbent eficaz para íons metálicos15. No entanto, a protonação dos grupos de amina em condições ácidas reduz a capacidade de adsorção metálica da quittina16. Uma estratégia bem sucedida é introduzir sites de adsorção mais resistentes à prótonação17,18. Em vez disso, aqui é descrito um método simples para aumentar a área de superfície específica e, portanto, o número de sites de adsorção em quitina.
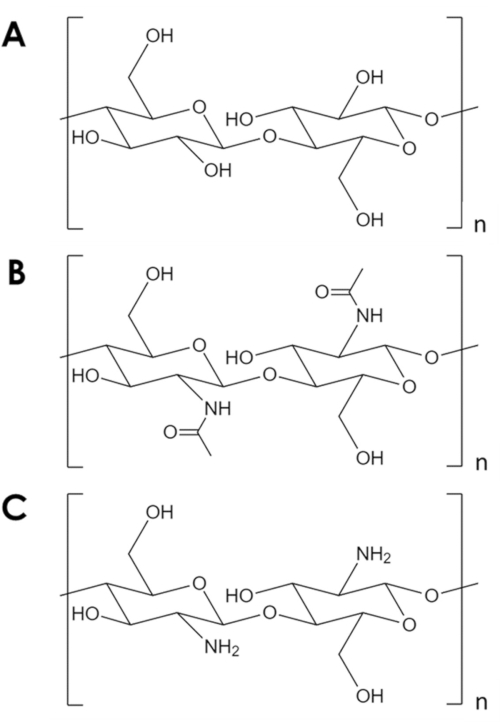
Figura 1. Estrutura química. (A) celulose, (B) chitina, (C) chitosan. Por favor clique aqui para ver uma versão maior desta figura.
Apesar de seus muitos usos potenciais, a quitina é subutilizada. O processamento de quitina é desafiador devido à sua baixa solubilidade na maioria dos solventes. Uma limitação fundamental ao seu uso em catálise e adsorção é sua área de superfície específica baixa. Enquanto os suportes típicos de carbono e óxido metálico têm áreas de superfície específicas na ordem 102-103 m2/g, os flocos comerciais de quitina têm áreas superficiais na ordem de 10 m2/g19,20,21. Existem métodos para expandir a quitina em espumas, mas invariavelmente dependem de alta temperatura e pressão, ácidos e bases fortes, ou equipamentos especializados que representam uma barreira de entrada significativa5,21,22,23,24,25. Além disso, esses métodos tendem a desacetilar a quitina para formar o quitosan (Figura 1C)-um biopolímero mais solúvel e reativo5,25,26.
Aqui, um método é descrito para expandir a quitina em espumas sólidas, aumentar sua área de superfície específica e capacidade de adsorção, e manter sua integridade química. O método conta com a rápida evolução do gás de dentro de um gel de quitina e não requer equipamentos especializados. O aumento da capacidade de adsorção da quitina expandida é demonstrado com2+aquoso -um contaminante comum nas águas subterrâneas locais26.
| Unidade | Floco Puro | Espuma Assada | Espuma lyophilizada | |
| Cristalinidade | % | 88 | 74 | 58 |
| Tamanho do cristal | Nm | 6.5 | 4.4 | 4.4 |
| Área de superfície | m2/g | 12.6 ± 2.1 | 43.1 ± 0.2 | 73,9 ± 0,2 |
| Uptake | mg/g | 13,8 ± 2,9 | 48,6 ± 1,9 | 73.1 ± 2.0 |
| Uptake | átomo/nm2 | 10.5 ± 2.8 | 10.7 ± 0.4 | 9.4 ± 0.3 |
Mesa 1. Resumo das propriedades do material. As espumas de quitina têm cristalidade mais baixa e tamanho de cristal em relação aos flocos de quitina puros. No entanto, a área de superfície específica e a absorção de das espumas de quitina são proporcionalmente maiores do que as dos flocos de quitina puros.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Preparação de quitina expandida
- Prepare uma solução de 250 mL de 5 wt% LiCl em dimetilacetamida (DMAc)
ATENÇÃO: O DMAc solvente é um irritante combustível que pode danificar a fertilidade e causar defeitos congênitos. Manuseie dMAc em um capô de fumaça usando luvas e óculos resistentes químicos para evitar contato com a pele e os olhos.- Adicione 15 g de LiCl e 285 g (268 mL) de DMAc em um frasco de 500 mL Erlenmeyer com, em seguida, coloque uma barra de agitação magnética revestida de Politetrafluoroetileno de 50 mm (PTFE).
- Tampe o frasco com um septo de borracha e coloque-o em uma placa de agitação de aquecimento. Coloque uma sonda de temperatura através do septo na mistura. Mexa a mistura a 400 rpm e 80 °C até que toda a Cicl seja dissolvida (~ 4 h)
- Dissolva 1,0 g de flocos de quitina secas no forno na solução LiCl/DMAc para formar um sol-gel
- Seque pelo menos 1,2 g de flocos de quitina em um forno a 80°C por 24 h.
- Adicione 1,0 g de flocos de quitina secas no forno e 250 mL de solução licl/DMAc de 5 wt% em um frasco de fundo redondo de 500 mL. Coloque uma barra de agitação magnética forrada com PTFE de 50 mm.
- Tampe o frasco com um septo de borracha e coloque-o em um bloco de calor agitado. Fure o septo com uma agulha e deixe-o para permitir que o frasco desabafe. Aqueça o bloco a 80 °C e mexa a mistura a 400 rpm até que toda a quitina seja dissolvida (24-48 h).
- Deixe que o sol-gel de quitina resultante esfrie até a temperatura ambiente lentamente enquanto continua a mexer (~ 1 h).
- Uma vez à temperatura ambiente, coloque o frasco contendo o sol-gel de quittin em um banho de gelo e continue mexendo até que sua temperatura se estabilize (~ 20 min).
- Prepare um chorume de 100 mL de NaH em DMAc.
ATENÇÃO: O NaH em contato com a água libera gases inflamáveis que podem inflamar espontaneamente. Para limitar o contato com o ar úmido, o NaH é armazenado em óleo mineral que deve ser lavado antes do uso. Manuseie com cautela em um capô de fumaça usando luvas e óculos resistentes químicos.- Remova aproximadamente 1 g de NaH de seu armazenamento de óleo mineral e lave três vezes com 10 mL de hexanos.
- Adicione 100 mL de DMAC em um frasco de Erlenmeyer de 250 mL, depois adicione 0,82 g do NaH lavado e coloque uma barra de agitação magnética forrada com PTFE.
- Gire a mistura para produzir um chorume NaH/DMAc.
NOTA: O NaH não se dissolverá completamente.
- Forme o gel de quitina adicionando todo o chorume NaH/DMAc ao sol-gel de quittina.
- Despreite o sol-gel resfriado e adicione toda a chorume NaH enquanto mexe vigorosamente. Substitua a tampa e continue a mexer a mistura a 400 rpm por 72 h ou até que um gel se forme no frasco.
- Forme a espuma de cebolinha adicionando água ao gel de quitina.
- Após a formação do gel, descape o frasco e adicione 100 mL de água desionizada (DI).
NOTA: É fundamental realizar esta etapa em um capô de fumaça, pois o processo evoluirá gás H2.
- Após a formação do gel, descape o frasco e adicione 100 mL de água desionizada (DI).
- Isole e lave a espuma de cebolinha na água e no metanol para remover DMAc e sais.
- Remova a espuma de cebolinha expandida do frasco e coloque em um prato de cristalização ou béquer suficientemente grande para segurá-la e 1000 mL de água DI.
NOTA: A espuma de cebolinha não sairá inteira e pode ter que ser quebrada. - Enxágüe o gel isolado três vezes com 500 mL de água DI. Mergulhe o gel em 1000 mL de água DI por 24 h, depois em 500 mL de metanol por 24 h, e finalmente em 1000 mL de água DI por 24 horas novamente.
- Retire a espuma de cebolinha expandida da lavagem da água e deixe secar o ar por 24-48 h.
- Remova a espuma de cebolinha expandida do frasco e coloque em um prato de cristalização ou béquer suficientemente grande para segurá-la e 1000 mL de água DI.
- Seque o gel de quitina lavada para formar uma espuma sólida e depois triture em pó.
- Seque o gel no forno a 85 °C por 48 h sob ar ambiente, ou em um liofilizador a -43 °C e 0,024 mbar por 48 h.
- Usando uma argamassa e pilão, triture a espuma seca de cebolinha em um pó fino.

Figura 2. Preparação de espuma de cebolinha expandida. (A) A quitina inicial na solução LiCl/DMAc. (B) A adição do chorume NaH/DMAc. (C) A espuma de quitina após a adição de água. (D) A espuma de quitina extraída do frasco de reação. (E) A espuma de cebolinha durante a lavagem com água. Clique aqui para ver uma versão maior desta figura.
2. Desenvolvimento dos isotherms de adsorção
- Prepare soluções de estoque de 500 mL de aq. 2+ (MW 63,5 g/mol) nas concentrações 50 mg/L, 100 mg/L, 200 mg/L, 300 mg/L, 400 mg/L e 450 mg/L. Para isso, adicione 90 mgs, 180 mgs, 360 mgs, 540 mgs, 720 mgs e 810 mgs de Cu(NO3)2· 2,5 H2O (MW 232,6 g/mol) a seis contêineres, respectivamente. Adicione 500 mL de água de 18 MΩ, tampa o recipiente e agite para dissolver os sólidos.
- Adicione 50 mg de quitina a 100 mL de cada solução de estoque, ajuste o pH para 7 e deixe equilibrar por 48 h.
- Transfira 100 mL de cada solução de estoque para um recipiente de 100 mL para que o espaço para a cabeça seja mínimo. Adicione 50 mg de quitina moída em cada recipiente e, em seguida, tampe-os.
- Coloque os recipientes em um agitador orbital e agite a 60 rpm por 30 minutos. Em seguida, retire os recipientes do agitador orbital e ajuste o pH para 7 usando NH4HCO3 ou HNO3.
- Substitua os recipientes de volta no agitador orbital e agite a 60 rpm e a uma temperatura constante por 48 h. Mantenha o laboratório a 18 ± 2 °C ao longo de todo.
- Meça a concentração de das soluções iniciais de estoque e daquelas às quais a quitina foi adicionada. Use o método bicinchoninato colorimétrico, um colorímetro e os pacotes de reagentes pré-medidos27.
- Remova os recipientes do agitador orbital, permita que as misturas se contentem com um mínimo de 30 minutos e, em seguida, pegue uma alíquota de 1 mL com uma seringa equipada com um filtro de microfibra de vidro de 0,3 μm.
- Transfira a alíquota para um recipiente de 250 mL e dilua para 100 mL com água de 18 MΩ.
NOTA: Esta etapa é necessária devido ao teto baixo de detecção de (5 mg/L) pelo método bicinchoninato utilizando o colorímetro. - Transfira 10 mL da amostra diluída para um cuvette. Coloque a cuvette no colorímetro e zero o instrumento.
- Adicione um pacote de reagente de pré-messecido (método bicinchoninato) à amostra diluída no cuvette e espere 45 s para que a reação de quelação seja concluída. Permita que a solução fique roxa. A intensidade da cor formada é proporcional à concentração de.
- Coloque a cuvette de volta no colorímetro e meça a concentração de da amostra diluída. Multiplique a concentração da amostra diluída por 100 para obter a amostra original.
- Extrair a absorção máxima de dos dados isotherm de adsorção.
- Calcule a absorção de cada amostra para cada concentração de de equilíbrio usando a equação28:

- Plote a absorção de adsorção versus concentração de equilíbrio das amostras para produzir um isoterm de adsorção de padrão.
- Plote a razão de concentração de equilíbrio para absorção versus a concentração de equilíbrio para produzir o isoterm de adsorção de linearizado.
NOTA: O enredo deve ser linear, e o inverso da inclinação representa a absorção máxima de.
- Calcule a absorção de cada amostra para cada concentração de de equilíbrio usando a equação28:
Access restricted. Please log in or start a trial to view this content.
Resultados
A quitina expandida mostra a mesma morfologia, independentemente do método de secagem. A Figura 3 mostra imagens de flocos de quitina puros(Figura 3A1),quitina expandida seca no forno(Figura 3B1)e quitina expandida liofilizada(Figura 3C3). Enquanto os flocos puros têm o aparecimento de areia grosseira, a espuma de cebolinha expandida tem a aparência de um grão de milho estourado. Micrografias e...
Access restricted. Please log in or start a trial to view this content.
Discussão
O método proposto para fabricação de espuma de cebolinha permite a produção de tais espumas sem a necessidade de equipamentos ou técnicas especializadas. A produção da espuma de quitina depende da suspensão do hidreto de sódio dentro de um sol-gel de quitina. O contato com a água da atmosfera induz a gelagem da matriz de quitina e a evolução do gás hidrogênio pela decomposição do hidreto de sódio. Portanto, as etapas críticas da preparação são (1) a formação do sol-gel, (2) introdução do hidreto...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
A pesquisa foi patrocinada pelo Laboratório de Pesquisa do Exército de Comando de Desenvolvimento de Recursos de Combate (Número de Acordo Cooperativo W911NF-15-2-0020). Quaisquer opiniões, conclusões e conclusões ou recomendações expressas neste material são dos autores e não refletem necessariamente as opiniões do Laboratório de Pesquisa do Exército.
Agradecemos ao Centro de Processamento de Materiais Avançados (CAMP) da Universidade Tecnológica de Montana pelo uso de alguns dos equipamentos especializados necessários neste estudo. Agradecemos também a Gary Wyss, Nancy Oyer, Rick LaDouceur, John Kirtley e Katherine Zodrow pela assistência técnica e discussões úteis.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Ammonium bicarbonate | Sigma-Aldrich | 9830 | NH4HCO3, ≥99.5 % |
| Chitin | Sigma-Aldrich | C7170 | Pandalus borealis, practical grade |
| Colorimeter | Hanna Instruments | HI83399-01 | Photometer for wastewater analysis |
| Copper High Range Checker | Hanna Instruments | HI702 | Bicinchoninate colorimetric titration |
| Copper nitrate hydrate | Sigma-Aldrich | 223395 | Cu(NO3)2 · 2.5 H2O, 98 % |
| Dimethylacetamide (DMAc) | Sigma-Aldrich | 271012 | Anhydrous, 99.8 % |
| IR Spectrophotometer | Thermo Nicolet | Nexus 670 | Fitted with an ATR cell |
| Lithium chloride | Sigma-Aldrich | 310468 | LiCl, ≥99 % |
| N2 Physisorption Apparatus | Micromeritics | Tristar II | |
| Nitric acid | BDH | BDH7208-1 | HNO3, 0.1 N |
| Scanning electron microscope | Zeiss LEO | 1430 VP | 15 kV, secondary electron detector, 29-31 mm working distance |
| Sodium hydride | Sigma-Aldrich | 223441 | NaH, packed in mineral oil, 90 % |
| Thermogravimetric analyzer | TA Instruments | Q500 | 100 ml/min N2, 10 °C/min to 800 °C |
| Water Purification System | Millipore | Milli-Q | Type A water (18 MΩ) |
| X-Ray Diffractometer | Rigaku | Ultima IV | Cu K-α radiation, 8.04 keV |
Referências
- Rinaudo, M. Chitin and chitosan: Properties and applications. Progress in Polymer Science. 31 (7), 603-632 (2006).
- Percot, A., Viton, C., Domard, A. Optimization of chitin extraction from shrimp shells. Biomacromolecules. 4 (1), 12-18 (2003).
- Austin, P. R. Chitin solvents and solubility parameters. Chitin, Chitosan, and Related Enzymes. , 227-237 (1984).
- Deepthi, S., Venkatesan, J., Kim, S. K., Bumgardner, J. D., Jayakumar, R. An overview of chitin or chitosan/nano ceramic composite scaffolds for bone tissue engineering. International Journal of Biological Macromolecules. 93, 1338-1353 (2016).
- Tao, F., et al. Applications of chitin and chitosan nanofibers in bone regenerative engineering. Carbohydrate Polymers. 230, 115658(2020).
- Zhao, L., et al. Regulation of the morphological and physical properties of a soft tissue scaffold by manipulating DD and DS of O-carboxymethyl chitin. ACS Applied Bio Materials. 3 (9), 6187-6195 (2020).
- Duan, Y., Freyburger, A., Kunz, W., Zollfrank, C. Cellulose and chitin composite materials from an ionic liquid and a green co-solvent. Carbohydrate Polymers. 192, 159-165 (2018).
- Kadokawa, J., Takegawa, A., Mine, S., Prasad, K. Preparation of chitin nanowhiskers using an ionic liquid and their composite materials with poly(vinyl alcohol). Carbohydrate Polymers. 84 (4), 1408-1412 (2011).
- Chen, Z., Wang, J., Qi, H. J., Wang, T., Naguib, H. E. Green and sustainable layered chitin-vitrimer composite with enhanced modulus, reprocessability, and smart actuator function. ACS Sustainable Chemistry and Engineering. 8 (40), 15168-15178 (2020).
- Zhang, Z., Lucia, L. A. Chitin-clay composite gels with enhanced thermal stability prepared in a green and facile approach. Journal of Materials Science. 56 (4), 3600-3611 (2021).
- Ahmed, M. J., Hameed, B. H., Hummadi, E. H. Review on recent progress in chitosan/chitin-carbonaceous material composites for the adsorption of water pollutants. Carbohydrate Polymers. 247, 116690(2020).
- Matsuoka, A., et al. Hydration of nitriles to amides by a chitin-supported ruthenium catalyst. RSC Advances. 5 (16), 12152-12160 (2015).
- Wang, Y., Li, Y., Liu, S., Li, B. Fabrication of chitin microspheres and their multipurpose application as catalyst support and adsorbent. Carbohydrate Polymers. 120, 53-59 (2015).
- Anastopoulos, I., Bhatnagar, A., Bikiaris, D., Kyzas, G. Chitin Adsorbents for Toxic Metals: A Review. International Journal of Molecular Sciences. 18 (1), 114(2017).
- Habiba, U., Afifi, A. M., Salleh, A., Ang, B. C. Chitosan/(polyvinyl alcohol)/zeolite electrospun composite nanofibrous membrane for adsorption of Cr6+, Fe3+ and Ni2+. Journal of Hazardous Materials. 322, 182-194 (2017).
- Kim, U. J., et al. Protein adsorption of dialdehyde cellulose-crosslinked chitosan with high amino group contents. Carbohydrate Polymers. 163, 34-42 (2017).
- He, Y., et al. Fabrication of PVA nanofibers grafted with octaamino-POSS and their application in heavy metal adsorption. Journal of Polymers and the Environment. , (2020).
- Tian, H., et al. Electrospinning of polyvinyl alcohol into crosslinked nanofibers: An approach to fabricate functional adsorbent for heavy metals. Journal of Hazardous Materials. 378, (2019).
- Meille, V. Review on methods to deposit catalysts on structured surfaces. Applied Catalysis A: General. 315, 1-17 (2006).
- Dotto, G. L., Cunha, J. M., Calgaro, C. O., Tanabe, E. H., Bertuol, D. A. Surface modification of chitin using ultrasound-assisted and supercritical CO2 technologies for cobalt adsorption. Journal of Hazardous Materials. 295, 29-36 (2015).
- Phongying, S., Aiba, S., Chirachanchai, S. Direct chitosan nanoscaffold formation via chitin whiskers. Polymer. 48 (1), 393-400 (2007).
- Tan, T. S., Chin, H. Y., Tsai, M. L., Liu, C. L. Structural alterations, pore generation, and deacetylation of α- and β-chitin submitted to steam explosion. Carbohydrate Polymers. 122, 321-328 (2015).
- Chang, F. S., Chin, H. Y., Tsai, M. L. Preparation of chitin with puffing pretreatment. Research on Chemical Intermediates. 44 (8), 4939-4955 (2018).
- Goodrich, J. D., Winter, W. T. α-Chitin Nanocrystals prepared from shrimp shells and their specific surface area measurement. Biomacromolecules. 8 (1), 252-257 (2007).
- Rolandi, M., Felts, J. Naturally sourced chitin foam. , US 2020/0239670 A1 (2020).
- McDermott, S., Hailer, M. K., Lead, J. R. Meconium identifies high levels of metals in newborns from a mining community in the U.S. Science of the Total Environment. 707, 135528(2020).
- Hach Handbook of Water Analysis. Copper, Bicinchoninate Method, Method 8506. Hach Handbook of Water Analysis. , (1979).
- Crittenden, J. C., Trusell, R. R., Hand, D. R., Howe, K. J., Tchbanoglous, G. Adsorption. MWH's Water Treatment. , 1117(2012).
- Focher, B., Beltrame, P. L., Naggi, A., Torri, G. Alkaline N-deacetylation of chitin enhanced by flash treatments. Reaction kinetics and structure modifications. Carbohydrate Polymers. 12 (4), 405-418 (1990).
- Scherrer, P. Determination of the size and the internal structure of colloidal particles by means of X-rays. News from the Society of Sciences in Göttingen, Mathematical- Physical Class. 2, 98-100 (1918).
- Brunauer, S., Emmett, P. H., Teller, E. Adsorption of gases in multimolecular layers. Journal of the American Chemical Society. 60 (2), 309-319 (1938).
- Sing, K. S. W. Adsorption methods for the characterization of porous materials. Advances in Colloid and Interface Science. 76-77, 3-11 (1998).
- Rouquerol, J., Llewellyn, P., Rouquerol, F. Is the bet equation applicable to microporous adsorbents. Studies in Surface Science and Catalysis. 160, 49-56 (2007).
- Vorokh, A. S. Scherrer formula: estimation of error in determining small nanoparticle size. Nanosystems: Physics, Chemistry, Mathematics. , 364-369 (2018).
- Labidi, A., Salaberria, A. M., Fernandes, S. C. M., Labidi, J., Abderrabba, M. Adsorption of copper on chitin-based materials: Kinetic and thermodynamic studies. Journal of the Taiwan Institute of Chemical Engineers. 65, 140-148 (2016).
- Tian, M., Zhao, T. Q., Chin, P. L., Liu, B. S., Cheung, A. S. -C. Methane and propane co-conversion study over zinc, molybdenum and gallium modified HZSM-5 catalysts using time-of-flight mass-spectrometry. Chemical Physics Letters. 592, 36-40 (2014).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados