È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Preparazione di schiume di chitina espansa e loro uso nella rimozione del rame acquoso
In questo articolo
Riepilogo
Questo studio descrive un metodo per espandere la chitina in una schiuma con tecniche chimiche che non richiedono attrezzature specializzate.
Abstract
La chitina è un biopolimero sottosfloso, naturalmente abbondante, meccanicamente robusto e chimicamente resistente. Queste qualità sono desiderabili in un adsorbente, ma la chitina manca della superficie specifica necessaria e la sua modifica comporta tecniche e attrezzature specializzate. Qui è descritta una nuova procedura chimica per espandere i fiocchi di chitina, derivati dai rifiuti di guscio di gamberetti, in schiume con una superficie più elevata. Il processo si basa sull'evoluzione del gas H2 dalla reazione dell'acqua con NaH intrappolato in un gel di chitina. Il metodo di preparazione non richiede attrezzature specializzate. La diffrazione a raggi X in polvere e la fisisorbimento N2indicano che la dimensione della cristallite diminuisce da 6,6 nm a 4,4 nm e la superficie specifica aumenta da 12,6 ± 2,1 m2/g a 73,9 ± 0,2 m2/g. Tuttavia, la spettroscopia infrarossa e l'analisi termogravimetrica indicano che il processo non modifica l'identità chimica della chitina. La capacità specifica di adsorbimento di Cu della chitina espansa aumenta in proporzione alla superficie specifica da 13,8 ± 2,9 mg/g a 73,1 ± 2,0 mg/g. Tuttavia, la capacità di adsorbimento del Cu come densità superficiale rimane relativamente costante ad una media di 10,1 ± 0,8 atomi / nm2, il che suggerisce ancora una volta nessun cambiamento nell'identità chimica della chitina. Questo metodo offre i mezzi per trasformare la chitina in un materiale di superficie più elevata senza sacrificare le sue proprietà desiderabili. Sebbene la schiuma di chitina sia descritta qui come un adsorbente, può essere immaginata come un supporto catalizzatore, isolante termico e materiale strutturale.
Introduzione
La chitina è un biopolimero meccanicamente robusto e chimicamente inerte, secondo solo alla cellulosa in abbondanza naturale1. È il componente principale nell'esoscheletro degli artropodi e nelle pareti cellulari di funghi e lieviti2. La chitina è simile alla cellulosa, ma con un gruppo ossidrile di ciascun monomero sostituito con un gruppo acetil amminico (Figura 1A,B). Questa differenza aumenta la forza del legame idrogeno tra catene polimeriche adiacenti e conferisce alla chitina la sua caratteristica resilienza strutturale e inerzia chimica2,3. Grazie alle sue proprietà e all'abbondanza, la chitina ha attirato un significativo interesse industriale e accademico. È stato studiato come impalcatura per la crescita tissutale4,5,6,come componente in materiali compositi7,8,9,10,11,e come supporto per adsorbenti e catalizzatori11,12,13,14. La sua stabilità chimica, in particolare, rende la chitina attraente per applicazioni di adsorbimento che comportano condizioni inospitali per i comuni adsorbenti14. Inoltre, l'abbondanza di gruppi amminici rende la chitina un efficace adsorbente per gli ioni metallici15. Tuttavia, la protonazione dei gruppi amminici in condizioni acide riduce la capacità di adsorbimento del metallo della chitina16. Una strategia di successo è quella di introdurre siti di adsorbimento più resistenti alla protonazione17,18. Invece, qui è descritto un metodo semplice per aumentare la superficie specifica e, quindi, il numero di siti di adsorbimento in chitina.
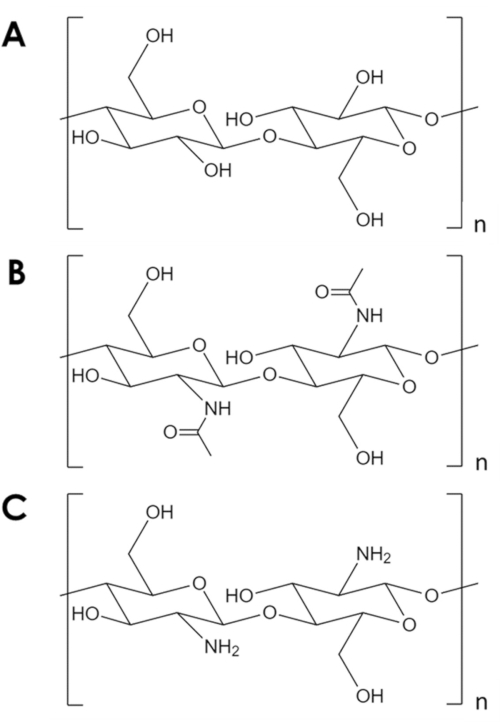
Figura 1. Struttura chimica. (A) cellulosa, (B) chitina, (C) chitosano. Clicca qui per visualizzare una versione più grande di questa figura.
Nonostante i suoi numerosi usi potenziali, la chitina è sottoutilizzata. La lavorazione della chitina è impegnativa a causa della sua bassa solubilità nella maggior parte dei solventi. Una limitazione chiave al suo uso in catalisi e adsorbimento è la sua bassa superficie specifica. Mentre i tipici supporti di carbonio e ossido metallico hanno superfici specifiche nell'ordine10 2-10 3 m2/ g, i fiocchi di chitina commerciali hanno superfici nell'ordine di 10 m2/ g19,20,21. Esistono metodi per espandere la chitina in schiume, ma invariabilmente si basano su alte temperature e pressioni, acidi e basi forti o apparecchiature specializzate che rappresentano una barriera all'ingresso significativa5,21,22,23,24,25. Inoltre, questi metodi tendono a deacetilare la chitina per formare il chitosano (Figura 1C) - un biopolimero più solubile e reattivo5,25,26.
Qui, viene descritto un metodo per espandere la chitina in schiume solide, aumentare la sua superficie specifica e la capacità di adsorbimento e mantenere la sua integrità chimica. Il metodo si basa sulla rapida evoluzione del gas dall'interno di un gel di chitina e non richiede attrezzature specializzate. L'aumento della capacità di adsorbimento della chitina espansa è dimostrato con Cu2+acquoso - un contaminante comune nelle acque sotterranee locali26.
| Unità | Fiocco pulito | Schiuma cotta | Schiuma liofilizzata | |
| Cristallinità | % | 88 | 74 | 58 |
| Dimensione del cristallo | Nm | 6.5 | 4.4 | 4.4 |
| Superficie | m2/g | 12.6 ± 2.1 | 43,1 ± 0,2 | 73,9 ± 0,2 |
| Assorbimento di Cu | mg/g | 13.8 ± 2.9 | 48,6 ± 1,9 | 73,1 ± 2,0 |
| Assorbimento di Cu | atomo/nm2 | 10,5 ± 2,8 | 10,7 ± 0,4 | 9,4 ± 0,3 |
Tabella 1. Riepilogo delle proprietà del materiale. Le schiume di chitina hanno una cristallinità e una dimensione del cristallo inferiori rispetto ai fiocchi di chitina puliti. Tuttavia, la superficie specifica e l'assorbimento di Cu delle schiume di chitina sono proporzionalmente superiori a quelli dei fiocchi di chitina puliti.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Preparazione della chitina espansa
- Preparare una soluzione da 250 ml di LiCl al 5% in peso in dimetilacetammide (DMAc)
ATTENZIONE: Il solvente DMAc è un irritante combustibile che può danneggiare la fertilità e causare difetti alla nascita. Maneggiare dmAc in una cappa aspirante utilizzando guanti e occhiali resistenti alle sostanze chimiche per evitare il contatto con la pelle e gli occhi.- Aggiungere 15 g di LiCl e 285 g (268 mL) di DMAc in un matraccio Erlenmeyer da 500 ml con, quindi posizionare una barra magnetica rivestita in politetrafluoroetilene (PTFE) da 50 mm.
- Tappare il pallone con un setto di gomma e posizionarlo su una piastra riscaldante. Posizionare una sonda di temperatura attraverso il setto nella miscela. Mescolare la miscela a 400 rpm e 80 °C fino a quando tutto il LiCl è sciolto (~ 4 h)
- Sciogliere 1,0 g di scaglie di chitina essiccate al forno nella soluzione di LiCl/DMAc per formare un sol-gel
- Asciugare almeno 1,2 g di scaglie di chitina in forno a 80°C per 24 ore.
- Aggiungere 1,0 g di scaglie di chitina essiccate al forno e 250 mL di soluzione di LiCl/DMAc al 5% in peso in un matraccio rotondo a fondo tondo da 500 mL. Posizionare una barra di agitazione magnetica rivestita in PTFE da 50 mm.
- Tappare il pallone con un setto di gomma e posizionarlo su un blocco di calore mescolando. Forare il setto con un ago e lasciarlo per consentire al pallone di sfogarsi. Riscaldare il blocco a 80 °C e mescolare la miscela a 400 giri/min fino a quando tutta la chitina non si scioglie (24-48 h).
- Lasciare raffreddare lentamente il sol-gel di chitina risultante a temperatura ambiente continuando a mescolare (~ 1 h).
- Una volta a temperatura ambiente, mettere il pallone contenente il sol-gel di chitina in un bagno di ghiaccio e continuare a mescolare fino a quando la sua temperatura si stabilizza (~ 20 min).
- Preparare un impasto da 100 ml di NaH in DMAc.
ATTENZIONE: NaH a contatto con l'acqua rilascia gas infiammabili che possono infiammarsi spontaneamente. Per limitare il contatto con l'aria umida, il NaH viene conservato in olio minerale che deve essere lavato via prima dell'uso. Maneggiare con cautela in una cappa aspirante utilizzando guanti e occhiali resistenti agli agenti chimici.- Rimuovere circa 1 g di NaH dalla sua conservazione dell'olio minerale e lavare tre volte con 10 ml di esani.
- Aggiungere 100 mL di DMAC in un matraccio Erlenmeyer da 250 mL, quindi aggiungere 0,82 g di NaH lavato e posizionare una barra magnetica rivestita in PTFE.
- Ruotare la miscela per produrre un impasto NaH/DMAc.
NOTA: NaH non si dissolverà completamente.
- Formare il gel di chitina aggiungendo tutto il liquame NaH / DMAc al sol-gel di chitina.
- Scapitolare il sol-gel raffreddato e aggiungere tutto il liquame NaH mescolando vigorosamente. Sostituire il tappo e continuare a mescolare la miscela a 400 giri/min per 72 ore o fino a quando non si forma un gel nel matraccio.
- Formare la schiuma di chitina aggiungendo acqua al gel di chitina.
- Dopo la formazione del gel, scolleghe il pallone e aggiungere 100 ml di acqua deionizzata (DI).
NOTA: è fondamentale eseguire questo passaggio in una cappa aspirante poiché il processo evolverà il gas H2.
- Dopo la formazione del gel, scolleghe il pallone e aggiungere 100 ml di acqua deionizzata (DI).
- Isolare e lavare la schiuma di chitina in acqua e metanolo per rimuovere DMAc e sali.
- Rimuovere la schiuma di chitina espansa dal matraccio e metterla in una cristallizzazione o in un becher sufficientemente grande da contenerla e 1000 ml di acqua DI.
NOTA: La schiuma di chitina non uscirà in un unico pezzo e potrebbe dover essere spezzata. - Risciacquare il gel isolato tre volte con 500 ml di acqua DI. Immergere il gel in 1000 ml di acqua DI per 24 ore, poi in 500 ml di metanolo per 24 ore e infine in 1000 ml di acqua DI per 24 ore di nuovo.
- Rimuovere la schiuma di chitina espansa dal lavaggio ad acqua e lasciare asciugare all'aria per 24-48 ore.
- Rimuovere la schiuma di chitina espansa dal matraccio e metterla in una cristallizzazione o in un becher sufficientemente grande da contenerla e 1000 ml di acqua DI.
- Asciugare il gel di chitina lavato per formare una schiuma solida e quindi macinare in polvere.
- Asciugare il gel nel forno a 85 °C per 48 ore sotto aria ambiente, o in un liofilizzatore a -43 °C e 0,024 mbar per 48 ore.
- Usando un mortaio e un pestello, macinare la schiuma di chitina secca in una polvere fine.

Figura 2. Preparazione di schiuma di chitina espansa. (A) La chitina iniziale in soluzione liCl/DMAc. (B) L'aggiunta del liquame NaH/DMAc. (C) La schiuma di chitina dopo aggiunta di acqua. (D) La schiuma di chitina estratta dal pallone di reazione. (E) La schiuma di chitina durante il lavaggio con acqua. Fare clic qui per visualizzare una versione più grande di questa figura.
2. Sviluppo delle isoterme di adsorbimento
- Preparare soluzioni stock da 500 ml di aq. Cu2+ (MW 63,5 g/mol) alle concentrazioni 50 mg/L, 100 mg/L, 200 mg/L, 300 mg/L, 400 mg/L e 450 mg/L. Per fare questo, aggiungere 90 mg, 180 mg, 360 mg, 540 mg, 720 mg e 810 mg di Cu(NO3)2· 2,5 H2O (MW 232,6 g/mol) a sei contenitori, rispettivamente. Aggiungere 500 ml di acqua 18 MΩ, tappare il contenitore e agitare per sciogliere i solidi.
- Aggiungere 50 mg di chitina a 100 ml di ciascuna soluzione stock, regolare il pH a 7 e lasciare equilibrare per 48 ore.
- Trasferire 100 mL di ciascuna soluzione stock in un contenitore da 100 mL in modo che lo spazio di testa sia minimo. Aggiungere 50 mg di chitina macinata a ciascun contenitore e quindi tapparli.
- Posizionare i contenitori su uno shaker orbitale e agitare a 60 giri / min per 30 minuti. Quindi togliere i contenitori dallo shaker orbitale e regolare il pH a 7 usando NH4HCO3 o HNO3.
- Sostituire i contenitori sullo shaker orbitale e agitare a 60 giri / min e a una temperatura costante per 48 ore. Mantenere il laboratorio a 18 ± 2 °C in tutto.
- Misurare la concentrazione di Cu delle soluzioni stock iniziali e di quelle a cui è stata aggiunta la chitina. Utilizzare il metodo colorimetrico bicinchoninato, un colorimetro e pacchetti di reagenti pre-misurati27.
- Rimuovere i contenitori dallo shaker orbitale, lasciare che le miscele si depositino per un minimo di 30 minuti, quindi prendere un'aliquota di 1 mL con una siringa dotata di un filtro in microfibra di vetro da 0,3 μm.
- Trasferire l'aliquota in un contenitore da 250 mL e diluire a 100 mL con acqua 18 MΩ.
NOTA: Questo passaggio è necessario a causa del basso limite di rilevamento di Cu (5 mg / L) con il metodo bicinchoninato utilizzando il colorimetro. - Trasferire 10 ml del campione diluito in una cuvetta. Posizionare la cuvetta nel colorimetro e azzerare lo strumento.
- Aggiungere un pacchetto di reagente Cu premisurato (metodo bicinchoninato) al campione diluito nella cuvetta e attendere 45 s per il completamento della reazione chelante. Lascia che la soluzione diventi viola. L'intensità del colore formato è proporzionale alla concentrazione di Cu.
- Rimettere la cuvetta nel colorimetro e misurare la concentrazione di Cu del campione diluito. Moltiplicare la concentrazione del campione diluito per 100 per ottenere quella del campione originale.
- Estrarre il massimo assorbimento di Cu dai dati isotermici di adsorbimento.
- Calcolare l'assorbimento di ciascun campione per ogni concentrazione di Cu di equilibrio utilizzando l'equazione28:

- Tracciare l'assorbimento dell'adsorbimento rispetto alla concentrazione di equilibrio dei campioni per produrre un'isoterma standard di adsorbimento di Cu.
- Traccia il rapporto tra la concentrazione di equilibrio e l'assorbimento rispetto alla concentrazione di equilibrio per produrre l'isoterma linearizzata di adsorbimento di Cu.
NOTA: il plottaggio deve essere lineare e l'inverso della pendenza rappresenta l'assorbimento massimo di Cu.
- Calcolare l'assorbimento di ciascun campione per ogni concentrazione di Cu di equilibrio utilizzando l'equazione28:
Access restricted. Please log in or start a trial to view this content.
Risultati
La chitina espansa mostra la stessa morfologia indipendentemente dal metodo di essiccazione. La Figura 3 mostra immagini di fiocchi di chitina pulita (Figura 3A1), chitina espansa essiccata al forno (Figura 3B1) e chitina espansa liofilizzata (Figura 3C3). Mentre i fiocchi puliti hanno l'aspetto di sabbia grossolana, la schiuma di chitina espansa ha l'aspetto di un chicco di popped corn. Le microgr...
Access restricted. Please log in or start a trial to view this content.
Discussione
Il metodo proposto per la fabbricazione della schiuma di chitina consente la produzione di tali schiume senza la necessità di attrezzature o tecniche specializzate. La produzione della schiuma di chitina si basa sulla sospensione di idruro di sodio all'interno di un sol-gel di chitina. Il contatto con l'acqua proveniente dall'atmosfera induce la gelificazione della matrice chitina e l'evoluzione dell'idrogeno gassoso per decomposizione dell'idruro di sodio. Pertanto, le fasi critiche della preparazione sono (1) la forma...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
La ricerca è stata sponsorizzata dal Combat Capabilities Development Command Army Research Laboratory (numero di accordo di cooperazione W911NF-15-2-0020). Eventuali opinioni, risultati e conclusioni o raccomandazioni espresse in questo materiale sono quelle degli autori e non riflettono necessariamente le opinioni del laboratorio di ricerca dell'esercito.
Ringraziamo il Center for Advanced Materials Processing (CAMP) della Montana Technological University per l'uso di alcune delle attrezzature specializzate richieste in questo studio. Ringraziamo anche Gary Wyss, Nancy Oyer, Rick LaDouceur, John Kirtley e Katherine Zodrow per l'assistenza tecnica e le discussioni utili.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Ammonium bicarbonate | Sigma-Aldrich | 9830 | NH4HCO3, ≥99.5 % |
| Chitin | Sigma-Aldrich | C7170 | Pandalus borealis, practical grade |
| Colorimeter | Hanna Instruments | HI83399-01 | Photometer for wastewater analysis |
| Copper High Range Checker | Hanna Instruments | HI702 | Bicinchoninate colorimetric titration |
| Copper nitrate hydrate | Sigma-Aldrich | 223395 | Cu(NO3)2 · 2.5 H2O, 98 % |
| Dimethylacetamide (DMAc) | Sigma-Aldrich | 271012 | Anhydrous, 99.8 % |
| IR Spectrophotometer | Thermo Nicolet | Nexus 670 | Fitted with an ATR cell |
| Lithium chloride | Sigma-Aldrich | 310468 | LiCl, ≥99 % |
| N2 Physisorption Apparatus | Micromeritics | Tristar II | |
| Nitric acid | BDH | BDH7208-1 | HNO3, 0.1 N |
| Scanning electron microscope | Zeiss LEO | 1430 VP | 15 kV, secondary electron detector, 29-31 mm working distance |
| Sodium hydride | Sigma-Aldrich | 223441 | NaH, packed in mineral oil, 90 % |
| Thermogravimetric analyzer | TA Instruments | Q500 | 100 ml/min N2, 10 °C/min to 800 °C |
| Water Purification System | Millipore | Milli-Q | Type A water (18 MΩ) |
| X-Ray Diffractometer | Rigaku | Ultima IV | Cu K-α radiation, 8.04 keV |
Riferimenti
- Rinaudo, M. Chitin and chitosan: Properties and applications. Progress in Polymer Science. 31 (7), 603-632 (2006).
- Percot, A., Viton, C., Domard, A. Optimization of chitin extraction from shrimp shells. Biomacromolecules. 4 (1), 12-18 (2003).
- Austin, P. R. Chitin solvents and solubility parameters. Chitin, Chitosan, and Related Enzymes. , 227-237 (1984).
- Deepthi, S., Venkatesan, J., Kim, S. K., Bumgardner, J. D., Jayakumar, R. An overview of chitin or chitosan/nano ceramic composite scaffolds for bone tissue engineering. International Journal of Biological Macromolecules. 93, 1338-1353 (2016).
- Tao, F., et al. Applications of chitin and chitosan nanofibers in bone regenerative engineering. Carbohydrate Polymers. 230, 115658(2020).
- Zhao, L., et al. Regulation of the morphological and physical properties of a soft tissue scaffold by manipulating DD and DS of O-carboxymethyl chitin. ACS Applied Bio Materials. 3 (9), 6187-6195 (2020).
- Duan, Y., Freyburger, A., Kunz, W., Zollfrank, C. Cellulose and chitin composite materials from an ionic liquid and a green co-solvent. Carbohydrate Polymers. 192, 159-165 (2018).
- Kadokawa, J., Takegawa, A., Mine, S., Prasad, K. Preparation of chitin nanowhiskers using an ionic liquid and their composite materials with poly(vinyl alcohol). Carbohydrate Polymers. 84 (4), 1408-1412 (2011).
- Chen, Z., Wang, J., Qi, H. J., Wang, T., Naguib, H. E. Green and sustainable layered chitin-vitrimer composite with enhanced modulus, reprocessability, and smart actuator function. ACS Sustainable Chemistry and Engineering. 8 (40), 15168-15178 (2020).
- Zhang, Z., Lucia, L. A. Chitin-clay composite gels with enhanced thermal stability prepared in a green and facile approach. Journal of Materials Science. 56 (4), 3600-3611 (2021).
- Ahmed, M. J., Hameed, B. H., Hummadi, E. H. Review on recent progress in chitosan/chitin-carbonaceous material composites for the adsorption of water pollutants. Carbohydrate Polymers. 247, 116690(2020).
- Matsuoka, A., et al. Hydration of nitriles to amides by a chitin-supported ruthenium catalyst. RSC Advances. 5 (16), 12152-12160 (2015).
- Wang, Y., Li, Y., Liu, S., Li, B. Fabrication of chitin microspheres and their multipurpose application as catalyst support and adsorbent. Carbohydrate Polymers. 120, 53-59 (2015).
- Anastopoulos, I., Bhatnagar, A., Bikiaris, D., Kyzas, G. Chitin Adsorbents for Toxic Metals: A Review. International Journal of Molecular Sciences. 18 (1), 114(2017).
- Habiba, U., Afifi, A. M., Salleh, A., Ang, B. C. Chitosan/(polyvinyl alcohol)/zeolite electrospun composite nanofibrous membrane for adsorption of Cr6+, Fe3+ and Ni2+. Journal of Hazardous Materials. 322, 182-194 (2017).
- Kim, U. J., et al. Protein adsorption of dialdehyde cellulose-crosslinked chitosan with high amino group contents. Carbohydrate Polymers. 163, 34-42 (2017).
- He, Y., et al. Fabrication of PVA nanofibers grafted with octaamino-POSS and their application in heavy metal adsorption. Journal of Polymers and the Environment. , (2020).
- Tian, H., et al. Electrospinning of polyvinyl alcohol into crosslinked nanofibers: An approach to fabricate functional adsorbent for heavy metals. Journal of Hazardous Materials. 378, (2019).
- Meille, V. Review on methods to deposit catalysts on structured surfaces. Applied Catalysis A: General. 315, 1-17 (2006).
- Dotto, G. L., Cunha, J. M., Calgaro, C. O., Tanabe, E. H., Bertuol, D. A. Surface modification of chitin using ultrasound-assisted and supercritical CO2 technologies for cobalt adsorption. Journal of Hazardous Materials. 295, 29-36 (2015).
- Phongying, S., Aiba, S., Chirachanchai, S. Direct chitosan nanoscaffold formation via chitin whiskers. Polymer. 48 (1), 393-400 (2007).
- Tan, T. S., Chin, H. Y., Tsai, M. L., Liu, C. L. Structural alterations, pore generation, and deacetylation of α- and β-chitin submitted to steam explosion. Carbohydrate Polymers. 122, 321-328 (2015).
- Chang, F. S., Chin, H. Y., Tsai, M. L. Preparation of chitin with puffing pretreatment. Research on Chemical Intermediates. 44 (8), 4939-4955 (2018).
- Goodrich, J. D., Winter, W. T. α-Chitin Nanocrystals prepared from shrimp shells and their specific surface area measurement. Biomacromolecules. 8 (1), 252-257 (2007).
- Rolandi, M., Felts, J. Naturally sourced chitin foam. , US 2020/0239670 A1 (2020).
- McDermott, S., Hailer, M. K., Lead, J. R. Meconium identifies high levels of metals in newborns from a mining community in the U.S. Science of the Total Environment. 707, 135528(2020).
- Hach Handbook of Water Analysis. Copper, Bicinchoninate Method, Method 8506. Hach Handbook of Water Analysis. , (1979).
- Crittenden, J. C., Trusell, R. R., Hand, D. R., Howe, K. J., Tchbanoglous, G. Adsorption. MWH's Water Treatment. , 1117(2012).
- Focher, B., Beltrame, P. L., Naggi, A., Torri, G. Alkaline N-deacetylation of chitin enhanced by flash treatments. Reaction kinetics and structure modifications. Carbohydrate Polymers. 12 (4), 405-418 (1990).
- Scherrer, P. Determination of the size and the internal structure of colloidal particles by means of X-rays. News from the Society of Sciences in Göttingen, Mathematical- Physical Class. 2, 98-100 (1918).
- Brunauer, S., Emmett, P. H., Teller, E. Adsorption of gases in multimolecular layers. Journal of the American Chemical Society. 60 (2), 309-319 (1938).
- Sing, K. S. W. Adsorption methods for the characterization of porous materials. Advances in Colloid and Interface Science. 76-77, 3-11 (1998).
- Rouquerol, J., Llewellyn, P., Rouquerol, F. Is the bet equation applicable to microporous adsorbents. Studies in Surface Science and Catalysis. 160, 49-56 (2007).
- Vorokh, A. S. Scherrer formula: estimation of error in determining small nanoparticle size. Nanosystems: Physics, Chemistry, Mathematics. , 364-369 (2018).
- Labidi, A., Salaberria, A. M., Fernandes, S. C. M., Labidi, J., Abderrabba, M. Adsorption of copper on chitin-based materials: Kinetic and thermodynamic studies. Journal of the Taiwan Institute of Chemical Engineers. 65, 140-148 (2016).
- Tian, M., Zhao, T. Q., Chin, P. L., Liu, B. S., Cheung, A. S. -C. Methane and propane co-conversion study over zinc, molybdenum and gallium modified HZSM-5 catalysts using time-of-flight mass-spectrometry. Chemical Physics Letters. 592, 36-40 (2014).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon