Method Article
腸オルガノイドモデルを用いたアプリカル特異的相互作用を研究する培養法
要約
ここでは、腸管固有の相互作用のモデリングを可能にする2つのプロトコルを提示する。オルガノイド由来の腸単層および空気液体界面(ALI)培養は、光とバソララルの両方からアクセス可能な十分に分化された上皮の生成を促進する一方で、極性逆腸器官は彼らの極性側を露出させ、高スループットアッセイに適している。
要約
腸上皮の内層は、内腔に彼らの上端側を露出し、外部の手がかりに応答する特殊な上皮細胞の単純な層で構成されています。インビトロ培養条件の最近の最適化は、腸幹細胞ニッチの再現と、細胞組成および上皮組織を再現する高度な3次元(3D)培養系の開発を可能にする。細胞外マトリックス(ECM)に埋め込まれた腸内オルガノイドは、内部内腔および外部露出基底側を包含する明確に定義された偏光上皮を生成するために、長期的かつ自己組織化のために維持することができる。腸器官のこの制限的な性質は、インビトロで上皮の上端表面にアクセスする際の課題を提示し、栄養素の取り込みおよび宿主微生物叢/宿主病原体相互作用などの生物学的メカニズムの調査を制限する。ここでは、オルガノイド上皮の有端側へのアクセスを容易にし、特定の腸細胞タイプの分化を支持する2つの方法について述べている。まず、ECM除去が上皮細胞極性の反転を誘導し、アピカルアウト3Dオルガノイドの生成を可能にする方法を示す。第2に、成熟した細胞タイプと分化された細胞タイプからなる、腸器官由来の単一細胞懸濁液から2次元(2D)単層を生成する方法を説明する。これらの技術は、上皮と外的な手がかりをインビトロで研究し、精密医療を促進するためのプラットフォームとしてのオルガノイドの使用を促進するための新しいツールを提供する。
概要
腸上皮は、人体で2番目に大きい上皮であり、栄養摂取を促進し、環境侮辱に対する障壁として機能する分極細胞層から構成される1。この円柱側とバソラショナル側の区別により、上皮の細胞は多様な機能を果たすことができます。このアピカルコンパートメントは、内腔にさらされ、環境刺激および微生物との上皮相互作用を媒介し、栄養摂取を促進する。バソラテラル表面は、細胞間接合と細胞母体接着を収容し、免疫系および他の組織の細胞との間に接合する2。これらの接合は、バリアとして機能し、周囲の体組織に吸収された栄養素を提供する地下膜に付着した不透過性単層を生成します。
これらの腸機能をvitroで再現できる培養システムの確立は、3.従来のin vitroモデルは、Caco-2などの形質転換されたヒト大腸癌細胞株を利用して、2D単層培養を生成する。吸収コンパートメントの複数の機能をモデル化することができるにもかかわらず、これらのモデルは腸上皮組成および機能を完全に再現することができず、主要な機能特性および用途4,5を制限する。
器官特異的な細胞型に自己組織化し、分化することができる幹細胞から生成される高度な3D培養系としてのオルガノイドの出現は、腸上皮6のインビトロ研究における画期的なものでした。腸管オルガノイドは、基底層層に似た細胞外マトリックス(ECM)に埋め込まれ、これらの培養物が上皮のアピコ基底極性を保持することを可能にする細胞マトリックス接合部を形成する。オルガノイドは、補助側が光室に露出し、腸の構造を模倣する、囲まれたアーキテクチャを示す。この閉鎖的な組織は、オリエンテーション固有の機能を研究する機会を提供しますが、上皮の尖体側へのアクセスを必要とする調査を制限します。オルガノイド断片化、オルガノイド微小インジェクション、単層培養7の生成を含む、2Dおよび3Dの両方でこれらの制限を克服するために異なるアプローチが講じられてきた。オルガノイドの断片化は、構造組織の喪失および細胞接合の破壊を引き起こし、上皮の素尖体表面を媒体に曝露することを可能にする。この技術は、細胞外マトリックスに播種した場合にオルガノイドを改質する断片の再生能力を利用し、感染症および宿主病原体相互作用8,9をモデル化するために使用されてきた。しかし、有端および基底面の両方への同時アクセスはまた、感染に対する非特異的な応答を引き出す可能性がある。
補助的な表面へのアクセスを可能にし、構造アーキテクチャと細胞接合の両方を維持する別のアプローチは、オルガノイドの内腔への因子の微小注入によって表される。この方法は、宿主と病原体の相互作用を研究し、クリプトスポリジウム10、ピロリ11、およびC.ディフィシル12がインビトロの消化管上皮に及ぼす影響をモデル化するために広く利用されている。同様の技術を用いて、腸上皮上皮上の大腸菌のpks+株の変異原性ポテンシャルを13と判定した。効果的ですが、オルガノイドマイクロインジェクションは、測定可能な効果を得るために注入する必要があるオルガノイドの数が多いことを考慮すると、骨の折れる非効率的な作業であり、したがって、高スループットアッセイへの応用を制限します。
腸オルガノイドの最近の進歩はまた、2D単層オルガノイド培養を確立するための方法を提供し、それによってそれらの有端表面14、15、16、17を露出させる。これらのオルガノイド由来単層は、腸上皮の生体内特性におけるキーを再現する。それらは、分化および幹細胞集団の両方を含む生理学的に関連する細胞組成を示し、クリプト・ビラス軸全体の多様性をモデル化する。アピコ基底極性が保持されると、固有の単層特性により、有端側側とバソララル側の両方に容易にアクセスでき、培地交換は腸の流れと廃棄物除去を模倣することができ、長期的な培養を可能にする。これらの特徴は、オルガノイド由来の単層を、光相互作用に焦点を当てた研究に適したレンダリングし、上皮バリアの完全性および透過性18、19のための優れたモデルを提供する。
研究は、上皮細胞極性がMDCKスフェロイド20、21および最近ヒト腸器官22においてECMタンパク質によって厳密に調節されることを示している。細胞母質結合を媒介するインテグリン受容体のECM成分の除去または阻害は、腸器官の極性逆転および上皮の上端側の媒体22への曝露をもたらす。このアプローチは、3Dでアペカル側に簡単にアクセスでき、高スループットアッセイを可能にするため、感染症に取り組む研究者の関心を集めています。ここでは、Amievaラボ22による最近の研究に基づく改変プロトコルについて、その補助的な側面を容易に露出する3D腸器官の生成を容易にする。また、腸管オルガノイド由来の腸管2D単層を効率的かつ再現的に生成できるプロトコルの概要を説明する。
プロトコル
ヒト腸器官培養物の導出は、他の23に記載されるように行った。オルガノイドは、腸器官拡張培地の製品情報シート(PIS)に記載されているように培養物で維持された( 材料表参照)。
1. 腸オルガノイド極性の反転
注:このセクションでは、3D腸器官の極性を反転するためのプロトコルの概要を説明します。このプロトコルは、培養プレートの懸濁液中に露出した有端表面を有する偏光オルガノイドを確立するための詳細な手順を提供する。このプロトコルは、エンドポイントアッセイとして意図されていますが、オルガノイドは2週間以上この立体構造で維持され、通過時にアピカルインオルガノイドを再確立することを可能にする小さな幹細胞集団を維持することができます。
- 防着剤を用いたコーティング用の培養物とチューブ
注:極限腸オルガノイドの数を最大化し、培養物への望ましくない付着を防ぐために、一般的に、培養器のプレコーティングが必要です。以下のセクションでは、防着溶液を用いた培養物およびプラスチック製品のコーティングについて説明します。- プロトコルの懸濁部分に使用されるコート培養プレートは以下の通りである。
- 24ウェル組織培養プレートの各ウェルに0.5 mLの抗付着液を加えます。
- プレートを旋回して、水面と井戸の壁に均等に溶液を広げます。
- プレートを1,300xgで10分間遠心します。
- アスピレーターまたは1 mLピペットを使用して、各ウェルから抗付着溶液を除去します。
- 15mM HEPES(DMEM/F12)で1mLのDMEM/F-12でウェルを洗います。
- 洗浄したDMEM/F-12を0.5mLで充分に充填し、使用するまで37°C、5%CO2でプレートを保管します。
注:すぐに使用しない場合、コーティングされたプレートは、少なくとも1週間インキュベーターに保管することができます。
- コート15 mL円錐形チューブは、次のようにこのプロトコルで使用されます。
- 15 mL円錐管に4 mLの付着防止液を加えます。
- チューブを旋回して、壁面全体に溶液を均等に広げます。
- チューブを1,300 x g で10分間遠心します。
- チューブから抗付着液を取り除きます。
- チューブ1xをDMEM/F-12の5mLで洗浄し、DMEM/F-12を吸引します。チューブは今使用する準備ができています。
注:すぐに使用しない場合は、DMEM/F12の5 mlを追加し、4°Cで保存してください。 コーティングされたチューブは、少なくとも1週間は4°Cで保つことができます。
- プロトコルの懸濁部分に使用されるコート培養プレートは以下の通りである。
- 懸濁培養による腸オルガノイドの極性反転
注:以下のステップは、以前に標準的なECMドーム条件下で培養された腸器官の反転を概説する。ここに記載されている手順は、24ウェルプレートの1つの井戸のためのものです。他のカルチャーウェアを使用する場合は、それに応じて音量を調整します。- 基質膜細胞外マトリックスドームを破壊することなく、オルガノイドを含む各ウェルから慎重に培地を取り除き、廃棄します。オルガノイドのサイズは、反転プロトコルを開始する前に直径150〜250μm(通常は3-5日目)であることを確認してください。
- 各ウェルに氷冷解離解液を1 mL加えます。
- 室温(15~25°C)で1分間インキュベートします。
- プラスチックチップのコーティングに使用する15 mLチューブに少なくとも2 mLの抗付着液を加えます。
- DMEM/F-12を15 mLチューブに2mL以上加え、防着剤で洗浄したプラスチックチップを洗浄します。
- 1 mL ピペットチップに抗付着液を塗布し、ステップ 1.2.4 から 1 mL の溶液をチューブに 3 回ピペット処理します。
- チップを冷たいDMEM/F-12で洗浄し、ステップ1.2.5からDMEM/F-12でチューブに1mLの溶液を3回ピペットします。
- コーティングされた先端を使用して、慎重にゆっくりとピペットによってドームを取り除きます。オルガノイドを破壊したり断片化したりしないように注意してください。
- オルガノイド懸濁液を、抗付着溶液で処理したプレートに移す(ステップ1.1.1から)。
- 4°Cのシェーカーにプレートを30分間置きます。ジャイロシェーカーは70rpmで使用できます。
メモ:オルガノイドの断片化を引き起こす可能性がありますので、サンプルを渦出させるなど、厳しい揺れを避けてください。泡と泡の形成は、過酷な揺れを示すことができます。 - 30分後、プレートを取り外します。1 mL ピペットチップに抗付着液を塗布し、溶液を上下に軽くピペットします。
- 4 °Cのシェーカーにプレートを15分間置きます。ジャイロシェーカーは70rpmで使用できます。
- プレートを取り外し、オルガノイドを重力で落ち着かせる(室温で1〜2分)。顕微鏡下でプレートを観察し、オルガノイド沈下を確認します。
注:プレートの大規模な攪拌は、オルガノイドが再中断する原因となる可能性がありますので避けてください。 - オルガノイドが落ち着いたら、解離液をできるだけ多く取り出し、DMEM/F-12の1.5 mLを加えて洗浄します。
- オルガノイドを堆積させ、できるだけ多くの上清を取り除く。もう一度洗浄を繰り返します。
注:顕微鏡下でプレートを観察し、洗浄工程を実行する前にオルガノイド沈降を確認します。 - できるだけ多くのDMEM/F-12を取り除き、腸オルガノイド拡張培地の0.5 mLを追加します。37°Cおよび5%CO2でインキュベートする。
- 翌日、プレートを25~30度の角度で傾け、ウェルの壁に沿って培地を取り除いて、部分的な培地交換を行います。懸濁したオルガノイドを除去しないように注意して培地の0.4 mLを除去します。
- 0.4 mL腸オルガノイド拡張培地を追加します。37°C、5%CO2で3日間インキュベートする。
注:3日後、オルガノイドのほとんどは極性を持つはずですが、大きな凝集体が形成されている可能性があります。 - 凝集体が形成された場合は、1 mLピペットを使用して、チップの先端をプレートの底に押し込みながら、20回上下にピペット処理を行い、防着溶液(ステップ1.2.6および1.2.7で説明)でコーティングされたチップを使用します。
- プレートを37°Cと5%CO2に置き、翌日に腸オルガノイド拡張培地(セクション1.2.17に記載)で完全な培地交換を行います。
- 2日後(懸濁5日目)、下流アッセイでアペカルアウト腸オルガノイドを使用することができる。
2. 3D腸器官由来の腸細胞2D単層及び空気液体界面(ALI)培養の確立
注:このセクションでは、腸のオルガノイドから2D単層培養を生成するためのプロトコルの概要を説明します。この技術は、細胞培養膜挿入物を含む組織培養板に露出した有端な単層培養物を、コンフルエント、偏極化した単層培養物に確立する利点を提供する。単層は水没した単層形式で区別し始めますが、合流に達した後にALI培養物に切り替えることで、単層のさらなる差別化を達成することができます。単層およびそれに続くALIプロトコルはいずれも、エンドポイントアッセイとして意図されており、単層培養は小さな幹細胞集団を維持するが、いずれも確立後に効率的に分割および通過することができる。
- 腸単層培養用の培地とプレートの準備
- 単層培養の製造業者によって概説された腸器官分化培地を準備する ( 材料のリストを参照してください).Y-27632を、1週間以内に使用する培地のボリュームに10μMの最終濃度で追加します。すぐに使用しない場合は、4°Cで保存してください。
- プリウォームトリプシンEDTA(0.05%)〜37°C。
- 単層培養液を播種する前に少なくとも2時間、以下のように2%のECMコーティング溶液を調製する。
- 氷の上でECMを解凍し、2%の溶液を調製するために冷たい、無菌PBSに1:50を加えます。使用する各6.5mm(0.33 cm2)細胞培養膜挿入物の上部ウェルに100 μLを加えるのに十分な量を準備してください。大きいか小さいカルチャに適したボリュームを調整します。
- 各ウェルに100 μLを加え、必要になるまで37°C、5%CO2で各プレートをインキュベートします(シード前に少なくとも2時間)。
- 単層生成と培養のための腸オルガノイドの解離
- 適切な数のオルガノイド培養井戸をインキュベーターから除去する。各種の培養物に収穫するウェルの推奨数については 、表1 を参照してください。
- ECMドームを乱すことなく、オルガノイド培養物からすべての培地を吸引する。
- 各ウェルに解離液1 mLを加えます。
- 室温(15~25°C)で1分以上インキュベートします。
- 1 mL ピペットを使用して、激しくピペットを上下にしてドームを破壊し、オルガノイドを放出します。
- 15 mL円錐形の管の各井戸から中断されたオルガノイドをプールします。穏やかな攪拌または揺れで10分間室温でインキュベート。複数のウェルを播種するためのオルガノイドは、このステップで、各チューブに最大10 mLの体積をプールすることができます。
- 4 °Cで5分間200 x g で遠心分離機。
- 上清を取り除き、捨てます。オルガノイドを再中断するために5 mL氷冷DMEM / F-12を加えます。
- 4°Cで5分間200xgで再び混ぜ合わせ、遠心分離機を入れてみてください。
- 上清を吸引し、できるだけ取り除き、ペレットを乱さないよう注意する。
注:一部の残留ECMはペレットに残っている可能性があります。しかし、これはオルガノイドの解離に大きな影響を与えるべきではありません。 - オルガノイドを再懸濁するために、1 mLのプリウォームド(37°C)トリプシン-EDTA(0.05%)を加えます。均一な懸濁液を確保するために十分に混ぜます。多数の細胞に対して、または大量のECMが残っている場合は、さらに1 mLのトリプシン-EDTAを追加します。
- 37°Cで5~10分間インキュベートします。
- オルガノイドを可能な限り破壊するために1 mLピペットと十分に混ぜます。オルガノイドは、単一細胞または小さな断片に完全に解き分けるべきである。完全にピペッティングした後に大きな断片またはオルガノイド全体が残っている場合は、トリプシン-EDTAを37°Cでインキュベーションを続けて3〜5分間続けます。
注:トリプシンEDTAを20分以上インキュベートしないでください。 - オルガノイドが十分に解熱されたら、DMEM/F-12の等しい体積(例えば、1 mL DMEM /F-12/mLトリプシン-EDTA)とピペットを上下に加えて完全に混合します。このステップでDMEM/F-12に10%FBSを加えてトリプシンEDTAを非アクティブ化します。
- 遠心分離機断片は2〜8°Cで5分間200xgで。
- 解体されたオルガノイドがペレットに失敗した場合、これは一般的であり、解き放たれた細胞によって放出される粘液の蓄積に起因する可能性があります。この場合、細胞を上下にピペットして十分に混合し、2〜8°Cで5分間200 x g で再び遠心分離します。
- 細胞ペレットのみを残して、できるだけ多くの上清を慎重に除去します。
- 各ウェルを播種する腸オルガノイド分化培地(10 μM Y-27632)の100 μLで細胞を再懸濁します。大きいか小さいウェルサイズに適した音量を調整します。
- インキュベーターからコーティングされたプレートを取り出し(ステップ3.1.4で準備)、各ウェルから余分なECMを取り除きます。
- 各細胞培養インサートの上部ウェルに細胞懸濁液100μLを加えます。
- 各細胞培養挿入物の下部ウェルに腸オルガノイド分化培地の500 μLを加えます。
- 37°Cおよび5%CO2でインキュベートする。
- 上下のウェルの両方で、2~3日ごとに培地を交換してください。単層培養は7日以内に合流し、2~3日以内に合流することが多い。
- 空気液体インタフェース (ALI) カルチャの確立
注:必要に応じて、水没した単層培養物をALI培養に移行させることで、水没した単層培養のさらなる分化を達成することができる。この培養法により、分化した細胞の種類、特に、ゴブレットや腸内分泌細胞などの分泌系統の細胞数の増加が可能となる。- 上記の手順2.2.1~2.2.23で説明した細胞培養挿入物に単層培養を確立し、この培養を少なくとも4日間100%合流に維持する。
- ALI培養を確立するには、上側と下側のウェルから培地を取り除きます。新鮮な腸器官分化培地(Y-27632)を下の井戸に加え、上側も空のままにします。
- 37°Cおよび5%CO2でインキュベートする。
- 2〜3日ごとに下ウェルで培地を交換し、単層が少なくとも1週間分化できるようにします。
- 必要に応じて、余分な粘液蓄積を除去するために滅菌PBSで上をよくすすぎ。
これらの条件下では、ALI培養は少なくとも2〜3週間維持することができる。
結果
オルガノイドは、先に説明したプロトコルに 従って生検サンプルから生成され、腸管オルガノイド拡張培地用PIS( 材料表を参照) 図1Aは、左パネル、腸器官拡張培地を用いたドームで培養した腸器官の表現型を示す。これらの培養条件において、オルガノイドは、内腔を囲む薄い(10〜25 μm)上皮によって定義される嚢胞形態を示す(図1A、右パネル)。この段階では、腸上皮の有端側が内腔に面し、バソラテラル側が周囲の細胞外マトリックスに接触する。オルガノイドの大部分が所望の大きさに達すると、細胞外マトリックスを除去し、次いでオルガノイドを懸濁液で培養した。細胞外マトリックスへの細胞結合の喪失は、オルガノイドの反転プロセスを引き起こし、オルガノイド上皮の極性の逆転をもたらし、上皮の上端を成長培地に露出させ、バソラターレ側を内在化させる。
一部の培養では、懸濁物凝集およびヒューズ中のオルガノイドは、最初の3日間でより深い効果である(図1B、左パネル)。剪断技術の適用は、オルガノイドの剥離と最小限の再凝集で数日間の培養の継続を可能にする(図1B、右パネル)。
ECMドームで培養された腸管オルガノイドは拡大し続け(図1C、左パネル)、内腔を取り囲む上皮の側に、小さな納骨堂に似た二次出芽構造の自発的な形成を示す(図1C、右パネル)。同時に、細胞外マトリックスの存在しない場合に5日間維持されるオルガノイドは、懸濁液中で発症し続けている(図1D、左パネル)。極性の反転は、オルガノイドの核を取り囲む上皮の肥厚(30〜40μm)と様々な形態の出現によって特徴付けられる:伸びる(図1D、右パネル および 補助図1A)、嚢胞性(補足 図1B)、および不規則な(補足 図1C)。これは、オルガノイド内の発光空間の縮小と組み合わされることが多く、全体的な大きさに影響を与えます。
腸特異的極性マーカーの発現を解析することによって、効率的な反転を確認することもできる。アピカルアウト腸器官は、4′,6-ジミジノ-2-フェニリンドール(DAPI)シグナルで示されるように、オルガノイドの内腔に向かって核の明確な局在を示す。この媒体に露出している上皮の外側で、VILLIN(図2A)やZO-1(図2B)などの有端マーカーの発現が検出される。この局在化は、ECMで培養された腸オルガノイドで観察されたものとは全く対照的である。細胞外マトリックス埋め込みオルガノイドは、核(DAPI)、VILLIN(図2C)、およびZO-1(図2D)に対して、アペカル側がオルガノイドの内腔に向いているアピコ基底極性を示す。
腸オルガノイドの有効な極性反転を得るためには、ECMの完全な除去が必要です。時折、ECM残基に囲まれた懸濁液培養物に見られるオルガノイドの一部は、上皮の極性反転の失敗を示唆する嚢胞形態を示す(補助図2A)。これらのオルガノイドに対して行われる免疫蛍光染色の解析は、上皮に沿った核のバソラショナル位置(DAPI)と、オルガノイドの内腔に面した頭先側のZO−1の発現の証拠を提供し、不完全なECMがECM埋め込み性の除去を引き起こすことを確認する。
腸単層培養の確立のためのプロトコルは、播種の7日以内にコンフルエント単層培養をもたらし、培養は、多くの場合、わずか2〜3日以内に合流に達する。成功の主要な決定要因の1つは、単層を播種するために使用される細胞の数と品質です。 図3A、左パネル は、6.5mm細胞培養膜挿入物中の約15万個の細胞の理想的な播種密度の例を示す。この数は固定されておらず、ドナーとソースオルガノイド培養の質に基づいて非常に可変することができます。したがって、セル番号は、これらの変数に基づいて最適化する必要があります。播種密度が低すぎる場合、または品質が悪い場合(図3A、右パネル)、コンフルエント単層培養を形成するのに十分なアタッチメントがない可能性があります。
単層が確立されると (図 3B)、細胞は緊密な接合を形成し、石畳の外観を作り出す(図3B、左パネル)。コンフルエント単層(図3B、右パネル)を形成できない場合、単層の外観は、良質の細胞の付着領域を持つ「パッチリ」であることが多く、これらの領域間のギャップが大きくなります。これらの培養物は、基底部と尖体の区画間に機能的な障壁を設けておらず、記載されたアッセイには適さない。コンフルエント単層は、そのビリン含有ブラシ境界を上皮の上端側に向け、その核を細胞のバソラテラの極に向けて配置する(図4B)。細胞間では、ZO-1を含むマルチタンパク質複合体からなる細胞間接合が形成される(図4B)。彼らの存在は、上皮文化のバリア機能を提供するための鍵です。
コンフルエント化すると、ALI文化への移行は、培養物のさらなる分化を誘発する(図3C)。小さな丸いゴブレット細胞が現れ、単層自体がより折り畳まれた外観を取ります。ゴブレット細胞は、水没培養の上皮内に存在するが(図4A)、それらはALI分化後に顕著である。上皮内に存在するゴブレット細胞は粘液を分泌し、上皮の上面にかすんだ外観を導く。このゴブレット細胞および分泌粘液は、分泌されたムチンタンパク質、MUC2(図4A、CおよびD)の染色により可視化され、かつ、ゴブレット細胞集団の増加はMUC2発現の増加によって測定することができる(補足図3A)。このゲル状粘液層を除去する必要はないし、上皮の表面に付着し、繰り返しの開く後も残る。除去が必要な場合は、10 mM N-アセチルシステインや50 μg/mL DTTなどの粘液分解化合物で培養液を洗浄すると、余分な粘液が除去されます。また、ゴブレット細胞集団の増加に加えて、ALIインターフェースは、腸内分泌細胞(CHGA発現で示される)(補足図3B)および成熟した腸球(KRT20発現で示される)の存在を増加させる(補足図3C)。
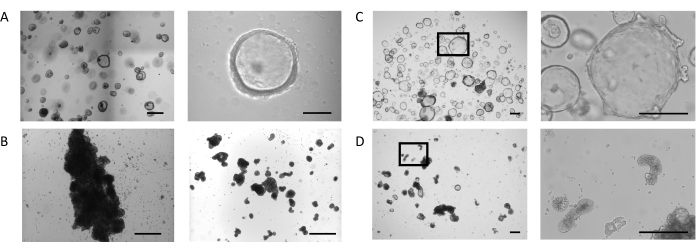
図1:アパイカルアウト腸器官の発生の段階(A) 4日目に所望の大きさのオルガノイドを持つドームの代表的な画像(左パネル、スケールバー= 500 μm)。オルガノイドは、開いた照明コンパートメント(右パネル、スケールバー= 100 μm)で、薄い壁です。(B)サスペンションで3日後に大規模な凝集を有するウェルの代表的な画像(左パネル、スケールバー=200μm)。せん断直後の塊片の画像(右パネル、スケールバー=200μm)。(C) 7日目のドームにおける腸内オルガノイドの代表的な画像。オルガノイドは、上皮のバソラテラル側に小さな芽の形成を伴う拡張された内腔を表示します(左20倍倍、マークされた領域の右100倍倍、スケールバー= 200μm)。(D) ECM除去後の腸内オルガノイドの代表的な画像を5日間の後の懸濁液培養。オルガノイドは肥厚した上皮を有する緻密な形態を得て、その上端を培地に露出させる。(左20倍倍、マークされた領域の右100倍の倍率、スケールバー=200μm)。 この図の大きなバージョンを表示するには、ここをクリックしてください。
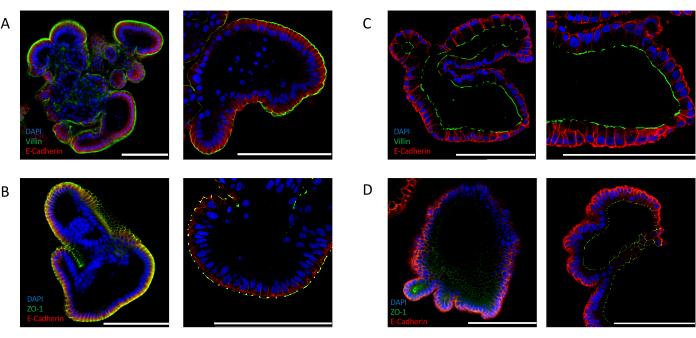
図2:腸管オルガノイドにおける細胞極性マーカーの免疫蛍光染色アプリカルアウト(A,B)およびアピカルイン(C,D)指向腸オルガノイドは、座尖マーカーZO-1とVILLIN、および上皮マーカーE-CADHERIN(赤)で染色された。核を可視化するためにDAPI(青)を用いた。左パネルは25倍の倍率で撮影した画像を表示し、右パネルは63倍の倍率で異なるオルガノイドの画像を表示します(パネルCのみが同じオルガノイドの25倍と63倍の倍率を表示します)。(A)アペカルアウト腸器官は、VILLIN(緑色)およびE-CADHERIN(赤色)で染色され、その培地へのアペジカル側の暴露を示す。(B)ZO-1(緑色)とE-CADHERIN(赤)で染色されたアピカルアウト腸器官は、狭い接合部の存在とアピコ基底極性の復帰を示す。(C)マトリゲル埋め込み腸オルガノイドは、ビリン(緑色)とE-CADHERIN(赤)で染色され、アピカル側をオルガノイド内腔に向けて示す。(D)MAtrigel組み込み腸オルガノイドは、オルガノイドの内腔に向いている有端なタイトな接合部の存在を示すZO-1(緑色)およびE-CADHERIN(赤)で染色された。(スケールバー= 100 μm)。オルガノイドは免疫蛍光によって染色され、以前に公開されたプロトコル24,25を用いて画像化した。この図の大きなバージョンを表示するには、ここをクリックしてください。
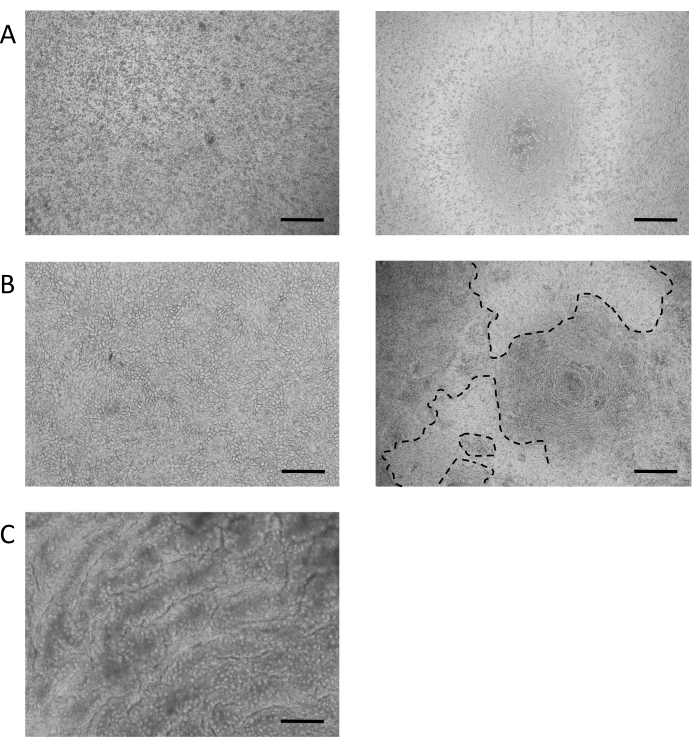
図3: 腸単層培養の確立( A) 0.05%トリプシン-EDTAによる治療後の3Dオルガノイドの代表的な画像オルガノイドは、単層培養物の播種に備えて単細胞または小さな細胞塊に解化される。左パネル:6.5mmの細胞培養膜挿入物に100μLあたり約150,000細胞、単層培養のための最適な播種密度の例。右パネル:6.5mm細胞培養膜挿入物で100μL当たり <50,000個の細胞で最適でない播種密度の例。(B) 水没した単層文化の代表的な明視野画像。左パネル:特徴的な石畳の外観を持つ100%コンフルエント層。右パネル:約50%コンフルエント単層。腸幹細胞の増殖が続いているため、単層(破線で示される)に見られる隙間は時間の経過とともに閉じます。(C) 7日で区別されたALI培養の代表的な明視野画像。(スケールバー= 200 μm)。 この図の大きなバージョンを表示するには、ここをクリックしてください。
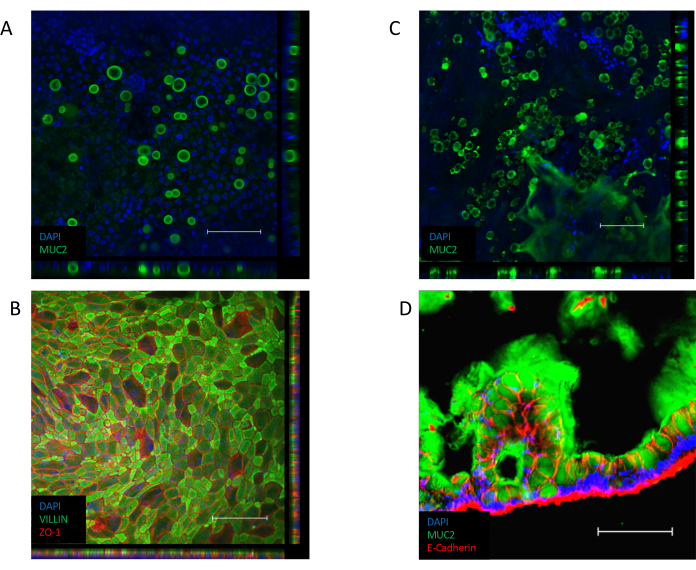
図4:単層培養における分化細胞マーカーに対する免疫蛍光染色法(A)MUC2の水没単層培養の免疫蛍光染色のZスタック画像は、単層培養中のゴブレット細胞の存在を示す(緑色=MUC2、青=DAPI)。(B)水没単層の免疫蛍光染色のZスタック画像。上皮の尖端に沿ったシリン染色(緑色)は、ブラシ境界の存在を示し、ZO-1染色(赤)は細胞間の緊密な接合(青=DAPI)の存在を示す。(C)MUC2のMUC2に対するALI分化単層培養物の免疫蛍光染色のZスタック画像は、ALI単層培養中に有意に多くのゴブレット細胞が存在することを示す(緑色=MUC2、青色=DAPI)。(D)ALI分化単層培養のクライオセクションは、上皮中のゴブレット細胞の存在と単層培養のアプリカル側に沿った粘液の分泌を示すMUC2(緑色)およびE-CADHERIN(赤)の存在のために染色される。(スケールバー= 200 μm)。単層培養物は、免疫蛍光によって染色され、以前に公開されたプロトコル26,27を用いて画像化した。この図の大きなバージョンを表示するには、ここをクリックしてください。
補足図1:培養懸濁液中の有端外腸オルガノイドのフェノタイプのスペクトル (A,B,C)ECM除去後5日目に懸濁液中に維持された腸器官形態の追加の代表的な画像。オルガノイド極性が反転している。オルガノイドは肥厚した上皮でより密になり、オルガノイドの上端側は外側に向いている。オルガノイドは、様々な形態を示すことができます:細長い(A)、嚢胞(B)、および不規則な(C)。(スケールバー= 100 μm)。 このファイルをダウンロードするには、ここをクリックしてください。
補足図2:腸管オルガノイドは、懸濁培養中の残基膜マトリックス培地の存在下で極性を反転することができない。 (A) 不完全なECM除去とオルガノイドの極性を反転させなかった場合の代表的な画像。マトリゲル残骸はオルガノイドの周りに存在し、上皮極性指向のアプリカルインを維持することに寄与する。オルガノイドは、内腔を取り囲む薄い上皮を有する嚢胞形態を示す(スケールバー=200μm)。(B)懸濁培養条件で見られる非反転オルガノイドの代表的な画像。核(青=DAPI)及びE-CADHERIN(赤色)はバソラテラ側に位置し、ZO−1(緑色)はオルガノイドの内腔に面した有端側に発現する。(スケールバー= 100 μm)。 このファイルをダウンロードするには、ここをクリックしてください。
補足図3:単層培養における分化細胞マーカーの遺伝子発現(A,B,C)qPCRを介して確立された腸オルガノイド拡張培地で成長した3Dオルガノイド培養物に対して、腸オルガノイド分化培地で生成される水没およびALI分化単層培養におけるMUC2、CHGA、およびKRT20の発現。 水没単層培養の確立は、各分化された細胞マーカーの発現を増加させます。ただし、ALI カルチャとしての分化は、各マーカーの発現を指数関数的に増加させます。エラーバー = +/- SEM.このファイルをダウンロードするには、ここをクリックしてください。
| 単層文化製品 | 収穫する腸器官のウェルの数(50 μLドームから/播種する井戸あたり) |
| 6.5 mm トランスウェル挿入 | 1 - 2ウェル |
| 12 mm トランスウェル挿入 | 3 - 4ウェル |
| 6ウェルプレート | 6 - 8ウェル |
| 24ウェルプレート | 3 - 4ウェル |
| 96ウェルプレート | 1 - 2ウェル |
表1:様々な培養物に収穫する腸オルガノイドの井戸の数
ディスカッション
上皮オルガノイドモデルは、組織組織、疾患進行をモデル化し、治療23、28、29を同定するために使用できる強力なプラットフォームとなっています。オルガノイドマイクロインジェクションは、宿主上皮の有端側との病原体の相互作用を可能にする、感染症をモデル化するオルガノイドの能力に付加価値を与えています。マイクロインジェクション技術の最近の進歩は、オルガノイドの注入速度を最適化し、1時間あたり最大90の注入オルガノイドの速度を達成しています。注入されたオルガノイドにおけるバリア機能を保持し、かつ、必須嫌気性注入細菌30の生存のために、内腔内の低酸素濃度を可能にした。しかし、研究は、同じ井戸内のオルガノイド集団における不均一性の存在を指摘している。これらの違いは、サイズおよび形状31、主要遺伝子32の発現レベル、ならびに増殖率33において観察された。フォルスコリンやPGE2などの化合物に対する同一オルガノイド集団内の差動応答、またはコレラ毒素に対する差動応答も28,33に記載されている。これらの結果は、研究における高オルガノイド数の必要性を強調し、発光注射の利用を制限する。
従来のオルガノイド培養は、ヒドロゲル中のオルガノイドのカプセル化および伝播に基づいている。しかし、ヒドロゲルは拡散に制限を与え、濃度勾配を導入し、異質性34を増加させることができる。さらに、文化とドナーの間だけでなく、個々の実験条件内でも高い変動性が文書化されています。ドナー源、ヒドロゲルの生化学的性質、および培養系としてのオルガノイドの固有の不均一性は、実験変動性を高め、下流用途で得られた結果の再現性を制限する重要な因子である。ここで説明する方法の両方は、上皮の有端側を露出させる簡単な手段を提供し、それらを培地に直接添加することによって目的の化合物および病原体のモデリングを可能にする。ヒドロゲル使用率の低下は、技術的な誤差源からの実験的変動を制限することができます。
アパイカルアウト腸オルガノイドは、オルガノイドモデルシステムの重要な特性を保持し、そのスケーラビリティは、2D単層と比較して、高スループットアッセイに適しています。しかし、オルガノイドは3D構造を保持するため、基底側のアクセシビリティは限られており、同時に両側へのアクセスを必要とする研究を妨げる可能性があります。
我々は、腸オルガノイドの極性反転が、オルガノイドの無傷の構造を維持しながら、ECMの効率的かつ絶対的な除去に依存していることを実証した。ECMを除去するための解離溶液とプラスチック製品へのオルガノイド付着を防ぐための抗付着溶液の両方が、特に下流アプリケーションのために産生されるアピカルアウトオルガノイドの数に関して、Co.J.Y.および同僚22が発表したプロトコルの全体的な効率を改善するのに寄与した。
さらに、プロトコルは250μm未満のオルガノイドのより効率的な反転をサポートし、より大きなオルガノイドを使用すると、ピペットによる断片化のためにオルガノイドの出力が減少する可能性があることを観察しました。 材料表に示されているような広孔の先端は、より大きなオルガノイドの利用を可能にするかもしれない。しかし、広孔先端は、適用された機械的力が低いため、標準のチップと比較するとECM解離にはあまり効果がありません。したがって、より大きなオルガノイドを操作する場合、十分な破壊とすべてのECM残骸の完全な除去のために、ステップ1.2.9-1.2.11を繰り返す必要があります。
懸濁液中のオルガノイドは、少なくとも2週間生存することができる。この期間の後、我々は形態の変化と細胞死の増加を観察した。アパイカルアウトオルガノイド22 中に増殖細胞が存在することで、アペカルイン腸オルガノイド培養の再確立が可能となる。これは、単一細胞にアピカルアウトオルガノイドを解離し、腸オルガノイド拡張培地とECMに埋め込むことによって達成することができる。
懸濁培養における腸器官の確立を記述するプロトコルで頻繁に遭遇する制限は、大きな凝集体の生成である。これは、効率、形態学的特徴の再現性、化合物への透過性、パラクリンシグナル伝達などのいくつかの変数に影響を与えます。Co、J.Y.および今回の同僚が発表したプロトコルと同様に、ここでは、懸濁されたオルガノイドの少なくとも97%の極性反転を得たが、3日後に懸濁液を断聴せずに得られた。しかしながら、今回の発表とは対照的に、大きな骨材の形成を減らし、収量を増加させるために機械的解離工程を導入した。この手順はオルガノイドの上皮に損傷を与える可能性があるため、我々は完全な上皮回収を可能にし、下流の適用のための高品質の培養を確保するために、さらに2日間のオルガノイドインキュベーション期間を延長しました。インキュベーターシェーカーまたはスピナーフラスコを使用して絶え間ない攪拌を導入すると、潜在的に融合イベントを減らし、断片化を最小限に抑え、酸素化を増加させる可能性があります。これらの代替アプローチは、培養をより長い期間維持し、細胞死を減少させ、そして、アピカルアウト腸器官のさらなる分化を可能にするかもしれない。
オルガノイド由来の2D単層の確立は、逆極性オルガノイドと比較していくつかの利点と欠点を提供します。ここで説明するプロトコルは、コンフルエント単層培養の迅速な確立を可能にします, 通常, 7日以内に, 長期間にわたって培養物の長期維持のオプション (10週間まで).ここで用いられるプロトコルおよび媒体はまた、有意な数の細胞の効率的な分化を可能にするが、他のオルガノイド由来単層培養16に常に見られるわけではない。細胞培養挿入膜上に単層を確立することで、上皮の上端側と下側側の両方に同時にアクセスできるため、バリア完全性および上皮輸送の研究に理想的です。この簡素化されたアクセスはまた、感染および薬物治療研究に彼らをより受け入れやすいレンダリングします。さらに、これらの培養は、ドナー特有の特性の多くを維持し、患者固有の研究に対する関連性を維持する。ALI培養法はまた、分泌細胞および吸収性細胞タイプの両方から構成されるより機能的な上皮の分化を促進し、ヒト腸上皮をより代表するものである。これらの培養の相対的な安定性はまた、長期間にわたって維持されることを可能にし、長期研究の可能性を提供する。しかし、このアプローチの限界は、コンフルエント単層を確立するために必要な細胞の数が多く、そして、補助的およびバソラショナルチャンバ間の機能的分離を有するために完全な合流性を維持する必要性である。3Dオルガノイド培養でモデル化できる特徴的な暗号アーキテクチャは、単層文化を確立すると失われます。それにもかかわらず、培養の実験的に友好的な形式と上皮の有端およびバソラテラル側にアクセスできる容易さは、腸生理学の研究のための強力なツールになります。
開示事項
G.S.、W.C、S.S.は、ケンブリッジ(英国)のSTEMCELLテクノロジーズ株式会社の従業員です。M.S.、F.E.、S.L.、A.E.、R.K..Cは、STEMCELL Technologies Inc.、バンクーバー(カナダ)の従業員です。
謝辞
この研究は、革新的なトレーニングITNプログラムであるウイルス研究のためのオルガノイドプロジェクトに関するHorizon 2020助成金OrganoVIR 812673によって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| Anti-Adherence Rinsing Solution | STEMCELL Technologies Inc. | 7010 | For coating cultureware. Referred as anti-adherent solution into the main text. |
| Conical tubes, 15 mL | STEMCELL Technologies Inc. | 38009 | |
| Corning Matrigel Matrix, Growth Factor Reduced (GFR), Phenol Red-Free | Corning | 356231 | Extracellular matrix (ECM) for maintenance and establishment of organoid lines. |
| Costar 6.5 mm or 12 mm Transwell inserts | STEMCELL Technologies Inc. | 38023/38024 | For 2D Monolayer culture. |
| Costar 24 Well Flat-Bottom, Tissue culture-treated plate | STEMCELL Technologies Inc. | 38017 | For maintenance and establishment of organoid lines. |
| D-PBS (Without Ca++ and Mg++) | STEMCELL Technologies Inc. | 37350 | For washing |
| Dimethyl sulfoxide (DMSO) | Millipore Sigma | D2650 | Reconstitution of small molecules |
| DMEM/F-12 with 15 mM HEPES | STEMCELL Technologies Inc. | 36254 | For washing |
| Gentle Cell Dissociation Reagent (GCDR) | STEMCELL Technologies Inc. | 7174 | For Matrigel removal. Referred as dissociation reagent into the main text. |
| IntestiCult Organoid Growth Medium (Human) | STEMCELL Technologies Inc. | 6010 | For expansion of organoid lines prior to differentiation. Referred as Intestinal Organoid Expansion Medium into the main text. |
| IntestiCult Organoid Differentiation Medium (Human) | STEMCELL Technologies Inc. | 100-0214 | For establishment of monolayers and 3D differentiation. Referred as Intestinal Organoid Differentiation Medium into the main text. |
| Trypsin-EDTA (0.05%) | STEMCELL Technologies Inc. | 7910 | For 2D Monolayer establishment. |
| Y-27632 | STEMCELL Technologies Inc. | 72302 | RHO/ROCK pathway inhibitor, Inhibits ROCK1 and ROCK2. Used for 2D monolayer establishment. |
| Wide bore tips | Corning | #TF-1005-WB-R-S | Organoids handling |
参考文献
- Gehart, H., Clevers, H. Tales from the crypt: new insights into intestinal stem cells. Nature Reviews Gastroenterology and Hepatology. 16 (1), 19-34 (2019).
- Schneeberger, K., Roth, S., Nieuwenhuis, E. E. S., Middendorp, S. Intestinal epithelial cell polarity defects in disease: lessons from microvillus inclusion disease. Disease Models & Mechanisms. 11 (2), (2018).
- Klunder, L. J., Faber, K. N., Dijkstra, G., Van Ijzendoorn, S. C. D. Mechanisms of cell polarity - Controlled epithelial homeostasis and immunity in the intestine. Cold Spring Harbor Perspectives in Biology. 9 (7), 0227888 (2017).
- DiMarco, R. L., Hunt, D. R., Dewi, R. E., Heilshorn, S. C. Improvement of paracellular transport in the Caco-2 drug screening model using protein-engineered substrates. Biomaterials. 129, 152-162 (2017).
- Sun, H., Chow, E. C., Liu, S., Du, Y., Pang, K. S. The Caco-2 cell monolayer: usefulness and limitations. Expert Opinion on Drug Metabolism & Toxicology. 4 (4), 395-411 (2008).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Dutta, D., Heo, I., Clevers, H. Disease modeling in stem cell-derived 3D organoid systems. Trends in Molecular Medicine. 23 (5), 393-410 (2017).
- Zhang, Y. -. G., Wu, S., Xia, Y., Sun, J. Salmonella-infected crypt-derived intestinal organoid culture system for host-bacterial interactions. Physiological Reports. 2 (9), 12147 (2014).
- Nigro, G., Rossi, R., Commere, P. -. H., Jay, P., Sansonetti, P. J. The cytosolic bacterial peptidoglycan sensor Nod2 affords stem cell protection and links microbes to gut epithelial regeneration. Cell Host & Microbe. 15 (6), 792-798 (2014).
- Heo, I., et al. Modelling Cryptosporidium infection in human small intestinal and lung organoids. Nature Microbiology. 3 (7), 814-823 (2018).
- Bartfeld, S., et al. In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection. Gastroenterology. 148 (1), 126-136 (2015).
- Leslie, J. L., et al. Persistence and toxin production by Clostridium difficile within human intestinal organoids result in disruption of epithelial paracellular barrier function. Infection and Immunity. 83 (1), 138-145 (2015).
- Pleguezuelos-Manzano, C., et al. Mutational signature in colorectal cancer caused by genotoxic pks(+) E. coli. Nature. 580 (7802), 269-273 (2020).
- Fernando, E. H., et al. A simple, cost-effective method for generating murine colonic 3D enteroids and 2D monolayers for studies of primary epithelial cell function. American journal of physiology. Gastrointestinal and Liver Physiology. 313 (5), 467-475 (2017).
- Moon, C., VanDussen, K. L., Miyoshi, H., Stappenbeck, T. S. Development of a primary mouse intestinal epithelial cell monolayer culture system to evaluate factors that modulate IgA transcytosis. Mucosal Immunology. 7 (4), 818-828 (2014).
- Wang, Y., et al. Long-term culture captures injury-repair cycles of colonic stem cells. Cell. 179 (5), 1144-1159 (2019).
- Noel, G., et al. A primary human macrophage-enteroid co-culture model to investigate mucosal gut physiology and host-pathogen interactions. Scientific Reports. 7, 45270 (2017).
- VanDussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. 64 (6), 911-920 (2015).
- Thorne, C. A., et al. Enteroid monolayers reveal an autonomous WNT and BMP circuit controlling intestinal epithelial growth and organization. Developmental Cell. 44 (5), 624-633 (2018).
- Wang, A. Z., Ojakian, G. K., Nelson, W. J. Steps in the morphogenesis of a polarized epithelium: I. Uncoupling the roles of cell-cell and cell-substratum contact in establishing plasma membrane polarity in multicellular epithelial (MDCK) cysts. Journal of Cell Science. 95 (1), 137-151 (1990).
- Wang, A. Z., Ojakian, G. K., Nelson, W. J. Steps in the morphogenesis of a polarized epithelium: II. Disassembly and assembly of plasma membrane domains during reversal of epithelial cell polarity in multicellular epithelial (MDCK) cysts. Journal of Cell Science. 95 (1), 153-165 (1990).
- Co, J. Y., et al. Controlling epithelial polarity: a human enteroid model for host-pathogen interactions. Cell Reports. 26 (9), 2509-2520 (2019).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Dodt, H. -. U., et al. Ultramicroscopy: three-dimensional visualization of neuronal networks in the whole mouse brain. Nature Methods. 4 (4), 331-336 (2007).
- Fujii, M., et al. Human intestinal organoids maintain self-renewal capacity and cellular diversity in niche-inspired culture condition. Cell Stem Cell. 23 (6), 787-793 (2018).
- Crowley, S. M., et al. Intestinal restriction of Salmonella Typhimurium requires caspase-1 and caspase-11 epithelial intrinsic inflammasomes. PLoS Pathogens. 16 (4), 1008498 (2020).
- Rees, W. D., et al. Enteroids derived from inflammatory bowel disease patients display dysregulated endoplasmic reticulum stress pathways, leading to differential inflammatory responses and dendritic cell maturation. Journal of Crohn's & Colitis. 14 (7), 948-961 (2020).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- Almeqdadi, M., Mana, M. D., Roper, J., Yilmaz, &. #. 2. 1. 4. ;. H. Gut organoids: mini-tissues in culture to study intestinal physiology and disease. American Journal of Physiology. Cell Physiology. 317 (3), 405-419 (2019).
- Williamson, I. A., et al. A high-throughput organoid microinjection platform to study gastrointestinal microbiota and luminal physiology. Cellular and Molecular Gastroenterology and Hepatology. 6 (3), 301-319 (2018).
- Kassis, T., Hernandez-Gordillo, V., Langer, R., Griffith, L. G. OrgaQuant: human intestinal organoid localization and quantification using deep convolutional neural networks. Scientific Reports. 9 (1), 12479 (2019).
- Gracz, A. D., et al. A high-throughput platform for stem cell niche co-cultures and downstream gene expression analysis. Nature Cell Biology. 17 (3), 340-349 (2015).
- Gunasekara, D. B., et al. Development of arrayed colonic organoids for screening of secretagogues associated with enterotoxins. Analytical Chemistry. 90 (3), 1941-1950 (2018).
- Shin, W., et al. Spatiotemporal gradient and instability of Wnt induce heterogeneous growth and differentiation of human intestinal organoids. iScience. 23 (8), 101372 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved