Method Article
장 관성 오르가노이드 모델을 사용하여 정법별 상호 작용을 연구하는 문화 방법
요약
여기서는 장 적정별 상호 작용을 모델링할 수 있는 두 가지 프로토콜을 제시합니다. 오르가노이드 유래 장 단층층 및 공기-액체 인터페이스(ALI) 배양은 발광 및 바생측 모두에서 접근할 수 있는 잘 차별화된 상피생성을 용이하게 하는 반면, 극성 반전장 기관가의 측면은 그들의 정면을 노출시키고 높은 처리량 분석에 적합합니다.
초록
창자 상피의 안대기는 루멘에 그들의 정압측을 드러내고 외부 단서에 반응하는 전문화한 상피 세포의 간단한 층으로 이루어져 있습니다. 최근 시험관 내 배양 조건의 최적화를 통해 장줄기 세포 틈새 시장을 재창조하고 세포 조성 및 상피의 조직을 재구성하는 고급 3차원(3D) 배양 시스템의 개발을 가능하게 한다. 세포외 매트릭스(ECM)에 내장된 장 내 오르가노이드는 내부 루멘과 외부 노출 기저 측을 포괄하는 잘 정의된 편광 상피를 생성하기 위해 장기적이고 자가 구성을 위해 유지될 수 있다. 장 기관지의 이 제한적인 본질은 시험관내 상피의 정량표면에 접근하는 데 어려움을 제시하고 영양 섭취 및 숙주 미생물/숙주 병원균 상호 작용과 같은 생물학적 메커니즘의 조사를 제한합니다. 여기서, 우리는 오르가노이드 상피의 정압 측에 대한 접근을 용이하게 하고 특정 장 세포 유형의 분화를 지원하는 두 가지 방법을 설명합니다. 첫째, 우리는 ECM 제거가 상피 세포 극성의 반전을 유도하고 정계 아웃 3D 오르가노이드의 생성을 허용하는 방법을 보여줍니다. 둘째, 성숙하고 분화된 세포 유형으로 구성된 장 가구형으로부터 유래된 단일 세포 현탁액으로부터 2차원(2D) 단층층을 생성하는 방법을 설명합니다. 이러한 기술은 시험관 내 외부 큐와 상피의 정표 특정 상호 작용을 연구하고 정밀 의학을 용이하게하는 플랫폼으로 오르가노이드의 사용을 촉진하는 새로운 도구를 제공합니다.
서문
장 상피는 인체에서 두 번째로 큰 상피이며 영양 섭취를 용이하게하고 환경 모욕 에 대한 장벽 역할을하는 편광 세포 층으로 구성됩니다1. 정문과 바소측 사이의 이러한 구별은 상피의 세포가 다양한 기능을 수행 할 수 있습니다. 정포 구획은 루멘에 노출되어 환경 자극 및 미생물과의 상피 상호 작용을 중재하는 동시에 영양 섭취를 촉진합니다. 바소쪽 표면은 세포 간 접합및 세포 매트릭스 접착력을 수용하고 면역 계통 및 기타 조직의 세포와 상호 작용하는 동안2. 이러한 접합은 장벽 역할을하고 주변 신체 조직에 흡수 된 영양소를 전달하는 지하 막에 부착 된 불투과성 단층을 생성합니다.
시험관 내 이러한 장 기능을 재구성할 수 있는 문화 시스템의 구축은도전적이다 3. 기존의 체외 모델은 Caco-2와 같은 변형된 인간 대장암 세포주를 활용하여 2D 단층 배양을 생성합니다. 흡수 구획의 여러 기능을 모델링 할 수 있음에도 불구하고,이 모델은 완전히 주요 기능적 특성과 응용 프로그램을 제한장 상피 조성 및 기능을 재구성 할 수 없습니다4,5.
장기 특이적 세포 유형으로 자가 구성및 분화할 수 있는 줄기 세포로부터 생성된 고급 3D 배양 시스템으로 오르가노이드의 출현은 장 상피6의시험관 내 연구에서 돌파구였다. 장 내 오르가노이드는 기저 라미나와 유사한 세포외 매트릭스(ECM)에 내장되어 있으며, 이러한 배양이 상피의 양피상극을 유지할 수 있도록 세포 매트릭스 접합을 형성한다. 오르가노이드는 유정측이 발광 구획에 노출되어 장의 구조를 모방하는 밀폐된 아키텍처를 나타낸다. 이 폐쇄된 조직은 방향별 기능을 연구할 수 있는 기회를 제공하지만 상피의 정점에 대한 액세스가 필요한 조사를 제한합니다. 오르가노이드 단편화, 오르가노이드 미세 주입 및 단일층 배양7의생성을 포함하여 2D 및 3D 모두에서 이러한 한계를 극복하기 위해 다양한 접근 법이 취해졌습니다. 오르가노이드 단편화는 구조 조직의 손실과 세포 접합의 파괴를 일으켜 상피 표면의 상피 표면을 매체에 노출할 수 있게 한다. 이 기술은 세포외 매트릭스로 시드될 때 오르가노이드를 개혁하기 위해 조각의 재생 능력을 활용하고 감염성 질환 및 숙주 병원체 상호 작용을 모델링하는 데 사용되었습니다8,9. 그러나, 정압 및 기저 표면에 대한 동시 접근은 또한 감염에 대한 비특이적 반응을 유도할 수 있다.
정표면에 접근할 수 있고 구조 구조 구조와 세포 접합을 모두 보존하는 대안접근법은 오르가노이드의 루멘으로 요인을 미세 주입하여 표현된다. 이 방법은 호스트 병원체 상호 작용을 연구하고 Cryptosporidium10, H. 파일로리11및 C. difficile12의 효과를 시험관 내의 위장 상피에 모델링하는 데 광범위하게 활용되었습니다. 유사한 기술을 사용하여, 장 상피에 대장균의 pks+ 균주의 돌연변이 전위가13을결정하였다. 비록 효과적인, organoid micro주입은 측정 가능한 효과 얻기 위해 주입 하는 데 필요한 장기의 높은 수를 고려 하는 힘들 고 비효율적인 작업 따라서 높은 처리량 측정량 에 대 한 그것의 응용 프로그램을 제한.
장 가구형과의 최근 발전은 또한 2D 단층 오르가노이드 배양의 확립을 위한 방법을 제공하여 그들의 apical 표면14,15,16,17을노출한다. 이러한 오르가노이드 유래 단층은 장 상피의 생체 내 특성에서 키를 재구성한다. 그(것)들은 분화하고 줄기 세포 인구를 둘 다 포함하는 생리적으로 관련있는 세포 조성물을 전시하고 crypt-villus 축을 통해 다양성을 모델링합니다. apicobasal 극성이 유지됨에 따라 고유의 단층 특성을 통해 정문 및 바식자 측 과 미디어 교환을 쉽게 접근할 수 있어 장 내 흐름과 폐기물 제거를 모방하여 장기적인 문화를 가능하게 합니다. 이러한 특징은 오르막성 단층원으로 발광 상호 작용에 초점을 맞춘 연구를 가능하게 하고 상피 장벽 무결성 및 투과성18,19에대한 우수한 모델을 제공한다.
연구에 따르면 상피 세포 극성은 MDCK 스페로이드20,21의 ECM 단백질에 의해 엄격하게 조절되고 있으며 최근에는 인간 장 가구(22)에서 과같이 조절된다. 세포 매트릭스 접합을 중재하는 인테그린 수용체의 ECM 성분 또는 억제의 제거는 장 장기성의 극성 반전과 상피 측의 노출을배지(22)에초래한다. 이 접근법은 3D의 정압 측에 쉽게 접근할 수 있고 높은 처리량 분석에 가능하게 하기 때문에 전염병에 일하는 연구원의 관심을 끌었습니다. 여기서, 우리는 쉽게 그들의 apical 측을 드러내는 3D 장 기관지성의 생성을 용이하게 하는 Amieva 실험실22에의하여 최근 작동을 기반으로 수정된 프로토콜을 기술합니다. 또한 장 내 오르가노이드에서 파생된 장 2D 단층층을 효율적이고 재현가능하게 생성할 수 있는 프로토콜을 간략하게 설명합니다.
프로토콜
인간 장 가구배 배양의 파생은 다른 곳에서 설명된 바와 같이수행되었다 23. 오르가노이드는 장 오르가노이드 팽창 매체(재료의 표참조)에 대한 제품 정보 시트(PIS)에 의해 기술된 바와 같이 배양에서 유지되었다.
1. 장 내장 극성의 반전
참고: 이 섹션에서는 장 가내장의 극성을 반전시키는 프로토콜을 간략하게 설명합니다. 이 프로토콜은 배양판에서 현탁액에 노출된 정표면을 가진 편광 오르가노이드의 확립을 위한 상세한 절차를 제공한다. 이 프로토콜은 장기가 2 주 이상이 형성에서 유지 될 수 있지만, 종점 분석으로 의도하고 통과 시 apical-in organoids를 다시 설정할 수 있도록 작은 줄기 세포 집단을 유지합니다.
- 부착 방지 용액으로 배양기 및 튜브 코팅
참고: 장 내 장기형의 수를 최대화하고 배양기구에 바람직하지 않은 부착을 방지하기 위해서는 일반적으로 배양기의 사전 코팅이 필요합니다. 아래 설명섹션은 반부착용액을 가진 배양 및 플라스틱 제품의 코팅을 설명합니다.- 다음과 같이 프로토콜의 서스펜션 부분에 사용되는 코트 배양 플레이트.
- 24웰 조직 배양 플레이트의 각 웰에 0.5 mL의 안티 부착 용액을 추가합니다.
- 플레이트를 소용돌이어 용액을 표면과 우물 벽에 고르게 분산시다.
- 10 분 동안 1,300 x g에서 접시를 원심 분리합니다.
- 흡착기 또는 1mL 파이펫을 사용하여 각 우물에서 안티 부착 용액을 제거합니다.
- 15mM HEPES (DMEM / F12)로 DMEM / F-12의 1mL로 우물을 씻으셔.
- DMEM/F-12의 0.5mL로 세척된 각 매를 잘 채우고, 사용전까지 37°C 및 5%CO2로 플레이트를 보관합니다.
참고: 즉시 사용하지 않을 경우 코팅된 플레이트를 인큐베이터에 1주일 이상 보관할 수 있습니다.
- 이 프로토콜에 사용되는 코트 15 mL 원콘튜브는 다음과 같습니다.
- 15mL 원판 튜브에 4mL의 안티 부착 용액을 추가합니다.
- 튜브를 소용돌이하여 용액을 벽 표면에 고르게 분산시다.
- 10 분 동안 1,300 x g에서 튜브를 원심 분리합니다.
- 튜브에서 안티 부착 용액을 제거합니다.
- DMEM/F-12 5mL로 튜브 1x를 세척하고 DMEM/F-12를 흡인시합니다. 이제 튜브를 사용할 준비가 되었습니다.
참고: 즉시 사용하지 않을 경우 DMEM/F12 5ml를 추가하고 4°C에 보관하십시오. 코팅 된 튜브는 적어도 일주일 동안 4 °C에서 보관 할 수 있습니다.
- 다음과 같이 프로토콜의 서스펜션 부분에 사용되는 코트 배양 플레이트.
- 현탁액 문화에 의한 장 가내장의 극성 반전
참고: 아래 단계는 표준 ECM 돔 조건하에서 이전에 배양된 장 가구형의 반전을 간략하게 설명합니다. 여기에 설명 된 절차는 24 웰 플레이트의 한 우물입니다. 다른 배양기구를 사용하는 경우 그에 따라 볼륨을 조정합니다.- 조심스럽게 제거하고 지하 막 세포 외 매트릭스 돔을 방해하지 않고 유기체를 포함하는 각 우물에서 매체를 폐기. 오르가노이드의 크기가 반전 프로토콜을 시작하기 전에 150-250 μm 직경(일반적으로 3-5일)인지 확인합니다.
- 각 웰에 1mL의 얼음 차가운 해리 솔루션을 추가합니다.
- 실온(15-25°C)에서 1분 동안 배양한다.
- 플라스틱 팁을 코팅하는 데 사용할 15mL 튜브에 부착 방지 용액을 최소 2mL이상 추가합니다.
- 15mL 튜브에 DMEM/F-12의 최소 2mL를 추가하여 부착 방지 용액으로 헹굴 플라스틱 팁을 세척하는 데 사용됩니다.
- 1mL 파이펫 팁을 안티 부착 용액으로 코팅하고, 1.2.4 단계에서 안티 부착 용액으로 튜브에 용액 1mL을 세 번 피펫팅합니다.
- 차가운 DMEM/F-12로 팁을 세척하고 1.2.5 단계에서 DMEM/F-12로 튜브에 용액 1mL을 세 번 피펫팅합니다.
- 코팅 된 팁을 사용하여 천천히 파이프를 사용하여 조심스럽게 돔을 빼내줍니다. 오르가노이드를 방해하거나 단편화하지 않도록 주의하십시오.
- 오르가노이드 현탁액을 부착용액으로 처리된 플레이트로 옮김(1.1.1단계부터).
- 30 분 동안 4 °C에서 셰이커에 접시를 놓습니다. 자이로 셰이커는 70 rpm에서 사용할 수 있습니다.
참고: 오간성 파편화를 초래할 수 있으므로 시료를 소용돌이치는 것과 같은 가혹한 흔들림을 피하십시오. 거품과 거품의 형성은 가혹한 흔들림을 나타낼 수 있습니다. - 30분 후 접시를 제거합니다. 안티 부착 용액으로 코팅 된 1 mL 파이펫 팁을 사용하여 용액을 위아래로 부드럽게 피펫합니다.
- 15 분 동안 4 °C에서 셰이커에 접시를 놓습니다. 자이로 셰이커는 70 rpm에서 사용할 수 있습니다.
- 접시를 제거하고 오르가노이드가 중력에 의해 정착하게하십시오 (실온에서 1-2 분). 오르가노이드 침전을 확인하기 위해 현미경의 밑에 접시를 관찰합니다.
참고: 정착된 오르가노이드가 다시 중단될 수 있으므로 플레이트의 광범위한 동요를 피하십시오. - 오르가노이드가 정착한 후, 가능한 한 많은 해리 용액을 제거하고 DMEM/F-12의 1.5mL을 추가하여 세척하십시오.
- 오가노이드가 퇴적물을 허용하고 가능한 한 많은 상체를 제거하십시오. 워시 스텝을 한 번 더 반복합니다.
참고: 어떤 세척 단계를 수행하기 전에 오르가노이드 퇴적물을 확인하기 위해 현미경의 밑에 접시를 관찰. - DMEM/F-12를 최대한 많이 제거하고 장 오르가노이드 확장 매체의 0.5mL을 추가합니다. 37 °C 및 5 % CO2에서인큐베이션.
- 다음 날, 플레이트를 25-30도 각도로 기울이고 우물의 벽을 따라 매체를 제거하여 부분 중간 변화를 수행한다. 중단된 오르가노이드를 제거하지 않도록 주의하는 매체의 0.4 mL을 제거하십시오.
- 0.4 mL 장 오르가노이드 확장 매체를 추가합니다. 3일 동안 37°C 및 5%CO2에서 배양합니다.
참고: 3일 후, 대부분의 오르가노이드는 극성 으로 극성을 가져야 하지만 큰 골재가 형성되었을 수 있습니다. - 응집체가 형성된 경우, 팁의 끝을 플레이트 바닥으로 누르면서 20배 이상 피펫을 피펫으로 배관하여 응고를 전단하는 반부착 용액(1.2.6 및 1.2.7 단계에 설명된 대로)으로 코팅된 팁이 있는 1mL 파이펫을 사용한다.
- 플레이트를 37°C 및 5%CO2로 놓고 다음 날 장 내 오르가노이드 확장 배지(섹션 1.2.17에 설명된 대로)로 전체 중간 변화를 수행한다.
- 2 일 후 (서스펜션에서 5 일), apical out 장 오르가노이드는 다운 스트림 분석에서 사용할 수 있습니다.
2. 장 세포 2D 단층 및 공기 -액체 인터페이스 (ALI) 배양 3D 장 오르가노이드에서 파생 된 배양의 설립
참고: 이 섹션에서는 장 내 유기체에서 2D 단층 배양을 생성하기 위한 프로토콜을 간략하게 설명합니다. 이 기술은 세포 배양막 삽입을 포함하는 조직 배양판에 노출된 정계를 가진 컨물, 편광 단층 배양을 확립하는 이점을 제공한다. 단층은 잠수된 단층 형식으로 차별화되기 시작하지만, 단일 레이어의 추가 분화는 합류에 도달한 후 ALI 문화로 전환하여 달성될 수 있다. 단층 및 후속 ALI 프로토콜은 모두 종점 분석으로 의도되며 단층 배양은 작은 줄기 세포 집단을 유지하지만, 확립 된 후에 효율적으로 분할되고 통과 될 수 없습니다.
- 장 단층 문화를 위한 미디어 및 플레이트 준비
- 단층 배양에 대한 제조업체가 설명한 대로 장 내 오르가노이드 분화 매체를 준비합니다(재료 목록참조). Y-27632를 10 μM의 최종 농도에서 1주일 이내에 사용할 매체의 부피에만 추가합니다. 즉시 사용하지 않을 경우 4 °C에 보관하십시오.
- 사전 웜 트립신 EDTA (0.05%) ~ 37 °C.
- 단층 배양을 종자하기 전에 최소 2시간, 다음과 같이 2% ECM 코팅 용액을 준비한다.
- 얼음에 ECM을 해동하고 2% 용액을 준비하기 위해 차갑고 멸균된 PBS에 1:50을 추가합니다. 사용할 각 6.5mm(0.33cm2)세포 배양막 인서트를 상부 웰에 100 μL을 추가하기에 충분한 양을 준비한다. 볼륨을 더 크거나 작은 배양에 맞게 적절하게 조정합니다.
- 각 우물에 100 μL을 추가하고 필요할 때까지 각 플레이트를 37°C및 5%CO2(시드 하기 전에 최소 2시간)에 배양합니다.
- 단층 생성 및 문화를 위한 장 내장 오르가노이드 해리
- 인큐베이터에서 적절한 수의 오르가노이드 배양 우물을 제거합니다. 다양한 배양기용으로 수확할 수 있는 권장 우물 수의 표 1을 참조하십시오.
- ECM 돔을 방해하지 않고 오르가노이드 배양에서 모든 배지를 흡인.
- 각 웰에 1mL의 해리 솔루션을 추가합니다.
- 실온(15-25°C)에서 최소 1분 동안 배양한다.
- 1mL 파이펫을 사용하여 돔을 방해하고 오르가노이드를 방출하기 위해 위아래로 격렬하게 피펫을 사용합니다.
- 15mL 원물 튜브에 각 우물에서 중단 된 오르가노이드를 풀. 상온에서 10분 동안 부드러운 동요 또는 흔들림으로 배양하십시오. 여러 개의 우물을 파종하기 위한 오르가노이드는 각 튜브에서 최대 10mL 의 부피를 이 단계에서 풀링할 수 있습니다.
- 4 °C에서 5 분 동안 200 x g의 원심 분리기.
- 상체를 제거하고 폐기합니다. 5mL 얼음 차가운 DMEM/F-12를 추가하여 오르가노이드를 다시 일시 중단합니다.
- 4°C에서 5분 동안 200 x g에서 다시 혼합하고 원심분리기를 섞습니다.
- 펠릿을 방해하지 않도록 주의하면서, 가능한 한 많이 제거, 슈퍼 티퍼를 흡인.
참고: 일부 잔류 ECM펠릿에 남아 있을 수 있습니다. 그러나, 이것은 유기인의 해리에 크게 영향을 미치지 않아야합니다. - 1mL의 사전 따뜻하게(37°C) 트립신-EDTA(0.05%)를 추가하여 오르가노이드를 재보펜한다. 균일한 서스펜션을 보장하기 위해 철저하게 섞습니다. 많은 수의 세포에 대해 트립신-EDTA의 추가 1 mL까지 추가하거나 상당한 양의 ECM이 남아 있는 경우.
- 5-10 분 동안 37 °C에서 배양하십시오.
- 1mL 파이펫과 철저히 섞어 오르가노이드를 최대한 방해합니다. 오르가노이드는 단일 세포 또는 작은 조각으로 완전히 해리되어야합니다. 더 큰 파편 또는 전체 오르가노이드가 철저하게 파이펫팅 후에 남아 있는 경우, 트립신-EDTA를 37°C에서 3-5분 동안 배양을 계속한다.
참고: 20분 이상 트립신-EDTA로 배양하지 마십시오. - 오르가노이드가 충분히 해리되면 동일한 양의 DMEM/F-12(예: mL 트립신-EDTA당 1mL DMEM/F-12)를 추가하고 파이펫을 위아래로 사용하여 철저히 섞어줍니다. 이 단계에서 DMEM/F-12에 10% FBS를 추가하여 트립신-EDTA를 비활성화합니다.
- 2-8°C에서 5분 동안 200 x g의 원심분리기 조각.
- 해리된 오르가노이드가 펠릿에 실패하면, 이것은 일반적이며 해리된 세포에 의해 방출되는 점액의 축적 때문일 수 있다. 이 경우, 2-8°C에서 5분 동안 200 x g에서 위아래로 파이프를 배관하여 세포를 철저히 혼합합니다.
- 가능한 한 많은 상체를 조심스럽게 제거하여 셀 펠릿만 남깁니다.
- 각 웰을 시드할 수 있도록 장 내 오르가노이드 분화 배지(10μM Y-27632)의 100μL에서 세포를 재연한다. 볼륨을 작거나 작은 웰 크기에 맞게 적절하게 조정합니다.
- 인큐베이터에서 코팅 된 플레이트를 제거하고 (3.1.4 단계에서 준비) 각 우물에서 초과 ECM을 제거합니다.
- 각 세포 배양 삽입물의 상부 웰에 셀 현탁액의 100 μL을 추가합니다.
- 각 세포 배양 삽입물의 하부 웰에 장 오르가노이드 분화 배지의 500 μL을 추가합니다.
- 37°C 및 5% CO2에서 배양합니다.
- 2~3일마다 상하웰모두에서 배지를 교체한다. 단층 배양은 7일 이내에 합류해야 하며 2-3일 이내에 합류하는 경우가 많습니다.
- 공기-액체 인터페이스(ALI) 문화 설정
참고: 원하는 경우 침수된 장 단층 배양을 ALI 문화권으로 전환하여 수중된 장 단층 배양을 추가로 분화할 수 있습니다. 이러한 배양 방법은 잔 및 장내 분비 세포와 같은 분화 세포 유형, 특히 분비 계보의 세포의 수를 증가시킬 수 있게 한다.- 전술한 바와 같이 세포 배양 삽입에 단층 배양을 확립하여 2.2.1-2.2.23단계로, 적어도 4일 동안 100% 수렴하여 이 배양을 유지한다.
- ALI 배양을 설정하려면 상하 우물에서 배지를 제거합니다. 신선한 장 내 오르가노이드 분화 배지(Y-27632 와 함께)를 하부 우물에 추가하여 상부를 잘 비워 둡니다.
- 37 °C 및 5 % CO2에서인큐베이션.
- 2-3일마다 낮은 음으로 배지를 교체하고 단층층이 적어도 1주일 동안 분화할 수 있도록 합니다.
- 필요한 경우 멸균 PBS로 상부를 잘 헹구어 과도한 점액 축적을 제거합니다.
이러한 조건하에서, ALI 배양은 적어도 2-3주 동안 유지될 수 있다.
결과
오르가노이드는 이전에 설명된 프로토콜에 따라 생검 샘플에서 생성되었다23 및 장 오르가노이드 확장 매체에 대한 PIS에서 (재료의 표참조). 도 1A,좌측 패널,장 관성 오르가노이드 팽창 배지를 가진 돔에서 배양된 장 가구형의 표현형을 나타낸다. 이러한 배양 조건에서, 오르가노이드는 루멘(도1A,오른쪽 패널)을둘러싸는 얇은(10-25 μm) 상피에 의해 정의된 낭포성 형태를 나타낸다. 이 단계에서, 장 상피의 정맥 면은 루멘을 향하고, 바소측은 주변 세포외 매트릭스에 접촉하는 동안. 대부분의 오르가노이드가 원하는 크기에 도달하면 세포외 매트릭스가 제거되고 오르가노이드가 현탁액으로 배양되었습니다. 세포외 매트릭스에 결합하는 세포 결합의 손실은 오르가노이드상 반전 과정을 유발하여 오르가노이드 상피의 극성의 반전을 일으켜 상피의 정파면을 성장 배지에 노출시키고 바소포측을 내면화한다.
일부 배양에서는, 서스펜션 골재 및 퓨즈의 오르가노이드, 처음 3일 동안 더 심오한효과(그림 1B,왼쪽 패널). 전단 기술의 적용은 최소한의 재집계(도 1B,오른쪽 패널)와며칠 동안 오르가노이드의 분리 및 문화 간의 연속을 허용합니다.
ECM 돔에서 배양된 장 내 오르가노이드는 계속팽창(도 1C,왼쪽 패널)을계속 확장하여, 작은 토굴을 닮은 이차 신진 구조물의 자발적인 형성을 나타내며, 루멘을 둘러싼 상피의 바칼랄측(도1C,오른쪽 패널)을둘러싼 상피측에 있다. 동시에, 세포외 매트릭스가 없는 상태에서 5일 동안 유지된 오르가노이드는서스펜션(도 1D,좌판)에서계속 개발되고 있다. 극성의 반전은 오르가노이드의 코어를 둘러싸고 다양한 형태학의 모양을 둘러싸고 있는 상피의 두껍게(30-40 μm)를 특징으로 하며, 다양한 형태의 출현을 특징으로 합니다: 길쭉한(도1D,오른쪽 패널 및 보충도 도 1A),낭포성(보충도 도 1B), 불규칙성(보충도 1B), 불규칙성(보충도 1C). 이것은 종종 오르가노이드 내의 발광 공간의 축소와 결합되어 전반적인 크기에 영향을 미칩니다.
또한 장별 극성 마커의 발현을 분석하여 효율적인 반전을 확인할 수 있다. Apical out 장 가구는 4′,6-diamidino-2-phenylindole (DAPI) 신호에 의해 표시된 바와 같이, 오르가노이드의 루멘을 향해 핵의 뚜렷한 국소화를 보여줍니다. VILLIN(도2A)및 ZO-1(도2B)과같은 정압 마커의 발현은 배지에 노출된 상피의 바깥쪽에서 검출된다. 이러한 국소화는 ECM에서 배양된 장 내 오르가노이드에서 관찰된 것과 극명한 대조를 이룹니다. 핵(DAPI), VILLIN(도2C)및 ZO-1(도2D)을위해 염색된 세포외 매트릭스 임베디드(2D) 편성측이 오르가노이드의 루멘을 마주하고 있는 양피영역극을 입증한다.
장 가구형의 효율적인 극성 반전을 얻기 위해서는 ECM의 완전한 제거가 필요합니다. 때때로, ECM 잔류물로 둘러싸인 현탁액 배양에서 발견되는 오르가노이드의 일부는 상피의 극성 반전실패를 암시하는 낭포성 형태를나타낸다(보충도 2A). 이러한 오르가노이드상 에수행된 면역형염색의 분석은,유기체(보충도 2B)의루멘에 직면한 apical 측에서 ZO-1의 상피 및 발현을 따라 핵(DAPI)의 혈관측 위치의 증거를 제공하여 불완전한 ECM 제거가 아피코바실 극성의 유지를 유발하는것을 확인한다.
장 단층 배양의 수립을 위한 프로토콜은 파종 후 7일 이내에 수렴된 단층 문화를 초래하며, 문화는 종종 2-3일 이내에 합류에 도달할 것이다. 성공의 주요 결정 요인 중 하나는 단층시드에 사용되는 세포의 수와 품질입니다. 도 3A,좌측 패널은 6.5mm 세포 배양막 인서트에서 약 150,000개의 세포의 이상적인 파종 밀도의 예를 제공한다. 이 숫자는 고정되지 않으며 기증자 및 소스 오르가노이드 문화의 품질에 따라 매우 가변적일 수 있습니다. 따라서 셀 번호는 이러한 변수에 따라 최적화되어야 합니다. 파종 밀도가 너무 낮거나 품질이 좋지 않은경우(그림 3A,오른쪽 패널) 컨서적 단층 배양을 형성하기에 충분한 첨부 파일이 없을 수 있습니다.
단층이 확립되면(도 3B),세포는 좁은 접합을 형성하여 조약돌모양(도 3B,왼쪽 패널)을생성합니다. 그들은 컨부유한 단층(도 3B,오른쪽 패널)을형성하지 못하는 경우, 단층의 모양은 종종 좋은 품질의 세포 부착의 영역과 함께, "패치"될 것입니다,하지만 이러한 영역 사이의 큰 간격. 이러한 배양은 기저구와 어포형 구획 사이의 기능적 장벽을 제공하지 않으며 기술된 분석에 적합하지 않습니다. 컨리셔블 한 단층은 VILLIN 함유 브러시 테두리를 상피의 정색 면을 향해 방향을 지정하며, 핵은 세포의 혈관기둥(도 4B)을향해 배치된다. 세포 간에서 ZO-1을 포함한 다중 단백질 복합체로 구성된 세포간 접합이 형성된다(도4B). 그들의 존재는 상피 문화의 장벽 기능을 제공하는 열쇠입니다.
일단 컨서크, ALI 배양으로의 전환은 문화의 추가 분화를 유도한다(도3C). 작고 둥근 잔 세포가 나타나고 단층 자체가 더 접힌 모양을 취합니다. 잔 세포는 침수 배양(도4A)의상피 내에 존재하지만, ALI 분화 에 따라 더 두드러지게 된다. 상피 분비 점액 내에 존재하는 잔 세포는 상피의 상단에 흐릿한 외관으로 이끌어 냅니다. 잔 세포 및 분비점액은 분비된 뮤신 단백질, MUC2(도4A,C 및 D)에대한 염색에 의해 시각화될 수 있으며, 잔성 세포 집단의 증가는 MUC2 발현(보충도 3A)의증가에 의해 측정될 수 있다. 이 젤 과 같은 점액 층을 제거 할 필요가 없으며 상피의 표면에 충실하고 반복 된 세차체를 따라 유지됩니다. 제거가 필요한 경우, 10mM N-아세틸 시스테인 또는 50 μg/mL DTT와 같은 점막성 화합물로 배양을 세척하면 과도한 점액을 제거합니다. 잔 세포 개체수가 증가하는 것 외에도, ALI 인터페이스는 장내분비 세포의 존재를 증가시킨다(CHGA 발현에 의해 표시된 바와 같이)(보충 도 3B)및 성숙한 장신구(KRT20 발현에 의해 표시)(보충 도 3C).
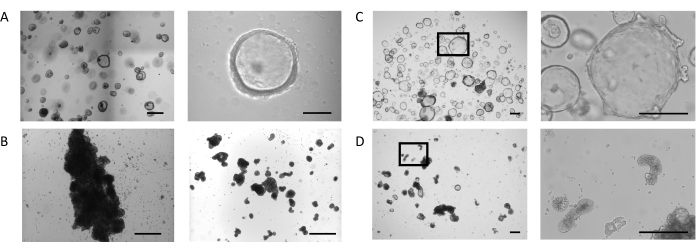
그림 1: 장 내 장기성 생성 단계. (A)4일째에 원하는 크기의 오르가노이드가 있는 돔의 대표적인 이미지(왼쪽 패널, 스케일 바 = 500 μm). 오르가노이드는 얇은 벽으로 되어 있으며, 개방형 조명 구획(오른쪽 패널, 스케일 바 = 100 μm)이 있습니다. (B)서스펜션에서 3 일 후 광범위한 응집과 우물의 대표적인 이미지 (왼쪽 패널, 스케일 바 = 200 μm). 전단 직후의 덩어리 조각 이미지(오른쪽 패널, 스케일 바 = 200 μm). (C)7일째돔에서 장 내장의 대표적인 이미지. 오르가노이드는 상피의 바솔탈측에 작은 싹이 형성된 확장된 루멘을 표시한다(왼쪽 20배배율, 오른쪽 100배배율, 표시된 영역의 오른쪽 100배율, 스케일 바 = 200 μm). (D)ECM 제거 후 장 가구형의 대표적인 이미지 및 후속 현탁액 문화5일. 오르가노이드는 두꺼운 상피와 조밀 한 형태를 얻고 매체에 자신의 정색 측면을 노출. (왼쪽 20배율, 표시된 영역의 오른쪽 100배율, 스케일 바 = 200 μm). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
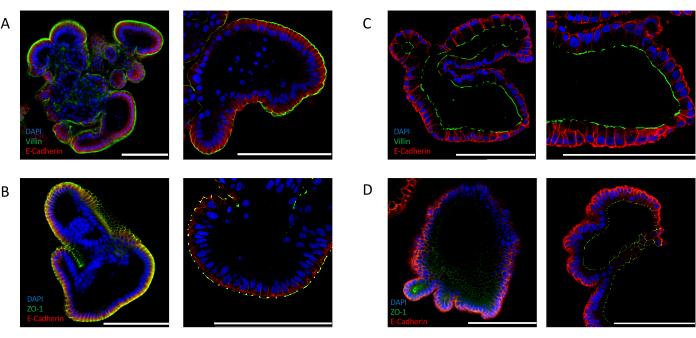
그림 2: 장 내 유기체에서 세포 극성 마커에 대한 면역 형광 염색. 어포칼아웃(A,B)및 어포형(C,D) 지향장 오르가노이드는 ZO-1 및 VILLIN, 상피 마커 E-CADHERIN(빨간색)으로 염색하였다. DAPI(파란색)는 핵을 시각화하는 데 사용되었다. 왼쪽 패널은 25배율로 촬영한 이미지를 표시하고 오른쪽 패널은 63배 배율로 서로 다른 오르가노이드의 이미지를 표시합니다(패널 C만 동일한 오르가노이드의 25배 및 63배 배율 표시). (A)빌린(green) 및 E-CADHERIN(빨간색)으로 염색된 장 내 오르가노이드는 정측측의 노출을 배지에 나타낸다. (B)ZO-1(녹색) 및 E-CADHERIN(빨간색)으로 염색된 아포칼아웃 장 가구형은 팽팽한 접합부의 존재와 양극성의 회귀를 나타낸다. (C)비거노이드 루멘을 향한 액면면을 보여주는 VILLIN(녹색) 및 E-CADHERIN(빨간색)으로 염색된 장 내장 내장. (D)ZO-1(녹색) 및 E-CADHERIN(빨간색)으로 염색된 장 내장 오르가노이드는 오르가노이드의 루멘을 향한 어포형 단단한 접합부의 존재를 나타낸다. (배율 막대 = 100 μm). 오르가노이드는 면역 형광에 의해 염색되었고 이전에 발표 된 프로토콜24,25를사용하여 이미지화되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
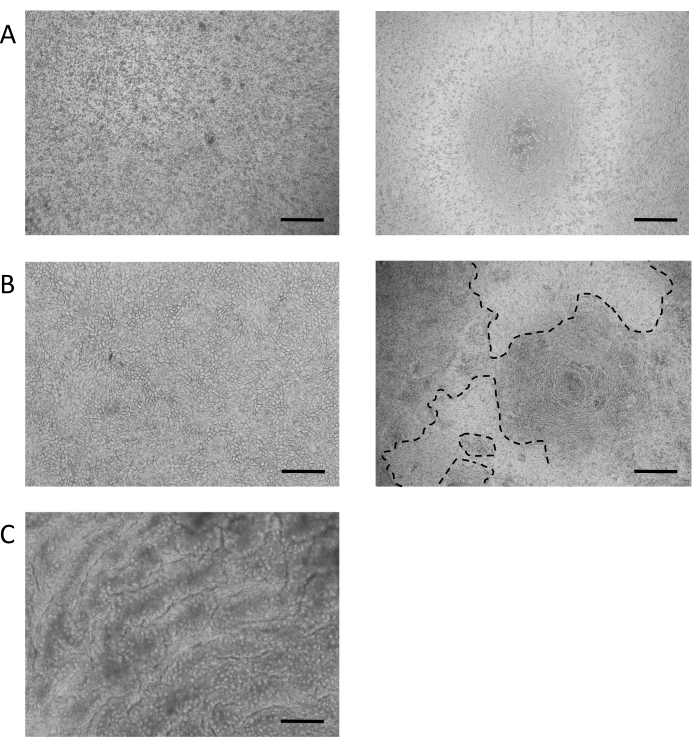
그림 3: 장 단층 배양의 설립. (A)0.05% 트립신-EDTA로 치료 후 3D 오르가노이드의 대표적인 이미지. 오르가노이드는 단층 배양을 종결하기 위해 단일 세포 또는 작은 세포 덩어리에 해리됩니다. 왼쪽 패널: 단층 배양을 위한 최적 파종 밀도의 예, 6.5mm 세포 배양막 인서트에 100 μL 당 약 150,000 개의 세포. 오른쪽 패널: 6.5mm 세포 배양막 인서트에서 100 μL당 <50,000 세포에서 최적이 아닌 파종 밀도의 예. (B)침수 된 단층 문화의 대표적인 브라이트 필드 이미지. 왼쪽 패널: 특징적인 자갈 모양의 100% 컨할수 있는 층. 오른쪽 패널: 약 50% 컨리치 모노레이어. 단층에서 볼 수있는 갭 (대시 선으로 표시) 장 줄기 세포의 지속적인 확산으로 인해 시간이 지남에 닫힙니다. (C)7일 차별화된 ALI 문화의 대표적인 브라이트필드 이미지. (배율 막대 = 200 μm). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
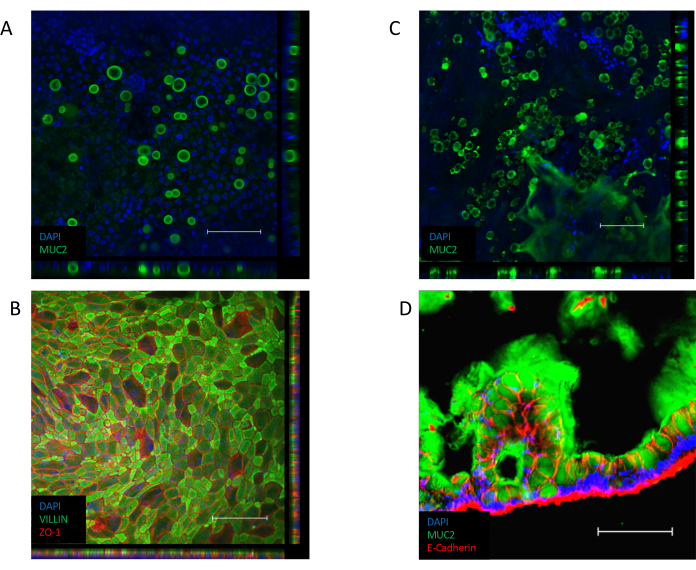
도 4: 단층 배양에서 분화 된 세포 마커에 대한 면역 형광 염색. (A)MUCin 단백질 MUC2에 대한 침수 단층 배양의 면역 형광 염색 의 Z 스택 이미지, 단층 배양 내의 잔류 세포의 존재를 나타낸다(녹색 = MUC2, 블루 = DAPI). (B)침수된 단층의 면역형광 염색의 Z-스택 이미지. 상피의 정점을 따라 VILLIN 염색(녹색)은 브러시 테두리의 존재를 나타내고 ZO-1 염색(빨간색)은 세포(blue = DAPI) 사이의 단단한 접합의 존재를 나타낸다. (C)Mucin 단백질 MUC2에 대한 ALI-분화 단층 배양의 면역형 염색이미지, ALI 단층 배양 내의 상당히 많은 수의 잔세포의 존재를 나타낸다(녹색 = MUC2, 블루 =DAPI). (D)ALI-분화 단층 배양의 극저부부는, MUC2(녹색) 및 E-CADHERIN(red)의 존재를 위해 염색되어 상피에서 잔세포의 존재와 단층 배양의 액피티측을 따라 점액의 분비를 나타낸다. (배율 막대 = 200 μm). 모노레이어 배양은 면역형광에 의해 염색되었고 이전에 발표된프로토콜(26,27)을사용하여 이미지화되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 도 1: 문화 현탁액에 있는 apical out 장 오르가노이드의 표현형의 스펙트럼. (A, B, C) 장 기관성 형태학의 추가 대표적인 이미지는 ECM 제거 후 5일 후에 서스펜션에서 유지되었다. 오르가노이드 극성은 반전되었습니다. 오르가노이드는 두꺼워진 상피로 더 조밀해졌으며 오르가노이드의 정색측면은 바깥쪽으로 향하고 있습니다. 오르가노이드는 다양한 형태를 보일 수 있습니다: 길쭉한(A),낭포성(B),불규칙한(C). (배율 막대 = 100 μm). 이 파일을 다운로드하려면 여기를 클릭하십시오.
보조 도 2: 장 내 유기체는 현탁액 배양에서 잔류 지하 막 매트릭스 배지의 존재속에서 극성을 반전시키지 못한다. (A)비불완전한 ECM 제거 및 오르가노이드의 극성을 반전하지 못하는 대표적인 이미지. Matrigel 잔재는 오르가노이드 주위에 존재하고 상피 극성 지향 apical-in을 유지하는 데 기여한다. 오르가노이드는 루멘을 둘러싼 얇은 상피와 낭포성 형태를 보여줍니다 (스케일 바 = 200 μm). (B)현탁액 배양 조건에서 발견되는 비반전 오르가노이드의 대표적인 이미지. 핵(blue =DAPI) 및 E-CADHERIN(빨간색)은 바소포탈 측에 위치하며, ZO-1(녹색)은 오르가노이드의 루멘을 마주하는 압정 측에 표현된다. (배율 막대 = 100 μm). 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 도 3: 단층 배양에서 분화 된 세포 마커의 유전자 발현. (A, B, C) QPCR을 통해 확립된 장 내 오르가노이드 확장 배지로 자란 3D 오르가노이드 배양에 비해 장 내 오르가노이드 분화 매체에서 생성된 수중 및 ALI 차별화 된 단층 배양에서 MUC2, CHGA및 KRT20의 발현. 침수된 단층 배양의 확립은 각각의 분화된 세포 마커의 발현을 증가시킨다; 그러나, ALI 배양으로서 의 분화는 각 마커의 발현을 기하급수적으로 증가시킨다. 오류 표시줄 = +/- SEM. 여기를 클릭하여 이 파일을 다운로드하십시오.
| 모노레이어 컬처웨어 | 수확할 장 가구의 우물 수(50 μL 돔/잘 씨를 뿌릴 수 있음) |
| 6.5mm 트랜스웰 인서트 | 1 - 2 우물 |
| 12mm 트랜스웰 인서트 | 3 - 4 우물 |
| 6웰 플레이트 | 6 - 8 우물 |
| 24웰 플레이트 | 3 - 4 우물 |
| 96웰 플레이트 | 1 - 2 우물 |
표 1: 다양한 배기제품을 수확하는 장 가구내장 우물 수
토론
상피 오르가노이드 모델은 조직 조직, 질병 진행을 모델링하고 치료 치료23,28,29를식별하는 데 사용할 수있는 강력한 플랫폼이되었다. 오르간구이성 미생물분사술은 숙주 상피의 정량면과의 병원균 상호작용을 허용하기 때문에 감염성 질환을 모델링하는 오르가노이드의 능력에 가치를 더합니다. 최근 미세 주입 기술의 발전은 오르가노이드의 주입 속도를 최적화하고 시간당 최대 90개의 주입 된 오르가노이드의 속도를 달성했습니다. 주입된 오르가노이드의 장벽 기능이 보존되었고, 루멘 내부의 낮은 산소 농도는 의무적 혐기성주입균(30)의생존을 허용했다. 그러나, 연구는 같은 잘 내에서 장기 체이 질 인구의 존재 지적. 이러한 차이는 키 유전자(32)의 크기 및형상(31)및 발현 수준뿐만 아니라 증식율(33)에서 관찰되었다. 산림 및 PGE2 와 같은 화합물에 동일한 오르가노이드 집단 내의 차동 반응, 또는 콜레라 독소에, 또한28,33을기술되었다. 이러한 결과 연구에서 높은 오르가노이드 숫자에 대 한 필요성을 강조 하 고 발광 주사의 활용을 제한.
종래의 오르가노이드 배양은 하이드로겔에서 오르가노이드의 캡슐화 및 전파를 기반으로 한다. 그러나, 하이드로겔은 확산에 한계를 제기하고 농도 그라데이션을 도입할 수 있으며, 이는 이질성을 증가시킬 수있다(34). 더욱이, 높은 가변성은 문화와 기증자 사이뿐만 아니라 개별적인 실험 조건 내에서 문서화되었습니다. 기증원, 하이드로겔의 생화학적 특성 및 배양 시스템으로서 오르가노이드의 본질적인 이질성은 실험적 가변성을 높이고 다운스트림 응용 분야에서 얻은 결과의 재현성을 제한할 수 있는 중요한 요소입니다. 여기에 기재된 두 가지 방법 모두 상피의 정압면을 노출시키는 간단한 수단을 제공하여 배양 배지에 직접 첨가하여 관심 있는 화합물 및 병원균의 모델링을 가능하게 한다. 하이드로겔 사용률이 감소하면 기술적 오류 원인으로부터 의 실험적 변동성을 제한할 수 있습니다.
장 내 장기형은 오르가노이드 모델 시스템의 주요 특성을 유지하고 확장성은 2D 단층과 비교하여 높은 처리량 분석에 더 적합합니다. 그러나, 오르가노이드가 3D 구조를 유지함에 따라, 기저측의 접근성이 제한되고 동시에 양측에 접근해야 하는 연구를 방해할 수 있다.
우리는 장 가구형의 극성 반전이 ECM의 효율적이고 절대적인 제거에 의존한다는 것을 보여주었으며, 또한 오르가노이드의 손상되지 않은 구조를 보존합니다. 특히 하류 애플리케이션을 위해 생산된 아포셜 아웃 오르노이드의 수와 관련하여, 특히 Co, J. Y. 및동료(22)가발행한 프로토콜의 전반적인 효율성을 개량시키는 데 기여한 플라스틱웨어에 대한 오르가노이드 부착을 방지하기 위한 분리 솔루션과 반부착 용액의 사용.
또한, 당사의 프로토콜은 250 μm 보다 작은 오르가노이드의 보다 효율적인 반전을 지원하고 더 큰 오르가노이드를 사용하면 파이펫팅으로 인한 단편화로 인해 오르가노이드 출력이 감소될 수 있음을 관찰했습니다. 재료 의 표에표시된 것과 같은 넓은 보어 팁은 더 큰 오르가노이드의 활용을 허용할 수 있습니다. 그러나, 넓은 보어 팁은 낮은 적용 된 기계적 힘으로 인해 표준 팁에 비해 ECM 해리에 덜 효과적이다. 따라서, 반복 단계 1.2.9-1.2.11은 더 큰 오르가노이드로 작업할 때 충분한 중단 및 모든 ECM 잔재의 완전한 제거를 위해 필요할 수 있다.
서스펜션의 오르가노이드는 적어도 2 주 동안 살아남을 수 있습니다. 이 기간 이후에, 우리는 형태 변경 및 세포 죽음의 증가한 수를 관찰했습니다. 정포 아웃오르가노이드(22)에서 증식 세포의 존재는 장 내 장기성 배양의 재확립을 가능하게 한다. 이는 단일 세포에 정편 아웃 오르가노이드를 분리하고 장 오르가노이드 확장 매체로 ECM에 포함시킴으로써 달성될 수 있다.
현탁액 배양에서 장 오르가노이드의 확립을 설명하는 프로토콜에서 자주 발생하는 제한은 큰 골재의 생성입니다. 이는 형태학적 특징의 효율성, 재현성, 화합물에 대한 투과성 및 파라크린 신호와 같은 여러 변수에 영향을 미칩니다. Co, J. Y. 및 동료가 발표 한 프로토콜과 유사하게 3 일 후에 전단없이 모든 일시 중단 된 오르가노이드의 최소 97 %의 극성 반전을 얻었습니다. 그러나, 출판과는 달리, 우리는 큰 골재의 형성을 줄이고 수율을 높이기 위해 기계적 해리 단계를 도입했다. 이 절차는 오르가노이드의 상피를 손상시킬 수 있기 때문에, 우리는 완전한 상피 회복을 허용하고 다운스트림 응용 프로그램에 대한 고품질의 문화를 보장하기 위해 추가 2 일 동안 오르가노이드 인큐베이션 기간을 연장했습니다. 인큐베이터 셰이커 또는 스피너 플라스크를 사용하여 지속적인 동요가 도입되면 융합 이벤트가 잠재적으로 감소하고 단편화를 최소화하며 산소화를 증가시킬 수 있습니다. 이러한 대체 접근법은 더 긴 기간 동안 배양을 유지하고, 세포 사멸을 감소시키고, 장 가구형의 추가 분화를 허용할 수 있다.
오르가노이드 유래 2D 단층의 설립은 반전된 극성 오르간노이드에 비해 몇 가지 장점과 단점을 제공한다. 여기서 설명된 프로토콜은 일반적으로 7일 이내에 수렴된 단층 배양을 신속하게 확립하고 장기간(최대 10주)에 대한 문화의 장기 유지 옵션을 허용한다. 여기서 사용되는 프로토콜과 매체는 또한 다른 오르가노이드 유래 단층배양(16)에서항상 발견되는 것은 아니라 상당수의 세포의 효율적인 분화를 허용한다. 세포 배양 인서식 막에 단층층을 설치하면 상피의 정모 및 혈관 측모두에 동시에 접근할 수 있어 장벽 무결성 및 상피 운송 연구에 이상적입니다. 이 단순화된 접근은 또한 그(것)들을 감염과 약 처리 연구 결과에 더 순종하게 만듭니다. 더욱이, 이 문화는 기증자에게 유일하게 많은 특성을 유지, 환자 특정 연구에 대한 그들의 관련성을 유지. 또한 ALI 배양 방법은 분비및 흡수세포 유형으로 구성된 보다 기능적인 상피의 분화를 용이하게 하여 인간 장 상피를 보다 대표한다. 이러한 문화의 상대적 안정성은 또한 장기 연구를위한 가능성을 제공, 오랜 기간 동안 유지 될 수 있습니다. 그러나, 이러한 접근법의 한계는 컨플루천 단층층을 확립하는 데 필요한 세포수가 많고, 완전한 결합을 유지하여 정맥과 바소포챔버 사이의 기능적 분리를 가질 필요가 있다. 3D 오르간구배에서 모델링할 수 있는 특징적인 토굴 아키텍처도 단층 문화를 확립할 때 손실됩니다. 그럼에도 불구하고, 문화의 실험 친화적 인 형식과 상피의 정모및 바소포측에 액세스 할 수있는 용이성, 그것은 장 생리학의 연구를위한 강력한 도구입니다.
공개
G. S., W.C. 및 S.S.는 영국 케임브리지 주 STEMCELL Technologies Ltd.의 직원입니다. M. S., F. E., S. L., A. E., R. K..C.
감사의 말
이 연구는 호라이즌 2020 보조금 OrganoVIR 812673 바이러스 연구를위한 프로젝트 오르가노이드에 의해 지원되었다 - 혁신적인 교육 - ITN 프로그램.
자료
| Name | Company | Catalog Number | Comments |
| Anti-Adherence Rinsing Solution | STEMCELL Technologies Inc. | 7010 | For coating cultureware. Referred as anti-adherent solution into the main text. |
| Conical tubes, 15 mL | STEMCELL Technologies Inc. | 38009 | |
| Corning Matrigel Matrix, Growth Factor Reduced (GFR), Phenol Red-Free | Corning | 356231 | Extracellular matrix (ECM) for maintenance and establishment of organoid lines. |
| Costar 6.5 mm or 12 mm Transwell inserts | STEMCELL Technologies Inc. | 38023/38024 | For 2D Monolayer culture. |
| Costar 24 Well Flat-Bottom, Tissue culture-treated plate | STEMCELL Technologies Inc. | 38017 | For maintenance and establishment of organoid lines. |
| D-PBS (Without Ca++ and Mg++) | STEMCELL Technologies Inc. | 37350 | For washing |
| Dimethyl sulfoxide (DMSO) | Millipore Sigma | D2650 | Reconstitution of small molecules |
| DMEM/F-12 with 15 mM HEPES | STEMCELL Technologies Inc. | 36254 | For washing |
| Gentle Cell Dissociation Reagent (GCDR) | STEMCELL Technologies Inc. | 7174 | For Matrigel removal. Referred as dissociation reagent into the main text. |
| IntestiCult Organoid Growth Medium (Human) | STEMCELL Technologies Inc. | 6010 | For expansion of organoid lines prior to differentiation. Referred as Intestinal Organoid Expansion Medium into the main text. |
| IntestiCult Organoid Differentiation Medium (Human) | STEMCELL Technologies Inc. | 100-0214 | For establishment of monolayers and 3D differentiation. Referred as Intestinal Organoid Differentiation Medium into the main text. |
| Trypsin-EDTA (0.05%) | STEMCELL Technologies Inc. | 7910 | For 2D Monolayer establishment. |
| Y-27632 | STEMCELL Technologies Inc. | 72302 | RHO/ROCK pathway inhibitor, Inhibits ROCK1 and ROCK2. Used for 2D monolayer establishment. |
| Wide bore tips | Corning | #TF-1005-WB-R-S | Organoids handling |
참고문헌
- Gehart, H., Clevers, H. Tales from the crypt: new insights into intestinal stem cells. Nature Reviews Gastroenterology and Hepatology. 16 (1), 19-34 (2019).
- Schneeberger, K., Roth, S., Nieuwenhuis, E. E. S., Middendorp, S. Intestinal epithelial cell polarity defects in disease: lessons from microvillus inclusion disease. Disease Models & Mechanisms. 11 (2), (2018).
- Klunder, L. J., Faber, K. N., Dijkstra, G., Van Ijzendoorn, S. C. D. Mechanisms of cell polarity - Controlled epithelial homeostasis and immunity in the intestine. Cold Spring Harbor Perspectives in Biology. 9 (7), 0227888 (2017).
- DiMarco, R. L., Hunt, D. R., Dewi, R. E., Heilshorn, S. C. Improvement of paracellular transport in the Caco-2 drug screening model using protein-engineered substrates. Biomaterials. 129, 152-162 (2017).
- Sun, H., Chow, E. C., Liu, S., Du, Y., Pang, K. S. The Caco-2 cell monolayer: usefulness and limitations. Expert Opinion on Drug Metabolism & Toxicology. 4 (4), 395-411 (2008).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Dutta, D., Heo, I., Clevers, H. Disease modeling in stem cell-derived 3D organoid systems. Trends in Molecular Medicine. 23 (5), 393-410 (2017).
- Zhang, Y. -. G., Wu, S., Xia, Y., Sun, J. Salmonella-infected crypt-derived intestinal organoid culture system for host-bacterial interactions. Physiological Reports. 2 (9), 12147 (2014).
- Nigro, G., Rossi, R., Commere, P. -. H., Jay, P., Sansonetti, P. J. The cytosolic bacterial peptidoglycan sensor Nod2 affords stem cell protection and links microbes to gut epithelial regeneration. Cell Host & Microbe. 15 (6), 792-798 (2014).
- Heo, I., et al. Modelling Cryptosporidium infection in human small intestinal and lung organoids. Nature Microbiology. 3 (7), 814-823 (2018).
- Bartfeld, S., et al. In vitro expansion of human gastric epithelial stem cells and their responses to bacterial infection. Gastroenterology. 148 (1), 126-136 (2015).
- Leslie, J. L., et al. Persistence and toxin production by Clostridium difficile within human intestinal organoids result in disruption of epithelial paracellular barrier function. Infection and Immunity. 83 (1), 138-145 (2015).
- Pleguezuelos-Manzano, C., et al. Mutational signature in colorectal cancer caused by genotoxic pks(+) E. coli. Nature. 580 (7802), 269-273 (2020).
- Fernando, E. H., et al. A simple, cost-effective method for generating murine colonic 3D enteroids and 2D monolayers for studies of primary epithelial cell function. American journal of physiology. Gastrointestinal and Liver Physiology. 313 (5), 467-475 (2017).
- Moon, C., VanDussen, K. L., Miyoshi, H., Stappenbeck, T. S. Development of a primary mouse intestinal epithelial cell monolayer culture system to evaluate factors that modulate IgA transcytosis. Mucosal Immunology. 7 (4), 818-828 (2014).
- Wang, Y., et al. Long-term culture captures injury-repair cycles of colonic stem cells. Cell. 179 (5), 1144-1159 (2019).
- Noel, G., et al. A primary human macrophage-enteroid co-culture model to investigate mucosal gut physiology and host-pathogen interactions. Scientific Reports. 7, 45270 (2017).
- VanDussen, K. L., et al. Development of an enhanced human gastrointestinal epithelial culture system to facilitate patient-based assays. Gut. 64 (6), 911-920 (2015).
- Thorne, C. A., et al. Enteroid monolayers reveal an autonomous WNT and BMP circuit controlling intestinal epithelial growth and organization. Developmental Cell. 44 (5), 624-633 (2018).
- Wang, A. Z., Ojakian, G. K., Nelson, W. J. Steps in the morphogenesis of a polarized epithelium: I. Uncoupling the roles of cell-cell and cell-substratum contact in establishing plasma membrane polarity in multicellular epithelial (MDCK) cysts. Journal of Cell Science. 95 (1), 137-151 (1990).
- Wang, A. Z., Ojakian, G. K., Nelson, W. J. Steps in the morphogenesis of a polarized epithelium: II. Disassembly and assembly of plasma membrane domains during reversal of epithelial cell polarity in multicellular epithelial (MDCK) cysts. Journal of Cell Science. 95 (1), 153-165 (1990).
- Co, J. Y., et al. Controlling epithelial polarity: a human enteroid model for host-pathogen interactions. Cell Reports. 26 (9), 2509-2520 (2019).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Dodt, H. -. U., et al. Ultramicroscopy: three-dimensional visualization of neuronal networks in the whole mouse brain. Nature Methods. 4 (4), 331-336 (2007).
- Fujii, M., et al. Human intestinal organoids maintain self-renewal capacity and cellular diversity in niche-inspired culture condition. Cell Stem Cell. 23 (6), 787-793 (2018).
- Crowley, S. M., et al. Intestinal restriction of Salmonella Typhimurium requires caspase-1 and caspase-11 epithelial intrinsic inflammasomes. PLoS Pathogens. 16 (4), 1008498 (2020).
- Rees, W. D., et al. Enteroids derived from inflammatory bowel disease patients display dysregulated endoplasmic reticulum stress pathways, leading to differential inflammatory responses and dendritic cell maturation. Journal of Crohn's & Colitis. 14 (7), 948-961 (2020).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- Almeqdadi, M., Mana, M. D., Roper, J., Yilmaz, &. #. 2. 1. 4. ;. H. Gut organoids: mini-tissues in culture to study intestinal physiology and disease. American Journal of Physiology. Cell Physiology. 317 (3), 405-419 (2019).
- Williamson, I. A., et al. A high-throughput organoid microinjection platform to study gastrointestinal microbiota and luminal physiology. Cellular and Molecular Gastroenterology and Hepatology. 6 (3), 301-319 (2018).
- Kassis, T., Hernandez-Gordillo, V., Langer, R., Griffith, L. G. OrgaQuant: human intestinal organoid localization and quantification using deep convolutional neural networks. Scientific Reports. 9 (1), 12479 (2019).
- Gracz, A. D., et al. A high-throughput platform for stem cell niche co-cultures and downstream gene expression analysis. Nature Cell Biology. 17 (3), 340-349 (2015).
- Gunasekara, D. B., et al. Development of arrayed colonic organoids for screening of secretagogues associated with enterotoxins. Analytical Chemistry. 90 (3), 1941-1950 (2018).
- Shin, W., et al. Spatiotemporal gradient and instability of Wnt induce heterogeneous growth and differentiation of human intestinal organoids. iScience. 23 (8), 101372 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유