このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
細菌外膜小胞ヘテロジネミティーを分析するサイズ排除クロマトグラフィー
要約
細菌性小胞は病因において重要な役割を果たし、有望なバイオテクノロジーの応用を有する。小胞の不均一性は分析と使用を複雑にします。したがって、小胞の様々なサイズを分離する簡単で再現可能な方法が必要です。ここでは、 アグリガチバクター放体菌によって産生される異種小胞を分離するためのサイズ排除クロマトグラフィーの使用を示す。
要約
グラム陰性細菌の細胞壁は、内(細胞質)と外膜(OM)で構成され、薄いペプチドグリカン層で分離される。成長を通して、外膜は球状の外膜小胞(Omv)を形成するために出血する。これらのOmvは、ホスト細胞への貨物輸送や細菌細胞との通信など、数多くの細胞機能に関与しています。近年、ワクチンや薬剤送達車としての使用など、Omvの治療可能性が探求され始めている。OmvはOMに由来するが、OMVの脂質およびタンパク質貨物は、しばしばOMのそれとは大きく異なることが長い間評価されてきた。最近では、細菌が複数の種類のOmvを放出できるという証拠が発見され、サイズが宿主細胞による取り込みのメカニズムに影響を与える可能性があるという証拠が存在する。しかし、この分野の研究は、異機種サイズのOPVを効率的に分離する際の困難によって制限されている。密度勾配遠心分離(DGC)は、伝統的にこの目的のために使用されてきました。ただし、この手法は時間がかかり、スケールアップが困難です。一方、サイズ排除クロマトグラフィー(SEC)は、面倒ではなく、Omvの治療的使用に必要な将来のスケールアップに適しています。ここでは、150nm未満から350nm以上の直径の範囲の アグリガチバクター放線菌菌によって産生されるOMVを試験ケースとして使用して、異種サイズの小胞の再現性分離を可能にするSECアプローチについて述べている。我々は、動的光散乱(DLS)によって検証された「大」(350nm)のOmvと「小型」(<150 nm)のAMVの分離を実証する。使いやすさ、再現性(ユーザー間を含む)、およびスケールアップの可能性により、異種サイズの小胞を分離するためのDGCベースの技術よりもSECベースの技術をお勧めします。
概要
グラム陰性細菌は、その外膜、いわゆる外膜小胞(Omv)に由来する小胞を増殖を通じて放出する。これらのOmvは、細菌と宿主の間、ならびに細菌細胞間の間の、DNA/RNA、タンパク質、脂質、およびペプチドグリカン1、2を含む多くの重要な生体分子を運ぶことによって、細胞間コミュニケーションにおいて重要な役割を果たす。特に、細菌病原体におけるOmvの役割は、特定の毒性因子および毒素3、4、5、6、7、8、9、10、11におけるそれらの濃縮のために広範囲に研究されている。
OMVは、親菌および増殖段階に応じて、20〜450nmの大きさの範囲であると報告されており、いくつかの種類の細菌が異種サイズのOPV8、12、13、14を放出し、これはそれらのタンパク質組成および宿主細胞エントリーのメカニズムも異なる。H.ピロリは直径20~450nmの範囲のOmvを放出し、より小さいOmvは大きなOmvよりも均質なタンパク質組成を含む。重要なことに、Omvの2つの集団は、異なるメカニズム12を介してホスト細胞によって内在化されることを観察した。また、アグリガチバクター放線菌症は、小さな(<150nm)のOMVの集団と大きな(>350 nm)のOMVの集団を放出し、OMVには大量の分泌タンパク質毒素、ロイコトキシン(LtxA)15を含むことが実証されました。細胞プロセスにおけるOMVヘテロジニティーの役割は明らかに重要であるが、小胞の異なる集団を分離および分析する際の技術的な困難は、これらの研究を制限している。
細菌の病因におけるそれらの重要性に加えて、Omvはワクチンおよび薬物送達車16、17、18、19、20として含む多くのバイオテクノロジー用途で使用するために提案されている。このようなアプローチでの翻訳的な使用には、小胞のクリーンで単分散の調製が必要です。したがって、効果的かつ効率的な分離方法が必要である。
最も一般的には、密度勾配遠心分離(DGC)は、不均一な大きさの小胞集団を、フラネラおよび分泌タンパク質21を含む細胞の破片から分離するために使用される。この方法は、異機種サイズのOMV亜集団12,13,14を分離するアプローチとしても報告されている。ただし、DGC は時間がかかり、非効率的で、ユーザーからユーザーへの変数が非常に大きく、スケールアップには適していません。対照的に、サイズ排除クロマトグラフィー(SEC)は、Omv21、23、24を浄化するためのスケーラブルで効率的で一貫したアプローチを表します。我々は、ゲル濾過媒体で満たされた長い(50cm)重力流SECカラムが、Omvの亜集団を効率的に精製し、分離するのに十分であることを発見した。具体的には、このアプローチを用いて、A.放基性菌小数体を「大」および「小さい」亜集団に分離し、タンパク質およびDNA汚染を除去しました。精製は4時間未満で完了し、OMV亜集団の完全分離および残骸の除去が達成された。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. バッファの準備
- ELISA洗浄バッファーを調製するには、3.94 g トリスベース、8.77 g NaCl、および1 g の牛血清アルブミン (BSA) を 1 L の脱イオン化 (DI) 水に加えます。500 μL ポリソルベート-20を加えます。HCl または NaOH を使用して pH を 7.2 に調整します。
- ブロッキングバッファを準備するには、3.94 g トリスベース、8.77 g NaCl、および10 g BSAを追加します。500 μL ポリソルベート-20~1 LのDI水を加えます。HCl または NaOH を使用して pH を 7.2 に調整します。
- 溶出バッファー (PBS) を調製するには、8.01 g NaCl、2.7 g KCl、1.42 g Na2HPO4、および 0.24 g KH2PO4 から 1 L DI 水を加えます。HCl または NaOH を使用して pH を 7.4 に調整します。
注:このバッファーの10倍の溶液を作り、必要に応じてDI水で希釈することができます。
2. OMV サンプルの調製
- A.アクチノミセテミテミタン細胞を後期指数相(0.7の600 nmでの光学密度)まで増殖させる。ペレット細胞を4°Cで10,000xgで2回遠心分離して10分間ペレット化した。上清を0.45 μmのフィルターでフィルターします。
- 50 kDa分子量カットオフフィルターを使用して、細菌を含まない上清を濃縮します。4°Cで105,000 x gの濃縮液を30分間超遠心分離します。
- PBSと超遠心分離機でペレットを再び再懸濁(105,000 x g 4°Cで30分間)2 mLのPBSでペレットを再懸濁します。
3. S-1000 カラムの梱包
- ゲル濾過用のストックボトルをガラスの攪拌棒と混合し、カラムを満たすために必要な体積をガラスボトルに注ぎ、約50%の過剰(約135mL)を加えます。これらのビーズは、彼らが落ち着くまで座って、余分な液体をデカントしてみましょう。溶出バッファー内のビーズを再懸濁し、最終的な溶液が約 70%(体積)ゲル、30% バッファーになるようにします。真空下で溶液を脱ガスします。
- リングスタンドを使用してガラス柱を垂直に取り付け、溶出バッファで充填して柱の壁を濡らします。列に残っているバッファーの約 1 cm が 1 cm しかないまでバッファーをドレインします。
- 気泡を作成せずに、慎重に柱にピペットビーズを、上部に列を充填します。このプロセス全体を通して余分なバッファを排出し続けます。列の上部に追加のビードを追加する前に、ビーズを完全に落ち着かせないようにしてください。カラムは、カラムの底面から約2cm下の高さまで梱包する必要があります。
4. サンプルのロードと分数の収集
- 真空下で溶出バッファーを脱気します。溶出バッファーの 2 つのカラムボリューム (180 mL) でカラムを洗浄します。
- 残りのバッファが列に完全に入るようにします。バッファーがゲル層の上部に到達したら、AMVを含む2mLサンプル(約100〜200 nmol/Lの脂質濃度)をビーズの表面に慎重にピペットし、カラムの上部にあるビーズを乱さないように注意してください。液体がゲル層の上に残っていない場合、サンプルがゲルに完全に入ることを許可します。
- ゲルカラムの上に溶出バッファーを慎重にゆっくりと追加します。これはサンプル希釈を引き起こすので、ゲルの最上層を乱さないで下さい。
- 柱の下に単一の 50 mL チューブを配置し、列を開きます。溶出液の最初の20 mLを集める。必要に応じて、列の上部に溶出バッファーを追加して、カラムが乾燥しないように注意してください。
- カラムの下に1.5 mLチューブを一連配置します。カラムを開始し、各チューブに一連の1mLサンプルを集めます。サンプルが収集される間、必要に応じて、引き続き列の上部に溶出バッファーを追加します。96分の一部が収集されるまで繰り返します。列を停止します。
注:サンプルは、長期保存のために-20°C、またはより詳細な分析まで短期保存のために4°Cで保存する必要があります。 - 列をクリーニングするには、列を通して 0.1 M NaOH の 1 つの列ボリューム (90 mL) を実行します。2 つの列ボリューム (180 mL) の溶出バッファーを列を通して実行します。
5. サンプル分析
- 各画分の脂質濃度を測定するために、各画分のピペット50 μLを96ウェルプレートの単一ウェルに入れ。各ウェルに、2.5 μLの脂溶性染料を加えます。15 sのインキュベート。励起波長515nm、発光波長640nmのプレートリーダーで蛍光強度を測定します。各サンプル中のすべての脂質の割合を計算するには、すべての発光強度を合計し、個々の強度を合計で割ります。
- 特定のタンパク質の濃度を測定するために、各画分のピペット100 μLをELISA免疫プレートの単一ウェルに入れた。25°Cで3時間インキュベートする。
- サンプルをデスキャンします。ELISA洗浄バッファーを200 μLずつウェルに加え、デカントを加えます。合計5回の打ち上げに対して4回繰り返します。
- 各ウェルに200μLのブロッキングバッファーを加え、25°Cで1時間インキュベートします。 デスキャント。
- 100 μLブロッキングバッファーと一次抗体を含むインキュベートプレート (精製抗体の場合は 1:10,000、未精製抗体の場合は 1:10) を 4 °C で一晩で行う。 デスキャント。
- ELISA洗浄バッファーを200 μLずつウェルに加え、デカントを加えます。合計5回の打ち上げに対して4回繰り返します。
- ELISA洗浄バッファーと二次抗体 (1:30,000) を各ウェルに 100 μL 加えます。25°Cで1時間インキュベートする。
- ELISA洗浄バッファーを200 μLずつウェルに加え、デカントを加えます。合計5回の打ち上げに対して4回繰り返します。
- 3,3',5'-テトラメチルベンジジン(TMB)ワンステップ溶液の100 μLを加え、15〜30分間、または青色が現れるまでインキュベートします。停止液の50 μLでTMB反応を停止します。
- プレートリーダーで、450 nmの波長で各ウェルの吸光度を読み取ります。
- 全タンパク質濃度を測定するには、UV-vis分光光度計を用いて、各画分の波長280nm(A280)で吸光度を記録します。
プロトコルの概略を 図 1に示します。
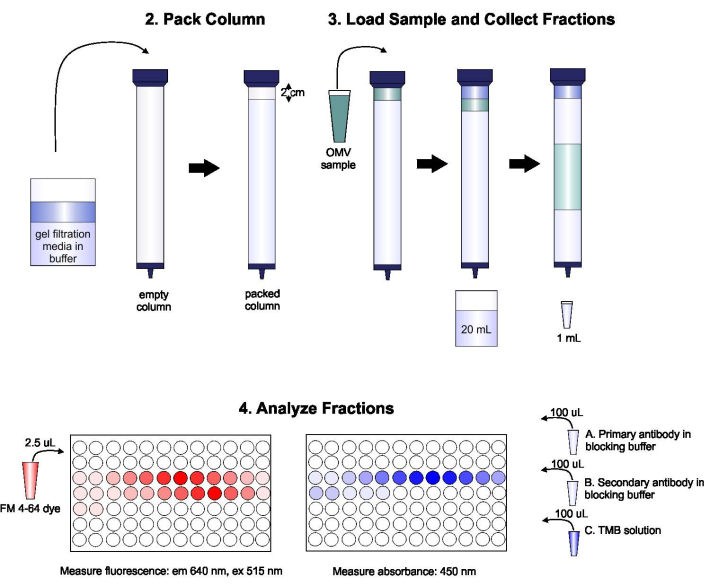
図1: SECの手順の概略図 このカラムには、気泡や不連続性を避けるために、脱気ゲル濾過媒体を慎重に詰め込み、2カラム量の溶出バッファーで洗浄します。次に、サンプルをゲルの上部に慎重にピペット処理し、ゲルパッキングを中断させることなくします。カラムは開いて、サンプルがゲルに完全に入るまで実行されます。この時点で、バッファーはカラムの上部に配置され、溶出液の最初の20 mLが収集されます。次に、一連の1-mL分数が収集される。これらの画分は、脂質およびタンパク質含有量の分析のために96ウェルプレートまたは96ウェル免疫プレートに入れられます。 この図の大きなバージョンを表示するには、ここをクリックしてください。
Access restricted. Please log in or start a trial to view this content.
結果
図2は、この方法の代表的な結果を示しています。 A.放吉菌菌株 JP2によって産生されるOMVは、まず超遠心化15を用いて培養上清から精製した。我々は以前、この株が、直径約300nmの1つと直径約100nm15の2つの集団を生成することを発見した。これらのOMV集団を分離するために、上述のSECプロトコルを用いてサンプルを精製した。各?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
ここでは、細菌OMV亜集団の単純で、速く、再現性のある分離のためのプロトコルを提供しました。この手法は比較的単純ですが、列内で効率的に分離を行うために、非常に慎重に実行する必要がある手順がいくつかあります。まず、気泡を避けるために、ゲルを慎重かつゆっくりとカラムにロードすることが不可欠です。我々は、カラムをロードする前にゲルを室温で数時間放置することで?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は報告する利害の対立はありません。
謝辞
この研究は、国立科学財団(1554417)と国立衛生研究所(DE027769)によって資金提供されました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 1-Step Ultra TMB-ELISA | Thermo Scientific | 34028 | |
| Amicon 50 kDa filters | Millipore Sigma | UFC905024 | |
| Bovine Serum Albumin (BSA) | Fisher Scientific | BP9704-100 | |
| ELISA Immuno Plates | Thermo Scientific | 442404 | |
| FM 4-64 | Thermo Scientific | T13320 | 1.5 x 50 cm |
| Glass Econo-Column | BioRad | 7371552 | |
| Infinite 200 Pro Plate Reader | Tecan | ||
| Potassium Chloride (KCl) | Amresco (VWR) | 0395-500G | |
| Potassium Phosphate Monobasic Anhydrous (KH2PO4) | Amresco (VWR) | 0781-500G | |
| Sephacryl S-1000 Superfine | GE Healthcare | 17-0476-01 | |
| Sodium Chloride (NaCl) | Fisher Chemical | S271-3 | |
| Sodium Phosphate Dibasic Anhydrous (Na2HPO4) | Amresco (VWR) | 0404-500G | |
| Tris Base | VWR | 0497-1KG | |
| Tween(R) 20 | Acros Organics | 23336-2500 |
参考文献
- Kuehn, M. J., Kesty, N. C. Bacterial outer membrane vesicles and the host-pathogen interaction. Genes and Development. 19, 2645-2655 (2005).
- Kulp, A., Kuehn, M. J. Biological functions and biogenesis of secreted bacterial outer membrane vesicles. Annual Reviews Microbiology. 64, 163-184 (2010).
- Kato, S., Kowashi, Y., Demuth, D. R. Outer membrane-like vesicles secreted by Actinobacillus actinomycetemcomitans are enriched in leukotoxin. Microbial Pathogenesis. 32 (1), 1-13 (2002).
- Nice, J. B., et al. Aggregatibacter actinomycetemcomitans leukotoxin is delivered to host cells in an LFA-1-independent manner when associated with outer membrane vesicles. Toxins. 10 (10), 414(2018).
- Haurat, M. F., et al. Selective sorting of cargo proteins into bacterial membrane vesicles. Journal of Biological Chemistry. 286 (2), 1269-1276 (2011).
- Horstman, A. L., Kuehn, M. J. Enterotoxigenic Escherichia coli secretes active heat-labile enterotoxin via outer membrane vesicles. The Journal of Biological Chemistry. 275 (17), 12489-12496 (2000).
- Wai, S. N., et al. Vesicle-mediated export and assembly of pore-forming oligomers of the Enterobacterial ClyA cytotoxin. Cell. 115, 25-35 (2003).
- Balsalobre, C., et al. Release of the Type I secreted α-haemolysin via outer membrane vesicles from Escherichia coli. Molecular Microbiology. 59 (1), 99-112 (2006).
- Donato, G. M., et al. Delivery of Bordetella pertussis adenylate cyclase toxin to target cells via outer membrane vesicles. FEBS Letters. 586, 459-465 (2012).
- Kim, Y. R., et al. Outer membrane vesicles of Vibrio vulnificus deliver cytolysin-hemolysin VvhA into epithelial cells to induce cytotoxicity. Biochemical and Biophysical Research Communications. 399, 607-612 (2010).
- Maldonado, R., Wei, R., Kachlany, S. C., Kazi, M., Balashova, N. V. Cytotoxic effects of Kingella kingae outer membrane vesicles on human cells. Microbial Pathogenesis. 51 (1-2), 22-30 (2011).
- Turner, L., et al. Helicobacter pylori outer membrane vesicle size determines their mechanisms of host cell entry and protein content. Frontiers in Immunology. 9, 1466(2018).
- Zavan, L., Bitto, N. J., Johnston, E. L., Greening, D. W., Kaparakis-Liaskos, M. Helicobacter pylori growth stage determines the size, protein composition, and preferential cargo packaging of outer membrane vesicles. Proteomics. 19 (1-2), 1800209(2019).
- Rompikuntal, P. K., et al. Perinuclear localization of internalized outer membrane vesicles carrying active cytolethal distending toxin from Aggregatibacter actinomycetemcomitans. Infections and Immunity. 80 (1), 31-42 (2012).
- Nice, J. B., et al. Aggregatibacter actinomycetemcomitans leukotoxin is delivered to host cells in an LFA-1-independent manner when associated with outer membrane vesicles. Toxins. 10 (10), 414(2018).
- Stevenson, T. C., et al. Immunization with outer membrane vesicles displaying conserved surface polysaccharide antigen elicits broadly antimicrobial antibodies. Proceedings of the National Academy of Sciences. 115 (14), 3106-3115 (2018).
- Gujrati, V., et al. Bioengineered bacterial outer membrane vesicles as cell-specific drug-delivery vehicles for cancer therapy. ACS Nano. 8 (2), 1525-1537 (2014).
- Huang, W., et al. Development of novel nanoantibiotics using an outer membrane vesicle-based drug efflux mechanism. Journal of Controlled Release. 317, 1-22 (2020).
- Chen, D. J., et al. Delivery of foreign antigens by engineered outer membrane vesicle vaccines. Proceedings of the National Academy of Sciences. 107 (7), 3099-3104 (2010).
- Chen, L., et al. Outer membrane vesicles displaying engineered glycotopes elicit protective antibodies. Proceedings of the National Academy of Sciences. 113 (26), 3609-3618 (2016).
- Singorenko, P. D., et al. Isolation of membrane vesicles from prokaryotes: A technical and biological comparison reveals heterogeneity. Journal of Extracellular Vesicles. 6 (1), 1324731(2017).
- Zeringer, E., Barta, T., Li, M., Vlassov, A. V. Strategies for isolation of exosomes. Cold Spring Harbor Protocols. 2015 (4), 319-323 (2015).
- Benedikter, B. J., et al. Ultrafiltration combined with size exclusion chromatography efficiently isolates extracellular vesicles from cell culture media for compositional and functional studies. Science Reports. 7 (1), 15297(2017).
- Mol, E. A., Goumans, M. J., Doevendans, P. A., Sluijter, J. P. G., Vader, P. Higher functionality of extracellular vesicles isolated using size-exclusion chromatography compared to ultracentrifugation. Nanomedicine. 13 (6), 2061-2065 (2017).
- Lally, E. T., Golub, E. E., Kieba, I. R. Identification and immunological characterization of the domain of Actinobacillus actinomycetemcomitans leukotoxin that determines its specificity for human target cells. Journal of Biological Chemistry. 269 (49), 31289-31295 (1994).
- Chang, E. H., Giaquinto, P., Huang, J., Balashova, N. V., Brown, A. C. Epigallocatechin gallate inhibits leukotoxin release by Aggregatibacter actinomycetemcomitans by promoting association with the bacterial membrane. Molecular Oral Microbiology. 35 (1), 29-39 (2020).
- Klimentová, J., Stulík, J. Methods of isolation and purification of outer membrane vesicles from gram-negative bacteria. Microbiological Research. 170, 1-9 (2015).
- Dauros Singorenko, P., et al. Isolation of membrane vesicles from prokaryotes: a technical and biological comparison reveals heterogeneity. Journal of Extracellular Vesicles. 6 (1), 1324731(2017).
- Monguió-Tortajada, M., Gálvez-Montón, C., Bayes-Genis, A., Roura, S., Borràs, F. E. Extracellular vesicle isolation methods: rising impact of size-exclusion chromatography. Cellular and Molecular Life Sciences. 76 (12), 2369-2382 (2019).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved