Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Исключение размеров Хроматография для анализа гетерогенности везикул наружной мембраны бактерий
В этой статье
Резюме
Бактериальные везикулы играют важную роль в патогенезе и имеют многообещающее биотехнологическое применение. Неоднородность везикул усложняет анализ и использование; поэтому необходим простой, воспроизводимый метод разделения везикул различного размера. Здесь мы демонстрируем использование размерной исключаемой хроматографии для разделения гетерогенных везикул, продуцируемых Aggregatibacter actinomycetemcomitans.
Аннотация
Клеточная стенка грамотрицательных бактерий состоит из внутренней (цитоплазматической) и наружной мембраны (ОМ), разделенных тонким пептидоликанским слоем. На протяжении всего роста внешняя мембрана может блефовать, образуя сферические везикулы наружной мембраны (OMV). Эти OMV участвуют в многочисленных клеточных функциях, включая доставку грузов к клеткам-хозяевам и связь с бактериальными клетками. В последнее время начал изучаться терапевтический потенциал OMV, включая их использование в качестве вакцин и средств доставки лекарств. Хотя OMV получены из OM, уже давно признано, что липидный и белковый груз OMV отличается, часто значительно, от OM. Совсем недавно были обнаружены доказательства того, что бактерии могут высвобождать несколько типов OMV, и существуют доказательства того, что размер может влиять на механизм их поглощения клетками-хозяевами. Однако исследования в этой области ограничены трудностями в эффективном разделении гетерогенно размеров OMV. Для этой цели традиционно используется центрифугирование градиента плотности (DGC); однако этот метод отнимает много времени и его трудно масштабировать. С другой стороны, хроматография с исключением размеров (SEC) менее громоздка и позволяет в будущем расширить масштабы терапевтического использования OMV. Здесь мы описываем подход SEC, который позволяет воспроизводить разделение везикул гетерогенного размера, используя в качестве тестового случая OMV, производимые Aggregatibacter actinomycetemcomitans,которые варьируются в диаметре от менее 150 нм до более 350 нм. Продемонстрирована разделение «больших» (350 нм) OMV и «малых» (<150 нм) OMV, проверенное динамическим рассеянием света (DLS). Мы рекомендуем методы на основе SEC по сравнению с методами на основе DGC для разделения везикул гетерогенного размера из-за простоты использования, воспроизводимости (включая от пользователя к пользователю) и возможности масштабирования.
Введение
Грамотрицательные бактерии высвобождают везикулы, полученные из их наружной мембраны, так называемые везикулы наружной мембраны (OMV), на протяжении всего роста. Эти OMV играют важную роль в межклеточной коммуникации, как между бактериями и хозяином, так и между бактериальными клетками, неся ряд важных биомолекул, включая ДНК / РНК, белки, липиды и пептидогликаны1,2. В частности, роль OMV в бактериальном патогенезе широко изучена в связи с их обогащением определенными факторами вирулентности и токсинами3,4,5,6,7,8,9,10,11.
Сообщалось, что OMV варьируются в размерах от 20 до 450 нм, в зависимости от родительских бактерий и стадии роста, причем несколько типов бактерий высвобождают гетерогенные размеры OMV8,12,13, 14,которые также различаются по своему белковому составу и механизму входа в клетку-хозяина12. H. pylori высвобождал OMV диаметром от 20 до 450 нм, причем меньшие OMV содержали более однородный белковый состав, чем более крупные OMV. Важно отметить, что было обнаружено, что две популяции OMV интернализуются клетками-хозяевами с помощью различных механизмов12. Кроме того, мы продемонстрировали, что Aggregatibacter actinomycetemcomitans высвобождает популяцию малых (<150 нм) OMV вместе с популяцией больших (>350 нм) OMV, причем OMV содержат значительное количество секретируемого белкового токсина, лейкотоксина (LtxA)15. Хотя роль гетерогенности OMV в клеточных процессах явно важна, технические трудности в разделении и анализе различных популяций везикул ограничили эти исследования.
В дополнение к их важности в бактериальном патогенезе, OMV были предложены для использования в ряде биотехнологических применений, в том числе в качестве вакцин и средств доставки лекарств16,17,18,19,20. Для их трансляционного использования в таких подходах требуется чистая и монодисперсная подготовка везикул. Таким образом, необходимы эффективные и действенные методы разделения.
Чаще всего центрифугирование градиента плотности (DGC) используется для отделения разнородных по размеру популяций везикул от клеточного мусора, включая жгутики и секретируемые белки21; метод также был представлен как подход к разделению разнородных размеров СУБПОПУЛЯЦИЙ OMV12,13,14. Однако DGC отнимает много времени, неэффективен и сильно варьируется от пользователя к пользователю22 и, следовательно, не идеален для масштабирования. Напротив, хроматография исключения размеров (SEC) представляет собой масштабируемый, эффективный и последовательный подход к очистке OMV21,23,24. Мы обнаружили, что длинная (50 см) гравитационная колонна SEC, заполненная гелевой фильтрационной средой, достаточна для эффективной очистки и разделения субпопуляций OMV. В частности, мы использовали этот подход для разделения A. actinomycetemcomitans OMV на «большие» и «маленькие» субпопуляции, а также для удаления белкового и ДНК-загрязнения. Очистка была завершена менее чем за 4 ч, и было завершено полное разделение субпопуляций OMV и удаление мусора.
протокол
1. Подготовка буферов
- Чтобы подготовить буфер для промывки ИФА, добавьте 3,94 г Tris-base, 8,77 г NaCl и 1 г бычий сывороточного альбумина (BSA) к 1 л деионизированной (DI) воды. Добавьте 500 мкл полисорбата-20. Отрегулируйте pH до 7,2 с помощью HCl или NaOH.
- Для подготовки блокирующего буфера добавьте 3,94 г Tris-base, 8,77 г NaCl и 10 г BSA. Добавьте 500 мкл полисорбата - 20 - 1 л воды DI. Отрегулируйте pH до 7,2 с помощью HCl или NaOH.
- Для приготовления буфера элюдения (PBS) добавляют 8,01 г NaCl, 2,7 г KCl, 1,42 г Na2HPO4и 0,24 г KH2PO4 до 1 л воды DI. Отрегулируйте pH до 7,4 с помощью HCl или NaOH.
ПРИМЕЧАНИЕ: 10-кратный раствор этого буфера может быть изготовлен и разбавлен водой DI по мере необходимости.
2. Подготовка образца OMV
- Выращивают клетки A. actinomycetemcomitans до поздней экспоненциальной фазы (оптическая плотность при 600 нм 0,7). Гранулируют клетки центрифугированием дважды при 10 000 х г при 4 °C в течение 10 мин. Фильтруйте супернатант через фильтр 0,45 мкм.
- Концентрируйте супернатант без бактерий с помощью фильтров отсечки 50 кДа. Ультрацентрифугируют концентрированный раствор при 105 000 х г при 4 °C в течение 30 мин.
- Повторное суспендирование гранул в PBS и ультрацентрифуге снова (105 000 x g при 4 °C в течение 30 мин.) Повторно суспендируют гранулы в 2 мл PBS.
3. Упаковка колонки С-1000
- Смешайте бутылочку с гелевой фильтрующей средой со стеклянным стержнем перемешивания и вылейте в стеклянную бутылку объем, необходимый для заполнения колонки, плюс примерно 50% избыток (около 135 мл). Дайте этим бусинам постоять, пока они не осядут, а затем оттените лишнюю жидкость. Повторно суспендируют шарики в буфере элюдения, чтобы конечный раствор составлял примерно 70% (по объему) геля, 30% буфера. Дегаз раствор под вакуумом.
- Установите стеклянную колонну вертикально с помощью кольцевой подставки и заполните буфером элюирования, чтобы смочить стенки колонны. Осушайте буфер до тех пор, пока в столбце не останется всего около 1 см буфера.
- Не создавая пузырьков, аккуратно пипетку бусины вставляем в колонну, заполняя колонну доверху. Продолжайте сливать лишний буфер на протяжении всего этого процесса. Не дайте бусинам полностью осесть, прежде чем добавлять дополнительные бусины в верхнюю часть колонны. Колонна должна быть упакована на высоту около 2 см ниже дна колонны резервуара.
4. Загрузка образца и сбор фракций
- Дегазирует буфер элюения в вакууме. Промыть колонну двумя колоннами-объемами (180 мл) буфера элюения.
- Позвольте оставшемуся буферу полностью войти в столбец. Как только буфер достигнет верхней части слоя геля, осторожно выложите на поверхность бусин образец 2 мл, содержащий OMV (при концентрации липидов приблизительно 100 - 200 нмоль/л), тщательно выложите на поверхность бусин, стараясь не потревожить ни одну из бусин в верхней части колонны. Дайте образцу полностью войти в гель, то есть когда над слоем геля не останется жидкости.
- Осторожно и медленно добавьте буфер элюдения поверх гелевого столба. Не нарушайте верхний слой геля, так как это вызовет разбавление образца.
- Поместите одну трубку 50 мл под колонну и откройте колонну. Соберите первые 20 мл элюента. Добавьте дополнительный буфер элюдения в верхнюю часть столбца, осторожно, по мере необходимости, чтобы убедиться, что столб никогда не высыхает.
- Поместите под колонну серию трубок по 1,5 мл. Запустите колонну и соберите серию образцов по 1 мл в каждой пробирке. По мере сбора образцов продолжайте добавлять буфер элюирования в верхнюю часть столбца, если это необходимо. Повторяйте до тех пор, пока не будет собрано 96 фракций. Остановите столбец.
ПРИМЕЧАНИЕ: Образцы следует хранить при -20 °C для длительного хранения или 4 °C для краткосрочного хранения до дальнейшего анализа. - Чтобы очистить столбец, запустите через столбец один объем колонки (90 мл) 0,1 М NaOH. Запустите два тома столбца (180 мл) буфера элюния через столбец.
5. Анализ образцов
- Для измерения концентрации липидов в каждой фракции пипетку 50 мкл каждой фракции в одну скважину из 96-скважинной пластины. К каждой скважине добавляют 2,5 мкл липофильного красителя. Инкубировать в течение 15 с. Измерьте интенсивность флуоресценции на пластинчатом считывателе с длиной волны возбуждения 515 нм и длиной волны излучения 640 нм. Чтобы рассчитать долю всех липидов в каждом образце, суммируйте все интенсивности выбросов и разделите каждую отдельную интенсивность на общую.
- Для измерения концентрации определенного белка пипетку по 100 мкл каждой фракции в один колодец ИФА-иммунопластицы. Инкубировать при 25 °C в течение 3 ч.
- Декант образцов. Добавьте 200 мкл буфера для промывки ИФА в каждую скважину и декант. Повторите четыре раза в общей сложности пять стирок.
- Добавьте 200 мкл блокирующего буфера в каждую скважину и инкубируют в течение 1 ч при 25 °C. Сцеживать.
- Инкубировать пластины с блокирующим буфером 100 мкл плюс первичное антитело (1:10 000 для очищенного антитела; 1:10 для неочищенного антитела) в течение ночи при 4 °C. Сцеживать.
- Добавьте 200 мкл буфера для промывки ИФА в каждую скважину и декант. Повторите четыре раза в общей сложности пять стирок.
- Добавьте 100 мкл буфера промывки ИФА плюс вторичные антитела (1:30 000) к каждой скважине. Инкубировать в течение 1 ч при 25 °C.
- Добавьте 200 мкл буфера для промывки ИФА в каждую скважину и декант. Повторите четыре раза в общей сложности пять стирок.
- Добавьте 100 мкл одноэтапного раствора 3,3',5,5'-тетраметилбензидина (TMB) и инкубировать в течение 15-30 мин или до развития синего цвета. Остановить реакцию TMB 50 мкл остановочного раствора.
- На пластинчатом считывателе считывают поглощение каждой скважины на длине волны 450 нм.
- Чтобы измерить общую концентрацию белка, запишите поглощение на длине волны 280 нм (A280)каждой фракции, используя спектрофотометр UV-vis.
Схема протокола показана на рисунке 1.
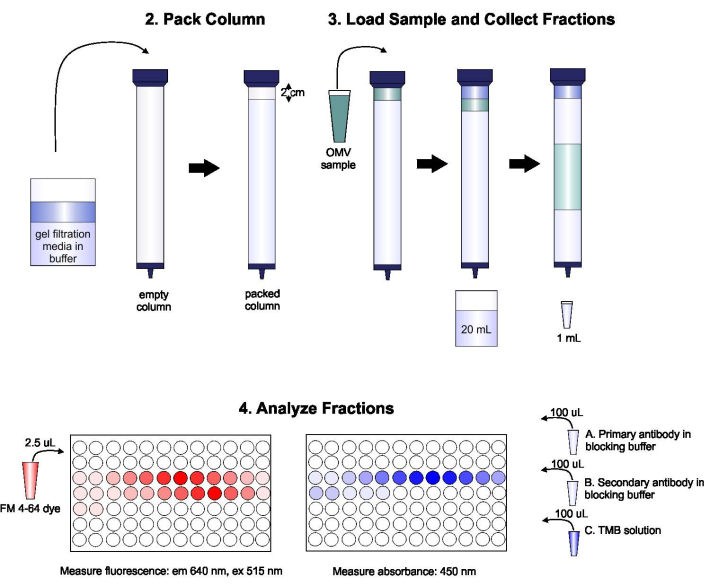
Рисунок 1:Схема процедуры SEC. Колонна тщательно упаковывается дегазированной гелевой фильтрующей средой, чтобы избежать пузырьков и разрывов, затем промывается двумя колонными объемами буфера элюации. Затем образец тщательно пипетируется на верхнюю часть геля, не нарушая упаковку геля. Колонка открывается и запускается до тех пор, пока образец полностью не войдет в гель. В этот момент буфер помещается на верхнюю часть колонны, и собираются первые 20 мл элюата. Далее собирается серия фракций по 1 мл. Затем эти фракции помещают в 96-скважинную пластину или 96-скважинную иммунопластинку для анализа содержания липидов и белков. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
На рисунке 2 показаны репрезентативные результаты этого метода. OMV, полученные штаммом A. actinomycetemcomitans JP2, были впервые очищены от супернатанта культуры с использованием ультрацентрифугирования15. Ранее мы обнаружили, что этот штамм производит две популя?...
Обсуждение
Здесь мы предоставили протокол для простого, быстрого и воспроизводимого разделения бактериальных субпопуляций OMV. Хотя техника относительно проста, есть некоторые шаги, которые должны быть выполнены чрезвычайно осторожно, чтобы гарантировать, что эффективное разделение происходит ?...
Раскрытие информации
Авторы не имеют конфликта интересов, о которых можно было бы сообщить.
Благодарности
Эта работа финансировалась Национальным научным фондом (1554417) и Национальными институтами здравоохранения (DE027769).
Материалы
| Name | Company | Catalog Number | Comments |
| 1-Step Ultra TMB-ELISA | Thermo Scientific | 34028 | |
| Amicon 50 kDa filters | Millipore Sigma | UFC905024 | |
| Bovine Serum Albumin (BSA) | Fisher Scientific | BP9704-100 | |
| ELISA Immuno Plates | Thermo Scientific | 442404 | |
| FM 4-64 | Thermo Scientific | T13320 | 1.5 x 50 cm |
| Glass Econo-Column | BioRad | 7371552 | |
| Infinite 200 Pro Plate Reader | Tecan | ||
| Potassium Chloride (KCl) | Amresco (VWR) | 0395-500G | |
| Potassium Phosphate Monobasic Anhydrous (KH2PO4) | Amresco (VWR) | 0781-500G | |
| Sephacryl S-1000 Superfine | GE Healthcare | 17-0476-01 | |
| Sodium Chloride (NaCl) | Fisher Chemical | S271-3 | |
| Sodium Phosphate Dibasic Anhydrous (Na2HPO4) | Amresco (VWR) | 0404-500G | |
| Tris Base | VWR | 0497-1KG | |
| Tween(R) 20 | Acros Organics | 23336-2500 |
Ссылки
- Kuehn, M. J., Kesty, N. C. Bacterial outer membrane vesicles and the host-pathogen interaction. Genes and Development. 19, 2645-2655 (2005).
- Kulp, A., Kuehn, M. J. Biological functions and biogenesis of secreted bacterial outer membrane vesicles. Annual Reviews Microbiology. 64, 163-184 (2010).
- Kato, S., Kowashi, Y., Demuth, D. R. Outer membrane-like vesicles secreted by Actinobacillus actinomycetemcomitans are enriched in leukotoxin. Microbial Pathogenesis. 32 (1), 1-13 (2002).
- Nice, J. B., et al. Aggregatibacter actinomycetemcomitans leukotoxin is delivered to host cells in an LFA-1-independent manner when associated with outer membrane vesicles. Toxins. 10 (10), 414 (2018).
- Haurat, M. F., et al. Selective sorting of cargo proteins into bacterial membrane vesicles. Journal of Biological Chemistry. 286 (2), 1269-1276 (2011).
- Horstman, A. L., Kuehn, M. J. Enterotoxigenic Escherichia coli secretes active heat-labile enterotoxin via outer membrane vesicles. The Journal of Biological Chemistry. 275 (17), 12489-12496 (2000).
- Wai, S. N., et al. Vesicle-mediated export and assembly of pore-forming oligomers of the Enterobacterial ClyA cytotoxin. Cell. 115, 25-35 (2003).
- Balsalobre, C., et al. Release of the Type I secreted α-haemolysin via outer membrane vesicles from Escherichia coli. Molecular Microbiology. 59 (1), 99-112 (2006).
- Donato, G. M., et al. Delivery of Bordetella pertussis adenylate cyclase toxin to target cells via outer membrane vesicles. FEBS Letters. 586, 459-465 (2012).
- Kim, Y. R., et al. Outer membrane vesicles of Vibrio vulnificus deliver cytolysin-hemolysin VvhA into epithelial cells to induce cytotoxicity. Biochemical and Biophysical Research Communications. 399, 607-612 (2010).
- Maldonado, R., Wei, R., Kachlany, S. C., Kazi, M., Balashova, N. V. Cytotoxic effects of Kingella kingae outer membrane vesicles on human cells. Microbial Pathogenesis. 51 (1-2), 22-30 (2011).
- Turner, L., et al. Helicobacter pylori outer membrane vesicle size determines their mechanisms of host cell entry and protein content. Frontiers in Immunology. 9, 1466 (2018).
- Zavan, L., Bitto, N. J., Johnston, E. L., Greening, D. W., Kaparakis-Liaskos, M. Helicobacter pylori growth stage determines the size, protein composition, and preferential cargo packaging of outer membrane vesicles. Proteomics. 19 (1-2), 1800209 (2019).
- Rompikuntal, P. K., et al. Perinuclear localization of internalized outer membrane vesicles carrying active cytolethal distending toxin from Aggregatibacter actinomycetemcomitans. Infections and Immunity. 80 (1), 31-42 (2012).
- Nice, J. B., et al. Aggregatibacter actinomycetemcomitans leukotoxin is delivered to host cells in an LFA-1-independent manner when associated with outer membrane vesicles. Toxins. 10 (10), 414 (2018).
- Stevenson, T. C., et al. Immunization with outer membrane vesicles displaying conserved surface polysaccharide antigen elicits broadly antimicrobial antibodies. Proceedings of the National Academy of Sciences. 115 (14), 3106-3115 (2018).
- Gujrati, V., et al. Bioengineered bacterial outer membrane vesicles as cell-specific drug-delivery vehicles for cancer therapy. ACS Nano. 8 (2), 1525-1537 (2014).
- Huang, W., et al. Development of novel nanoantibiotics using an outer membrane vesicle-based drug efflux mechanism. Journal of Controlled Release. 317, 1-22 (2020).
- Chen, D. J., et al. Delivery of foreign antigens by engineered outer membrane vesicle vaccines. Proceedings of the National Academy of Sciences. 107 (7), 3099-3104 (2010).
- Chen, L., et al. Outer membrane vesicles displaying engineered glycotopes elicit protective antibodies. Proceedings of the National Academy of Sciences. 113 (26), 3609-3618 (2016).
- Singorenko, P. D., et al. Isolation of membrane vesicles from prokaryotes: A technical and biological comparison reveals heterogeneity. Journal of Extracellular Vesicles. 6 (1), 1324731 (2017).
- Zeringer, E., Barta, T., Li, M., Vlassov, A. V. Strategies for isolation of exosomes. Cold Spring Harbor Protocols. 2015 (4), 319-323 (2015).
- Benedikter, B. J., et al. Ultrafiltration combined with size exclusion chromatography efficiently isolates extracellular vesicles from cell culture media for compositional and functional studies. Science Reports. 7 (1), 15297 (2017).
- Mol, E. A., Goumans, M. J., Doevendans, P. A., Sluijter, J. P. G., Vader, P. Higher functionality of extracellular vesicles isolated using size-exclusion chromatography compared to ultracentrifugation. Nanomedicine. 13 (6), 2061-2065 (2017).
- Lally, E. T., Golub, E. E., Kieba, I. R. Identification and immunological characterization of the domain of Actinobacillus actinomycetemcomitans leukotoxin that determines its specificity for human target cells. Journal of Biological Chemistry. 269 (49), 31289-31295 (1994).
- Chang, E. H., Giaquinto, P., Huang, J., Balashova, N. V., Brown, A. C. Epigallocatechin gallate inhibits leukotoxin release by Aggregatibacter actinomycetemcomitans by promoting association with the bacterial membrane. Molecular Oral Microbiology. 35 (1), 29-39 (2020).
- Klimentová, J., Stulík, J. Methods of isolation and purification of outer membrane vesicles from gram-negative bacteria. Microbiological Research. 170, 1-9 (2015).
- Dauros Singorenko, P., et al. Isolation of membrane vesicles from prokaryotes: a technical and biological comparison reveals heterogeneity. Journal of Extracellular Vesicles. 6 (1), 1324731 (2017).
- Monguió-Tortajada, M., Gálvez-Montón, C., Bayes-Genis, A., Roura, S., Borràs, F. E. Extracellular vesicle isolation methods: rising impact of size-exclusion chromatography. Cellular and Molecular Life Sciences. 76 (12), 2369-2382 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены