Method Article
遺伝子組み換えアノフェリン蚊の小さいケージ実験室の試験
要約
ここで報告されたプロトコルは、実験室に含まれる小さなケージ試験でベクター制御に向かう遺伝子組み換え蚊の性能を評価する3つの代替方法を示しています。各プロトコルは、蚊株クマ(遺伝子駆動または非遺伝子ドライブ)および測定されたパラメータの種類の特定の改変に合わせて調整されます。
要約
遺伝子組み換えベクターを用いた蚊媒介病原体の制御は、従来の制御戦略を補完する有望なツールとして提案されている。CRISPRベースのホーミング遺伝子駆動システムは、トランスジェニック技術を科学界内でよりアクセスしやすくしました。トランスジェニック蚊の性能の評価と小さな実験室ケージ試験における野生型の比較は、その後のフィールドケージ実験の設計と、疾病予防戦略の改善のための実験評価のための貴重なデータを提供します。ここでは、マラリアのアノフェリン蚊ベクターにおけるトランスジーン拡散を評価するために、実験室の設定で使用される3つの異なるプロトコルを提示する。これには、不浸透性放出(遺伝子駆動システムなし)、遺伝子駆動重複および非重複生成試験が含まれます。3つの試験は、いくつかのパラメータで異なり、所望の実験設定に適応することができる。さらに、小さなケージの昆虫研究は、実験室から開場離れへの操作された昆虫の進行的な移行の一部です。したがって、ここで説明するプロトコルは、最終的にマラリア撲滅のための新しい技術の分野実装を支援する経験的価値を提供するための貴重なツールを表しています。
概要
遺伝子組み換え蚊に基づく戦略は、マラリアを引き起こすようなベクター媒介病原体の伝染を制御するために追求されている。これには、 アノフェレス 蚊の数と密度を減少させることを目的とした技術1)(集団抑制)、または2)ヒト疾患(集団改変、置換、または改変)を担う寄生虫を媒介するベクターの能力を損なうことを目的とした技術が含まれる。これらの遺伝的アプローチは、CRISPR/Cas9ベースの遺伝子ドライブの出現によって強化されており、寄生虫透過蚊の概念実証はペイロード形質の効果的な広がりと、ケージ集団における抗寄生エフェクター分子である。
小さい実験室のケージ試験は、フィールドアプリケーションに向けた彼らのさらなる発展への段階的なアプローチの一部としてトランスジェニック株の特性を評価するための第一歩を表す2。具体的な結果の考慮事項には、競合環境で導入されたDNAの遺伝性、表現型の浸透性と表現力、安定性などがあります。関連する実験設計機能には、ケージの大きさ、蚊密度、複製の数、重複または重複しない世代、年齢構造の標的集団、工学的株の単一または複数の放出、男性のみ、女性専用または男女混合放出、放出比、血液供給源(人工または生きた動物)、スクリーニング手順が含まれる。
ここでは、アノフェリン蚊の菌株を評価するために使用されるプロトコル(遺伝子駆動システムなし)と、Cas9エンドヌクレアーゼとガイドRNA(gRNA)によって媒介される自律的な遺伝子駆動システムを運ぶプロトコルについて説明します。これらのプロトコルのアプリケーションは、Phamらに現 れます。 (2019)2、カルバラル・レハラス ら (2020)3、およびアドルフィ ら。 (2020)4.
膨大な放出試験は、多数のトランスジェニック蚊を野生集団に複数放出した後、メンデリア遺伝の下で設計されたトランスジーンの拡散率を評価する。ドライブシステムへのトランスジーンの付着がなければ、不安定なリリース試験からのデータは、安定化集団における関心のあるトランスジーンの適合性と動的性に関する情報を提供する。
蚊集団に自律的な遺伝子駆動システムが含まれている場合、小さなケージ試験は、トランスジェニックな男性の単一の導入に続く支配的なマーカー増加率を決定することによって、所望のトランスジーンの広がりのダイナミクスを評価するように設計されています。自律型遺伝子駆動要素は、Cas9ヌクレアーゼ、gRNAおよび支配的マーカーをコードする遺伝子を、その後の世代で活性であるようにリンクするように結合する遺伝子を運ぶ。
「重複」世代は、同じケージ内に複数の世代が同時に存在して年齢構造の連続集団を作成することを指し、「重複しない」は連続したケージ集団の単一の離散世代を指す2。遺伝子駆動ケージ実験は、ドライブの初期ダイナミクス(変換)速度を決定すると終了することができ(構成体に応じて8〜10世代)、蚊集団内のトランスジーンの短期的な安定性に関する情報を提供する一方で、支配的なマーカー周波数が完全な導入に達するか、または完全な導入に近い場合に何が起こるかを明らかにしない可能性があります(すべての蚊は遺伝子駆動システムの少なくとも1つのコピーを運ぶ)。
プロトコル
動物倫理に関する声明
この研究は、国立衛生研究所の実験動物のケアと使用ガイドの推奨事項に厳密に従って行われました。プロトコルは、カリフォルニア大学の施設動物のケアと使用委員会によって承認されました (動物福祉保証番号 A3416.01).
1. 非遺伝子駆動蚊に対する不含放出試験(図1)
- ケージのセットアップとメンテナンス
- 3週間連続して各ケージに60秒インスター野生型(WT)幼虫を加えることで、3組のトリクリケート0.216 m3ケージを設置します。
注:軽い顕微鏡で第2のインスターの幼虫の性別を決定することはできないので、各ケージに加えられるサンプルは男性と女性の両方で構成されます。 - 毎週、各ケージ内の成体雌を、血中ミール源として麻酔マウス(図2A)と、血液ミールの3日後に排卵容器を与える。
注:代替人工授乳装置を使用することができますが、血液食事のための生きた麻酔マウスを提供すると、これらの大きな(0.216 m3)ケージ形式での蚊の餌付け性能が向上します。これには、承認された動物使用プロトコルと関連する(例えば、制度的動物ケアと使用委員会、IACUC)マウスを使用するための承認が必要です。
注:個々のマウスは、4 mg/マウスケタミンHClと0.4 mg/マウスキシラジンの混合物で麻酔されます。動物は、この混合物の0.1〜0.5mLの間で注入される。 - 毎週各ケージから卵を孵化させ、死亡率を相殺するためにそれぞれのケージに戻す60秒インスター(L2)幼虫を無作為に選択します(週4〜8)。
注意: 「初期相」と呼ばれるケージ内の安定した分散型の年齢構造の集団を確立するには、手順 1.1.1 ~ 1.1.3 が必要です。 - 第9週では、ステップ1.1.1でランダムに組み立てられたケージを、望ましい男性の放出比のリリースのために三度ずつ割り当てます。
- 実験全体の一貫性を評価するためのコントロールとして、ケージの三重化のセットを 1 つ指定します。
- 各所望の放出比(例えば、1:1または1:0.1トランスジェニック:WTの男性)に対して、トリクリケートのセットを1セット指定します。
注: この点は「実験段階」と呼ばれます。
- 3週間連続して各ケージに60秒インスター野生型(WT)幼虫を加えることで、3組のトリクリケート0.216 m3ケージを設置します。
- 複製とリリースの比率
- 毎週60匹のWT子犬(男性30匹と女性30匹)をコントロールケージに加えます。
- 1:1の比率を維持するには、毎週30匹のトランスジェニックオスの子犬と60(30人の男性と30匹の女性)WT pupaeをそれぞれのケージに加えます。
- 1:0.1の比率を維持するには、毎週300匹のトランスジェニックオスの子犬と60(30人の男性と30匹の女性)WTの子犬をそれぞれのケージに加えます。
注:ケージに野生の蚊を継続的に加えるとケージ密度が維持され、加齢に伴う成人の死亡率のために毎週減少すると予想されます。
- 型のスクリーニング
- 各ケージから合計300の幼虫をランダムに選択します。蛍光フィルターを備えたステレオ顕微鏡を用いて、幼虫およびプパル段階で蛍光性マーカーの発現をスクリーニングし、得られた成人の性別をスコア付けする(図3)。
注:表現型スクリーニングは、蚊に統合されたトランスジーン構築物に含まれる支配的なマーカー(例えば、 赤 い蛍光タンパク質[DsRed]、シアン蛍光タンパク質[CFP]、緑色蛍光タンパク質[GFP])、およびその発現を駆動するプロモーター(蚊トランスジェネシスで最も使用される3xP3プロモーター駆動発現である) - 実験計画で定義された結果パラメータで必要な数の世代のためにこのプロトコルに従ってください。
注:試験は、すべての蚊が少なくとも1つのトランスジーンのコピーを持っている場合(支配的な蛍光マーカーの存在によって決定される)、またはケージ内のトランスジェニック対WT蚊の比率が安定し、数(3〜5)世代後に大きく変動しない場合に終了する。
- 各ケージから合計300の幼虫をランダムに選択します。蛍光フィルターを備えたステレオ顕微鏡を用いて、幼虫およびプパル段階で蛍光性マーカーの発現をスクリーニングし、得られた成人の性別をスコア付けする(図3)。
2. 遺伝子駆動蚊の重なり発生試験(図4)
注:遺伝子駆動システムを運ぶ蚊は、書面とレビューされたプロトコルを必要とし、必要に応じて機関バイオセーフティ委員会(IBC)または同等の、および他の人によって承認されるべきです。蚊の封じ込め(ACL 2+レベル)は推奨される手順5,6,7に従うべきである。具体的には、遺伝子駆動実験は、2つの厳格な閉じ込め戦略を採用する必要があります。1つ目は、生物と環境の間の物理的な障壁(バリア戦略)です。これには、蚊が逃げられないことを保証するための安全な昆虫と標準的な操作手順(監視を含む)が必要です。第2の閉じ込め戦略は、分子、生態学的または生殖5であり得る。
- ケージのセットアップ
- 各所望のトランスジェニック:WT男性の放出比のためのトリクリケート0.216 m3 ケージの2つのセットを設定します。
- 1:1の男性の放出比を達成するために、各複製ケージに、各複製ケージに、120人のトランスジェニック男性、120人のWT雄、120人のWTメスを各複製ケージに加える。
- 1:10の放出比を達成するために、各複製ケージに、各複製ケージに、12のトランスジェニック男性、120 WTオスおよび120 WTメスを各複製ケージに加える。
注:異なる放出比(1:1、1:3、1:10など)をテストすることができ、実験を開始するために使用される蚊の数は、それに応じて異なります。ただし、データの統計的評価に対する低い数値の影響を考慮することが重要です。
- 各所望のトランスジェニック:WT男性の放出比のためのトリクリケート0.216 m3 ケージの2つのセットを設定します。
- 人口維持・スクリーニング
- 各ケージに4~7日の雌を麻酔マウスを用いて血液食を与える(図2A)。
- 血液の食事の3日後、各ケージに排卵容器を挿入する。
- 幼虫の皿の中の孵卵は、各ケージからランダムに〜240最初のインスター(L1)幼虫を選択し、成人期に飼育し、それぞれのケージに戻します。
- ステップ2.2.1で説明したように、新たに出現した成人に対して3〜4日ごとに追加の(2-3)血液食事を提供する。
注: 以降の世代では、追加のトランスジェニック男性は追加されません。 - 各ケージから合計300匹の幼虫を無作為に選択し、蛍光ステレオ顕微鏡を使用して幼虫およびプパル段階での支配的なマーカー表現型の存在をスクリーニングし、セックスのために新興成人をスコア付けする(図3)。
注:前と同様に、表現型スクリーニングは遺伝子駆動システムに含まれ、トランスジェニック蚊(例えば、DsRed、CFPまたはGFP)に統合された支配的なマーカーおよびプロモーターに依存する。標的遺伝子のホモ接合または異形性破壊が目に見える表現型(例えば、眼色素沈着に関連する遺伝子)をもたらす場合、この形質のスクリーニングは、変化した表現型を視覚化するのが最も簡単なステージに依存する。 - 実験計画で定義された結果パラメータで必要な数の世代のためにこのプロトコルに従ってください。
注:各世代(血液分で区切られる)は、約3週間かかります。この試験は、通常、すべての蚊が遺伝子駆動構造のホモ接合とみなされた場合、または集団が遺伝子駆動構造の少なくとも1つのコピーを運ぶ蚊の最大割合で安定した場合に終了する。
3. 遺伝子駆動蚊の非重ね合わせ発生試験(図5)。
- ケージのセットアップ
- 調査対象のWT雄に対するトランスジェニックの放出比率ごとに0.005 m3 ケージ集団を三重化設定します(例えば、3組の三重ケージのセットがそれぞれ1:1、1:3、1:10リリース比で設定されています)。男性と女性の同じ合計数ですべてのケージを設定します。
注: 補足ファイル は、0.005 m3 コロニーケージの建設を示すビデオです。- トランスジェニック男性50名、WT雄50人、100人の女性を3つの複製ケージに加え、1:1の男性離度比を達成します。
- トランスジェニック男性25名、WT雄75人、100人の女性を3つの複製ケージに加え、1:3の男性離離度比を達成します。
- トランスジェニックオス9名、WTオス90人、100人の女性を3つの複製ケージに加え、1:10の男性離度比を達成します。
注:異なる放出比をテストすることができ、実験を開始するために使用される蚊の数は、それに応じて異なる場合があります。しかし、蚊の数が少ないことが統計分析に及ぼす影響を考慮することが重要です。これらは単一のリリースです。その後の世代では、追加のトランスジェニック男性は添加されません。
- 調査対象のWT雄に対するトランスジェニックの放出比率ごとに0.005 m3 ケージ集団を三重化設定します(例えば、3組の三重ケージのセットがそれぞれ1:1、1:3、1:10リリース比で設定されています)。男性と女性の同じ合計数ですべてのケージを設定します。
- 人口維持・スクリーニング
- 人工給餌装置(図2B)を使用して、各ケージ内の4〜7日の女性に血液ミールを2日連続で提供する。
注:女性のための日常的な血液の食事は、供給装置から提供される市販の血液源(例えば、子牛の血液)で構成されています。生きた麻酔をしたマウスは、より大きな(0.216 m3)ケージ形式で血液を提供し、より良い摂食性能を提供するためにのみ使用されます。 - 2回目の血液ミールの3日後に卵子容器を追加します。3日後、卵子容器を取り外します。
注:このステップでは、5〜10人のメスを各ケージからランダムに選択し、必要に応じて生殖能力や胎児性などの追加のフィットネスパラメータを評価するためにバイアルに個別に配置することができます。 - ケージに残っているすべての大人(死んで生きている)をセックスでスコアし、分子分析のために-80°Cでそれらを保存します。
- ハッチ卵をランダムに選択 1:1 と 1:3 比ケージから 200 L1 幼虫次世代のための新しいケージを入力します。
注:1:10比ケージでトランスジェニック個体を開始する頻度が低いため、ランダムサンプリングは、次の世代でトランスジェニック子孫の過剰な損失を引き起こし、集団を引き継ぐ可能性があります。 - 1:10ケージの正確なサンプリングと十分な数のトランスジェニック蚊を確保するために、支配的なマーカーのすべての幼虫をスクリーニングし、観察されたトランスジーン周波数を反映した200の幼虫を選択して新しいケージに入れます。
注: 1:10 ケージは、トランスジーン周波数が≥80%に達すると、1:1 と 1:3 ケージと同じように維持できます。 - 各ケージから500頭の幼虫をランダムに選択し、詳細な分析を行います。幼虫およびプパル段階で期待されるマーカーの表型のための蛍光ステレオ顕微鏡の下でスクリーニングし、成人のスコアセックス(図3)。
注:'例外的な'形型はさらに交差し、抵抗性のアレール形成を監視するために分子的に分析されるように選択することができる。 - このプロトコルは、実験計画で定義された結果パラメータによって必要な数の世代に従うことができます。
注:各世代は、血液量で区切られ、〜3週間かかります。この試験は、通常、すべての蚊が遺伝子駆動構造のホモ接合体とみなされるか、または遺伝子導入蚊の最大有病率で安定する場合に終了する。そして、以前と同様に、表現型のスクリーニングは、トランスジェニック蚊(例えば、DsRed、CFP、GFP)に統合された支配的なマーカーおよびプロモーターに依存するか、または目に見える表現型(例えば、眼色素沈着に関連する遺伝子)を提示する場合、標的遺伝子に含まれる。
- 人工給餌装置(図2B)を使用して、各ケージ内の4〜7日の女性に血液ミールを2日連続で提供する。
結果
非遺伝子駆動または自律的な遺伝子駆動の改変を負担するために生成されたトランスジェニックアノフェリン蚊は、プロトコルセクションに記載されているようにケージ試験のために設定されています。ここで示す代表的な結果は、Phamらの実験の各々の最もパフォーマンスの高い複製の表現型のダイナミクスを描写する。 (2019)アノフェレス・ステファンシ蚊のための2。3つの試験(1~3:それぞれ、不浸透な非遺伝子ドライブ、重複する遺伝子駆動および重複する遺伝子駆動)は、ケージの大きさ(0.216 m3対0.005 m3)、対象集団が年齢構造であったかどうか、血液の供給源(マウスまたは人工フィーダー)および放出比などの異なるパラメータで変化した。図6は、7世代の間に使用される3つのプロトコルすべてについて、同じリリース比(1:1)から選択された観測データを表示します。
1:1の非ドライブリリースは、6-7世代以内に>80%の導入導入に達します。遺伝子駆動トランスジェニックケージ試験では、非重複性および重複するプロトコルの両方の1:1リリースが3〜4世代以内でこのレベルに達し、遺伝子駆動システムの単一リリースがトランスジーン導入のための非駆動インダフェティブリリースよりも効率的であるという期待を検証する。より速い軌道は、近似曲線の傾きによっても確認できます。両方の遺伝子駆動プロトコルは、異なるセットアップにもかかわらず、同様の角度と傾斜傾向を提示します。観察の終わりに、非ドライブケージはトランスジーンを持つ個人の約80%を達成し、遺伝子駆動個体を持つケージは完全な(またはほぼ完全な)導入に達する。ここで説明するプロトコルを用いた個々の実験結果に関する完全なデータおよび処理の詳細は、Phamらの図1〜3に記載されている 。 (2019)2、カルバラ・レハラスー らの 図2-3(2020)ア ドルフィ ら の3および図3(2020)4.
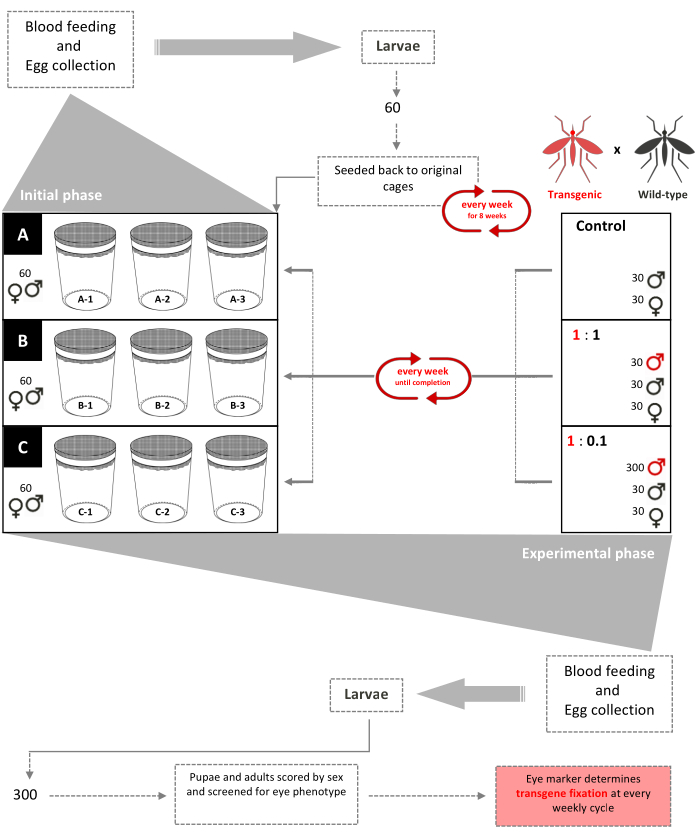
図 1.非ドライブの非無人リリーストライアル回路図。 9つの0.216 m3 ケージは、それぞれに追加された60の野生型セカンドインスター(男女混合)幼虫で設定されています。第3週から、メスは毎週血粉を提供され、卵は収集され、孵化する。第8週まで、60頭の幼虫が無作為に選択され、毎週それぞれのケージに戻され、ケージ内に年齢構造の集団を作り出す(初期段階)。9週目から、9つのケージは、トランスジェニック:野生型の男性の放出比(実験段階)に従ってランダムに三重に割り当てられます。ケージA(コントロール)は、トランスジェニックな子犬を加え込みない。メスは毎週献血され、卵は採取され、孵化し、子犬に飼育される。30人の雄と30匹の雌の野生型の子犬がケージに戻されます。ケージ1:1には、さらに30個のトランスジェニック雄の子犬が加えられます。ケージ1:0.1には、追加の300トランスジェニックオスの子犬が追加されています。9ケージのそれぞれから300の幼虫が無作為に選択され、蛍光マーカーについてスクリーニングされる。この手順は、トランス遺伝子固定(数世代後のトランスジェニック野生型蚊の安定化比)まで毎週繰り返された。ファム ら から適応(2019)2. この図の大きなバージョンを表示するには、ここをクリックしてください。

図 2.ケージ集団の血液供給。 (A) 麻酔付きマウスまたは (B) ヘモテック血液フィーダーは、それぞれ0.216 m3 ケージまたは小さな0.005 m3 ケージ上の雌の蚊に血液を供給するために提供される。この図の大きなバージョンを表示するには、ここをクリックしてください。

図 3.非駆動、重複する遺伝子駆動および非重なり合う遺伝子駆動ケージ試験に対するフェノタイプのスクリーニング。 トランスジェニックまたは野生型の表現型の幼虫、子犬および成人の蛍光画像。この例では、 An. stephensi 個体は、3xP3 プロモーターによって駆動される DsRed マーカー (DsRed+ または DsRed-) を 3 つのステージで見ることができ、成人は性別 (♀または♂) についてスクリーニングされました。中腸の食品ボーラスに関連する野生型幼虫の背景蛍光に注意してください。この図の大きなバージョンを表示するには、ここをクリックしてください。
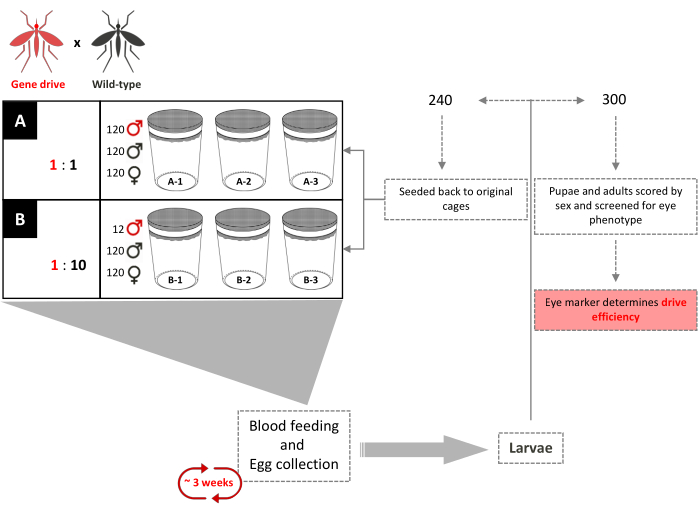
図 4.重複する遺伝子駆動ケージ試験概略図。 6つの0.216 m3 ケージは、その遺伝子駆動に従って三重に設定されています:野生型男性の放出比。120匹の野生型雄と120匹の野生型メスが各ケージに加えられた。1:1遺伝子駆動男性放出比を有するケージには、さらに120人のトランスジェニック男性が加えた。1:10の男性の放出比率を有するケージには、さらに12人のトランスジェニック男性が加えた。トランスジーンの完全な導入まで、3週間ごとに、成人女性は血液を与え、卵は収集され、孵化する。合計240頭の幼虫を無作為に選択し、それぞれのケージに戻した。300(300)の幼虫を無作為に選択し、支配的なマーカーをスクリーニングする。彼らは後に目の色とセックスのための子犬と大人としてスクリーニングされます。元のケージには、他のトランスジェニックな男性は加えありません。ファム ら から適応(2019)2. この図の大きなバージョンを表示するには、ここをクリックしてください。
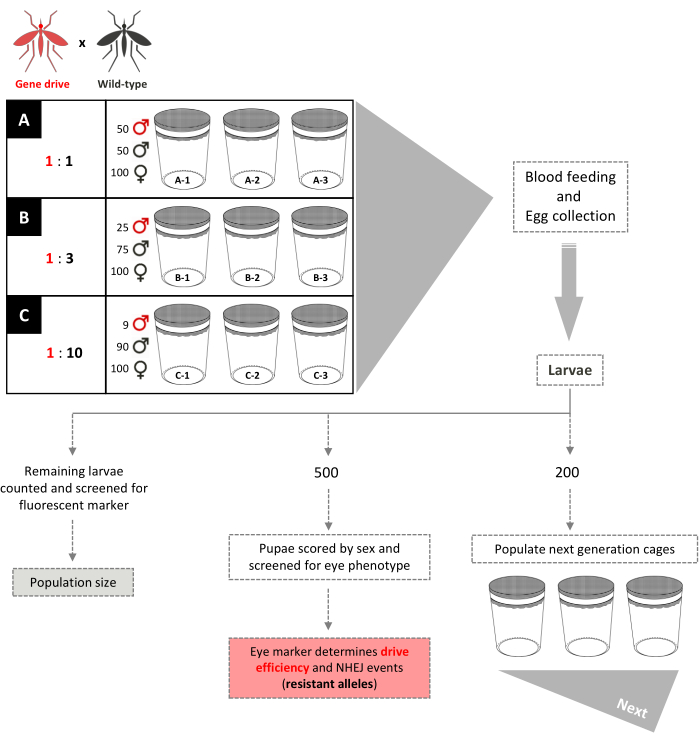
図 5.重複しない遺伝子駆動ケージ試験模式図。 9つの小さな0.005 m3 ケージは、その遺伝子ドライブに従って三重に設定されています:野生型男性の放出比。1:1の男性の放出率を持つケージには、100匹の野生型メス、50匹の野生型男性、50人の遺伝子駆動の雄が加えられる。1:3の男性の放出比を持つケージは、100野生型のメス、75の野生型の男性、および25の遺伝子駆動の男性を追加しました。ケージ1:10雄の放出比は、100の野生型メス、90の野生型の男性、および9つの遺伝子駆動の男性を加えた。メスには血液ミールが提供され、卵は採取され、孵化します。1:1と1:3のケージでは、200頭の幼虫がランダムに選択され、次の世代のために両親とは別の新しいケージを取り込むために使用されます。さらに500頭の幼虫が無作為に選択され、支配的なマーカー遺伝子のスクリーニングを受けると、子犬に飼育される。500人の子犬は、その後、大人に飼育され、セックスによって得点されます。残りのすべての幼虫はマーカーのためにスクリーニングされる。1:10ケージでは、すべての幼虫は、既存のトランスジーン周波数を反映した世代1〜12および200の幼虫で採点され、新しいケージを取り込むために使用されます。13 世代から、これらのケージは 1:1 と 1:3 ケージと同じように設定されます。ファム ら から適応(2019)2 とカルバラ・レハラス ら (2020)3. この図の大きなバージョンを表示するには、ここをクリックしてください。
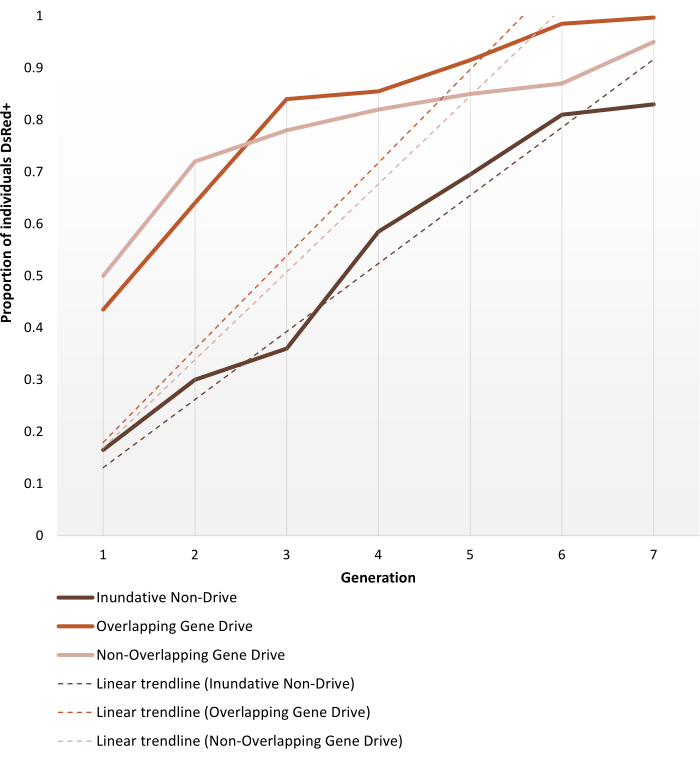
図 6.異なる集団置換ケージ試験に対するトランスジーン固定動力学の予測。 Phamらが行う各ケージ試験実験について、最もパフォーマンスの高い反復の予測型ダイナミクス を表す。 (2019)2、7世代以上監視。実験のセットアップはプロトコルで説明されています。予測は、1:1 リリース モデル (3 つの異なるケージトライアル プロトコルのそれぞれについて、反復複製を 3 重化) に関する 9 つの実験すべてのデータに基づいています。X軸は初期導入後の世代数で、Y軸はDsRedマーカー表現型(DsRed+)を経時に示す幼虫の割合です。破線は、データの線形近似曲線を表します。DsRed+ 表現型は、変更されたアリールのコピーを少なくとも1つ持つことから生じる。したがって、結果は、遺伝子駆動系において迅速化されたトランスジーンの広がりを反映し、観察終了時に(近い)完全な導入に達する。反復と実験に関する完全な詳細データの間の変動については、Phamらを参照してください 。 (2019)2, カルバラル・レハラズ・Rら (2020)3 およびアドルフィ Aら (2020)4.Pham TBらから適応した画像 (2019) マラリアベクター蚊の実験的集団改変, アノフェレス・ステファンシ. PLOSジェネト 15(12):e1008440。ドイ:10.1371/journal.pgen.1008440、アドルフィAら(2020)マラリア蚊 アノフェレス・ステファシにおける効率的な集団改変遺伝子駆動救助システム。 ナット・コミューン 11(1): 5553.ドイ:10.1038/s41467-020-19426-0およびカルバラ・レハラズRら(2020)マラリアベクター蚊の集団改変のための次世代遺伝子ドライブ、 アノフェレスガンビア。 プロク・ナットル・アカド・サイ・アメリカ 117(37):22805-22814.ドイ: 10.1073/pnas.2010214117.この図の大きなバージョンを表示するには、ここをクリックしてください。
補足ファイル:0.005 m3コロニーケージの建設。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
病原体遮断能力またはクマの滅菌遺伝子を有する遺伝子組み換え蚊は、ベクター媒介性疾患を制御するための新しいツールを構成する。これらの代替アプローチを構成するパラメータの多重度を考えると、彼らの研究における重要なステップは、制御目的のための合成トランスジーン放出の潜在的な結果の迅速かつ安全な予測を可能にする実験室での限定的な実験的評価からなる1。
ケージ集団におけるトランスジーンダイナミクスのモニタリングは数ヶ月間延長される可能性があるため、プロトコルの中心的な側面の1つは、複製(蚊の飼育、ケージサイズ、年齢構造の集団、固定放出比、安定した血液食事源、低侵襲スクリーニング手順を含む)間の実験設計の一貫性である。
男性専用の放出は、オスの蚊が病原体を伝播したり、人間に餌を与えることもないので、野生の集団に遺伝性の特徴を安全に導入することができるので、理想的であると考えられています。実験室のケージ実験では、男性の交配の競争力が低下し、トランスジーン統合に関連する他のフィットネス負荷を伴うトランスジェニック株を検出することが可能である。しかし、大型cages10で行われたような直接的かつ特異的な実験は、より自然な蚊密度における雄の競争力と女性の胎児性を適切に分析するために行うことができる2。さらに、ケージ試験からの経験データを使用して、耐性アリール形成を含むケージ集団力学のモデルをパラメータ化し、提案された技術の有効性および可能な調整に関する有用な情報を提供することができる。
ここで説明するプロトコルは、必要に応じて他の実験計画に簡単に適応でき、通常の防虫インフラや条件に関する要件は最小限に抑えられます。さらに、市販のケージや顕微鏡を除いて、材料のほとんどは安価であり、低コストの複数の反復と試験の反復を可能にします。特に、これはまた、段階的な試験経路で前進する最もパフォーマンスの高い候補を優先し、最適以下のパフォーマンスを示すもののテストを中断するために、小さなケージ試験で複数のトランスジェニック株を事前にスクリーニングすることを可能にする。
最後に、遺伝子組み換え生物の使用に関する懸念は、蚊媒介性疾患の予防のための遺伝的戦略の開発、評価、応用のためのフレームワークの精緻化を動機づける5,8,9。ここで定義したプロトコルの関連性と実行は、これらのガイドラインと一致しています。
開示事項
著者は開示を持っていません。
謝辞
私たちは、ドルシラ・スティリンジャー、キオナ・パーカー、パリッシュ・パウエル、マデリーン・トトリの蚊の夫に感謝しています。資金は、カリフォルニア大学アーバインマラリアイニシアチブによって提供されました.AAJはカリフォルニア大学アーバイン校のドナルド・ブレン教授です。
資料
| Name | Company | Catalog Number | Comments |
| Artificial feeders | Hemotek | SP6W1-3 | Starter pack – 6 feeders with 3ml reservoirs |
| Cage, commercial | BioQuip | 1450D | Collapsible Cage, 24 X 24 X 24" - 0.216 m3 (60 cm3) |
| Cage tub (popcorn) | Amazon.com | VP170-0006 | 0.005 m3 (170 fl oz) |
| Dissecting microscope with fluorescence light and filters | Leica | M165FC | |
| Glue sticks | Michaels | 88646598807 | Gluesticks 40 pk, 0.4X4” |
| Hot glue gun | Woodwards Ace | 2382513 | Stanley, 40 watt, GR20 |
| Nylon screen (netting) | Joann.com | 1102912 | Tulle 108" Wide x 50 Yds - ~35.6 cm2 (14 in2) |
| Oviposition cups | Fisher | 259126 | Beaker PP grad 50 mL |
| Razor cutting tool | Office Depot | 487899 | Box cutters |
| Scissors | Office Depot | 978561 | Scotch Precision Ultra Edge Titanium Non-Stick Scissors, 8" |
| Stapler | Office Depot | 908194 | Swingline Commercial Desk Stapler |
| Surgical sleeve (stockinette) | VWR | 56612-664 | ~48 cm (19”) cut from bolt ~15 cm (6”) X ~23 m (25y) |
| Zip ties | Home Depot | 295715 | Pk of 100, 14” cable ties - 35.6 cm (14 in) |
参考文献
- Carballar-Lejarazú, R., James, A. A. Population modification of Anopheline species to control malaria transmission. Pathogens and Global Health. 111 (8), 424-435 (2017).
- Pham, T. B., et al. Experimental population modification of the malaria vector mosquito, Anopheles stephensi. PLOS Genetics. 15 (12), 1008440 (2019).
- Carballar-Lejarazú, R., et al. Next-generation gene drive for population modification of the malaria vector mosquito, Anopheles gambiae. Proceedings of the National Academy of Sciences. 117 (37), 22805-22814 (2020).
- Adolfi, A., et al. Efficient population modification gene-drive rescue system in the malaria mosquito Anopheles stephensi. Nature Communications. 11 (1), 5553 (2020).
- Akbari, O. S., et al. Safeguarding gene drive experiments in the laboratory. Science. 349 (6251), 927-929 (2015).
- Benedict, M. Q., et al. Recommendations for Laboratory Containment and Management of Gene Drive Systems in Arthropods. Vector-Borne and Zoonotic Diseases. 18 (1), 2-13 (2018).
- Adelman, Z., et al. Rules of the road for insect gene drive research and testing. Nature Biotechnology. 35 (8), 716-718 (2017).
- Long, K. C., et al. Core commitments for field trials of gene drive organisms. Science. 370 (6523), 1417-1419 (2021).
- Facchinelli, L., North, A. R., Collins, C. M., et al. Large-cage assessment of a transgenic sex-ratio distortion strain on populations of an African malaria vector. Parasites Vectors. 12, 70 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved