Method Article
Kleinkäfig-Laborversuche mit gentechnisch veränderten Anopheline-Mücken
In diesem Artikel
Zusammenfassung
Die hier berichteten Protokolle veranschaulichen drei alternative Möglichkeiten, die Leistung von gentechnisch veränderten Moskitos zu bewerten, die für die Vektorkontrolle in laboreigenen Kleinkäfigversuchen bestimmt sind. Jedes Protokoll ist auf die spezifische Modifikation des Mückenstamms (Gene Drive oder Non-Gene Drive) und die Art der gemessenen Parameter zugeschnitten.
Zusammenfassung
Die Bekämpfung von durch Mücken übertragenen Krankheitserregern mit gentechnisch veränderten Vektoren wurde als vielversprechendes Instrument zur Ergänzung herkömmlicher Bekämpfungsstrategien vorgeschlagen. CRISPR-basierte Homing-Gene-Drive-Systeme haben transgene Technologien in der wissenschaftlichen Gemeinschaft zugänglicher gemacht. Die Bewertung der transgenen Mückenleistung und Vergleiche mit Wildtyp-Gegenstücken in kleinen Laborkäfigversuchen liefern wertvolle Daten für die Gestaltung nachfolgender Feldkäfigexperimente und experimenteller Bewertungen, um die Strategien zur Krankheitsprävention zu verfeinern. Hier stellen wir drei verschiedene Protokolle vor, die in Laborumgebungen verwendet werden, um die Transgenausbreitung in anophelinen Mückenvektoren der Malaria zu bewerten. Dazu gehören überschwängliche Freisetzungen (kein Gene-Drive-System) sowie Gene-Drive-überlappende und nicht überlappende Generationsstudien. Die drei Versuche unterscheiden sich in einer Reihe von Parametern und können an die gewünschten experimentellen Einstellungen angepasst werden. Darüber hinaus sind Insektärstudien in kleinen Käfigen Teil des fortschreitenden Übergangs von künstlichen Insekten aus dem Labor zu Freilandfreisetzungen. Daher stellen die hier beschriebenen Protokolle unschätzbare Werkzeuge dar, um Erfahrungswerte zu liefern, die letztendlich die Implementierung neuer Technologien zur Eliminierung von Malaria vor Ort unterstützen werden.
Einleitung
Strategien, die auf gentechnisch veränderten Mücken basieren, werden verfolgt, um die Übertragung von vektorübertragenen Krankheitserregern, wie sie Malaria verursachen, zu kontrollieren1. Dazu gehören Technologien, die 1) darauf abzielen, die Anzahl und Dichte von Anopheles-Mücken zu verringern (Populationsunterdrückung), oder 2) darauf abzielen, die Fähigkeit von Vektoren zu beeinträchtigen, Parasiten zu übertragen, die für menschliche Krankheiten verantwortlich sind (Populationsmodifikation, -ersatz oder -veränderung), wobei Vektorstämme so konstruiert werden, dass sie Effektorgene exprimieren, die die Übertragung von Krankheitserregern verhindern. Diese genetischen Ansätze wurden durch das Aufkommen von CRISPR / Cas9-basierten Gene Drives unterstützt, mit Proofs-of-Concept in Parasiten übertragenden Moskitos über eine effektive Ausbreitung von Nutzlastmerkmalen sowie antiparasitären Effektormolekülen in Käfigpopulationen.
Kleine Laborkäfigversuche stellen einen ersten Schritt zur Bewertung der Charakteristik transgener Stämme im Rahmen eines stufenweisen Ansatzes für ihre Weiterentwicklung hin zu Feldanwendungen dar2. Zu den spezifischen Ergebnisüberlegungen gehören die Vererbbarkeit der eingeführten DNA in einem wettbewerbsorientierten Umfeld, die Penetranz und Expressivität des Phänotyps sowie die Stabilität. Zu den relevanten experimentellen Designmerkmalen gehören die Größe der Käfige, die Mückendichte, die Anzahl der Replikate, überlappende oder nicht überlappende Generationen, altersstrukturierte Zielpopulationen, einzelne oder mehrfache Freisetzungen von technisch hergestellten Stämmen, freisetzungen nur für Männer, nur für Frauen oder gemischtgeschlechtliche Freisetzungen, Freisetzungsverhältnisse, Blutmehlquellen (künstlich oder lebend) und Screening-Verfahren.
Wir beschreiben hier Protokolle, die verwendet werden, um Stämme von anophelinen Moskitos auf überschwemmende Freisetzungen (kein Gene-Drive-System) und solche zu bewerten, die autonome Gene-Drive-Systeme tragen, die durch Cas9-Endonukleasen vermittelt werden und RNAs (gRNA) leiten. Anwendungen dieser Protokolle erscheinen in Pham et al. (2019) 2, Carballar-Lejarazú et al. (2020) 3 und Adolfi et al. (2020) 4. Auflage.
Inundative Freisetzungsstudien bewerten die Ausbreitungsrate eines entworfenen Transgens unter Mendelscher Vererbung nach mehreren Freisetzungen einer großen Anzahl transgener Moskitos in eine wilde Population. Ohne die Bindung des Transgens an ein Antriebssystem liefern Daten aus Überflutungsversuchen Aufschluss über die Eignung und Dynamik des interessierenden Transgens in einer stabilisierten Population.
Wenn Mückenpopulationen ein autonomes Gene-Drive-System enthalten, werden kleine Käfigversuche entwickelt, um die Dynamik der Ausbreitung des gewünschten Transgens zu bewerten, indem die Rate des dominanten Markeranstiegs nach einer einzigen Einführung transgener Männchen bestimmt wird. Autonome Gene-Drive-Elemente tragen die Gene, die für die Cas9-Nuklease, die gRNA und den dominanten Marker kodieren, die so verknüpft sind, dass sie in nachfolgenden Generationen aktiv sind.
"Überlappende" Generationen beziehen sich auf die gleichzeitige Anwesenheit mehrerer Generationen im selben Käfig, um eine altersstrukturierte kontinuierliche Population zu schaffen, während sich "nicht überlappende" auf einzelne diskrete Generationen in jeder aufeinanderfolgenden Käfigpopulation bezieht2. Gene-Drive-Cage-Experimente können beendet werden, sobald die anfängliche Dynamik der Antriebsrate (Umwandlungsrate) bestimmt werden kann (8-10 Generationen je nach Konstrukt), und während sie Informationen über die kurzfristige Stabilität des Transgens innerhalb der Mückenpopulation liefern, zeigen sie möglicherweise nicht, was passiert, wenn und wenn die dominanten Markerfrequenzen die vollständige Einführung erreichen oder nahe daran sind (jede Mücke trägt mindestens eine Kopie des Gene-Drive-Systems).
Protokoll
Erklärung zur Tierethik
Diese Studie wurde in strikter Übereinstimmung mit den Empfehlungen im Leitfaden für die Pflege und Verwendung von Versuchstieren der National Institutes of Health durchgeführt. Die Protokolle wurden von den Institutional Animal Care and Use Committees der University of California genehmigt (Animal Welfare Assurance Numbers A3416.01).
1. Überflutungsversuche an Nicht-Gene-Drive-Mücken (Abbildung 1)
- Aufbau und Wartung des Käfigs
- Richten Sie drei Sätze von dreifachen 0,216 m3 Käfigen ein, indem Sie in jedem Käfig über drei aufeinanderfolgende Wochen 60 Wildtyplarven (WT) im zweiten Stadium hinzufügen.
HINWEIS: Es ist nicht möglich, das Geschlecht von Larven im zweiten Stadium durch Lichtmikroskopie zu bestimmen, so dass die Proben, die jedem Käfig hinzugefügt werden, sowohl aus Männchen als auch aus Weibchen bestehen. - Stellen Sie den erwachsenen Weibchen in jedem Käfig jede Woche betäubte Mäuse als Blutmehlquelle (Abbildung 2A) und 3 Tage nach dem Blutmehl einen Eiablagebehälter zur Verfügung.
HINWEIS: Während ein alternatives künstliches Fütterungsgerät verwendet werden kann, führt die Bereitstellung von lebenden betäubten Mäusen für Blutmehl zu einer besseren Mückenfütterungsleistung in diesen großen (0,216 m3) Käfigformaten. Dies erfordert ein genehmigtes Tierverwendungsprotokoll und eine entsprechende Genehmigung (z. B. Institutional Animal Care and Use Committee, IACUC) für die Verwendung von Mäusen.
HINWEIS: Einzelne Mäuse werden mit einer Mischung aus 4 mg/Mausketamin HCl und 0,4 mg/Maus-Xylazin betäubt. Den Tieren werden zwischen 0,1 und 0,5 ml dieser Mischung injiziert. - Brüten Sie wöchentlich Eier aus jedem Käfig aus und wählen Sie nach dem Zufallsprinzip 60 Larven im zweiten Stadium (L2) aus, die in ihre jeweiligen Käfige zurückgebracht werden, um die Mortalität auszugleichen (Wochen 4-8).
ANMERKUNG: Die Schritte 1.1.1 bis 1.1.3 sind notwendig, um eine stabile und verteilte altersstrukturierte Population in den Käfigen zu etablieren - die als "Anfangsphase" bezeichnet wird. - Weisen Sie in Woche 9 die in Schritt 1.1.1 zufällig zusammengesetzten Käfige in Triplikaten zu, um das gewünschte männliche Freisetzungsverhältnis freizusetzen.
- Legen Sie einen Satz dreifacher Käfige als Kontrollen fest, um die Konsistenz während des gesamten Experiments zu bewerten.
- Legen Sie einen Satz Triplikate für jedes gewünschte Freisetzungsverhältnis fest (z. B. 1:1 oder 1:0,1 transgene:WT-Männchen).
HINWEIS: Dieser Punkt wird als "experimentelle Phase" bezeichnet.
- Richten Sie drei Sätze von dreifachen 0,216 m3 Käfigen ein, indem Sie in jedem Käfig über drei aufeinanderfolgende Wochen 60 Wildtyplarven (WT) im zweiten Stadium hinzufügen.
- Replikations- und Release-Verhältnisse
- Wöchentlich 60 WT-Puppen (30 Männchen und 30 Weibchen) in die Kontrollkäfige geben.
- Um ein Verhältnis von 1: 1 aufrechtzuerhalten, fügen Sie wöchentlich 30 transgene männliche Puppen zusammen mit 60 (30 männlichen und 30 weiblichen) WT-Puppen in den jeweiligen Käfig hinzu.
- Um ein Verhältnis von 1:0,1 aufrechtzuerhalten, fügen Sie wöchentlich 300 transgene männliche Puppen zusammen mit 60 (30 männlichen und 30 weiblichen) WT-Puppen in den jeweiligen Käfig hinzu.
HINWEIS: Die fortgesetzte Zugabe von wilden Moskitos zu den Käfigen hält die Käfigdichte aufrecht, die aufgrund der altersbedingten Erwachsenensterblichkeit voraussichtlich wöchentlich abnehmen wird.
- Screening von Phänotypen
- Wählen Sie insgesamt 300 Larven aus jedem Käfig nach dem Zufallsprinzip aus. Mit der Verwendung eines Stereomikroskops, das mit Fluoreszenzfiltern ausgestattet ist, wird die Expression des fluoreszierenden dominanten Markers im Larven- und Puppenstadium untersucht und das Geschlecht der resultierenden Erwachsenen bewertet (Abbildung 3).
HINWEIS: Das phänotypische Screening hängt von dem dominanten Marker ab, der im transgenen Konstrukt enthalten ist, das in die Moskitos integriert ist (z. B. Discosoma sp. rot fluoreszierendes Protein [DsRed], cyanfarbenes fluoreszierendes Protein [CFP], grün fluoreszierendes Protein [GFP]), und vom Promotor, der seine Expression antreibt (der am häufigsten verwendete in der Mückentransgenese verwendet wird, ist der 3xP3-Promotor, der die Expression in den Augen und der Nervenschleimhaut antreibt). - Befolgen Sie dieses Protokoll für so viele Generationen, wie es die im Versuchsdesign definierten Ergebnisparameter erfordern.
HINWEIS: Die Studie wird normalerweise beendet, wenn alle Moskitos mindestens eine Kopie des Transgens haben (bestimmt durch das Vorhandensein des dominanten fluoreszierenden Markers) oder das Verhältnis von transgenen zu WT-Mücken in einem Käfig stabilisiert ist und nach einigen (3-5) Generationen nicht stark schwankt.
- Wählen Sie insgesamt 300 Larven aus jedem Käfig nach dem Zufallsprinzip aus. Mit der Verwendung eines Stereomikroskops, das mit Fluoreszenzfiltern ausgestattet ist, wird die Expression des fluoreszierenden dominanten Markers im Larven- und Puppenstadium untersucht und das Geschlecht der resultierenden Erwachsenen bewertet (Abbildung 3).
2. Überlappende Generationsversuche von Gene-Drive-Mücken (Abbildung 4)
HINWEIS: Moskitos, die Gene-Drive-Systeme tragen, erfordern schriftliche und überprüfte Protokolle und sollten von einem Institutional Biosafety Committee (IBC) oder gleichwertig und anderen, falls erforderlich, genehmigt werden. Die Eindämmung von Mücken (ACL 2+ Level) sollte den empfohlenen Verfahren folgen5,6,7. Insbesondere sollten die Gene-Drive-Experimente zwei strenge Einschlussstrategien anwenden. Die erste sind in der Regel physische Barrieren (Barrierestrategie) zwischen Organismen und der Umwelt. Dies erfordert ein sicheres Insektarium und Standardarbeitsanweisungen (einschließlich Überwachung), um sicherzustellen, dass Moskitos nicht entkommen können. Die zweite Einschlussstrategie kann molekular, ökologisch oder reproduktiv sein5.
- Käfig-Setup
- Richten Sie zwei Sätze von dreifachen 0,216 m3 Käfigen für jedes gewünschte transgene: WT-Freisetzungsverhältnis für Männer ein.
- Um ein männliches Freisetzungsverhältnis von 1:1 zu erreichen, fügen Sie 120 transgene Männchen, 120 WT-Männchen und 120 WT-Weibchen im Puppenstadium zu jedem Replikatkäfig hinzu.
- Um ein Freisetzungsverhältnis von 1:10 zu erreichen, fügen Sie 12 transgene Männchen, 120 WT-Männchen und 120 WT-Weibchen im Puppenstadium zu jedem Replikationskäfig hinzu.
HINWEIS: Verschiedene Freisetzungsverhältnisse können getestet werden (1: 1, 1: 3, 1: 10 usw.) und die Anzahl der Moskitos, die zur Einleitung der Experimente verwendet werden, variiert entsprechend. Es ist jedoch wichtig, die Auswirkungen niedriger Zahlen auf die statistische Auswertung der Daten zu berücksichtigen.
- Richten Sie zwei Sätze von dreifachen 0,216 m3 Käfigen für jedes gewünschte transgene: WT-Freisetzungsverhältnis für Männer ein.
- Populationserhaltung und Screening
- Versorgen Sie 4-7 Tage alte Weibchen in jedem Käfig mit einer Blutmahlzeit mit anästhesierten Mäusen (Abbildung 2A).
- Legen Sie drei Tage nach der Blutmahlzeit einen Eiablagebehälter in jeden Käfig.
- Bruten Sie Eier in einer Larvenschale, wählen Sie ~ 240 Larven des ersten Stadiums (L1) nach dem Zufallsprinzip aus jedem Käfig aus, ziehen Sie sie bis ins Erwachsenenalter auf und bringen Sie sie in ihre jeweiligen Käfige zurück.
- Geben Sie zusätzliche (2-3) Blutmahlzeiten alle 3-4 Tage für die neu aufgetauchten Erwachsenen, wie in Schritt 2.2.1 beschrieben.
HINWEIS: Während der nachfolgenden Generationen werden keine zusätzlichen transgenen Männchen hinzugefügt. - Wählen Sie insgesamt 300 Larven aus jedem Käfig nach dem Zufallsprinzip aus und screenen Sie sie mit einem Fluoreszenz-Stereomikroskop auf das Vorhandensein des dominanten Marker-Phänotyps im Larven- und Puppenstadium und bewerten Sie aufstrebende Erwachsene für das Geschlecht (Abbildung 3).
HINWEIS: Wie bisher hängt das phänotypische Screening von dem dominanten Marker und Promotor ab, der im Gene-Drive-System enthalten und in die transgenen Moskitos integriert ist (z. B. DsRed, CFP oder GFP). Wenn homozygote oder heteroallelische Störungen der Zielgene zu einem sichtbaren Phänotyp führen (z. B. Gene, die mit der Augenpigmentierung zusammenhängen), hängt das Screening dieses Merkmals davon ab, in welchem Stadium es am einfachsten ist, den veränderten Phänotyp zu visualisieren. - Befolgen Sie dieses Protokoll für so viele Generationen, wie es die im Versuchsdesign definierten Ergebnisparameter erfordern.
HINWEIS: Jede Generation (abgegrenzt durch die Blutmahlzeit) dauert ~ drei Wochen. Die Studie wird normalerweise beendet, wenn alle Moskitos für das Gene-Drive-Konstrukt als homozygot gelten oder sich die Populationen bei einem maximalen Prozentsatz von Moskitos stabilisieren, die mindestens eine Kopie des Gene-Drive-Konstrukts tragen.
3. Nicht überlappende Generationsversuche mit Gene-Drive-Moskitos (Abbildung 5).
- Käfig-Setup
- Richten Sie dreifach 0,005 m3 Käfigpopulationen für jedes spezifische Freisetzungsverhältnis von transgenen zu WT-Männchen ein, die untersucht werden sollen (z. B. drei Sätze von dreifachen Käfigen mit einem Freisetzungsverhältnis von 1: 1, 1: 3, 1: 10). Richten Sie alle Käfige mit einer gleichen Gesamtzahl von Männchen und Weibchen ein.
HINWEIS: Die Ergänzende Datei ist ein Video, das den Bau des 0,005 m3 großen Koloniekäfigs demonstriert.- Fügen Sie 50 transgene Männchen, 50 WT-Männchen und 100 WT-Weibchen zu jedem der drei Replikationskäfige hinzu, um ein männliches Freisetzungsverhältnis von 1:1 zu erreichen.
- Fügen Sie 25 transgene Männchen, 75 WT-Männchen und 100 WT-Weibchen zu jedem der drei Replikationskäfige hinzu, um ein 1:3-Freisetzungsverhältnis von 1:3 zu erreichen.
- Fügen Sie 9 transgene Männchen, 90 WT-Männchen und 100 WT-Weibchen zu jedem der drei Replikationskäfige hinzu, um ein 1:10 männliches Freisetzungsverhältnis zu erreichen.
HINWEIS: Verschiedene Freisetzungsverhältnisse können getestet werden und die Anzahl der Moskitos, die zur Einleitung der Experimente verwendet werden, kann entsprechend variieren. Es ist jedoch wichtig, die Auswirkungen einer geringen Anzahl von Moskitos auf die statistischen Analysen zu berücksichtigen. Dies sind Single-Veröffentlichungen; bei einer nachfolgenden Generation kommen keine zusätzlichen transgenen Männchen hinzu.
- Richten Sie dreifach 0,005 m3 Käfigpopulationen für jedes spezifische Freisetzungsverhältnis von transgenen zu WT-Männchen ein, die untersucht werden sollen (z. B. drei Sätze von dreifachen Käfigen mit einem Freisetzungsverhältnis von 1: 1, 1: 3, 1: 10). Richten Sie alle Käfige mit einer gleichen Gesamtzahl von Männchen und Weibchen ein.
- Populationserhaltung und Screening
- Versorgen Sie die 4-7 Tage alten Weibchen in jedem Käfig an zwei aufeinanderfolgenden Tagen mit Blutmahlzeiten unter Verwendung eines künstlichen Fütterungsgeräts (Abbildung 2B).
HINWEIS: Routinemäßige Blutmahlzeiten für Frauen bestehen aus einer kommerziell erhältlichen Blutquelle (z. B. Kälberblut), die aus einem Fütterungsgerät bereitgestellt wird. Lebende anästhesierte Mäuse werden nur verwendet, um Blutmehl in größeren (0,216 m3) Käfigformaten für eine bessere Fütterungsleistung bereitzustellen. - Fügen Sie 3 Tage nach dem zweiten Blutmehl einen Eiablagebehälter hinzu. Entfernen Sie nach drei Tagen die Eiablagebehälter.
HINWEIS: In diesem Schritt können 5-10 Weibchen nach dem Zufallsprinzip aus jedem Käfig ausgewählt und einzeln in Fläschchen gelegt werden, um bei Bedarf zusätzliche Fitnessparameter wie Fruchtbarkeit und Fruchtbarkeit zu beurteilen. - Bewerten Sie nach Geschlecht alle Erwachsenen (tot und lebendig), die im Käfig verbleiben, und lagern Sie sie bei -80 ° C für molekulare Analysen.
- Schlüpfen Sie Eier und wählen Sie nach dem Zufallsprinzip 200 L1-Larven aus den Käfigen im Verhältnis 1: 1 und 1: 3 aus, um neue Käfige für die nächste Generation zu bevölkern.
HINWEIS: Aufgrund der geringen Häufigkeit, mit der transgene Individuen in den Käfigen im Verhältnis 1:10 beginnen, kann eine Zufallsstichprobe zu einem übermäßigen Verlust transgener Nachkommen in der nächsten Generation führen, um die Population fortzusetzen. - Um eine genaue Probenahme für die 1:10-Käfige und eine ausreichende Anzahl transgener Moskitos zu gewährleisten, sollten Sie alle Larven auf den dominanten Marker untersuchen und 200 Larven auswählen, die die beobachtete Transgenfrequenz widerspiegeln, um die neuen Käfige zu bevölkern.
HINWEIS: Die 1:10-Käfige können identisch mit 1:1- und 1:3-Käfigen gehalten werden, wenn sie eine Transgenfrequenz von ≥80% erreichen. - Wählen Sie 500 Larven aus jedem Käfig nach dem Zufallsprinzip aus, um eine eingehende Analyse durchzuführen. Screenen Sie unter einem Fluoreszenz-Stereomikroskop auf die erwarteten Marker-Phänotypen im Larven- und Puppenstadium und das Score-Geschlecht von Erwachsenen (Abbildung 3).
HINWEIS: "Außergewöhnliche" Phänotypen können ausgewählt werden, um weiter gekreuzt und molekular analysiert zu werden, um die Bildung resistenter Allele zu überwachen. - Dieses Protokoll kann für so viele Generationen befolgt werden, wie es die im Versuchsdesign definierten Ergebnisparameter erfordern.
HINWEIS: Jede Generation wird durch das Blutmehl begrenzt und dauert ~ drei Wochen. Die Studie wird normalerweise beendet, wenn alle Moskitos für das Gene-Drive-Konstrukt als homozygot gelten oder sich die Populationen bei einer maximalen Prävalenz transgener Moskitos stabilisieren. Und wie bisher hängt das Screening auf Phänotypen von den dominanten Markern und Promotoren ab, die in den transgenen Mücken (z. B. DsRed, CFP, GFP) oder in den Zielgenen integriert sind, wenn sie einen sichtbaren Phänotyp aufweisen (z. B. Gene, die mit der Augenpigmentierung zusammenhängen).
- Versorgen Sie die 4-7 Tage alten Weibchen in jedem Käfig an zwei aufeinanderfolgenden Tagen mit Blutmahlzeiten unter Verwendung eines künstlichen Fütterungsgeräts (Abbildung 2B).
Ergebnisse
Transgene anopheline Moskitos, die erzeugt werden, um Nicht-Gene-Drive- oder autonome Gene-Drive-Modifikationen zu tragen, werden für Käfigversuche eingerichtet, wie im Abschnitt Protokolle beschrieben. Die hier gezeigten repräsentativen Ergebnisse zeigen die Phänotypdynamik der leistungsstärksten Replikate jedes der von Pham et al. durchgeführten Käfigversuche. (2019) 2 für Anopheles stephensi Moskitos. Die drei Studien (1 - 3 beziehungsweise: inundativer Nicht-Gene-Drive, überlappender Gene-Drive und nicht-überlappender Gene-Drive) variierten in verschiedenen Parametern, wie der Größe des Käfigs (0,216 m3 vs 0,005 m3), ob die Zielpopulation altersstrukturiert war oder nicht, der Quelle der Blutmahlzeit (Mäuse oder künstlicher Feeder) und den Freisetzungsverhältnissen. Als Darstellungsmittel zeigt Abbildung 6 die beobachteten Daten, die aus dem gleichen Freisetzungsverhältnis (1:1) für alle drei verwendeten Protokolle im Laufe von sieben Generationen ausgewählt wurden.
Die 1:1 Non-Drive-Version erreicht >80% Transgen-Einführung innerhalb von 6-7 Generationen. Für Gen-Drive-transgene Käfigversuche erreichen die 1: 1-Freisetzungen sowohl in den nicht überlappenden als auch in den überlappenden Protokollen dieses Niveau innerhalb von 3-4 Generationen, wodurch die Erwartung bestätigt wird, dass eine einzelne Freisetzung eines Gene-Drive-Systems effizienter sein kann als non-drive-inundative Freisetzungen für die Transgeneinführung. Die schnellere Trajektorie kann auch durch die Steigung der Trendlinien bestätigt werden. Beide Gene-Drive-Protokolle weisen trotz unterschiedlicher Setups ähnliche Winkel und Neigungstrends auf. Am Ende der Beobachtung erreichen Nicht-Antriebskäfige ~ 80% der Individuen, die das Transgen tragen, während Käfige mit Gene-Drive-Individuen eine vollständige (oder fast vollständige) Einführung erreichen. Vollständige Daten und Verarbeitungsdetails zu einzelnen Versuchsergebnissen unter Verwendung der hier beschriebenen Protokolle finden Sie in den Abbildungen 1-3 von Pham et al. (2019) 2, Abbildungen 2-3 von Carballar-Lejarazú et al. (2020) 3 und Abbildung 3 von Adolfi et al. (2020) 4. Auflage.
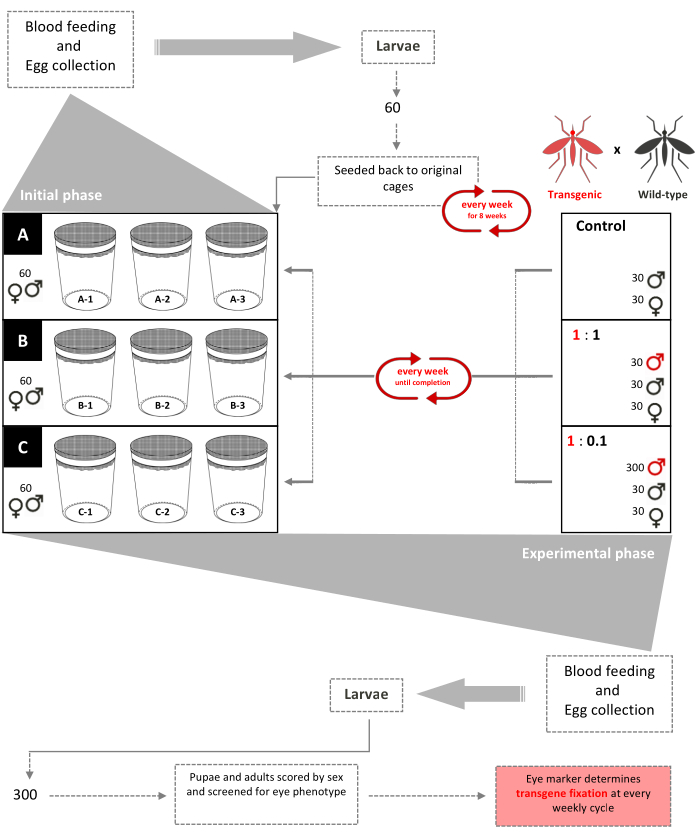
Abbildung 1. Schematische Nicht-Laufwerk-Inundative-Release-Testversion. Neun 0,216 m3 große Käfige sind mit jeweils 60 Wildtyp-Larven im zweiten Stadium (gemischtgeschlechtlich) aufgebaut. Ab Woche 3 erhalten die Weibchen wöchentlich ein Blutmehl und die Eier werden gesammelt und geschlüpft. Bis Woche 8 werden 60 Larven zufällig ausgewählt und wöchentlich in ihre jeweiligen Käfige zurückgebracht, um eine altersstrukturierte Population in den Käfigen zu bilden (Anfangsphase). Ab Woche 9 werden die neun Käfige nach ihren transgenen:Wildtyp-Freisetzungsverhältnissen von Männchen nach dem Zufallsprinzip dreifach zugeordnet (experimentelle Phase). Käfige A (Kontrolle) haben keine transgenen Puppen hinzugefügt. Den Weibchen wird wöchentlich ein Blutmehl zur Verfügung gestellt und Eier werden gesammelt, geschlüpft und zu Puppen aufgezogen. 30 männliche und 30 weibliche Wildtyppuppen werden wieder in ihre Käfige gegeben. Käfige 1: 1 haben zusätzliche 30 transgene männliche Puppen hinzugefügt. Käfige 1:0.1 haben zusätzliche 300 transgene männliche Puppen hinzugefügt. 300 Larven aus jedem der 9 Käfige werden zufällig ausgewählt und auf den fluoreszierenden Marker untersucht. Dieses Verfahren wurde wöchentlich bis zur Transgenfixierung wiederholt (stabilisiertes Verhältnis von transgenen Wildtyp-Mücken nach einigen Generationen). Adaptiert von Pham et al. (2019) 2. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2. Blutfütterung von Käfigpopulationen. (A) Anästhesierte Mäuse oder (B) Hemotek Blutspender werden für die Blutfütterung weiblicher Moskitos in den 0,216 m3 Käfigen bzw. den kleinen 0,005 m3 Käfigen angeboten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3. Screening von Phänotypen für Non-Drive-, Overlapping Gene-Drive- und Non-Overlapping-Gene-Drive-Cage-Studien. Fluoreszierende Bilder einer Larve, einer Puppe und eines Erwachsenen von transgenen oder Wildtyp-Phänotypen. In diesem Beispiel wurden An. stephensi-Individuen auf den DsRed-Marker untersucht, der vom 3xP3-Promotor in den Augen (DsRed+ oder DsRed-) angetrieben wird, der in allen drei Stadien sichtbar ist, und Erwachsene wurden auf Sex ( oder ♂ ) ♀ untersucht. Beachten Sie die Hintergrundfluoreszenz bei Wildtyplarven, die mit dem Nahrungsbolus im Mitteldarm assoziiert sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
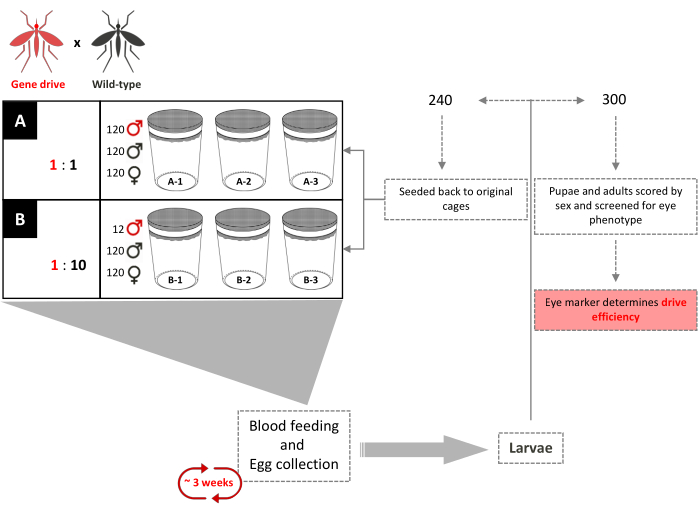
Abbildung 4. Schema der überlappenden Gene-Drive-Cage-Studie. Sechs 0,216 m3 große Käfige sind in dreifacher Ausfertigung entsprechend ihrem Gen-Drive:Wildtyp-Ungsaustrittsverhältnis von Männchen eingerichtet. 120 Wildtyp-Männchen und 120 Wildtyp-Weibchen wurden in jeden Käfig aufgenommen. Käfige mit einem 1:1 Gene-Drive-Freisetzungsverhältnis für Männchen wurden zusätzlich 120 transgene Männchen hinzugefügt. Käfige mit einem männlichen Freisetzungsverhältnis von 1:10 wurden zusätzlich 12 transgene Männchen hinzugefügt. Bis zur vollständigen Einführung des Transgens werden alle 3 Wochen erwachsene Weibchen mit Blutmehl versorgt und Eier gesammelt und geschlüpft. Insgesamt wurden 240 Larven nach dem Zufallsprinzip ausgewählt und in ihre jeweiligen Käfige zurückgebracht. Dreihundert (300) Larven werden zufällig ausgewählt und auf den dominanten Marker untersucht. Sie werden später als Puppen und Erwachsene auf Augenfarbe und Sex untersucht. Den ursprünglichen Käfigen werden keine zusätzlichen transgenen Männchen hinzugefügt. Adaptiert von Pham et al. (2019) 2. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
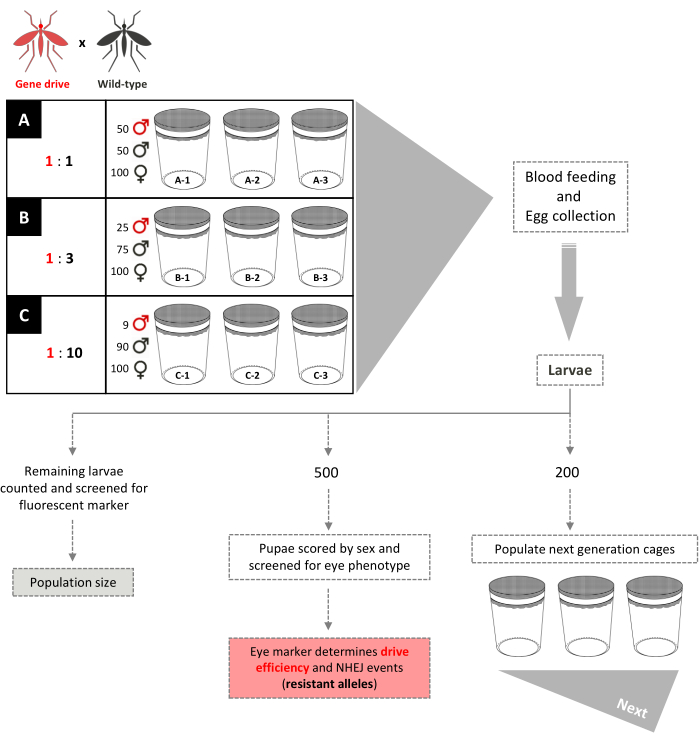
Abbildung 5. Schema der nicht überlappenden Gene-Drive-Cage-Studie. Neun kleine 0,005 m3 große Käfige sind in dreifacher Ausfertigung entsprechend ihrem Gen-Drive:Wildtyp-Freisetzungsverhältnis von Männchen eingerichtet. Käfige mit einem männlichen Freisetzungsverhältnis von 1: 1 haben 100 Wildtyp-Weibchen, 50 Wildtyp-Männchen und 50 Gene-Drive-Männchen hinzugefügt. Käfige mit einem männlichen Freisetzungsverhältnis von 1: 3 haben 100 Wildtyp-Weibchen, 75 Wildtyp-Männchen und 25 Gene-Drive-Männchen hinzugefügt. Cages 1:10 männliche Freisetzungsverhältnis haben 100 Wildtyp-Weibchen, 90 Wildtyp-Männchen und 9 Gene-Drive-Männchen hinzugefügt. Den Weibchen wird eine Blutmahlzeit zur Verfügung gestellt und Eier gesammelt und geschlüpft. Für 1:1- und 1:3-Käfige werden 200 Larven zufällig ausgewählt und verwendet, um neue Käfige, getrennt von denen ihrer Eltern, für die nächste Generation zu bevölkern. Weitere 500 Larven werden zufällig ausgewählt und zu Puppen aufgezogen, wenn sie auf das dominante Markergen untersucht werden. Die 500 Puppen werden dann zu Erwachsenen aufgezogen und nach Geschlecht bewertet. Alle verbleibenden Larven werden auf den Marker untersucht. Für die 1:10-Käfige werden alle Larven in den Generationen 1-12 bewertet und 200 Larven, die die bestehende Transgenfrequenz widerspiegeln, werden verwendet, um neue Käfige zu besiedeln. Ab Generation 13 sind diese Käfige identisch mit den Käfigen 1:1 und 1:3 aufgebaut. Adaptiert von Pham et al. (2019) 2 und Carballar-Lejarazú et al. (2020) 3. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
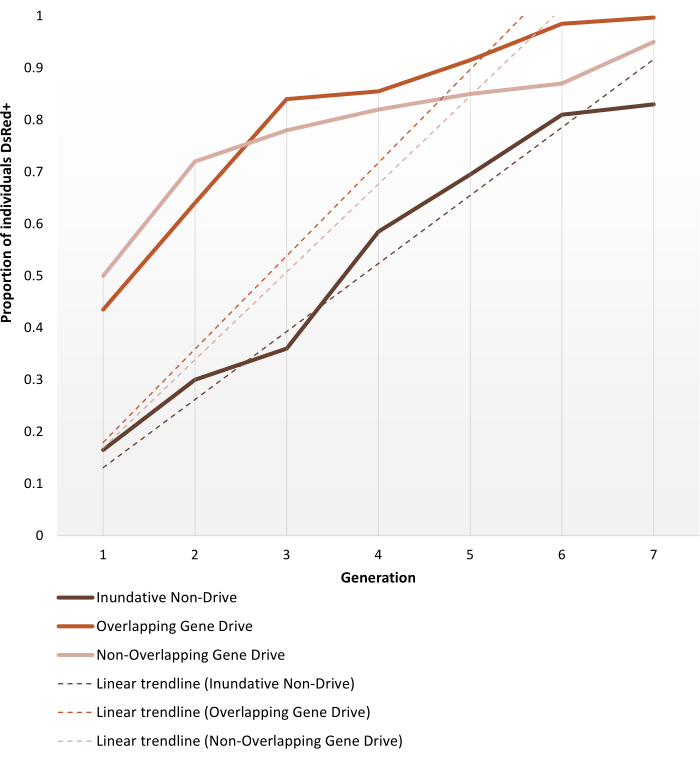
Abbildung 6. Vorhergesagte Transgen-Fixationsdynamik für die verschiedenen Populationsersatzkäfigstudien. Darstellung der erwarteten Phänotypdynamik der leistungsstärksten Replikate für jedes der von Pham et al. durchgeführten Käfigversuche. (2019) 2, überwacht über 7 Generationen. Der Aufbau von Experimenten ist in den Protokollen beschrieben. Die Vorhersagen basieren auf Daten aus allen 9 Experimenten auf den 1:1-Release-Modellen (dreifache Replikate für jedes der drei verschiedenen Käfigversuchsprotokolle). Die X-Achse ist die Generationszahl nach der ersten Einführung und die Y-Achse ist der Anteil der Larven, die im Laufe der Zeit den DsRed-Marker-Phänotyp (DsRed+) aufweisen. Gestrichelte Linien stellen lineare Trendlinien der Daten dar. Der DsRed+ Phänotyp ergibt sich aus mindestens einer Kopie des modifizierten Allels. Daher spiegeln die Ergebnisse die Ausbreitung des Transgens wider, die im Gene-Drive-System beschleunigt wird und am Ende der Beobachtung (fast) vollständig eingeführt wird. Für die Variabilität zwischen Replikaten und vollständigen detaillierten Daten zu den Experimenten siehe Pham et al. (2019) 2, Carballar-Lejarazú R et al. (2020)3 und Adolfi A et al. (2020)4. Bilder adaptiert von Pham TB et al. (2019) Experimentelle Populationsmodifikation der Malaria-Vektormücke, Anopheles stephensi. PLOS Genet 15(12): e1008440. doi: 10.1371/journal.pgen.1008440, Adolfi A et al. (2020) Efficient population modification gene-drive rescue system in the malaria mosquito Anopheles stephensi. Nat Commun 11(1): 5553. doi: 10.1038/s41467-020-19426-0 und Carballar-Lejarazú R et al. (2020) Next-generation gene drive for population modification of the malaria vector mosquito, Anopheles gambiae. Proc Natl Acad Sci USA 117 (37): 22805-22814. doi: 10.1073/pnas.2010214117. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Datei: Der Bau des 0,005 m3 großen Koloniekäfigs. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Gentechnisch veränderte Moskitos, die eine pathogenblockierende Fähigkeit haben oder Sterilitätsgene tragen, stellen neue Werkzeuge zur Bekämpfung von durch Vektoren übertragenen Krankheiten dar. Angesichts der Vielzahl von Parametern, aus denen diese alternativen Ansätze bestehen, besteht ein kritischer Schritt in ihrer Forschung aus laborgebundenen experimentellen Bewertungen, die eine schnelle und sichere Vorhersage der potenziellen Ergebnisse einer Freisetzung synthetischer Transgene zu Kontrollzwecken ermöglichen1.
Da sich die Überwachung der Transgendynamik in Käfigpopulationen über mehrere Monate erstrecken kann, ist einer der zentralen Aspekte der Protokolle die Konsistenz im experimentellen Design zwischen den Replikaten (einschließlich Mückenaufzucht, Käfiggröße, altersstrukturierte Populationen, feste Freisetzungsverhältnisse, stabile Blutmehlquellen und minimal-invasive Screening-Verfahren).
Freisetzungen nur für Männchen gelten als ideal, da männliche Moskitos weder Krankheitserreger übertragen noch sich vom Menschen ernähren, daher können sie vererbbare Eigenschaften sicher in wilde Populationen einführen. In Laborkäfigexperimenten ist es möglich, transgene Stämme mit reduzierter männlicher Paarungskonkurrenz und anderen Fitnessbelastungen im Zusammenhang mit der Transgenintegration nachzuweisen. Es können jedoch direkte und spezifische Experimente, wie sie in großen Käfigen10 durchgeführt werden, durchgeführt werden, um die männliche Wettbewerbsfähigkeit sowie die weibliche Fruchtbarkeit in natürlicheren Mückendichten richtig zu analysieren2. Darüber hinaus können empirische Daten aus den Käfigversuchen verwendet werden, um Modelle der Käfigpopulationsdynamik, einschließlich der Bildung resistenter Allele, zu parametrisieren und nützliche Informationen über die Wirksamkeit und mögliche Anpassungen in der vorgeschlagenen Technologie zu liefern.
Die hier beschriebenen Protokolle können bei Bedarf leicht an andere experimentelle Designs angepasst werden, mit minimalen Anforderungen an die reguläre insektäre Infrastruktur und Bedingungen. Darüber hinaus sind die meisten Materialien, mit Ausnahme der kommerziellen Käfige und Mikroskope, kostengünstig und ermöglichen kostengünstige Mehrfachreplikationen und Iterationen der Versuche. Dies ermöglicht insbesondere auch die Voruntersuchung mehrerer transgener Stämme in kleinen Käfigstudien, um die leistungsstärksten Kandidaten zu priorisieren, die im phasenweisen Testweg vorangetrieben werden sollen, und die Tests an solchen mit suboptimalen Leistungen auszusetzen.
Schließlich motiviert die Besorgnis über die Verwendung genetisch veränderter Organismen die Ausarbeitung von Rahmenbedingungen für die Entwicklung, Bewertung und Anwendung genetischer Strategien zur Prävention von durch Mücken übertragenen Krankheiten5,8,9. Die Relevanz und Ausführung der hier definierten Protokolle stehen im Einklang mit diesen Richtlinien.
Offenlegungen
Die Autoren haben keine Offenlegungen.
Danksagungen
Wir danken Drusilla Stillinger, Kiona Parker, Parrish Powell und Madeline Nottoli für die Mückenhaltung. Die Finanzierung erfolgte durch die Irvine Malaria Initiative der University of California. AAJ ist Donald Bren Professor an der University of California, Irvine.
Materialien
| Name | Company | Catalog Number | Comments |
| Artificial feeders | Hemotek | SP6W1-3 | Starter pack – 6 feeders with 3ml reservoirs |
| Cage, commercial | BioQuip | 1450D | Collapsible Cage, 24 X 24 X 24" - 0.216 m3 (60 cm3) |
| Cage tub (popcorn) | Amazon.com | VP170-0006 | 0.005 m3 (170 fl oz) |
| Dissecting microscope with fluorescence light and filters | Leica | M165FC | |
| Glue sticks | Michaels | 88646598807 | Gluesticks 40 pk, 0.4X4” |
| Hot glue gun | Woodwards Ace | 2382513 | Stanley, 40 watt, GR20 |
| Nylon screen (netting) | Joann.com | 1102912 | Tulle 108" Wide x 50 Yds - ~35.6 cm2 (14 in2) |
| Oviposition cups | Fisher | 259126 | Beaker PP grad 50 mL |
| Razor cutting tool | Office Depot | 487899 | Box cutters |
| Scissors | Office Depot | 978561 | Scotch Precision Ultra Edge Titanium Non-Stick Scissors, 8" |
| Stapler | Office Depot | 908194 | Swingline Commercial Desk Stapler |
| Surgical sleeve (stockinette) | VWR | 56612-664 | ~48 cm (19”) cut from bolt ~15 cm (6”) X ~23 m (25y) |
| Zip ties | Home Depot | 295715 | Pk of 100, 14” cable ties - 35.6 cm (14 in) |
Referenzen
- Carballar-Lejarazú, R., James, A. A. Population modification of Anopheline species to control malaria transmission. Pathogens and Global Health. 111 (8), 424-435 (2017).
- Pham, T. B., et al. Experimental population modification of the malaria vector mosquito, Anopheles stephensi. PLOS Genetics. 15 (12), 1008440 (2019).
- Carballar-Lejarazú, R., et al. Next-generation gene drive for population modification of the malaria vector mosquito, Anopheles gambiae. Proceedings of the National Academy of Sciences. 117 (37), 22805-22814 (2020).
- Adolfi, A., et al. Efficient population modification gene-drive rescue system in the malaria mosquito Anopheles stephensi. Nature Communications. 11 (1), 5553 (2020).
- Akbari, O. S., et al. Safeguarding gene drive experiments in the laboratory. Science. 349 (6251), 927-929 (2015).
- Benedict, M. Q., et al. Recommendations for Laboratory Containment and Management of Gene Drive Systems in Arthropods. Vector-Borne and Zoonotic Diseases. 18 (1), 2-13 (2018).
- Adelman, Z., et al. Rules of the road for insect gene drive research and testing. Nature Biotechnology. 35 (8), 716-718 (2017).
- Long, K. C., et al. Core commitments for field trials of gene drive organisms. Science. 370 (6523), 1417-1419 (2021).
- Facchinelli, L., North, A. R., Collins, C. M., et al. Large-cage assessment of a transgenic sex-ratio distortion strain on populations of an African malaria vector. Parasites Vectors. 12, 70 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten