Method Article
Essais en laboratoire en petite cage de moustiques anophélines génétiquement modifiés
Dans cet article
Résumé
Les protocoles présentés ici illustrent trois autres façons d’évaluer la performance des moustiques génétiquement modifiés destinés à la lutte antivectorielle dans des essais en laboratoire sur de petites cages. Chaque protocole est adapté à la modification spécifique de la souche de moustique (forçage génétique ou non) et aux types de paramètres mesurés.
Résumé
La lutte contre les agents pathogènes transmis par les moustiques à l’aide de vecteurs génétiquement modifiés a été proposée comme un outil prometteur pour compléter les stratégies de lutte conventionnelles. Les systèmes de forçage génétique basés sur CRISPR ont rendu les technologies transgéniques plus accessibles au sein de la communauté scientifique. L’évaluation de la performance des moustiques transgéniques et les comparaisons avec leurs homologues de type sauvage dans les essais en petites cages de laboratoire fournissent des données précieuses pour la conception d’expériences ultérieures en cage sur le terrain et d’évaluations expérimentales afin d’affiner les stratégies de prévention des maladies. Nous présentons ici trois protocoles différents utilisés en laboratoire pour évaluer la propagation des transgènes chez les moustiques vecteurs anophèles du paludisme. Il s’agit notamment des rejets inundatifs (pas de système de forçage génétique) et des essais de génération qui se chevauchent et ne se chevauchent pas. Les trois essais varient dans un certain nombre de paramètres et peuvent être adaptés aux contextes expérimentaux souhaités. De plus, les études insectaires dans de petites cages font partie de la transition progressive des insectes modifiés du laboratoire vers les rejets en plein champ. Par conséquent, les protocoles décrits ici représentent des outils inestimables pour fournir des valeurs empiriques qui, en fin de compte, aideront à la mise en œuvre sur le terrain de nouvelles technologies pour l’élimination du paludisme.
Introduction
Des stratégies fondées sur des moustiques génétiquement modifiés sont mises à l’essai pour contrôler la transmission d’agents pathogènes à transmission vectorielle tels que ceux qui causent le paludisme1. Il s’agit notamment de technologies 1) visant à réduire le nombre et la densité des moustiques anophèles (suppression de la population), ou 2) visant à altérer la capacité des vecteurs à transmettre des parasites responsables de maladies humaines (modification, remplacement ou altération de la population) dans lesquelles des souches de vecteurs sont conçues pour exprimer des gènes effecteurs qui empêchent la transmission d’agents pathogènes. Ces approches génétiques ont été renforcées par l’avènement des forçages génétiques basés sur CRISPR / Cas9, avec des preuves de concept dans les moustiques transmettant des parasites de la propagation efficace des traits de charge utile ainsi que des molécules effectrices antiparasitaires dans les populations en cage.
Les essais en cage de petits laboratoires représentent une première étape pour évaluer les caractéristiques des souches transgéniques dans le cadre d’une approche progressive de leur développement vers des applications sur le terrain2. Les considérations de résultats spécifiques comprennent l’héritabilité de l’ADN introduit dans un environnement concurrentiel, la pénétrance et l’expressivité du phénotype, et la stabilité. Les caractéristiques pertinentes de la conception expérimentale comprennent la taille des cages, la densité des moustiques, le nombre de répétitions, les générations qui se chevauchent ou ne se chevauchent pas, les populations cibles structurées par âge, les rejets uniques ou multiples de souches modifiées, les rejets réservés aux hommes, aux femmes ou aux sexes mixtes, les rapports de libération, les sources de farines sanguines (animaux artificiels ou vivants) et les procédures de dépistage.
Nous décrivons ici les protocoles utilisés pour évaluer les souches de moustiques anophèles pour les rejets inundatifs (pas de système de forçage génétique) et ceux qui portent des systèmes de forçage génétique autonomes médiés par des endonucléases Cas9 et des ARN guides (ARNg). Les applications de ces protocoles apparaissent dans Pham et al. (2019) 2, Carballar-Lejarazú et al. (2020) 3, et Adolfi et al. (2020) 4. L'
Les essais de dissémination inundative évaluent le taux de propagation d’un transgène conçu sous héritage mendélien à la suite de rejets multiples d’un grand nombre de moustiques transgéniques dans une population sauvage. Sans l’attachement du transgène à un système d’entraînement, les données des essais de libération inondante fournissent des informations sur l’aptitude et la dynamique du transgène d’intérêt dans une population stabilisée.
Lorsque les populations de moustiques contiennent un système de forçage génétique autonome, les essais en petites cages sont conçus pour évaluer la dynamique de la propagation du transgène souhaité en déterminant le taux d’augmentation des marqueurs dominants après une seule introduction de mâles transgéniques. Les éléments de forçage génétique autonomes portent les gènes codant pour la nucléase Cas9, l’ARNg et le marqueur dominant liés de manière à être actifs dans les générations suivantes.
Les générations qui se chevauchent font référence à la présence simultanée de plusieurs générations dans la même cage pour créer une population continue structurée par âge, tandis que « sans chevauchement » fait référence à des générations distinctes uniques dans chaque population en cage consécutive2. Les expériences en cage de forçage génétique peuvent être terminées une fois que la dynamique initiale du taux d’entraînement (conversion) peut être déterminée (8 à 10 générations selon la construction), et bien qu’elles fournissent des informations sur la stabilité à court terme du transgène au sein de la population de moustiques, elles peuvent ne pas révéler ce qui se passe quand et si les fréquences des marqueurs dominants atteignent ou sont proches de l’introduction complète (chaque moustique transportant au moins une copie du système de forçage génétique).
Protocole
Déclaration d’éthique animale
Cette étude a été réalisée en stricte conformité avec les recommandations du Guide pour le soin et l’utilisation des animaux de laboratoire des National Institutes of Health. Les protocoles ont été approuvés par les comités institutionnels de soins et d’utilisation des animaux de l’Université de Californie (numéros d’assurance du bien-être animal A3416.01).
1. Essais de rejets inundatifs sur des moustiques non porteurs de gènes (Figure 1)
- Installation et maintenance de la cage
- Installez trois ensembles de cages triples de 0,216 m3 en ajoutant 60 larves de type sauvage (WT) de deuxième stade dans chaque cage pendant trois semaines consécutives.
REMARQUE: Il n’est pas possible de déterminer le sexe des larves du deuxième stade par microscopie optique, de sorte que les échantillons ajoutés à chaque cage seront constitués de mâles et de femelles. - Chaque semaine, fournir aux femelles adultes de chaque cage des souris anesthésiées comme source de farine de sang (figure 2A) et un récipient de ponte 3 jours après la farine de sang.
REMARQUE: Bien qu’un autre appareil d’alimentation artificielle puisse être utilisé, la fourniture de souris anesthésiées vivantes pour les farines de sang entraîne une meilleure performance d’alimentation des moustiques dans ces grands formats de cage (0,216 m3). Cela nécessite un protocole d’utilisation des animaux approuvé et une approbation pertinente (p. ex., Comité institutionnel de soins et d’utilisation des animaux, IACUC) pour l’utilisation de souris.
REMARQUE: Les souris individuelles sont anesthésiées avec un mélange de 4 mg / kétamine de souris HCl et de 0,4 mg / xylazine de souris. Les animaux sont injectés avec entre 0,1 - 0,5 mL de ce mélange. - Éclosez des œufs de chaque cage chaque semaine et sélectionnez 60 larves du deuxième stade (L2) au hasard pour les ramener dans leurs cages respectives afin de compenser la mortalité (semaines 4 à 8).
NOTE: Les étapes 1.1.1 à 1.1.3 sont nécessaires pour établir une population stable et répartie structurée par âge dans les cages - appelée « phase initiale ». - À la semaine 9, assignez des cages assemblées à l’étape 1.1.1 au hasard en trois exemplaires pour les libérations du taux de libération mâle souhaité.
- Désignez un ensemble de cages triples comme témoins pour évaluer la cohérence tout au long de l’expérience.
- Désignez un ensemble de triples pour chaque rapport de libération souhaité (par exemple, 1:1 ou 1:0,1 transgénique:WT mâles).
REMARQUE: Ce point est appelé « phase expérimentale ».
- Installez trois ensembles de cages triples de 0,216 m3 en ajoutant 60 larves de type sauvage (WT) de deuxième stade dans chaque cage pendant trois semaines consécutives.
- Réplications et ratios de libération
- Ajouter 60 pupes WT (30 mâles et 30 femelles) aux cages de contrôle chaque semaine.
- Pour maintenir un rapport de 1:1, ajoutez chaque semaine 30 nymphes mâles transgéniques ainsi que 60 (30 mâles et 30 femelles) de pupes WT dans chaque cage respective.
- Pour maintenir un ratio de 1:0,1, ajoutez chaque semaine 300 pupes mâles transgéniques ainsi que 60 (30 mâles et 30 femelles) pupes WT dans chaque cage respective.
REMARQUE: L’ajout continu de moustiques sauvages aux cages maintient la densité de la cage, qui devrait diminuer chaque semaine en raison de la mortalité adulte liée à l’âge.
- Dépistage des phénotypes
- Sélectionnez un total de 300 larves de chaque cage au hasard. À l’aide d’un stéréomicroscope équipé de filtres de fluorescence, dépister l’expression du marqueur dominant fluorescent aux stades larvaire et nymphal et noter le sexe des adultes résultants (Figure 3).
REMARQUE: Le dépistage phénotypique dépendra du marqueur dominant inclus dans la construction du transgène intégré dans les moustiques (par exemple, Discosoma sp. protéine fluorescente rouge [DsRed], protéine fluorescente cyan [CFP], protéine fluorescente verte [GFP]), et du promoteur conduisant son expression (le plus utilisé dans la transgénèse des moustiques est l’expression motrice du promoteur 3xP3 dans les yeux et le cordon nerveux). - Suivez ce protocole pendant autant de générations que les paramètres de résultat définis dans le plan expérimental l’exigent.
REMARQUE: L’essai est généralement terminé lorsque tous les moustiques ont au moins une copie du transgène (déterminé par la présence du marqueur fluorescent dominant) ou que le rapport entre les moustiques transgéniques et WT dans une cage est stabilisé et ne fluctue pas beaucoup après quelques (3-5) générations.
- Sélectionnez un total de 300 larves de chaque cage au hasard. À l’aide d’un stéréomicroscope équipé de filtres de fluorescence, dépister l’expression du marqueur dominant fluorescent aux stades larvaire et nymphal et noter le sexe des adultes résultants (Figure 3).
2. Essais de génération chevauchants de moustiques forgétiques (Figure 4)
REMARQUE : Les moustiques porteurs de systèmes de forçage génétique nécessitent des protocoles écrits et révisés et doivent être approuvés par un comité institutionnel de biosécurité (CIB) ou l’équivalent, et d’autres le cas échéant. Le confinement des moustiques (niveau ACL 2+) doit suivre les procédures recommandées5,6,7. Plus précisément, les expériences de forçage génétique devraient utiliser deux stratégies de confinement strictes. Le premier est généralement les barrières physiques (stratégie de barrière) entre les organismes et l’environnement. Cela nécessite d’avoir une insecticide sécurisée et des procédures opérationnelles normalisées (y compris la surveillance) pour s’assurer que les moustiques ne peuvent pas s’échapper. La deuxième stratégie de confinement peut être moléculaire, écologique ou reproductive5.
- Configuration de la cage
- Installez deux ensembles de cages triples de 0,216 m3 pour chaque rapport de libération mâle transgénique:WT souhaité.
- Pour obtenir un taux de libération mâle de 1:1, ajoutez 120 mâles transgéniques, 120 mâles WT et 120 femelles WT au stade nymphe à chaque cage répliquée.
- Pour obtenir un rapport de libération de 1:10, ajoutez 12 mâles transgéniques, 120 mâles WT et 120 femelles WT au stade nymphe à chaque cage répliquée.
REMARQUE: Différents rapports de libération peuvent être testés (1: 1, 1: 3, 1: 10, etc.) et le nombre de moustiques utilisés pour lancer les expériences varie en conséquence. Cependant, il est important de tenir compte des effets d’un faible nombre sur l’évaluation statistique des données.
- Installez deux ensembles de cages triples de 0,216 m3 pour chaque rapport de libération mâle transgénique:WT souhaité.
- Maintien de la population et dépistage
- Fournir aux femelles âgées de 4 à 7 jours dans chaque cage un repas de sang à l’aide de souris anesthésiées (figure 2A).
- Trois jours après le repas de sang, insérez un récipient de ponte dans chaque cage.
- Faites éclore les œufs dans un plateau larvaire, sélectionnez environ 240 larves du premier stade (L1) au hasard dans chaque cage, élevez-les à l’âge adulte et retournez-les dans leurs cages respectives.
- Fournir des repas de sang supplémentaires (2-3) tous les 3-4 jours pour les adultes nouvellement émergés comme décrit à l’étape 2.2.1.
REMARQUE: Aucun mâle transgénique supplémentaire n’est ajouté au cours de l’une des générations suivantes. - Sélectionnez un total de 300 larves de chaque cage au hasard et dépistez-les pour détecter la présence du phénotype marqueur dominant aux stades larvaire et nymphal à l’aide d’un stéréomicroscope à fluorescence et évaluez les adultes émergents pour le sexe (Figure 3).
REMARQUE: Comme précédemment, le dépistage phénotypique dépendra du marqueur dominant et du promoteur inclus dans le système de forçage génétique et intégré dans les moustiques transgéniques (par exemple, DsRed, CFP ou GFP). Si des perturbations homozygotes ou hétéroalléliques des gènes ciblés entraînent un phénotype visible (par exemple, des gènes liés à la pigmentation oculaire), le dépistage de ce trait dépendra du stade où il est le plus facile de visualiser le phénotype modifié. - Suivez ce protocole pendant autant de générations que les paramètres de résultat définis dans le plan expérimental l’exigent.
REMARQUE: Chaque génération (délimitée par le repas de sang) prend environ trois semaines. L’essai est généralement terminé lorsque tous les moustiques sont considérés comme homozygotes pour la construction du forçage génétique ou que les populations se stabilisent à un pourcentage maximal de moustiques porteurs d’au moins une copie de la construction du forçage génétique.
3. Essais de génération sans chevauchement de moustiques forgétiques (figure 5).
- Configuration de la cage
- Mettre en place des populations de cages triples de 0,005 m3 pour chaque rapport de rejet spécifique des transgéniques par rapport aux mâles WT à étudier (par exemple, trois ensembles de cages triplicates avec chacun des rapports de libération de 1:1, 1:3, 1:10). Installez toutes les cages avec un nombre total égal de mâles et de femelles.
REMARQUE : Le dossier supplémentaire est une vidéo démontrant la construction de la cage de colonie de 0,005 m3 .- Ajoutez 50 mâles transgéniques, 50 mâles WT et 100 femelles WT à chacune des trois cages répliquées pour obtenir un rapport de libération mâle de 1:1.
- Ajoutez 25 mâles transgéniques, 75 mâles WT et 100 femelles WT à chacune des trois cages répliquées pour obtenir un rapport de libération mâle 1:3.
- Ajoutez 9 mâles transgéniques, 90 mâles WT et 100 femelles WT à chacune des trois cages répliquées pour obtenir un rapport de libération mâle 1:10.
REMARQUE: Différents rapports de libération peuvent être testés et le nombre de moustiques utilisés pour lancer les expériences peut varier en conséquence. Cependant, il est important de considérer l’impact d’un faible nombre de moustiques sur les analyses statistiques. Ce sont des sorties uniques; aucun mâle transgénique supplémentaire n’est ajouté à la génération suivante.
- Mettre en place des populations de cages triples de 0,005 m3 pour chaque rapport de rejet spécifique des transgéniques par rapport aux mâles WT à étudier (par exemple, trois ensembles de cages triplicates avec chacun des rapports de libération de 1:1, 1:3, 1:10). Installez toutes les cages avec un nombre total égal de mâles et de femelles.
- Maintien de la population et dépistage
- Fournir aux femelles âgées de 4 à 7 jours dans chaque cage des repas de sang à l’aide d’un appareil d’alimentation artificiel (figure 2B) pendant deux jours consécutifs.
REMARQUE : Les repas sanguins de routine pour les femmes consistent en une source de sang disponible dans le commerce (p. ex., le sang de veau) fournie par un appareil d’alimentation. Les souris anesthésiées vivantes ne sont utilisées que pour fournir des farines de sang dans des formats de cage plus grands (0,216 m3) pour de meilleures performances d’alimentation. - Ajouter un récipient de ponte 3 jours après la deuxième farine de sang. Après trois jours, retirez les récipients de ponte.
REMARQUE: À cette étape, 5 à 10 femelles peuvent être sélectionnées au hasard dans chaque cage et placées individuellement dans des flacons pour évaluer des paramètres de condition physique supplémentaires, tels que la fertilité et la fécondité, si nécessaire. - Score par sexe tous les adultes (morts et vivants) restant dans la cage et stockez-les à -80°C pour l’analyse moléculaire.
- Éclosez des œufs et sélectionnez au hasard 200 larves L1 dans les cages de rapport 1:1 et 1:3 pour peupler de nouvelles cages pour la prochaine génération.
REMARQUE: En raison de la faible fréquence de départ de l’individu transgénique dans les cages de rapport 1: 10, l’échantillonnage aléatoire peut entraîner une perte excessive de progéniture transgénique dans la prochaine génération pour poursuivre la population. - Pour assurer un échantillonnage précis des cages 1:10 et un nombre suffisant de moustiques transgéniques, filtrez toutes les larves pour le marqueur dominant et sélectionnez 200 larves reflétant la fréquence de transgène observée pour peupler les nouvelles cages.
REMARQUE: Les cages 1:10 peuvent être maintenues de manière identique aux cages 1:1 et 1:3 lorsqu’elles atteignent une fréquence de transgène de ≥80%. - Sélectionnez 500 larves de chaque cage au hasard pour une analyse approfondie. Dépister au stéréomicroscope à fluorescence les phénotypes marqueurs attendus aux stades larvaire et nymphal et noter le sexe des adultes (Figure 3).
REMARQUE: Les phénotypes « exceptionnels » peuvent être sélectionnés pour être croisés et analysés moléculairement afin de surveiller la formation d’allèles résistants. - Ce protocole peut être suivi pendant autant de générations que les paramètres de résultat définis dans la conception expérimentale l’exigent.
REMARQUE: Chaque génération est délimitée par la farine de sang et prend environ trois semaines. L’essai est généralement terminé lorsque tous les moustiques sont considérés comme homozygotes pour la construction du forçage génétique ou que les populations se stabilisent à une prévalence maximale de moustiques transgéniques. Et comme auparavant, le dépistage des phénotypes dépendra des marqueurs dominants et du promoteur intégrés dans les moustiques transgéniques (par exemple, DsRed, CFP, GFP) ou dans les gènes ciblés s’ils présentent un phénotype visible (par exemple, des gènes liés à la pigmentation oculaire).
- Fournir aux femelles âgées de 4 à 7 jours dans chaque cage des repas de sang à l’aide d’un appareil d’alimentation artificiel (figure 2B) pendant deux jours consécutifs.
Résultats
Les moustiques anophélines transgéniques générés pour supporter des modifications non génétiques ou autonomes sont mis en place pour les essais en cage comme décrit dans la section Protocoles. Les résultats représentatifs présentés ici décrivent la dynamique du phénotype des répliques les plus performantes de chacune des expériences d’essais en cage réalisées par Pham et al. (2019) 2 pour les moustiques Anopheles stephensi . Les trois essais (1 à 3, respectivement : inundative non-gene drive, chevauchement de gènes et non-chevauchement de gènes) variaient en différents paramètres, tels que la taille de la cage (0,216 m3 vs 0,005 m3), si la population cible était structurée ou non selon l’âge, la source de farine de sang (souris ou mangeoire artificielle) et les taux de libération. À titre de moyen de représentation, la figure 6 montre les données observées sélectionnées à partir du même rapport de rejet (1:1) pour les trois protocoles utilisés, au cours de sept générations.
La version 1:1 sans entraînement atteint >80% d’introduction de transgène en 6-7 générations. Pour les essais en cage transgénique de forçage génétique, les rejets 1:1 dans les protocoles sans chevauchement et chevauchement atteignent ce niveau en 3-4 générations, validant ainsi l’attente qu’une seule libération d’un système de forçage génétique peut être plus efficace que les rejets inundatifs non pulsés pour l’introduction de transgènes. La trajectoire plus rapide peut également être confirmée par la pente des courbes de tendance. Les deux protocoles de forçage génétique, malgré des configurations différentes, présentent des angles et des tendances de pente similaires. À la fin de l’observation, les cages non pulsées atteignent environ 80% des individus portant le transgène, tandis que les cages avec des individus porteurs de gènes atteignent une introduction complète (ou presque complète). Les données complètes et les détails de traitement sur les résultats d’expériences individuelles en utilisant les protocoles décrits ici peuvent être trouvés dans les figures 1-3 de Pham et al. (2019) 2, Figures 2-3 de Carballar-Lejarazú et al. (2020) 3 et la figure 3 d’Adolfi et al. (2020) 4. L'
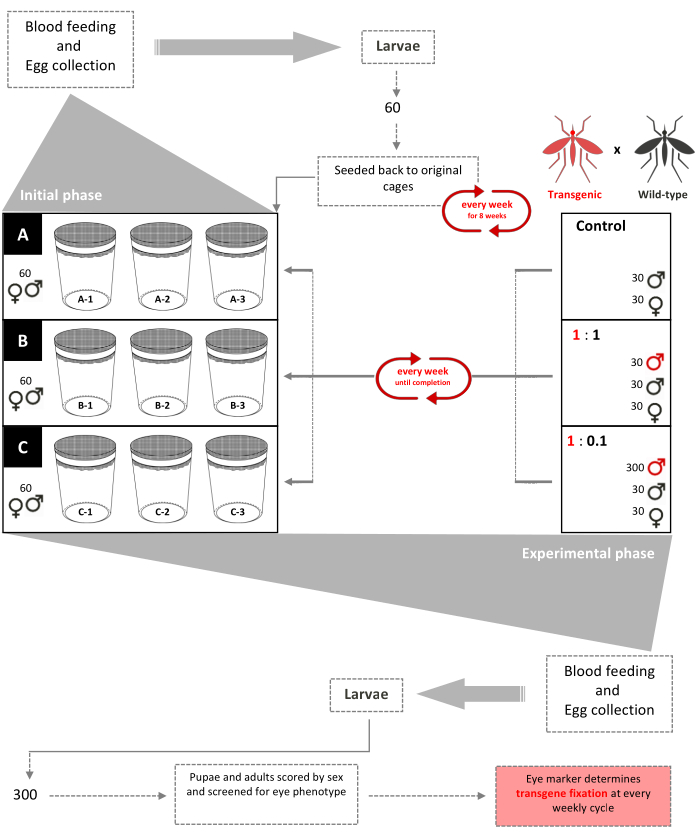
Graphique 1. Schéma d’essai de version inundative sans lecteur. Neuf cages de 0,216 m3 sont installées avec 60 larves de deuxième stade de type sauvage (sexes mixtes) ajoutées à chacune. À partir de la semaine 3, les femelles reçoivent une farine de sang hebdomadaire et les œufs sont collectés et éclos. Jusqu’à la semaine 8, 60 larves sont sélectionnées au hasard et renvoyées dans leurs cages respectives chaque semaine pour créer une population structurée par âge dans les cages (phase initiale). À partir de la semaine 9, les neuf cages sont assignées au hasard en trois exemplaires en fonction de leurs rapports de libération transgéniques/sauvages mâles (phase expérimentale). Les cages A (Contrôle) n’ont pas de pupes transgéniques ajoutées. Les femelles reçoivent une farine de sang hebdomadaire et les œufs sont collectés, éclos et élevés jusqu’aux nymphes. 30 pupes mâles et 30 nymphes femelles de type sauvage sont rajoutées à leurs cages. Les cages 1: 1 ont 30 pupes mâles transgéniques supplémentaires ajoutées. Les cages 1:0.1 ont 300 pupes mâles transgéniques supplémentaires ajoutées. 300 larves de chacune des 9 cages sont sélectionnées au hasard et sélectionnées pour le marqueur fluorescent. Cette procédure a été répétée chaque semaine jusqu’à la fixation du transgène (rapport stabilisé de moustiques transgéniques-sauvages après quelques générations). Adapté de Pham et al. (2019) 2. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 2. Alimentation sanguine des populations en cage. (A) Des souris anesthésiées ou (B) des mangeoires sanguines Hemotek sont proposées pour nourrir les moustiques femelles sur les cages de 0,216 m3 ou les petites cages de 0,005 m3 , respectivement. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 3. Dépistage des phénotypes pour les essais en cage de non-entraînement, de forçage génétique qui se chevauchent et de forçage génétique qui ne se chevauchent pas. Images fluorescentes d’une larve, d’une nymphe et d’un adulte de phénotypes transgéniques ou de type sauvage. Dans cet exemple, les individus d’An. stephensi ont été dépistés pour le marqueur DsRed piloté par le promoteur 3xP3 dans les yeux (DsRed+ ou DsRed-), visible dans les trois stades, et les adultes ont été dépistés pour le sexe ( ♀ ou ♂ ). Notez la fluorescence de fond chez les larves de type sauvage associées au bolus alimentaire dans l’intestin moyen. Veuillez cliquer ici pour voir une version agrandie de cette figure.
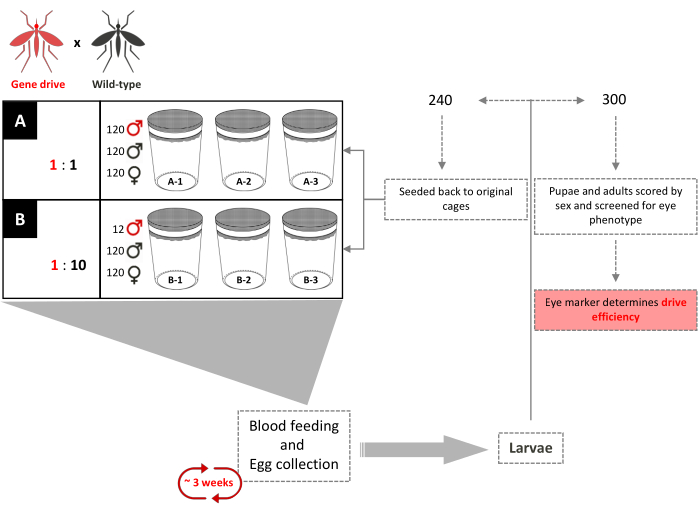
Graphique 4. Schéma d’essai en cage de forçage génétique qui se chevauche. Six cages de 0,216 m3 sont aménagées en trois exemplaires en fonction de leurs rapports gène-forçage:libération mâle de type sauvage. 120 mâles de type sauvage et 120 femelles de type sauvage ont été ajoutés à chaque cage. Les cages avec un rapport de libération mâle de 1: 1 gène ont eu 120 mâles transgéniques supplémentaires ajoutés. Les cages avec un taux de libération mâle de 1:10 avaient 12 mâles transgéniques supplémentaires ajoutés. Jusqu’à l’introduction complète du transgène, toutes les 3 semaines, les femelles adultes reçoivent des farines de sang et les œufs sont collectés et éclos. Au total, 240 larves ont été sélectionnées au hasard et retournées dans leurs cages respectives. Trois cents (300) larves sont sélectionnées au hasard et sélectionnées pour le marqueur dominant. Ils sont ensuite dépistés en tant que nymphes et adultes pour la couleur des yeux et le sexe. Aucun mâle transgénique supplémentaire n’est ajouté aux cages d’origine. Adapté de Pham et al. (2019) 2. Veuillez cliquer ici pour voir une version agrandie de cette figure.
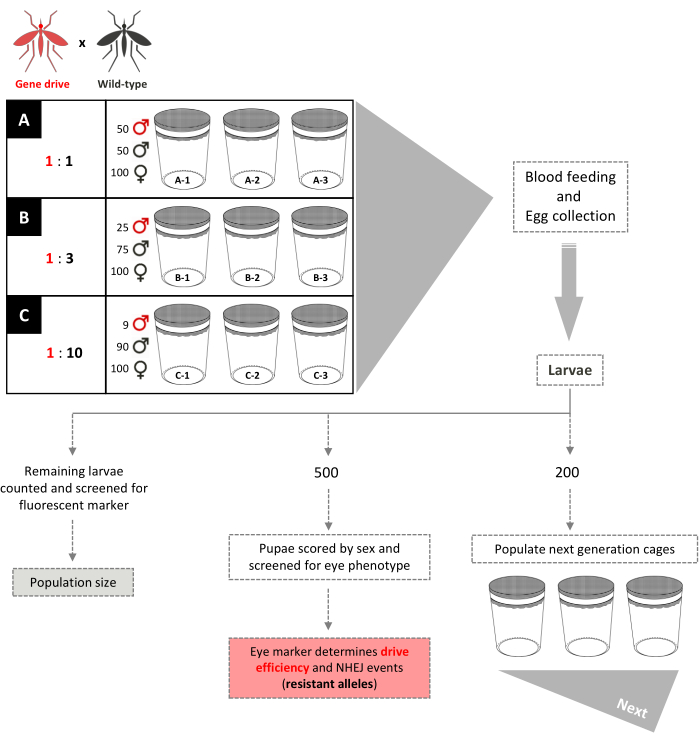
Graphique 5. Schéma d’essai en cage de forçage génétique ne se chevauchant pas. Neuf petites cages de 0,005 m3 sont aménagées en trois exemplaires en fonction de leurs rapports de libération mâle de type gene-drive:wild. Les cages avec un taux de libération mâle de 1: 1 ont 100 femelles de type sauvage, 50 mâles de type sauvage et 50 mâles de forçage génétique ajoutés. Les cages avec un taux de libération mâle de 1:3 ont 100 femelles de type sauvage, 75 mâles de type sauvage et 25 mâles de forçage génétique ajoutés. Le taux de libération mâle 1:10 des cages comprend 100 femelles de type sauvage, 90 mâles de type sauvage et 9 mâles de forçage génétique ajoutés. Les femelles reçoivent un repas de sang et des œufs sont collectés et éclos. Pour les cages 1:1 et 1:3, 200 larves sont sélectionnées au hasard et utilisées pour peupler de nouvelles cages, séparées de celles de leurs parents, pour la génération suivante. 500 larves supplémentaires sont sélectionnées au hasard et élevées en nymphes, lorsqu’elles sont dépistées pour le gène marqueur dominant. Les 500 nymphes sont ensuite élevées à l’âge adulte et notées par sexe. Toutes les larves restantes sont dépistées pour le marqueur. Pour les cages 1:10, toutes les larves sont notées en générations 1 à 12 et 200 larves reflétant la fréquence transgénique existante sont utilisées pour peupler de nouvelles cages. À partir de la génération 13, ces cages sont configurées de manière identique aux cages 1:1 et 1:3. Adapté de Pham et al. (2019) 2 et Carballar-Lejarazú et al. (2020) 3. Veuillez cliquer ici pour voir une version agrandie de cette figure.
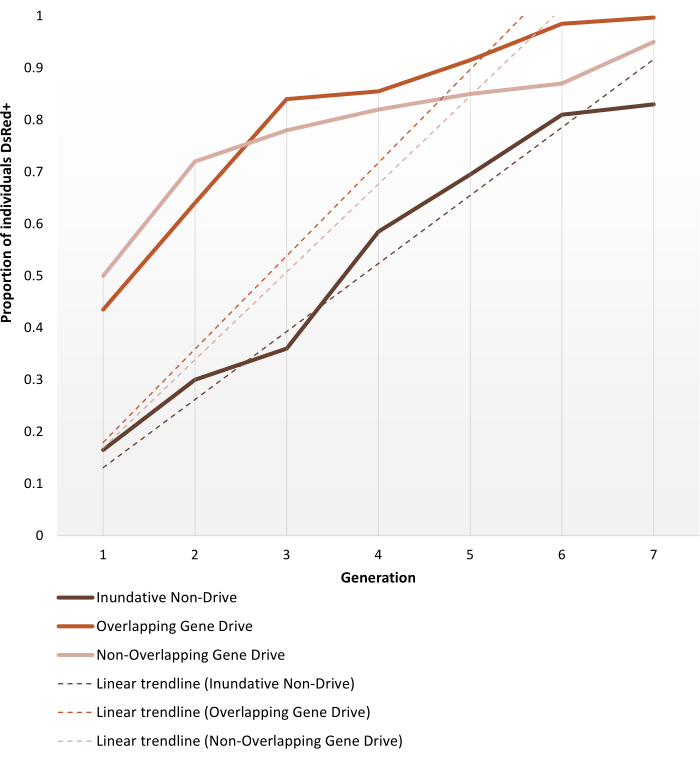
Graphique 6. Dynamique de fixation du transgène prédite pour les différents essais en cage de remplacement de population. Représentation de la dynamique phénotypique attendue des répliques les plus performantes pour chacune des expériences d’essais en cage réalisées par Pham et al. (2019) 2, surveillé sur 7 générations. Les expériences mises en place sont décrites dans les Protocoles. Les prédictions sont basées sur les données des 9 expériences sur les modèles de libération 1:1 (réplications triples pour chacun des trois protocoles d’essai en cage différents). L’axe X est le numéro de génération après l’introduction initiale et l’axe Y est la proportion de larves montrant le phénotype marqueur DsRed (DsRed+) au fil du temps. Les lignes pointillées représentent les courbes de tendance linéaires des données. Le phénotype DsRed+ résulte d’au moins une copie de l’allèle modifié. Par conséquent, les résultats reflètent la propagation du transgène, accélérée dans le système de forçage génétique, atteignant (presque) l’introduction complète à la fin de l’observation. Pour la variabilité entre les réplications et les données détaillées complètes sur les expériences, veuillez vous référer à Pham et al. (2019) 2, Carballar-Lejarazú R et al. (2020)3 et Adolfi A et al. (2020)4. Images adaptées de Pham TB et al. (2019) Modification expérimentale de la population du moustique vecteur du paludisme, Anopheles stephensi. PLOS Genet 15(12): e1008440. doi: 10.1371/journal.pgen.1008440, Adolfi A et al. (2020) Efficient population modification gene-drive rescue system in the malaria mosquito Anopheles stephensi. Nat Commun 11(1): 5553. doi: 10.1038/s41467-020-19426-0 et Carballar-Lejarazú R et al. (2020) Next-generation gene drive for population modification of the malaria vector mosquito, Anopheles gambiae. Proc Natl Acad Sci USA 117(37):22805-22814. doi: 10.1073/pnas.2010214117. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Dossier supplémentaire : La construction de la cage de la colonie de 0,005 m3. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Les moustiques génétiquement modifiés qui ont une capacité de blocage des agents pathogènes ou des gènes de stérilité des ours constituent de nouveaux outils pour lutter contre les maladies à transmission vectorielle. Compte tenu de la multiplicité des paramètres qui composent ces approches alternatives, une étape critique de leur recherche consiste en des évaluations expérimentales confinées en laboratoire qui permettent une prédiction rapide et sûre des résultats potentiels d’un rejet de transgène synthétique à des fins de contrôle1.
Étant donné que la surveillance de la dynamique des transgènes dans les populations en cage peut s’étendre sur plusieurs mois, l’un des aspects centraux des protocoles est la cohérence de la conception expérimentale entre les réplicats (y compris l’élevage des moustiques, la taille des cages, les populations structurées par âge, les taux de libération fixes, les sources de farine sanguine stables et les procédures de dépistage mini-invasives).
Les rejets réservés aux mâles sont considérés comme idéaux parce que les moustiques mâles ne transmettent pas d’agents pathogènes et ne se nourrissent pas d’humains, de sorte qu’ils peuvent introduire en toute sécurité des caractéristiques héréditaires dans les populations sauvages. Dans les expériences en cage de laboratoire, il est possible de détecter des souches transgéniques avec une compétitivité d’accouplement mâle réduite et d’autres charges de condition physique associées à l’intégration du transgène. Cependant, des expériences directes et spécifiques, telles que celles menées dans de grandes cages10, peuvent être menées pour analyser correctement la compétitivité masculine, ainsi que la fécondité féminine dans des densités de moustiques plus naturelles2. De plus, les données empiriques des essais en cage peuvent être utilisées pour paramétrer des modèles de dynamique des populations en cage, y compris la formation d’allèles résistants, et fournir des renseignements utiles sur l’efficacité et les ajustements possibles de la technologie proposée.
Les protocoles décrits ici peuvent être facilement adaptés à d’autres conceptions expérimentales selon les besoins, avec des exigences minimales concernant l’infrastructure et les conditions d’insectes réguliers. De plus, à l’exception des cages et des microscopes commerciaux, la plupart des matériaux sont peu coûteux et permettent de multiples répétitions et itérations à faible coût des essais. Notamment, cela permet également de présélectionner plusieurs souches transgéniques dans des essais en petites cages afin de donner la priorité aux candidats les plus performants à faire progresser dans la voie des tests progressifs et de suspendre les tests sur ceux qui présentent des performances sous-optimales.
Enfin, les préoccupations concernant l’utilisation d’organismes génétiquement modifiés motivent l’élaboration de cadres pour l’élaboration, l’évaluation et l’application de stratégies génétiques pour la prévention des maladies transmises par les moustiques5,8,9. La pertinence et l’exécution des protocoles définis ici sont conformes à ces lignes directrices.
Déclarations de divulgation
Les auteurs n’ont aucune divulgation.
Remerciements
Nous sommes reconnaissants à Drusilla Stillinger, Kiona Parker, Parrish Powell et Madeline Nottoli pour l’élevage des moustiques. Le financement a été fourni par l’Université de Californie Irvine Malaria Initiative. AAJ est professeur Donald Bren à l’Université de Californie à Irvine.
matériels
| Name | Company | Catalog Number | Comments |
| Artificial feeders | Hemotek | SP6W1-3 | Starter pack – 6 feeders with 3ml reservoirs |
| Cage, commercial | BioQuip | 1450D | Collapsible Cage, 24 X 24 X 24" - 0.216 m3 (60 cm3) |
| Cage tub (popcorn) | Amazon.com | VP170-0006 | 0.005 m3 (170 fl oz) |
| Dissecting microscope with fluorescence light and filters | Leica | M165FC | |
| Glue sticks | Michaels | 88646598807 | Gluesticks 40 pk, 0.4X4” |
| Hot glue gun | Woodwards Ace | 2382513 | Stanley, 40 watt, GR20 |
| Nylon screen (netting) | Joann.com | 1102912 | Tulle 108" Wide x 50 Yds - ~35.6 cm2 (14 in2) |
| Oviposition cups | Fisher | 259126 | Beaker PP grad 50 mL |
| Razor cutting tool | Office Depot | 487899 | Box cutters |
| Scissors | Office Depot | 978561 | Scotch Precision Ultra Edge Titanium Non-Stick Scissors, 8" |
| Stapler | Office Depot | 908194 | Swingline Commercial Desk Stapler |
| Surgical sleeve (stockinette) | VWR | 56612-664 | ~48 cm (19”) cut from bolt ~15 cm (6”) X ~23 m (25y) |
| Zip ties | Home Depot | 295715 | Pk of 100, 14” cable ties - 35.6 cm (14 in) |
Références
- Carballar-Lejarazú, R., James, A. A. Population modification of Anopheline species to control malaria transmission. Pathogens and Global Health. 111 (8), 424-435 (2017).
- Pham, T. B., et al. Experimental population modification of the malaria vector mosquito, Anopheles stephensi. PLOS Genetics. 15 (12), 1008440 (2019).
- Carballar-Lejarazú, R., et al. Next-generation gene drive for population modification of the malaria vector mosquito, Anopheles gambiae. Proceedings of the National Academy of Sciences. 117 (37), 22805-22814 (2020).
- Adolfi, A., et al. Efficient population modification gene-drive rescue system in the malaria mosquito Anopheles stephensi. Nature Communications. 11 (1), 5553 (2020).
- Akbari, O. S., et al. Safeguarding gene drive experiments in the laboratory. Science. 349 (6251), 927-929 (2015).
- Benedict, M. Q., et al. Recommendations for Laboratory Containment and Management of Gene Drive Systems in Arthropods. Vector-Borne and Zoonotic Diseases. 18 (1), 2-13 (2018).
- Adelman, Z., et al. Rules of the road for insect gene drive research and testing. Nature Biotechnology. 35 (8), 716-718 (2017).
- Long, K. C., et al. Core commitments for field trials of gene drive organisms. Science. 370 (6523), 1417-1419 (2021).
- Facchinelli, L., North, A. R., Collins, C. M., et al. Large-cage assessment of a transgenic sex-ratio distortion strain on populations of an African malaria vector. Parasites Vectors. 12, 70 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon