Method Article
Ensaios laboratoriais de pequenas gaiolas de mosquitos anofelina geneticamente modificados
Neste Artigo
Resumo
Os protocolos aqui relatados ilustram três maneiras alternativas de avaliar o desempenho de mosquitos geneticamente modificados destinados ao controle de vetores em pequenos ensaios de gaiolas em laboratório. Cada protocolo é adaptado à modificação específica que a cepa de mosquito carrega (unidade genética ou unidade não genética) e os tipos de parâmetros medidos.
Resumo
O controle de patógenos transmitidos por mosquitos usando vetores geneticamente modificados tem sido proposto como uma ferramenta promissora para complementar estratégias convencionais de controle. Os sistemas de acionamento genético baseados em CRISPR tornaram as tecnologias transgênicas mais acessíveis dentro da comunidade científica. A avaliação do desempenho do mosquito transgênico e as comparações com contrapartes do tipo selvagem em pequenos ensaios de gaiolas de laboratório fornecem dados valiosos para o desenho de experimentos subsequentes de gaiolas de campo e avaliações experimentais para refinar as estratégias de prevenção de doenças. Aqui, apresentamos três protocolos diferentes utilizados em ambientes laboratoriais para avaliar a disseminação transgênica em vetores de mosquitos anofelinos da malária. Estes incluem liberações inundativas (sem sistema de unidade genética) e ensaios de geração sobrepostos e não sobrepostos por genes. Os três ensaios variam em vários parâmetros e podem ser adaptados às configurações experimentais desejadas. Além disso, estudos inseticidas em gaiolas pequenas fazem parte da transição progressiva de insetos projetados do laboratório para liberações de campo aberto. Portanto, os protocolos aqui descritos representam ferramentas inestimáveis para fornecer valores empíricos que, em última análise, ajudarão na implementação em campo de novas tecnologias para a eliminação da malária.
Introdução
Estratégias baseadas em mosquitos geneticamente modificados estão sendo perseguidas para controlar a transmissão de patógenos transportados por vetores, como aqueles que causam malária1. Estas incluem tecnologias 1) destinadas a diminuir os números e densidades dos mosquitos Anofelinos (supressão populacional), ou 2) destinadas a prejudicar a capacidade dos vetores de transmitir parasitas responsáveis por doenças humanas (modificação populacional, substituição ou alteração) em que cepas de vetores são projetadas para expressar genes efeitos que previnem a transmissão de patógenos. Essas abordagens genéticas foram reforçadas pelo advento de unidades genéticas baseadas em CRISPR/Cas9, com provas de conceito em mosquitos transmissores de parasitas de propagação efetiva de traços de carga, bem como moléculas de efeitos anti-parasitários em populações enjauladas.
Pequenos ensaios de gaiolas de laboratório representam um primeiro passo para avaliar a característica das cepas transgênicas como parte de uma abordagem em fases para seu desenvolvimento adicional para aplicações de campo2. Considerações específicas de desfecho incluem herdabilidade do DNA introduzido em um ambiente competitivo, penetração e expressividade do fenótipo e estabilidade. Características de design experimental relevantes incluem o tamanho das gaiolas, densidades de mosquitos, número de réplicas, gerações sobrepostas ou não sobrepostas, populações-alvo estruturadas por idade, liberações únicas ou múltiplas de cepas projetadas, liberações somente para mulheres, somente para mulheres ou mistos, proporções de liberação, fontes de farinha de sangue (animais artificiais ou vivos) e procedimentos de triagem.
Descrevemos aqui protocolos usados para avaliar cepas de mosquitos anofelinos para liberações inundativas (sem sistema de acionamento genético) e aqueles que carregam sistemas autônomos de acionamento genético mediados por endonucleases Cas9 e guiam RNAs (gRNA). As aplicações desses protocolos aparecem em Pham et al. (2019) 2, Carballar-Lejarazú et al. (2020) 3, e Adolfi et al. (2020) 4.
Ensaios de liberação inundativa avaliam a taxa de disseminação de um transgênico projetado sob herança mendeliana após múltiplas liberações de um grande número de mosquitos transgênicos em uma população selvagem. Sem a ligação do transgene a um sistema de acionamento, dados de ensaios de liberação inundativa fornecem informações sobre a aptidão e dinâmica do transgene de interesse em uma população estabilizada.
Quando as populações de mosquitos contêm um sistema autônomo de acionamento genético, pequenos ensaios de gaiolas são projetados para avaliar a dinâmica da disseminação do transgene desejado, determinando a taxa de aumento de marcadores dominantes após uma única introdução de machos transgênicos. Elementos autônomos de unidade genética carregam os genes codificando a nuclease Cas9, gRNA e marcador dominante ligados de forma a ser ativo nas gerações seguintes.
Gerações "sobrepostas" referem-se à presença simultânea de várias gerações na mesma gaiola para criar uma população contínua estruturada por idade, enquanto "não sobreposta" refere-se a gerações únicas e discretas em cada população enjaucida consecutiva2. Os experimentos da gaiola de acionamento genético podem ser encerrados uma vez que a dinâmica inicial da taxa de unidade (conversão) pode ser determinada (8-10 gerações dependendo da construção), e embora forneçam informações sobre a estabilidade de curto prazo do transgene dentro da população de mosquitos, eles podem não revelar o que acontece quando e se as frequências de marcador dominantes atingem ou estão perto da introdução completa (cada mosquito carregando pelo menos uma cópia do sistema de acionamento genético).
Protocolo
Declaração de ética animal
Este estudo foi realizado em estrita conformidade com as recomendações do Guia de Cuidado e Uso de Animais de Laboratório dos Institutos Nacionais de Saúde. Os protocolos foram aprovados pelos Comitês Institucionais de Cuidados e Uso de Animais da Universidade da Califórnia (Números de Garantia do Bem-Estar Animal A3416.01).
1. Ensaios de liberação inundativa em mosquitos não-genéticos (Figura 1)
- Configuração e manutenção da gaiola
- Configure três conjuntos de gaiolas triplicadas de 0,216 m3 adicionando 60 larvas do tipo selvagem (WT) em cada gaiola ao longo de três semanas consecutivas.
NOTA: Não é possível determinar o sexo de larvas de segunda instar por microscopia leve, de modo que as amostras adicionadas a cada gaiola consistirão tanto em machos quanto em fêmeas. - A cada semana, forneça fêmeas adultas em cada gaiola com camundongos anestesiados como fonte de farinha de sangue (Figura 2A) e um recipiente de oviposição 3 dias após a farinha de sangue.
NOTA: Embora um aparelho de alimentação artificial alternativo possa ser usado, fornecer camundongos anestoizados vivos para farinhas de sangue resulta em melhor desempenho de alimentação de mosquitos nestes grandes formatos de gaiola (0,216 m3). Isso requer um protocolo de uso animal aprovado e aprovação relevante (por exemplo, Comitê Institucional de Cuidados e Uso de Animais, IACUC) para o uso de camundongos.
NOTA: Ratos individuais são anestesiados com uma mistura de 4 mg/ketamina de rato HCl e 0,4 mg/xilazina de rato. Os animais são injetados entre 0,1 - 0,5 mL desta mistura. - Chocar ovos de cada gaiola semanalmente e selecionar 60 larvas instar (L2) aleatoriamente para serem devolvidos às suas respectivas gaiolas para compensar a mortalidade (semanas 4-8).
NOTA: As etapas 1.1.1 a 1.1.3 são necessárias para estabelecer uma população estável e distribuída estruturada por idade nas gaiolas - denominada 'Fase Inicial'. - Na semana 9, atribuem gaiolas montadas na etapa 1.1.1 aleatoriamente em triplicados para liberação da razão de liberação masculina desejada.
- Designe um conjunto de gaiolas triplicadas como controles para avaliar a consistência durante todo o experimento.
- Designe um conjunto de triplicados para cada razão de liberação desejada (por exemplo, 1:1 ou 1:0.1 machos transgênicos:WT).
NOTA: Este ponto é chamado de "Fase Experimental".
- Configure três conjuntos de gaiolas triplicadas de 0,216 m3 adicionando 60 larvas do tipo selvagem (WT) em cada gaiola ao longo de três semanas consecutivas.
- Réplicas e relações de liberação
- Adicione 60 pupas WT (30 machos e 30 fêmeas) às gaiolas de controle semanalmente.
- Para manter uma proporção de 1:1, adicione uma pupa masculina transgênica semanal de 30, juntamente com 60 (30 machos e 30 fêmeas) pupas WT em cada gaiola respectiva.
- Para manter uma proporção de 1:0.1, adicione a pupa masculina transgênica semanal 300, juntamente com 60 (30 machos e 30 fêmeas) pupas WT em cada gaiola respectiva.
NOTA: A continuação da adição de mosquitos selvagens às gaiolas mantém a densidade da gaiola, que deverá diminuir semanalmente devido à mortalidade adulta relacionada à idade.
- Triagem de fenótipos
- Selecione um total de 300 larvas de cada gaiola aleatoriamente. Com o uso de um microscópio estéreo equipado com filtros de fluorescência, tela para a expressão do marcador dominante fluorescente nos estágios larval e pupal e pontuação do sexo dos adultos resultantes (Figura 3).
NOTA: A triagem fenotípica dependerá do marcador dominante incluído na construção transgênica integrada aos mosquitos (por exemplo, discosoma sp. proteína fluorescente vermelha [DsRed], proteína fluorescente de ciano [CFP], proteína fluorescente verde [GFP]), e sobre o promotor que conduz sua expressão (a mais usada na transgenese do mosquito é a expressão de condução promotora 3xP3 nos olhos e cordão nervoso). - Siga este protocolo por quantas gerações for exigido pelos parâmetros de resultado definidos no projeto experimental.
NOTA: O ensaio é geralmente encerrado quando todos os mosquitos têm pelo menos uma cópia do transgene (determinada pela presença do marcador fluorescente dominante) ou a razão de mosquitos transgênicos para WT em uma gaiola é estabilizada e não flutua muito após algumas (3-5) gerações.
- Selecione um total de 300 larvas de cada gaiola aleatoriamente. Com o uso de um microscópio estéreo equipado com filtros de fluorescência, tela para a expressão do marcador dominante fluorescente nos estágios larval e pupal e pontuação do sexo dos adultos resultantes (Figura 3).
2. Ensaios de geração sobreposta de mosquitos de acionamento genético (Figura 4)
NOTA: Os mosquitos que possuem sistemas de acionamento genético exigem protocolos escritos e revisados e devem ser aprovados por um Comitê de Biossegurança Institucional (IBC) ou equivalente, e outros, quando necessário. A contenção do mosquito (nível ACL 2+) deve seguir os procedimentos recomendados5,6,7. Especificamente, os experimentos de unidade genética devem empregar duas estratégias de confinamento rigorosas. A primeira geralmente são barreiras físicas (Estratégia de Barreira) entre organismos e meio ambiente. Isso requer ter um procedimento operacional inseticário e padrão seguro (incluindo monitoramento) para garantir que os mosquitos não possam escapar. A segunda estratégia de confinamento pode ser Molecular, Ecológica ou Reprodutiva5.
- Configuração da gaiola
- Configure dois conjuntos de gaiolas triplicadas de 0,216 m3 para cada relação de liberação transgênica:WT desejada.
- Para alcançar uma razão de liberação masculina de 1:1, adicione 120 machos transgênicos, 120 machos WT e 120 fêmeas WT na fase pupa para cada gaiola de replicação.
- Para alcançar uma razão de liberação de 1:10, adicione 12 machos transgênicos, 120 machos WT e 120 fêmeas WT no estágio pupa para cada gaiola de replicação.
NOTA: Diferentes proporções de liberação podem ser testadas (1:1, 1:3, 1:10, etc.) e o número de mosquitos usados para iniciar os experimentos varia de acordo. No entanto, é importante considerar os efeitos dos números baixos na avaliação estatística dos dados.
- Configure dois conjuntos de gaiolas triplicadas de 0,216 m3 para cada relação de liberação transgênica:WT desejada.
- Manutenção e triagem populacional
- Forneça fêmeas de 4 a 7 dias em cada gaiola com uma refeição sanguínea usando camundongos anestesiados (Figura 2A).
- Três dias após a refeição sanguínea, insira um recipiente de oviposição em cada gaiola.
- Eclode ovos em uma bandeja larval, selecione ~240 primeiras larvas instar (L1) aleatoriamente de cada gaiola, crie-os até a idade adulta e devolva-os às suas respectivas gaiolas.
- Fornecer refeições sanguíneas adicionais (2-3) a cada 3-4 dias para os adultos recém-emergido, conforme descrito na etapa 2.2.1.
NOTA: Nenhum macho transgênico adicional é adicionado durante qualquer uma das gerações subsequentes. - Selecione um total de 300 larvas de cada gaiola aleatoriamente e trie-as para a presença do fenótipo marcador dominante nos estágios larval e pupal usando um microscópio estereo estéreo de fluorescência e escore adultos emergentes para sexo (Figura 3).
NOTA: Como antes, a triagem fenotípica dependerá do marcador e promotor dominante incluídos no sistema de acionamento genético e integrados aos mosquitos transgênicos (por exemplo, DsRed, CFP ou GFP). Se rupturas homozigosas ou heteroallélicas dos genes alvo resultarem em um fenótipo visível (por exemplo, genes relacionados à pigmentação ocular), a triagem desse traço dependerá de qual estágio é mais fácil visualizar o fenótipo alterado. - Siga este protocolo por quantas gerações for exigido pelos parâmetros de resultado definidos no projeto experimental.
NOTA: Cada geração (delimitada pela refeição de sangue) leva ~três semanas. O ensaio é geralmente encerrado quando todos os mosquitos são considerados homozigos para a construção de unidades genéticas ou as populações estabilizam em uma porcentagem máxima de mosquitos carregando pelo menos uma cópia da construção de unidade genética.
3. Ensaios de geração não sobrepostas de mosquitos de acionamento genético (Figura 5).
- Configuração da gaiola
- Configure populações de gaiolas triplicadas de 0,005 m3 para cada razão específica de liberação de transgênicos para homens de 2008 a serem investigados (por exemplo, três conjuntos de gaiolas triplicadas cada uma configurada com 1:1, 1:3, 1:10 relações de liberação). Montar todas as gaiolas com um número total igual de machos e fêmeas.
NOTA: O Arquivo Suplementar é um vídeo que demonstra a construção da gaiola da colônia de 0,005 m3 .- Adicione 50 machos transgênicos, 50 machos WT e 100 fêmeas WT a cada uma das três gaiolas de réplica para alcançar uma razão de liberação masculina de 1:1.
- Adicione 25 machos transgênicos, 75 machos WT e 100 fêmeas WT a cada uma das três gaiolas de réplica para alcançar uma razão de liberação masculina de 1:3.
- Adicione 9 machos transgênicos, 90 machos WT e 100 fêmeas WT a cada uma das três gaiolas de réplica para alcançar uma razão de liberação masculina de 1:10.
NOTA: Diferentes proporções de liberação podem ser testadas e o número de mosquitos usados para iniciar os experimentos pode variar de acordo. No entanto, é importante considerar o impacto do baixo número de mosquitos nas análises estatísticas. São lançamentos individuais; nenhum macho transgênico adicional é adicionado em qualquer geração subsequente.
- Configure populações de gaiolas triplicadas de 0,005 m3 para cada razão específica de liberação de transgênicos para homens de 2008 a serem investigados (por exemplo, três conjuntos de gaiolas triplicadas cada uma configurada com 1:1, 1:3, 1:10 relações de liberação). Montar todas as gaiolas com um número total igual de machos e fêmeas.
- Manutenção e triagem populacional
- Forneça às fêmeas de 4 a 7 dias de idade em cada gaiola refeições sanguíneas usando um aparelho de alimentação artificial (Figura 2B) em dois dias consecutivos.
NOTA: As refeições de sangue de rotina para as fêmeas consistem em uma fonte comercialmente disponível de sangue (por exemplo, sangue de bezerro) fornecida a partir de um aparelho de alimentação. Ratos anestesiados vivos são usados apenas para fornecer farinhas de sangue em formatos maiores (0,216 m3) de gaiola para melhor desempenho alimentar. - Adicione um recipiente de oviposição 3 dias após a segunda farinha de sangue. Após três dias, remova os recipientes de oviposição.
NOTA: Nesta etapa, 5-10 fêmeas podem ser selecionadas aleatoriamente de cada gaiola e colocadas individualmente em frascos para avaliar parâmetros adicionais de aptidão, como fertilidade e fecundidade, se necessário. - Pontuação por sexo todos os adultos (vivos e mortos) permanecendo na gaiola e armazená-los a -80°C para análise molecular.
- Eclode ovos e selecione aleatoriamente 200 larvas L1 das gaiolas de proporção 1:1 e 1:3 para povoar novas gaiolas para a próxima geração.
NOTA: Devido à baixa frequência de indivíduo transgênico inicial nas gaiolas de proporção de 1:10, a amostragem aleatória pode levar à perda excessiva de progênero transgênico na próxima geração para continuar a população. - Para garantir uma amostragem precisa para as gaiolas 1:10 e número suficiente de mosquitos transgênicos, trie todas as larvas para o marcador dominante e selecione 200 larvas refletindo a frequência transgênica observada para povoar as novas gaiolas.
NOTA: As gaiolas 1:10 podem ser mantidas de forma idêntica às gaiolas 1:1 e 1:3 quando atingem uma frequência transgênica de ≥80%. - Selecione 500 larvas de cada gaiola aleatoriamente para uma análise aprofundada. Tela sob um microscópio estéreo de fluorescência para os fenótipos marcadores esperados nos estágios larval e pupal e escorar sexo de adultos (Figura 3).
NOTA: Fenótipos 'excepcionais' podem ser selecionados para serem mais cruzados e analisados molecularmente para monitorar a formação de alelos resistentes. - Este protocolo pode ser seguido por quantas gerações são exigidos pelos parâmetros de resultado definidos no projeto experimental.
NOTA: Cada geração é delimitada pela farinha de sangue e leva ~três semanas. O ensaio é geralmente encerrado quando todos os mosquitos são considerados homozigos para a construção de unidades genéticas ou populações estabilizam a uma prevalência máxima de mosquitos transgênicos. E como antes, a triagem de fenótipos dependerá dos marcadores dominantes e promotores integrados nos mosquitos transgênicos (por exemplo, DsRed, CFP, GFP) ou nos genes alvo se apresentarem um fenótipo visível (por exemplo, genes relacionados à pigmentação ocular).
- Forneça às fêmeas de 4 a 7 dias de idade em cada gaiola refeições sanguíneas usando um aparelho de alimentação artificial (Figura 2B) em dois dias consecutivos.
Resultados
Mosquitos anofelinos transgênicos gerados para suportar acionamento não-genético ou modificações autônomas de unidade genética são configurados para ensaios de gaiola, conforme descrito na seção Protocolos. Os resultados representativos aqui apresentados retratam a dinâmica do fenótipo das réplicas de melhor desempenho de cada um dos experimentos de ensaios da gaiola realizados por Pham et al. (2019) 2 para os mosquitos Anopheles stephensi . Os três ensaios (1 -3, respectivamente: unidade não-genética inundativa, sobreposição de genes e unidade genética não sobreposta) variaram em diferentes parâmetros, como o tamanho da gaiola (0,216 m3 vs 0,005 m3), se a população-alvo era estruturada ou não, fonte de farinha de sangue (camundongos ou alimentador artificial) e razões de liberação. Como forma de representação, a Figura 6 exibe os dados observados selecionados da mesma razão de liberação (1:1) para todos os três protocolos utilizados, ao longo de sete gerações.
A versão 1:1 sem drive atinge >80% de introdução transgênica dentro de 6-7 gerações. Para ensaios de gaiola transgênica de unidade genética, as versões 1:1 em ambos os protocolos não sobrepostos e sobrepostos atingem esse nível dentro de 3-4 gerações, validando assim a expectativa de que uma única liberação de um sistema de acionamento genético pode ser mais eficiente do que as liberações inundativas não-drive para introdução transgênica. A trajetória mais rápida também pode ser confirmada pela inclinação das linhas de tendência. Ambos os protocolos de unidade genética, apesar de configurações diferentes, apresentam ângulos semelhantes e tendências de inclinação. Ao final da observação, as gaiolas não-drive atingem ~80% dos indivíduos portadores do transgene, enquanto as gaiolas com indivíduos de unidade genética atingem introdução completa (ou quase completa). Dados completos e detalhes de processamento sobre os resultados individuais do experimento usando os protocolos descritos aqui podem ser encontrados nas Figuras 1-3 de Pham et al. (2019) 2, Figuras 2-3 de Carballar-Lejarazú et al. (2020) 3 e Figura 3 de Adolfi et al. (2020) 4.
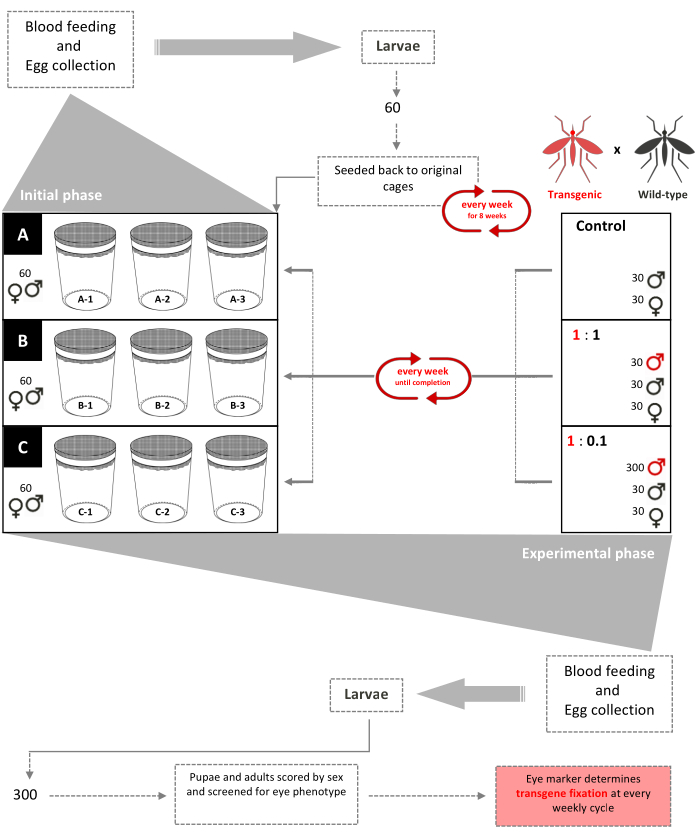
Figura 1. Esquema de teste de liberação inundativa não drive. Nove gaiolas de 0,216 m3 são montadas com 60 larvas de segunda instar (sexos mistos) do tipo selvagem adicionadas a cada uma. A partir da semana 3, as fêmeas recebem uma farinha de sangue semanalmente e os ovos são coletados e eclodidos. Até a semana 8, 60 larvas são selecionadas aleatoriamente e devolvidas às suas respectivas gaiolas semanalmente para criar uma população estruturada por idade nas gaiolas (fase inicial). No início da semana 9, as nove gaiolas são aleatoriamente atribuídas em triplicado de acordo com suas relações de liberação masculina transgênicas (fase experimental). As gaiolas A (Controle) não têm pupae transgênica adicionada. As fêmeas recebem uma farinha de sangue semanalmente e os ovos são coletados, eclodidos e criados para pupas. 30 pupas machos e 30 fêmeas são adicionadas de volta às suas gaiolas. As gaiolas 1:1 têm mais 30 pupas transgênicas machos adicionadas. As gaiolas 1:0.1 têm mais 300 pupas machos transgênicas adicionadas. 300 larvas de cada uma das 9 gaiolas são selecionadas aleatoriamente e rastreadas para o marcador fluorescente. Este procedimento foi repetido semanalmente até a fixação transgênica (razão estabilizada de mosquitos transgênicos-selvagens após algumas gerações). Adaptado de Pham et al. (2019) 2. Clique aqui para ver uma versão maior desta figura.

Figura 2. Alimentação sanguínea de populações de gaiolas. (A) Camundongos anestesiados ou (B) Alimentadores de sangue Hemotek são oferecidos para alimentar os mosquitos fêmeas nas gaiolas de 0,216 m3 ou nas pequenas gaiolas de 0,005 m3 , respectivamente. Clique aqui para ver uma versão maior desta figura.

Figura 3. Rastreando fenótipos para ensaios de gaiola de não-drive, sobreposição de genes e ensaios de gaiola de acionamento genético não sobrepostos. Imagens fluorescentes de uma larva, pupa e adulto de fenótipos transgênicos ou selvagens. Neste exemplo, os indivíduos de An. stephensi foram examinados para o marcador DsRed conduzido pelo promotor 3xP3 nos olhos (DsRed+ ou DsRed-), visível nos três estágios, e os adultos foram selecionados para sexo ( ♀ ou ♂ ). Observe a fluorescência de fundo em larvas do tipo selvagem associadas ao bolus de alimentos no midgut. Clique aqui para ver uma versão maior desta figura.
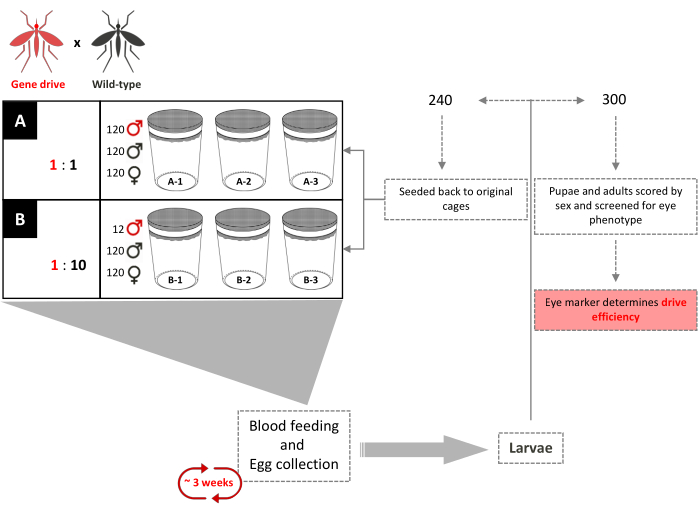
Figura 4. Sobreposição de genes-drive cage esquema de ensaio. Seis gaiolas de 0,216 m3 são montadas em triplicado de acordo com suas relações de liberação masculina do tipo selvagem. 120 machos do tipo selvagem e 120 fêmeas do tipo selvagem foram adicionados a cada gaiola. Gaiolas com uma razão de liberação masculina de 1:1 gene-drive tiveram um adicional de 120 machos transgênicos adicionados. Gaiolas com uma razão de liberação masculina de 1:10 tiveram um adicional de 12 machos transgênicos adicionados. Até a introdução completa do transgene, a cada 3 semanas, fêmeas adultas são fornecidas com farinhas de sangue e ovos são coletados e eclodidos. Um total de 240 larvas foram selecionadas aleatoriamente e devolvidas às suas respectivas gaiolas. 300 (300) larvas são selecionadas aleatoriamente e rastreadas para o marcador dominante. Eles são mais tarde selecionados como pupas e adultos para a cor dos olhos e sexo. Nenhum macho transgênico adicional é adicionado às gaiolas originais. Adaptado de Pham et al. (2019) 2. Clique aqui para ver uma versão maior desta figura.
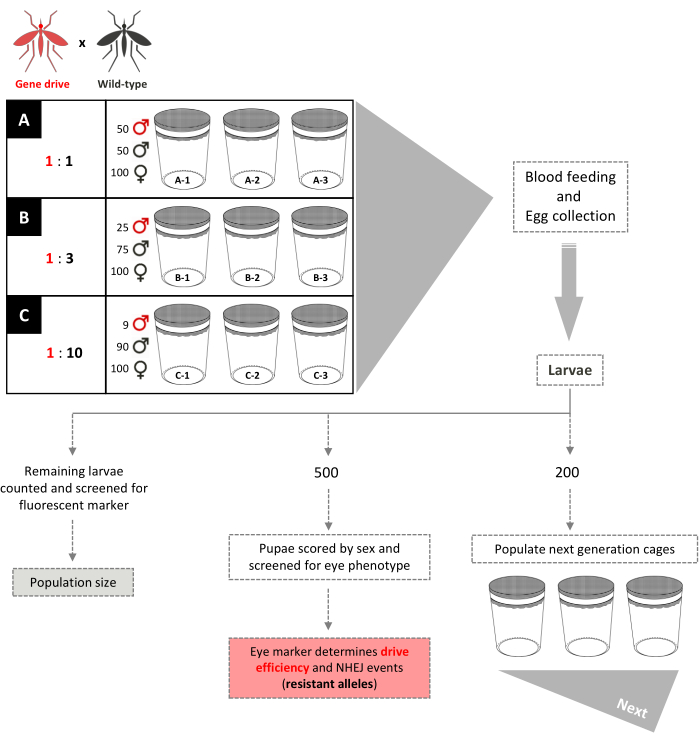
Figura 5. Esquema de ensaio de gaiola de unidade genética não sobreposto. Nove pequenas gaiolas de 0,005 m3 são montadas em triplicado de acordo com suas relações de liberação masculina do tipo selvagem. Gaiolas com uma proporção de liberação masculina 1:1 têm 100 fêmeas do tipo selvagem, 50 machos do tipo selvagem e 50 machos de unidade genética adicionados. Gaiolas com uma proporção de liberação masculina de 1:3 têm 100 fêmeas do tipo selvagem, 75 machos do tipo selvagem e 25 machos de unidade genética adicionados. As gaiolas 1:10 a proporção de libertação masculina tem 100 fêmeas do tipo selvagem, 90 machos do tipo selvagem e 9 machos de unidade genética adicionados. As fêmeas recebem uma refeição de sangue e ovos coletados e eclodidos. Para 1:1 e 1:3 gaiolas, 200 larvas são selecionadas aleatoriamente e usadas para povoar novas gaiolas, separadas das de seus pais, para a próxima geração. Mais 500 larvas são selecionadas aleatoriamente e criadas para pupas, quando são rastreadas para o gene marcador dominante. As 500 pupas são então criadas para adultos e pontuadas por sexo. Todas as larvas restantes são rastreadas para o marcador. Para as gaiolas de 1:10, todas as larvas são pontuadas nas gerações 1-12 e 200 larvas que refletem a frequência transgênica existente são usadas para povoar novas gaiolas. A partir da geração 13, essas gaiolas são montadas de forma idêntica às gaiolas 1:1 e 1:3. Adaptado de Pham et al. (2019) 2 e Carballar-Lejarazú et al. (2020) 3. Clique aqui para ver uma versão maior desta figura.
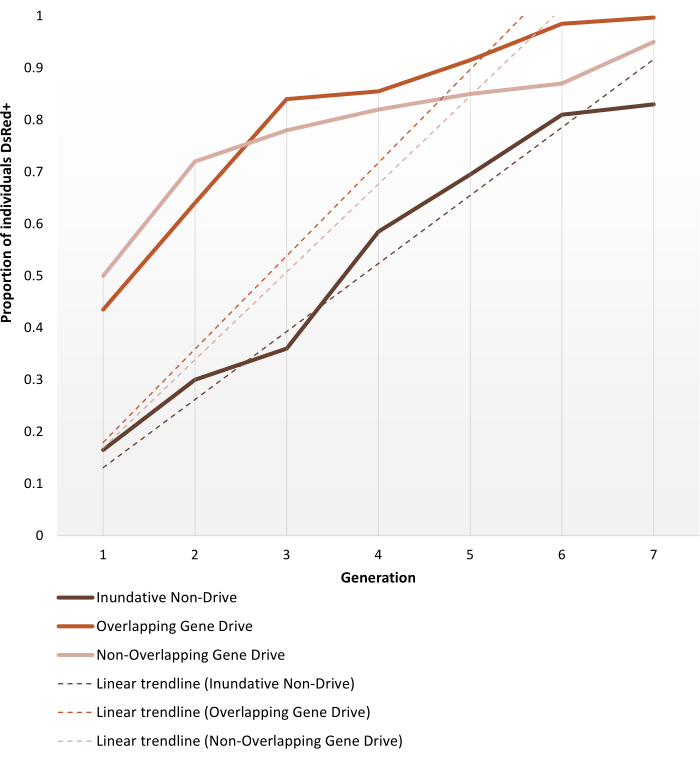
Figura 6. Dinâmica de fixação transgênica prevista para os diferentes ensaios de gaiola de substituição populacional. Representação da dinâmica esperada do fenótipo das réplicas de melhor desempenho para cada um dos experimentos de ensaios da gaiola realizados por Pham et al. (2019) 2, monitorado ao longo de 7 gerações. As configurações de experimentos são descritas nos Protocolos. As previsões são baseadas em dados de todos os 9 experimentos nos modelos de lançamento 1:1 (triplicate replica para cada um dos três protocolos de ensaio de gaiola diferentes). O eixo X é o número de geração após a introdução inicial e o eixo Y é a proporção de larvas mostrando o fenótipo de marcador DsRed (DsRed+) ao longo do tempo. As linhas tracejadas representam linhas de tendência lineares dos dados. O fenótipo DsRed+ resulta de ter pelo menos uma cópia do alelo modificado. Assim, os resultados refletem a disseminação do transgene, acelerado no sistema de acionamento genético, atingindo (perto) a introdução completa no final da observação. Para a variabilidade entre as réplicas e os dados completos detalhados sobre os experimentos, consulte Pham et al. (2019) 2, Carballar-Lejarazú R et al. (2020)3 e Adolfi A et al. (2020)4. Imagens adaptadas de Pham TB et al. (2019) Modificação populacional experimental do mosquito vetor da malária, Anopheles stephensi. PLOS Genet 15(12): e1008440. doi: 10.1371/journal.pgen.1008440, Adolfi A et al. (2020) Eficiente sistema de resgate de genes de modificação populacional no mosquito da malária Anopheles stephensi. Nat Commun 11(1): 5553. doi: 10.1038/s41467-020-19426-0 e Carballar-Lejarazú R et al. (2020) Unidade genética de última geração para modificação populacional do mosquito vetor da malária, Anopheles gambiae. Proc Natl Acad Sci USA 117(37):22805-22814. doi: 10.1073/pnas.2010214117. Clique aqui para ver uma versão maior desta figura.
Arquivo Suplementar: A construção da gaiola colônia de 0,005 m3. Clique aqui para baixar este Arquivo.
Discussão
Mosquitos geneticamente modificados que têm capacidade de bloqueio de patógenos ou genes de esterilidade constituem novas ferramentas para controlar doenças transmitidas por vetores. Dada a multiplicidade de parâmetros que compõem essas abordagens alternativas, um passo crítico em suas pesquisas consiste em avaliações experimentais confinadas em laboratório que permitem uma previsão rápida e segura dos resultados potenciais de uma liberação sintética de transgene para fins de controle1.
Como o monitoramento da dinâmica transgênica em populações enjauladas pode se estender por vários meses, um dos aspectos centrais dos protocolos é a consistência no design experimental entre as réplicas (incluindo criação de mosquitos, tamanho da gaiola, populações estruturadas por idade, relações de liberação fixa, fontes estáveis de farinha de sangue e procedimentos de triagem minimamente invasivos).
As liberações somente para homens são consideradas ideais porque os mosquitos machos não transmitem patógenos nem se alimentam de humanos, portanto, eles podem introduzir com segurança características hereiáveis em populações selvagens. Em experimentos de gaiolas de laboratório, é possível detectar cepas transgênicas com redução da competitividade do acasalamento masculino e outras cargas de aptidão associadas à integração transgênica. No entanto, experimentos diretos e específicos, como os realizados em gaiolas de grande porte10, podem ser realizados para analisar adequadamente a competitividade masculina, bem como a fecundidade feminina em densidades mais naturais de mosquitos2. Além disso, os dados empíricos dos ensaios da gaiola podem ser usados para parametrizar modelos de dinâmica populacional da gaiola, incluindo formação de alelo resistente, e fornecer informações úteis sobre eficácia e possíveis ajustes na tecnologia proposta.
Os protocolos aqui descritos podem ser facilmente adaptados a outros projetos experimentais conforme necessário, com requisitos mínimos em relação à infraestrutura e condições regulares dos insetos. Além disso, com exceção das gaiolas comerciais e microscópios, a maioria dos materiais são baratos e permitem múltiplas réplicas e iterações de baixo custo dos ensaios. Notavelmente, isso também permite que várias cepas transgênicas sejam pré-triadas em pequenos ensaios de gaiola, a fim de priorizar candidatos de melhor desempenho para serem movidos adiante na via de teste em fases e suspender os testes naqueles que apresentam desempenhos sub-ótimos.
Por fim, a preocupação com o uso de organismos geneticamente modificados motiva a elaboração de estruturas para o desenvolvimento, avaliação e aplicação de estratégias genéticas de prevenção de doenças transmitidas por mosquitos5,8,9. A relevância e execução dos protocolos aqui definidos são consistentes com essas diretrizes.
Divulgações
Os autores não têm revelações.
Agradecimentos
Somos gratos a Drusilla Stillinger, Kiona Parker, Parrish Powell e Madeline Nottoli pela criação de mosquitos. O financiamento foi fornecido pela Iniciativa irvine de malária da Universidade da Califórnia. AAJ é um professor donald bren na Universidade da Califórnia, Irvine.
Materiais
| Name | Company | Catalog Number | Comments |
| Artificial feeders | Hemotek | SP6W1-3 | Starter pack – 6 feeders with 3ml reservoirs |
| Cage, commercial | BioQuip | 1450D | Collapsible Cage, 24 X 24 X 24" - 0.216 m3 (60 cm3) |
| Cage tub (popcorn) | Amazon.com | VP170-0006 | 0.005 m3 (170 fl oz) |
| Dissecting microscope with fluorescence light and filters | Leica | M165FC | |
| Glue sticks | Michaels | 88646598807 | Gluesticks 40 pk, 0.4X4” |
| Hot glue gun | Woodwards Ace | 2382513 | Stanley, 40 watt, GR20 |
| Nylon screen (netting) | Joann.com | 1102912 | Tulle 108" Wide x 50 Yds - ~35.6 cm2 (14 in2) |
| Oviposition cups | Fisher | 259126 | Beaker PP grad 50 mL |
| Razor cutting tool | Office Depot | 487899 | Box cutters |
| Scissors | Office Depot | 978561 | Scotch Precision Ultra Edge Titanium Non-Stick Scissors, 8" |
| Stapler | Office Depot | 908194 | Swingline Commercial Desk Stapler |
| Surgical sleeve (stockinette) | VWR | 56612-664 | ~48 cm (19”) cut from bolt ~15 cm (6”) X ~23 m (25y) |
| Zip ties | Home Depot | 295715 | Pk of 100, 14” cable ties - 35.6 cm (14 in) |
Referências
- Carballar-Lejarazú, R., James, A. A. Population modification of Anopheline species to control malaria transmission. Pathogens and Global Health. 111 (8), 424-435 (2017).
- Pham, T. B., et al. Experimental population modification of the malaria vector mosquito, Anopheles stephensi. PLOS Genetics. 15 (12), 1008440 (2019).
- Carballar-Lejarazú, R., et al. Next-generation gene drive for population modification of the malaria vector mosquito, Anopheles gambiae. Proceedings of the National Academy of Sciences. 117 (37), 22805-22814 (2020).
- Adolfi, A., et al. Efficient population modification gene-drive rescue system in the malaria mosquito Anopheles stephensi. Nature Communications. 11 (1), 5553 (2020).
- Akbari, O. S., et al. Safeguarding gene drive experiments in the laboratory. Science. 349 (6251), 927-929 (2015).
- Benedict, M. Q., et al. Recommendations for Laboratory Containment and Management of Gene Drive Systems in Arthropods. Vector-Borne and Zoonotic Diseases. 18 (1), 2-13 (2018).
- Adelman, Z., et al. Rules of the road for insect gene drive research and testing. Nature Biotechnology. 35 (8), 716-718 (2017).
- Long, K. C., et al. Core commitments for field trials of gene drive organisms. Science. 370 (6523), 1417-1419 (2021).
- Facchinelli, L., North, A. R., Collins, C. M., et al. Large-cage assessment of a transgenic sex-ratio distortion strain on populations of an African malaria vector. Parasites Vectors. 12, 70 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados