Method Article
Лабораторные испытания генетически модифицированных анофелиновых комаров в малой клетке
В этой статье
Резюме
Протоколы, представленные здесь, иллюстрируют три альтернативных способа оценки эффективности генетически модифицированных комаров, предназначенных для борьбы с переносчиками в лабораторных испытаниях в небольших клетках. Каждый протокол адаптирован к конкретной модификации штамма комара (генный драйв или негенный драйв) и типам измеряемых параметров.
Аннотация
Борьба с переносимыми комарами патогенами с использованием генетически модифицированных переносчиков была предложена в качестве перспективного инструмента в дополнение к традиционным стратегиям борьбы. Системы самонаведения генов на основе CRISPR сделали трансгенные технологии более доступными в научном сообществе. Оценка эффективности трансгенных комаров и сравнение с аналогами дикого типа в небольших лабораторных испытаниях в клетках дают ценные данные для разработки последующих полевых экспериментов в клетках и экспериментальных оценок для уточнения стратегий профилактики заболеваний. Здесь мы представляем три различных протокола, используемых в лабораторных условиях для оценки распространения трансгенов у анофелиновых комаров-переносчиков малярии. К ним относятся индовые высвобождения (без системы генного драйва) и перекрывающиеся и неперекрывающиеся испытания генерации ген-драйва. Три испытания различаются по ряду параметров и могут быть адаптированы к желаемым экспериментальным условиям. Более того, инсектарные исследования в небольших клетках являются частью прогрессивного перехода инженерных насекомых из лаборатории в открытые полевые выбросы. Таким образом, протоколы, описанные здесь, представляют собой бесценные инструменты для обеспечения эмпирических ценностей, которые в конечном итоге помогут внедрению на местах новых технологий для элиминации малярии.
Введение
Стратегии, основанные на генетически модифицированных комарах, реализуются для борьбы с передачей трансмиссивных патогенов, таких как те, которые вызывают малярию1. К ним относятся технологии 1), направленные на уменьшение численности и плотности комаров Anopheles (подавление популяции), или 2) направленные на снижение способности переносчиков передавать паразитов, ответственных за болезни человека (модификация популяции, замена или изменение), в которых штаммы векторов спроектированы для экспрессии эффекторных генов, предотвращающих передачу патогенов. Эти генетические подходы были подкреплены появлением генных драйвов на основе CRISPR / Cas9, с доказательствами концепции у комаров-паразитов, передающих эффективное распространение признаков полезной нагрузки, а также антипаразитарных эффекторных молекул в популяциях в клетках.
Небольшие лабораторные испытания в клетках представляют собой первый шаг к оценке характеристик трансгенных штаммов в рамках поэтапного подхода к их дальнейшему развитию в полевых условиях2. Конкретные соображения результата включают наследуемость введенной ДНК в конкурентной среде, пенетрантность и экспрессивность фенотипа и стабильность. Соответствующие экспериментальные конструктивные особенности включают размер клеток, плотность комаров, количество реплик, перекрывающиеся или неперекрывающиеся поколения, возрастные целевые популяции, одиночные или множественные выбросы инженерных штаммов, выбросы только для самцов, женщин или смешанных полов, коэффициенты высвобождения, источники кровяной муки (искусственные или живые животные) и процедуры скрининга.
Здесь мы описываем протоколы, используемые для оценки штаммов анофелиновых комаров на предмет затопления (без системы генного драйва) и те, которые несут автономные системы генного драйва, опосредованные эндонуклеазами Cas9 и направляющими РНК (гРНК). Применение этих протоколов приводится в Pham et al. (2019) 2, Карбаллар-Лехарасу и др. (2020) 3, и Адольфи и др. (2020) 4.
Испытания на интопное высвобождение оценивают скорость распространения разработанного трансгена под менделевским наследованием после многократного высвобождения большого количества трансгенных комаров в дикую популяцию. Без прикрепления трансгена к системе привода данные испытаний с индовым высвобождением предоставляют информацию о пригодности и динамике трансгена, представляющего интерес для стабилизированной популяции.
Когда популяции комаров содержат автономную систему генного драйва, небольшие клеточные испытания предназначены для оценки динамики распространения желаемого трансгена путем определения скорости увеличения доминантного маркера после однократного введения трансгенных самцов. Автономные элементы генного драйва несут гены, кодирующие нуклеазу Cas9, гРНК и доминантный маркер, связанные таким образом, чтобы быть активными в последующих поколениях.
«Перекрывающиеся» поколения относятся к одновременному присутствию нескольких поколений в одной клетке для создания возрастной структурированной непрерывной популяции, в то время как «неперекрывающаяся» относится к отдельным дискретным поколениям в каждой последовательной популяции в клетке2. Эксперименты с клеткой генного драйва могут быть прекращены после определения начальной динамики скорости драйва (конверсии) (8-10 поколений в зависимости от конструкции), и, хотя они предоставляют информацию о краткосрочной стабильности трансгена в популяции комаров, они могут не раскрывать, что происходит, когда и если доминирующие частоты маркеров достигают или близки к полному внедрению (каждый комар, несущий по крайней мере одну копию системы генного драйва).
протокол
Заявление об этике животных
Данное исследование проводилось в строгом соответствии с рекомендациями Руководства по уходу за лабораторными животными и их использованию Национальными институтами здравоохранения. Протоколы были одобрены институциональными комитетами по уходу за животными и их использованию Калифорнийского университета (номера по обеспечению благополучия животных A3416.01).
1. Испытания на интоплятивное высвобождение комаров без генного драйва (рисунок 1)
- Установка и обслуживание сепараторов
- Установите три набора тройных клеток по 0,216 м3, добавив 60 личинок дикого типа (WT) в каждую клетку в течение трех последовательных недель.
ПРИМЕЧАНИЕ: Невозможно определить пол личинок второй звезды с помощью световой микроскопии, поэтому образцы, добавленные в каждую клетку, будут состоять как из самцов, так и из самок. - Каждую неделю предоставляйте взрослым самкам в каждой клетке обезболенных мышей в качестве источника кровяной муки (рисунок 2A) и контейнер для яйцекладки через 3 дня после кровяной муки.
ПРИМЕЧАНИЕ: В то время как альтернативный аппарат искусственного кормления может быть использован, предоставление живых обезболенных мышей для кровеносных мук приводит к улучшению производительности кормления комаров в этих больших (0,216 м3) форматах клеток. Для этого требуется утвержденный протокол использования животных и соответствующее (например, Институциональный комитет по уходу и использованию животных, IACUC) одобрение для использования мышей.
ПРИМЕЧАНИЕ: Отдельных мышей анестезируют смесью 4 мг/мышиный кетамин HCl и 0,4 мг/мышиный ксилазин. Животным вводят от 0,1 до 0,5 мл этой смеси. - Еженедельно высиживают яйца из каждой клетки и случайным образом выбирают 60 личинок второй звезды (L2), которые будут возвращены в соответствующие клетки, чтобы компенсировать смертность (недели 4-8).
ПРИМЕЧАНИЕ: Этапы 1.1.1-1.1.3 необходимы для создания стабильной и распределенной возрастной популяции в клетках, называемой "начальной фазой". - На 9-й неделе назначают клетки, собранные на этапе 1.1.1, случайным образом в трех экземплярах для высвобождения желаемого коэффициента высвобождения самцов.
- Назначьте один набор тройных клеток в качестве элементов управления для оценки согласованности на протяжении всего эксперимента.
- Назначьте один набор тройств для каждого желаемого коэффициента высвобождения (например, 1:1 или 1:0,1 трансгенный:WT у самцов).
ПРИМЕЧАНИЕ: Этот пункт называется «Экспериментальная фаза».
- Установите три набора тройных клеток по 0,216 м3, добавив 60 личинок дикого типа (WT) в каждую клетку в течение трех последовательных недель.
- Реплики и коэффициенты выпуска
- Добавляйте 60 куколок WT (30 самцов и 30 самок) в контрольные клетки еженедельно.
- Чтобы поддерживать соотношение 1:1, добавляйте еженедельно 30 трансгенных мужских куколок вместе с 60 (30 самцов и 30 самок) куколок WT в каждую соответствующую клетку.
- Чтобы поддерживать соотношение 1:0,1, добавляйте еженедельно 300 трансгенных куколок мужского пола вместе с 60 (30 самцов и 30 самок) куколок WT в каждую соответствующую клетку.
ПРИМЕЧАНИЕ: Продолжающееся добавление диких комаров в клетки поддерживает плотность клеток, которая, как ожидается, будет еженедельно уменьшаться из-за возрастной смертности взрослых.
- Скрининг фенотипов
- Выберите в общей сложности 300 личинок из каждой клетки случайным образом. С помощью стереомикроскопа, оснащенного флуоресцентными фильтрами, экран для выражения флуоресцентного доминантного маркера на личиночной и куколочной стадиях и оценки пола полученных взрослых особей (рисунок 3).
ПРИМЕЧАНИЕ: Фенотипический скрининг будет зависеть от доминирующего маркера, включенного в трансгенную конструкцию, интегрированную в комаров (например, Discosoma sp. красный флуоресцентный белок [DsRed], голубой флуоресцентный белок [CFP], зеленый флуоресцентный белок [GFP]), и от промотора, стимулирующего его экспрессию (наиболее используемым в трансгенезе комаров является промотор 3xP3, стимулирующий экспрессию в глазах и нервной кантии). - Следуйте этому протоколу в течение столько поколений, сколько требуется параметрами результата, определенными в экспериментальном проекте.
ПРИМЕЧАНИЕ: Испытание обычно прекращается, когда все комары имеют по крайней мере одну копию трансгена (определяемую присутствием доминирующего флуоресцентного маркера) или отношение трансгенных комаров к WT в клетке стабилизируется и не колеблется сильно через несколько (3-5) поколений.
- Выберите в общей сложности 300 личинок из каждой клетки случайным образом. С помощью стереомикроскопа, оснащенного флуоресцентными фильтрами, экран для выражения флуоресцентного доминантного маркера на личиночной и куколочной стадиях и оценки пола полученных взрослых особей (рисунок 3).
2. Перекрывающиеся испытания генерации комаров с генным драйвом (рисунок 4)
ПРИМЕЧАНИЕ: Комары, несущие системы генного драйва, требуют письменных и пересмотренных протоколов и должны быть одобрены Институциональным комитетом по биобезопасности (IBC) или эквивалентом, а также другими, где это необходимо. Сдерживание комаров (уровень ACL 2+) должно осуществляться в соответствии с рекомендуемыми процедурами5,6,7. В частности, эксперименты с генным драйвом должны использовать две строгие стратегии удержания. Во-первых, это, как правило, физические барьеры (барьерная стратегия) между организмами и окружающей средой. Это требует наличия безопасных инсектарных и стандартных оперативных процедур (включая мониторинг) для обеспечения того, чтобы комары не могли убежать. Вторая стратегия удержания может быть молекулярной, экологической или репродуктивной5.
- Установка клетки
- Установите два комплекта тройных клеток объемом 0,216 м3 для каждого желаемого соотношения высвобождения трансгенных:WT самцов.
- Чтобы достичь соотношения высвобождения самцов 1:1, добавьте 120 трансгенных самцов, 120 самцов WT и 120 самок WT на стадии куколки к каждой реплицированной клетке.
- Чтобы достичь коэффициента высвобождения 1:10, добавьте 12 трансгенных самцов, 120 самцов WT и 120 самок WT на стадии куколки к каждой реплицированной клетке.
ПРИМЕЧАНИЕ: Могут быть протестированы различные коэффициенты высвобождения (1:1, 1:3, 1:10 и т.д.), и количество комаров, используемых для начала экспериментов, соответственно варьируется. Однако важно учитывать влияние низких цифр на статистическую оценку данных.
- Установите два комплекта тройных клеток объемом 0,216 м3 для каждого желаемого соотношения высвобождения трансгенных:WT самцов.
- Содержание и скрининг населения
- Обеспечьте 4-7 дневных самок в каждой клетке кровяной пищей с помощью анестезированных мышей (рисунок 2А).
- Через три дня после приема пищи с кровью вставьте контейнер для яйцекладки в каждую клетку.
- Высиживает яйца в личиночном лотке, выбирайте ~ 240 первых личинок (L1) случайным образом из каждой клетки, выращивайте их до взрослой жизни и верните их в соответствующие клетки.
- Обеспечьте дополнительное (2-3) прием пищи с кровью каждые 3-4 дня для вновь появившихся взрослых, как описано в шаге 2.2.1.
ПРИМЕЧАНИЕ: Никакие дополнительные трансгенные самцы не добавляются в течение любого из последующих поколений. - Выберите в общей сложности 300 личинок из каждой клетки случайным образом и проверьте их на наличие доминантного маркерного фенотипа на личиночной и куколочной стадиях с помощью флуоресцентного стереомикроскопа и оцените появляющихся взрослых особей по полу (рисунок 3).
ПРИМЕЧАНИЕ: Как и прежде, фенотипический скрининг будет зависеть от доминантного маркера и промотора, включенных в систему генного драйва и интегрированных в трансгенных комаров (например, DsRed, CFP или GFP). Если гомозиготные или гетероаллельные нарушения целевых генов приводят к видимому фенотипу (например, генам, связанным с пигментацией глаза), скрининг этого признака будет зависеть от того, на какой стадии легче всего визуализировать измененный фенотип. - Следуйте этому протоколу в течение столько поколений, сколько требуется параметрами результата, определенными в экспериментальном проекте.
ПРИМЕЧАНИЕ: Каждое поколение (ограниченное кровяной мукой) занимает ~ три недели. Испытание обычно прекращается, когда все комары считаются гомозиготными для конструкции генного драйва или популяции стабилизируются при максимальном проценте комаров, несущих по крайней мере одну копию конструкции генного драйва.
3. Неперекрывающиеся испытания генерации комаров с генным драйвом (рисунок 5).
- Установка клетки
- Настройте три популяции клеток 0,005 м3 для каждого конкретного отношения высвобождения трансгенных веществ к самцам WT, которые будут исследованы (например, три набора тройных клеток, каждая из которых установлена с коэффициентами высвобождения 1:1, 1:3, 1:10). Установите все клетки с равным общим количеством самцов и самок.
ПРИМЕЧАНИЕ: Дополнительный файл представляет собой видео, демонстрирующее строительство клетки колонии площадью 0,005 м3 .- Добавьте 50 трансгенных самцов, 50 самцов WT и 100 САМОК WT к каждой из трех реплицированных клеток, чтобы достичь соотношения высвобождения самцов 1:1.
- Добавьте 25 трансгенных самцов, 75 самцов WT и 100 САМок WT к каждой из трех реплицированных клеток, чтобы достичь соотношения высвобождения самцов 1:3.
- Добавьте 9 трансгенных самцов, 90 WT самцов и 100 WT самок к каждой из трех реплицированных клеток, чтобы достичь соотношения высвобождения самцов 1:10.
ПРИМЕЧАНИЕ: Различные коэффициенты высвобождения могут быть проверены, и количество комаров, используемых для начала экспериментов, может варьироваться соответственно. Тем не менее, важно учитывать влияние низкой численности комаров на статистический анализ. Это одиночные релизы; никакие дополнительные трансгенные самцы не добавляются при любом последующем поколении.
- Настройте три популяции клеток 0,005 м3 для каждого конкретного отношения высвобождения трансгенных веществ к самцам WT, которые будут исследованы (например, три набора тройных клеток, каждая из которых установлена с коэффициентами высвобождения 1:1, 1:3, 1:10). Установите все клетки с равным общим количеством самцов и самок.
- Содержание и скрининг населения
- Обеспечьте 4-7-дневных самок в каждой клетке кровяной пищей с помощью аппарата искусственного питания (рисунок 2B) в течение двух последовательных дней.
ПРИМЕЧАНИЕ: Обычное питание кровью для женщин состоит из коммерчески доступного источника крови (например, крови теленка), предоставляемого из питательного аппарата. Живые обезболенные мыши используются только для обеспечения кровопролитием в более крупных (0,216 м3) форматах клеток для лучшей производительности кормления. - Добавьте контейнер для яйцекладки через 3 дня после второй кровяной муки. Через три дня снимите контейнеры для яйцекладки.
ПРИМЕЧАНИЕ: На этом этапе 5-10 самок могут быть выбраны случайным образом из каждой клетки и помещены индивидуально во флаконы для оценки дополнительных параметров пригодности, таких как фертильность и плодовитость, если это необходимо. - Оцените по полу всех взрослых (мертвых и живых), оставшихся в клетке, и храните их при -80°C для молекулярного анализа.
- Высиживает яйца и случайным образом выбирает 200 личинок L1 из клеток с соотношением 1:1 и 1:3 для заселения новых клеток для следующего поколения.
ПРИМЕЧАНИЕ: Из-за низкой частоты запуска трансгенной особи в клетках соотношения 1:10 случайная выборка может привести к чрезмерной потере трансгенного потомства в следующем поколении для продолжения популяции. - Чтобы обеспечить точный отбор проб для клеток 1:10 и достаточное количество трансгенных комаров, отсейте всех личинок на наличие доминирующего маркера и выберите 200 личинок, отражающих наблюдаемую частоту трансгенов для заселения новых клеток.
ПРИМЕЧАНИЕ: Клетки 1:10 могут поддерживаться идентично клеткам 1:1 и 1:3, когда они достигают трансгенной частоты ≥80%. - Выберите 500 личинок из каждой клетки случайным образом для углубленного анализа. Экран под флуоресцентным стереомикроскопом для ожидаемых маркерных фенотипов на личиночной и куколочной стадиях и оценки пола взрослых особей (рисунок 3).
ПРИМЕЧАНИЕ: «Исключительные» фенотипы могут быть выбраны для дальнейшего скрещивания и молекулярного анализа для мониторинга образования резистентных аллелей. - Этот протокол может соблюдаться в течение стольких поколений, сколько требуется параметрами результата, определенными в экспериментальном проекте.
ПРИМЕЧАНИЕ: Каждое поколение ограничено кровопролитной мукой и занимает ~ три недели. Испытание обычно прекращается, когда все комары считаются гомозиготными для конструкции генного драйва или популяции стабилизируются при максимальной распространенности трансгенных комаров. И, как и прежде, скрининг на фенотипы будет зависеть от доминантных маркеров и промоторов, интегрированных в трансгенных комаров (например, DsRed, CFP, GFP) или в целевых генах, если они представляют видимый фенотип (например, гены, связанные с пигментацией глаз).
- Обеспечьте 4-7-дневных самок в каждой клетке кровяной пищей с помощью аппарата искусственного питания (рисунок 2B) в течение двух последовательных дней.
Результаты
Трансгенные анофелиновые комары, генерируемые с негенным драйвом или автономными модификациями генного драйва, предназначены для испытаний в клетках, как описано в разделе «Протоколы». Репрезентативные результаты, показанные здесь, отображают динамику фенотипов наиболее эффективных реплик каждого из экспериментов в клетке, выполненных Pham et al. (2019) 2 для комаров Anopheles stephensi . Три испытания (1 - 3, соответственно: индулятивный негенный драйв, перекрывающийся ген-драйв и неперекрывающийся ген-драйв) варьировались по разным параметрам, таким как размер клетки (0,216 м3 против 0,005 м3), была ли целевая популяция структурирована по возрасту, источник кровяной муки (мыши или искусственная кормушка) и коэффициенты высвобождения. В качестве средства представления на рисунке 6 показаны наблюдаемые данные, выбранные из одного и того же коэффициента высвобождения (1:1) для всех трех используемых протоколов в течение семи поколений.
Недисковый выпуск 1:1 достигает >80% введения трансгена в течение 6-7 поколений. Для испытаний трансгенной клетки генного драйва высвобождение 1:1 как в неперекрывающихся, так и в перекрывающихся протоколах достигает этого уровня в течение 3-4 поколений, таким образом, подтверждая ожидание того, что одно высвобождение системы генного драйва может быть более эффективным, чем недисводные индуктивные выбросы для внедрения трансгенов. Более быстрая траектория также может быть подтверждена наклоном линий тренда. Оба протокола генного драйва, несмотря на разные настройки, представляют схожие углы и тенденции наклона. В конце наблюдения неприводные клетки достигают ~ 80% особей, несущих трансген, в то время как клетки с генным драйвом достигают полного (или почти полного) введения. Полные данные и детали обработки отдельных результатов эксперимента с использованием протоколов, описанных здесь, можно найти на рисунках 1-3 Pham et al. (2019) 2, рисунки 2-3 Карбаллара-Лехарасу и др. (2020) 3 и рисунок 3 Адольфи и др. (2020) 4.
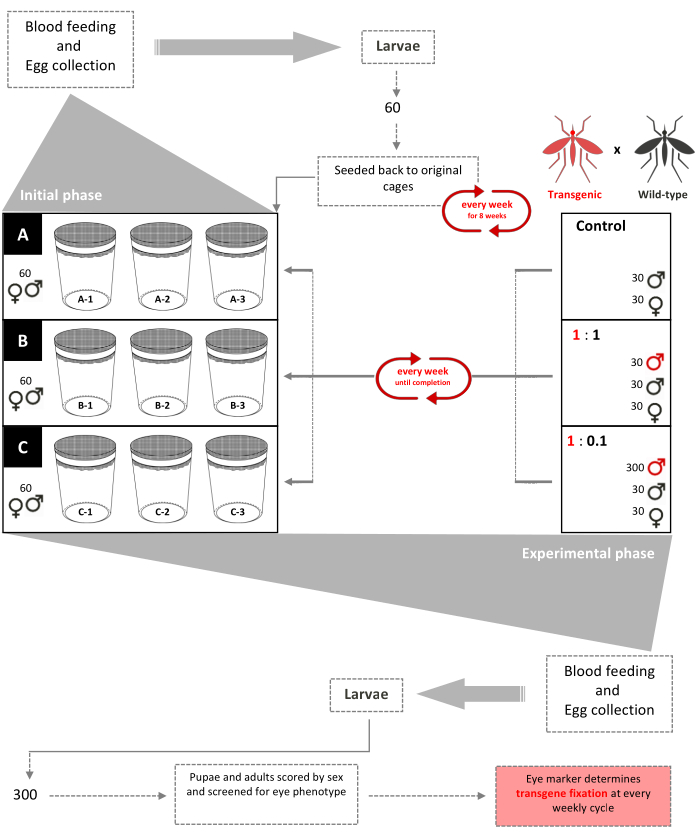
Рисунок 1. Схема пробной версии недискового аварийного выпуска. Девять клеток площадью 0,216 м3 установлены с добавлением к каждой из них 60 личинок второго типа (смешанных полов). Начиная с 3-й недели, самкам еженедельно дают кровожадную муку, а яйца собирают и вылупляют. До 8-й недели 60 личинок выбираются случайным образом и еженедельно возвращаются в свои соответствующие клетки, чтобы создать возрастную популяцию в клетках (начальная фаза). Начиная с 9-й недели, девять клеток случайным образом распределяются в трех экземплярах в соответствии с их трансгенными соотношениями высвобождения самцов дикого типа (экспериментальная фаза). Клетки А (Контроль) не имеют трансгенных куколок. Самкам еженедельно дают кровопускание, а яйца собирают, вылупляют и выращивают до куколок. 30 самцов и 30 самок куколок дикого типа добавляются обратно в свои клетки. Клетки 1:1 имеют дополнительно 30 трансгенных мужских куколок. Клетки 1:0.1 имеют дополнительно 300 трансгенных мужских куколок. 300 личинок из каждой из 9 клеток выбираются случайным образом и проверяются на флуоресцентный маркер. Эту процедуру повторяли еженедельно до фиксации трансгена (стабилизировали соотношение комаров трансгенно-дикого типа через несколько поколений). Адаптировано из Pham et al. (2019) 2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2. Кровоснабжение клеточных популяций. (A) Обезболенные мыши или (B) Кровососы с кормушками Hemotek предлагаются для кормления кровью самок комаров в клетках площадью 0,216 м3 или небольших клетках площадью 0,005 м3 соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3. Скрининг фенотипов для испытаний без драйва, перекрывающегося ген-драйва и неперекрывающейся клетки генного драйва. Флуоресцентные изображения личинки, куколки и взрослой особи трансгенных или диких фенотипов. В этом примере людей An. stephensi проверяли на наличие маркера DsRed, управляемого промотором 3xP3 в глазах (DsRed+ или DsRed-), видимого на всех трех этапах, а взрослых проверяли на секс ( ♀ или ♂ ). Обратите внимание на фоновую флуоресценцию у личинок дикого типа, связанную с пищевым болюсом в средней кишке. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
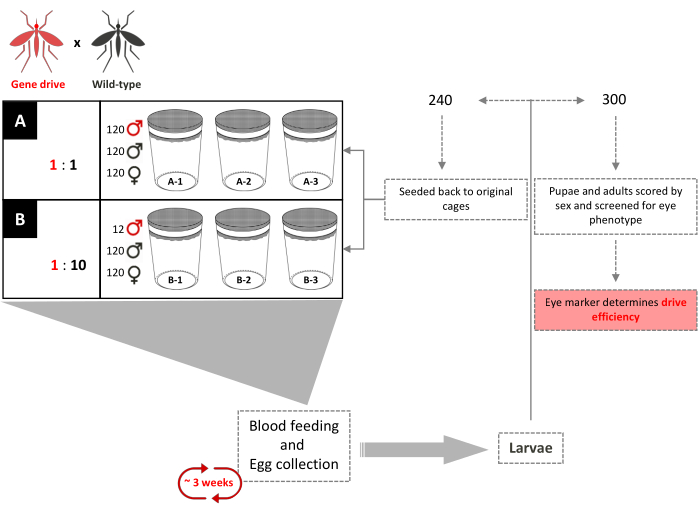
Рисунок 4. Схема испытания перекрывающейся клетки генного драйва. Шесть клеток размером 0,216 м3 установлены в трех экземплярах в соответствии с их коэффициентами высвобождения самцов диких типов: дикий тип. В каждую клетку было добавлено 120 самцов дикого типа и 120 самок дикого типа. В клетки с соотношением высвобождения самцов генов 1:1 было добавлено дополнительно 120 трансгенных самцов. В клетки с соотношением высвобождения самцов 1:10 было добавлено еще 12 трансгенных самцов. До полного введения трансгена каждые 3 недели взрослым самкам снабжаются кровожадными муками, а яйца собираются и вылупляются. В общей сложности 240 личинок были выбраны случайным образом и возвращены в свои соответствующие клетки. Триста (300) личинок выбираются случайным образом и проверяются на наличие доминирующего маркера. Позже они проверяются как куколки и взрослые особи на цвет глаз и секс. Никакие дополнительные трансгенные самцы не добавляются в оригинальные клетки. Адаптировано из Pham et al. (2019) 2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
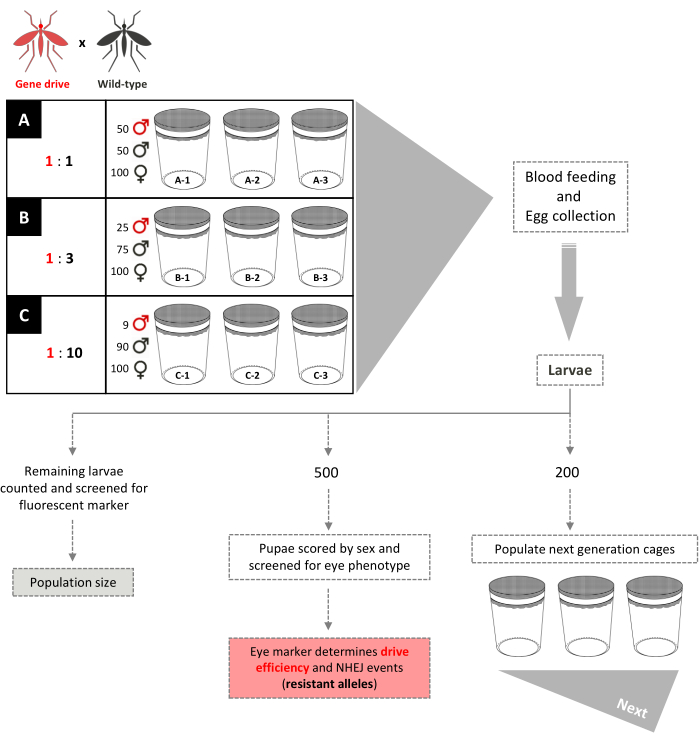
Рисунок 5. Схема испытания без перекрывающейся клетки генного драйва. Девять небольших клеток площадью 0,005 м3 установлены в трех экземплярах в соответствии с их коэффициентами генного драйва: высвобождения самцов дикого типа. Клетки с соотношением выпуска самцов 1:1 имеют 100 самок дикого типа, 50 самцов дикого типа и 50 самцов генного драйва. Клетки с соотношением высвобождения самцов 1:3 имеют 100 самок дикого типа, 75 самцов дикого типа и 25 самцов генного драйва. В клетках с соотношением высвобождения самцов 1:10 добавлено 100 самок дикого типа, 90 самцов дикого типа и 9 самцов генного драйва. Самкам обеспечивается кровяная мука, а яйца собираются и вылупляются. Для клеток 1:1 и 1:3 200 личинок выбираются случайным образом и используются для заселения новых клеток, отдельно от клеток их родителей, для следующего поколения. Еще 500 личинок отбираются случайным образом и выращиваются до куколок, когда их проверяют на наличие доминантного маркерного гена. Затем 500 куколок выращиваются во взрослых особях и оцениваются по полу. Все оставшиеся личинки проверяются на маркер. Для клеток 1:10 все личинки забиваются в поколениях 1-12 и 200 личинок, отражающих существующую частоту трансгенов, используются для заселения новых клеток. Начиная с поколения 13, эти клетки установлены идентично клеткам 1:1 и 1:3. Адаптировано из Pham et al. (2019) 2 и Карбаллар-Лехарасу и др. (2020) 3. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
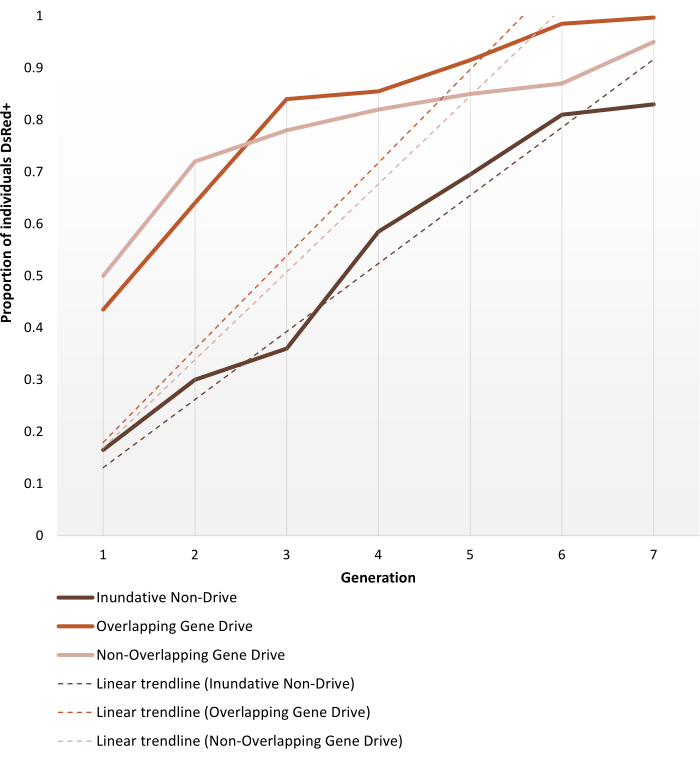
Рисунок 6. Предсказана динамика фиксации трансгенов для различных испытаний популяционной замещающей клетки. Представление ожидаемой динамики фенотипа наиболее эффективных реплик для каждого из экспериментов в клетке, выполненных Pham et al. (2019) 2, контролируется в течение 7 поколений. Поставленные эксперименты описаны в Протоколах. Прогнозы основаны на данных всех 9 экспериментов по моделям выпуска 1:1 (тройные реплики для каждого из трех различных протоколов испытаний в клетке). Ось X — это номер генерации после первоначальной интродукции, а ось Y — это доля личинок, показывающих фенотип маркера DsRed (DsRed+) с течением времени. Пунктирные линии представляют собой линейные линии тренда данных. Фенотип DsRed+ является результатом наличия по крайней мере одной копии модифицированного аллеля. Следовательно, результаты отражают распространение трансгена, ускоренное в системе генного драйва, достигающее (близкого) полного введения в конце наблюдения. Для получения информации о вариативности между репликами и полных подробных данных об экспериментах, пожалуйста, обратитесь к Pham et al. (2019) 2, Карбаллар-Лехарасу Р и др. (2020)3 и Адольфи А и др. (2020)4. Изображения, адаптированные из Pham TB et al. (2019) Экспериментальная популяционная модификация комара-переносчика малярии Anopheles stephensi. PLOS Genet 15(12): e1008440. doi: 10.1371/journal.pgen.1008440, Adolfi A et al. (2020) Эффективная система спасения генного драйва модификации популяции у малярийного комара Anopheles stephensi. Nat Commun 11(1): 5553. doi: 10.1038/s41467-020-19426-0 и Carballar-Lejarazú R et al. (2020) Генный драйв следующего поколения для популяционной модификации комара-переносчика малярии Anopheles gambiae. Proc Natl Acad Sci США 117(37):22805-22814. doi: 10.1073/pnas.2010214117. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный файл: Строительство колониальной клетки площадью 0,005 м3. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Генетически модифицированные комары, которые обладают способностью блокировать патогены или несут гены стерильности, представляют собой новые инструменты для борьбы с трансмиссивными болезнями. Учитывая множественность параметров, составляющих эти альтернативные подходы, критическим шагом в их исследованиях являются лабораторные экспериментальные оценки, которые позволяют быстро и безопасно прогнозировать потенциальные результаты высвобождения синтетических трансгенов для целей контроля1.
Поскольку мониторинг динамики трансгенов в популяциях в клетках может длиться в течение нескольких месяцев, одним из центральных аспектов протоколов является согласованность в экспериментальном проектировании между репликами (включая выращивание комаров, размер клетки, возрастные структурированные популяции, фиксированные коэффициенты высвобождения, стабильные источники кровяной муки и минимально инвазивные процедуры скрининга).
Выбросы только для самцов считаются идеальными, потому что самцы комаров не передают патогены и не питаются людьми, поэтому они могут безопасно вводить наследственные характеристики в дикие популяции. В лабораторных клеточных экспериментах можно обнаружить трансгенные штаммы со сниженной соревновательностью самцов при спаривании и другими фитнес-нагрузками, связанными с трансгенной интеграцией. Тем не менее, прямые и конкретные эксперименты, такие как те, которые проводятся в больших клетках10, могут быть проведены для правильного анализа мужской конкурентоспособности, а также женской плодовитости при более естественной плотности комаров2. Кроме того, эмпирические данные испытаний в клетках могут быть использованы для параметризации моделей динамики популяции клеток, включая формирование устойчивых аллелей, и предоставления полезной информации об эффективности и возможных корректировках предлагаемой технологии.
Протоколы, описанные здесь, могут быть легко адаптированы к другим экспериментальным проектам по мере необходимости, с минимальными требованиями в отношении регулярной инсектарной инфраструктуры и условий. Кроме того, за исключением коммерческих клеток и микроскопов, большинство материалов являются недорогими и позволяют недорогие множественные реплики и итерации испытаний. Примечательно, что это также позволяет предварительно проверять несколько трансгенных штаммов в небольших клеточных испытаниях, чтобы определить приоритеты наиболее эффективных кандидатов, которые будут продвигаться вперед по поэтапному пути тестирования, и приостановить тестирование на тех, кто показывает неоптимальные характеристики.
Наконец, озабоченность по поводу использования генетически измененных организмов мотивирует разработку рамок для разработки, оценки и применения генетических стратегий профилактики болезней, переносимых комарами5,8,9. Актуальность и исполнение протоколов, определенных здесь, согласуются с этими руководящими принципами.
Раскрытие информации
Авторы не раскрывают информацию.
Благодарности
Мы благодарны Друзилле Стиллингер, Кионе Паркер, Пэрриш Пауэлл и Мадлен Ноттоли за разведение комаров. Финансирование было предоставлено Инициативой по борьбе с малярией в Ирвине Калифорнийского университета. AAJ является профессором Дональда Брена в Калифорнийском университете в Ирвине.
Материалы
| Name | Company | Catalog Number | Comments |
| Artificial feeders | Hemotek | SP6W1-3 | Starter pack – 6 feeders with 3ml reservoirs |
| Cage, commercial | BioQuip | 1450D | Collapsible Cage, 24 X 24 X 24" - 0.216 m3 (60 cm3) |
| Cage tub (popcorn) | Amazon.com | VP170-0006 | 0.005 m3 (170 fl oz) |
| Dissecting microscope with fluorescence light and filters | Leica | M165FC | |
| Glue sticks | Michaels | 88646598807 | Gluesticks 40 pk, 0.4X4” |
| Hot glue gun | Woodwards Ace | 2382513 | Stanley, 40 watt, GR20 |
| Nylon screen (netting) | Joann.com | 1102912 | Tulle 108" Wide x 50 Yds - ~35.6 cm2 (14 in2) |
| Oviposition cups | Fisher | 259126 | Beaker PP grad 50 mL |
| Razor cutting tool | Office Depot | 487899 | Box cutters |
| Scissors | Office Depot | 978561 | Scotch Precision Ultra Edge Titanium Non-Stick Scissors, 8" |
| Stapler | Office Depot | 908194 | Swingline Commercial Desk Stapler |
| Surgical sleeve (stockinette) | VWR | 56612-664 | ~48 cm (19”) cut from bolt ~15 cm (6”) X ~23 m (25y) |
| Zip ties | Home Depot | 295715 | Pk of 100, 14” cable ties - 35.6 cm (14 in) |
Ссылки
- Carballar-Lejarazú, R., James, A. A. Population modification of Anopheline species to control malaria transmission. Pathogens and Global Health. 111 (8), 424-435 (2017).
- Pham, T. B., et al. Experimental population modification of the malaria vector mosquito, Anopheles stephensi. PLOS Genetics. 15 (12), 1008440 (2019).
- Carballar-Lejarazú, R., et al. Next-generation gene drive for population modification of the malaria vector mosquito, Anopheles gambiae. Proceedings of the National Academy of Sciences. 117 (37), 22805-22814 (2020).
- Adolfi, A., et al. Efficient population modification gene-drive rescue system in the malaria mosquito Anopheles stephensi. Nature Communications. 11 (1), 5553 (2020).
- Akbari, O. S., et al. Safeguarding gene drive experiments in the laboratory. Science. 349 (6251), 927-929 (2015).
- Benedict, M. Q., et al. Recommendations for Laboratory Containment and Management of Gene Drive Systems in Arthropods. Vector-Borne and Zoonotic Diseases. 18 (1), 2-13 (2018).
- Adelman, Z., et al. Rules of the road for insect gene drive research and testing. Nature Biotechnology. 35 (8), 716-718 (2017).
- Long, K. C., et al. Core commitments for field trials of gene drive organisms. Science. 370 (6523), 1417-1419 (2021).
- Facchinelli, L., North, A. R., Collins, C. M., et al. Large-cage assessment of a transgenic sex-ratio distortion strain on populations of an African malaria vector. Parasites Vectors. 12, 70 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены