Method Article
D11 scFv-アルカリホスファターゼ融合タンパク質と免疫蛍光を用いた組織中のイソレブグランジンの直接検出(英語)
* これらの著者は同等に貢献しました
Erratum Notice
要約
この記事では、アルカリホスファターゼ結合ScFv D11抗体を使用した免疫蛍光法による組織内のイソレブグランジンの測定のための詳細な方法論を提供します。マウスとヒトの両方の高血圧モデルは、組織サンプル中のイソレブグランジン測定に関連する段階的な手順と基本原理を説明するために使用されます。
要約
イソレブグランジン(IsoLG)は、H2-イソプロスタンから脂質過酸化および架橋タンパク質を介して形成される反応性の高いガンマケトアルデヒドであり、炎症や高血圧を含むさまざまな疾患を引き起こします。組織におけるIsoLG蓄積の検出は、疾患プロセスへのIsoLGの関与を明らかにする上で非常に重要です。しかし、組織中のIsoLGsの測定は非常に困難であり、質量分析を含む現在利用可能なツールは手間がかかり、非常に高価です。ここでは、アルカリホスファターゼ結合D11 ScFvと大腸菌で産生された組換えファージディスプレイ抗体を免疫蛍光顕微鏡法により、組織中のIsoLGをin situ検出する新しい方法について説明します。染色の検証には、(1)D11の有無にかかわらず染色、(2)アルカリホスファターゼリンカーによる細菌ペリプラズム抽出物による染色、(3)無関係なscFV抗体染色、および(4)染色前のIsoLGによる競合対照の4つの対照が使用されました。アルカリホスファターゼ結合D11の有効性を、高血圧の有無にかかわらずヒトとマウスの両方の組織で実証します。この方法は、さまざまな疾患プロセスにおけるIsoLGの役割を研究するための重要なツールとして役立つ可能性があります。
概要
イソケタールとしても知られるイソレブグランジン(IsoLG)は、脂質過酸化の産物である4-ケトアルデヒドファミリーの異性体であり、タンパク質1,2上の第一級アミンと反応して付加します。IsoLGは、心血管疾患、アルツハイマー病、肺疾患、肝臓疾患、および多くの種類の癌を含むいくつかの疾患に関与しています3。IsoLGsは、米国を含む世界的に大きな健康的および経済的負担である心血管疾患(CVD)への寄与において最も広く研究されてきました。9,210万人の米国の成人が少なくとも1種類のCVDを患っていると推定されており、2030年の推定予測は米国の成人人口の43.9%に達します4。血圧、コレステロール、禁煙を下げると、CVDイベントの全体的なリスクと発生が減少します5。
高血圧または高血圧は心血管疾患の主要な危険因子であり、米国の人口の約半数に影響を及ぼします6。以前の研究では、炎症が高血圧の根本的な原因であり、IsoLGが役割を果たすことがわかっています7。アンジオテンシンII、カテコールアミン、アルドステロン、および過剰な食事塩を含む高血圧刺激は、樹状細胞(DC)を含む抗原提示細胞にIsoLG蓄積を誘導し、次にT細胞を活性化して増殖し、高血圧に寄与する炎症性サイトカインを産生します8,9。
これまで、IsoLGsは、免疫組織化学、質量分析、酵素結合免疫吸着アッセイ、およびフローサイトメトリーによって測定されてきました10,11。IsoLGsの測定を容易にするために、IsoLGs12に対する一本鎖フラグメント可変(scfv)組換え抗体(D11)が開発された。当初、このD11抗体は11個のアミノ酸Eタグを含み、免疫組織化学検出のために二次抗体を必要とした11。しかしながら、製造業者による製造中止後にEタグに対する信頼できる二次抗体を見つけることは困難であった。そこで、アルカリホスファターゼ(D11-AP)と結合したD11を用いたIsoLGの免疫蛍光染色のための信頼性の高いプロトコルを開発し、高血圧の有無にかかわらずマウスおよびヒト組織で実証しました。
プロトコル
ヴァンダービルト大学の施設動物管理および使用委員会は、この原稿に記載されているすべての手順を承認しました。マウスは、実験動物の世話と使用のためのガイドに従って飼育され、世話をされます。すべての被験者は、ヴァンダービルト大学の治験審査委員会によって承認された研究に登録する前に、書面によるインフォームドコンセントを与えました。すべての手続きはヘルシンキ宣言に従って行われました。
1. D11-アルカリホスファターゼ融合タンパク質をコードするプラスミドおよびネガティブコントロールベクターの作製
- pCANTAB5Eプラスミド13,14の改変バージョンを構築し、一本鎖断片変数(scFv)セグメントの3'末端が細菌性アルカリホスファターゼ(AP)をコードする配列に連結されています。
注:scFv配列のNotI制限部位のすぐ下流では、修飾プラスミドはEタグのコード配列を含まず、代わりにリンカー配列GGSGGHMGSGGをコードし、その後にAPの配列(GenBankアクセッション番号AXY87039.1、T16-K464)が続きます15,16。APの下流では、プラスミドは8xHisおよびDYKDDDDKタグをコードします。タグの3'末端では、コード配列はアンバー終止コドンで終わる。修飾されたプラスミドはpCANTAB5-APと呼ばれます。 - D11 scFv(GenBankアクセッション番号AAW28931.1)をSfiI/NotI制限部位を持つpCANTAB5-APにクローニングします。
- D20 scFv を SfiI/NotI 制限部位を持つ pCANTAB5-AP にクローニングします。
注:D20 scFvは、無関係なscFvの組織相互作用パターンを評価するために設計されたネガティブコントロールです。このscFvは、もともとA2として知られるグリカン基と相互作用する能力のためにファージディスプレイによって選択されました。 - プラスミドからscFv部分を完全に除去し、アミノ酸GGGGSGRAGSGGGGSからなる「APリンカー」コード配列で置き換えることにより、「空の」ベクターを生成します。
- すべてのプラスミドをコンピテントTG1大腸 菌 に変換し、100 μg/mLのアンピシリンと2%グルコース(2xYTAG)培地を添加した2xYTを含む0.5%寒天プレート上で、30°Cで一晩細菌を増殖させます。
注:supE遺伝子を有する株(TG1大腸 菌など)は、アンバー終止コドンを100%抑制しません。推定値は0.8〜20%の範囲であるため、これらの実験を対象としているため、BAPのすぐ下流で終了する製品がまだたくさんあります17。TG1大腸 菌 は、主に時間とコストの削減、pCANTABタンパク質発現システムとの互換性、実験室で一般的に行われるファージディスプレイでの使用などの実用的な理由で使用されます。BAPに続くアンバー終止コドンの下流には、geneIIIの配列がある。scFv-geneIII融合タンパク質は、その特定のgeneIIIタンパク質を妨害してナイーブ細菌に再感染するため、ファージディスプレイが意図したとおりに機能するためには、GeneIII融合タンパク質をめったに発現させる必要はありません。したがって、融合のない遺伝子IIIタンパク質は、機能するファージの生成のためにビリオンアセンブリ中に存在する必要があり、すなわち、scFv-geneIIIタンパク質産物は通常、細菌内では比較的まれです。D11-AP、D20-AP、空のベクター、およびこの記事で使用されるすべての構築物はすべて、時折起こるgeneIII融合タンパク質発現によって同様に影響を受けます。これらのタンパク質の挙動にはまだ違いが観察されています。 - 個々のコロニーを選び、新鮮な5 mLの2xYTAG培養液を接種します。細菌を30°Cで一晩増殖させ、150rpmで振とうします。
- 室温で10分間3,000 x g で遠心分離することにより、細胞をペレット化します。上清を廃棄し、ペレットを85%2xYTAGおよび15%グリセロールの2mLに再懸濁します。
- グリセロールストックを-80°Cの冷凍庫に維持します。
2. タンパク質の発現とペリプラズム抽出物の生成
注:ペリプラズム抽出物の生成は、主にジスルフィド結合の形成がscFvおよび抗体生成において重要であるため、ファージディスプレイにおけるタンパク質発現に一般的に使用される方法です。この方法は、ライセート(一般的に封入体を含む)を生成する必要性を回避し、タンパク質が適切に折り畳まれていることを保証します。pCANTABは、D11-BAP融合タンパク質のscFv部分の上流にgIIIシグナル配列を有する。シグナル配列は、タンパク質が細菌のペリプラズム空間にシャトルされることを確実にし、次いでシグナル配列が切断される。ペリプラズム空間は酸化環境を提供し、これはジスルフィド架橋の適切な形成に不可欠です。浸透圧ショックは、細菌を無傷に保ちながら、ペリプラズムタンパク質を周囲の培地に放出するのに十分な外膜を破壊するため、ペリプラズム抽出物の誘導に使用されます。
- 関連するプラスミドを含むTG1大腸 菌 グリセロールストックを2xYTAGの60 mL培養液に接種し、150 rpmで振とうしながら30°Cで一晩培養します。
- タンパク質発現を誘導するには、細菌培養物を3,000 x g で10分間ペレット化し、60 mLの2xYTA培地に再懸濁し、150 rpmで振とうしながら30°Cで一晩培養します。
注:2xTYAG培地から2xYTA培地への切り替えは、タンパク質発現の十分な誘導に役立ちます18。グルコースが細菌培地中に存在する場合、グルコースは処理に必要なエネルギーが少ないため、細菌はグルコースを優先的に消費し、ラクトースを無視するため、lacプロモーターが抑制されます。培地切り替え後にグルコースが除去されると、細菌は2xYT培地によって提供される炭水化物に依存します。酵母エキス(2xYTのY成分)には炭水化物が含まれており、その中にはラクトースが含まれているため、lacプロモーターを介してタンパク質発現を促進することができます。IPTGはpCANTABコンストラクトでは必要ではなく、非機能的なタンパク質をもたらす封入体とともに、過剰なタンパク質発現をもたらす可能性があります。 - 浸透圧ショックによってペリプラズム抽出物を生成します。
- 細菌培養物を3,000 x g で10分間ペレット化します。
- 20 mLの1xTES(0.2 M Tris-HCl pH 8.0、0.5 mM EDTA、0.5 Mスクロース)に再懸濁し、氷上で1時間インキュベートします。
- 再び3,000 x g で10分間ペレット化し、0.05 M Tris、pH 7.6の15 mLに再懸濁します。
- この懸濁液を氷上で1時間インキュベートし、次に5,000 x g で10分間遠心分離して清澄化します。
- 上清を新鮮なチューブに移し、精製または実験での直接使用に必要になるまで-20°Cで保存します。
- ELISAにおける活性型D11-BAPの存在により細胞溶解を評価する。ペリプラズム抽出物3〜5 μLを1 mLのpNPPに加え、次の10分間で色の変化が起こるかどうかを観察します(色は透明な黄色から濃い黄色になります)。
注:色は、ライセートを受け取っていないpNPPのチューブ、またはナイーブTG1細菌のライセートを受け取ったpNPPのチューブと並べて比較できます。405 nmの吸光度で定量します。
4. ELISAにおけるD11-AP力価の特性評価
- 5 μg/mLのマウス血清アルブミン(MSA)(陰性対照)または5 μg/mLのIsoLG/MSA(陽性対照)を含む25 μL/ウェルリン酸緩衝生理食塩水(PBS)(1.8 mM KH 2 PO 4、10 mM Na2 HPO4、2.7mM KCl、137 mM NaCl)で384ウェルポリスチレンプレートを4°Cで一晩コーティングします。
- プレートを空にし、タップして乾かします。PBS + 0.1%トゥイーン(PBS-T)で1回洗浄します。プレートを空にし、タップして乾かします。
- ブロッキングバッファーとしてプレートにPBS-Tを充填します(120 μL/ウェル)。室温で1時間インキュベートします。
- プレートを空にし、タップして乾かします。D11-APペリプラズム抽出物を25 μL/ウェルで連続1:2希釈し、PBS-Tで希釈します。陰性対照としてPBS-Tのみを含む1つのウェルを含めます。
注:ペリプラズム抽出物の一般的な希釈範囲は1:8〜1:4096です。アッセイ容量が25 μLの場合、開始濃度の「1:8」濃度50 μL(ペリプラズム抽出物6.25 μL、PBS-T43.75 μL)から開始します。次に、この溶液25 μLを除去し、25 μLのPBS-Tを含む次のウェルに追加し、上下にピペットでピペット化して、2倍希釈を行います。このウェルには「1:16」希釈液が含まれています。2倍希釈を繰り返して、説明されている1:2希釈シリーズを生成します。 - 室温で1.5時間インキュベートします。
- プレートを空にし、タップして乾かします。PBS-Tで5回洗浄してください。空にしてタップして乾かします。
- 1 gのpNPPを1 Lの930 mMジエタノールアミン(H 2 Oで1:10に希釈した98%ストック溶液)に0.5 mM MgCl2で溶解し、HClでpH 9.5に調整してpNPP溶液を調製します。
- 25 μL/ウェルのpNPP溶液を塗布してAPを開発します。 室温で1時間インキュベートし、互換性のあるプレートリーダーを使用して各ウェル内の405 nmの吸光度を測定します。
- IsoLG / MSAウェルから生成された信号とMSAウェルから生成されたノイズを比較し、信号がノイズの少なくとも5倍高い希釈範囲を見つけます。
- このD11-AP信号希釈系列をグラフにプロットし、曲線の線形範囲を決定し、信号の50%が観察できる希釈を確立します。
注:この希釈率が約1:1,000に相当する場合、D11-AP溶液はIHC / IFで1:10の濃度で使用できます。
5.免疫蛍光法
- ミクロトームを使用してマウスおよびヒトパラフィン包埋組織(厚さ5 μm)の連続切片を切り取り、温水浴(37°C)に入れます。スライドガラスに組織切片を取り付け、一晩乾燥させます。
注:この研究では、大動脈はマウスから得られました。正常血圧および高血圧のヒトの結腸切片は、ヴァンダービルト協同組合ヒト組織ネットワークから入手した。 - スライドをキシレンに3回5分間浸して、組織を脱パラフィンします。
- 2中の再水和組織は、H2O中の95%、70%および50%エタノールの各々を洗浄する。
- スライドホルダーにTBSTを充填してからTBSTを廃棄することにより、0.1%Tween20(TBST)を含むトリス緩衝生理食塩水(TBS)でスライドを3回洗浄し、すばやく洗浄します。
注:水和スライドは、抗原回収前に4°CのTBSTに1週間以内保存できます。 - スライドの熱誘発抗原賦活化を行うには、スライドを予熱した(80〜95°C)クエン酸ナトリウムバッファー(10 mMクエン酸ナトリウム、0.05%トゥイーン20、pH 6.0)に入れ、高圧で4分に設定した圧力鍋でインキュベートし、合計抗原賦活化時間を20分にします。
- 圧力鍋からスライドを取り出し、室温まで20分間冷却します。
- TBSTのスライドをクイックウォッシュで3回洗浄します。
注:スライドは、抗原賦活化後、染色前に1週間以内にTBSTに保存することができます。 - TBSTに溶解した2%BSAを加えてスライドをブロックします。スライドをパラフィンフィルムのストリップで覆い、室温で15分間インキュベートする。
- スライドからブロックバッファを破棄します。
- TBST中の1:10 D11-APを200 μLスライドに加え、パラフィンフィルムのストリップで覆います。
- 加湿チャンバー内でインキュベートし、抗体溶液の蒸発を室温で3時間最小限に抑えます。
- TBSTでスライドを3回洗ってください。
- 免疫組織化学または免疫蛍光用の比色アルカリホスファターゼ現像液または蛍光アルカリホスファターゼ現像液でそれぞれ開発します。スライドをTBSTで一度洗浄して余分な現像液を取り除き、それ以上の発色を防ぎます。
- ヘキスト核染色剤をPBS中で1 μg/mLで対比染色し、免疫蛍光を発します。TBSTでスライドを一度洗浄して、余分な対比汚れを取り除きます。
- 封入剤を使用してカバーガラスを塗布します。
- 免疫組織化学用の倒立型光学顕微鏡または免疫蛍光用の共焦点蛍光顕微鏡でスライドを表示します。
6.ネガティブコントロール
注:IsoLGに対するD11-AP染色の特異性を確認するために、4つの陰性対照実験を行うことができます。陰性対照実験は、同じ条件下で同じ染色セットで実施する必要があります。
- 最初の陰性対照実験では、TBSTまたはTBSTのみで希釈したD11-APで組織をインキュベートします。
- TBSTで希釈したD11-APと、TBSTで希釈したD11-AP(APリンカー)を含まない細菌ペリプラズム抽出物で組織をインキュベートします。
- 前述のように、IsoLG / MSAまたは非付加MSAを使用して競合アッセイを実行します12。
- 前述のようにマウス血清アルブミン(MSA)に付加されたIsoLGおよびIsoLGを調製し19、モル比8IsoLG:1MSA(8:1 IsoLG/MSA)で調製する。
- TBSTでD11-AP 1:10を希釈します。
- 希釈したD11-APを50 μg/mLのIsoLG/MSAまたは非付加MSAとともに室温で1時間インキュベートします。
- 染色のために、IsoLG/MSAを含むD11-APまたは非付加MSAを含むD11-APを組織に追加します。
- 無関係なscFv抗体D20を使用して、最終的なネガティブコントロールセットの組織を染色します。
結果
代表的な実験では、アルカリホスファターゼ結合(D11-AP)を有するD11 scfvを免疫蛍光法で使用して、アンジオテンシンII処理マウスに存在するIsoLGを正常な偽マウスと比較し、正常血圧ヒトと比較して高血圧を有するヒトを検出した。マウスをアンジオテンシンIIで490 ng / kg / minの用量で2週間治療し、偽マウスと比較して収縮期血圧の上昇で高血圧が確認されました10。D11-APの特異性を確保するために、組織はD11-APの存在の有無にかかわらず染色した。D11-AP染色によって実証されるように、アンジオテンシンII誘発性高血圧症のマウスの大動脈は、対照マウスと比較してIsoLGs濃度の上昇を示した(図1)。バックグラウンド染色または自家蛍光は、D11-APで染色されなかったネガティブコントロールによって示されるように、制限された。
D11-APは、高血圧(HTN)または正常血圧ヒト(NTN)のヒト患者の腸組織に存在するIsoLGを検出するために使用されました。高血圧状態は、収縮期血圧が140を超え、拡張期血圧が80mmHgを超える病院の記録から確立されました。D11-APの免疫蛍光プロトコルを開発している研究者は、ヒト組織の高血圧状態を知らされていませんでした。切片をD11-APの存在下および非存在下で染色して、抗体の特異性を確認し、バックグラウンド染色または自家蛍光を示しました。 図2に示すように、HTN患者の組織はNTN患者と比較してIsoLGsの濃度が高いことがわかりました。D11-APなしの染色でも、バックグラウンド染色と自家蛍光は最小限でした。内因性アルカリホスファターゼは腸上皮によって発現されるため、D11-APなしで染色された組織の限られた蛍光は、このプロトコルで使用される抗原賦活化が組織に存在する内因性アルカリホスファターゼを不活性化するのに十分であったことを示しています。マウスでの結果と組み合わせて、これらの結果は、免疫蛍光プロトコルが正常血圧状態と比較した場合、高血圧におけるIsoLGの上昇を効果的に示すことも示しています。
D11-APを単離し、細菌ペリプラズム抽出物に保存した。マウスおよびヒトの組織をD11-APおよびD11を含まないAPリンカーを含むペリプラズム抽出物で染色し、ペリプラズム抽出物に存在する可能性のある他の因子(過剰または非結合アルカリホスファターゼなど)がD11-APで処理された組織で観察される染色に寄与しないことを確認しました(図3)。D11-APで染色された組織は、ペリプラズム抽出物で染色された組織と比較して明るい染色をもたらしました。これらの結果は、D11-APが組織を染色していることを裏付けており、染色はペリプラズム抽出物に潜在的に存在し、IsoLGの誤った染色をもたらすか、バックグラウンド染色に寄与する可能性のある非結合細菌アルカリホスファターゼによるものではないことを確認しています。
競合対照は、組織を染色する前に、MSAまたは非付加MSAに付加されたIsoLGと共にD11-APをプレインキュベートすることにより実施され、D11-APのIsoLGに対する特異性を示した。D11-APがIsoLGに特異的である場合、抗体はIsoLG-MSAに結合し、組織を染色するためのD11-APの利用可能性が低下し、非付加MSAとインキュベートされたD11-APは、通常のD11-APと同様の染色を示します。IsoLGの競合製品とプレインキュベートしたD11-APで染色した組織では、プレインキュベーションを行わずにD11-APで染色した組織と比較して染色が減少していることがわかりました(図4)。非付加MSAでプレインキュベートしたD11-APで染色した組織では、染色はD11-APで観察された染色と類似していることがわかりました。これらの結果は、D11-APをIsoLG / MSAとプレインキュベートした場合の組織の染色の減少によるIsoLGに対するD11-APの特異性を示していますが、非付加MSAはそうではありませんでした。最終陰性対照では、マウス組織をD11-APまたは無関係なscFv抗体D20で染色した。マウス大動脈をD11-APで染色すると、D20と比較して強い染色が得られ、高血圧大動脈のIsoLGに対するD11-APの特異性を示しました(図5)。
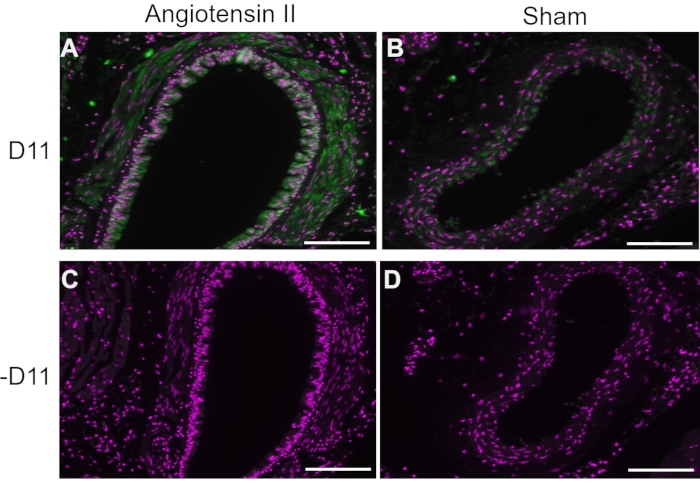
図1:高血圧および正常血圧マウスにおける大動脈の免疫蛍光。 アンジオテンシンIIおよび偽注入マウスからの動脈を、IsoLGの存在を示すためにD11-AP(D11)の有無にかかわらず染色した。(A)D11-AP(緑色)および核対比染色(マゼンタ)でプローブしたアンジオテンシンII処理マウスの動脈、(B)D11-APでプローブした対照偽処理マウスの動脈、(C)D11-APを含まないアンジオテンシンII処理マウスの動脈、(D)D11-APを含まない対照偽処理マウスの動脈(スケールバー=100μm)。 この図の拡大版を表示するには、ここをクリックしてください。
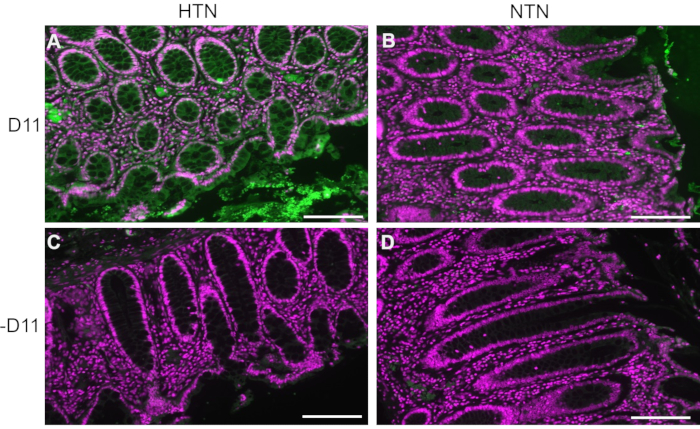
図2:高血圧および正常血圧患者からのヒト腸組織の免疫蛍光。 高血圧(HTN)および正常血圧ヒト(NTN)の患者の組織をD11-AP(D11)の有無にかかわらず染色し、HTN患者におけるIsoLGの存在を示した。(A)D11-AP(緑色)および核対比染色(マゼンタ)で染色されたHTN組織、(B)D11-APで染色されたNTN組織、(C)D11-APなしで染色されたHTN組織、(D)D11-APなしで染色されたNTN組織(スケールバー=100μm)。 この図の拡大版を表示するには、ここをクリックしてください。
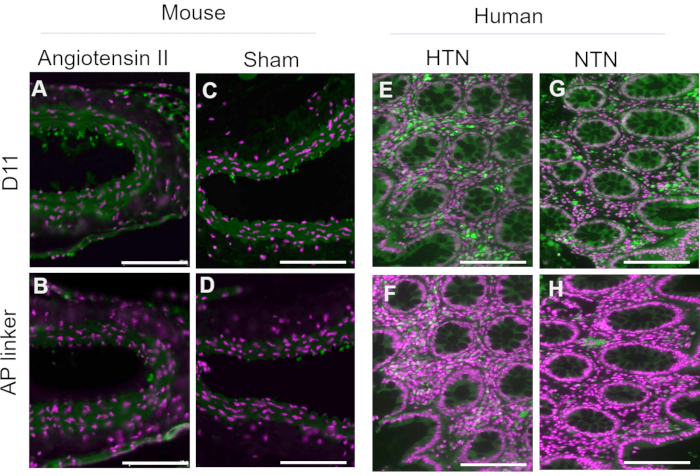
図3:D11-APの有無にかかわらずペリプラズム抽出物で染色されたマウスおよびヒト組織。 マウスおよびヒトの組織を、D11-APの有無にかかわらずペリプラズム抽出物で染色した。画像は、D11-APを含まないペリプラズム抽出物による組織の限定的な染色を示しており、染色は主にペリプラズム抽出物に存在する可能性のある別の成分ではなく、D11-AP結合によるものであることを示しています。(a)D11-AP(緑色)及び核対比染色(マゼンタ)で染色したアンマウス大動脈、 (B)ペリプラズム抽出物で染色したアンマウス大動脈、 (C)D11-APで染色した偽マウス大動脈、 (D)ペリプラズム抽出物で染色した偽マウス大動脈、 (E)D11-APで染色した高血圧性ヒト腸組織、 (F)ペリプラズム抽出物で染色した高血圧性ヒト腸組織、 (G)D11-APで染色した正常血圧ヒト腸管組織、 (h)ペリプラズム抽出物で染色された正常血圧ヒト腸組織(スケールバー=100μm)。 この図の拡大版を表示するには、ここをクリックしてください。
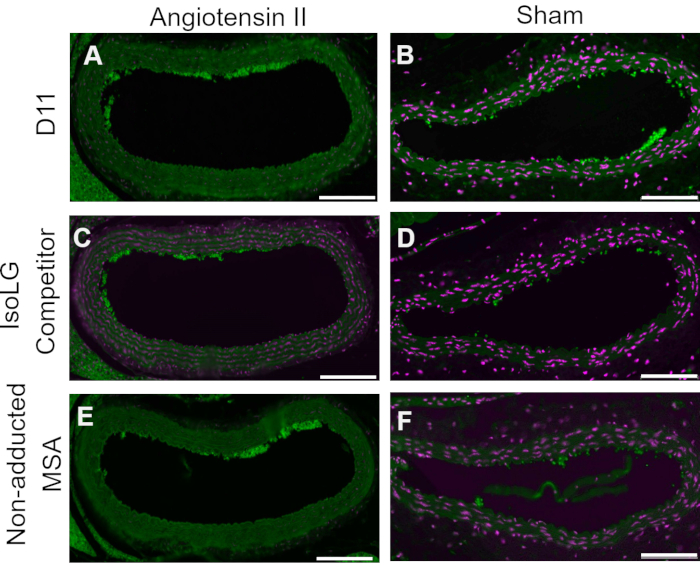
図4:AngマウスとShamマウスの血管における競合対照。 この競合対照において、D11−APをIsoLG付加MSAまたは非付加MSAと共にプレインキュベートした。プレインキュベーションなしのD11-APをコントロールとして用いた。これらの結果は、D11-APと比較してIsoLG-MSAの競合製品による組織の染色が減少しているため、D11-APのIsoLGに対する特異性を示しています。この減少は、非付加MSAプレインキュベーションがD11-APコントロールと同様の染色をもたらしたため、MSAではなくIsoLGによるものである。D11-AP(緑色)および核対比染色(マゼンタ)で染色したアンジオテンシンII(A)およびシャム(B)マウス大動脈、IsoLG-MSAとインキュベートした後にD11-APで染色したアンジオテンシンII(C)およびシャム(D)マウス大動脈、非付加MSA(スケールバー=100μm)とインキュベートした後にD11-APで染色したアンジオテンシンII(E)およびシャム(F)マウス大動脈。 この図の拡大版を表示するには、ここをクリックしてください。
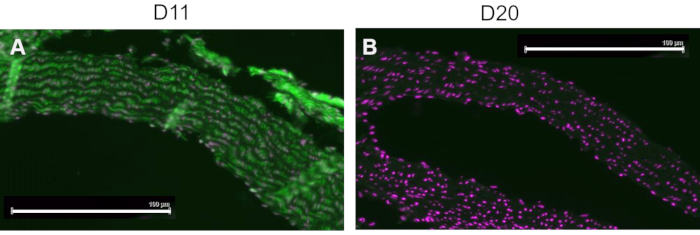
図5:D11および無関係なscFv、D20で染色されたマウス大動脈。 マウス組織をD11-APで染色し、糖タンパク質A2に特異的な無関係な対照抗体D20と比較しました。D11-AP(緑)および核対比染色(マゼンタ)(A)による組織染色は、D20(緑)および核対比染色(マゼンタ)(B)と比較して強い免疫蛍光をもたらし、これはIsoLGに対するD11-APの特異性を示す(スケールバー=100μm)。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
D11は、疾患8,9,20における炎症または酸化ストレスのマーカーとして、細胞または組織中のIsoLG付加タンパク質を検出するために広く使用されています。以前は、D11にはEタグが含まれており、IHCの開発にはHRP10、20、21と結合した二次抗Eタグ抗体を使用する必要がありました。ここでは、Eタグの代わりにアルカリホスファターゼを結合させたD11抗体を使用して、IsoLG付加タンパク質を検出するためのプロトコルを開発および最適化しました。
D11-APの特異性を決定するために、4回の陰性対照実験を行った。D11なしでプロトコルを実行し、最小限の開発しかありませんでした。これらの結果は、内因性アルカリホスファターゼが発生に寄与していないこと、観察された染色がD11によるものであり、他の寄与因子ではないという2つの兆候があります。次に、D11を含まないAPリンカーでスライドを染色した。この実験では染色がほとんどなく、ペリプラズム抽出物中の遊離APまたは他の因子がD11の存在下で観察される染色を引き起こさないことを示しています。D11のIsoLGに対する特異性を確保するために、スライドを染色する前に、精製されたIsoLGでD11-APをプレインキュベートしました。D11-APがIsoLGタンパク質に結合し、組織中に存在するIsoLGに結合する遊離D11-APの量を使い果たしたことを示す発達の減少が見られました。最後に、D11-APがIsoLGに結合し、IsoLGが結合していたMSAタンパク質ではないことを確認するために、D11-APをMSAのみでプレインキュベートしました。発生に変化はなく、D11-APがMSAではなくIsoLGタンパク質に結合していたことを示しています。最後に、染色プロトコルを開発した研究者は、ヒト腸組織の高血圧状態を知らなかった。高血圧患者と正常血圧患者の間で観察された染色の違いはバイアスによるものではなく、以前に説明されています22,23。
Eタグの代わりにアルカリホスファターゼを結合させたD11抗体を用いたIsoLG付加タンパク質の検出プロトコルは厳密かつ堅牢であり、二次抗体のインキュベーションは不要ですが、いくつかの制限があります。1つの制限は、ペリプラズム抽出物にアルカリホスファターゼと結合したD11を使用したことであり、ペリプラズム抽出物または腸24などの特定の組織に内因性アルカリホスファターゼの誤った染色が存在する可能性があります。しかしながら、このプロトコルを開発するための最初のステップは、組織25中に存在し得る内因性アルカリホスファターゼを無効にすることを含んでいた。最初に、冷酢酸、BME、およびレバミゾール26 の効率がテストされました。これらのいずれも、活性内因性アルカリホスファターゼの存在を完全に減少させませんでした。アルカリホスファターゼ27の失活に熱が用いられているため、アルカリホスファターゼの熱失活を異なるバッファーで試験しました。クエン酸緩衝液中でスライドを加熱マウントして水和すると、ほとんどの内因性アルカリホスファターゼが除去されることがわかりました。スライドは当初、化学発光/蛍光基質を使用して開発されましたが、この基質なしで画像化すると、大量の自家蛍光がありました。VectorRedは、アルカリホスファターゼの存在下で発達し、テキサスレッド/TRITCチャネル範囲で視覚化できる色原体を生成する基質です。この基質を用いて、バックグラウンド自家蛍光以上のシグナルをより簡便に観察することができました。染色プロセス中は、人工物の染色を最小限に抑えるように注意する必要があります。水和後のスライド上の組織の乾燥は、イメージングが促進された発達をもたらしました。D11-APは分注し、-20°Cで保存する必要があります。 D11-APを使用する場合は、複数の凍結融解サイクルを避ける必要があります。リン酸緩衝生理食塩水(PBS)もアルカリホスファターゼの酵素活性に影響を与える可能性があるため、洗浄緩衝液として使用すべきではない28。他の抗体ベースのアプローチと同様に、染色が特異的であり、シグナルが過剰または過少に増幅されていないことを確認するために、徹底的なテストと最適化を実行する必要があります。
結論として、Eタグの代わりにアルカリホスファターゼを結合させたD11抗体を使用して、IsoLG付加タンパク質を検出するための強力で厳密で堅牢な最適化されたプロトコルを開発しました。このプロトコルにはいくつかの利点があります:まず、D11をアルカリホスファターゼ融合タンパク質として使用する方が安価です。D11はもともとファージ抗体ライブラリーに由来していたが、これは商業化できず、精製に費用がかかるものであった。 大腸菌 ペリプラズム抽出物中のD11は安価な代替品を提供することができたが、ほとんどのアッセイでは効果がなかった。第二に、アルカリホスファターゼ融合アプローチは、D11 scfvがそれに融合した有用なレポーター15 (アルカリホスファターゼ)を有することを可能にし、基質が市販されているので、イムノアッセイで使用するために精製する必要がないであろう。第三に、 大腸菌 アルカリホスファターゼは二量体29を形成する。したがって、D11は、アルカリホスファターゼに融合すると二量体も形成し、これにより抗体の結合活性および結合活性が増加する30。最後に、ペリプラズム抽出物中のアルカリホスファターゼと結合したD11は、シバクロンブルーセファロースを使用して簡単に洗浄できます。D11は高い等電点(~9.2pH)を有する。そのため、正に帯電しており、パイカチオン相互作用を介してシバクロンブルーに結合することができます。 大腸菌 ペリプラズム抽出物中の不純物のほとんどは、樹脂から溶出することができます。アルカリホスファターゼと結合したD11は、水中の高塩(~1.5M NaCl)を使用して溶出できます。アルカリホスファターゼと結合した溶出D11は、高塩溶液中で4〜8°Cで非常に安定です。したがって、D11抗体を低コストで入手できるだけでなく、二次抗体のインキュベーションの余分なステップと必要性を排除するプロトコルを開発しました。このプロトコルは、酸化ストレスの増加が役割を果たす複数の疾患の組織に蓄積するIsoLGの再現性のある測定を容易にします。
開示事項
著者は開示するものは何もありません。
謝辞
この研究は、国立衛生研究所の助成金K01HL130497、R01HL147818、R01HL144941、およびR03HL155041によってA.K.に支援されました。デジタル組織学共有リソース-テネシー州ヴァンダービルトヘルスナッシュビル https://www.vumc.org/dhsr/46298 視覚化とスライドスキャンに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 1 ml TALON HiTrap column (Cobalt-CMA) | Cytiva | 28953766 | |
| 200 Proof Ethanol | Pharmco | 111000200 | |
| 2xYT powder | MP Biomedicals | 3012-032 | |
| 384-well, clear, flat-bottom polystyrene microplates | ThermoFisher (NUNC) | 242757 | |
| 4-Nitrophenyl phosphate disodium salt hexahydrate (pNPP) | Carbosynth | EN08508 | |
| 5-Bromo-4-chloro-3indoxyl phosphate, p-toluidine salt (BCIP) | Carbosynth | EB09335 | |
| Ampicillin, sodium salt | Research Products International (RPI) | A40040 | |
| Bovine Serum Albumin | RPI | A30075 | |
| Chemically competent TG1 E. coli | Amid Biosciences | TG1-201 | |
| Diethanolamine, >98% | Sigma-Aldrich | D8885 | |
| EDTA | Sigma-Aldrich | ED | |
| Fluoromount-G | SouthernBiotech | 0100-01 | Mouting medium |
| Glucose | Research Products International (RPI) | G32045 | |
| Glycerol | Sigma-Aldrich | G7893 | |
| Histoclear | National Diagnostics | HS-200 | Xylene alternative |
| Hoechst 33342 | ThermoFisher | H3570 | stock solution = 10 mg/mL |
| Hydrochloric acid (HCl), 30%, Macron Fine Chemicals | ThermoFisher | MK-2624-212 | |
| Imidazole | Research Products International (RPI) | I52000 | |
| MgCl2 (anhydrous) | Sigma-Aldrich | M8266 | |
| Mouse Serum Albumin (MSA) | Sigma-Aldrich/Calbiochem | 126674 | |
| Nitroblue tetrazolium chloride (NBT) | Carbosynth | EN13587 | |
| Potassium chloride (KCl) | Sigma-Aldrich | P4504 | |
| Potassium phosphate, monobasic (KH2PO4) | Sigma-Aldrich | P0662 | |
| Pressure Cooker | Cuisinart | CPC-600 | |
| Slide-a-Lyzer Dialysis cassettes, 10K MWCO, 3 ml | ThermoFisher | 66380 | |
| Sodium chloride (NaCl) | Research Products International (RPI) | S23020 | |
| Sodium Citrate | Sigma-Aldrich | 1064461000 | |
| Sodium phosphate, dibasic (Na2HPO4) | Research Products International (RPI) | S23100 | |
| Sucrose | Research Products International (RPI) | S24065 | |
| Tris base | Research Products International (RPI) | T60040 | |
| Tris-buffered Saline | Boston Bio-Products | 25mM Tris, 2.7mM KCl, 137 mM NaCl, pH 7.4 | |
| Tris-HCl | Research Products International (RPI) | T60050 | |
| Tween20 | Sigma-Aldrich | P9416 | |
| Vector Red | Vector Labs | SK-5105 |
参考文献
- Brame, C. J., Salomon, R. G., Morrow, J. D., Roberts, L. J. Identification of extremely reactive gamma-ketoaldehydes (isolevuglandins) as products of the isoprostane pathway and characterization of their lysyl protein adducts. Journal of Biological Chemistry. 274, 13139-13146 (1999).
- Brame, C. J., et al. Modification of proteins by isoketal-containing oxidized phospholipids. Journal of Biological Chemistry. 279, 13447-13451 (2004).
- May-Zhang, L. S., et al. Scavenging reactive lipids to prevent oxidative injury. Annual Review of Pharmacology and Toxicology. 61, 291-308 (2021).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2019 update: A report from the American Heart Association. Circulation. 139, 56 (2019).
- Collins, D. R., et al. Global cardiovascular risk assessment in the primary prevention of cardiovascular disease in adults: Systematic review of systematic reviews. BMJ Open. 7, 013650 (2017).
- Whelton, P. K., et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the prevention, detection, evaluation, and management of high blood pressure in adults: Executive summary: A report of the American College of Cardiology/American Heart Association Task Force on clinical practice guidelines. Circulation. 138, 426-483 (2018).
- Patrick, D. M., Van Beusecum, J. P., Kirabo, A. The role of inflammation in hypertension: Novel concepts. Current Opinion in Physiology. 19, 92-98 (2021).
- Davies, S. S., et al. Isolevuglandins as mediators of disease and the development of dicarbonyl scavengers as pharmaceutical interventions. Pharmacology and Therapeutics. 205, 107418 (2020).
- Dixon, K. B., Davies, S. S., Kirabo, A. Dendritic cells and isolevuglandins in immunity, inflammation, and hypertension. American Journal of Physiology-Heart and Circulation Physiology. 312, 368-374 (2017).
- Kirabo, A., et al. DC isoketal-modified proteins activate T cells and promote hypertension. Journal of Clinical Investigation. 124, 4642-4656 (2014).
- Yan, H. P., et al. Isolevuglandins as a gauge of lipid peroxidation in human tumors. Free Radical Biology and Medicine. 106, 62-68 (2017).
- Davies, S. S., et al. Localization of isoketal adducts in vivo using a single-chain antibody. Free Radical Biology and Medicine. 36, 1163-1174 (2004).
- Shen, Z., et al. Single-chain fragment variable antibody piezoimmunosensors. Analytical Chemistry. 77, 797-805 (2005).
- Hennig, E. E., Mernaugh, R., Edl, J., Cao, P., Cover, T. L. Heterogeneity among Helicobacter pylori strains in expression of the outer membrane protein BabA. Infections and Immunity. 72, 3429-3435 (2004).
- Martin, C. D., et al. A simple vector system to improve performance and utilisation of recombinant antibodies. BMC Biotechnology. 6, 46 (2006).
- Han, Z., Karatan, E., Scholle, M. D., McCafferty, J., Kay, B. K. Accelerated screening of phage-display output with alkaline phosphatase fusions. Combinatorial Chemistry and High Throughput Screening. 7, 55-62 (2004).
- Miller, J. . Handbook for a short course in bacterial genetics. , (1992).
- Nair, R., et al. Yeast extract mediated autoinduction of lacUV5 promoter: An insight. New Biotechnology. 26 (6), 282-288 (2009).
- Davies, S. S., Amarnath, V., Roberts, L. J. Isoketals: Highly reactive γ-ketoaldehydes formed from the H2-isoprostane pathway. Chemistry and Physics of Lipids. 128 (1-2), 85-99 (2004).
- Ngwenyama, N., et al. Isolevuglandin-modified cardiac proteins drive CD4+ T-Cell activation in the heart and promote cardiac dysfunction. Circulation. 143 (12), 1242-1255 (2021).
- Prinsen, J. K., et al. Highly reactive Isolevuglandins promote atrial fibrillation caused by hypertension. Basic to Translational Science JACC. 5 (6), 602-615 (2020).
- Ferguson, J. F., et al. High dietary salt-induced dendritic cell activation underlies microbial dysbiosis-associated hypertension. JCI Insight. 5 (13), 126241 (2019).
- Madhur, M. S., et al. Hypertension: Do inflammation and immunity hold the key to solving this epidemic. Circulation Research. 128 (7), 908-933 (2021).
- Estaki, M., DeCoffe, D., Gibson, D. L. Interplay between intestinal alkaline phosphatase, diet, gut microbes and immunity. World Journal of Gastroenterology. 20 (42), 15650-15656 (2014).
- Millán, J. L. . Mammalian alkaline phosphatases: From biology to applications in medicine and biotechnology. , (2006).
- Ponder, B. A., Wilkinson, M. M. Inhibition of endogenous tissue alkaline phosphatase with the use of alkaline phosphatase conjugates in immunohistochemistry. Journal of Histochemistry and Cytochemistry. 29 (8), 981-984 (1981).
- Goldstein, D. J., Rogers, C. E., Harris, H. Expression of alkaline phosphatase loci in mammalian tissues. Proceedings of the National Academy of Science U. S. A. 77 (5), 2857-2860 (1980).
- Ramos-Vara, J. A. Technical aspects of immunohistochemistry. Veterinary Pathology. 42 (4), 405-426 (2005).
- Coleman, J. E. Structure and mechanism of alkaline phosphatase. Annual Review of Biophysics and Biomolecular Structure. 21, 441-483 (1992).
- Harper, J. E., Toth, R. L., Mayo, M. A., Torrance, L. Properties of a panel of single chain variable fragments against Potato leafroll virus obtained from two phage display libraries. Journal of Virological Methods. 81 (1-2), 159-168 (1999).
Erratum
Formal Correction: Erratum: Direct Detection of Isolevuglandins in Tissues using a D11 scFv-Alkaline Phosphatase Fusion Protein and Immunofluorescence
Posted by JoVE Editors on 4/11/2023. Citeable Link.
An erratum was issued for: Direct Detection of Isolevuglandins in Tissues using a D11 scFv-Alkaline Phosphatase Fusion Protein and Immunofluorescence. The Authors section was updated from:
Cassandra Warden1
Alan J. Simmons2
Lejla Pasic3
Sean S. Davies4
Justin H. Layer5
Raymond L. Mernaugh3
Annet Kirabo4,6
1Vanderbilt Eye Institute, Vanderbilt University Medical Center
2Department of Cell and Developmental Biology, Vanderbilt University
3Department of Biochemistry, Vanderbilt University
4Division of Clinical Pharmacology, Department of Medicine, Vanderbilt University Medical Center
5Division of Hematology and Oncology, Indiana University School of Medicine
6Department of Molecular Physiology and Biophysics, Vanderbilt University
to:
Cassandra Warden1
Alan J. Simmons2
Lejla Pasic3
Ashley Pitzer4,6
Sean S. Davies4
Justin H. Layer5
Raymond L. Mernaugh3
Annet Kirabo4,6
1Vanderbilt Eye Institute, Vanderbilt University Medical Center
2Department of Cell and Developmental Biology, Vanderbilt University
3Department of Biochemistry, Vanderbilt University
4Division of Clinical Pharmacology, Department of Medicine, Vanderbilt University Medical Center
5Division of Hematology and Oncology, Indiana University School of Medicine
6Department of Molecular Physiology and Biophysics, Vanderbilt University
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved