Method Article
Rilevazione diretta delle isolevuglandine nei tessuti utilizzando una proteina di fusione della fosfatasi alcalina D11 scFv e immunofluorescenza
* Questi autori hanno contribuito in egual misura
In questo articolo
Erratum Notice
Riepilogo
Questo articolo fornisce una metodologia dettagliata per la misurazione delle isolevuglandine nei tessuti mediante immunofluorescenza utilizzando l'anticorpo ScFv D11 coniugato con fosfatasi alcalina. I modelli di ipertensione sia nei topi che nell'uomo sono utilizzati per spiegare le procedure passo-passo e i principi fondamentali associati alla misurazione dell'isolevuglandina nei campioni di tessuto.
Abstract
Le isolevuglandine (IsoLGs) sono chetoaldeidi gamma altamente reattive formate da H2-isoprostani attraverso la perossidazione lipidica e le proteine reticolanti che portano all'infiammazione e a varie malattie tra cui l'ipertensione. Il rilevamento dell'accumulo di IsoLG nei tessuti è fondamentale per far luce sul loro coinvolgimento nei processi patologici. Tuttavia, la misurazione delle IsoLG nei tessuti è estremamente difficile e gli strumenti attualmente disponibili, compresa l'analisi della spettrometria di massa, sono laboriosi ed estremamente costosi. Qui descriviamo un nuovo metodo per la rilevazione in situ di IsoLGs nei tessuti utilizzando ScFv D11 coniugato con fosfatasi alcalina e un anticorpo fagico ricombinante prodotto in E. coli mediante microscopia immunofluorescente. Quattro controlli sono stati utilizzati per convalidare la colorazione: (1) colorazione con e senza D11, (2) colorazione con estratto periplasmatico batterico con il linker della fosfatasi alcalina, (3) colorazione anticorpale scFV irrilevante e (4) controllo competitivo con IsoLG prima della colorazione. Dimostriamo l'efficacia del D11 coniugato con fosfatasi alcalina in tessuti umani e murini con o senza ipertensione. Questo metodo servirà probabilmente come uno strumento importante per studiare il ruolo delle IsoLG in un'ampia varietà di processi patologici.
Introduzione
Le isolevuglandine (IsoLGs), note anche come isochetali, sono isomeri della famiglia delle 4-chetoaldeide, che sono prodotti della perossidazione lipidica e reagiscono e si addotto alle ammine primarie sulle proteine 1,2. Le IsoLG sono state implicate in diverse malattie, tra cui malattie cardiovascolari, Alzheimer, polmonari ed epatiche e molti tipi di cancro3. Le IsoLG sono state ampiamente studiate nel loro contributo alle malattie cardiovascolari (CVD), che è un onere sanitario ed economico significativo a livello globale, compresi gli Stati Uniti. Si stima che 92,1 milioni di adulti statunitensi abbiano almeno un tipo di CVD, con proiezioni stimate per il 2030 che raggiungono il 43,9% della popolazione adulta degli Stati Uniti4. L'abbassamento della pressione sanguigna, del colesterolo e la cessazione del fumo riducono il rischio complessivo e l'insorgenza di eventi CVD5.
L'ipertensione o ipertensione è un importante fattore di rischio per le malattie cardiovascolari e colpisce circa la metà della popolazione degli Stati Uniti6. Studi precedenti hanno scoperto che l'infiammazione è una causa sottostante dell'ipertensione e che gli IsoLG svolgono un ruolo7. Gli stimoli ipertensivi, tra cui angiotensina II, catecolamine, aldosterone e sale alimentare in eccesso, inducono l'accumulo di IsoLG nelle cellule presentanti l'antigene, comprese le cellule dendritiche (DC), che a loro volta attivano le cellule T per proliferare e produrre citochine infiammatorie che contribuiscono all'ipertensione 8,9.
In precedenza, gli IsoLG sono stati misurati mediante immunoistochimica, spettrometria di massa, saggio immunoassorbente enzimatico e citometria a flusso10,11. Per facilitare la misurazione degli IsoLG, è stato sviluppato un anticorpo ricombinante (D11) a frammento a catena singola (scfv) contro gli IsoLG12. Inizialmente, questo anticorpo D11 conteneva un E-tag di aminoacidi 11 e richiedeva un anticorpo secondario per il rilevamento immunoistochimico11. Tuttavia, è stato difficile trovare un anticorpo secondario affidabile contro l'E-tag dopo l'interruzione della sua produzione da parte del produttore. Pertanto, abbiamo sviluppato un protocollo affidabile per la colorazione immunofluorescente di IsoLGs utilizzando D11 coniugato con fosfatasi alcalina (D11-AP), che abbiamo dimostrato in tessuti murini e umani con e senza ipertensione.
Protocollo
Il Comitato istituzionale per la cura e l'uso degli animali della Vanderbilt University ha approvato tutte le procedure descritte in questo manoscritto. I topi sono alloggiati e curati in conformità con la Guida per la cura e l'uso degli animali da laboratorio. Tutti i soggetti hanno dato il consenso informato scritto prima di iscriversi allo studio come approvato dall'Institutional Review Board della Vanderbilt University. Tutte le procedure sono state eseguite secondo la Dichiarazione di Helsinki.
1. Preparazione di plasmidi codificanti la proteina di fusione della fosfatasi alcalina D11 e vettori di controllo negativo
- Costruire una versione modificata del plasmide pCANTAB5E13,14 in cui il segmento variabile a singola catena (scFv) è collegato alla sua estremità 3' a una sequenza che codifica fosfatasi alcalina batterica (AP).
NOTA: Immediatamente a valle del sito di restrizione NotI della sequenza scFv, il plasmide modificato non contiene più la sequenza codificante dell'E-tag e codifica invece la sequenza linker GGSGGHMGSGG, seguita dalla sequenza per AP (GenBank accession number AXY87039.1, T16-K464)15,16. A valle di AP, il plasmide codificherà i tag 8xHis e DYKDDDDK. All'estremità 3' dei tag, la sequenza di codifica termina con un codone di arresto ambra. Il plasmide modificato è chiamato pCANTAB5-AP. - Clonare D11 scFv (numero di adesione GenBank AAW28931.1) in pCANTAB5-AP con i siti di restrizione SfiI/NotI.
- Clonare D20 scFv in pCANTAB5-AP con i siti di restrizione SfiI/NotI.
NOTA: D20 scFv è un controllo negativo progettato per valutare il modello di interazione tissutale di un scFv irrilevante. Questo scFv è stato originariamente selezionato dal display fagico per la sua capacità di interagire con un gruppo glicano noto come A2. - Generare un vettore "vuoto" rimuovendo completamente la porzione scFv dal plasmide e sostituendola con una sequenza codificante "AP linker" costituita dagli amminoacidi GGGGSGRAGSGGGGS.
- Trasformare tutti i plasmidi in TG1 E. coli competente e far crescere i batteri durante la notte a 30 °C, su piastre di agar allo 0,5% contenenti 2xYT integrate con 100 μg/ml di ampicillina e 2% di glucosio (2xYTAG) di mezzo.
NOTA: I ceppi con il gene supE (come TG1 E. coli) non sopprimono il codone di stop ambrato al 100%. Le stime vanno dallo 0,8 al 20% delle volte, quindi c'è ancora molto prodotto che termina appena a valle del BAP, poiché è destinato a questi esperimenti17. TG1 E. coli sono utilizzati principalmente per ragioni pratiche, come la riduzione di tempi e costi, la loro compatibilità con il sistema di espressione della proteina pCANTAB e il loro uso nella visualizzazione dei fagi, che viene comunemente condotta in laboratorio. A valle del codone di stop ambrato che segue BAP c'è una sequenza per geneIII. Le proteine di fusione GeneIII devono essere espresse raramente affinché la visualizzazione dei fagi funzioni come previsto perché le proteine di fusione scFv-geneIII interferiscono con quella particolare proteina geneIII per reinfettare i batteri naïve. Pertanto, le proteine geneIII libere da fusione devono esistere durante l'assemblaggio del virione per la generazione di fagi funzionanti, cioè i prodotti proteici scFv-geneIII sono di solito relativamente rari all'interno del batterio. D11-AP, D20-AP, vettore vuoto e tutti i costrutti usati in questo articolo sono tutti influenzati in modo simile dall'occasionale espressione della proteina di fusione geneIII. Ci sono ancora differenze osservate nel modo in cui queste proteine si comportano. - Scegli una singola colonia e inocula 5 ml di coltura 2xYTAG. Lasciare che i batteri crescano durante la notte a 30 °C e agitarsi a 150 giri/min.
- Pellettare le celle mediante centrifugazione a 3.000 x g per 10 minuti a temperatura ambiente. Scartare il surnatante e risospendere il pellet in 2 ml di 85% 2xYTAG e 15% glicerolo.
- Mantenere le scorte di glicerolo in un congelatore a -80 °C.
2. Espressione proteica e generazione di estratto periplasmatico
NOTA: La generazione dell'estratto periplasmatico è un metodo comunemente usato per l'espressione proteica nella visualizzazione dei fagi, principalmente perché la formazione di legami disolfuro è importante nella generazione di scFv e anticorpi. Il metodo evita la necessità di generare lisati (comunemente contenenti corpi di inclusione) e garantisce che le proteine siano correttamente piegate. pCANTAB ha una sequenza di segnale gIII a monte della porzione scFv della proteina di fusione D11-BAP. La sequenza di segnale assicura che la proteina venga trasportata nello spazio periplasmatico del batterio e quindi la sequenza di segnale venga scissa. Lo spazio periplasmatico fornisce un ambiente ossidante, che è cruciale per la corretta formazione dei ponti disolfuro. Lo shock osmotico viene utilizzato per ricavare estratti periplasmatici perché distrugge la membrana esterna abbastanza da rilasciare le proteine periplasmatiche nel mezzo circostante, mantenendo intatto il batterio.
- Inoculare le scorte di glicerolo di TG1 E. coli contenenti i relativi plasmidi in una coltura di 60 mL di 2xYTAG e coltura per una notte a 30 °C con agitazione a 150 giri/min.
- Per indurre l'espressione proteica, colture batteriche di pellet a 3.000 x g per 10 minuti, risospendere in 60 ml di terreno 2xYTA e coltura per una notte a 30 °C con agitazione a 150 giri/min.
NOTA: Il passaggio da 2xTYAG a 2xYTA medium aiuta a indurre sufficientemente l'espressione proteica18. Quando il glucosio è presente nel mezzo batterico, il promotore lac viene soppresso perché i batteri consumano preferenzialmente glucosio e ignorano il lattosio, poiché il glucosio richiede meno energia per essere elaborato. Quando il glucosio viene rimosso seguendo il passaggio del mezzo, i batteri si affidano ai carboidrati forniti dal mezzo 2xYT. L'estratto di lievito (il componente Y in 2xYT) contiene carboidrati, tra cui il lattosio, ed è, quindi, in grado di guidare l'espressione proteica attraverso il promotore lac. L'IPTG non è necessaria con il costrutto pCANTAB e può causare un'eccessiva espressione proteica, insieme a corpi di inclusione che si traducono in proteine non funzionali. - Generare estratti periplasmatici tramite shock osmotico.
- Colture batteriche in pellet a 3.000 x g per 10 min.
- Risospendere in 20 mL di 1xTES (0,2 M Tris-HCl pH 8,0, 0,5 mM EDTA, 0,5 M saccarosio) e incubare per 1 ora su ghiaccio.
- Pellet di nuovo a 3.000 x g per 10 minuti e risospendere in 15 ml di 0,05 M Tris, pH 7,6.
- Incubare questa sospensione su ghiaccio per 1 ora, quindi chiarire mediante centrifugazione a 5.000 x g per 10 minuti.
- Trasferire i surnatanti in una provetta fresca e conservare a -20 °C fino a quando necessario per la purificazione o l'uso diretto negli esperimenti.
- Valutare la lisi cellulare mediante la presenza di D11-BAP attivo nell'ELISA. Aggiungere 3-5 μL dell'estratto periplasmatico a un mL di pNPP, quindi osservare se si verifica un cambiamento di colore nei successivi 10 minuti (il colore va dal giallo chiaro al giallo intenso).
NOTA: Il colore può essere confrontato fianco a fianco con un tubo di pNPP che non ha ricevuto alcun lisato o un tubo di pNPP che ha ricevuto lisato di batteri naïve TG1. Quantificare con assorbanza a 405 nm.
4. Caratterizzazione del titolo D11-AP in ELISA
- Rivestire una piastra di polistirene da 384 pozzetti per una notte a 4 °C con soluzione salina tamponata con fosfato (PBS) da 25 μL/pozzetto (PBS) (1,8 mM KH 2 PO 4, 10 mM Na 2 HPO4,2,7mM KCl, 137 mM NaCl) contenente 5 μg/ml di albumina sierica di topo (MSA) (controllo negativo) o 5 μg/ml di IsoLG/MSA (controllo positivo).
- Svuotare il piatto e toccare asciutto. Lavare una volta con PBS + 0,1% Tween (PBS-T). Svuotare il piatto e toccare asciutto.
- Riempire la piastra con PBS-T come tampone bloccante (120 μL/pozzetto). Incubare per 1 ora a temperatura ambiente.
- Svuotare il piatto e toccare asciutto. Applicare diluizioni seriali 1:2 di estratti periplasmatici D11-AP a 25 μL/pozzetto e diluiti in PBS-T. Includere un pozzetto contenente solo PBS-T come controllo negativo.
NOTA: Gli intervalli di diluizione tipici per gli estratti periplasmatici sono 1:8 - 1:4096. Per un volume di analisi di 25 μL, iniziare con 50 μL della concentrazione iniziale "1:8": 6,25 μL di estratto periplasmatico e 43,75 μL di PBS-T. Quindi, eseguire una diluizione 2 volte rimuovendo 25 μL di questa soluzione e aggiungendola al pozzetto successivo contenente 25 μL di PBS-T e pipettandola su e giù. Questo pozzo ora contiene la diluizione "1:16". Continuare a ripetere la diluizione 2 volte per generare la serie di diluizione 1:2 descritta. - Incubare per 1,5 h a temperatura ambiente.
- Svuotare il piatto e toccare asciutto. Lavare 5 volte con PBS-T. Svuotare e toccare a secco.
- Preparare la soluzione di pNPP sciogliendo 1 g di pNPP in 1 L di 930 mM di dietanolammina (soluzione madre al 98% diluita 1:10 in H 2 O), con 0,5 mM MgCl2 e regolata a pH 9,5 con HCl.
- Applicare una soluzione pNPP da 25 μL/pozzetto per sviluppare AP. Incubare per 1 ora a temperatura ambiente e determinare l'assorbanza a 405 nm all'interno di ciascun pozzetto utilizzando un lettore di piastre compatibile.
- Confrontare il segnale generato dai pozzetti IsoLG/MSA con il rumore generato dai pozzi MSA e trovare l'intervallo di diluizioni in cui il segnale è almeno 5 volte superiore al rumore.
- Tracciare questa serie di diluizioni del segnale D11-AP su un grafico, determinare l'intervallo lineare della curva e stabilire la diluizione in cui è possibile osservare il 50% del segnale.
NOTA: Se questa diluizione è equivalente a circa 1:1.000, la soluzione di D11-AP può essere utilizzata ad una concentrazione di 1:10 in IHC/IF.
5. Immunofluorescenza
- Tagliare sezioni seriali di tessuti incorporati in paraffina umana e di topo (5 μm di spessore) utilizzando un microtomo e porli a bagnomaria tiepida (37 °C). Montare sezioni di tessuto su vetrini e lasciare asciugare per una notte.
NOTA: Per questo studio, le aorte sono state ottenute dai topi. Sezioni del colon di esseri umani normotesi e ipertesi sono state ottenute dalla Vanderbilt Cooperative Human Tissue Network. - Immergere i vetrini in xilene tre volte per 5 minuti per deparaffinizzare i tessuti.
- Reidratare i tessuti in 2 lavaggi ciascuno del 95%, 70% e 50% di etanolo in H2O.
- Lavare i vetrini in soluzione salina tamponata Tris (TBS) con Tween20 allo 0,1% (TBST) tre volte con lavaggi rapidi riempiendo il supporto del vetrino con TBST e quindi scartando TBST.
NOTA: I vetrini idratati possono essere conservati in TBST a 4 °C per non più di una settimana prima del recupero dell'antigene. - Per eseguire il recupero dell'antigene indotto dal calore dei vetrini, posizionare i vetrini in tampone di citrato di sodio preriscaldato (80-95 °C) (10 mM di citrato di sodio, 0,05% Tween 20, pH 6,0) e incubare in una pentola a pressione impostata a 4 minuti ad alta pressione per un tempo totale di recupero dell'antigene di 20 minuti.
- Rimuovere i vetrini dalla pentola a pressione e lasciarli raffreddare per 20 minuti a temperatura ambiente.
- Lavare i vetrini in TBST tre volte con lavaggi rapidi.
NOTA: I vetrini possono essere conservati in TBST dopo il recupero dell'antigene per non più di una settimana prima della colorazione. - Aggiungi il 2% di BSA disciolto in TBST per bloccare le diapositive. Coprire i vetrini con una striscia di pellicola di paraffina e incubare a temperatura ambiente per 15 minuti.
- Eliminare il buffer di blocco dalle diapositive.
- Aggiungere 200 μL di 1:10 D11-AP in TBST ai vetrini e coprire con una striscia di pellicola di paraffina.
- Incubare in una camera umidificata per ridurre al minimo l'evaporazione della soluzione anticorpale per 3 ore a temperatura ambiente.
- Lavare i vetrini tre volte in TBST.
- Sviluppare con uno sviluppatore di fosfatasi alcalina colorimetrica o fluorescente per immunoistochimica o immunofluorescenza, rispettivamente. Lavare le diapositive una volta con TBST per rimuovere lo sviluppatore in eccesso e prevenire ulteriori sviluppi del colore.
- Vetrini antimacchia con colorazione nucleare di Hoechst a 1 μg/mL in PBS per immunofluorescenza. Lavare i vetrini una volta in TBST per rimuovere eventuali contromacchie in eccesso.
- Applicare i vetrini di copertura utilizzando il supporto di montaggio.
- Visualizza i vetrini sotto un microscopio a luce invertita per l'immunoistochimica o un microscopio fluorescente confocale per l'immunofluorescenza.
6. Controlli negativi
NOTA: È possibile eseguire quattro esperimenti di controllo negativo per confermare la specificità della colorazione D11-AP per IsoLG. Gli esperimenti di controllo negativo devono essere eseguiti nello stesso set di colorazione nelle stesse condizioni.
- Nel primo esperimento di controllo negativo, incubare tessuti con D11-AP diluito in TBST o TBST da solo.
- Incubare tessuti con D11-AP diluito in TBST ed estratto periplasmatico batterico senza D11-AP (AP Linker) diluito in TBST.
- Eseguire un test competitivo con IsoLG/MSA o MSA non addotto come descritto in precedenza12.
- Preparare IsoLG e IsoLG addotti all'albumina sierica di topo (MSA) come descritto in precedenza19, con un rapporto molare di 8 IsoLG: 1 MSA (8:1 IsoLG/MSA).
- Diluire D11-AP 1:10 in TBST.
- Incubare D11-AP diluito con 50 μg/mL di IsoLG/MSA o MSA non addotto per 1 ora a temperatura ambiente.
- Aggiungere D11-AP con IsoLG/MSA o D11-AP con MSA non addotto ai tessuti per la colorazione.
- Utilizzare anticorpi scFv irrilevanti, D20, per colorare i tessuti per il set di controllo negativo finale.
Risultati
In esperimenti rappresentativi, D11 scfv con una coniugazione di fosfatasi alcalina (D11-AP) è stato utilizzato in immunofluorescenza per rilevare IsoLG presenti nei topi trattati con angiotensina II rispetto ai topi sham normali e negli esseri umani con ipertensione rispetto agli esseri umani normotensivi. I topi sono stati trattati con angiotensina II alla dose di 490 ng / kg / min per due settimane e l'ipertensione è stata confermata con un aumento della pressione arteriosa sistolica rispetto ai topi sham10. Per garantire la specificità di D11-AP, i tessuti sono stati colorati con o senza la presenza di D11-AP. Come dimostrato dalla colorazione D11-AP, l'aorta di topi con ipertensione indotta da angiotensina II ha mostrato un'elevata concentrazione di IsoLG rispetto ai topi di controllo (Figura 1). La colorazione di fondo o l'autofluorescenza erano limitate, come dimostrato dai controlli negativi che non erano colorati con D11-AP.
D11-AP è stato utilizzato per rilevare le IsoLG presenti nei tessuti intestinali di pazienti umani con ipertensione (HTN) o normotesi (NTN). Lo stato di ipertensione è stato stabilito dai registri ospedalieri come pressione arteriosa sistolica superiore a 140 e pressione diastolica superiore a 80 mmHg. I ricercatori che hanno sviluppato il protocollo di immunofluorescenza per D11-AP sono stati ciechi allo stato di ipertensione dei tessuti umani. Le sezioni sono state colorate in presenza e assenza di D11-AP per garantire la specificità anticorpale e mostrare colorazione di fondo o autofluorescenza. Come mostrato nella Figura 2, abbiamo scoperto che i tessuti di pazienti con HTN avevano concentrazioni elevate di IsoLGs rispetto ai pazienti con NTN. La colorazione senza D11-AP ha anche mostrato una colorazione di fondo minima e autofluorescenza. La fosfatasi alcalina endogena è espressa dall'epitelio intestinale, quindi la limitata fluorescenza dei tessuti colorati senza D11-AP mostra che il recupero dell'antigene utilizzato in questo protocollo era sufficiente per inattivare la fosfatasi alcalina endogena presente nei tessuti. In combinazione con i risultati nei topi, questi risultati mostrano anche che il protocollo di immunofluorescenza mostra efficacemente elevati IsoLG nell'ipertensione rispetto allo stato normotensivo.
D11-AP è stato isolato e conservato nell'estratto periplasmatico batterico. I tessuti di topo e umani sono stati colorati con D11-AP ed estratto periplasmatico contenente il linker AP senza D11 per garantire che altri fattori che possono essere presenti nell'estratto periplasmatico, come la fosfatasi alcalina in eccesso o non coniugata, non contribuiscano alla colorazione osservata nei tessuti trattati con D11-AP (Figura 3). I tessuti colorati con D11-AP hanno provocato una colorazione più luminosa rispetto ai tessuti colorati con estratto periplasmatico. Questi risultati confermano che D11-AP sta colorando i tessuti e la colorazione non è dovuta alla fosfatasi alcalina batterica non coniugata che può potenzialmente essere presente nell'estratto periplasmatico e provocare una falsa colorazione di IsoLG o contribuire alla colorazione di fondo.
Un controllo competitivo è stato eseguito pre-incubando D11-AP con IsoLG addotto a MSA o MSA non addotto prima di colorare i tessuti per mostrare la specificità di D11-AP a IsoLG. Se D11-AP è specifico per IsoLG, l'anticorpo si legherebbe a IsoLG-MSA, con conseguente disponibilità esaurita di D11-AP per colorare i tessuti, e D11-AP incubato con MSA non addotto avrebbe una colorazione simile al normale D11-AP. Nei tessuti colorati con D11-AP pre-incubati con il concorrente IsoLG, abbiamo riscontrato una colorazione ridotta rispetto ai tessuti che sono stati colorati con D11-AP senza alcuna preincubazione (Figura 4). Nei tessuti colorati con D11-AP preincubati con MSA non addotto, abbiamo trovato che la colorazione è simile alla colorazione osservata nei tessuti con D11-AP. Questi risultati mostrano la specificità di D11-AP rispetto agli IsoLG a causa della ridotta colorazione dei tessuti quando D11-AP è stato pre-incubato con IsoLG / MSA, ma non MSA non addotto. Nel controllo negativo finale, il tessuto del topo è stato colorato con D11-AP o anticorpo scFv irrilevante, D20. La colorazione dell'aorta di topo con D11-AP ha determinato una forte colorazione rispetto a D20 indicando la specificità di D11-AP rispetto alle IsoLG nelle aorte ipertensive (Figura 5).
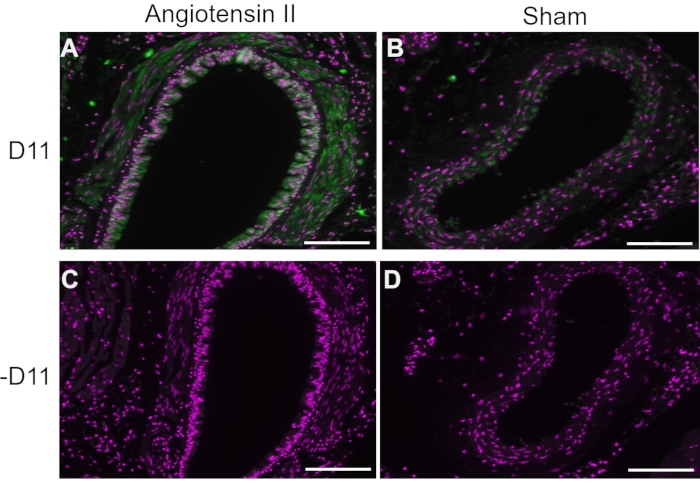
Figura 1: Immunofluorescenza dell'aorta in topi ipertesi e normotensivi. Le arterie di angiotensina II e topi infusi con finzione sono state colorate con e senza D11-AP (D11) per mostrare la presenza di IsoLG. (A) Arteria di un topo trattato con angiotensina II sondato con D11-AP (verde) e controcolorante nucleare (magenta), (B) Arteria di un topo trattato con finzione di controllo sondato con D11-AP, (C) Arteria di un topo trattato con angiotensina II senza D11-AP, (D) Arteria di un topo trattato con sham di controllo senza D11-AP (barra di scala = 100 μm). Fare clic qui per visualizzare una versione ingrandita di questa figura.
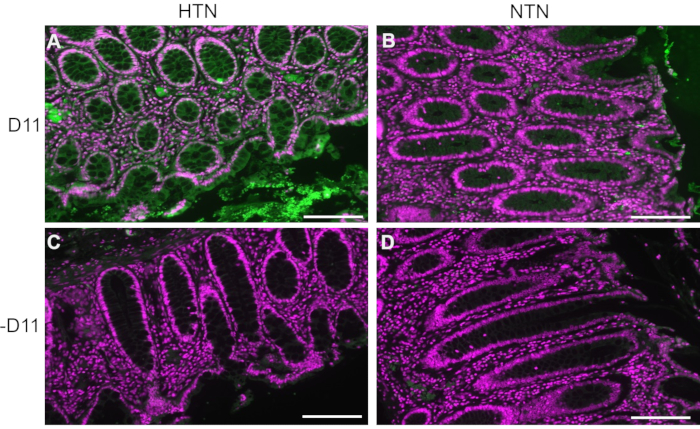
Figura 2: Immunofluorescenza dei tessuti intestinali umani di pazienti ipertesi e normotensivi. I tessuti di pazienti con ipertensione (HTN) e normotesi nell'uomo (NTN) sono stati colorati con e senza D11-AP (D11) per mostrare la presenza di IsoLGs nei pazienti con HTN. (A) tessuti HTN colorati con D11-AP (verde) e controcolorante nucleare (magenta), (B) tessuti NTN colorati con D11-AP, (C) tessuti HTN colorati senza D11-AP, (D) tessuti NTN colorati senza D11-AP (barra scala =100 μm). Fare clic qui per visualizzare una versione ingrandita di questa figura.
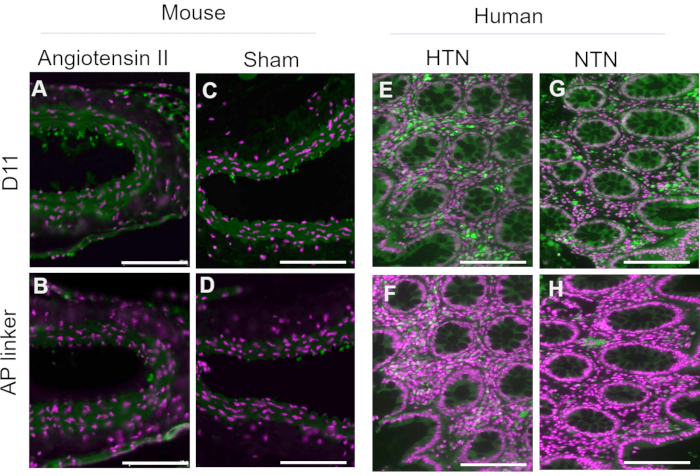
Figura 3: Tessuti di topo e umani colorati con estratto periplasmatico con e senza D11-AP. I tessuti di topo e umani sono stati colorati con estratti periplasmatici con e senza D11-AP. Le immagini mostrano una colorazione limitata dei tessuti con estratto periplasmatico senza D11-AP, che mostrano che la colorazione è dovuta principalmente al legame D11-AP piuttosto che ad un altro componente che può essere presente nell'estratto periplasmatico. (A) Aorta di topo Ang colorata con D11-AP (verde) e controcolorante nucleare (magenta), (B) Aorta di topo Ang colorata con estratto periplasmatico, (C) Aorta di topo fittizia colorata con D11-AP, (D) Aorta di topo fittizia colorata con estratto periplasmatico, (E) tessuto intestinale umano ipertensivo colorato con D11-AP, (F) tessuto intestinale umano ipertensivo colorato con estratto periplasmatico, (G) tessuto intestinale umano normotensivo colorato con D11-AP, (H) tessuto intestinale umano normotensivo colorato con estratto periplasmatico (barra della scala = 100 μm). Fare clic qui per visualizzare una versione ingrandita di questa figura.
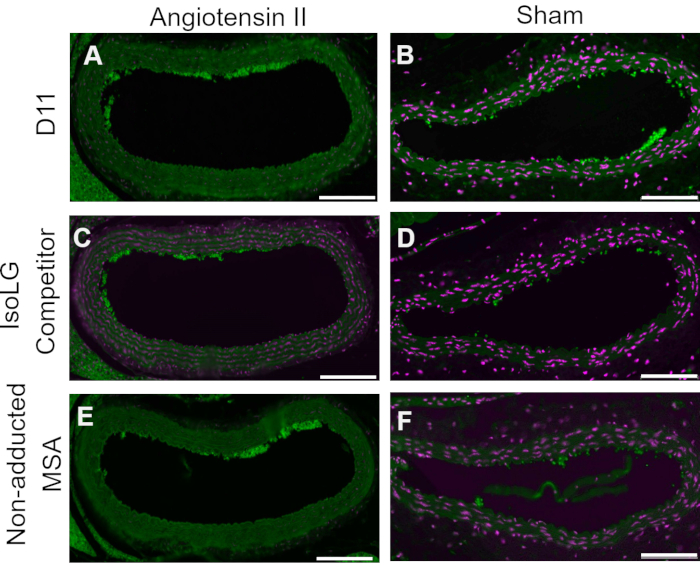
Figura 4: Controllo competitivo nei vasi di topi Ang e Sham. In questo controllo competitivo, D11-AP è stato pre-incubato con MSA addotto IsoLG o MSA non addotto. D11-AP senza alcuna pre-incubazione è stato utilizzato come controllo. Questi risultati mostrano la specificità di D11-AP per IsoLGs perché vi è una ridotta colorazione dei tessuti con il concorrente IsoLG-MSA rispetto a D11-AP. Questa riduzione è dovuta a IsoLG e non MSA perché la pre-incubazione MSA non addotta ha portato a una colorazione simile al controllo D11-AP. Aorta di topo Angiotensina II (A) e Sham (B) colorata con D11-AP (verde) e controcolorante nucleare (magenta), aorta di topo Angiotensina II (C) e Sham (D) colorata con D11-AP dopo incubazione con IsoLG-MSA, Angiotensina II (E) e Sham (F) aorta di topo colorata con D11-AP dopo incubazione con MSA non addotto (barra della scala = 100 μm). Fare clic qui per visualizzare una versione ingrandita di questa figura.
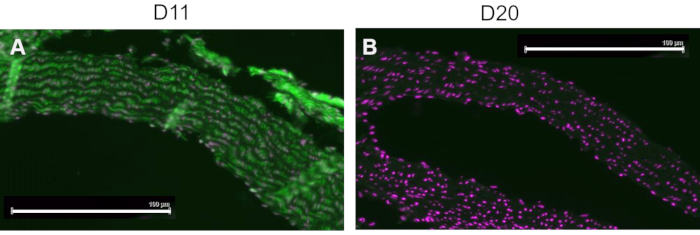
Figura 5: Aorta di topo colorata con D11 e scFv irrilevante, D20. Il tessuto del topo è stato colorato con D11-AP e confrontato con un anticorpo di controllo irrilevante, D20, che è specifico per la glicoproteina A2. La colorazione del tessuto con D11-AP (verde) e controcolorazione nucleare (magenta) (A) ha determinato un'intensa immunofluorescenza rispetto a D20 (verde) e controcolorazione nucleare (magenta) (B) che indica la specificità di D11-AP rispetto alle IsoLG (barra di scala = 100 μm). Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
D11 è stato ampiamente utilizzato per rilevare le proteine addotto IsoLG in cellule o tessuti come marker per l'infiammazione o lo stress ossidativo nella malattia 8,9,20. In precedenza, D11 conteneva un tag E e lo sviluppo IHC richiedeva l'uso di un anticorpo secondario anti-E tag coniugato con HRP10,20,21. Qui, abbiamo sviluppato e ottimizzato il protocollo per la rilevazione di proteine addotto IsoLG utilizzando l'anticorpo D11 coniugato con fosfatasi alcalina al posto del tag E, che elimina la necessità di un'incubazione anticorpale secondaria.
Per determinare la specificità di D11-AP, sono stati eseguiti quattro esperimenti di controllo negativo. Abbiamo eseguito il protocollo senza la presenza di D11 e abbiamo avuto uno sviluppo minimo. Questi risultati hanno una duplice indicazione: la fosfatasi alcalina endogena non contribuisce allo sviluppo e la colorazione osservata è dovuta a D11 e non a un altro fattore che contribuisce. Successivamente, abbiamo colorato le diapositive con il linker AP senza D11. Questo esperimento ha portato a una piccola colorazione, che indica che l'AP libero o altri fattori nell'estratto periplasmatico non causano la macchia che osserviamo in presenza di D11. Per garantire la specificità di D11 a IsoLG, abbiamo preincubato D11-AP con IsoLG purificato prima di colorare i vetrini. Abbiamo visto una diminuzione dello sviluppo che indica che il D11-AP era legato alla proteina IsoLG, esaurendo così la quantità di D11-AP libero per legarsi a IsoLG presente nel tessuto. Infine, per garantire che D11-AP si legasse a IsoLG e non alla proteina MSA a cui IsoLG era legato, abbiamo preincubato D11-AP solo con MSA. Non ci sono stati cambiamenti nello sviluppo, indicando che D11-AP non si legava alla MSA ma alla proteina IsoLG. Infine, i ricercatori che hanno sviluppato il protocollo di colorazione erano ciechi allo stato ipertensivo del tessuto intestinale umano. Le differenze di colorazione osservate tra pazienti con ipertensione e pazienti con normotensione non erano dovute a distorsioni e sono state descritte in precedenza22,23.
Sebbene il nostro protocollo per la rilevazione delle proteine addotto da IsoLG utilizzando l'anticorpo D11 coniugato con fosfatasi alcalina al posto dell'E-tag sia rigoroso e robusto ed elimini la necessità di un'incubazione secondaria di anticorpi, presenta alcune limitazioni. Una limitazione è che abbiamo usato D11 coniugato con fosfatasi alcalina nell'estratto periplasmatico e potrebbe esserci una falsa colorazione della fosfatasi alcalina endogena nell'estratto periplasmatico o in alcuni tessuti, come l'intestino24. Tuttavia, il primo passo per sviluppare questo protocollo includeva la disabilitazione della fosfatasi alcalina endogena che può essere presente nei tessuti25. Inizialmente, l'acido acetico freddo, BME e levamisolo26 sono stati testati per l'efficienza. Nessuno di questi ha completamente diminuito la presenza di fosfatasi alcalina endogena attiva. Il calore è stato utilizzato per disattivare la fosfatasi alcalina27, quindi abbiamo testato la disattivazione termica della fosfatasi alcalina in diversi tamponi. Abbiamo scoperto che i vetrini riscaldanti e idratati nel tampone citrato hanno eliminato la maggior parte della fosfatasi alcalina endogena. I vetrini sono stati sviluppati inizialmente utilizzando un substrato chemiluminescente / fluorescente, ma quando le immagini sono state visualizzate senza questo substrato, c'era un'elevata quantità di autofluorescenza. VectorRed è un substrato che si sviluppa in presenza di fosfatasi alcalina per produrre un cromogeno che può essere visualizzato nella gamma di canali Texas Red / TRITC. Utilizzando questo substrato, siamo stati in grado di osservare più facilmente il segnale sopra l'autofluorescenza di fondo. È necessario prestare attenzione durante il processo di colorazione per ridurre al minimo la colorazione artificiosa. L'essiccazione dei tessuti sui vetrini dopo l'idratazione fino a quando l'imaging non ha portato a un maggiore sviluppo. D11-AP deve essere aliquotato e conservato a -20 °C. Cicli multipli di gelo-disgelo dovrebbero essere evitati quando si lavora con D11-AP. Anche la soluzione salina tamponata con fosfato (PBS) può influenzare l'attività enzimatica della fosfatasi alcalina e non deve essere utilizzata come tampone di lavaggio28. Come con qualsiasi approccio basato sugli anticorpi, è necessario eseguire test approfonditi e ottimizzazione per garantire che la colorazione sia specifica e che il segnale non sia sovraamplificato o sottoamplificato.
In conclusione, abbiamo sviluppato un protocollo ottimizzato potente, rigoroso e robusto per rilevare le proteine addotto IsoLG utilizzando l'anticorpo D11 coniugato con fosfatasi alcalina al posto dell'E-tag. Questo protocollo presenta diversi vantaggi: in primo luogo, l'utilizzo di D11 come proteina di fusione della fosfatasi alcalina è più economico. D11 è stato originariamente derivato da una libreria di anticorpi fagici che non poteva essere commercializzata ed era costoso da purificare. Sebbene D11 nell'estratto periplasmatico di E. coli potesse fornire un'alternativa poco costosa, era inefficace nella maggior parte dei test. In secondo luogo, l'approccio di fusione della fosfatasi alcalina consente a D11 scfv di avere un utile reporter15 (fosfatasi alcalina) fuso ad esso e non avrebbe bisogno di essere purificato per l'uso in saggi immunologici poiché i substrati sono disponibili in commercio. In terzo luogo, la fosfatasi alcalina di E. coli forma dimeri29. Quindi D11, quando fuso alla fosfatasi alcalina, formerebbe anche dimeri e questo aumenta l'avidità dell'anticorpo e l'attività di legame30. Infine, D11 coniugato con fosfatasi alcalina in estratto periplasmatico può essere facilmente pulito utilizzando Cibacron Blue Sepharose. D11 ha un alto punto isoelettrico (~9,2 pH). Come tale, è caricato positivamente e può legarsi a Cibacron Blue attraverso interazioni pi-cationiche. La maggior parte delle impurità nell'estratto periplasmatico di E. coli possono essere eluite dalla resina. Il D11 coniugato con fosfatasi alcalina può quindi essere eluito usando sale alto (~ 1,5 M NaCl) in acqua. Il D11 eluito coniugato con fosfatasi alcalina è abbastanza stabile a 4-8 °C nella soluzione ad alto contenuto di sale. Pertanto, abbiamo sviluppato un protocollo che non solo rende disponibile l'anticorpo D11 a basso costo, ma elimina anche i passaggi aggiuntivi e la necessità di incubazione secondaria degli anticorpi. Questo protocollo facilita la misurazione riproducibile degli IsoLG, che si accumulano nei tessuti in molteplici malattie in cui l'aumento dello stress ossidativo gioca un ruolo.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato supportato dalle sovvenzioni del National Institutes of Health K01HL130497, R01HL147818, R01HL144941 e R03HL155041 ad A.K. Ringraziamo la Digital Histology Shared Resource - Vanderbilt Health Nashville, TN https://www.vumc.org/dhsr/46298 per la visualizzazione e la scansione delle diapositive.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 ml TALON HiTrap column (Cobalt-CMA) | Cytiva | 28953766 | |
| 200 Proof Ethanol | Pharmco | 111000200 | |
| 2xYT powder | MP Biomedicals | 3012-032 | |
| 384-well, clear, flat-bottom polystyrene microplates | ThermoFisher (NUNC) | 242757 | |
| 4-Nitrophenyl phosphate disodium salt hexahydrate (pNPP) | Carbosynth | EN08508 | |
| 5-Bromo-4-chloro-3indoxyl phosphate, p-toluidine salt (BCIP) | Carbosynth | EB09335 | |
| Ampicillin, sodium salt | Research Products International (RPI) | A40040 | |
| Bovine Serum Albumin | RPI | A30075 | |
| Chemically competent TG1 E. coli | Amid Biosciences | TG1-201 | |
| Diethanolamine, >98% | Sigma-Aldrich | D8885 | |
| EDTA | Sigma-Aldrich | ED | |
| Fluoromount-G | SouthernBiotech | 0100-01 | Mouting medium |
| Glucose | Research Products International (RPI) | G32045 | |
| Glycerol | Sigma-Aldrich | G7893 | |
| Histoclear | National Diagnostics | HS-200 | Xylene alternative |
| Hoechst 33342 | ThermoFisher | H3570 | stock solution = 10 mg/mL |
| Hydrochloric acid (HCl), 30%, Macron Fine Chemicals | ThermoFisher | MK-2624-212 | |
| Imidazole | Research Products International (RPI) | I52000 | |
| MgCl2 (anhydrous) | Sigma-Aldrich | M8266 | |
| Mouse Serum Albumin (MSA) | Sigma-Aldrich/Calbiochem | 126674 | |
| Nitroblue tetrazolium chloride (NBT) | Carbosynth | EN13587 | |
| Potassium chloride (KCl) | Sigma-Aldrich | P4504 | |
| Potassium phosphate, monobasic (KH2PO4) | Sigma-Aldrich | P0662 | |
| Pressure Cooker | Cuisinart | CPC-600 | |
| Slide-a-Lyzer Dialysis cassettes, 10K MWCO, 3 ml | ThermoFisher | 66380 | |
| Sodium chloride (NaCl) | Research Products International (RPI) | S23020 | |
| Sodium Citrate | Sigma-Aldrich | 1064461000 | |
| Sodium phosphate, dibasic (Na2HPO4) | Research Products International (RPI) | S23100 | |
| Sucrose | Research Products International (RPI) | S24065 | |
| Tris base | Research Products International (RPI) | T60040 | |
| Tris-buffered Saline | Boston Bio-Products | 25mM Tris, 2.7mM KCl, 137 mM NaCl, pH 7.4 | |
| Tris-HCl | Research Products International (RPI) | T60050 | |
| Tween20 | Sigma-Aldrich | P9416 | |
| Vector Red | Vector Labs | SK-5105 |
Riferimenti
- Brame, C. J., Salomon, R. G., Morrow, J. D., Roberts, L. J. Identification of extremely reactive gamma-ketoaldehydes (isolevuglandins) as products of the isoprostane pathway and characterization of their lysyl protein adducts. Journal of Biological Chemistry. 274, 13139-13146 (1999).
- Brame, C. J., et al. Modification of proteins by isoketal-containing oxidized phospholipids. Journal of Biological Chemistry. 279, 13447-13451 (2004).
- May-Zhang, L. S., et al. Scavenging reactive lipids to prevent oxidative injury. Annual Review of Pharmacology and Toxicology. 61, 291-308 (2021).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2019 update: A report from the American Heart Association. Circulation. 139, 56 (2019).
- Collins, D. R., et al. Global cardiovascular risk assessment in the primary prevention of cardiovascular disease in adults: Systematic review of systematic reviews. BMJ Open. 7, 013650 (2017).
- Whelton, P. K., et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the prevention, detection, evaluation, and management of high blood pressure in adults: Executive summary: A report of the American College of Cardiology/American Heart Association Task Force on clinical practice guidelines. Circulation. 138, 426-483 (2018).
- Patrick, D. M., Van Beusecum, J. P., Kirabo, A. The role of inflammation in hypertension: Novel concepts. Current Opinion in Physiology. 19, 92-98 (2021).
- Davies, S. S., et al. Isolevuglandins as mediators of disease and the development of dicarbonyl scavengers as pharmaceutical interventions. Pharmacology and Therapeutics. 205, 107418 (2020).
- Dixon, K. B., Davies, S. S., Kirabo, A. Dendritic cells and isolevuglandins in immunity, inflammation, and hypertension. American Journal of Physiology-Heart and Circulation Physiology. 312, 368-374 (2017).
- Kirabo, A., et al. DC isoketal-modified proteins activate T cells and promote hypertension. Journal of Clinical Investigation. 124, 4642-4656 (2014).
- Yan, H. P., et al. Isolevuglandins as a gauge of lipid peroxidation in human tumors. Free Radical Biology and Medicine. 106, 62-68 (2017).
- Davies, S. S., et al. Localization of isoketal adducts in vivo using a single-chain antibody. Free Radical Biology and Medicine. 36, 1163-1174 (2004).
- Shen, Z., et al. Single-chain fragment variable antibody piezoimmunosensors. Analytical Chemistry. 77, 797-805 (2005).
- Hennig, E. E., Mernaugh, R., Edl, J., Cao, P., Cover, T. L. Heterogeneity among Helicobacter pylori strains in expression of the outer membrane protein BabA. Infections and Immunity. 72, 3429-3435 (2004).
- Martin, C. D., et al. A simple vector system to improve performance and utilisation of recombinant antibodies. BMC Biotechnology. 6, 46 (2006).
- Han, Z., Karatan, E., Scholle, M. D., McCafferty, J., Kay, B. K. Accelerated screening of phage-display output with alkaline phosphatase fusions. Combinatorial Chemistry and High Throughput Screening. 7, 55-62 (2004).
- Miller, J. . Handbook for a short course in bacterial genetics. , (1992).
- Nair, R., et al. Yeast extract mediated autoinduction of lacUV5 promoter: An insight. New Biotechnology. 26 (6), 282-288 (2009).
- Davies, S. S., Amarnath, V., Roberts, L. J. Isoketals: Highly reactive γ-ketoaldehydes formed from the H2-isoprostane pathway. Chemistry and Physics of Lipids. 128 (1-2), 85-99 (2004).
- Ngwenyama, N., et al. Isolevuglandin-modified cardiac proteins drive CD4+ T-Cell activation in the heart and promote cardiac dysfunction. Circulation. 143 (12), 1242-1255 (2021).
- Prinsen, J. K., et al. Highly reactive Isolevuglandins promote atrial fibrillation caused by hypertension. Basic to Translational Science JACC. 5 (6), 602-615 (2020).
- Ferguson, J. F., et al. High dietary salt-induced dendritic cell activation underlies microbial dysbiosis-associated hypertension. JCI Insight. 5 (13), 126241 (2019).
- Madhur, M. S., et al. Hypertension: Do inflammation and immunity hold the key to solving this epidemic. Circulation Research. 128 (7), 908-933 (2021).
- Estaki, M., DeCoffe, D., Gibson, D. L. Interplay between intestinal alkaline phosphatase, diet, gut microbes and immunity. World Journal of Gastroenterology. 20 (42), 15650-15656 (2014).
- Millán, J. L. . Mammalian alkaline phosphatases: From biology to applications in medicine and biotechnology. , (2006).
- Ponder, B. A., Wilkinson, M. M. Inhibition of endogenous tissue alkaline phosphatase with the use of alkaline phosphatase conjugates in immunohistochemistry. Journal of Histochemistry and Cytochemistry. 29 (8), 981-984 (1981).
- Goldstein, D. J., Rogers, C. E., Harris, H. Expression of alkaline phosphatase loci in mammalian tissues. Proceedings of the National Academy of Science U. S. A. 77 (5), 2857-2860 (1980).
- Ramos-Vara, J. A. Technical aspects of immunohistochemistry. Veterinary Pathology. 42 (4), 405-426 (2005).
- Coleman, J. E. Structure and mechanism of alkaline phosphatase. Annual Review of Biophysics and Biomolecular Structure. 21, 441-483 (1992).
- Harper, J. E., Toth, R. L., Mayo, M. A., Torrance, L. Properties of a panel of single chain variable fragments against Potato leafroll virus obtained from two phage display libraries. Journal of Virological Methods. 81 (1-2), 159-168 (1999).
Erratum
Formal Correction: Erratum: Direct Detection of Isolevuglandins in Tissues using a D11 scFv-Alkaline Phosphatase Fusion Protein and Immunofluorescence
Posted by JoVE Editors on 4/11/2023. Citeable Link.
An erratum was issued for: Direct Detection of Isolevuglandins in Tissues using a D11 scFv-Alkaline Phosphatase Fusion Protein and Immunofluorescence. The Authors section was updated from:
Cassandra Warden1
Alan J. Simmons2
Lejla Pasic3
Sean S. Davies4
Justin H. Layer5
Raymond L. Mernaugh3
Annet Kirabo4,6
1Vanderbilt Eye Institute, Vanderbilt University Medical Center
2Department of Cell and Developmental Biology, Vanderbilt University
3Department of Biochemistry, Vanderbilt University
4Division of Clinical Pharmacology, Department of Medicine, Vanderbilt University Medical Center
5Division of Hematology and Oncology, Indiana University School of Medicine
6Department of Molecular Physiology and Biophysics, Vanderbilt University
to:
Cassandra Warden1
Alan J. Simmons2
Lejla Pasic3
Ashley Pitzer4,6
Sean S. Davies4
Justin H. Layer5
Raymond L. Mernaugh3
Annet Kirabo4,6
1Vanderbilt Eye Institute, Vanderbilt University Medical Center
2Department of Cell and Developmental Biology, Vanderbilt University
3Department of Biochemistry, Vanderbilt University
4Division of Clinical Pharmacology, Department of Medicine, Vanderbilt University Medical Center
5Division of Hematology and Oncology, Indiana University School of Medicine
6Department of Molecular Physiology and Biophysics, Vanderbilt University
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon