Method Article
Direkter Nachweis von Isolevuglandinen in Geweben mittels eines D11 scFv-alkalischen Phosphatase-Fusionsproteins und Immunfluoreszenz
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Erratum Notice
Zusammenfassung
Dieser Artikel stellt eine detaillierte Methodik zur Messung von Isolevuglandinen in Geweben durch Immunfluoreszenz unter Verwendung von alkalischen Phosphatase-konjugierten ScFv D11-Antikörpern vor. Bluthochdruckmodelle sowohl bei Mäusen als auch bei Menschen werden verwendet, um die Schritt-für-Schritt-Verfahren und grundlegenden Prinzipien der Isolevuglandin-Messung in Gewebeproben zu erklären.
Zusammenfassung
Isolevuglandine (IsoLGs) sind hochreaktive Gamma-Ketoaldehyde, die aus H2-Isoprostanen durch Lipidperoxidation gebildet werden und Proteine vernetzen, was zu Entzündungen und verschiedenen Krankheiten wie Bluthochdruck führt. Der Nachweis der IsoLG-Akkumulation im Gewebe ist entscheidend, um Licht auf ihre Beteiligung an den Krankheitsprozessen zu werfen. Die Messung von IsoLGs in Geweben ist jedoch äußerst schwierig, und die derzeit verfügbaren Werkzeuge, einschließlich der Massenspektrometrie, sind mühsam und extrem teuer. In dieser Arbeit beschreiben wir eine neue Methode zum in situ Nachweis von IsoLGs in Geweben unter Verwendung von alkalischer Phosphatase-konjugiertem D11 ScFv und einem rekombinanten Phagen-Display-Antikörper, der in E. coli durch Immunfluoreszenzmikroskopie hergestellt wurde. Zur Validierung der Färbung wurden vier Kontrollen verwendet: (1) Färbung mit und ohne D11, (2) Färbung mit bakteriellem periplasmatischem Extrakt mit dem alkalischen Phosphatase-Linker, (3) irrelevante scFV-Antikörperfärbung und (4) Konkurrenzkontrolle mit IsoLG vor der Färbung. Wir zeigen die Wirksamkeit der alkalischen Phosphatase-konjugierten D11 sowohl in humanen als auch in Mausgeweben mit oder ohne Hypertonie. Diese Methode wird wahrscheinlich als wichtiges Werkzeug dienen, um die Rolle von IsoLGs in einer Vielzahl von Krankheitsprozessen zu untersuchen.
Einleitung
Isolevuglandine (IsoLGs), auch Isoketale genannt, sind Isomere aus der Familie der 4-Ketoaldehyde, die Produkte der Lipidperoxidation sind und mit primären Aminen auf Proteine 1,2 reagieren und diese adduktieren. IsoLGs werden mit verschiedenen Krankheiten in Verbindung gebracht, darunter Herz-Kreislauf-, Alzheimer-, Lungen- und Lebererkrankungen sowie viele Krebsarten3. IsoLGs wurden am ausführlichsten in ihrem Beitrag zu Herz-Kreislauf-Erkrankungen untersucht, die weltweit, einschließlich der Vereinigten Staaten, eine erhebliche gesundheitliche und wirtschaftliche Belastung darstellen. Es wird geschätzt, dass 92,1 Millionen Erwachsene in den USA mindestens eine Art von Herz-Kreislauf-Erkrankungen haben, wobei die geschätzten Prognosen für 2030 43,9 % der erwachsenen US-Bevölkerung erreichen4. Die Senkung des Blutdrucks, des Cholesterinspiegels und der Raucherentwöhnung verringert das Gesamtrisiko und das Auftreten von kardiovaskulären Ereignissen5.
Bluthochdruck oder Hypertonie ist ein Hauptrisikofaktor für Herz-Kreislauf-Erkrankungen und betrifft etwa die Hälfte der US-Bevölkerung6. Frühere Studien haben ergeben, dass Entzündungen eine zugrunde liegende Ursache für Bluthochdruck sind und dass IsoLGs eine Rolle spielen7. Hypertensive Stimuli, einschließlich Angiotensin II, Katecholamine, Aldosteron und überschüssiges Nahrungssalz, induzieren eine IsoLG-Akkumulation in antigenpräsentierenden Zellen, einschließlich dendritischer Zellen (DCs), die wiederum T-Zellen aktivieren, um sich zu vermehren und entzündliche Zytokine zu produzieren, die zu Bluthochdruck beitragen 8,9.
Zuvor wurden IsoLGs mittels Immunhistochemie, Massenspektrometrie, Enzyme-linked Immunosorbent Assay und Durchflusszytometrie gemessen10,11. Um die Messung von IsoLGs zu erleichtern, wurde ein rekombinanter Antikörper (D11) gegen IsoLGs12 entwickelt. Ursprünglich enthielt dieser D11-Antikörper einen 11-Aminosäure-E-Tag und benötigte einen sekundären Antikörper für den immunhistochemischen Nachweis11. Es war jedoch schwierig, einen zuverlässigen Sekundärantikörper gegen den E-Tag zu finden, nachdem die Produktion durch den Hersteller eingestellt wurde. Daher haben wir ein zuverlässiges Protokoll für die Immunfluoreszenzfärbung von IsoLGs unter Verwendung von D11 konjugiert mit alkalischer Phosphatase (D11-AP) entwickelt, das wir in Maus- und menschlichen Geweben mit und ohne Bluthochdruck nachgewiesen haben.
Protokoll
Das Institutional Animal Care and Use Committee der Vanderbilt University genehmigte alle in diesem Manuskript beschriebenen Verfahren. Mäuse werden gemäß dem Leitfaden für die Pflege und Verwendung von Versuchstieren untergebracht und gepflegt. Alle Probanden gaben vor der Aufnahme in die Studie eine schriftliche Einverständniserklärung ab, die vom Institutional Review Board der Vanderbilt University genehmigt wurde. Alle Verfahren wurden gemäß der Deklaration von Helsinki durchgeführt.
1. Herstellung von Plasmiden, die für das D11-alkalische Phosphatase-Fusionsprotein und Negativkontrollvektoren kodieren
- Konstruieren Sie eine modifizierte Version des pCANTAB5E-Plasmids13,14, in der das Segment der Einzelkettenfragmentvariablen (scFv) an seinem 3'-Ende mit einer Sequenz verknüpft ist, die für die bakterielle alkalische Phosphatase (AP) kodiert.
HINWEIS: Unmittelbar stromabwärts der NotI-Restriktionsstelle der scFv-Sequenz enthält das modifizierte Plasmid nicht mehr die kodierende Sequenz des E-Tags und kodiert stattdessen die Linkersequenz GGSGGHMGSGG, gefolgt von der Sequenz für AP (GenBank-Zugangsnummer AXY87039.1, T16-K464)15,16. Stromabwärts von AP kodiert das Plasmid für 8xHis- und DYKDDDDK-Tags. Am 3'-Ende der Tags endet die Codierungssequenz mit einem Amber-Stop-Codon. Das modifizierte Plasmid wird pCANTAB5-AP genannt. - Klonen Sie D11 scFv (GenBank-Zugangsnummer AAW28931.1) in pCANTAB5-AP mit den SfiI/NotI-Restriktionsstellen.
- Klonen Sie D20 scFv in pCANTAB5-AP mit den SfiI/NotI-Restriktionsstellen.
HINWEIS: D20 scFv ist eine Negativkontrolle, die entwickelt wurde, um das Gewebeinteraktionsmuster eines irrelevanten scFv zu beurteilen. Dieses scFv wurde ursprünglich durch Phagen-Display selektiert, da es mit einer Glykangruppe namens A2 interagieren kann. - Erzeugen Sie einen "leeren" Vektor, indem Sie den scFv-Anteil vollständig aus dem Plasmid entfernen und durch eine "AP-Linker"-kodierende Sequenz ersetzen, die aus den Aminosäuren GGGGSGRAGSGGGGS besteht.
- Verwandeln Sie alle Plasmide in kompetente TG1 E. coli und züchten Sie Bakterien über Nacht bei 30 °C auf 0,5%igen Agarplatten, die 2xYT enthalten, ergänzt mit 100 μg/ml Ampicillin und 2% Glucose (2xYTAG) Medium.
HINWEIS: Stämme mit dem supE-Gen (z. B. TG1 E. coli) unterdrücken das bernsteinfarbene Stopcodon nicht zu 100%. Die Schätzungen reichen von 0,8 bis 20 % der Zeit, so dass es immer noch eine Menge Produkt gibt, das direkt stromabwärts von BAP endet, wie es für diese Experimente vorgesehen ist17. TG1 E. coli werden hauptsächlich aus praktischen Gründen eingesetzt, wie z.B. der Zeit- und Kostenersparnis, ihrer Kompatibilität mit dem pCANTAB Proteinexpressionssystem und ihrer Verwendung in der Phagenanzeige, die üblicherweise im Labor durchgeführt wird. Stromabwärts des bernsteinfarbenen Stoppcodons folgt BAP eine Sequenz für GenIII. GeneIII-Fusionsproteine müssen selten exprimiert werden, damit die Phagenanzeige wie vorgesehen funktioniert, da scFv-GenIII-Fusionsproteine mit diesem speziellen GenIII-Protein interferieren, um naive Bakterien erneut zu infizieren. Daher müssen fusionsfreie GenIII-Proteine während der Virionassemblierung vorhanden sein, um funktionierende Phagen zu erzeugen, d.h. scFv-GenIII-Proteinprodukte sind im Bakterium normalerweise relativ selten. D11-AP, D20-AP, leere Vektoren und alle in diesem Artikel verwendeten Konstrukte werden alle in ähnlicher Weise von der gelegentlichen Expression von GenIII-Fusionsproteinen beeinflusst. Es gibt immer noch Unterschiede im Verhalten dieser Proteine. - Wählen Sie eine einzelne Kolonie aus und beimpfen Sie eine frische 5 ml 2xYTAG-Kultur. Lassen Sie die Bakterien über Nacht bei 30 °C wachsen und schütteln Sie sie bei 150 U/min.
- Pelletieren Sie die Zellen durch Zentrifugation bei 3.000 x g für 10 min bei Raumtemperatur. Verwerfen Sie den Überstand und resuspendieren Sie das Pellet in 2 ml 85 % 2xYTAG und 15 % Glycerin.
- Bewahren Sie die Glycerinvorräte in einem Gefrierschrank bei -80 °C auf.
2. Proteinexpression und Generierung von periplasmatischem Extrakt
HINWEIS: Die Generierung des periplasmatischen Extrakts ist eine häufig verwendete Methode für die Proteinexpression in der Phagenanzeige, vor allem, weil die Bildung von Disulfidbrücken für die scFv- und Antikörpergenerierung wichtig ist. Die Methode vermeidet die Notwendigkeit, Lysate zu erzeugen (die üblicherweise Einschlusskörper enthalten) und stellt sicher, dass Proteine richtig gefaltet werden. pCANTAB besitzt eine gIII-Signalsequenz stromaufwärts des scFv-Teils des D11-BAP-Fusionsproteins. Die Signalsequenz sorgt dafür, dass das Protein in den periplasmatischen Raum des Bakteriums transportiert wird und dann die Signalsequenz gespalten wird. Der periplasmatische Raum bietet eine oxidierende Umgebung, die für die ordnungsgemäße Bildung von Disulfidbrücken entscheidend ist. Der osmotische Schock wird zur Gewinnung periplasmatischer Extrakte verwendet, da er die äußere Membran so weit aufbricht, dass die periplasmatischen Proteine in das umgebende Medium freigesetzt werden, während das Bakterium intakt bleibt.
- TG1 E. coli Glycerinvorräte, die die relevanten Plasmide enthalten, werden in eine 60 mL Kultur mit 2xYTAG inokuliert und über Nacht bei 30 °C unter Schütteln bei 150 U/min kultiviert.
- Um die Proteinexpression zu induzieren, pelletieren Sie Bakterienkulturen bei 3.000 x g für 10 Minuten, resuspendieren Sie sie in 60 ml 2xYTA-Medium und kultivieren Sie sie über Nacht bei 30 °C unter Schütteln bei 150 U/min.
HINWEIS: Der Wechsel von 2xTYAG auf 2xYTA-Medium trägt zu einer ausreichenden Induktion der Proteinexpression18 bei. Wenn Glukose im bakteriellen Medium vorhanden ist, wird der lac-Promotor unterdrückt, da Bakterien bevorzugt Glukose verbrauchen und Laktose ignorieren, da Glukose weniger Energie für die Verarbeitung benötigt. Wenn Glukose nach dem Medienwechsel entfernt wird, sind die Bakterien auf die Kohlenhydrate angewiesen, die vom 2xYT-Medium bereitgestellt werden. Hefeextrakt (die Y-Komponente in 2xYT) enthält Kohlenhydrate, darunter Laktose, und ist daher in der Lage, die Proteinexpression durch den lac-Promotor zu steuern. IPTG ist mit dem pCANTAB-Konstrukt nicht notwendig und kann zu einer übermäßigen Proteinexpression führen, zusammen mit Einschlusskörpern, die zu nicht-funktionellem Protein führen. - Erzeugen Sie periplasmatische Extrakte durch osmotischen Schock.
- Pelletieren Sie Bakterienkulturen bei 3.000 x g für 10 min.
- In 20 mL 1xTES (0,2 M Tris-HCl pH 8,0, 0,5 mM EDTA, 0,5 M Saccharose) resuspendieren und 1 h auf Eis inkubieren.
- Erneut 10 Minuten lang bei 3.000 x g pelletieren und in 15 ml 0,05 M Tris, pH 7,6 resuspendieren.
- Diese Suspension wird 1 h auf Eis inkubiert und dann 10 min lang durch Zentrifugation bei 5.000 x g geklärt.
- Überstände in ein frisches Röhrchen überführen und bei -20 °C lagern, bis sie entweder zur Reinigung oder zur direkten Verwendung in Experimenten benötigt werden.
- Beurteilen Sie die Zelllyse anhand des Vorhandenseins von aktivem D11-BAP im ELISA. Fügen Sie 3-5 μl des periplasmatischen Extrakts zu einem ml pNPP hinzu und beobachten Sie dann, ob sich die Farbe in den nächsten 10 Minuten ändert (die Farbe wechselt von klar-gelb zu intensivem Gelb).
HINWEIS: Die Farbe kann nebeneinander mit einem Röhrchen pNPP verglichen werden, das kein Lysat erhalten hat, oder einem Röhrchen mit pNPP, das Lysat von naiven TG1-Bakterien erhalten hat. Quantifizierung mit Absorption bei 405 nm.
4. Charakterisierung des D11-AP-Titers im ELISA
- Eine 384-Well-Polystyrolplatte wird über Nacht bei 4 °C mit 25 μL/Well phosphatgepufferter Kochsalzlösung (PBS) (1,8 mMKH2PO4, 10 mMNa2HPO4, 2,7 mM KCl, 137 mM NaCl) beschichtet, die entweder 5 μg/ml Mausserumalbumin (MSA) (Negativkontrolle) oder 5 μg/ml IsoLG/MSA (Positivkontrolle) enthält.
- Leeren Sie den Teller und klopfen Sie ihn trocken. Einmal mit PBS + 0,1% Tween (PBS-T) waschen. Leeren Sie den Teller und klopfen Sie ihn trocken.
- Füllen Sie die Platte mit PBS-T als Blockierpuffer (120 μL/Well). 1 h bei Raumtemperatur inkubieren.
- Leeren Sie den Teller und klopfen Sie ihn trocken. Auftragen Sie serielle 1:2-Verdünnungen von D11-AP periplasmatischen Extrakten bei 25 μL/Well und verdünnt in PBS-T. Fügen Sie eine Vertiefung ein, die nur PBS-T als Negativkontrolle enthält.
HINWEIS: Typische Verdünnungsbereiche für periplasmatische Extrakte liegen zwischen 1:8 und 1:4096. Für ein Assay-Volumen von 25 μl beginnen Sie mit 50 μl der Anfangskonzentration "1:8": 6,25 μl periplasmatischer Extrakt und 43,75 μl PBS-T. Führen Sie dann eine 2-fache Verdünnung durch, indem Sie 25 μl dieser Lösung entfernen und in die nächste Vertiefung mit 25 μl PBS-T geben und auf und ab pipettieren. Diese Vertiefung enthält nun die Verdünnung "1:16". Wiederholen Sie die 2-fache Verdünnung immer wieder, um die beschriebene 1:2-Verdünnungsreihe zu erzeugen. - 1,5 h bei Raumtemperatur inkubieren.
- Leeren Sie den Teller und klopfen Sie ihn trocken. 5 Mal mit PBS-T waschen. Entleeren und trocken klopfen.
- Die pNPP-Lösung wird hergestellt, indem 1 g pNPP in 1 l 930 mM Diethanolamin (98%ige Stammlösung, 1:10 in H2O verdünnt) mit 0,5 mMMgCl2gelöst und mit HCl auf pH 9,5 eingestellt wird.
- Tragen Sie 25 μL/Well pNPP-Lösung auf, um AP zu entwickeln. Inkubieren Sie 1 h bei Raumtemperatur und bestimmen Sie die Absorption bei 405 nm in jeder Vertiefung mit einem kompatiblen Plattenlesegerät.
- Vergleichen Sie das von den IsoLG/MSA-Wells erzeugte Signal mit dem von den MSA-Wells erzeugten Rauschen und ermitteln Sie den Verdünnungsbereich, in dem das Signal mindestens 5-fach höher ist als das Rauschen.
- Zeichnen Sie diese D11-AP-Signalverdünnungsreihe in einem Diagramm auf, bestimmen Sie den linearen Bereich der Kurve und legen Sie die Verdünnung fest, bei der 50 % des Signals beobachtet werden können.
Anmerkungen: Wenn diese Verdünnung etwa 1:1.000 entspricht, kann die D11-AP-Lösung in einer Konzentration von 1:10 in IHC/IF verwendet werden.
5. Immunfluoreszenz
- Schneiden Sie mit einem Mikrotom Serienschnitte von in Paraffin eingebettetem Gewebe von Mäusen und Menschen (5 μm dick) und legen Sie sie in ein warmes Wasserbad (37 °C). Gewebeschnitte auf Objektträger legen und über Nacht trocknen lassen.
HINWEIS: Für diese Studie wurden Aorten von Mäusen gewonnen. Dickdarmschnitte von normotensiven und hypertensiven Menschen wurden aus dem Vanderbilt Cooperative Human Tissue Network gewonnen. - Tauchen Sie die Objektträger dreimal 5 Minuten lang in Xylol, um das Gewebe zu entparaffinieren.
- Rehydrieren Sie das Gewebe in je 2 Waschgängen mit 95 %, 70 % und 50 % Ethanol inH2O.
- Waschen Sie Objektträger in Tris-gepufferter Kochsalzlösung (TBS) mit 0,1 % Tween20 (TBST) dreimal mit Schnellwäschen, indem Sie den Objektträgerhalter mit TBST füllen und TBST entsorgen.
HINWEIS: Hydratisierte Objektträger können vor der Antigenentnahme nicht länger als eine Woche bei 4 °C in TBST gelagert werden. - Um eine hitzeinduzierte Antigenentnahme von Objektträgern durchzuführen, legen Sie die Objektträger in einen vorgewärmten (80-95 °C) Natriumcitratpuffer (10 mM Natriumcitrat, 0,05 % Tween 20, pH 6,0) und inkubieren Sie sie in einem Schnellkochtopf, der auf 4 Minuten unter hohem Druck eingestellt ist, für eine Gesamtantigengewinnungszeit von 20 Minuten.
- Nehmen Sie die Objektträger aus dem Schnellkochtopf und lassen Sie sie 20 Minuten auf Raumtemperatur abkühlen.
- Waschen Sie die Objektträger in TBST dreimal mit Schnellwäsche.
HINWEIS: Objektträger können nach der Antigenentnahme nicht länger als eine Woche vor der Färbung in TBST gelagert werden. - Fügen Sie 2% BSA, gelöst in TBST, hinzu, um Objektträger zu blockieren. Objektträger mit einem Streifen Paraffinfolie abdecken und 15 Minuten bei Raumtemperatur inkubieren.
- Verwerfen Sie den Blockierungspuffer von den Folien.
- 200 μL 1:10 D11-AP in TBST auf die Objektträger geben und mit einem Streifen Paraffinfolie abdecken.
- In einer befeuchteten Kammer inkubieren, um die Verdunstung der Antikörperlösung für 3 h bei Raumtemperatur zu minimieren.
- Waschen Sie die Objektträger dreimal in TBST.
- Entwickeln Sie mit einem kolorimetrischen oder fluoreszierenden alkalischen Phosphataseentwickler für die Immunhistochemie bzw. Immunfluoreszenz. Waschen Sie die Objektträger einmal mit TBST, um überschüssigen Entwickler zu entfernen und eine weitere Farbentwicklung zu verhindern.
- Gegenfärbung von Objektträgern mit Hoechst-Kernfärbung bei 1 μg/ml in PBS zur Immunfluoreszenz. Waschen Sie die Objektträger einmal in TBST, um überschüssige Gegenflecken zu entfernen.
- Deckgläser mit dem Eindeckmedium anbringen.
- Betrachten Sie Objektträger unter einem Inverslichtmikroskop für die Immunhistochemie oder einem konfokalen Fluoreszenzmikroskop für die Immunfluoreszenz.
6. Negativkontrollen
HINWEIS: Es können vier Negativkontrollexperimente durchgeführt werden, um die Spezifität der D11-AP-Färbung für IsoLG zu bestätigen. Negativkontrollexperimente sollten im selben Färbeset unter den gleichen Bedingungen durchgeführt werden.
- Im ersten Negativkontrollexperiment werden Gewebe mit D11-AP inkubiert, das in TBST oder TBST allein verdünnt ist.
- Inkubieren von Geweben mit verdünntem D11-AP in TBST und bakteriellem periplasmatischem Extrakt ohne D11-AP (AP Linker) in TBST verdünnt.
- Führen Sie einen kompetitiven Assay mit IsoLG/MSA oder nicht-adduziertem MSA durch, wie zuvor beschrieben12.
- IsoLG und IsoLG, adduziert an Mausserumalbumin (MSA), wie zuvor beschrieben19, bei einem molaren Verhältnis von 8 IsoLG: 1 MSA (8:1 IsoLG/MSA) herstellen.
- D11-AP 1:10 in TBST verdünnen.
- Verdünntes D11-AP mit 50 μg/mL IsoLG/MSA oder nicht adduziertem MSA für 1 h bei Raumtemperatur inkubieren.
- D11-AP mit IsoLG/MSA oder D11-AP mit nicht adduziertem MSA zur Färbung in das Gewebe geben.
- Verwenden Sie den irrelevanten scFv-Antikörper D20, um Gewebe für das endgültige Negativkontrollset zu färben.
Ergebnisse
In repräsentativen Experimenten wurde D11 scfv mit einer alkalischen Phosphatase-Konjugation (D11-AP) in der Immunfluoreszenz verwendet, um IsoLGs nachzuweisen, die in mit Angiotensin II behandelten Mäusen im Vergleich zu normalen Scheinmäusen und Menschen mit Bluthochdruck im Vergleich zu normotensiven Menschen vorhanden waren. Die Mäuse wurden zwei Wochen lang mit Angiotensin II in einer Dosis von 490 ng/kg/min behandelt, und der Bluthochdruck wurde mit erhöhtem systolischem Blutdruck im Vergleich zu Scheinmäusen bestätigt10. Um die Spezifität von D11-AP zu gewährleisten, wurden Gewebe mit oder ohne D11-AP gefärbt. Wie die D11-AP-Färbung zeigte, zeigte die Aorta von Mäusen mit Angiotensin-II-induzierter Hypertonie im Vergleich zu Kontrollmäusen eine erhöhte Konzentration von IsoLGs (Abbildung 1). Die Hintergrundfärbung oder Autofluoreszenz war begrenzt, wie Negativkontrollen zeigten, die nicht mit D11-AP gefärbt wurden.
D11-AP wurde verwendet, um IsoLGs im Darmgewebe von humanen Patienten mit Hypertonie (HTN) oder normotensiven Menschen (NTN) nachzuweisen. Der Hypertoniestatus wurde anhand der Krankenhausakten als systolischer Blutdruck über 140 und diastolischer Blutdruck über 80 mmHg ermittelt. Forscher, die ein Immunfluoreszenzprotokoll für D11-AP entwickelten, waren für den Bluthochdruckstatus von menschlichem Gewebe blind. Die Schnitte wurden in An- und Abwesenheit von D11-AP gefärbt, um die Spezifität der Antikörper sicherzustellen und eine Hintergrundfärbung oder Autofluoreszenz zu zeigen. Wie in Abbildung 2 gezeigt, fanden wir heraus, dass Gewebe von Patienten mit HTN im Vergleich zu Patienten mit NTN erhöhte Konzentrationen von IsoLGs aufwiesen. Die Färbung ohne D11-AP zeigte ebenfalls eine minimale Hintergrundfärbung und Autofluoreszenz. Die endogene alkalische Phosphatase wird durch das intestinale Epithel exprimiert, so dass die begrenzte Fluoreszenz von Geweben, die ohne D11-AP gefärbt wurden, zeigt, dass die in diesem Protokoll verwendete Antigenabfrage ausreichend war, um die im Gewebe vorhandene endogene alkalische Phosphatase zu inaktivieren. In Kombination mit den Ergebnissen an Mäusen zeigen diese Ergebnisse auch, dass das Immunfluoreszenzprotokoll im Vergleich zum normotensiven Status effektiv erhöhte IsoLGs bei Hypertonie zeigt.
D11-AP wurde isoliert und im bakteriellen periplasmatischen Extrakt gespeichert. Maus- und menschliches Gewebe wurden mit D11-AP und periplasmatischem Extrakt, der den AP-Linker enthielt, ohne D11 gefärbt, um sicherzustellen, dass andere Faktoren, die im periplasmatischen Extrakt vorhanden sein können, wie z. B. überschüssige oder nicht konjugierte alkalische Phosphatase, nicht zu der Färbung beitragen, die in Geweben beobachtet wurde, die mit D11-AP behandelt wurden (Abbildung 3). Gewebe, die mit D11-AP gefärbt wurden, führten zu einer helleren Färbung im Vergleich zu Geweben, die mit periplasmatischem Extrakt gefärbt wurden. Diese Ergebnisse bestätigen, dass D11-AP das Gewebe färbt und die Färbung nicht auf eine nicht-konjugierte bakterielle alkalische Phosphatase zurückzuführen ist, die möglicherweise im periplasmatischen Extrakt vorhanden sein und zu einer falschen Färbung von IsoLGs führen oder zur Hintergrundfärbung beitragen kann.
Eine kompetitive Kontrolle wurde durchgeführt, indem D11-AP vor der Färbung von Gewebe mit IsoLG an MSA oder nicht-adduziertem MSA vorinkubiert wurde, um die Spezifität von D11-AP gegenüber IsoLG zu zeigen. Wenn D11-AP spezifisch für IsoLG ist, würde der Antikörper an IsoLG-MSA binden, was zu einer verminderten Verfügbarkeit von D11-AP zur Färbung von Geweben führt, und D11-AP, das mit nicht-adduziertem MSA inkubiert wird, hätte eine ähnliche Färbung wie normales D11-AP. In Geweben, die mit D11-AP gefärbt wurden, die mit dem IsoLG-Konkurrenten vorinkubiert wurden, fanden wir eine verringerte Färbung im Vergleich zu Geweben, die mit D11-AP ohne jegliche Vorinkubation gefärbt wurden (Abbildung 4). In Geweben, die mit D11-AP gefärbt und mit nicht-adduziertem MSA vorinkubiert wurden, fanden wir eine ähnliche Färbung wie in Geweben mit D11-AP. Diese Ergebnisse zeigen die Spezifität von D11-AP für IsoLGs aufgrund einer reduzierten Färbung des Gewebes, wenn D11-AP mit IsoLG/MSA, aber nicht mit nicht-adduziertem MSA vorinkubiert wurde. In der abschließenden Negativkontrolle wurde Mausgewebe mit D11-AP oder dem irrelevanten scFv-Antikörper D20 gefärbt. Die Färbung der Aorta der Maus mit D11-AP führte zu einer starken Färbung im Vergleich zu D20, was auf die Spezifität von D11-AP gegenüber IsoLGs in hypertensiven Aorten hinweist (Abbildung 5).
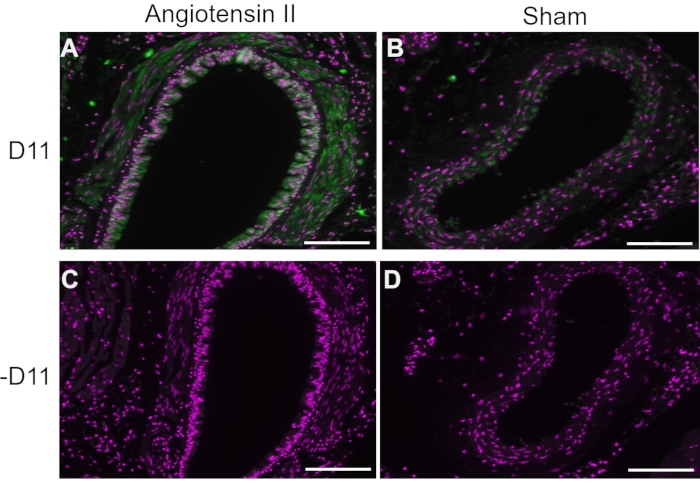
Abbildung 1: Immunfluoreszenz der Aorta bei hypertensiven und normotensiven Mäusen. Arterien von Angiotensin II und scheininfundierten Mäusen wurden mit und ohne D11-AP (D11) gefärbt, um das Vorhandensein von IsoLGs zu zeigen. (A) Arterie einer mit Angiotensin II behandelten Maus, die mit D11-AP (grün) und nuklearer Gegenfärbung (magenta) sondiert wurde, (B) Arterie einer mit D11-AP untersuchten Maus, (C) Arterie einer mit Angiotensin II behandelten Maus ohne D11-AP, (D) Arterie einer mit Angiotensin II behandelten Maus ohne D11-AP (Maßstabsbalken = 100 μm). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
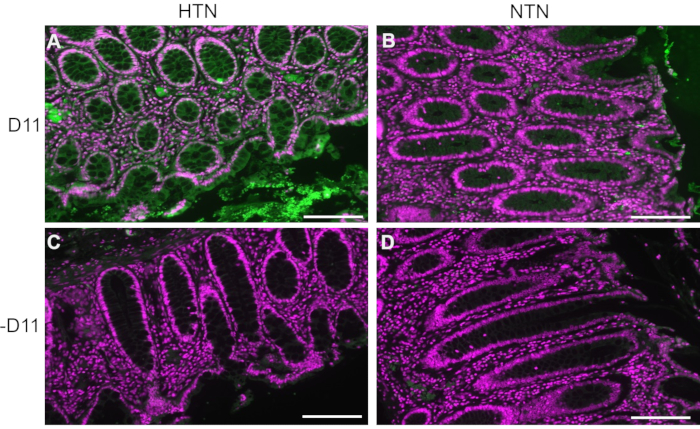
Abbildung 2: Immunfluoreszenz von humanem Darmgewebe von hypertensiven und normotensiven Patienten. Gewebe von Patienten mit Hypertonie (HTN) und normotensiven Menschen (NTN) wurden mit und ohne D11-AP (D11) gefärbt, um das Vorhandensein von IsoLGs bei Patienten mit HTN zu zeigen. (A) HTN-Gewebe, gefärbt mit D11-AP (grün) und Kerngegenfärbung (magenta), (B) NTN-Gewebe, gefärbt mit D11-AP, (C) HTN-Gewebe, gefärbt ohne D11-AP, (D) NTN-Gewebe, gefärbt ohne D11-AP (Maßstabsbalken = 100 μm). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
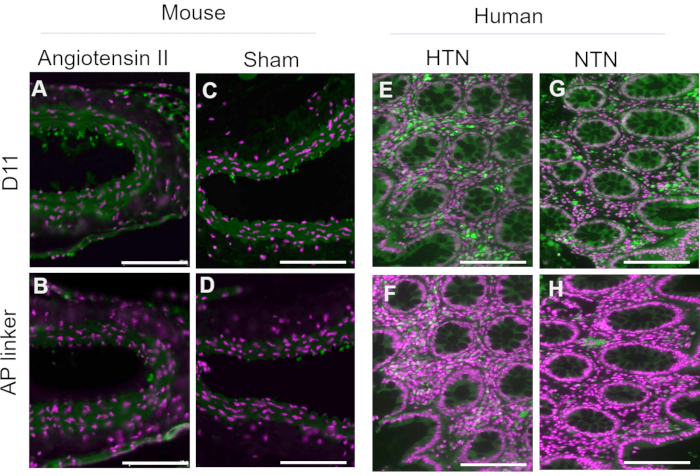
Abbildung 3: Mit periplasmatischem Extrakt gefärbtes Gewebe der Maus und des Menschen mit und ohne D11-AP. Maus- und humanes Gewebe wurden mit periplasmatischen Extrakten mit und ohne D11-AP gefärbt. Die Bilder zeigen eine begrenzte Färbung von Geweben mit periplasmatischem Extrakt ohne D11-AP, was zeigt, dass die Färbung hauptsächlich auf die Bindung von D11-AP zurückzuführen ist und nicht auf eine andere Komponente, die im periplasmatischen Extrakt vorhanden sein könnte. (A) Aorta der Ang-Maus, gefärbt mit D11-AP (grün) und nuklearer Gegenfärbung (magenta), (B) Aorta der Ang-Maus, gefärbt mit periplasmatischem Extrakt, (C) Scheinaorta der Maus, gefärbt mit D11-AP, (D) Scheinaorta der Maus, gefärbt mit periplasmatischem Extrakt, (E) hypertensives menschliches Darmgewebe, gefärbt mit D11-AP, (F) hypertensives menschliches Darmgewebe, gefärbt mit periplasmatischem Extrakt, (G) normotensives menschliches Darmgewebe, gefärbt mit D11-AP, (H) normotensives menschliches Darmgewebe, gefärbt mit periplasmatischem Extrakt (Maßstabsbalken = 100 μm). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
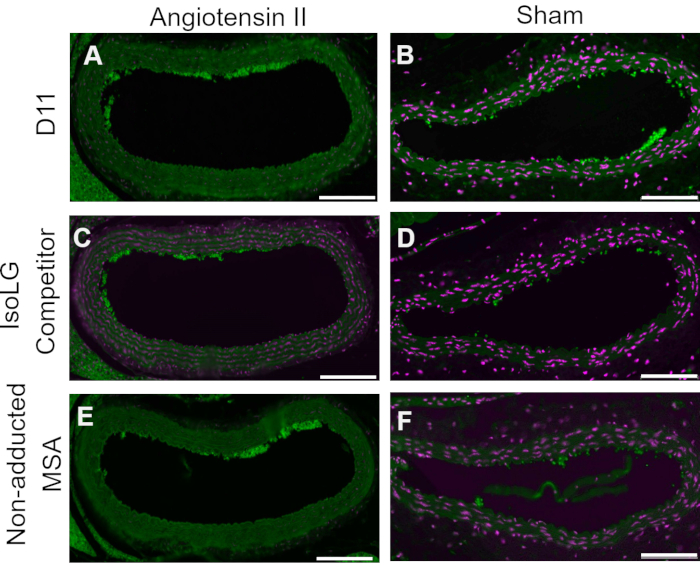
Abbildung 4: Konkurrenzkontrolle in Gefäßen von Ang- und Sham-Mäusen. In dieser kompetitiven Kontrolle wurde D11-AP mit IsoLG-adductiertem MSA oder nicht-adduziertem MSA vorinkubiert. Als Kontrolle diente D11-AP ohne jegliche Vorinkubation. Diese Ergebnisse zeigen die Spezifität von D11-AP gegenüber IsoLGs, da die Färbung von Geweben mit dem IsoLG-MSA-Konkurrenten im Vergleich zu D11-AP reduziert ist. Diese Reduktion ist auf IsoLG und nicht auf MSA zurückzuführen, da die nicht-adduzierte MSA-Vorinkubation zu einer Färbung ähnlich der D11-AP-Kontrolle führte. Angiotensin II (A) und Sham (B) Mausaorten, gefärbt mit D11-AP (grün) und nuklearer Gegenfärbung (magenta), Angiotensin II (C) und Sham (D) Mausaorten, gefärbt mit D11-AP nach Inkubation mit IsoLG-MSA, Angiotensin II (E) und Sham (F) Mausaorten, gefärbt mit D11-AP nach Inkubation mit nicht-adduziertem MSA (Maßstabsbalken = 100 μm). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
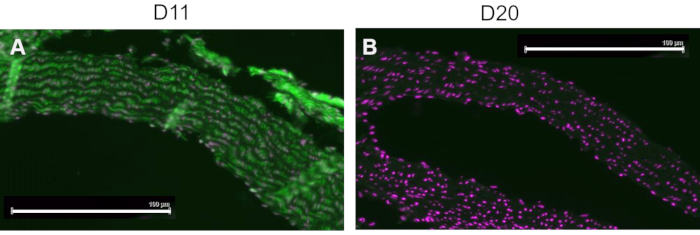
Abbildung 5: Aorten der Maus, gefärbt mit D11 und irrelevantem scFv, D20. Mausgewebe wurde mit D11-AP gefärbt und mit einem irrelevanten Kontrollantikörper, D20, verglichen, der spezifisch für das Glykoprotein A2 ist. Die Färbung von Gewebe mit D11-AP (grün) und nukleärer Gegenfärbung (magenta) (A) ergab eine intensive Immunfluoreszenz im Vergleich zu D20 (grün) und nukleärer Gegenfärbung (magenta) (B), was auf die Spezifität von D11-AP gegenüber IsoLGs hinweist (Maßstabsbalken = 100 μm). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
D11 wurde ausgiebig verwendet, um IsoLG-adduzierte Proteine in Zellen oder Geweben als Marker für Entzündungen oder oxidativen Stress bei der Krankheit 8,9,20 nachzuweisen. Zuvor enthielt D11 einen E-Tag, und die IHC-Entwicklung erforderte die Verwendung eines sekundären Anti-E-Tag-Antikörpers, der mit HRP 10,20,21 konjugiert war. Hier haben wir ein Protokoll für den Nachweis von IsoLG-adduzierten Proteinen entwickelt und optimiert, wobei der D11-Antikörper, der mit alkalischer Phosphatase konjugiert ist, anstelle des E-Tags konjugiert ist, wodurch eine sekundäre Antikörperinkubation entfällt.
Um die Spezifität von D11-AP zu bestimmen, wurden vier Negativkontrollexperimente durchgeführt. Wir haben das Protokoll ohne das Vorhandensein von D11 durchgeführt und hatten nur minimale Entwicklung. Diese Ergebnisse haben einen zweifachen Hinweis: Die endogene alkalische Phosphatase trägt nicht zur Entwicklung bei, und die beobachtete Färbung ist auf D11 zurückzuführen und nicht auf einen anderen beitragenden Faktor. Als nächstes färbten wir Objektträger mit dem AP-Linker ohne D11. Dieses Experiment führte zu einer geringen Färbung, was darauf hindeutet, dass freie AP oder andere Faktoren im periplasmatischen Extrakt nicht die Färbung verursachen, die wir in Gegenwart von D11 beobachten. Um die Spezifität von D11 gegenüber IsoLG zu gewährleisten, haben wir D11-AP vor der Färbung von Objektträgern mit gereinigtem IsoLG vorinkubiert. Wir sahen eine Abnahme der Entwicklung, was darauf hindeutet, dass das D11-AP an das IsoLG-Protein gebunden war, wodurch die Menge an freiem D11-AP erschöpft war, um an IsoLG im Gewebe zu binden. Um sicherzustellen, dass D11-AP an IsoLG und nicht an das MSA-Protein bindet, an das IsoLG gebunden ist, haben wir D11-AP nur mit MSA vorinkubiert. Es gab keine Veränderungen in der Entwicklung, was darauf hindeutet, dass D11-AP nicht an MSA, sondern an das IsoLG-Protein bindet. Schließlich waren die Forscher, die das Färbeprotokoll entwickelten, blind für den hypertensiven Status des menschlichen Darmgewebes. Die Unterschiede in der Färbung, die zwischen Patienten mit Hypertonie und Patienten mit Normotension beobachtet wurden, waren nicht auf Bias zurückzuführen und wurden bereits beschrieben22,23.
Obwohl unser Protokoll zum Nachweis von IsoLG-adduzierten Proteinen unter Verwendung des D11-Antikörpers, der mit alkalischer Phosphatase konjugiert ist, anstelle des E-Tags streng und robust ist und die Notwendigkeit einer sekundären Antikörperinkubation überflüssig macht, weist es einige Einschränkungen auf. Eine Einschränkung besteht darin, dass wir D11 konjugiert mit alkalischer Phosphatase im periplasmatischen Extrakt verwendet haben, und es könnte zu einer falschen Färbung der endogenen alkalischen Phosphatase im periplasmatischen Extrakt oder in bestimmten Geweben, wie z. B. Darm24, kommen. Der erste Schritt zur Entwicklung dieses Protokolls bestand jedoch darin, die endogene alkalische Phosphatase, die in Geweben vorhanden sein kann, zu deaktivieren25. Zunächst wurden kalte Essigsäure, BME und Levamisol26 auf ihre Wirksamkeit getestet. Keiner dieser Faktoren verringerte das Vorhandensein der aktiven endogenen alkalischen Phosphatase vollständig. Hitze wurde verwendet, um die alkalische Phosphatase27 zu deaktivieren, daher haben wir die Hitzedeaktivierung der alkalischen Phosphatase in verschiedenen Puffern getestet. Wir fanden heraus, dass das Erhitzen von montierten und hydratisierten Objektträgern in Citratpuffer den größten Teil der endogenen alkalischen Phosphatase eliminierte. Objektträger wurden ursprünglich mit einem Chemilumineszenz-/Fluoreszenzsubstrat entwickelt, aber wenn sie ohne dieses Substrat abgebildet wurden, gab es eine hohe Menge an Autofluoreszenz. VectorRed ist ein Substrat, das sich in Gegenwart alkalischer Phosphatase zu einem Chromogen entwickelt, das im Texas Red/TRITC-Kanalbereich sichtbar gemacht werden kann. Mit diesem Substrat konnten wir das Signal oberhalb der Hintergrundautofluoreszenz leichter beobachten. Während des Färbevorgangs sollte darauf geachtet werden, dass die künstliche Färbung minimiert wird. Trocknung des Gewebes auf Objektträgern nach der Hydratation, bis die Bildgebung zu einer verstärkten Entwicklung geführt hat. D11-AP sollte aliquotiert und bei -20 °C gelagert werden. Mehrfaches Einfrieren und Auftauen sollte bei der Arbeit mit D11-AP vermieden werden. Phosphatgepufferte Kochsalzlösung (PBS) kann auch die enzymatische Aktivität der alkalischen Phosphatase beeinflussen und sollte nicht als Waschpuffer verwendet werden28. Wie bei jedem antikörperbasierten Ansatz müssen gründliche Tests und Optimierungen durchgeführt werden, um sicherzustellen, dass die Färbung spezifisch ist und das Signal nicht über- oder unterverstärkt wird.
Zusammenfassend lässt sich sagen, dass wir ein leistungsstarkes, rigoroses und robustes, optimiertes Protokoll zum Nachweis von IsoLG-adduzierten Proteinen entwickelt haben, wobei der D11-Antikörper, der mit alkalischer Phosphatase konjugiert ist, anstelle des E-Tags konjugiert wird. Dieses Protokoll bietet mehrere Vorteile: Erstens ist die Verwendung von D11 als alkalisches Phosphatase-Fusionsprotein billiger. D11 wurde ursprünglich aus einer Phagen-Antikörper-Bibliothek gewonnen, die nicht kommerzialisiert werden konnte und teuer in der Reinigung war. Obwohl D11 im periplasmatischen Extrakt von E. coli eine kostengünstige Alternative darstellen könnte, war es in den meisten Assays unwirksam. Zweitens ermöglicht der Ansatz der alkalischen Phosphatase-Fusion, dass D11 scfv mit einem nützlichen Reporter15 (alkalische Phosphatase) fusioniert wird und für die Verwendung in Immunoassays nicht gereinigt werden müsste, da Substrate kommerziell verfügbar sind. Drittens bildet die alkalische Phosphatase von E. coli Dimere29. D11 würde also, wenn es mit der alkalischen Phosphatase fusioniert wird, auch Dimere bilden, was die Avidität und Bindungsaktivität des Antikörpers erhöht30. Schließlich kann D11, das mit alkalischer Phosphatase in periplasmatischem Extrakt konjugiert ist, leicht mit Cibacron Blue Sepharose gereinigt werden. D11 hat einen hohen isoelektrischen Punkt (~9,2 pH). Als solches ist es positiv geladen und kann durch pi-kation-Wechselwirkungen an Cibacron Blue binden. Die meisten Verunreinigungen im periplasmatischen Extrakt von E. coli können vom Harz eluiert werden. Das mit alkalischer Phosphatase konjugierte D11 kann dann mit hohem Salzgehalt (~1,5M NaCl) in Wasser eluiert werden. Das eluierte D11, konjugiert mit alkalischer Phosphatase, ist bei 4-8 °C in der Hochsalzlösung recht stabil. Daher haben wir ein Protokoll entwickelt, das nicht nur den D11-Antikörper kostengünstig verfügbar macht, sondern auch die zusätzlichen Schritte und die Notwendigkeit der Inkubation des Sekundärantikörpers eliminiert. Dieses Protokoll ermöglicht die reproduzierbare Messung von IsoLGs, die sich in Geweben bei mehreren Krankheiten anreichern, bei denen erhöhter oxidativer Stress eine Rolle spielt.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde durch die Zuschüsse der National Institutes of Health K01HL130497, R01HL147818, R01HL144941 und R03HL155041 an A.K. unterstützt. Wir danken der Digital Histology Shared Resource - Vanderbilt Health Nashville, TN https://www.vumc.org/dhsr/46298 für die Visualisierung und das Scannen von Objektträgern.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 ml TALON HiTrap column (Cobalt-CMA) | Cytiva | 28953766 | |
| 200 Proof Ethanol | Pharmco | 111000200 | |
| 2xYT powder | MP Biomedicals | 3012-032 | |
| 384-well, clear, flat-bottom polystyrene microplates | ThermoFisher (NUNC) | 242757 | |
| 4-Nitrophenyl phosphate disodium salt hexahydrate (pNPP) | Carbosynth | EN08508 | |
| 5-Bromo-4-chloro-3indoxyl phosphate, p-toluidine salt (BCIP) | Carbosynth | EB09335 | |
| Ampicillin, sodium salt | Research Products International (RPI) | A40040 | |
| Bovine Serum Albumin | RPI | A30075 | |
| Chemically competent TG1 E. coli | Amid Biosciences | TG1-201 | |
| Diethanolamine, >98% | Sigma-Aldrich | D8885 | |
| EDTA | Sigma-Aldrich | ED | |
| Fluoromount-G | SouthernBiotech | 0100-01 | Mouting medium |
| Glucose | Research Products International (RPI) | G32045 | |
| Glycerol | Sigma-Aldrich | G7893 | |
| Histoclear | National Diagnostics | HS-200 | Xylene alternative |
| Hoechst 33342 | ThermoFisher | H3570 | stock solution = 10 mg/mL |
| Hydrochloric acid (HCl), 30%, Macron Fine Chemicals | ThermoFisher | MK-2624-212 | |
| Imidazole | Research Products International (RPI) | I52000 | |
| MgCl2 (anhydrous) | Sigma-Aldrich | M8266 | |
| Mouse Serum Albumin (MSA) | Sigma-Aldrich/Calbiochem | 126674 | |
| Nitroblue tetrazolium chloride (NBT) | Carbosynth | EN13587 | |
| Potassium chloride (KCl) | Sigma-Aldrich | P4504 | |
| Potassium phosphate, monobasic (KH2PO4) | Sigma-Aldrich | P0662 | |
| Pressure Cooker | Cuisinart | CPC-600 | |
| Slide-a-Lyzer Dialysis cassettes, 10K MWCO, 3 ml | ThermoFisher | 66380 | |
| Sodium chloride (NaCl) | Research Products International (RPI) | S23020 | |
| Sodium Citrate | Sigma-Aldrich | 1064461000 | |
| Sodium phosphate, dibasic (Na2HPO4) | Research Products International (RPI) | S23100 | |
| Sucrose | Research Products International (RPI) | S24065 | |
| Tris base | Research Products International (RPI) | T60040 | |
| Tris-buffered Saline | Boston Bio-Products | 25mM Tris, 2.7mM KCl, 137 mM NaCl, pH 7.4 | |
| Tris-HCl | Research Products International (RPI) | T60050 | |
| Tween20 | Sigma-Aldrich | P9416 | |
| Vector Red | Vector Labs | SK-5105 |
Referenzen
- Brame, C. J., Salomon, R. G., Morrow, J. D., Roberts, L. J. Identification of extremely reactive gamma-ketoaldehydes (isolevuglandins) as products of the isoprostane pathway and characterization of their lysyl protein adducts. Journal of Biological Chemistry. 274, 13139-13146 (1999).
- Brame, C. J., et al. Modification of proteins by isoketal-containing oxidized phospholipids. Journal of Biological Chemistry. 279, 13447-13451 (2004).
- May-Zhang, L. S., et al. Scavenging reactive lipids to prevent oxidative injury. Annual Review of Pharmacology and Toxicology. 61, 291-308 (2021).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2019 update: A report from the American Heart Association. Circulation. 139, 56 (2019).
- Collins, D. R., et al. Global cardiovascular risk assessment in the primary prevention of cardiovascular disease in adults: Systematic review of systematic reviews. BMJ Open. 7, 013650 (2017).
- Whelton, P. K., et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the prevention, detection, evaluation, and management of high blood pressure in adults: Executive summary: A report of the American College of Cardiology/American Heart Association Task Force on clinical practice guidelines. Circulation. 138, 426-483 (2018).
- Patrick, D. M., Van Beusecum, J. P., Kirabo, A. The role of inflammation in hypertension: Novel concepts. Current Opinion in Physiology. 19, 92-98 (2021).
- Davies, S. S., et al. Isolevuglandins as mediators of disease and the development of dicarbonyl scavengers as pharmaceutical interventions. Pharmacology and Therapeutics. 205, 107418 (2020).
- Dixon, K. B., Davies, S. S., Kirabo, A. Dendritic cells and isolevuglandins in immunity, inflammation, and hypertension. American Journal of Physiology-Heart and Circulation Physiology. 312, 368-374 (2017).
- Kirabo, A., et al. DC isoketal-modified proteins activate T cells and promote hypertension. Journal of Clinical Investigation. 124, 4642-4656 (2014).
- Yan, H. P., et al. Isolevuglandins as a gauge of lipid peroxidation in human tumors. Free Radical Biology and Medicine. 106, 62-68 (2017).
- Davies, S. S., et al. Localization of isoketal adducts in vivo using a single-chain antibody. Free Radical Biology and Medicine. 36, 1163-1174 (2004).
- Shen, Z., et al. Single-chain fragment variable antibody piezoimmunosensors. Analytical Chemistry. 77, 797-805 (2005).
- Hennig, E. E., Mernaugh, R., Edl, J., Cao, P., Cover, T. L. Heterogeneity among Helicobacter pylori strains in expression of the outer membrane protein BabA. Infections and Immunity. 72, 3429-3435 (2004).
- Martin, C. D., et al. A simple vector system to improve performance and utilisation of recombinant antibodies. BMC Biotechnology. 6, 46 (2006).
- Han, Z., Karatan, E., Scholle, M. D., McCafferty, J., Kay, B. K. Accelerated screening of phage-display output with alkaline phosphatase fusions. Combinatorial Chemistry and High Throughput Screening. 7, 55-62 (2004).
- Miller, J. . Handbook for a short course in bacterial genetics. , (1992).
- Nair, R., et al. Yeast extract mediated autoinduction of lacUV5 promoter: An insight. New Biotechnology. 26 (6), 282-288 (2009).
- Davies, S. S., Amarnath, V., Roberts, L. J. Isoketals: Highly reactive γ-ketoaldehydes formed from the H2-isoprostane pathway. Chemistry and Physics of Lipids. 128 (1-2), 85-99 (2004).
- Ngwenyama, N., et al. Isolevuglandin-modified cardiac proteins drive CD4+ T-Cell activation in the heart and promote cardiac dysfunction. Circulation. 143 (12), 1242-1255 (2021).
- Prinsen, J. K., et al. Highly reactive Isolevuglandins promote atrial fibrillation caused by hypertension. Basic to Translational Science JACC. 5 (6), 602-615 (2020).
- Ferguson, J. F., et al. High dietary salt-induced dendritic cell activation underlies microbial dysbiosis-associated hypertension. JCI Insight. 5 (13), 126241 (2019).
- Madhur, M. S., et al. Hypertension: Do inflammation and immunity hold the key to solving this epidemic. Circulation Research. 128 (7), 908-933 (2021).
- Estaki, M., DeCoffe, D., Gibson, D. L. Interplay between intestinal alkaline phosphatase, diet, gut microbes and immunity. World Journal of Gastroenterology. 20 (42), 15650-15656 (2014).
- Millán, J. L. . Mammalian alkaline phosphatases: From biology to applications in medicine and biotechnology. , (2006).
- Ponder, B. A., Wilkinson, M. M. Inhibition of endogenous tissue alkaline phosphatase with the use of alkaline phosphatase conjugates in immunohistochemistry. Journal of Histochemistry and Cytochemistry. 29 (8), 981-984 (1981).
- Goldstein, D. J., Rogers, C. E., Harris, H. Expression of alkaline phosphatase loci in mammalian tissues. Proceedings of the National Academy of Science U. S. A. 77 (5), 2857-2860 (1980).
- Ramos-Vara, J. A. Technical aspects of immunohistochemistry. Veterinary Pathology. 42 (4), 405-426 (2005).
- Coleman, J. E. Structure and mechanism of alkaline phosphatase. Annual Review of Biophysics and Biomolecular Structure. 21, 441-483 (1992).
- Harper, J. E., Toth, R. L., Mayo, M. A., Torrance, L. Properties of a panel of single chain variable fragments against Potato leafroll virus obtained from two phage display libraries. Journal of Virological Methods. 81 (1-2), 159-168 (1999).
Erratum
Formal Correction: Erratum: Direct Detection of Isolevuglandins in Tissues using a D11 scFv-Alkaline Phosphatase Fusion Protein and Immunofluorescence
Posted by JoVE Editors on 4/11/2023. Citeable Link.
An erratum was issued for: Direct Detection of Isolevuglandins in Tissues using a D11 scFv-Alkaline Phosphatase Fusion Protein and Immunofluorescence. The Authors section was updated from:
Cassandra Warden1
Alan J. Simmons2
Lejla Pasic3
Sean S. Davies4
Justin H. Layer5
Raymond L. Mernaugh3
Annet Kirabo4,6
1Vanderbilt Eye Institute, Vanderbilt University Medical Center
2Department of Cell and Developmental Biology, Vanderbilt University
3Department of Biochemistry, Vanderbilt University
4Division of Clinical Pharmacology, Department of Medicine, Vanderbilt University Medical Center
5Division of Hematology and Oncology, Indiana University School of Medicine
6Department of Molecular Physiology and Biophysics, Vanderbilt University
to:
Cassandra Warden1
Alan J. Simmons2
Lejla Pasic3
Ashley Pitzer4,6
Sean S. Davies4
Justin H. Layer5
Raymond L. Mernaugh3
Annet Kirabo4,6
1Vanderbilt Eye Institute, Vanderbilt University Medical Center
2Department of Cell and Developmental Biology, Vanderbilt University
3Department of Biochemistry, Vanderbilt University
4Division of Clinical Pharmacology, Department of Medicine, Vanderbilt University Medical Center
5Division of Hematology and Oncology, Indiana University School of Medicine
6Department of Molecular Physiology and Biophysics, Vanderbilt University
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten