Method Article
Detecção direta de isolevuvolinas em tecidos usando uma proteína de fusão D11 scFv-fosfatase alcalina e imunofluorescência
* Estes autores contribuíram igualmente
Neste Artigo
Erratum Notice
Resumo
Este artigo fornece uma metodologia detalhada para a dosagem de isolevuglandinas em tecidos por imunofluorescência usando o anticorpo ScFv D11 conjugado à fosfatase alcalina. Modelos de hipertensão em camundongos e humanos são usados para explicar os procedimentos passo a passo e os princípios fundamentais associados à dosagem de isolevuvolina em amostras de tecido.
Resumo
As isovuglandinas (IsoLGs) são gama-cetoaldeídos altamente reativos formados a partir de isoprostanos H2 através da peroxidação lipídica e proteínas de ligações cruzadas que levam à inflamação e a várias doenças, incluindo hipertensão. A detecção do acúmulo de IsoLG nos tecidos é crucial para esclarecer seu envolvimento nos processos da doença. No entanto, a medição de IsoLGs em tecidos é extremamente difícil, e as ferramentas atualmente disponíveis, incluindo análise por espectrometria de massa, são trabalhosas e extremamente caras. Aqui descrevemos um novo método para detecção in situ de IsoLGs em tecidos usando fosfatase alcalina conjugada D11 ScFv e um anticorpo recombinante phage-display produzido em E. coli por microscopia de imunofluorescência. Quatro controles foram utilizados para validar a coloração: (1) coloração com e sem D11, (2) coloração com extrato periplasmático bacteriano com o ligante fosfatase alcalina, (3) coloração de anticorpos scFV irrelevantes e (4) controle competitivo com IsoLG antes da coloração. Demonstramos a eficácia da fosfatase alcalina conjugada D11 em tecidos humanos e de camundongos com ou sem hipertensão. Este método provavelmente servirá como uma ferramenta importante para estudar o papel das IsoLGs em uma ampla variedade de processos patológicos.
Introdução
As isovuglandinas (IsoLGs), também conhecidas como isocetolas, são isômeros da família dos 4-cetoaldeídos, que são produtos da peroxidação lipídica, reagem com e aduzem aminas primárias sobre proteínas 1,2. IsoLGs têm sido implicados em várias doenças, incluindo doenças cardiovasculares, Alzheimer, pulmonares e hepáticas, e muitos tipos de câncer3. As isoLGs têm sido mais extensamente estudadas em sua contribuição para a doença cardiovascular (DCV), que é um fardo econômico e de saúde significativo em todo o mundo, incluindo os Estados Unidos. Estima-se que 92,1 milhões de adultos norte-americanos tenham pelo menos um tipo de DCV, com projeções estimadas para 2030 chegando a 43,9% da população adulta dos EUA4. A redução da pressão arterial, do colesterol e a cessação do tabagismo reduzem o risco global e a ocorrência de eventos cardiovasculares5.
A hipertensão arterial ou hipertensão arterial é um importante fator de risco para doenças cardiovasculares e afeta aproximadamente metade da população norte-americana6. Estudos anteriores descobriram que a inflamação é uma causa subjacente de hipertensão e que os IsoLGs desempenham um papel7. Estímulos hipertensivos, incluindo angiotensina II, catecolaminas, aldosterona e excesso de sal na dieta, induzem o acúmulo de IsoLG em células apresentadoras de antígenos, incluindo células dendríticas (DCs), que por sua vez ativam células T para proliferar e produzir citocinas inflamatórias que contribuem para a hipertensão 8,9.
Anteriormente, as IsoLGs foram dosadas por imunohistoquímica, espectrometria de massa, ensaio imunoenzimático e citometria de fluxo10,11. Para facilitar a dosagem de IsoLGs, um anticorpo recombinante (D11) de variável de fragmento de cadeia única (scfv) foi desenvolvido contra IsoLGs12. Inicialmente, esse anticorpo D11 continha um E-tag de 11 aminoácidos e necessitava de um anticorpo secundário para detecção imunoistoquímica11. No entanto, foi difícil encontrar um anticorpo secundário confiável contra o E-tag após a interrupção de sua produção pelo fabricante. Portanto, desenvolvemos um protocolo confiável para coloração por imunofluorescência de IsoLGs usando D11 conjugado com fosfatase alcalina (D11-AP), que demonstramos em tecidos de camundongos e humanos com e sem hipertensão.
Protocolo
O Comitê Institucional de Cuidados e Uso de Animais da Universidade Vanderbilt aprovou todos os procedimentos descritos neste manuscrito. Os ratos são alojados e cuidados de acordo com o Guia para o Cuidado e Uso de Animais de Laboratório. Todos os indivíduos assinaram o termo de consentimento livre e esclarecido antes de se inscreverem no estudo, conforme aprovado pelo Comitê de Revisão Institucional da Universidade Vanderbilt. Todos os procedimentos foram realizados de acordo com a Declaração de Helsinque.
1. Preparação de plasmídeos que codificam a proteína de fusão D11-fosfatase alcalina e vetores de controle negativo
- Construir uma versão modificada do plasmídeo pCANTAB5E13,14 na qual o segmento variável de fragmento de cadeia única (scFv) é ligado em sua extremidade 3' a uma sequência que codifica a fosfatase alcalina bacteriana (AP).
NOTA: Imediatamente a jusante do sítio de restrição NotI da sequência scFv, o plasmídeo modificado não contém mais a sequência codificadora do E-tag e codifica a sequência do linker GGSGGHMGSGG, seguida pela sequência para AP (número de acesso do GenBank AXY87039.1, T16-K464)15,16. A jusante do AP, o plasmídeo codificará as tags 8xHis e DYKDDDDK. No final de 3' das tags, a sequência de codificação termina com um códon de parada de Âmbar. O plasmídeo modificado é denominado pCANTAB5-AP. - Clone D11 scFv (número de acesso do GenBank AAW28931.1) no pCANTAB5-AP com os sites de restrição SfiI/NotI.
- Clone D20 scFv em pCANTAB5-AP com os sites de restrição SfiI/NotI.
NOTA: D20 scFv é um controle negativo projetado para avaliar o padrão de interação tecidual de um scFv irrelevante. Este scFv foi originalmente selecionado por phage display por sua capacidade de interagir com um grupo glicano conhecido como A2. - Gere um vetor "vazio" removendo a porção scFv do plasmídeo inteiramente e substituindo-a por uma sequência codificadora "AP linker" consistindo de aminoácidos GGGGSGRAGSGGGGS.
- Transformar todos os plasmídeos em competentes TG1 E. coli e cultivar bactérias durante a noite a 30 °C, em placas de ágar 0,5% contendo 2xYT suplementado com 100 μg/mL de ampicilina e 2% de glicose (2xYTAG).
NOTA: Cepas com o gene supE (como TG1 E. coli) não suprimem o códon âmbar stop 100%. As estimativas variam de 0,8 a 20% do tempo, de modo que ainda há muito produto que termina apenas a jusante do BAP, como se pretende para esses experimentos17. As E. coli TG1 são usadas principalmente por razões práticas, tais como a redução de tempo e custos, sua compatibilidade com o sistema de expressão da proteína pCANTAB e seu uso em phage display, que é comumente conduzido em laboratório. A jusante do códon da parada âmbar após BAP é uma sequência para o gene III. As proteínas de fusão GeneIII precisam ser expressas raramente para que a exibição de fagos funcione como pretendido, porque as proteínas de fusão scFv-geneIII interferem com essa proteína específica do gene III para reinfectar bactérias virgens. Portanto, proteínas geneIII livres de fusão precisam existir durante a montagem do virion para a geração de fagos funcionantes, ou seja, produtos proteicos scFv-geneIII são geralmente relativamente raros dentro da bactéria. D11-AP, D20-AP, vetor vazio e todos os construtos usados neste artigo são todos afetados similarmente pela expressão ocasional da proteína de fusão geneIII. Ainda são observadas diferenças em como essas proteínas se comportam. - Escolher uma colônia individual e inocular 5 mL frescos de cultura 2xYTAG. Deixe as bactérias crescerem durante a noite a 30 °C e agitando a 150 rpm.
- Pellet as células por centrifugação a 3.000 x g por 10 min à temperatura ambiente. Descarte o sobrenadante e ressuspenda o pellet em 2 mL de 2xYTAG a 85% e glicerol a 15%.
- Mantenha os estoques de glicerol em um freezer de -80 °C.
2. Expressão proteica e geração de extrato periplasmático
NOTA: A geração do extrato periplasmático é um método comumente utilizado para expressão de proteínas em phage display, principalmente porque a formação de ligações dissulfeto é importante na scFv e geração de anticorpos. O método evita a necessidade de gerar lisados (comumente contendo corpos de inclusão) e garante que as proteínas sejam devidamente dobradas. O pCANTAB tem uma sequência de sinal gIII a montante da porção scFv da proteína de fusão D11-BAP. A sequência de sinal garante que a proteína seja transportada para o espaço periplasmático da bactéria e, em seguida, a sequência de sinal seja clivada. O espaço periplasmático fornece um ambiente oxidante, que é crucial para a formação adequada de pontes dissulfeto. O choque osmótico é usado para derivar extratos periplasmáticos porque rompe a membrana externa o suficiente para liberar as proteínas periplasmáticas no meio circundante, mantendo a bactéria intacta.
- Inocular reservas de TG1 E. coli glicerol contendo os plasmídeos relevantes numa cultura de 60 ml de 2xYTAG e cultura durante a noite a 30 °C com agitação a 150 rpm.
- Para induzir a expressão proteica, culturas bacterianas em pellets a 3.000 x g por 10 min, ressuspensão em 60 mL de meio 2xYTA e cultura durante a noite a 30 °C com agitação a 150 rpm.
NOTA: A mudança do meio 2xTYAG para 2xYTA ajuda na indução suficiente da expressão proteica18. Quando a glicose está presente no meio bacteriano, o promotor de lac é suprimido porque as bactérias consomem preferencialmente glicose e ignoram a lactose, pois a glicose leva menos energia para ser processada. Quando a glicose é removida após a troca do meio, as bactérias dependem dos carboidratos fornecidos pelo meio 2xYT. O extrato de levedura (o componente Y em 2xYT) contém carboidratos, entre eles lactose, e é, portanto, capaz de conduzir a expressão de proteínas através do promotor de lac. O IPTG não é necessário com a construção pCANTAB e pode resultar em expressão excessiva de proteínas, juntamente com corpos de inclusão que resultam em proteínas não funcionais. - Gerar extratos periplasmáticos via choque osmótico.
- Culturas bacterianas em pellets a 3.000 x g por 10 min.
- Ressuspender em 20 mL de 1xTES (Tris-HCl 0,2 M pH 8,0, EDTA 0,5 mM, sacarose 0,5 M) e incubar por 1 h em gelo.
- Novamente pastilhar a 3.000 x g por 10 min, e ressuspender em 15 mL de Tris 0,05 M, pH 7,6.
- Incubar esta suspensão no gelo por 1 h, depois esclarecer por centrifugação a 5.000 x g por 10 min.
- Transfira os sobrenadantes para um tubo fresco e armazene a -20 °C até ser necessário para purificação ou uso direto em experimentos.
- Avaliar a lise celular pela presença de D11-BAP ativo no ELISA. Adicione 3-5 μL do extrato periplasmático a um mL de pNPP e, em seguida, observe se uma mudança de cor ocorre nos próximos 10 min (a cor vai de amarelo-claro para amarelo intenso).
NOTA: A cor pode ser comparada lado a lado com um tubo de pNPP que não recebeu nenhum lisado ou um tubo de pNPP que recebeu lisado de bactérias TG1 virgens. Quantificar com absorbância a 405 nm.
4. Caracterização do título de D11-AP em ELISA
- Revestir uma placa de poliestireno de 384 poços durante a noite a 4 °C com solução salina tamponada com fosfato (PBS) 25 μL/poço (1,8 mM KH 2 PO 4, 10 mM Na 2 HPO4, 2,7mM KCl, 137 mM NaCl) contendo 5 μg/mL de albumina sérica de camundongo (MSA) (controle negativo) ou 5 μg/mL de IsoLG/MSA (controle positivo).
- Esvazie o prato e seque. Lave uma vez com PBS + 0,1% Tween (PBS-T). Esvazie o prato e seque.
- Encher a placa com PBS-T como tampão de bloqueio (120 μL/poço). Incubar durante 1 h à temperatura ambiente.
- Esvazie o prato e seque. Aplicar diluições seriadas 1:2 de extratos periplasmáticos D11-AP a 25 μL/poço e diluídos em PBS-T. Incluir um poço contendo apenas PBS-T como controle negativo.
NOTA: Os intervalos de diluição típicos para extractos periplasmáticos são 1:8 - 1:4096. Para um volume de ensaio de 25 μL, comece com 50 μL da concentração inicial "1:8": 6,25 μL de extrato periplasmático e 43,75 μL de PBS-T. Em seguida, realizar uma diluição de 2 vezes retirando 25 μL dessa solução e adicionando-a ao próximo poço contendo 25 μL de PBS-T e pipetá-la para cima e para baixo. Este poço agora contém a diluição "1:16". Continue repetindo a diluição de 2 vezes para gerar a série de diluição 1:2 descrita. - Incubar durante 1,5 h à temperatura ambiente.
- Esvazie o prato e seque. Lave 5 vezes com PBS-T. Esvazie e seque.
- Preparar a solução de pNPP dissolvendo 1 g de pNPP em 1 L de dietanolamina 930 mM (solução estoque a 98% diluída 1:10 em H 2 O),com 0,5 mM MgCl2 e ajustada para pH 9,5 com HCl.
- Incubar por 1 h à temperatura ambiente e determinar a absorbância a 405 nm dentro de cada poço usando um leitor de placas compatível.
- Compare o sinal gerado pelos poços IsoLG/MSA com o ruído gerado pelos poços MSA e encontre a faixa de diluições em que o sinal é pelo menos 5 vezes maior que o ruído.
- Plote esta série de diluição do sinal D11-AP em um gráfico, determine a faixa linear da curva e estabeleça a diluição onde 50% do sinal pode ser observado.
NOTA: Se esta diluição for equivalente a aproximadamente 1:1.000, a solução D11-AP pode ser utilizada a uma concentração de 1:10 em IHC/FI.
5. Imunofluorescência
- Cortar secções seriadas de tecidos de rato e de parafina humana (5 μm de espessura) utilizando um micrótomo e colocar num banho de água morna (37 °C). Monte seções de tecido em lâminas de vidro e deixe secar durante a noite.
NOTA: Para este estudo, as aortas foram obtidas de camundongos. Cortes de cólon de humanos normotensos e hipertensos foram obtidos da Vanderbilt Cooperative Human Tissue Network. - Imergir as lâminas em xileno três vezes por 5 min para desparafinizar os tecidos.
- Hidratar os tecidos em 2 lavagens cada de 95%, 70% e 50% de etanol em H2O.
- Lavar as lâminas em solução salina tamponada Tris (TBS) com Tween20 0,1% (TBST) três vezes com lavagens rápidas, preenchendo o suporte de lâmina com TBST e, em seguida, descartando TBST.
NOTA: As lâminas hidratadas podem ser armazenadas em TBST a 4 °C por não mais de uma semana antes da recuperação do antígeno. - Para realizar a recuperação antigênica induzida pelo calor das lâminas, colocar as lâminas em tampão citrato de sódio pré-aquecido (80-95 °C) (citrato de sódio 10 mM, Tween 20 0,05%, pH 6,0) e incubar em uma panela de pressão regulada para 4 min em alta pressão para um tempo total de recuperação do antígeno de 20 min.
- Retire as lâminas da panela de pressão e deixe esfriar por 20 min até a temperatura ambiente.
- Lave as lâminas em TBST três vezes com lavagens rápidas.
NOTA: As lâminas podem ser armazenadas em TBST após a recuperação do antígeno por não mais do que uma semana antes da coloração. - Adicione 2% de BSA dissolvido em TBST para bloquear slides. Cubra as lâminas com uma tira de filme de parafina e incube à temperatura ambiente por 15 min.
- Descarte o buffer de bloqueio dos slides.
- Adicionar 200 μL de 1:10 D11-AP em TBST às lâminas e cobrir com uma tira de filme de parafina.
- Incubar em uma câmara umidificada para minimizar a evaporação da solução de anticorpos por 3 h à temperatura ambiente.
- Lave as lâminas três vezes em TBST.
- Desenvolver com um revelador de fosfatase alcalina colorimétrica ou fluorescente para imunohistoquímica ou imunofluorescência, respectivamente. Lave as lâminas uma vez com TBST para remover o excesso de revelador e evitar o desenvolvimento de cores.
- Lâminas de contracoloração com corante nuclear Hoechst a 1 μg/mL em PBS para imunofluorescência. Lave as lâminas uma vez no TBST para remover qualquer excesso de manchas.
- Aplique lamínulas usando o meio de montagem.
- Visualize lâminas em microscópio de luz invertida para imunohistoquímica ou em microscópio confocal fluorescente para imunofluorescência.
6. Controlos negativos
NOTA: Quatro experimentos de controle negativo podem ser realizados para confirmar a especificidade da coloração D11-AP para IsoLG. Experimentos de controle negativo devem ser realizados no mesmo conjunto de coloração nas mesmas condições.
- No primeiro experimento de controle negativo, incubar os tecidos com D11-AP diluído em TBST ou TBST isoladamente.
- Incubar tecidos com D11-AP diluído em TBST e extrato periplasmático bacteriano sem D11-AP (AP Linker) diluído em TBST.
- Realizar um ensaio competitivo com IsoLG/MSA ou MSA não aduzido, conforme descrito anteriormente12.
- Preparar IsoLG e IsoLG aduzidos à albumina sérica de camundongo (MSA) como descrito anteriormente19, em uma razão molar de 8 IsoLG: 1 MSA (8:1 IsoLG/MSA).
- Diluir D11-AP 1:10 em TBST.
- Incubar D11-AP diluído com 50 μg/mL de IsoLG/MSA ou MSA não aduzido por 1 h à temperatura ambiente.
- Adicionar D11-AP com IsoLG/MSA ou D11-AP com MSA não aduzido aos tecidos para coloração.
- Use o anticorpo scFv irrelevante, D20, para corar os tecidos para o conjunto de controle negativo final.
Resultados
Em experimentos representativos, D11 scfv com uma conjugação de fosfatase alcalina (D11-AP) foi usado em imunofluorescência para detectar IsoLGs presentes em camundongos tratados com angiotensina II em comparação com camundongos sham normais e humanos com hipertensão em comparação com humanos normotensos. Camundongos foram tratados com angiotensina II na dose de 490 ng/kg/min por duas semanas, e a hipertensão foi confirmada com aumento da pressão arterial sistólica em comparação com camundongos sham10. Para garantir a especificidade do D11-AP, os tecidos foram corados com ou sem a presença do D11-AP. Como demonstrado pela coloração D11-AP, a aorta de camundongos com hipertensão induzida por angiotensina II apresentou concentração elevada de IsoLGs quando comparada aos camundongos controle (Figura 1). A coloração de fundo ou autofluorescência foi limitada, como demonstrado por controles negativos que não foram corados com D11-AP.
O D11-AP foi utilizado para detectar IsoLGs presentes em tecidos intestinais de pacientes humanos com hipertensão arterial sistêmica (HAS) ou humanos normotensos (NTN). O estado de hipertensão foi estabelecido a partir dos registros hospitalares como pressão arterial sistólica acima de 140 e pressão arterial diastólica acima de 80 mmHg. Os pesquisadores que desenvolveram o protocolo de imunofluorescência para D11-AP foram cegados para o estado de hipertensão dos tecidos humanos. Os cortes foram corados na presença e ausência de D11-AP para garantir a especificidade do anticorpo e mostrar coloração de fundo ou autofluorescência. Como mostrado na Figura 2, observamos que os tecidos de pacientes com HA tinham concentrações elevadas de IsoLGs em comparação com pacientes com NTN. A coloração sem D11-AP também mostrou mínima coloração de fundo e autofluorescência. A fosfatase alcalina endógena é expressa pelo epitélio intestinal, de modo que a fluorescência limitada dos tecidos corados sem D11-AP mostra que a recuperação antigênica utilizada neste protocolo foi suficiente para inativar a fosfatase alcalina endógena presente nos tecidos. Em combinação com os resultados em camundongos, esses resultados também mostram que o protocolo de imunofluorescência efetivamente mostra IsoLGs elevadas na hipertensão quando comparado ao estado normotenso.
D11-AP foi isolado e armazenado no extrato periplasmático bacteriano. Tecidos de camundongos e humanos foram corados com D11-AP e extrato periplasmático contendo o ligante AP sem D11 para garantir que outros fatores que possam estar presentes no extrato periplasmático, como excesso ou fosfatase alcalina não conjugada, não contribuam para a coloração observada nos tecidos tratados com D11-AP (Figura 3). Os tecidos corados com D11-AP resultaram em coloração mais brilhante em comparação com os tecidos corados com extrato periplasmático. Estes resultados confirmam que a D11-AP está corando os tecidos, e a coloração não é devida à fosfatase alcalina bacteriana não conjugada que pode potencialmente estar presente no extrato periplasmático e resultar em falsa coloração de IsoLGs ou contribuir para a coloração de fundo.
Um controle competitivo foi realizado pré-incubando D11-AP com IsoLG aduzido a MSA ou MSA não aduzido antes da coloração dos tecidos para mostrar a especificidade de D11-AP para IsoLG. Se D11-AP for específico para IsoLG, o anticorpo se ligaria a IsoLG-MSA, resultando em uma disponibilidade esgotada de D11-AP para corar tecidos, e D11-AP incubado com MSA não aduzido teria coloração semelhante à D11-AP normal. Nos tecidos corados com D11-AP pré-incubados com o competidor IsoLG, encontramos coloração diminuída em relação aos tecidos que foram corados com D11-AP sem qualquer pré-incubação (Figura 4). Nos tecidos corados com D11-AP pré-incubados com MSA não aduzida, encontramos coloração semelhante à observada em tecidos com D11-AP. Esses resultados mostram a especificidade do D11-AP para IsoLGs devido à redução da coloração dos tecidos quando o D11-AP foi pré-incubado com IsoLG/MSA, mas não com MSA não aduzido. No controle negativo final, o tecido de camundongo foi corado com D11-AP ou anticorpo irrelevante scFv, D20. A coloração da aorta de camundongos com D11-AP resultou em forte coloração em relação ao D20, indicando a especificidade do D11-AP para IsoLGs em aortas hipertensivas (Figura 5).
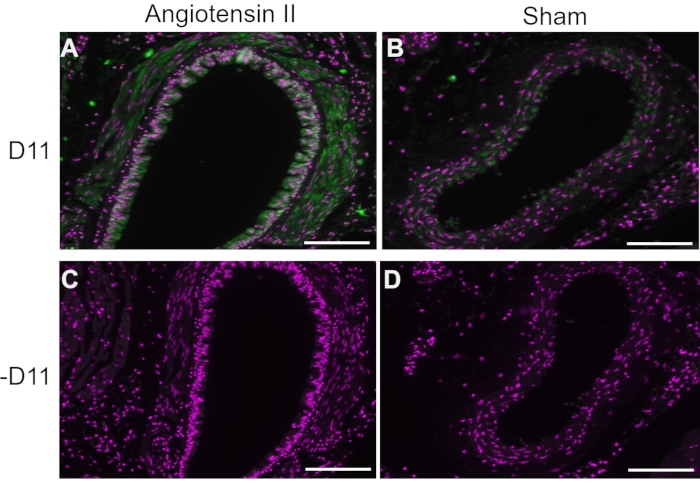
Figura 1: Imunofluorescência da aorta em camundongos hipertensos e normotensos. Artérias de camundongos com angiotensina II e sham infundidos foram coradas com e sem D11-AP (D11) para mostrar a presença de IsoLGs. (A) Artéria de camundongo tratado com angiotensina II sondado com D11-AP (verde) e contracoloração nuclear (magenta), (B) Artéria de camundongo tratado com simulação controle sondado com D11-AP, (C) Artéria de camundongo tratado com angiotensina II sem D11-AP, (D) Artéria de camundongo controle tratado com simulação sem D11-AP (barra de escala =100 μm). Clique aqui para ver uma versão maior desta figura.
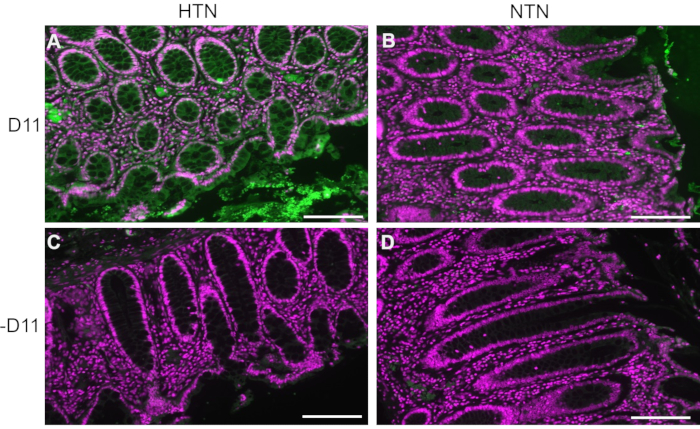
Figura 2: Imunofluorescência do tecido intestinal humano de pacientes hipertensos e normotensos. Tecidos de pacientes com hipertensão arterial sistêmica (HAS) e humanos normotensos (NTN) foram corados com e sem D11-AP (D11) para mostrar a presença de IsoLGs em pacientes com HA. (A) Tecidos de HTN corados com D11-AP (verde) e contracoloração nuclear (magenta), (B) tecidos de NTN corados com D11-AP, (C) tecidos de HTN corados sem D11-AP, (D) tecidos de NTN corados sem D11-AP (barra de escala =100 μm). Clique aqui para ver uma versão maior desta figura.
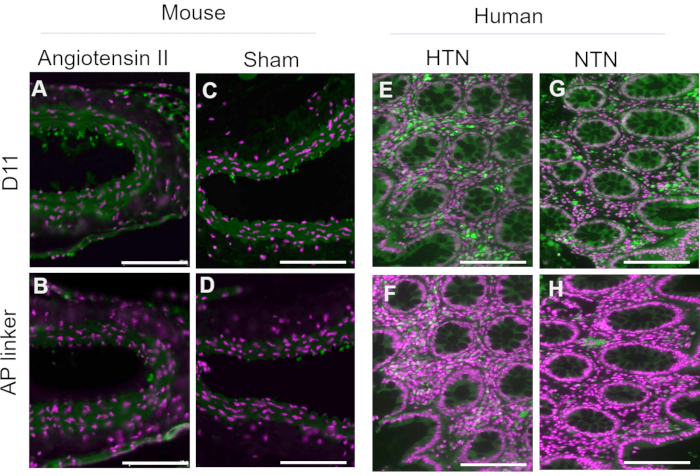
Figura 3: Tecidos de camundongos e humanos corados com extrato periplasmático com e sem D11-AP. Tecidos de camundongos e humanos foram corados com extratos periplasmáticos com e sem D11-AP. As imagens mostram coloração limitada dos tecidos com extrato periplasmático sem D11-AP, o que mostra que a coloração é principalmente devida à ligação D11-AP em vez de outro componente que pode estar presente no extrato periplasmático. (A) Aorta de camundongo Ang corada com D11-AP (verde) e contracoloração nuclear (magenta), (B) Aorta de camundongo Ang corada com extrato periplasmático, (C) Aorta de camundongo Sham corada com D11-AP, (D) Aorta de camundongo sham corada com extrato periplasmático, (E) tecido intestinal humano hipertensivo corado com D11-AP, (F) tecido intestinal humano hipertensivo corado com extrato periplasmático, (G) tecido intestinal humano normotenso corado com D11-AP, (H) tecido intestinal humano normotenso corado com extrato periplasmático (barra de escala =100 μm). Clique aqui para ver uma versão maior desta figura.
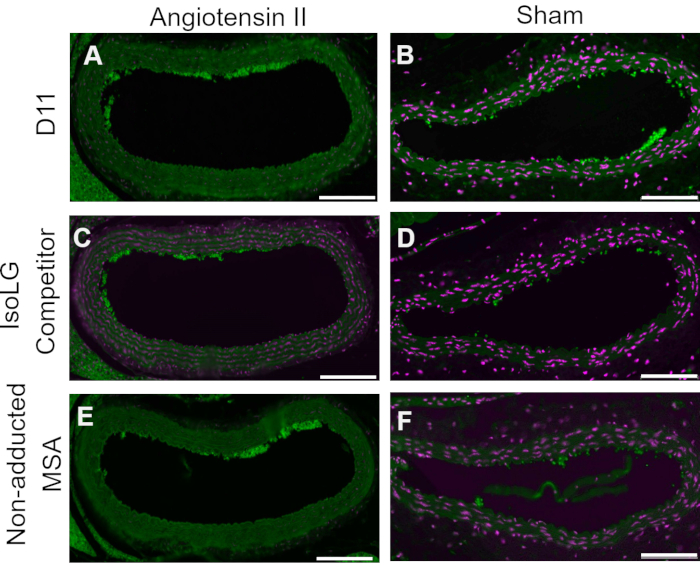
Figura 4: Controle competitivo em vasos de camundongos Ang e Sham. Nesse controle competitivo, o D11-AP foi pré-incubado com MSA aduzida com IsoLG ou MSA não aduzida. D11-AP sem pré-incubação foi utilizado como controle. Estes resultados mostram a especificidade do D11-AP para IsoLGs, pois há redução da coloração dos tecidos com o competidor IsoLG-MSA em relação ao D11-AP. Essa redução deve-se à IsoLG e não à MSA, pois a pré-incubação da MSA não aduzida resultou em coloração semelhante ao controle D11-AP. Aortas de camundongos coradas com D11-AP (verde) e Sham (B) coradas com D11-AP (verde) e contracoloração nuclear (magenta), Angiotensina II (C) e Sham (D) coradas com D11-AP após incubação com IsoLG-MSA, Angiotensina II (E) e Sham (F) coradas com D11-AP após incubação com MSA não aduzida (barra de escala =100 μm). Clique aqui para ver uma versão maior desta figura.
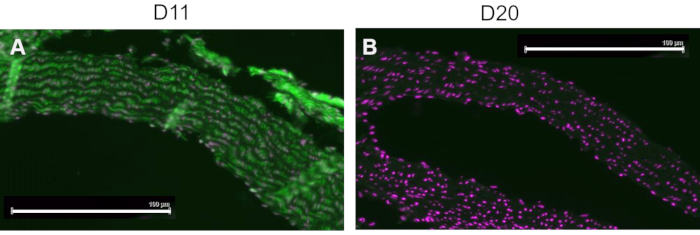
Figura 5: Aortas de camundongos coradas com D11 e scFv irrelevante, D20. O tecido de camundongo foi corado com D11-AP e comparado a um anticorpo controle irrelevante, D20, que é específico para a glicoproteína A2. A coloração do tecido com D11-AP (verde) e contracoloração nuclear (magenta) (A) resultou em intensa imunofluorescência em relação à D20 (verde) e contracoloração nuclear (magenta) (B), o que indica especificidade de D11-AP para IsoLGs (barra de escala =100 μm). Clique aqui para ver uma versão maior desta figura.
Discussão
O D11 tem sido amplamente utilizado para detectar proteínas aduzidas por IsoLG em células ou tecidos como marcador de inflamação ou estresse oxidativo na doença 8,9,20. Anteriormente, o D11 continha um tag E e o desenvolvimento de IHQ exigiu o uso de um anticorpo anti-tag anti-E secundário conjugado com HRP10,20,21. Aqui, desenvolvemos e otimizamos um protocolo para detecção de proteínas aduzidas por IsoLG usando o anticorpo D11 conjugado com fosfatase alcalina no lugar do E-tag, o que elimina a necessidade de incubação secundária de anticorpos.
Para determinar a especificidade do D11-AP, quatro experimentos de controle negativo foram realizados. Realizamos o protocolo sem a presença do D11 e tivemos evolução mínima. Esses resultados têm dupla indicação: a fosfatase alcalina endógena não está contribuindo para o desenvolvimento, e a coloração observada é devida ao D11 e não a outro fator contribuinte. Em seguida, coramos as lâminas com o ligante AP sem D11. Este experimento resultou em pouca coloração, o que indica que a PA livre ou outros fatores no extrato periplasmático não estão causando a coloração que observamos na presença de D11. Para garantir a especificidade de D11 para IsoLG, pré-incubamos D11-AP com IsoLG purificado antes de colorir as lâminas. Observamos uma diminuição no desenvolvimento, o que indica que a D11-AP estava ligada à proteína IsoLG, esgotando assim a quantidade de D11-AP livre para se ligar à IsoLG presente no tecido. Finalmente, para garantir que D11-AP estava ligando ao IsoLG e não à proteína MSA à qual o IsoLG estava ligado, pré-incubamos o D11-AP apenas com MSA. Não houve alterações no desenvolvimento, indicando que a D11-AP não se ligou à MSA, mas sim à proteína IsoLG. Por fim, os pesquisadores que desenvolveram o protocolo de coloração foram cegos para o estado hipertensivo do tecido intestinal humano. As diferenças de coloração observadas entre pacientes hipertensos e normotensos não foram devidas a viés e já foram previamente descritas22,23.
Embora nosso protocolo para detecção de proteínas aduzidas por IsoLG usando o anticorpo D11 conjugado com fosfatase alcalina no lugar do E-tag seja rigoroso e robusto e elimine a necessidade de incubação secundária de anticorpos, ele tem algumas limitações. Uma limitação é que utilizamos D11 conjugado com fosfatase alcalina no extrato periplasmático, podendo haver falsa coloração de fosfatase alcalina endógena no extrato periplasmático ou em determinados tecidos, como intestino24. No entanto, o primeiro passo para o desenvolvimento desse protocolo incluiu a desativação da fosfatase alcalina endógena que pode estar presente nos tecidos25. Inicialmente, ácido acético frio, BME e Levamisole26 foram testados quanto à eficiência. Nenhum deles diminuiu completamente a presença de fosfatase alcalina endógena ativa. O calor tem sido usado para desativar a fosfatase alcalina27, por isso testamos a desativação térmica da fosfatase alcalina em diferentes tampões. Encontramos lâminas aquecidas e hidratadas em tampão citrato que eliminaram a maior parte da fosfatase alcalina endógena. As lâminas foram desenvolvidas inicialmente utilizando um substrato quimioluminescente/fluorescente, mas quando imageadas sem este substrato, houve uma grande quantidade de autofluorescência. VectorRed é um substrato que se desenvolve na presença de fosfatase alcalina para produzir um cromógeno que pode ser visualizado na faixa de canais Texas Red/TRITC. Usando este substrato, pudemos observar mais facilmente o sinal acima da autofluorescência de fundo. Cuidados devem ser tomados durante o processo de coloração para minimizar a coloração artefactual. A secagem dos tecidos nas lâminas após a hidratação até a aquisição de imagens resultou em maior desenvolvimento. D11-AP deve ser aliquotado e armazenado a -20 °C. Vários ciclos de congelamento-descongelamento devem ser evitados ao trabalhar com D11-AP. A solução salina tamponada com fosfato (PBS) também pode afetar a atividade enzimática da fosfatase alcalina e não deve ser usada como tampão de lavagem28. Como acontece com qualquer abordagem baseada em anticorpos, testes e otimização completos devem ser realizados para garantir que a coloração seja específica e que o sinal não seja amplificado ou não seja amplificado.
Em conclusão, desenvolvemos um protocolo otimizado poderoso, rigoroso e robusto para detectar proteínas aduzidas por IsoLG usando o anticorpo D11 conjugado com fosfatase alcalina no lugar do E-tag. Este protocolo apresenta várias vantagens: Primeiro, o uso de D11 como proteína de fusão de fosfatase alcalina é mais barato. D11 foi originalmente derivado de uma biblioteca de anticorpos de fago que não podia ser comercializada e era caro para purificar. Embora D11 no extrato periplasmático de E. coli possa fornecer uma alternativa barata, foi ineficaz na maioria dos ensaios. Em segundo lugar, a abordagem de fusão de fosfatase alcalina permite que o D11 scfv tenha um repórter útil15 (fosfatase alcalina) fundido a ele e não precisaria ser purificado para uso em imunoensaios, pois substratos estão comercialmente disponíveis. Terceiro, a fosfatase alcalina de E. coli forma dímeros29. Assim, a D11, quando fusionada à fosfatase alcalina, também formaria dímeros e isso aumentaria a avidez e a atividade de ligação do anticorpo30. Finalmente, D11 conjugado com fosfatase alcalina em extrato periplasmático pode ser facilmente limpo usando Cibacron Blue Sepharose. D11 tem um ponto isoelétrico alto (~9,2 pH). Como tal, é carregado positivamente e pode ligar-se ao Cibacron Blue através de interações pi-cátion. A maioria das impurezas do extrato periplasmático de E. coli pode ser eluída da resina. O D11 conjugado com fosfatase alcalina pode então ser eluído usando sal alto (~1,5M NaCl) em água. O D11 eluído conjugado com fosfatase alcalina é bastante estável a 4-8 °C na solução salina alta. Assim, desenvolvemos um protocolo que não só disponibiliza o anticorpo D11 a baixo custo, mas também elimina as etapas extras e a necessidade de incubação do anticorpo secundário. Este protocolo facilita a medição reprodutível de IsoLGs, que se acumulam nos tecidos em múltiplas doenças onde o aumento do estresse oxidativo desempenha um papel.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelos subsídios do National Institutes of Health K01HL130497, R01HL147818, R01HL144941 e R03HL155041 para A.K. Agradecemos ao Digital Histology Shared Resource - Vanderbilt Health Nashville, TN https://www.vumc.org/dhsr/46298 pela visualização e digitalização das lâminas.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 ml TALON HiTrap column (Cobalt-CMA) | Cytiva | 28953766 | |
| 200 Proof Ethanol | Pharmco | 111000200 | |
| 2xYT powder | MP Biomedicals | 3012-032 | |
| 384-well, clear, flat-bottom polystyrene microplates | ThermoFisher (NUNC) | 242757 | |
| 4-Nitrophenyl phosphate disodium salt hexahydrate (pNPP) | Carbosynth | EN08508 | |
| 5-Bromo-4-chloro-3indoxyl phosphate, p-toluidine salt (BCIP) | Carbosynth | EB09335 | |
| Ampicillin, sodium salt | Research Products International (RPI) | A40040 | |
| Bovine Serum Albumin | RPI | A30075 | |
| Chemically competent TG1 E. coli | Amid Biosciences | TG1-201 | |
| Diethanolamine, >98% | Sigma-Aldrich | D8885 | |
| EDTA | Sigma-Aldrich | ED | |
| Fluoromount-G | SouthernBiotech | 0100-01 | Mouting medium |
| Glucose | Research Products International (RPI) | G32045 | |
| Glycerol | Sigma-Aldrich | G7893 | |
| Histoclear | National Diagnostics | HS-200 | Xylene alternative |
| Hoechst 33342 | ThermoFisher | H3570 | stock solution = 10 mg/mL |
| Hydrochloric acid (HCl), 30%, Macron Fine Chemicals | ThermoFisher | MK-2624-212 | |
| Imidazole | Research Products International (RPI) | I52000 | |
| MgCl2 (anhydrous) | Sigma-Aldrich | M8266 | |
| Mouse Serum Albumin (MSA) | Sigma-Aldrich/Calbiochem | 126674 | |
| Nitroblue tetrazolium chloride (NBT) | Carbosynth | EN13587 | |
| Potassium chloride (KCl) | Sigma-Aldrich | P4504 | |
| Potassium phosphate, monobasic (KH2PO4) | Sigma-Aldrich | P0662 | |
| Pressure Cooker | Cuisinart | CPC-600 | |
| Slide-a-Lyzer Dialysis cassettes, 10K MWCO, 3 ml | ThermoFisher | 66380 | |
| Sodium chloride (NaCl) | Research Products International (RPI) | S23020 | |
| Sodium Citrate | Sigma-Aldrich | 1064461000 | |
| Sodium phosphate, dibasic (Na2HPO4) | Research Products International (RPI) | S23100 | |
| Sucrose | Research Products International (RPI) | S24065 | |
| Tris base | Research Products International (RPI) | T60040 | |
| Tris-buffered Saline | Boston Bio-Products | 25mM Tris, 2.7mM KCl, 137 mM NaCl, pH 7.4 | |
| Tris-HCl | Research Products International (RPI) | T60050 | |
| Tween20 | Sigma-Aldrich | P9416 | |
| Vector Red | Vector Labs | SK-5105 |
Referências
- Brame, C. J., Salomon, R. G., Morrow, J. D., Roberts, L. J. Identification of extremely reactive gamma-ketoaldehydes (isolevuglandins) as products of the isoprostane pathway and characterization of their lysyl protein adducts. Journal of Biological Chemistry. 274, 13139-13146 (1999).
- Brame, C. J., et al. Modification of proteins by isoketal-containing oxidized phospholipids. Journal of Biological Chemistry. 279, 13447-13451 (2004).
- May-Zhang, L. S., et al. Scavenging reactive lipids to prevent oxidative injury. Annual Review of Pharmacology and Toxicology. 61, 291-308 (2021).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2019 update: A report from the American Heart Association. Circulation. 139, 56 (2019).
- Collins, D. R., et al. Global cardiovascular risk assessment in the primary prevention of cardiovascular disease in adults: Systematic review of systematic reviews. BMJ Open. 7, 013650 (2017).
- Whelton, P. K., et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the prevention, detection, evaluation, and management of high blood pressure in adults: Executive summary: A report of the American College of Cardiology/American Heart Association Task Force on clinical practice guidelines. Circulation. 138, 426-483 (2018).
- Patrick, D. M., Van Beusecum, J. P., Kirabo, A. The role of inflammation in hypertension: Novel concepts. Current Opinion in Physiology. 19, 92-98 (2021).
- Davies, S. S., et al. Isolevuglandins as mediators of disease and the development of dicarbonyl scavengers as pharmaceutical interventions. Pharmacology and Therapeutics. 205, 107418 (2020).
- Dixon, K. B., Davies, S. S., Kirabo, A. Dendritic cells and isolevuglandins in immunity, inflammation, and hypertension. American Journal of Physiology-Heart and Circulation Physiology. 312, 368-374 (2017).
- Kirabo, A., et al. DC isoketal-modified proteins activate T cells and promote hypertension. Journal of Clinical Investigation. 124, 4642-4656 (2014).
- Yan, H. P., et al. Isolevuglandins as a gauge of lipid peroxidation in human tumors. Free Radical Biology and Medicine. 106, 62-68 (2017).
- Davies, S. S., et al. Localization of isoketal adducts in vivo using a single-chain antibody. Free Radical Biology and Medicine. 36, 1163-1174 (2004).
- Shen, Z., et al. Single-chain fragment variable antibody piezoimmunosensors. Analytical Chemistry. 77, 797-805 (2005).
- Hennig, E. E., Mernaugh, R., Edl, J., Cao, P., Cover, T. L. Heterogeneity among Helicobacter pylori strains in expression of the outer membrane protein BabA. Infections and Immunity. 72, 3429-3435 (2004).
- Martin, C. D., et al. A simple vector system to improve performance and utilisation of recombinant antibodies. BMC Biotechnology. 6, 46 (2006).
- Han, Z., Karatan, E., Scholle, M. D., McCafferty, J., Kay, B. K. Accelerated screening of phage-display output with alkaline phosphatase fusions. Combinatorial Chemistry and High Throughput Screening. 7, 55-62 (2004).
- Miller, J. . Handbook for a short course in bacterial genetics. , (1992).
- Nair, R., et al. Yeast extract mediated autoinduction of lacUV5 promoter: An insight. New Biotechnology. 26 (6), 282-288 (2009).
- Davies, S. S., Amarnath, V., Roberts, L. J. Isoketals: Highly reactive γ-ketoaldehydes formed from the H2-isoprostane pathway. Chemistry and Physics of Lipids. 128 (1-2), 85-99 (2004).
- Ngwenyama, N., et al. Isolevuglandin-modified cardiac proteins drive CD4+ T-Cell activation in the heart and promote cardiac dysfunction. Circulation. 143 (12), 1242-1255 (2021).
- Prinsen, J. K., et al. Highly reactive Isolevuglandins promote atrial fibrillation caused by hypertension. Basic to Translational Science JACC. 5 (6), 602-615 (2020).
- Ferguson, J. F., et al. High dietary salt-induced dendritic cell activation underlies microbial dysbiosis-associated hypertension. JCI Insight. 5 (13), 126241 (2019).
- Madhur, M. S., et al. Hypertension: Do inflammation and immunity hold the key to solving this epidemic. Circulation Research. 128 (7), 908-933 (2021).
- Estaki, M., DeCoffe, D., Gibson, D. L. Interplay between intestinal alkaline phosphatase, diet, gut microbes and immunity. World Journal of Gastroenterology. 20 (42), 15650-15656 (2014).
- Millán, J. L. . Mammalian alkaline phosphatases: From biology to applications in medicine and biotechnology. , (2006).
- Ponder, B. A., Wilkinson, M. M. Inhibition of endogenous tissue alkaline phosphatase with the use of alkaline phosphatase conjugates in immunohistochemistry. Journal of Histochemistry and Cytochemistry. 29 (8), 981-984 (1981).
- Goldstein, D. J., Rogers, C. E., Harris, H. Expression of alkaline phosphatase loci in mammalian tissues. Proceedings of the National Academy of Science U. S. A. 77 (5), 2857-2860 (1980).
- Ramos-Vara, J. A. Technical aspects of immunohistochemistry. Veterinary Pathology. 42 (4), 405-426 (2005).
- Coleman, J. E. Structure and mechanism of alkaline phosphatase. Annual Review of Biophysics and Biomolecular Structure. 21, 441-483 (1992).
- Harper, J. E., Toth, R. L., Mayo, M. A., Torrance, L. Properties of a panel of single chain variable fragments against Potato leafroll virus obtained from two phage display libraries. Journal of Virological Methods. 81 (1-2), 159-168 (1999).
Erratum
Formal Correction: Erratum: Direct Detection of Isolevuglandins in Tissues using a D11 scFv-Alkaline Phosphatase Fusion Protein and Immunofluorescence
Posted by JoVE Editors on 4/11/2023. Citeable Link.
An erratum was issued for: Direct Detection of Isolevuglandins in Tissues using a D11 scFv-Alkaline Phosphatase Fusion Protein and Immunofluorescence. The Authors section was updated from:
Cassandra Warden1
Alan J. Simmons2
Lejla Pasic3
Sean S. Davies4
Justin H. Layer5
Raymond L. Mernaugh3
Annet Kirabo4,6
1Vanderbilt Eye Institute, Vanderbilt University Medical Center
2Department of Cell and Developmental Biology, Vanderbilt University
3Department of Biochemistry, Vanderbilt University
4Division of Clinical Pharmacology, Department of Medicine, Vanderbilt University Medical Center
5Division of Hematology and Oncology, Indiana University School of Medicine
6Department of Molecular Physiology and Biophysics, Vanderbilt University
to:
Cassandra Warden1
Alan J. Simmons2
Lejla Pasic3
Ashley Pitzer4,6
Sean S. Davies4
Justin H. Layer5
Raymond L. Mernaugh3
Annet Kirabo4,6
1Vanderbilt Eye Institute, Vanderbilt University Medical Center
2Department of Cell and Developmental Biology, Vanderbilt University
3Department of Biochemistry, Vanderbilt University
4Division of Clinical Pharmacology, Department of Medicine, Vanderbilt University Medical Center
5Division of Hematology and Oncology, Indiana University School of Medicine
6Department of Molecular Physiology and Biophysics, Vanderbilt University
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados