Method Article
Détection directe des isolévuglandines dans les tissus à l’aide d’une protéine de fusion phosphatase alcaline D11 scFv et d’une immunofluorescence
* Ces auteurs ont contribué à parts égales
Dans cet article
Erratum Notice
Résumé
Cet article fournit une méthodologie détaillée pour la mesure des isolévuglandines dans les tissus par immunofluorescence à l’aide d’anticorps ScFv D11 conjugués à la phosphatase alcaline. Des modèles d’hypertension chez la souris et l’homme sont utilisés pour expliquer les procédures étape par étape et les principes fondamentaux associés à la mesure de l’isolévuglandine dans des échantillons de tissus.
Résumé
Les isolevuglandines (IsoLGs) sont des gamma cétoaldéhydes hautement réactifs formés à partir d’isoprostanes H2 par peroxydation lipidique et protéines de réticulation conduisant à l’inflammation et à diverses maladies, y compris l’hypertension. La détection de l’accumulation d’IsoLG dans les tissus est cruciale pour faire la lumière sur leur implication dans les processus de la maladie. Cependant, la mesure des IsoLGs dans les tissus est extrêmement difficile, et les outils actuellement disponibles, y compris l’analyse par spectrométrie de masse, sont laborieux et extrêmement coûteux. Nous décrivons ici une nouvelle méthode de détection in situ des IsoLGs dans les tissus à l’aide de D11 ScFv conjugué à la phosphatase alcaline et d’un anticorps phage-affichage recombinant produit chez E. coli par microscopie immunofluorescente. Quatre témoins ont été utilisés pour valider la coloration : (1) coloration avec et sans D11, (2) coloration avec un extrait périplasmique bactérien avec le liant phosphatase alcalin, (3) coloration non pertinente des anticorps scFV et (4) contrôle compétitif avec IsoLG avant la coloration. Nous démontrons l’efficacité de la phosphatase alcaline conjuguée D11 dans les tissus humains et murins avec ou sans hypertension. Cette méthode servira probablement d’outil important pour étudier le rôle des IsoLG dans une grande variété de processus pathologiques.
Introduction
Les isolévuglandines (IsoLG), également appelées isocétals, sont des isomères de la famille des 4-cétoaldéhydes, qui sont des produits de la peroxydation lipidique et réagissent avec les amines primaires sur les protéines 1,2. Les IsoLG ont été impliqués dans plusieurs maladies, notamment les maladies cardiovasculaires, la maladie d’Alzheimer, les maladies pulmonaires et hépatiques et de nombreux types de cancer3. Les IsoLG ont fait l’objet d’études plus approfondies pour leur contribution aux maladies cardiovasculaires (MCV), qui représentent un fardeau sanitaire et économique important à l’échelle mondiale, y compris aux États-Unis. On estime que 92,1 millions d’adultes américains ont au moins un type de MCV, avec des projections estimées pour 2030 atteignant 43,9% de la population adulte américaine4. L’abaissement de la pression artérielle, du cholestérol et du sevrage tabagique réduit le risque global et la survenue d’événements cardiovasculaires5.
L’hypertension artérielle ou l’hypertension est un facteur de risque majeur de maladie cardiovasculaire et touche environ la moitié de la population américaine6. Des études antérieures ont montré que l’inflammation est une cause sous-jacente de l’hypertension et que les IsoLG jouent un rôle7. Les stimuli hypertenseurs, y compris l’angiotensine II, les catécholamines, l’aldostérone et l’excès de sel alimentaire, induisent une accumulation d’IsoLG dans les cellules présentatrices d’antigènes, y compris les cellules dendritiques (DC), qui à leur tour activent les cellules T pour proliférer et produire des cytokines inflammatoires qui contribuent à l’hypertension 8,9.
Auparavant, les IsoLG ont été mesurés par immunohistochimie, spectrométrie de masse, dosage immuno-enzymatique et cytométrieen flux 10,11. Pour faciliter la mesure des IsoLGs, un anticorps recombinant à fragment à chaîne unique (scfv) (D11) a été développé contre IsoLGs12. Initialement, cet anticorps D11 contenait un E-tag de 11 acides aminés et nécessitait un anticorps secondaire pour la détection immunohistochimique11. Cependant, il a été difficile de trouver un anticorps secondaire fiable contre le E-tag après l’arrêt de sa production par le fabricant. Par conséquent, nous avons développé un protocole fiable pour la coloration immunofluorescente des IsoLGs en utilisant D11 conjugué avec la phosphatase alcaline (D11-AP), que nous avons démontré dans les tissus de souris et humains avec et sans hypertension.
Protocole
Le comité institutionnel de soin et d’utilisation des animaux de l’Université Vanderbilt a approuvé toutes les procédures décrites dans ce manuscrit. Les souris sont hébergées et soignées conformément au Guide sur le soin et l’utilisation des animaux de laboratoire. Tous les sujets ont donné leur consentement éclairé écrit avant de s’inscrire à l’étude, tel qu’approuvé par le comité d’examen institutionnel de l’Université Vanderbilt. Toutes les procédures ont été effectuées conformément à la Déclaration d’Helsinki.
1. Préparation de plasmides codant pour la protéine de fusion de la phosphatase D11-alcaline et des vecteurs témoins négatifs
- Construire une version modifiée du plasmide pCANTAB5E13,14 dans lequel le segment variable de fragment à chaîne unique (scFv) est lié à son extrémité 3' à une séquence codant pour la phosphatase alcaline bactérienne (AP).
NOTE: Immédiatement en aval du site de restriction NotI de la séquence scFv, le plasmide modifié ne contient plus la séquence de codage de l’étiquette E et code plutôt la séquence de liaison GGSGGHMGSGG, suivie de la séquence pour AP (numéro d’acquisition GenBank AXY87039.1, T16-K464)15,16. En aval de l’AP, le plasmide encodera les balises 8xHis et DYKDDDK. À l’extrémité 3' des balises, la séquence de codage se termine par un codon d’arrêt ambre. Le plasmide modifié est appelé pCANTAB5-AP. - Cloner D11 scFv (numéro d’acquisition GenBank AAW28931.1) dans pCANTAB5-AP avec les sites de restriction SfiI/NotI.
- Clonez D20 scFv dans pCANTAB5-AP avec les sites de restriction SfiI/NotI.
REMARQUE : D20 scFv est un témoin négatif conçu pour évaluer le profil d’interaction tissulaire d’un scFv non pertinent. Ce scFv a été initialement sélectionné par phage display pour sa capacité à interagir avec un groupe de glycanes connu sous le nom de A2. - Générer un vecteur « vide » en retirant entièrement la partie scFv du plasmide et en la remplaçant par une séquence codante « AP linker » composée d’acides aminés GGGGSGRAGSGGGGS.
- Transformer tous les plasmides en E. coli TG1 compétent et cultiver des bactéries pendant une nuit à 30 °C, sur des plaques de gélose à 0,5 % contenant 2xYT complétées par 100 μg/mL d’ampicilline et 2 % de glucose (2xYTAG) milieu.
NOTE: Les souches avec le gène supE (comme TG1 E. coli) ne suppriment pas le codon stop ambre à 100%. Les estimations vont de 0,8 à 20% du temps, il y a donc encore beaucoup de produits qui se terminent juste en aval du BAP, car il est prévu pour ces expériences17. TG1 E. coli est principalement utilisé pour des raisons pratiques, telles que la réduction du temps et des coûts, leur compatibilité avec le système d’expression de la protéine pCANTAB et leur utilisation dans l’affichage des phages, qui est couramment effectué en laboratoire. En aval du codon stop ambre suivant BAP se trouve une séquence pour le gène III. Les protéines de fusion GeneIII doivent être exprimées rarement pour que l’affichage des phages fonctionne comme prévu, car les protéines de fusion scFv-geneIII interfèrent avec cette protéine gène III particulière pour réinfecter les bactéries naïves. Par conséquent, les protéines gènes III sans fusion doivent exister pendant l’assemblage du virion pour la génération de phages fonctionnels, c’est-à-dire que les produits protéiques scFv-geneIII sont généralement relativement rares à l’intérieur de la bactérie. D11-AP, D20-AP, vecteur vide et toutes les constructions utilisées dans cet article sont tous affectés de la même manière par l’expression occasionnelle de la protéine de fusion geneIII. Il y a encore des différences observées dans la façon dont ces protéines se comportent. - Choisissez une colonie individuelle et inoculez 5 ml frais de culture 2xYTAG. Laisser les bactéries se développer pendant la nuit à 30 °C et agiter à 150 tr/min.
- Enduire les cellules par centrifugation à 3 000 x g pendant 10 min à température ambiante. Jeter le surnageant et remettre en suspension la pastille dans 2 mL de 25% 2xYTAG et 15% de glycérol.
- Maintenir les stocks de glycérol dans un congélateur à -80 °C.
2. Expression protéique et génération d’extrait périplasmique
REMARQUE: La génération de l’extrait périplasmique est une méthode couramment utilisée pour l’expression des protéines dans l’affichage des phages, principalement parce que la formation de liaisons disulfure est importante dans la scFv et la génération d’anticorps. La méthode évite d’avoir à générer des lysats (contenant généralement des corps d’inclusion) et garantit que les protéines sont correctement repliées. pCANTAB a une séquence de signaux gIII en amont de la partie scFv de la protéine de fusion D11-BAP. La séquence de signal garantit que la protéine est transportée vers l’espace périplasmique de la bactérie, puis la séquence de signal est clivée. L’espace périplasmique fournit un environnement oxydant, ce qui est crucial pour la bonne formation des ponts disulfures. Le choc osmotique est utilisé pour obtenir des extraits périplasmiques car il perturbe suffisamment la membrane externe pour libérer les protéines périplasmiques dans le milieu environnant, tout en maintenant la bactérie intacte.
- Inoculer les stocks de glycérol TG1 E. coli contenant les plasmides pertinents dans une culture de 60 ml de 2xYTAG et les cultiver pendant une nuit à 30 °C avec agitation à 150 rpm.
- Pour induire l’expression des protéines, injecter des cultures bactériennes à 3 000 x g pendant 10 min, les remettre en suspension dans 60 mL de milieu 2xYTA et les cultiver pendant une nuit à 30 °C en agitant à 150 tr/min.
REMARQUE: Le passage du milieu 2xTYAG au milieu 2xYTA aide à induire suffisamment l’expression protéique18. Lorsque le glucose est présent dans le milieu bactérien, le promoteur de lac est supprimé parce que les bactéries consomment préférentiellement le glucose et ignorent le lactose, car le glucose prend moins d’énergie à traiter. Lorsque le glucose est éliminé après le changement de milieu, les bactéries dépendent des glucides fournis par le milieu 2xYT. L’extrait de levure (le composant Y dans 2xYT) contient des glucides, parmi lesquels du lactose, et est donc capable de conduire l’expression des protéines à travers le promoteur lac. L’IPTG n’est pas nécessaire avec la construction pCANTAB et peut entraîner une expression excessive des protéines, ainsi que des corps d’inclusion qui entraînent une protéine non fonctionnelle. - Générer des extraits périplasmiques par choc osmotique.
- Cultures bactériennes en granulés à 3 000 x g pendant 10 min.
- Remettez en suspension dans 20 mL de 1xTES (0,2 M Tris-HCl pH 8,0, 0,5 mM EDTA, 0,5 M saccharose) et incuber pendant 1 h sur glace.
- Ensemencer à nouveau à 3 000 x g pendant 10 min, puis remettre en suspension dans 15 mL de Tris 0,05 M, pH 7,6.
- Incuber cette suspension sur glace pendant 1 h, puis clarifier par centrifugation à 5 000 x g pendant 10 min.
- Transférer les surnageants dans un tube frais et les conserver à -20 °C jusqu’à ce qu’ils soient nécessaires pour la purification ou l’utilisation directe dans des expériences.
- Évaluer la lyse cellulaire par la présence de D11-BAP actif dans l’ELISA. Ajouter 3-5 μL de l’extrait périplasmique à un mL de pNPP, puis observer si un changement de couleur se produit au cours des 10 prochaines minutes (la couleur passe du jaune clair au jaune intense).
REMARQUE: La couleur peut être comparée côte à côte à un tube de pNPP qui n’a reçu aucun lysat ou à un tube de pNPP qui a reçu du lysat de bactéries TG1 naïves. Quantifier avec une absorbance à 405 nm.
4. Caractérisation du titre D11-AP dans ELISA
- Enduire une plaque de polystyrène de 384 puits pendant une nuit à 4 °C avec une solution saline tamponnée au phosphate (PBS) de 25 μL/puits (1,8 mM KH 2 PO 4, 10 mM Na 2 HPO4,2,7mM KCl, 137 mM NaCl) contenant soit 5 μg/mL d’albumine sérique (MSA) de souris (témoin négatif), soit 5 μg/mL d’IsoLG/MSA (témoin positif).
- Vider l’assiette et sécher en tapotant. Laver une fois avec PBS + 0,1% Tween (PBS-T). Vider l’assiette et sécher en tapotant.
- Remplissez la plaque avec du PBS-T comme tampon de blocage (120 μL/puits). Incuber pendant 1 h à température ambiante.
- Vider l’assiette et sécher en tapotant. Appliquer des dilutions en série 1:2 d’extraits périplasmiques de D11-AP à 25 μL/puits et diluer dans du PBS-T. Inclure un puits contenant uniquement du PBS-T comme témoin négatif.
NOTE: Les plages de dilution typiques pour les extraits périplasmiques sont de 1:8 - 1:4096. Pour un volume d’essai de 25 μL, commencez avec 50 μL de la concentration initiale « 1:8 » : 6,25 μL d’extrait périplasmique et 43,75 μL de PBS-T. Ensuite, effectuez une dilution 2 fois en retirant 25 μL de cette solution et en l’ajoutant au puits suivant contenant 25 μL de PBS-T et en la pipette de haut en bas. Ce puits contient maintenant la dilution « 1:16 ». Répétez la dilution 2 fois pour obtenir la série de dilution 1:2 décrite. - Incuber pendant 1,5 h à température ambiante.
- Vider l’assiette et sécher en tapotant. Lavez 5 fois avec PBS-T. Vider et tapoter sec.
- Préparer la solution de pNPP en dissolvant 1 g de pNPP dans 1 L de diéthanolamine 930 mM (solution mère à 98 % diluée à 1:10 dansH2O), avec 0,5 mM de MgCl2et ajustée à pH 9,5 avec HCl.
- Appliquer une solution de NPP de 25 μL/puits pour développer l’AP. Incuber pendant 1 h à température ambiante et déterminer l’absorbance à 405 nm dans chaque puits à l’aide d’un lecteur de plaques compatible.
- Comparez le signal généré par les puits IsoLG/MSA au bruit généré par les puits MSA et trouvez la gamme de dilutions dans laquelle le signal est au moins 5 fois plus élevé que le bruit.
- Tracez cette série de dilution du signal D11-AP sur un graphique, déterminez la plage linéaire de la courbe et établissez la dilution où 50% du signal peut être observé.
NOTA: Si cette dilution est équivalente à environ 1:1 000, la solution de D11-AP peut être utilisée à une concentration de 1:10 dans IHC/IF.
5. Immunofluorescence
- Couper en série des coupes de tissus de souris et de paraffine humaine (5 μm d’épaisseur) à l’aide d’un microtome et les placer dans un bain-marie tiède (37 °C). Fixez les coupes de tissu sur des lames de verre et laissez sécher pendant la nuit.
NOTE: Pour cette étude, les aortae ont été obtenues à partir de souris. Des coupes de côlon d’humains normotendus et hypertendus ont été obtenues auprès du Vanderbilt Cooperative Human Tissue Network. - Immerger les lames dans le xylène trois fois pendant 5 minutes pour déparaffiniser les tissus.
- Réhydrater les tissus en 2 lavages chacun d’éthanol à 95%, 70% et 50% dansH2O.
- Lavez les lames dans une solution saline tamponnée Tris (TBS) avec 0,1% Tween20 (TBST) trois fois avec des lavages rapides en remplissant le support de lame avec TBST puis en jetant TBST.
REMARQUE : Les lames hydratées peuvent être conservées dans du TBST à 4 °C pendant une semaine au plus avant le prélèvement de l’antigène. - Pour effectuer le prélèvement d’antigènes induits par la chaleur des lames, placer les lames dans un tampon de citrate de sodium préchauffé (80-95 °C) (10 mM de citrate de sodium, 0,05 % Tween 20, pH 6,0) et incuber dans un autocuiseur réglé à 4 min à haute pression pour un temps total de récupération de l’antigène de 20 min.
- Retirez les lames de l’autocuiseur et laissez-les refroidir pendant 20 minutes à température ambiante.
- Lavez les lames dans TBST trois fois avec des lavages rapides.
REMARQUE: Les lames peuvent être stockées dans TBST après le prélèvement de l’antigène pendant une semaine au maximum avant la coloration. - Ajouter 2% de BSA dissous dans TBST pour bloquer les lames. Couvrir les lames d’une bande de film de paraffine et incuber à température ambiante pendant 15 min.
- Supprimez la mémoire tampon de blocage des diapositives.
- Ajouter 200 μL de D11-AP 1:10 dans TBST aux lames et couvrir d’une bande de film de paraffine.
- Incuber dans une chambre humidifiée pour minimiser l’évaporation de la solution d’anticorps pendant 3 h à température ambiante.
- Lavez les lames trois fois dans TBST.
- Développer avec un révélateur de phosphatase alcaline colorimétrique ou fluorescente pour l’immunohistochimie ou l’immunofluorescence, respectivement. Lavez les lames une fois avec TBST pour éliminer l’excès de révélateur et empêcher tout développement ultérieur des couleurs.
- La contre-coloration glisse avec la coloration nucléaire de Hoechst à 1 μg/mL dans le PBS pour l’immunofluorescence. Lavez les lames une fois dans TBST pour enlever tout excès de contre-tache.
- Appliquez les lamelles de couverture à l’aide du support de montage.
- Visualisez les diapositives sous un microscope à lumière inversée pour l’immunohistochimie ou un microscope confocale fluorescent pour l’immunofluorescence.
6. Contrôles négatifs
NOTE: Quatre expériences de contrôle négatif peuvent être effectuées pour confirmer la spécificité de la coloration D11-AP pour IsoLG. Les expériences de contrôle négatif doivent être effectuées dans le même jeu de coloration dans les mêmes conditions.
- Dans la première expérience de contrôle négatif, incuber des tissus avec du D11-AP dilué dans TBST ou TBST seul.
- Incuber des tissus avec du D11-AP dilué dans du TBST et de l’extrait périplasmique bactérien sans D11-AP (AP Linker) dilué dans du TBST.
- Effectuer un essai compétitif avec IsoLG/MSA ou MSA non adduit comme décrit précédemment12.
- Préparer IsoLG et IsoLG adduits à l’albumine sérique de souris (MSA) comme décrit précédemment19, à un rapport molaire de 8 IsoLG: 1 MSA (8:1 IsoLG / MSA).
- Diluer D11-AP 1:10 dans TBST.
- Incuber du D11-AP dilué avec 50 μg/mL d’IsoLG/MSA ou du MSA non adduit pendant 1 h à température ambiante.
- Ajouter D11-AP avec IsoLG/MSA ou D11-AP avec MSA non adduit aux tissus pour la coloration.
- Utilisez l’anticorps non pertinent scFv, D20, pour colorer les tissus pour l’ensemble de contrôle négatif final.
Résultats
Dans des expériences représentatives, le D11 scfv avec une conjugaison de phosphatase alcaline (D11-AP) a été utilisé en immunofluorescence pour détecter les IsoLG présents chez les souris traitées à l’angiotensine II par rapport aux souris simulées normales et les humains souffrant d’hypertension par rapport aux humains normotendus. Les souris ont été traitées avec de l’angiotensine II à une dose de 490 ng / kg / min pendant deux semaines, et l’hypertension a été confirmée par une augmentation de la pression artérielle systolique par rapport aux souris simulées10. Pour assurer la spécificité du D11-AP, les tissus ont été colorés avec ou sans la présence de D11-AP. Comme démontré par la coloration D11-AP, l’aorte de souris souffrant d’hypertension induite par l’angiotensine II a montré une concentration élevée d’IsoLGs par rapport aux souris témoins (Figure 1). La coloration de fond ou l’autofluorescence était limitée, comme le montrent les témoins négatifs qui n’ont pas été colorés au D11-AP.
D11-AP a été utilisé pour détecter les IsoLGs présents dans les tissus intestinaux de patients humains souffrant d’hypertension (HTN) ou d’humains normotendus (NTN). Le statut d’hypertension a été établi à partir des dossiers de l’hôpital comme une pression artérielle systolique supérieure à 140 et une pression artérielle diastolique supérieure à 80 mmHg. Les chercheurs développant un protocole d’immunofluorescence pour D11-AP ont été aveuglés par le statut d’hypertension des tissus humains. Les coupes ont été colorées en présence et en l’absence de D11-AP pour assurer la spécificité des anticorps et montrer une coloration de fond ou une autofluorescence. Comme le montre la figure 2, nous avons constaté que les tissus des patients atteints de HTN présentaient des concentrations élevées d’IsoLG par rapport aux patients atteints de NTN. La coloration sans D11-AP a également montré une coloration de fond minimale et une autofluorescence. La phosphatase alcaline endogène est exprimée par l’épithélium intestinal, de sorte que la fluorescence limitée des tissus colorés sans D11-AP montre que la récupération de l’antigène utilisée dans ce protocole était suffisante pour inactiver la phosphatase alcaline endogène présente dans les tissus. En combinaison avec les résultats chez la souris, ces résultats montrent également que le protocole d’immunofluorescence montre efficacement des IsoLG élevés dans l’hypertension par rapport à l’état normotendeur.
Le D11-AP a été isolé et stocké dans l’extrait périplasmique bactérien. Des tissus de souris et humains ont été colorés avec du D11-AP et un extrait périplasmique contenant l’agent de liaison AP sans D11 afin de s’assurer que d’autres facteurs pouvant être présents dans l’extrait périplasmique, tels que l’excès ou la phosphatase alcaline non conjuguée, ne contribuent pas à la coloration observée dans les tissus traités par D11-AP (Figure 3). Les tissus colorés avec D11-AP ont entraîné une coloration plus brillante par rapport aux tissus colorés avec un extrait périplasmique. Ces résultats confirment que D11-AP colore les tissus, et la coloration n’est pas due à la phosphatase alcaline bactérienne non conjuguée qui peut potentiellement être présente dans l’extrait périplasmique et entraîner une fausse coloration des IsoLGs ou contribuer à la coloration de fond.
Un contrôle concurrentiel a été effectué en pré-incubant le D11-AP avec de l’IsoLG adduit au MSA ou au MSA non adduit avant de colorer les tissus pour montrer la spécificité du D11-AP à IsoLG. Si le D11-AP est spécifique de l’IsoLG, l’anticorps se lierait à l’IsoLG-MSA, ce qui entraînerait une diminution de la disponibilité du D11-AP pour colorer les tissus, et le D11-AP incubé avec du MSA non adduit aurait une coloration similaire à la D11-AP normale. Dans les tissus colorés avec D11-AP pré-incubés avec le concurrent IsoLG, nous avons constaté une diminution de la coloration par rapport aux tissus colorés avec D11-AP sans aucune préincubation (Figure 4). Dans les tissus colorés avec D11-AP préincubés avec MSA non adduit, nous avons constaté que la coloration était similaire à la coloration observée dans les tissus avec D11-AP. Ces résultats montrent la spécificité du D11-AP aux IsoLG en raison de la coloration réduite des tissus lorsque le D11-AP a été pré-incubé avec IsoLG/MSA, mais pas avec le MSA non adduit. Dans le contrôle négatif final, le tissu de souris a été coloré avec D11-AP ou un anticorps scFv non pertinent, D20. La coloration de l’aorte de souris avec D11-AP a entraîné une forte coloration par rapport à D20, indiquant la spécificité de D11-AP à IsoLGs dans les aortes hypertendues (Figure 5).
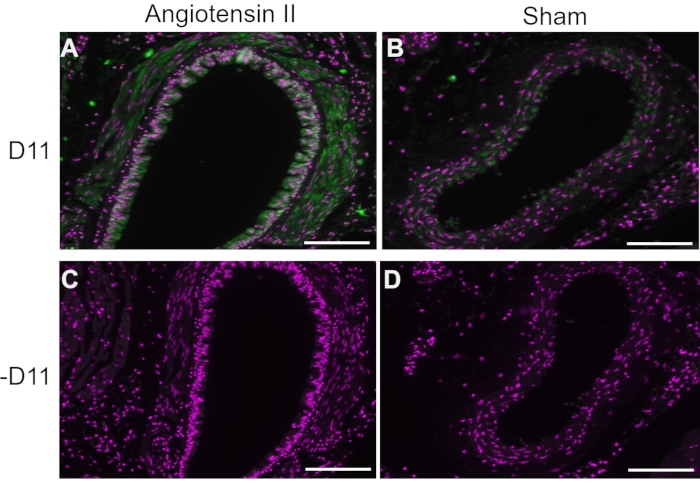
Figure 1 : Immunofluorescence de l’aorte chez les souris hypertendues et normotendues. Les artères de l’angiotensine II et de souris infusées fictives ont été colorées avec et sans D11-AP (D11) pour montrer la présence d’IsoLGs. (A) Artère d’une souris traitée à l’angiotensine II sondée avec D11-AP (vert) et contre-coloration nucléaire (magenta), (B) Artère d’une souris témoin traitée simulée sondée avec D11-AP, (C) Artère d’une souris traitée à l’angiotensine II sans D11-AP, (D) Artère d’une souris témoin traitée simulée sans D11-AP (barre d’échelle = 100 μm). Veuillez cliquer ici pour voir une version agrandie de cette figure.
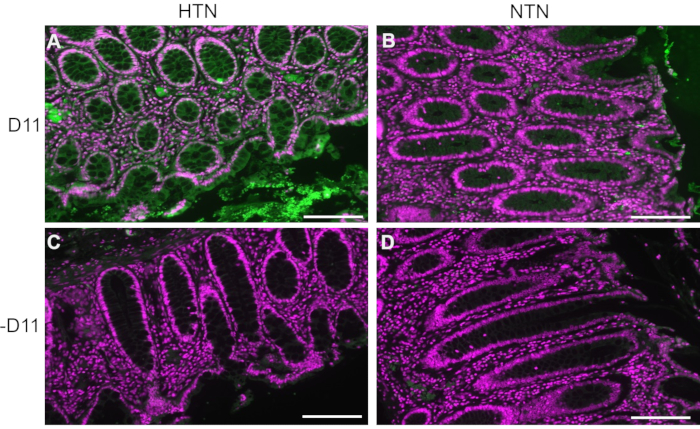
Figure 2 : Immunofluorescence des tissus intestinaux humains de patients hypertendus et normotendus. Les tissus des patients souffrant d’hypertension (HTN) et des humains normotendus (NTN) ont été colorés avec et sans D11-AP (D11) pour montrer la présence d’IsoLGs chez les patients atteints de HTN. (A) tissus HTN colorés avec D11-AP (vert) et contre-colorant nucléaire (magenta), (B) tissus NTN colorés avec D11-AP, (C) tissus HTN colorés sans D11-AP, (D) tissus NTN colorés sans D11-AP (barre d’échelle = 100 μm). Veuillez cliquer ici pour voir une version agrandie de cette figure.
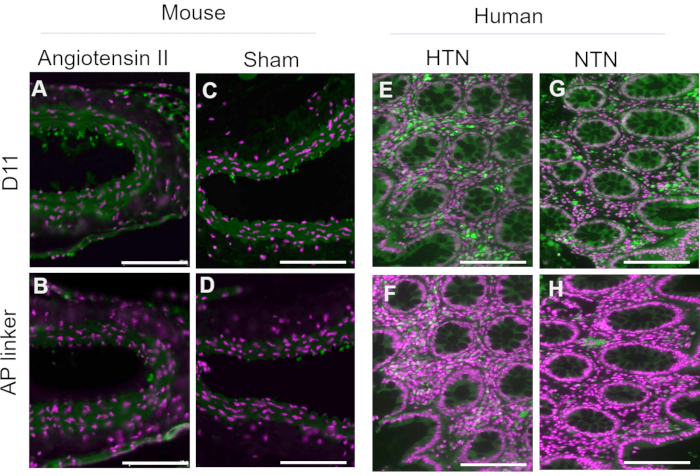
Figure 3 : Tissus de souris et humains colorés à l’extrait périplasmique avec et sans D11-AP. Les tissus de souris et humains ont été colorés avec des extraits périplasmiques avec et sans D11-AP. Les images montrent une coloration limitée des tissus avec un extrait périplasmique sans D11-AP, ce qui montre que la coloration est principalement due à la liaison D11-AP plutôt qu’à un autre composant pouvant être présent dans l’extrait périplasmique. (A) Aorte de souris Ang colorée avec D11-AP (vert) et contre-coloration nucléaire (magenta), (B) Aorte de souris Ang colorée avec un extrait périplasmique, (C) Aorte de souris simulée avec D11-AP, (D) Aorte de souris simulée avec un extrait périplasmique, (E) tissu intestinal humain hypertendu coloré avec D11-AP, (F) tissu intestinal humain hypertendu coloré avec de l’extrait périplasmique, (G) tissu intestinal humain normotendus coloré avec D11-AP, (H) tissu intestinal humain normotendus coloré avec un extrait périplasmique (barre d’échelle = 100 μm). Veuillez cliquer ici pour voir une version agrandie de cette figure.
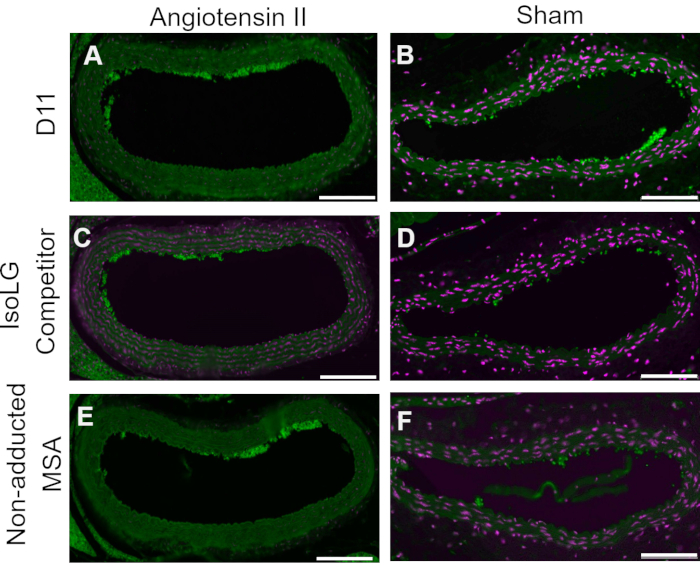
Figure 4: Contrôle concurrentiel dans les navires des souris Ang et Sham. Dans ce contrôle concurrentiel, le D11-AP a été pré-incubé avec du MSA adduit à IsoLG ou du MSA non adduit. Le D11-AP sans pré-incubation a été utilisé comme témoin. Ces résultats montrent la spécificité du D11-AP aux IsoLGs car il y a moins de coloration des tissus avec le concurrent IsoLG-MSA par rapport au D11-AP. Cette réduction est due à IsoLG et non à MSA, car la pré-incubation de MSA non adduite a entraîné une coloration similaire à celle du contrôle D11-AP. L’angiotensine II (A) et l’aorte de souris simulée (B) colorée avec D11-AP (vert) et contre-coloration nucléaire (magenta), l’angiotensine II (C) et l’aorte de souris simulée (D) colorée avec D11-AP après incubation avec IsoLG-MSA, l’angiotensine II (E) et l’aorte de souris simulée (F) colorée avec D11-AP après incubation avec MSA non adduite (barre d’échelle = 100 μm). Veuillez cliquer ici pour voir une version agrandie de cette figure.
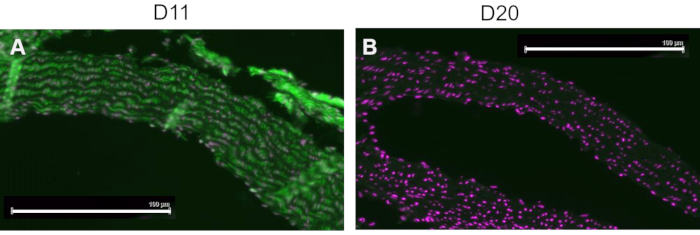
Figure 5 : Aorte de souris colorée avec D11 et scFv, D20 non pertinent. Le tissu de souris a été coloré avec D11-AP et comparé à un anticorps témoin non pertinent, D20, qui est spécifique de la glycoprotéine A2. La coloration des tissus avec D11-AP (vert) et contre-colorant nucléaire (magenta) (A) a entraîné une immunofluorescence intense par rapport à D20 (vert) et contre-coloration nucléaire (magenta) (B), ce qui indique la spécificité de D11-AP à IsoLGs (barre d’échelle = 100 μm). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le D11 a été largement utilisé pour détecter les protéines adduites à IsoLG dans les cellules ou les tissus en tant que marqueur de l’inflammation ou du stress oxydatif dans la maladie 8,9,20. Auparavant, D11 contenait une étiquette E et le développement de l’IHC nécessitait l’utilisation d’un anticorps anti-E secondaire conjugué avec HRP10,20,21. Ici, nous avons développé et optimisé un protocole de détection des protéines adduites à IsoLG en utilisant l’anticorps D11 conjugué à la phosphatase alcaline à la place du E-tag, ce qui élimine le besoin d’une incubation d’anticorps secondaires.
Pour déterminer la spécificité du D11-AP, quatre expériences de contrôle négatif ont été réalisées. Nous avons effectué le protocole sans la présence de D11 et avons eu un développement minimal. Ces résultats ont une double indication : la phosphatase alcaline endogène ne contribue pas au développement, et la coloration observée est due à D11 et non à un autre facteur contributif. Ensuite, nous avons coloré les diapositives avec l’éditeur de liens AP sans D11. Cette expérience a entraîné peu de coloration, ce qui indique que l’AP libre ou d’autres facteurs dans l’extrait périplasmique ne causent pas la tache que nous observons en présence de D11. Pour assurer la spécificité du D11 à IsoLG, nous avons préincubé le D11-AP avec de l’IsoLG purifié avant de colorer les lames. Nous avons constaté une diminution du développement qui indique que le D11-AP était lié à la protéine IsoLG, épuisant ainsi la quantité de D11-AP libre à lier à IsoLG présente dans le tissu. Enfin, pour nous assurer que D11-AP se liait à IsoLG et non à la protéine MSA à laquelle IsoLG était lié, nous avons préincubé le D11-AP avec MSA uniquement. Il n’y a eu aucun changement dans le développement, indiquant que D11-AP n’était pas lié à MSA mais à la protéine IsoLG. Enfin, les chercheurs qui ont développé le protocole de coloration étaient aveugles à l’état hypertendu du tissu intestinal humain. Les différences de coloration observées entre les patients hypertendus et les patients atteints de normotension n’étaient pas dues à un biais et ont été décritesprécédemment 22,23.
Bien que notre protocole de détection des protéines adduites à IsoLG à l’aide de l’anticorps D11 conjugué à la phosphatase alcaline à la place de l’E-tag soit rigoureux et robuste et élimine le besoin d’une incubation d’anticorps secondaires, il présente certaines limites. Une limitation est que nous avons utilisé D11 conjugué avec la phosphatase alcaline dans l’extrait périplasmique, et il pourrait y avoir une fausse coloration de la phosphatase alcaline endogène dans l’extrait périplasmique ou certains tissus, tels que l’intestin24. Cependant, la première étape pour développer ce protocole comprenait la désactivation de la phosphatase alcaline endogène qui peut être présente dans les tissus25. Initialement, l’acide acétique froid, le BME et le lévamisole26 ont été testés pour leur efficacité. Aucun d’entre eux n’a complètement diminué la présence de phosphatase alcaline endogène active. La chaleur a été utilisée pour désactiver la phosphatase alcaline27, nous avons donc testé la désactivation thermique de la phosphatase alcaline dans différents tampons. Nous avons constaté que les lames chauffées montées et hydratées dans le tampon de citrate éliminaient la plupart des phosphatases alcalines endogène. Les lames ont été développées initialement en utilisant un substrat chimiluminescent / fluorescent, mais lorsqu’elles ont été imagées sans ce substrat, il y avait une grande quantité d’autofluorescence. VectorRed est un substrat qui se développe en présence de phosphatase alcaline pour produire un chromogène qui peut être visualisé dans la gamme de canaux Texas Red/TRITC. En utilisant ce substrat, nous avons pu observer plus facilement le signal au-dessus de l’autofluorescence de fond. Des précautions doivent être prises pendant le processus de coloration pour minimiser la coloration artificielle. Séchage des tissus sur lames après l’hydratation jusqu’à ce que l’imagerie ait entraîné un développement accru. Le D11-AP doit être aliquote et conservé à -20 °C. Les cycles multiples de gel-dégel doivent être évités lorsque vous travaillez avec D11-AP. La solution saline tamponnée au phosphate (PBS) peut également affecter l’activité enzymatique de la phosphatase alcaline et ne doit pas être utilisée comme tampon de lavage28. Comme pour toute approche basée sur les anticorps, des tests et une optimisation approfondis doivent être effectués pour s’assurer que la coloration est spécifique et que le signal n’est pas trop ou sous-amplifié.
En conclusion, nous avons développé un protocole optimisé puissant, rigoureux et robuste pour détecter les protéines adduites par IsoLG en utilisant l’anticorps D11 conjugué à la phosphatase alcaline à la place de l’E-tag. Ce protocole présente plusieurs avantages : premièrement, l’utilisation de D11 comme protéine de fusion de phosphatase alcaline est moins chère. D11 était à l’origine dérivé d’une bibliothèque d’anticorps de phages qui ne pouvait pas être commercialisée et était coûteuse à purifier. Bien que D11 dans l’extrait périplasmique d’E. coli puisse fournir une alternative peu coûteuse, il était inefficace dans la plupart des essais. Deuxièmement, l’approche de fusion de la phosphatase alcaline permet au D11 scfv d’avoir un rapporteurutile 15 (phosphatase alcaline) fusionné et n’aurait pas besoin d’être purifié pour être utilisé dans des immunoessais car les substrats sont disponibles dans le commerce. Troisièmement, la phosphatase alcaline E. coli forme des dimères29. Ainsi, D11, lorsqu’il est fusionné à la phosphatase alcaline, formerait également des dimères, ce qui augmenterait l’avidité et l’activité de liaison de l’anticorps30. Enfin, le D11 conjugué à la phosphatase alcaline dans un extrait périplasmique peut facilement être nettoyé à l’aide de Séphararose bleu de Cibacron. D11 a un point isoélectrique élevé (~9,2 pH). En tant que tel, il est chargé positivement et peut se lier au bleu de cibacron par des interactions pi-cation. La plupart des impuretés contenues dans l’extrait périplasmique d’E. coli peuvent être éluées de la résine. Le D11 conjugué à la phosphatase alcaline peut ensuite être élué à l’aide de sel élevé (~1,5M NaCl) dans l’eau. Le D11 élué conjugué à la phosphatase alcaline est assez stable à 4-8 °C dans la solution à haute teneur en sel. Ainsi, nous avons développé un protocole qui non seulement rend l’anticorps D11 disponible à faible coût, mais élimine également les étapes supplémentaires et la nécessité de l’incubation de l’anticorps secondaire. Ce protocole facilite la mesure reproductible des IsoLG, qui s’accumulent dans les tissus de multiples maladies où l’augmentation du stress oxydatif joue un rôle.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par les subventions K01HL130497, R01HL147818, R01HL144941 et R03HL155041 des National Institutes of Health à A.K. Nous remercions la ressource partagée en cardiologie numérique - Vanderbilt Health Nashville, TN https://www.vumc.org/dhsr/46298 pour la visualisation et la numérisation des diapositives.
matériels
| Name | Company | Catalog Number | Comments |
| 1 ml TALON HiTrap column (Cobalt-CMA) | Cytiva | 28953766 | |
| 200 Proof Ethanol | Pharmco | 111000200 | |
| 2xYT powder | MP Biomedicals | 3012-032 | |
| 384-well, clear, flat-bottom polystyrene microplates | ThermoFisher (NUNC) | 242757 | |
| 4-Nitrophenyl phosphate disodium salt hexahydrate (pNPP) | Carbosynth | EN08508 | |
| 5-Bromo-4-chloro-3indoxyl phosphate, p-toluidine salt (BCIP) | Carbosynth | EB09335 | |
| Ampicillin, sodium salt | Research Products International (RPI) | A40040 | |
| Bovine Serum Albumin | RPI | A30075 | |
| Chemically competent TG1 E. coli | Amid Biosciences | TG1-201 | |
| Diethanolamine, >98% | Sigma-Aldrich | D8885 | |
| EDTA | Sigma-Aldrich | ED | |
| Fluoromount-G | SouthernBiotech | 0100-01 | Mouting medium |
| Glucose | Research Products International (RPI) | G32045 | |
| Glycerol | Sigma-Aldrich | G7893 | |
| Histoclear | National Diagnostics | HS-200 | Xylene alternative |
| Hoechst 33342 | ThermoFisher | H3570 | stock solution = 10 mg/mL |
| Hydrochloric acid (HCl), 30%, Macron Fine Chemicals | ThermoFisher | MK-2624-212 | |
| Imidazole | Research Products International (RPI) | I52000 | |
| MgCl2 (anhydrous) | Sigma-Aldrich | M8266 | |
| Mouse Serum Albumin (MSA) | Sigma-Aldrich/Calbiochem | 126674 | |
| Nitroblue tetrazolium chloride (NBT) | Carbosynth | EN13587 | |
| Potassium chloride (KCl) | Sigma-Aldrich | P4504 | |
| Potassium phosphate, monobasic (KH2PO4) | Sigma-Aldrich | P0662 | |
| Pressure Cooker | Cuisinart | CPC-600 | |
| Slide-a-Lyzer Dialysis cassettes, 10K MWCO, 3 ml | ThermoFisher | 66380 | |
| Sodium chloride (NaCl) | Research Products International (RPI) | S23020 | |
| Sodium Citrate | Sigma-Aldrich | 1064461000 | |
| Sodium phosphate, dibasic (Na2HPO4) | Research Products International (RPI) | S23100 | |
| Sucrose | Research Products International (RPI) | S24065 | |
| Tris base | Research Products International (RPI) | T60040 | |
| Tris-buffered Saline | Boston Bio-Products | 25mM Tris, 2.7mM KCl, 137 mM NaCl, pH 7.4 | |
| Tris-HCl | Research Products International (RPI) | T60050 | |
| Tween20 | Sigma-Aldrich | P9416 | |
| Vector Red | Vector Labs | SK-5105 |
Références
- Brame, C. J., Salomon, R. G., Morrow, J. D., Roberts, L. J. Identification of extremely reactive gamma-ketoaldehydes (isolevuglandins) as products of the isoprostane pathway and characterization of their lysyl protein adducts. Journal of Biological Chemistry. 274, 13139-13146 (1999).
- Brame, C. J., et al. Modification of proteins by isoketal-containing oxidized phospholipids. Journal of Biological Chemistry. 279, 13447-13451 (2004).
- May-Zhang, L. S., et al. Scavenging reactive lipids to prevent oxidative injury. Annual Review of Pharmacology and Toxicology. 61, 291-308 (2021).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2019 update: A report from the American Heart Association. Circulation. 139, 56(2019).
- Collins, D. R., et al. Global cardiovascular risk assessment in the primary prevention of cardiovascular disease in adults: Systematic review of systematic reviews. BMJ Open. 7, 013650(2017).
- Whelton, P. K., et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the prevention, detection, evaluation, and management of high blood pressure in adults: Executive summary: A report of the American College of Cardiology/American Heart Association Task Force on clinical practice guidelines. Circulation. 138, 426-483 (2018).
- Patrick, D. M., Van Beusecum, J. P., Kirabo, A. The role of inflammation in hypertension: Novel concepts. Current Opinion in Physiology. 19, 92-98 (2021).
- Davies, S. S., et al. Isolevuglandins as mediators of disease and the development of dicarbonyl scavengers as pharmaceutical interventions. Pharmacology and Therapeutics. 205, 107418(2020).
- Dixon, K. B., Davies, S. S., Kirabo, A. Dendritic cells and isolevuglandins in immunity, inflammation, and hypertension. American Journal of Physiology-Heart and Circulation Physiology. 312, 368-374 (2017).
- Kirabo, A., et al. DC isoketal-modified proteins activate T cells and promote hypertension. Journal of Clinical Investigation. 124, 4642-4656 (2014).
- Yan, H. P., et al. Isolevuglandins as a gauge of lipid peroxidation in human tumors. Free Radical Biology and Medicine. 106, 62-68 (2017).
- Davies, S. S., et al. Localization of isoketal adducts in vivo using a single-chain antibody. Free Radical Biology and Medicine. 36, 1163-1174 (2004).
- Shen, Z., et al. Single-chain fragment variable antibody piezoimmunosensors. Analytical Chemistry. 77, 797-805 (2005).
- Hennig, E. E., Mernaugh, R., Edl, J., Cao, P., Cover, T. L. Heterogeneity among Helicobacter pylori strains in expression of the outer membrane protein BabA. Infections and Immunity. 72, 3429-3435 (2004).
- Martin, C. D., et al. A simple vector system to improve performance and utilisation of recombinant antibodies. BMC Biotechnology. 6, 46(2006).
- Han, Z., Karatan, E., Scholle, M. D., McCafferty, J., Kay, B. K. Accelerated screening of phage-display output with alkaline phosphatase fusions. Combinatorial Chemistry and High Throughput Screening. 7, 55-62 (2004).
- Miller, J. Handbook for a short course in bacterial genetics. , Cold Spring Harbor Laboratory. New York. (1992).
- Nair, R., et al. Yeast extract mediated autoinduction of lacUV5 promoter: An insight. New Biotechnology. 26 (6), 282-288 (2009).
- Davies, S. S., Amarnath, V., Roberts, L. J. Isoketals: Highly reactive γ-ketoaldehydes formed from the H2-isoprostane pathway. Chemistry and Physics of Lipids. 128 (1-2), 85-99 (2004).
- Ngwenyama, N., et al. Isolevuglandin-modified cardiac proteins drive CD4+ T-Cell activation in the heart and promote cardiac dysfunction. Circulation. 143 (12), 1242-1255 (2021).
- Prinsen, J. K., et al. Highly reactive Isolevuglandins promote atrial fibrillation caused by hypertension. Basic to Translational Science JACC. 5 (6), 602-615 (2020).
- Ferguson, J. F., et al. High dietary salt-induced dendritic cell activation underlies microbial dysbiosis-associated hypertension. JCI Insight. 5 (13), 126241(2019).
- Madhur, M. S., et al. Hypertension: Do inflammation and immunity hold the key to solving this epidemic. Circulation Research. 128 (7), 908-933 (2021).
- Estaki, M., DeCoffe, D., Gibson, D. L. Interplay between intestinal alkaline phosphatase, diet, gut microbes and immunity. World Journal of Gastroenterology. 20 (42), 15650-15656 (2014).
- Millán, J. L. Mammalian alkaline phosphatases: From biology to applications in medicine and biotechnology. , John Wiley and Sons. (2006).
- Ponder, B. A., Wilkinson, M. M. Inhibition of endogenous tissue alkaline phosphatase with the use of alkaline phosphatase conjugates in immunohistochemistry. Journal of Histochemistry and Cytochemistry. 29 (8), 981-984 (1981).
- Goldstein, D. J., Rogers, C. E., Harris, H. Expression of alkaline phosphatase loci in mammalian tissues. Proceedings of the National Academy of Science U. S. A. 77 (5), 2857-2860 (1980).
- Ramos-Vara, J. A. Technical aspects of immunohistochemistry. Veterinary Pathology. 42 (4), 405-426 (2005).
- Coleman, J. E. Structure and mechanism of alkaline phosphatase. Annual Review of Biophysics and Biomolecular Structure. 21, 441-483 (1992).
- Harper, J. E., Toth, R. L., Mayo, M. A., Torrance, L. Properties of a panel of single chain variable fragments against Potato leafroll virus obtained from two phage display libraries. Journal of Virological Methods. 81 (1-2), 159-168 (1999).
Erratum
Formal Correction: Erratum: Direct Detection of Isolevuglandins in Tissues using a D11 scFv-Alkaline Phosphatase Fusion Protein and Immunofluorescence
Posted by JoVE Editors on 4/11/2023. Citeable Link.
An erratum was issued for: Direct Detection of Isolevuglandins in Tissues using a D11 scFv-Alkaline Phosphatase Fusion Protein and Immunofluorescence. The Authors section was updated from:
Cassandra Warden1
Alan J. Simmons2
Lejla Pasic3
Sean S. Davies4
Justin H. Layer5
Raymond L. Mernaugh3
Annet Kirabo4,6
1Vanderbilt Eye Institute, Vanderbilt University Medical Center
2Department of Cell and Developmental Biology, Vanderbilt University
3Department of Biochemistry, Vanderbilt University
4Division of Clinical Pharmacology, Department of Medicine, Vanderbilt University Medical Center
5Division of Hematology and Oncology, Indiana University School of Medicine
6Department of Molecular Physiology and Biophysics, Vanderbilt University
to:
Cassandra Warden1
Alan J. Simmons2
Lejla Pasic3
Ashley Pitzer4,6
Sean S. Davies4
Justin H. Layer5
Raymond L. Mernaugh3
Annet Kirabo4,6
1Vanderbilt Eye Institute, Vanderbilt University Medical Center
2Department of Cell and Developmental Biology, Vanderbilt University
3Department of Biochemistry, Vanderbilt University
4Division of Clinical Pharmacology, Department of Medicine, Vanderbilt University Medical Center
5Division of Hematology and Oncology, Indiana University School of Medicine
6Department of Molecular Physiology and Biophysics, Vanderbilt University
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon