Method Article
Прямое обнаружение изолевугландинов в тканях с использованием слитого белка D11 scFv-щелочной фосфатазы и иммунофлуоресценции
* Эти авторы внесли равный вклад
В этой статье
Erratum Notice
Резюме
В данной статье представлена подробная методика измерения изолевугландинов в тканях методом иммунофлюоресценции с использованием щелочного фосфатаз-конъюгированного антитела ScFv D11. Модели гипертонии как у мышей, так и у людей используются для объяснения пошаговых процедур и фундаментальных принципов, связанных с измерением изолевугландина в образцах тканей.
Аннотация
Изолевугландины (IsoLG) представляют собой высокореакционноспособные гамма-кетоальдегиды, образующиеся из H2-изопростанов в результате перекисного окисления липидов и сшитых белков, что приводит к воспалению и различным заболеваниям, включая гипертонию. Обнаружение накопления IsoLG в тканях имеет решающее значение для того, чтобы пролить свет на их участие в процессах заболевания. Однако измерение изоЛГ в тканях чрезвычайно сложно, а доступные в настоящее время инструменты, включая масс-спектрометрический анализ, трудоемки и чрезвычайно дороги. Здесь мы описываем новый метод обнаружения in situ изоЛГ в тканях с использованием щелочной фосфатазы-конъюгированной D11 ScFv и рекомбинантного фагового антитела, продуцируемого в E. coli с помощью иммунофлуоресцентной микроскопии. Для валидации окрашивания использовали четыре контроля: (1) окрашивание с D11 и без него, (2) окрашивание бактериальным периплазматическим экстрактом линкером щелочной фосфатазы, (3) нерелевантное окрашивание антителами scFV и (4) конкурентный контроль с IsoLG перед окрашиванием. Мы демонстрируем эффективность щелочной фосфатазы-конъюгированной D11 как в тканях человека, так и в тканях мыши с артериальной гипертензией или без нее. Этот метод, вероятно, послужит важным инструментом для изучения роли IsoLG в широком спектре болезненных процессов.
Введение
Изолевугландины (IsoLGs), также известные как изокетали, представляют собой изомеры семейства 4-кетоальдегидов, которые являются продуктами перекисного окисления липидов и реагируют с первичными аминами на белках 1,2 и аддуктируют их. ИзоЛГ были вовлечены в несколько заболеваний, включая сердечно-сосудистые, болезни Альцгеймера, заболевания легких и печени, а также многие виды рака3. ИзоЛГ были наиболее широко изучены с точки зрения их вклада в сердечно-сосудистые заболевания (ССЗ), которые являются значительным бременем для здоровья и экономики во всем мире, включая Соединенные Штаты. По оценкам, 92,1 миллиона взрослых в США имеют по крайней мере один тип сердечно-сосудистых заболеваний, при этом оценочные прогнозы на 2030 год охватывают 43,9% взрослого населения США4. Снижение артериального давления, холестерина и отказ от курения снижают общий риск и возникновение сердечно-сосудистых заболеваний5.
Высокое кровяное давление или гипертония является основным фактором риска сердечно-сосудистых заболеваний и затрагивает примерно половину населения США6. Предыдущие исследования показали, что воспаление является основной причиной гипертонии и что IsoLG играют роль7. Гипертензивные стимулы, включая ангиотензин II, катехоламины, альдостерон и избыток пищевой соли, индуцируют накопление IsoLG в антигенпрезентирующих клетках, включая дендритные клетки (ДК), которые, в свою очередь, активируют Т-клетки для пролиферации и продуцирования воспалительных цитокинов, способствующих гипертонии 8,9.
Ранее IsoLG измеряли с помощью иммуногистохимии, масс-спектрометрии, иммуноферментного анализа и проточной цитометрии10,11. Чтобы облегчить измерение IsoLGs, было разработано рекомбинантное антитело (D11) с одноцепочечной переменной фрагментом (scfv) против IsoLGs12. Первоначально это антитело D11 содержало E-метку из 11 аминокислот и требовало вторичного антитела для иммуногистохимического обнаружения11. Однако найти надежное вторичное антитело против Е-метки после прекращения ее производства производителем было сложно. Поэтому мы разработали надежный протокол иммунофлуоресцентного окрашивания IsoLG с использованием D11, конъюгированного со щелочной фосфатазой (D11-AP), который мы продемонстрировали на тканях мышей и человека с гипертонией и без нее.
протокол
Институциональный комитет по уходу за животными и их использованию Университета Вандербильта одобрил все процедуры, описанные в этой рукописи. Мыши содержатся и обслуживаются в соответствии с Руководством по уходу и использованию лабораторных животных. Все испытуемые дали письменное информированное согласие перед зачислением в исследование, одобренное Институциональным наблюдательным советом Университета Вандербильта. Все процедуры были выполнены в соответствии с Хельсинкской декларацией.
1. Получение плазмид, кодирующих слитый белок D11-щелочной фосфатазы и отрицательные контрольные векторы
- Построить модифицированную версию плазмиды pCANTAB5E13,14, в которой сегмент переменной одноцепочечного фрагмента (scFv) связан на своем 3'-конце с последовательностью, кодирующей бактериальную щелочную фосфатазу (AP).
ПРИМЕЧАНИЕ: Непосредственно после сайта рестрикции NotI последовательности scFv модифицированная плазмида больше не содержит кодирующую последовательность E-метки, а вместо этого кодирует последовательность линкера GGSGGHMGSGG, за которой следует последовательность для AP (регистрационный номер GenBank AXY87039.1, T16-K464)15,16. Ниже по течению от AP плазмида будет кодировать теги 8xHis и DYKDDDDK. На 3'-конце тегов кодирующая последовательность заканчивается стоп-кодоном Amber. Модифицированная плазмида называется pCANTAB5-AP. - Клонируйте D11 scFv (регистрационный номер GenBank AAW28931.1) в pCANTAB5-AP с сайтами ограничений SfiI/NotI.
- Клонируйте D20 scFv в pCANTAB5-AP с сайтами ограничения SfiI/NotI.
ПРИМЕЧАНИЕ: D20 scFv представляет собой отрицательный контроль, предназначенный для оценки картины тканевого взаимодействия нерелевантного scFv. Этот scFv был первоначально выбран фаговым дисплеем из-за его способности взаимодействовать с гликановой группой, известной как A2. - Сгенерируйте «пустой» вектор, полностью удалив часть scFv из плазмиды и заменив ее кодирующей последовательностью «AP-линкер», состоящей из аминокислот GGGGSGRAGSGGGGS.
- Превратите все плазмиды в компетентную TG1 E. coli и вырастите бактерии в течение ночи при 30 ° C на 0,5% агаровых планшетах, содержащих 2xYT с добавлением 100 мкг / мл ампициллина и 2% среды глюкозы (2xYTAG).
ПРИМЕЧАНИЕ: Штаммы с геном supE (такие как TG1 E. coli) не подавляют янтарный стоп-кодон на 100%. Оценки варьируются от 0,8 до 20% времени, поэтому все еще существует много продукта, который заканчивается сразу после БАП, поскольку он предназначен для этих экспериментов17. TG1 E. coli в основном используются по практическим причинам, таким как сокращение времени и затрат, их совместимость с системой экспрессии белка pCANTAB и их использование в фаговом дисплее, который обычно проводится в лаборатории. Ниже по течению от янтарного стоп-кодона, следующего за BAP, находится последовательность для geneIII. Белки слияния GeneIII должны экспрессироваться редко, чтобы фаговый дисплей функционировал должным образом, потому что слитые белки scFv-geneIII мешают этому конкретному белку гена III повторно инфицировать наивные бактерии. Следовательно, свободные от слияния белки гена III должны существовать во время сборки вириона для генерации функционирующего фага, т. е. белковые продукты scFv-geneIII обычно относительно редко встречаются внутри бактерии. D11-AP, D20-AP, пустой вектор и все конструкции, используемые в этой статье, одинаково подвержены влиянию случайной экспрессии белка слияния geneIII. До сих пор наблюдаются различия в поведении этих белков. - Выберите отдельную колонию и привите свежие 5 мл культуры 2xYTAG. Дайте бактериям расти в течение ночи при 30 ° C и встряхивайте при 150 об/мин.
- Гранулируют ячейки центрифугированием при 3 000 x g в течение 10 мин при комнатной температуре. Выбросьте надосадочную жидкость и ресуспендируйте гранулу в 2 мл 85% 2xYTAG и 15% глицерина.
- Храните запасы глицерина в морозильной камере при температуре -80 °C.
2. Экспрессия белка и генерация периплазматического экстракта
ПРИМЕЧАНИЕ: Генерация периплазматического экстракта является широко используемым методом экспрессии белка в фаговом дисплее, главным образом потому, что образование дисульфидных связей важно для scFv и генерации антител. Метод позволяет избежать необходимости генерировать лизаты (обычно содержащие тельца включения) и обеспечивает правильное сворачивание белков. pCANTAB имеет сигнальную последовательность gIII выше по течению от части scFv слитого белка D11-BAP. Сигнальная последовательность гарантирует, что белок перемещается в периплазматическое пространство бактерии, а затем сигнальная последовательность расщепляется. Периплазматическое пространство обеспечивает окислительную среду, которая имеет решающее значение для правильного образования дисульфидных мостиков. Осмотический шок используется для получения периплазматических экстрактов, потому что он разрушает внешнюю мембрану настолько, чтобы высвобождать периплазматические белки в окружающую среду, сохраняя при этом бактерию нетронутой.
- Инокулируют запасы глицерина TG1 E. coli , содержащие соответствующие плазмиды, в культуру объемом 60 мл 2xYTAG и культивируют в течение ночи при 30 ° C с встряхиванием при 150 об/мин.
- Чтобы индуцировать экспрессию белка, гранулируют бактериальные культуры в дозе 3000 x g в течение 10 мин, ресуспендируют в 60 мл среды 2xYTA и культивируют в течение ночи при 30 ° C с встряхиванием при 150 об/мин.
ПРИМЕЧАНИЕ: Переход от среды 2xTYAG к среде 2xYTA помогает в достаточной индукции экспрессии белка18. Когда глюкоза присутствует в бактериальной среде, промотор lac подавляется, потому что бактерии преимущественно потребляют глюкозу и игнорируют лактозу, поскольку глюкоза требует меньше энергии для обработки. Когда глюкоза удаляется после переключения среды, бактерии полагаются на углеводы, обеспечиваемые средой 2xYT. Дрожжевой экстракт (Y-компонент в 2xYT) содержит углеводы, в том числе лактозу, и, следовательно, способен стимулировать экспрессию белка через промотор lac. IPTG не является необходимым с конструкцией pCANTAB и может привести к чрезмерной экспрессии белка наряду с тельцами включения, которые приводят к нефункциональному белку. - Генерируйте периплазматические экстракты с помощью осмотического шока.
- Гранулированные бактериальные культуры по 3 000 x г в течение 10 мин.
- Ресуспендировать в 20 мл 1xTES (0,2 М Tris-HCl pH 8,0, 0,5 мМ ЭДТА, 0,5 М сахарозы) и инкубировать в течение 1 ч на льду.
- Гранулы снова в дозе 3000 x г в течение 10 мин и ресуспендирование в 15 мл 0,05 М Tris, pH 7,6.
- Инкубируют эту суспензию на льду в течение 1 ч, затем осветляют центрифугированием при 5000 х г в течение 10 мин.
- Перенесите надосадочные жидкости в свежую пробирку и храните при температуре -20 °C до тех пор, пока они не понадобятся для очистки или непосредственного использования в экспериментах.
- Оценивают лизис клеток по присутствию активного D11-БАТ в ИФА. Добавьте 3-5 мкл периплазматического экстракта к одному мл pNPP, затем наблюдайте, произойдет ли изменение цвета в течение следующих 10 минут (цвет меняется от ярко-желтого до интенсивного желтого).
ПРИМЕЧАНИЕ: Цвет можно сравнить бок о бок с пробиркой из pNPP, которая не получила лизата, или с пробиркой pNPP, которая получила лизат наивных бактерий TG1. Количественное определение с коэффициентом поглощения при длине волны 405 нм.
4. Характеристика титра D11-AP в ИФА
- Покройте 384-луночную полистирольную пластину на ночь при температуре 4 °C 25 мкл / лунка фосфатно-буферного физиологического раствора (PBS) (1,8 мМ KH 2 PO 4, 10 мМ Na 2 HPO4,2,7мМ KCl, 137 мМ NaCl), содержащей либо 5 мкг / мл сывороточного альбумина мыши (MSA) (отрицательный контроль), либо 5 мкг / мл IsoLG / MSA (положительный контроль).
- Опорожните тарелку и высушите. Постирайте один раз с PBS + 0,1% Tween (PBS-T). Опорожните тарелку и высушите.
- Заполните пластину PBS-T в качестве блокирующего буфера (120 мкл / лунка). Инкубировать в течение 1 ч при комнатной температуре.
- Опорожните тарелку и высушите. Применяют серийные разведения периплазматических экстрактов D11-AP в соотношении 1:2 при 25 мкл / лунку и разбавляют PBS-T. Включите одну скважину, содержащую только PBS-T, в качестве отрицательного контроля.
ПРИМЕЧАНИЕ: Типичные диапазоны разведения периплазматических экстрактов составляют 1:8 - 1:4096. Для объема анализа 25 мкл начните с 50 мкл начальной концентрации «1:8»: 6,25 мкл периплазматического экстракта и 43,75 мкл PBS-T. Затем выполните 2-кратное разведение, удалив 25 мкл этого раствора и добавив его в следующую лунку, содержащую 25 мкл PBS-T, и пипеткой вверх и вниз. Этот колодец теперь содержит разбавление «1:16». Продолжайте повторять 2-кратное разбавление, чтобы получить описанную серию разбавления 1:2. - Инкубировать 1,5 ч при комнатной температуре.
- Опорожните тарелку и высушите. Постирайте 5 раз с помощью PBS-T. Опорожните и высушите.
- Приготовьте раствор pNPP, растворив 1 г pNPP в 1 л диэтаноламина 930 мМ (98% исходный раствор, разбавленный 1:10 в H 2 O)0,5 мМ MgCl2 и доведенный до pH 9,5 с HCl.
- Нанесите 25 мкл на лунку раствор pNPP для разработки AP. Инкубируйте в течение 1 ч при комнатной температуре и определите поглощение при 405 нм в каждой лунке с помощью совместимого планшетного считывателя.
- Сравните сигнал, генерируемый скважинами IsoLG/MSA, с шумом, генерируемым скважинами MSA, и найдите диапазон разведений, в котором сигнал как минимум в 5 раз превышает шум.
- Нанесите этот ряд разбавления сигнала D11-AP на график, определите линейный диапазон кривой и установите разбавление, при котором можно наблюдать 50% сигнала.
ПРИМЕЧАНИЕ: Если это разбавление эквивалентно приблизительно 1:1000, то раствор D11-AP можно использовать в концентрации 1:10 в IHC/IF.
5. Иммунофлюоресценция
- Нарежьте серийные срезы тканей, залитых парафином мыши и человека (толщиной 5 мкм), с помощью микротома и поместите на баню с теплой водой (37 °C). Установите срезы ткани на предметные стекла и дайте высохнуть в течение ночи.
ПРИМЕЧАНИЕ: Для этого исследования аорты были получены от мышей. Срезы толстой кишки нормотензивных и гипертонических людей были получены из Кооперативной сети тканей человека Вандербильта. - Трижды погрузите предметные стекла в ксилол на 5 минут, чтобы депарафинизировать ткани.
- Регидратируют ткани в 2 стирки в каждой 95%, 70% и 50% этанола вH2O.
- Промойте предметные стекла в трис-буферном физиологическом растворе (TBS) с 0,1% Tween20 (TBST) три раза с быстрой промывкой, заполнив держатель предметного стекла TBST, а затем выбросив TBST.
ПРИМЕЧАНИЕ: Гидратированные предметные стекла можно хранить в TBST при 4 ° C не более недели до извлечения антигена. - Чтобы выполнить термоиндуцированное извлечение антигена из предметных стекол, поместите предметные стекла в предварительно нагретый (80-95 °C) буфер цитрата натрия (10 мМ цитрат натрия, 0,05% Tween 20, pH 6,0) и инкубируйте в скороварке, установленной на 4 минуты при высоком давлении, чтобы общее время извлечения антигена составило 20 минут.
- Снимите горки со скороварки и дайте им остыть в течение 20 минут до комнатной температуры.
- Вымойте предметные стекла в TBST три раза с помощью быстрой стирки.
ПРИМЕЧАНИЕ: Предметные стекла можно хранить в TBST после извлечения антигена не более недели до окрашивания. - Добавьте 2% BSA, растворенного в TBST, чтобы заблокировать слайды. Накройте предметные стекла полоской парафиновой пленки и выдерживайте при комнатной температуре в течение 15 мин.
- Удалите блокирующий буфер со слайдов.
- Добавьте 200 мкл 1:10 D11-AP в TBST на предметные стекла и накройте полоской парафиновой пленки.
- Инкубируют в увлажненной камере, чтобы свести к минимуму испарение раствора антител в течение 3 ч при комнатной температуре.
- Вымойте предметные стекла три раза в TBST.
- Разрабатывают с помощью колориметрического или флуоресцентного проявителя щелочной фосфатазы для иммуногистохимии или иммунофлуоресценции соответственно. Промойте предметные стекла один раз с помощью TBST, чтобы удалить излишки проявителя и предотвратить дальнейшее развитие цвета.
- Противопятно скользит с ядерным окрашиванием Хёхста в дозе 1 мкг/мл в PBS для иммунофлуоресценции. Вымойте слайды один раз в TBST, чтобы удалить лишнее пятно.
- Нанесите покровные стекла, используя монтажную среду.
- Просмотр предметных стекол под микроскопом с инвертированным светом для иммуногистохимии или конфокальным флуоресцентным микроскопом для иммунофлуоресценции.
6. Негативный контроль
ПРИМЕЧАНИЕ: Четыре отрицательных контрольных эксперимента могут быть проведены для подтверждения специфичности окрашивания D11-AP для IsoLG. Отрицательные контрольные эксперименты должны проводиться в одном и том же наборе окрашивания в тех же условиях.
- В первом отрицательном контрольном эксперименте инкубировали ткани с D11-AP, разбавленным только в TBST или TBST.
- Инкубируют ткани с разбавленным D11-AP в TBST и бактериальным периплазматическим экстрактом без D11-AP (AP Linker), разбавленным в TBST.
- Проведите конкурентный анализ с IsoLG / MSA или неаддуктивным MSA, как описаноранее 12.
- Приготовьте IsoLG и IsoLG, аддуцированные к сывороточному альбумину мыши (MSA), как описаноранее 19, при молярном соотношении 8 IsoLG: 1 MSA (8: 1 IsoLG / MSA).
- Разбавьте D11-AP 1:10 в TBST.
- Инкубировать разбавленный D11-AP с 50 мкг/мл IsoLG/MSA или неаддуктивным MSA в течение 1 ч при комнатной температуре.
- Добавьте D11-AP с IsoLG / MSA или D11-AP с неаддуктивным MSA в ткани для окрашивания.
- Используйте нерелевантные антитела scFv, D20, для окрашивания тканей для окончательного отрицательного контрольного набора.
Результаты
В репрезентативных экспериментах D11 scfv с конъюгацией щелочной фосфатазы (D11-AP) использовался в иммунофлуоресценции для обнаружения изоЛГ, присутствующих у мышей, получавших ангиотензин II, по сравнению с нормальными фиктивными мышами и людьми с гипертонией по сравнению с нормотензивными людьми. Мышей лечили ангиотензином II в дозе 490 нг/кг/мин в течение двух недель, и артериальная гипертензия была подтверждена повышением систолического артериального давления по сравнению с фиктивными мышами10. Для обеспечения специфичности D11-AP ткани окрашивали с присутствием D11-AP или без него. Как показано при окрашивании D11-AP, аорта мышей с ангиотензин-индуцированной гипертензией II показала повышенную концентрацию IsoLGs по сравнению с контрольными мышами (рис. 1). Фоновое окрашивание или автофлуоресценция были ограничены, о чем свидетельствуют отрицательные контрольные элементы, которые не были окрашены D11-AP.
D11-AP использовали для обнаружения изоЛГ, присутствующих в тканях кишечника пациентов с артериальной гипертензией (АГ) или нормотензивных людей (НТН). Статус гипертонии был установлен из больничных записей как систолическое артериальное давление выше 140 и диастолическое артериальное давление выше 80 мм рт.ст. Исследователи, разрабатывающие протокол иммунофлуоресценции для D11-AP, были слепы к состоянию гипертонии тканей человека. Срезы окрашивали в присутствии и отсутствии D11-AP, чтобы обеспечить специфичность антител и показать фоновое окрашивание или автофлуоресценцию. Как показано на рисунке 2, мы обнаружили, что ткани пациентов с АГ имели повышенные концентрации изоЛГ по сравнению с пациентами с НТН. Окрашивание без D11-AP также показало минимальное фоновое окрашивание и автофлуоресценцию. Эндогенная щелочная фосфатаза экспрессируется кишечным эпителием, поэтому ограниченная флуоресценция тканей, окрашенных без D11-AP, показывает, что извлечение антигена, используемое в этом протоколе, было достаточным для инактивации эндогенной щелочной фосфатазы, присутствующей в тканях. В сочетании с результатами на мышах эти результаты также показывают, что протокол иммунофлуоресценции эффективно показывает повышенные изоЛГ при гипертонии по сравнению с нормотензивным статусом.
D11-AP был выделен и сохранен в бактериальном периплазматическом экстракте. Ткани мышей и человека окрашивали D11-AP и периплазматическим экстрактом, содержащим линкер AP без D11, чтобы гарантировать, что другие факторы, которые могут присутствовать в периплазматическом экстракте, такие как избыток или неконъюгированная щелочная фосфатаза, не способствуют окрашиванию, наблюдаемому в тканях, обработанных D11-AP (рис. 3). Ткани, окрашенные D11-AP, приводили к более яркому окрашиванию по сравнению с тканями, окрашенными периплазматическим экстрактом. Эти результаты подтверждают, что D11-AP окрашивает ткани, и окрашивание не связано с неконъюгированной бактериальной щелочной фосфатазой, которая потенциально может присутствовать в периплазматическом экстракте и приводить к ложному окрашиванию IsoLG или способствовать фоновому окрашиванию.
Конкурентный контроль проводили путем предварительной инкубации D11-AP с IsoLG, аддуцированным к MSA, или неаддуктивным MSA перед окрашиванием тканей, чтобы показать специфичность D11-AP к IsoLG. Если D11-AP специфичен для IsoLG, антитело будет связываться с IsoLG-MSA, что приведет к истощению доступности D11-AP для окрашивания тканей, а D11-AP, инкубированный с неаддуктивным MSA, будет иметь окрашивание, аналогичное нормальному D11-AP. В тканях, окрашенных D11-AP, предварительно инкубированных с конкурентом IsoLG, мы обнаружили уменьшенное окрашивание по сравнению с тканями, окрашенными D11-AP без какой-либо предварительной инкубации (рис. 4). В тканях, окрашенных D11-AP, предварительно инкубированных с неаддуктивной MSA, мы обнаружили, что окрашивание аналогично окрашиванию, наблюдаемому в тканях с D11-AP. Эти результаты показывают специфичность D11-AP к IsoLGs из-за снижения окрашивания тканей при предварительной инкубации D11-AP с IsoLG / MSA, но не с неаддуктивной MSA. В окончательном отрицательном контроле ткань мыши окрашивали D11-AP или нерелевантным антителом scFv, D20. Окрашивание аорты мыши D11-AP приводило к сильному окрашиванию по сравнению с D20, что указывает на специфичность D11-AP к IsoLGs в гипертонических аортах (рис. 5).
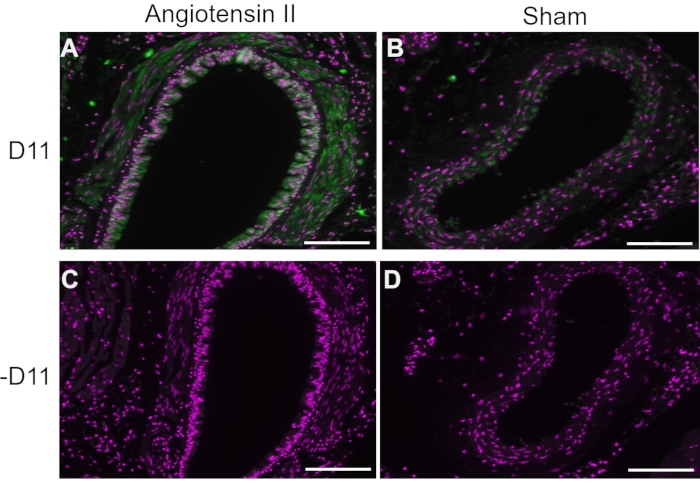
Рисунок 1: Иммунофлюоресценция аорты у гипертонических и нормотензивных мышей. Артерии мышей с ангиотензином II и фиктивной инфузией окрашивали с D11-AP (D11) и без него, чтобы показать наличие IsoLG. (A) Артерия мыши, обработанной ангиотензином II, прощупана D11-AP (зеленый) и ядерным контрокрашиванием (пурпурный), (B) Артерия контрольной мыши, обработанной фиктивной обработкой, исследованная D11-AP, (C) Артерия мыши, получавшей ангиотензин II, без D11-AP, (D) Артерия контрольной мыши, обработанной фиктивным способом без D11-AP (шкала = 100 мкм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
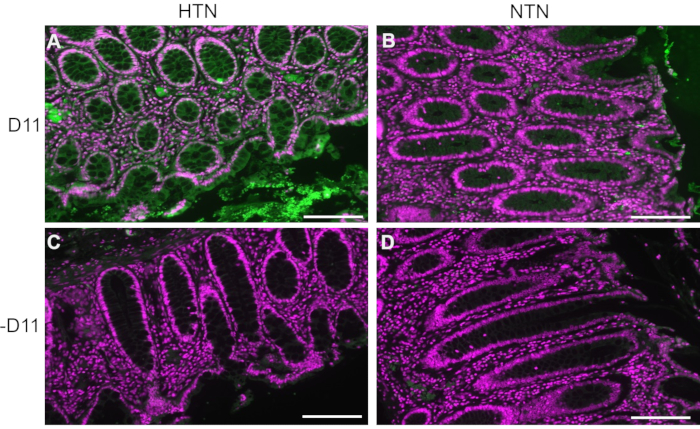
Рисунок 2: Иммунофлюоресценция тканей кишечника человека у пациентов с гипертонической и нормотензивной болезнью. Ткани пациентов с артериальной гипертензией (АГ) и нормотензивных людей (НТН) окрашивали с D11-AP (D11) и без него, чтобы показать наличие изоЛГ у пациентов с АГ. (A) ткани HTN, окрашенные D11-AP (зеленый) и ядерным контрокрашиванием (пурпурный), (B) ткани NTN, окрашенные D11-AP, (C) ткани HTN, окрашенные без D11-AP, (D) ткани NTN, окрашенные без D11-AP (масштабная линейка = 100 мкм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
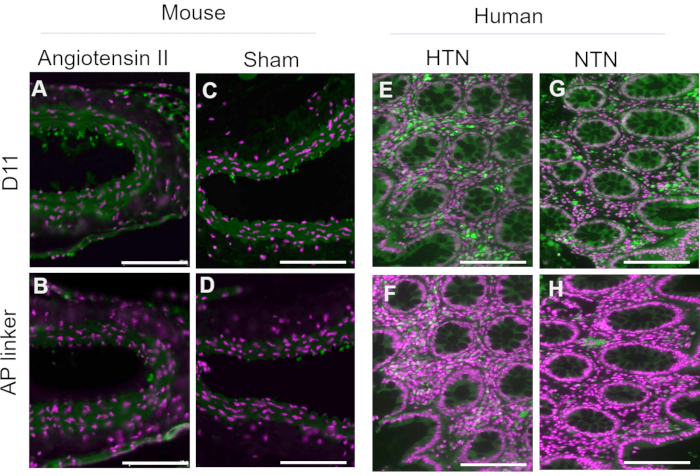
Рисунок 3: Ткани мыши и человека, окрашенные периплазматическим экстрактом с D11-AP и без него. Ткани мышей и человека окрашивали периплазматическими экстрактами с D11-AP и без него. Изображения показывают ограниченное окрашивание тканей периплазматическим экстрактом без D11-AP, что показывает, что окрашивание в основном связано со связыванием D11-AP, а не с другим компонентом, который может присутствовать в периплазматическом экстракте. (A) аорта мыши Ang, окрашенная D11-AP (зеленый) и ядерным противопятном (пурпурный), (B) аорта мыши Ang, окрашенная периплазматическим экстрактом, (C) аорта фиктивной мыши, окрашенная D11-AP, (D) аорта фиктивной мыши, окрашенная периплазматическим экстрактом, (E) гипертоническая ткань кишечника человека, окрашенная D11-AP, (F) гипертоническая ткань кишечника человека, окрашенная периплазматическим экстрактом, (G) нормотензивная кишечная ткань человека, окрашенная D11-AP, (H) нормотензивная кишечная ткань человека, окрашенная периплазматическим экстрактом (шкала = 100 мкм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
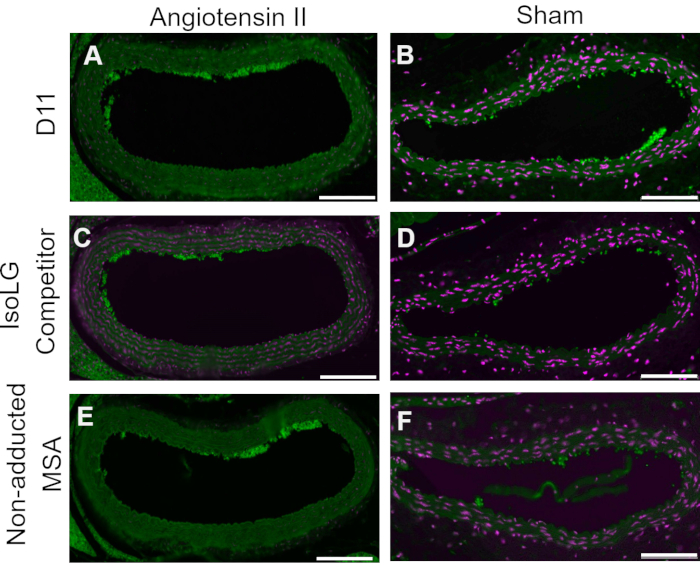
Рисунок 4: Конкурентный контроль в сосудах мышей Анг и Шам . В этом конкурентном контроле D11-AP был предварительно инкубирован с IsoLG-аддуктивным MSA или неаддуктивным MSA. В качестве контроля использовали D11-AP без какой-либо предварительной инкубации. Эти результаты показывают специфичность D11-AP к IsoLGs, поскольку у конкурента IsoLG-MSA снижается окрашивание тканей по сравнению с D11-AP. Это снижение связано с IsoLG, а не с MSA, потому что неаддуктивная предварительная инкубация MSA привела к окрашиванию, аналогичному контролю D11-AP. Ангиотензин II (A) и Sham (B) аорты мыши, окрашенные D11-AP (зеленый) и ядерным контрокрашиванием (пурпурный), ангиотензин II (C) и Sham (D) аорты мыши, окрашенные D11-AP после инкубации с IsoLG-MSA, ангиотензином II (E) и Sham (F), аорты мыши, окрашенные D11-AP после инкубации с неаддуктивной MSA (шкала = 100 мкм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
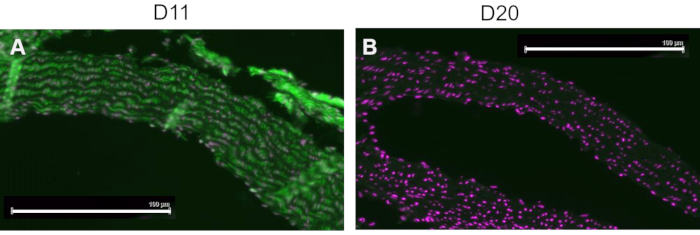
Рисунок 5: Аорта мыши, окрашенная D11 и нерелевантным scFv, D20. Ткань мыши окрашивали D11-AP и сравнивали с нерелевантным контрольным антителом D20, которое специфично для гликопротеина A2. Окрашивание ткани D11-AP (зеленый) и ядерным противопятном (пурпурный) (A) приводило к интенсивной иммунофлуоресценции по сравнению с D20 (зеленый) и ядерным контрокрашиванием (пурпурный) (B), что указывает на специфичность D11-AP к IsoLGs (масштабная линейка = 100 мкм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
D11 широко использовался для обнаружения IsoLG-аддуктированных белков в клетках или тканях в качестве маркера воспаления или окислительного стресса при заболевании 8,9,20. Ранее D11 содержал E-метку, и разработка IHC требовала использования вторичного антитела против E-метки, конъюгированного с HRP10,20,21. Здесь мы разработали и оптимизировали протокол для обнаружения IsoLG-аддуктированных белков с использованием антитела D11, конъюгированного со щелочной фосфатазой вместо E-tag, что устраняет необходимость инкубации вторичных антител.
Для определения специфичности D11-AP было проведено четыре отрицательных контрольных эксперимента. Мы выполнили протокол без присутствия D11 и имели минимальную разработку. Эти результаты имеют двоякое указание: эндогенная щелочная фосфатаза не способствует развитию, а наблюдаемое окрашивание связано с D11, а не с другим способствующим фактором. Далее мы окрашивали слайды линкером AP без D11. Этот эксперимент привел к небольшому окрашиванию, что указывает на то, что свободный AP или другие факторы в периплазматическом экстракте не вызывают пятна, которое мы наблюдаем в присутствии D11. Чтобы обеспечить специфичность D11 к IsoLG, мы предварительно инкубировали D11-AP с очищенным IsoLG перед окрашиванием предметных стекол. Мы наблюдали снижение развития, что указывает на то, что D11-AP был связан с белком IsoLG, тем самым исчерпывая количество свободного D11-AP для связывания с IsoLG, присутствующим в ткани. Наконец, чтобы убедиться, что D11-AP связывается с IsoLG, а не с белком MSA, с которым был связан IsoLG, мы предварительно инкубировали D11-AP только с MSA. Не было никаких изменений в развитии, указывающих на то, что D11-AP связывался не с MSA, а с белком IsoLG. Наконец, исследователи, разрабатывающие протокол окрашивания, были слепы к гипертоническому статусу кишечной ткани человека. Различия в окрашивании, наблюдаемые между пациентами с артериальной гипертензией и пациентами с нормотензией, не были обусловлены смещением и были описаны ранее22,23.
Хотя наш протокол обнаружения IsoLG-аддуктированных белков с использованием антитела D11, конъюгированного с щелочной фосфатазой вместо E-tag, является строгим и надежным и устраняет необходимость инкубации вторичных антител, он имеет некоторые ограничения. Одним из ограничений является то, что мы использовали D11, конъюгированный со щелочной фосфатазой, в периплазматическом экстракте, и могло быть ложное окрашивание эндогенной щелочной фосфатазы в периплазматическом экстракте или некоторых тканях, таких как кишечник24. Однако первый шаг к разработке этого протокола включал отключение эндогенной щелочной фосфатазы, которая может присутствовать в тканях25. Первоначально холодная уксусная кислота, BME и левамизол26 были проверены на эффективность. Ни один из них полностью не уменьшил присутствие активной эндогенной щелочной фосфатазы. Тепло использовалось для дезактивации щелочной фосфатазы27, поэтому мы протестировали тепловую дезактивацию щелочной фосфатазы в разных буферах. Мы обнаружили, что нагревательные и гидратированные предметные стекла в цитратном буфере устраняют большую часть эндогенной щелочной фосфатазы. Слайды были первоначально разработаны с использованием хемилюминесцентной / флуоресцентной подложки, но при изображении без этой подложки наблюдалось большое количество автофлуоресценции. VectorRed - это субстрат, который развивается в присутствии щелочной фосфатазы с образованием хромогена, который можно визуализировать в диапазоне каналов Texas Red / TRITC. Используя этот субстрат, мы смогли легче наблюдать сигнал над фоновой автофлуоресценцией. В процессе окрашивания следует соблюдать осторожность, чтобы свести к минимуму искусственное окрашивание. Сушка тканей на предметных стеклах после гидратации до визуализации привела к усиленному развитию. D11-AP следует аликвотировать и хранить при -20 °C. При работе с D11-AP следует избегать многократных циклов замораживания-оттаивания. Фосфатно-буферный физиологический раствор (PBS) также может влиять на ферментативную активность щелочной фосфатазы и не должен использоваться в качестве промывочного буфера28. Как и в случае с любым подходом, основанным на антителах, необходимо провести тщательное тестирование и оптимизацию, чтобы убедиться, что окрашивание является специфическим, и что сигнал не перегружен или недостаточно усилен.
В заключение, мы разработали мощный, строгий и надежный оптимизированный протокол для обнаружения IsoLG-аддуктированных белков с использованием антитела D11, конъюгированного со щелочной фосфатазой вместо E-tag. Этот протокол имеет несколько преимуществ: во-первых, использование D11 в качестве белка слияния щелочной фосфатазы дешевле. D11 был первоначально получен из библиотеки фаговых антител, которая не могла быть коммерциализирована и была дорогой для очистки. Хотя D11 в периплазматическом экстракте E. coli может обеспечить недорогую альтернативу, он был неэффективен в большинстве анализов. Во-вторых, подход к синтезу щелочной фосфатазы позволяет D11 scfv иметь полезный репортер15 (щелочная фосфатаза), слитый с ним, и его не нужно очищать для использования в иммунологических анализах, поскольку субстраты коммерчески доступны. В-третьих, щелочная фосфатаза E. coli образует димеры29. Таким образом, D11 при слиянии со щелочной фосфатазой также образует димеры, и это увеличивает авидность антитела и связывающую активность30. Наконец, D11, конъюгированный со щелочной фосфатазой в периплазматическом экстракте, можно легко очистить с помощью сибакроновой синей сефарозы. D11 имеет высокую изоэлектрическую точку (~9.2 pH). Таким образом, он положительно заряжен и может связываться с синим цибакроном посредством пикатионных взаимодействий. Большая часть примесей в периплазматическом экстракте E. coli может быть элюирована смолой. D11, конъюгированный щелочной фосфатазой, затем может быть элюирован с использованием высокого содержания соли (~ 1,5 М NaCl) в воде. Элюированный D11, конъюгированный щелочной фосфатазой, достаточно стабилен при 4-8 ° C в растворе с высоким содержанием соли. Таким образом, мы разработали протокол, который не только делает антитело D11 доступным по низкой цене, но и устраняет дополнительные этапы и необходимость инкубации вторичных антител. Этот протокол облегчает воспроизводимое измерение изоЛГ, которые накапливаются в тканях при множественных заболеваниях, где играет роль повышенный окислительный стресс.
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Эта работа была поддержана грантами Национального института здравоохранения K01HL130497, R01HL147818, R01HL144941 и R03HL155041 для А.К. Мы благодарим общий ресурс цифровой гистологии - Vanderbilt Health Nashville, TN https://www.vumc.org/dhsr/46298 за визуализацию и сканирование слайдов.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 ml TALON HiTrap column (Cobalt-CMA) | Cytiva | 28953766 | |
| 200 Proof Ethanol | Pharmco | 111000200 | |
| 2xYT powder | MP Biomedicals | 3012-032 | |
| 384-well, clear, flat-bottom polystyrene microplates | ThermoFisher (NUNC) | 242757 | |
| 4-Nitrophenyl phosphate disodium salt hexahydrate (pNPP) | Carbosynth | EN08508 | |
| 5-Bromo-4-chloro-3indoxyl phosphate, p-toluidine salt (BCIP) | Carbosynth | EB09335 | |
| Ampicillin, sodium salt | Research Products International (RPI) | A40040 | |
| Bovine Serum Albumin | RPI | A30075 | |
| Chemically competent TG1 E. coli | Amid Biosciences | TG1-201 | |
| Diethanolamine, >98% | Sigma-Aldrich | D8885 | |
| EDTA | Sigma-Aldrich | ED | |
| Fluoromount-G | SouthernBiotech | 0100-01 | Mouting medium |
| Glucose | Research Products International (RPI) | G32045 | |
| Glycerol | Sigma-Aldrich | G7893 | |
| Histoclear | National Diagnostics | HS-200 | Xylene alternative |
| Hoechst 33342 | ThermoFisher | H3570 | stock solution = 10 mg/mL |
| Hydrochloric acid (HCl), 30%, Macron Fine Chemicals | ThermoFisher | MK-2624-212 | |
| Imidazole | Research Products International (RPI) | I52000 | |
| MgCl2 (anhydrous) | Sigma-Aldrich | M8266 | |
| Mouse Serum Albumin (MSA) | Sigma-Aldrich/Calbiochem | 126674 | |
| Nitroblue tetrazolium chloride (NBT) | Carbosynth | EN13587 | |
| Potassium chloride (KCl) | Sigma-Aldrich | P4504 | |
| Potassium phosphate, monobasic (KH2PO4) | Sigma-Aldrich | P0662 | |
| Pressure Cooker | Cuisinart | CPC-600 | |
| Slide-a-Lyzer Dialysis cassettes, 10K MWCO, 3 ml | ThermoFisher | 66380 | |
| Sodium chloride (NaCl) | Research Products International (RPI) | S23020 | |
| Sodium Citrate | Sigma-Aldrich | 1064461000 | |
| Sodium phosphate, dibasic (Na2HPO4) | Research Products International (RPI) | S23100 | |
| Sucrose | Research Products International (RPI) | S24065 | |
| Tris base | Research Products International (RPI) | T60040 | |
| Tris-buffered Saline | Boston Bio-Products | 25mM Tris, 2.7mM KCl, 137 mM NaCl, pH 7.4 | |
| Tris-HCl | Research Products International (RPI) | T60050 | |
| Tween20 | Sigma-Aldrich | P9416 | |
| Vector Red | Vector Labs | SK-5105 |
Ссылки
- Brame, C. J., Salomon, R. G., Morrow, J. D., Roberts, L. J. Identification of extremely reactive gamma-ketoaldehydes (isolevuglandins) as products of the isoprostane pathway and characterization of their lysyl protein adducts. Journal of Biological Chemistry. 274, 13139-13146 (1999).
- Brame, C. J., et al. Modification of proteins by isoketal-containing oxidized phospholipids. Journal of Biological Chemistry. 279, 13447-13451 (2004).
- May-Zhang, L. S., et al. Scavenging reactive lipids to prevent oxidative injury. Annual Review of Pharmacology and Toxicology. 61, 291-308 (2021).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2019 update: A report from the American Heart Association. Circulation. 139, 56 (2019).
- Collins, D. R., et al. Global cardiovascular risk assessment in the primary prevention of cardiovascular disease in adults: Systematic review of systematic reviews. BMJ Open. 7, 013650 (2017).
- Whelton, P. K., et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the prevention, detection, evaluation, and management of high blood pressure in adults: Executive summary: A report of the American College of Cardiology/American Heart Association Task Force on clinical practice guidelines. Circulation. 138, 426-483 (2018).
- Patrick, D. M., Van Beusecum, J. P., Kirabo, A. The role of inflammation in hypertension: Novel concepts. Current Opinion in Physiology. 19, 92-98 (2021).
- Davies, S. S., et al. Isolevuglandins as mediators of disease and the development of dicarbonyl scavengers as pharmaceutical interventions. Pharmacology and Therapeutics. 205, 107418 (2020).
- Dixon, K. B., Davies, S. S., Kirabo, A. Dendritic cells and isolevuglandins in immunity, inflammation, and hypertension. American Journal of Physiology-Heart and Circulation Physiology. 312, 368-374 (2017).
- Kirabo, A., et al. DC isoketal-modified proteins activate T cells and promote hypertension. Journal of Clinical Investigation. 124, 4642-4656 (2014).
- Yan, H. P., et al. Isolevuglandins as a gauge of lipid peroxidation in human tumors. Free Radical Biology and Medicine. 106, 62-68 (2017).
- Davies, S. S., et al. Localization of isoketal adducts in vivo using a single-chain antibody. Free Radical Biology and Medicine. 36, 1163-1174 (2004).
- Shen, Z., et al. Single-chain fragment variable antibody piezoimmunosensors. Analytical Chemistry. 77, 797-805 (2005).
- Hennig, E. E., Mernaugh, R., Edl, J., Cao, P., Cover, T. L. Heterogeneity among Helicobacter pylori strains in expression of the outer membrane protein BabA. Infections and Immunity. 72, 3429-3435 (2004).
- Martin, C. D., et al. A simple vector system to improve performance and utilisation of recombinant antibodies. BMC Biotechnology. 6, 46 (2006).
- Han, Z., Karatan, E., Scholle, M. D., McCafferty, J., Kay, B. K. Accelerated screening of phage-display output with alkaline phosphatase fusions. Combinatorial Chemistry and High Throughput Screening. 7, 55-62 (2004).
- Miller, J. . Handbook for a short course in bacterial genetics. , (1992).
- Nair, R., et al. Yeast extract mediated autoinduction of lacUV5 promoter: An insight. New Biotechnology. 26 (6), 282-288 (2009).
- Davies, S. S., Amarnath, V., Roberts, L. J. Isoketals: Highly reactive γ-ketoaldehydes formed from the H2-isoprostane pathway. Chemistry and Physics of Lipids. 128 (1-2), 85-99 (2004).
- Ngwenyama, N., et al. Isolevuglandin-modified cardiac proteins drive CD4+ T-Cell activation in the heart and promote cardiac dysfunction. Circulation. 143 (12), 1242-1255 (2021).
- Prinsen, J. K., et al. Highly reactive Isolevuglandins promote atrial fibrillation caused by hypertension. Basic to Translational Science JACC. 5 (6), 602-615 (2020).
- Ferguson, J. F., et al. High dietary salt-induced dendritic cell activation underlies microbial dysbiosis-associated hypertension. JCI Insight. 5 (13), 126241 (2019).
- Madhur, M. S., et al. Hypertension: Do inflammation and immunity hold the key to solving this epidemic. Circulation Research. 128 (7), 908-933 (2021).
- Estaki, M., DeCoffe, D., Gibson, D. L. Interplay between intestinal alkaline phosphatase, diet, gut microbes and immunity. World Journal of Gastroenterology. 20 (42), 15650-15656 (2014).
- Millán, J. L. . Mammalian alkaline phosphatases: From biology to applications in medicine and biotechnology. , (2006).
- Ponder, B. A., Wilkinson, M. M. Inhibition of endogenous tissue alkaline phosphatase with the use of alkaline phosphatase conjugates in immunohistochemistry. Journal of Histochemistry and Cytochemistry. 29 (8), 981-984 (1981).
- Goldstein, D. J., Rogers, C. E., Harris, H. Expression of alkaline phosphatase loci in mammalian tissues. Proceedings of the National Academy of Science U. S. A. 77 (5), 2857-2860 (1980).
- Ramos-Vara, J. A. Technical aspects of immunohistochemistry. Veterinary Pathology. 42 (4), 405-426 (2005).
- Coleman, J. E. Structure and mechanism of alkaline phosphatase. Annual Review of Biophysics and Biomolecular Structure. 21, 441-483 (1992).
- Harper, J. E., Toth, R. L., Mayo, M. A., Torrance, L. Properties of a panel of single chain variable fragments against Potato leafroll virus obtained from two phage display libraries. Journal of Virological Methods. 81 (1-2), 159-168 (1999).
Erratum
Formal Correction: Erratum: Direct Detection of Isolevuglandins in Tissues using a D11 scFv-Alkaline Phosphatase Fusion Protein and Immunofluorescence
Posted by JoVE Editors on 4/11/2023. Citeable Link.
An erratum was issued for: Direct Detection of Isolevuglandins in Tissues using a D11 scFv-Alkaline Phosphatase Fusion Protein and Immunofluorescence. The Authors section was updated from:
Cassandra Warden1
Alan J. Simmons2
Lejla Pasic3
Sean S. Davies4
Justin H. Layer5
Raymond L. Mernaugh3
Annet Kirabo4,6
1Vanderbilt Eye Institute, Vanderbilt University Medical Center
2Department of Cell and Developmental Biology, Vanderbilt University
3Department of Biochemistry, Vanderbilt University
4Division of Clinical Pharmacology, Department of Medicine, Vanderbilt University Medical Center
5Division of Hematology and Oncology, Indiana University School of Medicine
6Department of Molecular Physiology and Biophysics, Vanderbilt University
to:
Cassandra Warden1
Alan J. Simmons2
Lejla Pasic3
Ashley Pitzer4,6
Sean S. Davies4
Justin H. Layer5
Raymond L. Mernaugh3
Annet Kirabo4,6
1Vanderbilt Eye Institute, Vanderbilt University Medical Center
2Department of Cell and Developmental Biology, Vanderbilt University
3Department of Biochemistry, Vanderbilt University
4Division of Clinical Pharmacology, Department of Medicine, Vanderbilt University Medical Center
5Division of Hematology and Oncology, Indiana University School of Medicine
6Department of Molecular Physiology and Biophysics, Vanderbilt University
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены