Method Article
認識された運動ニューロンの神経筋接合部における変化を検出する ショウジョウバエ 成脚の解剖と免疫染色
要約
神経筋接合のアーキテクチャを維持し、成人 ショウジョウバエ 脚の運動ニューロンの詳細な免疫細胞化学的研究を可能にする解剖技術について述べています。
要約
ショウジョウバエメラノガスター は、神経の構造と機能、および病気状態のその後の変化を研究するための遺伝的に難解なモデルを表します。よく特徴付けられる幼虫神経筋接合は、しばしばそのような研究のために使用される。しかし、急速な幼虫の発達に続いて、変態中の筋肉組織異常と神経系のリモデリングは、筋萎縮性側索硬化症で起こるような遅い加齢依存性変性変化の研究にとってこのモデルを問題にする。あるいは、成人ハエは90日間生きており、成人の脚は、キューティクルを介して インビボ 蛍光イメージングを使用して成人の寿命にわたって運動ニューロンの変化を研究するために使用することができます。ここでは、同定された成人脚運動ニューロンの神経筋接合における分子変化の研究を可能にする免疫細胞化学と組み合わせた脚解剖技術について述べている。これらの技術は、シナプス前およびシナプス後の両方の構造を標識する無数の抗体と結合することができる。これらの手順を組み合わせることで、成人ハエの年齢依存性の変化がより完全に特徴付けることができ、複数の運動ニューロン疾患モデルに適用することができます。
概要
運動ニューロン(MN)疾患は、一次臨床表現型として筋肉の消耗および麻痺につながる進行性変性を含む異種の状態のグループを包含する。世界的な罹患率は10万人当たり4.5人とまれですが、高齢化に伴ってこの罹患率は増加すると予想されます2。筋萎縮性側索硬化症(ALS)は、最も一般的なMN疾患(MND)であり、通常、既存の疾患修飾治療がない診断の短時間で致命的である3。MNDsは、患者4で見られる初期の分子バイオマーカーの変化および機能的イメージング変化と共に、長引く前症候性相を共通に共有する。初期の前兆性細胞病理は、非ヒト疾患モデル5,6,7,8でも観察される。神経筋接合部における早期変化の研究は、MN疾患の病因を理解するために重要であり、早期診断および潜在的な治療法の開発に役立つ可能性がある。
ショウジョウバエには、神経筋接合の構造と機能を解剖するための豊富な遺伝的および分子的ツールが存在する(NMJ、よく特徴付けられた幼虫NMJのレビューについては9を参照)。これらのツールは、短い寿命と組み合わせることで、ショウジョウバエはNMJで神経変性変化を研究するための優れたモデルになります。具体的には、RNの内在成人の筋肉は、〜90日間の成人の寿命を通して存在し、正常な老化プロセス10、11、12、13の対象となります。したがって、成人のMNsは、変態14,15の前に短い〜1週間の期間だけ存在する幼虫NmJとは対照的に、遅い変性変化を研究する機会を提供する。
ここでは、成人区間のMNsの免疫細胞化学的分析を行うことを可能にする解剖手順について述べています。各成人脚は〜50 Mで内面化され、関連する脚にシナプスを付け、運動を促進する。脚の解剖学、機械的生理学、および神経生物学は、十分に記述されている16,17,18。脚Mの軸索は、以前に二部的なGal4/UASシステムを使用して、後ろに充填されたまたは遺伝的に標識された細胞集団におけるキューティクルを介してイメージングすることを特徴としており、イメージング方法は以前に公開されています19。ここで示す解剖方法は、軸索分岐形態を保存し、NMJの異なる分子成分を標識する多様な抗体を利用することを可能にする。私たちの前の研究は、脛骨浮上筋(ティルム)を内面的にし、一貫した樹木パターンとブトン数を示すメタソラシック(第3)脚の定義されたMNの投影に焦点を当てています。最初に、ショウジョウバエスーパーオキシドジスムターゼ1(dsod1)変異体の年齢依存性変化を研究し、NMJ20の解体と一致する変化を発見した。これらの解剖法は、他のALSモデル、老化および他のMN関連疾患の基礎研究のためのNMJでの遅い変性変化をより良く特徴付ける機会を提供する。
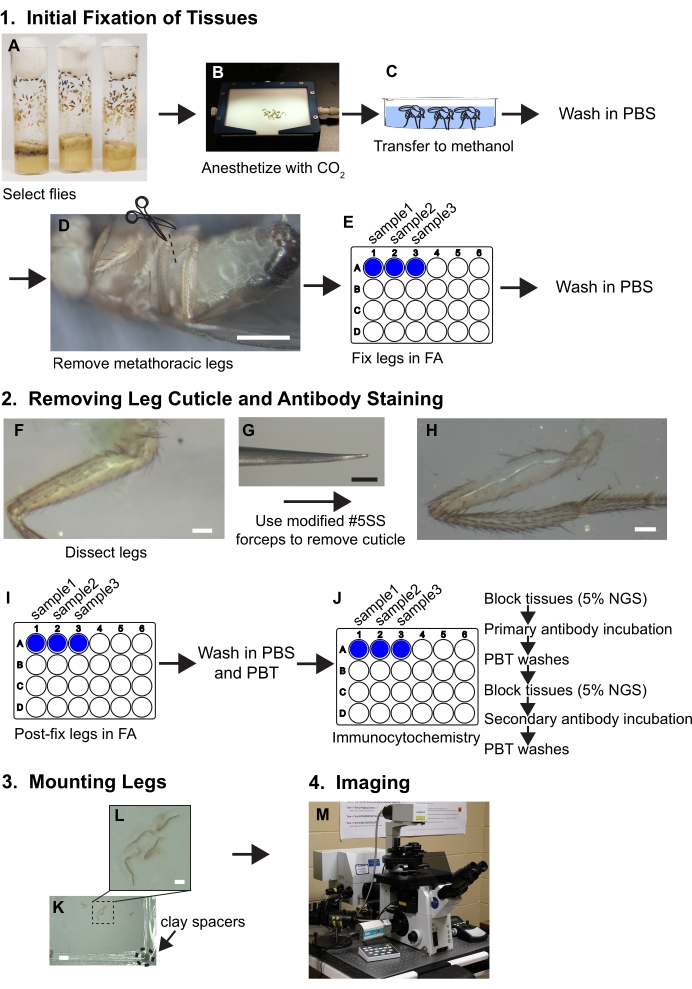
図 1.足の解剖のワークフローの概要。 詳細な手順については、プロトコルを参照してください。(A,B)ハエが選択され、麻酔されます。(C)ハエをメタノールに移し、PBSで洗浄する。(D) メタソシック脚は、解剖顕微鏡で視覚化しながらコサの基部で取り除かれます(〜30倍倍)。スケールバー= 500 μm(E)脚は、24ウェルプレートのウェル内で30分間30分間ホルムアルデヒド/PBS(FA)溶液に固定され、その後FAはPBSでのスケで除去されます。(F、G、H)脚はシリコーンエラストマーの解剖トレイに移され、キューティクルの一部は、80倍の解剖顕微鏡の下で視覚化しながら、ベベル鉗子を使用して近位大腿骨から取り除かれます。スケールバー= 50 μm(I)脚は、FAで解剖後固定され、PBSおよびPBT(PBS+0.1%非イオン性界面活性剤)で洗浄される。(J)脚は免疫細胞化学染色を行う。(K,L)脚はガラススライドに移され、取り付けメディアでクリアされ、粘土スペーサーを含むカバースリップで覆われます。スケールバー= 2 mm および 500 μm。(M)脚は共焦点顕微鏡で画像化される。 この図の大きなバージョンを表示するには、ここをクリックしてください。
プロトコル
このプロトコルと組み合わせて使用される作業ソリューションを準備する手順は 、表 1 で説明されています。
| 試薬 | 準備 | 貯蔵 | |||
| PBS | 蒸留水に希釈して10xPBSストック溶液から1x PBSの作業ストックを作ります。 作業PBS在庫のpHは7.2- 7.4でなければなりません | 細菌汚染が見えるまで1ヶ月以上4°C。 | |||
| PBT | 1x PBS溶液に0.1%非イオン性界面活性剤を使用。 | 細菌汚染が見えるまで1ヶ月以上4°C。 | |||
| ファ | 3.7%ホルムアルデヒド溶液は37%ホルムアルデヒドストックから作られ、1x PBSで希釈されています。 | 室温。解剖の毎日新鮮な作る | |||
| 注意:37%のストック溶液として供給されたホルムアルデヒドは、潜在的な発がん性物質であり、ヒュームフードで希釈する必要があります。 | |||||
| 5% NGS | PBTで希釈した5%の正常なヤギ血清。 使用される血清は、使用する二次抗体の種と一致する必要があります。 | 細菌汚染が見えるまで、4°Cの数週間 | |||
表 1.成体ショウジョウバエ脚の免疫細胞化学を行うためのソリューション。
1. 組織の初期固定
- 各遺伝子型と年齢に約10ハエを選択します。二酸化炭素の下でフライパッドで麻酔をします(図1A、B)。
注:解剖後に十分な大きさのサンプルサイズを確保するために、必要以上にハエを使用してください。 - ペイントブラシを使用して、ハエをガラスウェルまたは皿に約30秒から1分間冷たいメタノールに移します(図1C)。メタノールは、カチカリン炭化水素を可溶化し、ハエは水溶液に浮かばすのではなく、水没させることができるようになりました。
- 鉗子で、慎重にPBSにハエを移す。氷冷PBSで3倍をすすぎ、余分なメタノールを取り除き、解剖と固定するまで氷上のPBSでハエを保ちます。この時点で、ハエを解剖し、可能な限り最短時間(<30分)以内に修正します。
- 脚を分離するには、冷たいPBSで満たされたシリコーンエラストマー解剖皿にハエを移し、#5デュモン鉗子の2組を使用してコクサのメタソシック脚を取り除くか、ヴァンナハサミで脚を切断します(図1D)。PBSの1 mLで満たされたプラスチック24ウェルプレートのウェルに脚を移し、すべての脚が取り除かれ、井戸に移されるまでプレートを氷の上に保ちます。
注:各井戸は少なくとも20本の脚を保持することができます。 - PBS溶液を1mLのFA溶液に交換し、ヌテタで30分間回転させます(図1E)。ヌテタの設定は、中速度(17 rpm)に設定する必要があります。脚が十分な固定のために、この時間の間にFA溶液に完全に沈められるようにしてください。
- FA溶液を除去するには、PBS 3xの1mLで速やかに洗浄し、さらに3つの洗浄をそれぞれ1mLで5分間洗浄します。氷上のPBSの1mLで組織を氷上に保持し、以下に記載の解剖ステップ中に保持する。
2. 脚のキューティクルと抗体染色の除去
- 脚のキューティクルを取り外す
- 解剖鉗子は成功のために重要である。#5スーパーファイン鉗子の端にある両プロングにわずかな平行な曲げを導入し、キューティクルを突くのではなく表面的につかむことができるベベルを提供し、組織を台無しにすることができます(図1F、G)。
メモ:平行に曲げた突起は、閉じたときに、プロングの長さ全体にわたって互いに接触する必要があります(図2)。 - 解剖のためにPBSのシリコーンエラストマー皿に足を移す。前側が上向きになるように脚を向けます(脚の解剖学と向きの情報については 図 3 を参照)。1組の鉗子を使用して、脛物セグメントをシリコーンエラストマー皿に対して保持する。ベベル側を下に保持した他の鉗子を使用して、大腿骨の遠位端にキューティクルの一部をつかみ、トロシャンターに向かって近位方向に引っ張ります。
- 大腿骨の近位端に裸の筋肉が見えるまで、系統的にキューティクルを取り除きます(図1F、G、H)。
注:筋肉を引っ張らないように、鉗子の面前の側を使用して脚と表面的な接触をするだけです。 - すべての脚を解剖したら、PBSをFAに置き換えて、中速でヌテーターで振って30分間脚を後固定します(図1I)。サンプルを1 mLのPBSで3回、PBTでそれぞれ5分間3回洗浄します(図1J)。
注:モノクローナル抗体NC82(アンチブリュフパイロット)で染色して活性領域を標識する場合、この抗原はより長い固定に敏感であるため、20分間の後修正を行います。
- 解剖鉗子は成功のために重要である。#5スーパーファイン鉗子の端にある両プロングにわずかな平行な曲げを導入し、キューティクルを突くのではなく表面的につかむことができるベベルを提供し、組織を台無しにすることができます(図1F、G)。
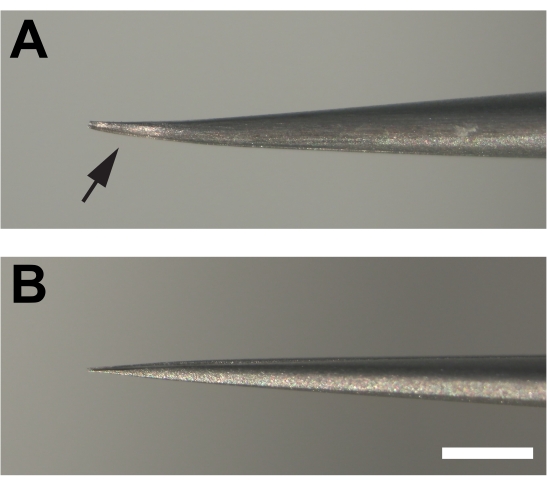
図 2.大人の足を解剖するために使用される修正された鉗子。 (A)鉗子の端部は曲がり、その後、研ぎ石に出してベベルを作成する下部(矢印)で平らにされています。(B)対照的に、不変鉗子の突起は曲がっていない。スケールバー= 1 mm この図の大きなバージョンを表示するには、ここをクリックしてください。
- 抗体染色
- 抗体染色用の組織をブロックするには、PBTで希釈した5%NGSの1 mLからなるブロッキング溶液でPBTの1mLを交換してください。解剖した脚を室温で4時間、または4°Cで一晩、中速(17rpm)でヌテーターで揺れながらインキュベートします。すべてのインキュベーション中に、プラスチックカバーに加えてシールテープでウェルをカバーします(図1J)。
注:24ウェルプレートは、マイクロ遠心チューブを使用する以前の試みは足の骨折や組織の損傷をもたらしたので、1.5 mLまたは2 mLマイクロ遠心分離機ではなく免疫細胞化学に使用されます。 - ブロッキング溶液を除去し、新鮮なブロッキング溶液で希釈した一次抗体の300 mLを添加します。使用される抗体の少量は、組織をカバーするのに十分である必要があります。実験室の密封テープとプラスチック製の蓋でウェルを再密封し、中速でヌテーターで振る4°Cで一晩インキュベートします(図1J)。これらの研究に用いられる働く抗体試薬情報および濃度を 表2に記載する。
- 1 mL の PBT で一次抗体を 3 回短時間、3 回ずつ 15 分間洗浄します(図 1J)。
注:希釈された一次抗体は、4°Cで最大2週間保存すると保存し、再利用することができます。 - 組織を室温で少なくとも2時間、または4Cで一晩、5%NGSの1mLで再びブロックする(図1J)。
- 5%NGSブロッキング溶液を取り外し、適切な希釈蛍光コンジュゲート二次抗体を300μL添加します。さらに、1:2000の蛍光結合ファロイジンを標識筋に加える(図1J)。
- 二次抗体インキュベーションの場合、実験室のシールテープと蓋付きのシールウェル。また、光からフッ素を保護するために、アルミ箔でプレートをラップします。室温で6〜8時間、または4°Cで一晩インキュベートする。
- 上記のステップ2.2.3に記載の2次抗体およびファロイジンを洗浄する。蛍光体を光から保護するために、打ち上げの間にアルミホイルでプレートをカバーします。
- 抗体染色用の組織をブロックするには、PBTで希釈した5%NGSの1 mLからなるブロッキング溶液でPBTの1mLを交換してください。解剖した脚を室温で4時間、または4°Cで一晩、中速(17rpm)でヌテーターで揺れながらインキュベートします。すべてのインキュベーション中に、プラスチックカバーに加えてシールテープでウェルをカバーします(図1J)。
3. 脚の取り付け
- 鉗子を使用してスライドに足を移し、前部側を上に向けます。取り付け用メディアで脚を覆います(図1K、L)。
注:切断された脚は、下の穴がカミソリの刃で切断することによって広がる場合、P1000ピペットチップで吸引することができます。 - モデリング粘土の小さなボールにカバースリップコーナーを削り取ることによって、22x22 mm2 カバースリップ(#1.5厚さ)に粘土スペーサーを追加します。各コーナーには、厚さ1〜2mmの粘土が少量必要です(図1K)。
- スライドを覆うために、粘土スペーサーをスライドに向けてカバースリップを追加し、カバースリップが大腿骨の表面に触れるまで慎重にコーナーを押します。
- 蒸発を防ぐために、カバースリップの端をマニキュアで密封し、暗い場所(約10分)で乾燥させてから、イメージングまで4°Cで保存します。
4. イメージング
- 共焦点顕微鏡による画像(図1M)。解剖の質をより良く評価するために透過光チャネルを含め、関心のある領域で目に見えて破壊された筋線維を有するサンプルは廃棄すべきである。
- 2倍のズームと、大腿骨の厚さに対応する〜40 mmの合計画像深度を持つ20倍の拡大でZスタックのイメージングを開始します。蛍光信号検出では、ナイキストサンプリングと一致する解像度で画像をキャプチャします(1024 x 1024ピクセル、8~10μs/ピクセルの位取り設定を使用)。信号強度は、高電圧ゲイン設定を調整することによって達成される線形範囲にあるべきです。実験内の一連のサンプルにゲイン設定を設定した後は、サンプル間で信号強度を比較できるように変更しないでください。
- シナプス・ブトンやその他の細胞下構造をイメージングする場合は、≥60倍の倍率で共焦点画像をキャプチャします。検出器の設定は線形範囲にする必要がありますが、ピクセル密度、位取り設定、Z深度は、低倍率で撮影された画像に対して類似している必要があります(ステップ 4.1)。
結果
図4 は、抗hrp、抗dlg、およびファロイジンで染色されたメタソリック脚の代表的な例を示す。大腿骨の近位部分からキューティクルを除去する解剖のために、ステレオタイプのアーバーは、自己蛍光によって容易に検出される腱の近くに明らかになります。なお、脚への抗体の浸透は、キューティクルが除去された領域を越えて短い距離で起こる(図4A)。これらの領域は、強い蛍光シグナルが存在する場合に効果的に画像化することができる。低倍率(2倍ズームで20倍)でのイメージングでは、1)キューティクルが取り除かれる量、および2)解剖中に損傷が発生したかどうかを簡単に判断できます。拡大された倍率(60x)は、ティルム上のステレオタイプ投影を示す(図4B)。我々の研究は、近位大腿骨の中のチルムを内面的に浸透させるI-MN系統に由来する可能性が高い1つのMNに焦点を当てています(ボックス、 図4B および 図4C)。さらに拡大倍率(2倍ズームで100倍)を増加させることで、シナプス・ブトンの効果的な視覚化が可能になります(図4D)。
成人NMJにおける経時変化を研究するために、以前はalSのモデルとしてdsod1変異体を用いてきた。ブトン腫脹は、dsod1nulland sosod1+に対して老化したdsod1H71Y変異体において生じる(図5A、B)。幼虫NMJでは、モノクローナル抗体NC82が活性領域の標識に使用されることが多く、この構造は成体NMJで容易に可視化することができます(図5C)。dsod1H71Y変異体には弱い陽性のHRP軸索枝が豊富であり、これらの枝はしばしば弱く、びまんなBRP局在化を示す(矢印)。
神経変性に重要な市販の抗体は、凝集体にしばしば見られるユビキチン化タンパク質を検出することができ、老化した変異型 dsod1 ハエの末端軸索内および筋肉内のユビキチン化凝集体を検出しました(図6A)。また、ミトコンドリアを標識する抗体は、年齢とともに形態変化を検出することもできる(図6B)。
いくつかの準備のために, 解剖中の筋肉の損傷は、サンプルが使用できなくなります.最初は、このような損傷は一般的な発生ですが、練習では改善が行われます。良好な解剖の例は 、図7A、C を示し、一方で不十分な解剖は 図7B、Dに示されている。不十分な解剖は、位相コントラスト顕微鏡で検出された筋線維の解体を引き起こす(図7B)または蛍光共役ファロイジンによって可視化された失われた筋線維(図7D、矢印)。ファロイジンを使用して筋肉を標識し、かつ透過光画像を使用して、解剖顕微鏡で見たときには見えない筋肉の損傷を検出するのに役立ちます。
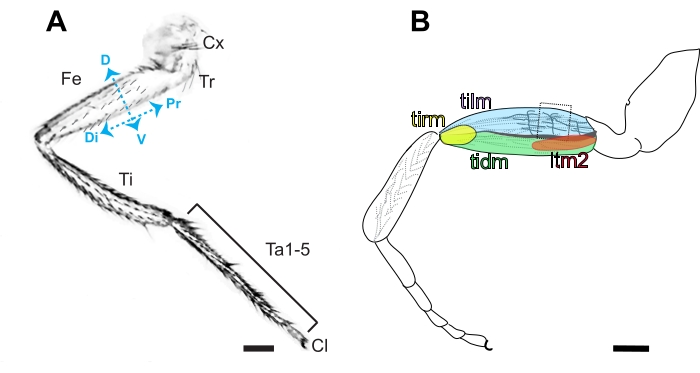
図 3.ショ ウジョウバエ 脚の解剖学。 (A)後部側に存在する顕著な裸のキューティクルとは対照的に毛の存在を特徴とする、形骨脚の前側の図。セグメント化された脚は、コクサ(Cx)、トロシャンター(Tr)、大腿骨(Fe)、脛骨(Ti)、5つのタールサルセグメント(Ta1-5)、および近位(Pr)から遠位(Di)までの順に(Cl)で構成される。大腿骨の側の側(D)および腹側(V)も示される。スケールバー =100 μm。(B)脛骨浮上剤(ティルム)、脛骨圧圧子(tidm)、長腱筋2(ltm2)および脛骨筋(tirm)筋肉および脛骨筋(tirm)筋肉およびチルムを内面的に内径する軸索突起を含む大腿骨の図。これらのステレオタイプ軸索突起は、I-系統神経芽細胞16に由来すると推測され、第2の樹型化は解剖(箱入り)によってアクセスするのが最も簡単である。スケールバー= 100 μm この図の大きなバージョンを表示するには、ここをクリックしてください。
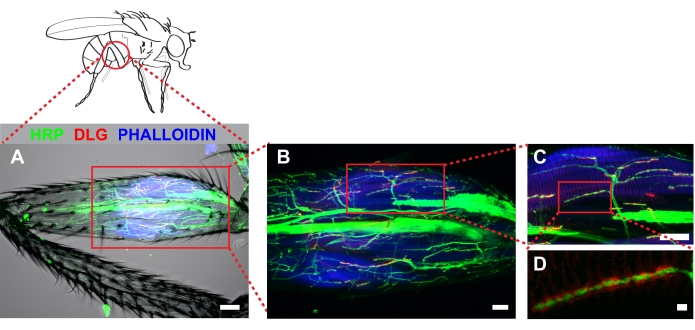
図 4.解剖されたメタソラシック大腿骨は、チラムを内面的に固定されたMNアーキテクチャを明らかにした。 免疫細胞化学は、ニューロン(HRP)、ディスクラージ(DLG)および筋肉(ファロイジン)をマークするために使用されました。Zスタックは、大腿骨全体を通る共焦点顕微鏡イメージングによって捕捉され、最大シリーズ投影として示された。(A)透過光チャネルも含まれ、解剖中に検出可能な筋損傷が生じなかったことを示す。画像は20倍の倍率で撮影され、スケールバー=50μmであった。(B)ティルム(箱入り面積、中央)、スケールバー=20 μmに関連するアーバーを特定。60倍の拡大で(C)、スケールバー= 20 μm。(D) 2倍ズームで100倍の倍率で画像化した野生動物型動物では、(D) 周囲のブトンを取り巻くDLGが明らかであった。スケールバー = 2 μm この図の大きなバージョンを表示するには、ここをクリックしてください。
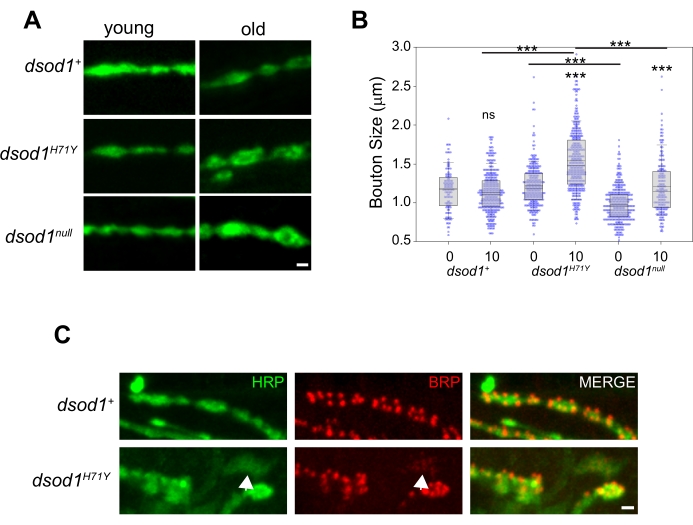
図 5.脚解剖技術を用いて検出できるブトン形態における年齢依存性変化の例ブートン腫脹は、老化したdsod1H71Y変異体において見られる。(A)若い(新たに閉鎖された、0日目の成人)および古い(10日目)ハエ、スケールバー=1μmからのHRP染色されたブトンの代表的な画像。(B)ブトンサイズは、ImageJ内の測定関数を用いてそれぞれの遺伝子型から定量化した。p<0.0001 (ポストホック・トゥーキー検定を使用した双方向のANOVA)(C) モノクローナル抗体 NC82 (抗ブリュッフパイロット) で標識されたシナプスブトン内の活性ゾーン;スケールバー = 1 μm20000 から変更された図この図の大きいバージョンを表示するには、ここをクリックしてください。
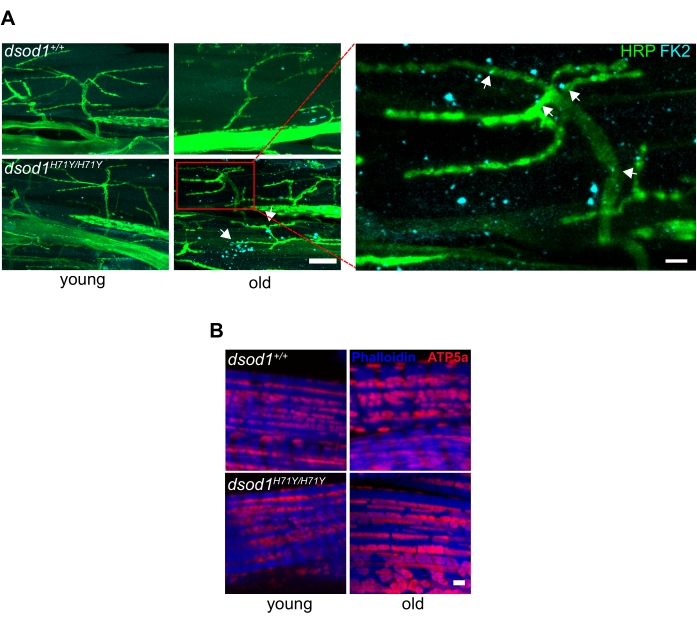
図 6.ショウジョウバエ脚製剤に使用される神経変性疾患に関連する一般的なマーカー。(A)細胞下のポリユビキチン化凝集体は、老化したdsod1H71Yハエの末端軸索および筋肉で検出される。抗ポリユビキチン(FK2)を用いた免疫細胞化学は、老齢dsod1H71Y/H71Y、スケールバー=20μm(左)および5μm(右)でパンクタ(矢印)を検出します。(B) 腫れたミトコンドリアは、抗ATP5A、スケールバー=1 μmを使用して検出することができる。20000 から変更された図この図の大きいバージョンを表示するには、ここをクリックしてください。
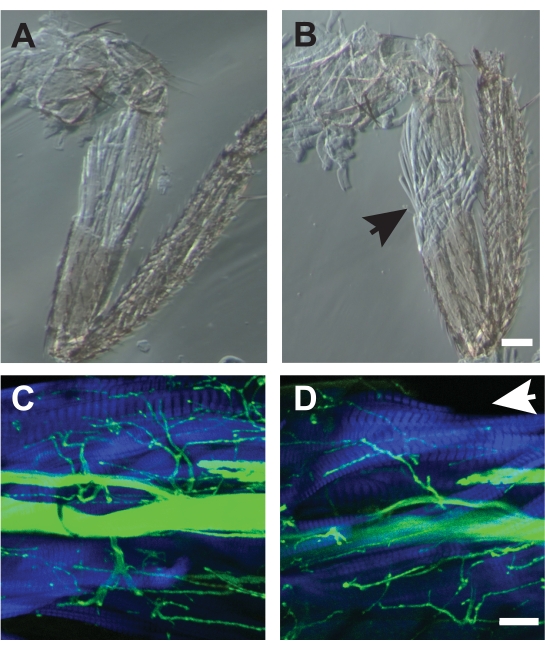
図 7.良いと悪いの崩壊の例。 (A) 根底にある筋肉アーキテクチャを破壊しなかった解離。(B)ほつれた筋線維(矢印)を示し、分析に使用できなかった貧弱な解剖の例。両サンプルを位相対比顕微鏡で画像化した。スケールバー= 50 μm(C)HRP(緑色)とファロイジン(青)と共焦点顕微鏡で像化した良好な解剖の例。(D)失われたTILMの足下筋線維の欠損の解剖不良(矢印)。スケールバー= 50 μm この図の大きなバージョンを表示するには、ここをクリックしてください。
| 抗体/ステイン | 希釈* |
| アンチATP5A | 1:500 |
| アンチブリュッチパイロット(nc82) | 1:20 |
| 抗システインストリングタンパク質 (ab49) | 1:50 |
| アンチディスク大 (4F3) | 1:200 |
| アンチ・フルプ | 1:550 |
| 抗ポリウビキチン(FK2) | 1:1000 |
| アンチレポ (8D12) | 1:5 |
| ヤギ抗マウス二次抗体 | 1:800 |
| ファロイジン | 1:2000 |
| *5%NGSで希釈 |
表 2.抗体および希釈液。 これらの研究で使用される抗体の市販業者は、材料リストに記載されています。
ディスカッション
ショウジョウバエの成人脚は、神経芽細胞系統とステレオタイプの樹型パターンからマッピングされた十分に特徴付けられたMNsを持つ相対的な単純さを与えられた神経変性を研究するのに理想的なモデルです。いくつかの報告は、以前に神経変性疾患の研究のために脚のMNsを使用しています21,22。これらの研究は、GFP発現ラインと抑制性細胞マーカー(MARCM)を有するモザイク解析と組み合わせてキューティクルを画像化し、一連の形態学的変化を文書化した。切除されたキューティクルを用いた免疫細胞化学による成人NmJのイメージングは、利用可能な抗体のツールボックスを使用して複雑な分子変化を追跡する能力を持つさらなる特徴付けを可能にする。
このプロトコルの免疫細胞化学部分は比較的標準的であり、遺伝子型とは無関係に実施することができる(ショウジョウバエで使用するための一般的な抗体染色法の優れた説明については23参照)。さらに、画像を撮影して定量分析のための詳細な方法が公開されると、蛍光強度、軸索枝長さ、およびブットン数およびサイズなどのパラメータを、さまざまな ImageJ マクロを使用して決定することができます(例えば、24,25,26 を参照)。したがって、解剖技術はここで説明する主な革新である。解剖する前に、ハエは、カチカチカル炭化水素を取り除くためにアルコールに沈んでいます。エタノールとメタノールの両方がこの目的のために一般的に使用されます。しかし、メタノールしか使用していません。解剖の成功に重要ないくつかの要因があります:まず、ベベルを持つ修正された鉗子を使用すると、キューティクルとの非常に表面的な接触が可能になります。第二に、キューティクルの表面がはっきりと見えるように60〜100倍の総拡大が可能な解剖顕微鏡を用いた。最大倍率の低い顕微鏡では、ほとんどの一般的なブランドで2倍の目標が利用可能であり、既存のレンズと組み合わせると十分です。第三に、最初の固定ステップは、キューティクルを脆くし、下の筋肉を損傷することなく引き離しやすくします。このステップでの過剰固定は、脚全体が効果的な解剖のために硬すぎます。したがって、最初の固定は 30 分に制限する必要があります。ホルムアルデヒド固定剤は、この短い期間の間に効果的に下の組織を架橋するのに十分に浸透しないため、第2の固定ステップが必要である。2回目の固定化の前に、組織は劣化や形態の変化を防ぐために氷の上に保管する必要があります。第四に、寒さも重要である一方でサンプルを解剖することが判明しましたが、キューティクルが脆く、小さな部分をより簡単に取り除くことができるという同様の理由で、可能性が高いです。
練習では、約50%の切分が目に見える組織損傷の中で使用できることがわかります。この割合は他のいくつかの組織に比べて低く見えるかもしれませんが、解剖手順は迅速であり、多くの脚は30〜60分で処理することができます。したがって、最初は成功率が低い場合でも、実験グループごとに4~5の良好なサンプルを得ることが可能です。しかし、遺伝子型や年齢が実質的な致死性をもたらす場合、制限は、任意の時点で利用可能なハエの数である可能性があります。
もう一つの制限は、大腿骨の近位領域を越えて脚の他の領域を大きさのために解剖することができないということです。このように、TILMを確実に内面化するMNアーバーを同定し、解剖時の脚の向き方に小さな変化を伴う脛骨うつ筋の上のキューティクルを解剖することが可能である。しかし、脚の他の領域へのアクセスは、解剖中に軸索アーキテクチャを破壊することなく、より困難であることが判明しました。
ここでは、免疫細胞化学を用いてチルムを内面化する定義されたMNsに対する成人NMJでの変化を検出するための解剖方法を提示する。脚は、わずか〜50のMNsによってインナートされ、よく説明された解剖学を持つ14の筋肉を含む、単純なシステムとして有用です。解剖された脚の調製物は遺伝子型をまたいで使用することができ、一連の抗体は変異型の背景にレポーター遺伝子構築物の遺伝子型的に複雑なストックを構築する必要なしにNMJの視覚化のために利用できる。このアプローチにより、MN疾患やその他の加齢に伴う疾患に対するNMJの変化をより詳細に特徴付けられるようになります。
開示事項
著者らは利益相反を宣言しない。
謝辞
私たちは、イメージングに関するアドバイスのためにエリック・ロバーツに感謝します。また、ロードアイランド大学の情報技術サービス、特にマイケル・ケインとジェイク・ダグラスのビデオ撮影に感謝したいと思います。モノクローナル抗体抗体は、UCバークレーとユニバーシテブリニキム・ヴュルツブルクによってそれぞれ開発され、NIHのNICHDによって作成され、アイオワ大学生物学部で維持された発達研究ハイブリドーマ銀行から取得されました。ここで報告された研究は、ロードアイランド州の制度開発賞(IDeA)生物医学研究ネットワーク、国立衛生研究所の一般医学研究所の助成番号[P20GM103430]によって完全に支持されました。
資料
| Name | Company | Catalog Number | Comments |
| 10x Phosphate Buffered Saline | Fisher Scientific | BP3991 | |
| 24 well plates | Corning | 3473 | Hydrophobic, ultra-low attachment surface |
| 2x objective accessory | Olympus | 110AL2X | Screw-on attachment |
| Anti-ATP5A primary antibody | Abcam | ab14748 | Mouse monoclonal |
| Anti-bruchpilot primary antibody | Developmental Studies Hybridoma Bank | nc82 | Mouse monoclonal |
| Anti-discs large primary antibody | Developmental Studies Hybridoma Bank | 4F3 | Mouse monoclonal |
| Anti-hrp primary antibody | Jackson Immuno Research | 123-605-021 | Alexa Fluor 647 conjugated polyclonal |
| Anti-polyubiquitin (FK2) primary antibody | Millipore Sigma | 04-263 | Mouse monoclonal |
| Confocal Microscope | Olympus | FV1000 | Objectives (NA): 10x (0.4), 20x (0.85), 40x (1.20), 60x (1.42), 100x (1.40) |
| Coverslips | Corning | 285022 | 160-190 mm thickness |
| Dissecting forceps | Fine Science Tools | 11252-00 | Dumont #5SF |
| Dissecting Microscope | Olympus | SZ61 | |
| Formaldehyde | Fisher Scientific | BP531-500 | 37% stock stabilized with methanol |
| Goat anti-mouse secondary antibody | Jackson Immuno Research | 115-545-146 | Alexa Fluor 488 conjugated |
| Goat Serum | Novus Biologicals | NB036768 | 0.2 mm filtered |
| Laboratory sealing tape | Fisher Scientific | 03-448-254 | Parafilm M |
| Methanol | Fisher Scientific | A413 | |
| Microscope Slides | Fisher Scientific | 12-550-123 | 76mm x 25mm |
| Mounting media | Molecular Probes | S36972 | Slowfade Diamond mounting media |
| Nonionic surfactant | Acros Organics | 215680010 | Triton-X 100 |
| Nutator | Fisher Scientific | S06622 | |
| Phalloidin | Invitrogen | A34055 | Alexa Fluor 555- conjugated |
| Sharpening stone | Fine Science Tools | 29008-01 | |
| Silicone elastomer | Electron Microscopy Sciences | 2423610 | Sylgard 184 |
参考文献
- McDermott, C. J., Shaw, P. J. Diagnosis and management of motor neurone disease. BMJ. 336 (7645), 658-662 (2008).
- Global Collaborators, G. B. D. M. N. D. Global, regional, and national burden of motor neuron diseases 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurology. 17 (12), 1083-1097 (2018).
- Foster, L. A., Salajegheh, M. K. Motor Neuron Disease: Pathophysiology, Diagnosis, and Management. American Journal of Medicine. 132 (1), 32-37 (2019).
- Bede, P., Pradat, P. F. Editorial: Biomarkers and Clinical Indicators in Motor Neuron Disease. Frontiers in Neurology. 10, 1318 (2019).
- Clark, J. A., Southam, K. A., Blizzard, C. A., King, A. E., Dickson, T. C. Axonal degeneration, distal collateral branching and neuromuscular junction architecture alterations occur prior to symptom onset in the SOD1(G93A) mouse model of amyotrophic lateral sclerosis. Journal of Chemical Neuroanatomy. 76, 35-47 (2016).
- Martineau, E., Di Polo, A., Van de Velde, C., Robitaille, R. Dynamic neuromuscular remodeling precedes motor-unit loss in a mouse model of ALS. Elife. 7, (2018).
- Shahidullah, M., et al. Defects in synapse structure and function precede motor neuron degeneration in Drosophila models of FUS-related ALS. Journal of Neuroscience. 33 (50), 19590-19598 (2013).
- Tremblay, E., Martineau, E., Robitaille, R. Opposite Synaptic Alterations at the Neuromuscular Junction in an ALS Mouse Model: When Motor Units Matter. Journal of Neuroscience. 37 (37), 8901-8918 (2017).
- Harris, K. P., Littleton, J. T. Transmission, Development, and Plasticity of Synapses. Genetics. 201 (2), 345-375 (2015).
- Beramendi, A., Peron, S., Casanova, G., Reggiani, C., Cantera, R. Neuromuscular junction in abdominal muscles of Drosophila melanogaster during adulthood and aging. Journal of Comparative Neurology. 501 (4), 498-508 (2007).
- Banerjee, S., et al. Miniature neurotransmission is required to maintain Drosophila synaptic structures during ageing. Nature Communications. 12 (1), 4399 (2021).
- Liao, S., Broughton, S., Nassel, D. R. Behavioral Senescence and Aging-Related Changes in Motor Neurons and Brain Neuromodulator Levels Are Ameliorated by Lifespan-Extending Reproductive Dormancy in Drosophila. Frontiers in Cellular Neuroscience. 11, 111 (2017).
- Mahoney, R. E., Rawson, J. M., Eaton, B. A. An age-dependent change in the set point of synaptic homeostasis. Journal of Neuroscience. 34 (6), 2111-2119 (2014).
- Fernandes, J. J., Keshishian, H. Development of the adult neuromuscular system. International Review of Neurobiology. 43, 221-239 (1999).
- Truman, J. W. Metamorphosis of the central nervous system of Drosophila. Journal of Neurobiology. 21 (7), 1072-1084 (1990).
- Baek, M., Mann, R. S. Lineage and birth date specify motor neuron targeting and dendritic architecture in adult Drosophila. Journal of Neuroscience. 29 (21), 6904-6916 (2009).
- Enriquez, J., et al. Specification of individual adult motor neuron morphologies by combinatorial transcription factor codes. Neuron. 86 (4), 955-970 (2015).
- Soler, C., Daczewska, M., Da Ponte, J. P., Dastugue, B., Jagla, K. Coordinated development of muscles and tendons of the Drosophila leg. Development. 131 (24), 6041-6051 (2004).
- Guan, W., Venkatasubramanian, L., Baek, M., Mann, R. S., Enriquez, J. Visualize Drosophila Leg Motor Neuron Axons Through the Adult Cuticle. Journal of Visualized Experiments. (140), e58365 (2018).
- Agudelo, A., et al. Age-dependent degeneration of an identified adult leg motor neuron in a Drosophila SOD1 model of ALS. Biology Open. 9 (10), (2020).
- Fernius, J., Starkenberg, A., Thor, S. Bar-coding neurodegeneration: identifying subcellular effects of human neurodegenerative disease proteins using Drosophila leg neurons. Disease Models & Mechanisms. 10 (8), 1027-1038 (2017).
- Sreedharan, J., Neukomm, L. J., Brown, R. H., Freeman, M. R. Age-Dependent TDP-43-Mediated Motor Neuron Degeneration Requires GSK3, hat-trick, and xmas-2. Current Biology. 25 (16), 2130-2136 (2015).
- Patel, N. H. Imaging neuronal subsets and other cell types in whole-mount Drosophila embryos and larvae using antibody probes. Methods in Cell Biology. 44, 445-487 (1994).
- Guirado, R., Carceller, H., Castillo-Gomez, E., Castren, E., Nacher, J. Automated analysis of images for molecular quantification in immunohistochemistry. Heliyon. 4 (6), 00669 (2018).
- Castells-Nobau, A., et al. Two Algorithms for High-throughput and Multi-parametric Quantification of Drosophila Neuromuscular Junction Morphology. Journal of Visualized Experiments. (123), e55395 (2017).
- Brown, J. R., Phongthachit, C., Sulkowski, M. J. Immunofluorescence and image analysis pipeline for Drosophila motor neurons. Biology Methods and Protocols. 4 (1), (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved