Method Article
Dissection et immunohistochimie de la jambe adulte de la drosophile pour détecter les changements à la jonction neuromusculaire d’un motoneurone identifié
Dans cet article
Résumé
Nous décrivons une technique de dissection qui préserve l’architecture de la jonction neuromusculaire et permet une étude immunocytochimique détaillée des motoneurones dans la jambe de la drosophile adulte.
Résumé
Drosophila melanogaster représente un modèle génétiquement traitable pour étudier la structure et la fonction neuronales, ainsi que les changements ultérieurs dans les états pathologiques. La jonction neuromusculaire larvaire bien caractérisée est souvent utilisée pour de telles études. Cependant, le développement larvaire rapide suivi d’une histolyse musculaire et d’un remodelage du système nerveux pendant la métamorphose rend ce modèle problématique pour l’étude des changements dégénératifs lents dépendant de l’âge comme ceux qui se produisent dans la sclérose latérale amyotrophique. Alternativement, les mouches adultes vivent pendant 90 jours et la jambe adulte peut être utilisée pour étudier les changements des motoneurones au cours de la vie adulte en utilisant l’imagerie fluorescente in vivo à travers la cuticule. Ici, nous décrivons une technique de dissection des jambes couplée à l’immunocytochimie, qui permet d’étudier les changements moléculaires à la jonction neuromusculaire des motoneurones de jambe adultes identifiés. Ces techniques peuvent être couplées à une myriade d’anticorps marquant à la fois les structures pré- et post-synaptiques. Ensemble, ces procédures permettent une caractérisation plus complète des changements lents en fonction de l’âge chez les mouches adultes et peuvent être appliquées à plusieurs modèles de maladies des motoneurones.
Introduction
Les maladies des motoneurones (MN) englobent un groupe de conditions hétérogènes qui comprennent la dégénérescence progressive conduisant à la fonte musculaire et à la paralysie en tant que phénotype clinique primaire1. Bien que rare avec une prévalence mondiale de 4,5 pour 100 000, cette prévalence devrait augmenter avec le vieillissement de la population2. La sclérose latérale amyotrophique (SLA) est la maladie MN la plus courante (MND) et est généralement mortelle dans un court laps de temps après le diagnostic sans qu’aucun traitement modificateur de la maladie ne soit disponible3. Les MND partagent en commun une phase présymptomatique prolongée avec des changements précoces de biomarqueurs moléculaires et des changements d’imagerie fonctionnelle observés chez les patients4. Une pathologie cellulaire présymptomatique précoce est également observée dans des modèles de maladies non humaines5,6,7,8. L’étude des changements précoces à la jonction neuromusculaire est importante pour comprendre la pathogenèse de la maladie MN et peut aider à développer des diagnostics précoces et des thérapies potentielles.
Il existe une multitude d’outils génétiques et moléculaires chez la drosophile pour disséquer la structure et la fonction de la jonction neuromusculaire (NMJ, voir9 pour une revue de la NMJ larvaire bien caractérisée). Ces outils combinés à une courte durée de vie font de la drosophile un excellent modèle pour étudier les changements neurodégénératifs au NMJ. Plus précisément, les NM innervant les muscles adultes sont présents tout au long de la vie adulte d’environ 90 jours et sont soumis à des processus de vieillissement normaux10,11,12,13. Les NM adultes offrent donc l’occasion d’étudier les changements dégénératifs lents contrairement aux NMJ larvaires qui n’existent que pendant une courte période d’environ 1 semaine avant la métamorphose14,15.
Ici, nous décrivons une procédure de dissection qui nous permet d’effectuer une analyse immunocytochimique des MN dans la jambe adulte. Chaque jambe adulte est innervée par environ 50 MN, qui se synapsent sur la jambe musculaire associée pour conduire la locomotion. L’anatomie de la jambe, la physiologie mécanique et la neurobiologie ont été bien décrites16,17,18. Les tonnelles axonales des NM de jambes ont déjà été caractérisées par imagerie par cuticule dans des populations cellulaires remplies à l’arrière ou génétiquement marquées à l’aide du système bipartite Gal4 / UAS et des méthodes d’imagerie ont été publiées précédemment19. Les méthodes de dissection présentées ici préservent la morphologie des ramifications axonales et nous permettent d’exploiter une gamme variée d’anticorps pour marquer différents composants moléculaires du NMJ. Nos travaux précédents se sont concentrés sur les projections d’un MN défini dans la jambe métathoracique (3ème), qui innerve le muscle releveur du tibia (tilm) et montre des modèles d’arborisation et des nombres de boutons cohérents. Initialement, nous avons étudié les changements dépendant de l’âge chez les mutants de la superoxyde dismutase 1 (dsod1) de la drosophile et avons trouvé des altérations compatibles avec le démantèlement du NMJ20. Ces méthodes de dissection offrent la possibilité de mieux caractériser les changements dégénératifs lents au NMJ pour d’autres modèles de SLA, des études de base sur le vieillissement et d’autres maladies associées à la MN.
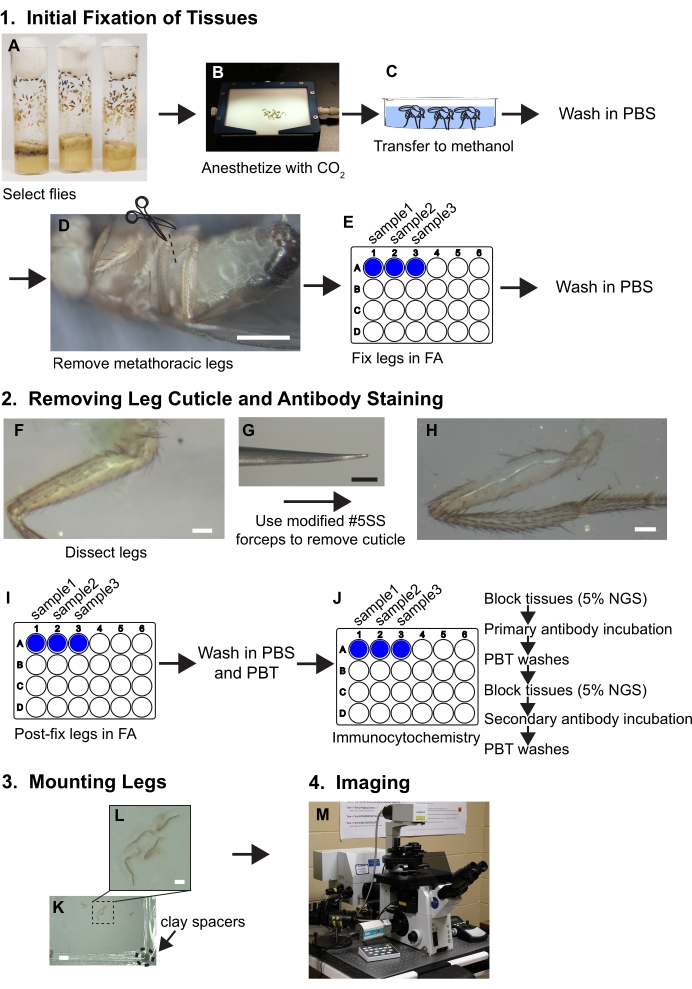
Graphique 1. Résumé du flux de travail pour disséquer les jambes. Voir le protocole pour les étapes détaillées. (A,B) Les mouches sont sélectionnées et anesthésiées. (C) Les mouches sont transférées au méthanol et lavées avec du PBS. (D) Les jambes métathoraciques sont enlevées à la base de la coxa tout en visualisant avec un microscope à dissection (grossissement ~ 30x); barre d’échelle = 500 μm. (E) Les jambes sont ensuite fixées dans une solution de formaldéhyde/PBS (FA) à 3,7 % pendant 30 minutes dans des puits de plaques de 24 puits, puis l’AF est éliminée par lavage au PBS. (F, G, H) Les jambes sont transférées sur des plateaux de dissection en élastomère de silicone et un morceau de cuticule est retiré du fémur proximal à l’aide d’une pince biseautée tout en visualisant sous un microscope à dissection à 80x; barre d’échelle = 50 μm. (I) Les jambes sont fixées après la dissection dans FA et lavées dans PBS puis PBT (PBS + 0,1% de tensioactif non ionique). (J) Les jambes sont soumises à une coloration immunocytochimique. (K,L) Les pieds sont transférés sur une lame de verre, dégagés dans un support de montage et recouverts d’un couvercle contenant des entretoises en argile; barres d’échelle = 2 mm et 500 μm. (M) Les jambes sont imagées par microscopie confocale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocole
Les procédures de préparation des solutions de travail utilisées conjointement avec le présent protocole sont décrites dans le tableau 1.
| Réactif | Préparation | Stockage | |||
| PBS | Faire un stock de travail de 1x PBS à partir d’une solution mère 10x PBS en diluant dans de l’eau distillée. Le pH du stock de PBS de travail doit être de 7,2 à 7,4 | 4 °C pendant plus de 1 mois jusqu’à ce que la contamination bactérienne soit visible. | |||
| PBT | 1x solution de PBS avec 0,1% de tensioactif non ionique. | 4 °C pendant plus de 1 mois jusqu’à ce que la contamination bactérienne soit visible. | |||
| FA | Solution de formaldéhyde à 3,7% fabriquée à partir d’un stock de formaldéhyde à 37% et diluée dans 1x PBS. | Température ambiante. Faire frais chaque jour de dissection | |||
| ATTENTION : Le formaldéhyde fourni sous forme de solution mère à 37 % est un cancérogène potentiel et doit être dilué dans une hotte. | |||||
| 5 % de NGS | 5% de sérum de chèvre normal dilué dans du PBT. Le sérum utilisé doit correspondre à l’espèce de l’anticorps secondaire à utiliser. | 4 °C pendant plusieurs semaines jusqu’à ce que la contamination bactérienne soit visible | |||
Tableau 1. Solutions pour effectuer l’immunocytochimie de la jambe de la drosophile adulte .
1. Fixation initiale des tissus
- Sélectionnez environ 10 mouches pour chaque génotype et âge. Anesthésier sur une aire de mouche sous dioxyde de carbone (Figure 1A, B).
REMARQUE: Commencez avec plus de mouches que nécessaire pour assurer une taille d’échantillon suffisamment grande après la dissection. - À l’aide d’un pinceau, transférer les mouches au méthanol froid dans un puits ou un plat en verre pendant environ 30 secondes à 1 minute (Figure 1C). Le méthanol solubilise les hydrocarbures cuticulaires et les mouches peuvent maintenant être immergées plutôt que de flotter dans des solutions aqueuses.
- Avec les pinces, transférez soigneusement les mouches sur PBS. Rincez 3x dans du PBS glacé pour éliminer l’excès de méthanol et garder les mouches dans le PBS sur la glace jusqu’à la dissection et la fixation. À ce stade, disséquez les mouches et fixez-les dans les plus brefs délais (<30 minutes).
- Pour isoler les pattes, transférer les mouches dans une boîte de dissection en élastomère de silicone remplie de PBS froid, retirer les pattes métathoraciques à la coxa à l’aide de deux paires de pinces Dumont #5 ou couper les jambes avec des ciseaux Vanna (Figure 1D). Transférer les jambes dans un puits dans une plaque de 24 puits en plastique remplie de 1 mL de PBS et garder la plaque sur la glace jusqu’à ce que toutes les jambes soient retirées et transférées dans des puits.
REMARQUE: Chaque puits peut contenir au moins 20 jambes. - Remplacez la solution PBS par 1 mL de solution FA et faites pivoter sur un écrou pendant 30 minutes (Figure 1E). Le réglage du nutateur doit être réglé à une vitesse moyenne (17 tr/min). Assurez-vous que les jambes sont complètement immergées dans la solution DE FA pendant ce temps pour une fixation adéquate.
- Pour éliminer la solution de FA, laver dans 1 mL de PBS 3x rapidement suivi de 3 lavages supplémentaires pendant 5 minutes chacun dans 1 mL de PBS. Maintenir les tissus dans 1 mL de PBS sur la glace avant et pendant les étapes de dissection décrites ci-dessous.
2. Enlever la cuticule de la jambe et la coloration des anticorps
- Retrait de la cuticule de la jambe
- Les pinces à disséquer sont essentielles au succès. Introduisez de légères courbures parallèles dans les deux broches à l’extrémité de la pince super fine #5 pour fournir un biseau qui permet à la cuticule d’être saisie superficiellement plutôt que d’être piquée, ce qui peut ruiner le tissu (Figure 1F, G).
REMARQUE : Les broches pliées en parallèle doivent toujours entrer en contact les unes avec les autres sur toute la longueur de la broche lorsqu’elles sont fermées (Figure 2). - Transférer les jambes dans un plat en élastomère de silicone dans PBS pour la dissection. Orientez une jambe de manière à ce que la face antérieure soit orientée vers le haut (voir la figure 3 pour l’anatomie et l’orientation de la jambe). À l’aide d’une pince, maintenez le segment du tibia contre le plat en élastomère de silicone. À l’aide des autres pinces maintenues en biseau vers le bas, attrapez un morceau de cuticule à l’extrémité distale du fémur et tirez dans la direction proximale vers le trochanter.
- Continuez à retirer méthodiquement la cuticule jusqu’à ce que le muscle nu soit visible dans toute l’extrémité proximale du fémur (Figure 1F, G, H).
REMARQUE: N’établissez un contact superficiel avec les jambes qu’en utilisant le côté biseauté de la pince pour éviter de tirer sur les muscles. - Une fois que toutes les jambes sont disséquées, remplacez PBS par FA pour post-fixer les jambes pendant 30 minutes en secouant sur un nutateur à vitesse moyenne (Figure 1I). Laver les échantillons dans 1 mL de PBS pendant 3 fois rapidement, puis 3 fois pendant 5 minutes chacun dans PBT (Figure 1J).
REMARQUE: Si vous colorez avec l’anticorps monoclonal NC82 (anti-bruchpilot) pour marquer les zones actives, fixez-le pendant 20 minutes car cet antigène est sensible à des fixations plus longues.
- Les pinces à disséquer sont essentielles au succès. Introduisez de légères courbures parallèles dans les deux broches à l’extrémité de la pince super fine #5 pour fournir un biseau qui permet à la cuticule d’être saisie superficiellement plutôt que d’être piquée, ce qui peut ruiner le tissu (Figure 1F, G).
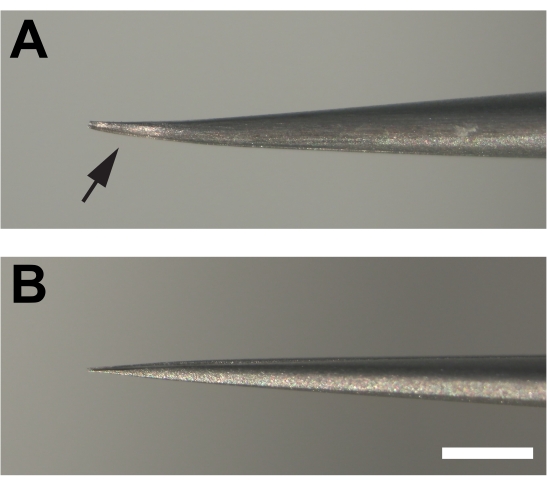
Graphique 2. Pinces modifiées utilisées pour disséquer les jambes adultes. (A) Les extrémités des pinces sont pliées puis aplaties en bas (flèche) créant un biseau en l limant sur une pierre à aiguiser. B) En revanche, les broches des pinces non modifiées ne sont pas pliées. Barre d’échelle = 1 mm Veuillez cliquer ici pour voir une version plus grande de cette figure.
- Coloration des anticorps
- Pour bloquer les tissus pour la coloration des anticorps, remplacez 1 mL de PBT par une solution bloquante composée de 1 mL de NGS à 5% dilué dans du PBT. Incuber les jambes disséquées pendant 4 heures à température ambiante ou toute la nuit à 4 °C tout en se balançant sur un nutateur à vitesse moyenne (17 tr/min). Pendant toutes les incubations, recouvrir les puits de ruban adhésif d’étanchéité en plus du couvercle en plastique (Figure 1J).
REMARQUE: 24 plaques de puits sont utilisées pour l’immunocytochimie plutôt que pour la microcentrifugation de 1,5 mL ou 2 mL parce que des tentatives antérieures d’utilisation de tubes de microcentrifugation ont entraîné des jambes cassées et des tissus endommagés. - Retirer la solution bloquante et ajouter 300 mL d’anticorps primaires dilués dans une solution bloquante fraîche. Le petit volume d’anticorps utilisé doit être suffisant pour couvrir les tissus. Refermer les puits avec du ruban d’étanchéité de laboratoire et un couvercle en plastique et incuber pendant la nuit à 4 °C en agitant un nutateur à vitesse moyenne (Figure 1J). Les informations et les concentrations de réactifs d’anticorps de travail utilisées dans ces études sont décrites dans le tableau 2.
- Lavez les anticorps primaires dans 1 mL de PBT pendant 3 fois brièvement, puis 3 fois pendant 15 minutes chacun (Figure 1J).
REMARQUE: Les anticorps primaires dilués peuvent être conservés et réutilisés s’ils sont conservés à 4 ° C pendant 2 semaines. - Bloquer à nouveau les tissus dans 1 mL de 5 % de NGS pendant au moins 2 heures à température ambiante ou pendant la nuit à 4 °C (figure 1J).
- Retirer la solution bloquante NGS à 5 % et ajouter 300 μL des anticorps secondaires conjugués fluorescents dilués appropriés. De plus, ajoutez une dilution de 1:2000 de phalloïdine conjuguée par fluorescence pour marquer le muscle (Figure 1J).
- Pour les incubations d’anticorps secondaires, sceller les puits avec du ruban d’étanchéité de laboratoire et un couvercle. En outre, enveloppez les plaques dans du papier d’aluminium pour protéger les fluorophores de la lumière. Incuber pendant 6 à 8 heures à température ambiante ou toute la nuit à 4 °C.
- Laver les anticorps secondaires et la phalloïdine comme décrit à l’étape 2.2.3 ci-dessus. Couvrez les plaques avec du papier d’aluminium entre les lavages pour protéger les fluorophores de la lumière.
- Pour bloquer les tissus pour la coloration des anticorps, remplacez 1 mL de PBT par une solution bloquante composée de 1 mL de NGS à 5% dilué dans du PBT. Incuber les jambes disséquées pendant 4 heures à température ambiante ou toute la nuit à 4 °C tout en se balançant sur un nutateur à vitesse moyenne (17 tr/min). Pendant toutes les incubations, recouvrir les puits de ruban adhésif d’étanchéité en plus du couvercle en plastique (Figure 1J).
3. Pieds de montage
- Transférez les jambes sur une glissière à l’aide d’une pince et orientez le côté antérieur vers le haut. Couvrez les pieds avec un support de montage (Figure 1K, L).
REMARQUE: Les pieds disséqués peuvent être aspirés avec une pointe de pipette P1000 si l’alésage inférieur est élargi en coupant avec une lame de rasoir. - Ajoutez des entretoises en argile à un couvercle de 22x22 mm2 (épaisseur n ° 1,5) en grattant les coins du couvercle sur une petite boule de pâte à modeler. Chaque coin doit avoir une petite quantité d’argile de 1 à 2 mm d’épaisseur (Figure 1K).
- Pour couvrir la glissière, ajoutez la lèvre de couverture avec les entretoises en argile orientées vers la glissière et poussez soigneusement sur les coins jusqu’à ce que la lèvre de couverture touche simplement la surface du fémur.
- Pour éviter l’évaporation, scellez les bords de la housse avec du vernis à ongles et laissez sécher dans un endroit sombre (environ 10 minutes) avant de les conserver à 4 °C jusqu’à l’imagerie.
4. Imagerie
- Image au microscope confocal (Figure 1M). Inclure un canal de lumière transmise pour mieux évaluer la qualité de la dissection et les échantillons avec des fibres musculaires visiblement perturbées dans la zone d’intérêt doivent être jetés.
- Commencez à imager des piles z avec un grossissement de 20x avec un zoom 2x et une profondeur d’image totale d’environ 40 mm correspondant à l’épaisseur du fémur. Pour la détection de signaux fluorescents, capturez des images à des résolutions compatibles avec l’échantillonnage Nyquist (nous utilisons 1024 x 1024 pixels avec un réglage de séjour de 8 à 10 μs / pixel). L’intensité du signal doit être dans la plage linéaire qui est obtenue en ajustant les paramètres de gain de haute tension. Une fois que les paramètres de gain sont définis pour une série d’échantillons dans une expérience, ils ne doivent pas être modifiés afin que les intensités du signal puissent être comparées entre les échantillons.
- Pour l’imagerie des boutons synaptiques et d’autres structures subcellulaires, capturez des images confocales à un grossissement de ≥60x. Les paramètres du détecteur doivent être dans la plage linéaire, tandis que la densité de pixels, les paramètres de séjour et la profondeur z doivent être similaires pour les images capturées à un grossissement inférieur (étape 4.1).
Résultats
La figure 4 montre un exemple représentatif d’une jambe métathoracique colorée avec de l’anti-hrp, de l’anti-dlg et de la phalloïdine. Pour les dissections qui enlèvent la cuticule de la partie proximale du fémur, des tonnelles stéréotypées seront apparentes près du tendon qui est facilement détecté par autofluorescence. Notez que la pénétration des anticorps dans la jambe se produit sur une courte distance au-delà de la région dans laquelle la cuticule a été enlevée (Figure 4A). Ces régions peuvent être imagées efficacement lorsqu’un signal de fluorescence fort est présent. L’imagerie à faible grossissement (20x avec un zoom 2x) permet de déterminer facilement 1) la quantité de cuticule enlevée et 2) si des dommages se sont produits pendant la dissection. L’augmentation du grossissement (60x) montre des projections stéréotypées sur le tilm (Figure 4B). Notre travail s’est concentré sur un MN, probablement dérivé de la lignée I-MN qui innerve le tilm dans le fémur proximal (encadré, Figure 4B et Figure 4C). L’augmentation du grossissement (100x avec zoom 2x) permet une visualisation efficace des boutons synaptiques (Figure 4D).
Pour étudier les changements morphologiques chez le NMJ adulte au fil du temps, nous avons déjà utilisé des mutants dsod1 comme modèle de la SLA. L’enflure des boutons se produit chez les mutants dsod1H71Y âgés par rapport à dsod1null et dsod1+ (Figure 5A, B). Au nmJ larvaire, l’anticorps monoclonal NC82 est souvent utilisé pour marquer les zones actives et ces structures peuvent être facilement visualisées chez le NMJ adulte (Figure 5C). Les branches axonales HRP faiblement positives sont abondantes chez les mutants dsod1H71Y et ces branches montrent souvent une localisation BRP faible et diffuse (flèches).
Important pour la neurodégénérescence, les anticorps disponibles dans le commerce peuvent détecter des protéines ubiquitinées souvent trouvées dans les agrégats, et nous avons détecté des agrégats ubiquitinés dans les axones terminaux des MN chez les mouches dsod1 mutantes âgées ainsi que dans les muscles (Figure 6A). En outre, les anticorps marquant les mitochondries peuvent également détecter des changements morphologiques avec l’âge (Figure 6B).
Pour certaines préparations, des lésions musculaires lors de la dissection rendent l’échantillon inutilisable. Au début, de tels dommages peuvent être fréquents, mais l’amélioration se produit avec la pratique. Des exemples de bonnes dissections sont la figure 7A, C tandis que les mauvaises dissections sont illustrées à la figure 7B, D. De mauvaises dissections provoquent une désorganisation des fibres musculaires détectée par microscopie à contraste de phase (Figure 7B) ou des fibres musculaires manquantes visualisées par phalloïdine conjuguée fluorescente (Figure 7D, flèche). La combinaison de l’utilisation de la phalloïdine pour marquer les muscles et des images lumineuses transmises peut aider à détecter de tels dommages musculaires qui peuvent ne pas être apparents lors de la visualisation sous un microscope à dissection.
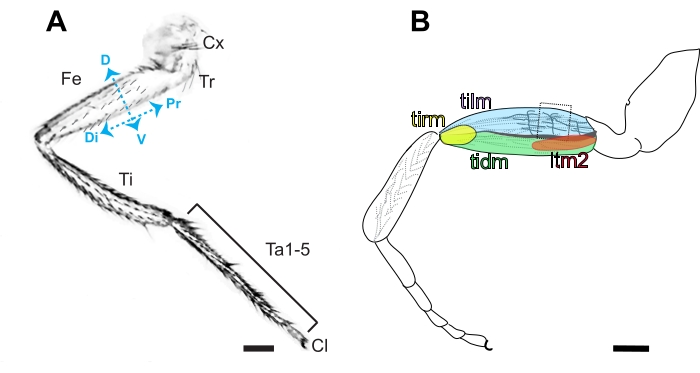
Graphique 3. Anatomie de la jambe de la drosophile . (A) Schéma de la face antérieure d’une jambe métathoracique, caractérisé par la présence de poils contrairement à la cuticule nue proéminente présente sur la face postérieure. La jambe segmentée est composée de la coxa (Cx), du trochanter (Tr), du fémur (Fe), du tibia (Ti), de 5 segments tarsiens (Ta1-5) et de la griffe (Cl) dans l’ordre du proximal (Pr) au distal (Di). Les côtés dorsal (D) et ventral (V) du fémur sont également indiqués. Barre d’échelle = 100 μm. (B) Schéma du fémur contenant le releveur du tibia (tilm), le dépresseur du tibia (tidm), le muscle tendineux long 2 (ltm2) et les muscles réducteurs du tibia (tirm) et les projections axonales dans le fémur proximal innervant le tilm. Ces projections axonales stéréotypées sont présumées dérivées des neuroblastes de la lignée I16, et la deuxième arborisation est la plus facile d’accès par dissection (encadrée). Barre d’échelle = 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
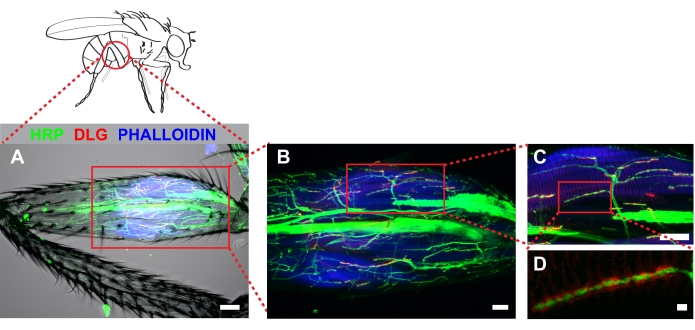
Graphique 4. Le fémur métathoracique disséqué a révélé une architecture MN stéréotypée innervant le tilm. L’immunocytochimie a été utilisée pour marquer les neurones (HRP), les disques larges (DLG) et les muscles (phalloïdine). Les piles Z ont été capturées par imagerie par microscopie confocale à travers l’ensemble du fémur et montrées comme une projection en série maximale. (A) Un canal lumineux transmis a également été inclus pour illustrer qu’aucun dommage musculaire détectable ne s’est produit pendant la dissection. L’image a été capturée à un grossissement de 20x, barre d’échelle = 50 μm. (B) Tonnelles identifiées associées au tilm (zone en boîte, centre), barre d’échelle = 20 μm; et (C) à un grossissement de 60x, barre d’échelle = 20 μm. (D) La DLG entourant les boutons était apparente chez les animaux de type sauvage lorsqu’ils étaient photographiés à un grossissement de 100x avec un zoom de 2x; barre d’échelle = 2 μm Veuillez cliquer ici pour voir une version agrandie de cette figure.
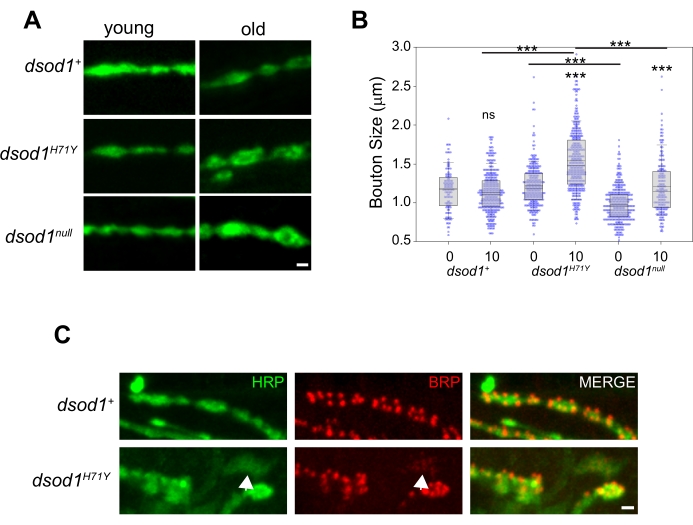
Graphique 5. Exemple de changements dépendant de l’âge dans la morphologie des boutons qui peuvent être détectés à l’aide de la technique de dissection de la jambe. Un gonflement de la bouton est observé chez les mutants dsod1H71Y âgés. (A) Images représentatives de boutons colorés HRP de mouches jeunes (nouvellement écloses, jour 0 adultes) et âgées (jour 10), barre d’échelle = 1 μm. (B) Les tailles de boutons ont été quantifiées à partir des génotypes respectifs à l’aide de la fonction de mesure dans ImageJ. p<0,0001 (ANOVA 2 voies avec test Tukey post-hoc). (C) Zones actives à l’intérieur des boutons synaptiques marqués avec l’anticorps monoclonal NC82 (anti-bruchpilot); barre d’échelle = 1 μm. Figure modifiée à partir de20Veuillez cliquer ici pour voir une version agrandie de cette figure.
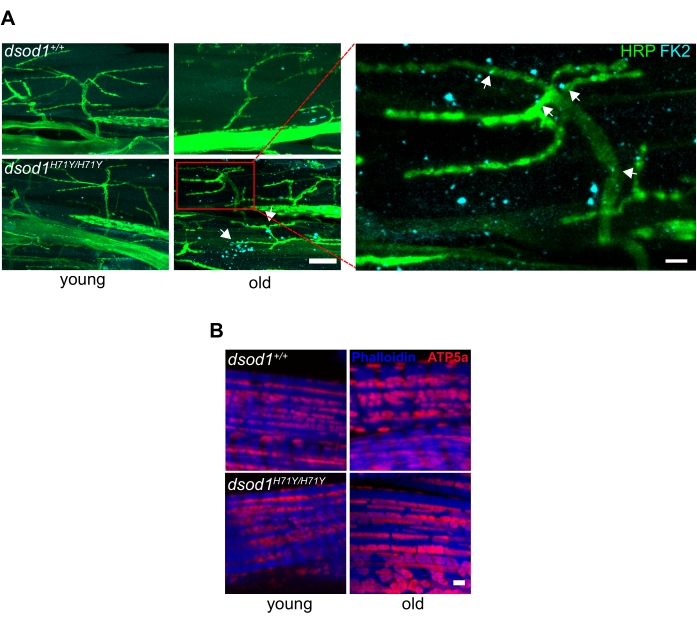
Graphique 6. Marqueurs communs associés à la maladie neurodégénérative utilisés dans les préparations de jambes de drosophiles. (A) Des agrégats polyubiquitinés subcellulaires sont détectés dans les axones terminaux et les muscles des mouches dsod1H71Y âgées. L’immunocytochimie utilisant l’anti-polyubiquitine (FK2) détecte les puncta (flèches) chez les dsod1H71Y/H71Y vieillis, barre d’échelle = 20 μm (à gauche) et 5 μm (à droite). (B) Les mitochondries enflées peuvent être détectées à l’aide d’anti-ATP5A, barre d’échelle = 1 μm. Figure modifiée à partir de20Veuillez cliquer ici pour voir une version agrandie de cette figure.
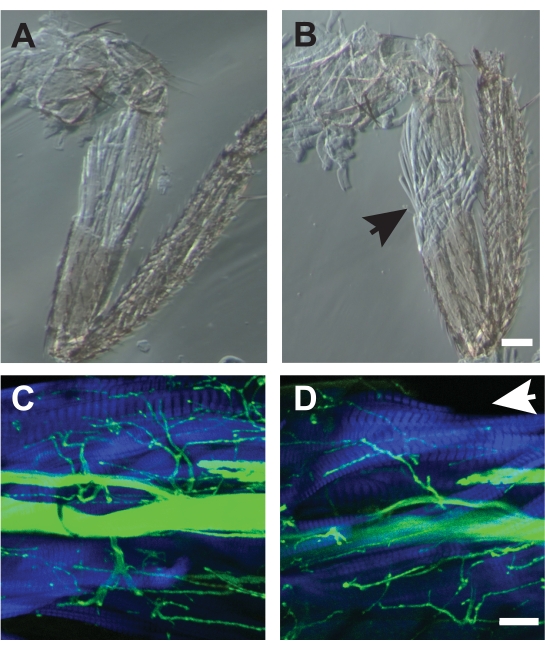
Graphique 7. Exemples de bonnes et de mauvaises dissections. (A) Dissection qui n’a pas perturbé l’architecture musculaire sous-jacente. (B) Un exemple de mauvaise dissection qui a montré des fibres musculaires effilochées (flèche) et qui n’a pas pu être utilisé pour l’analyse. Les deux échantillons ont été imagés par microscopie à contraste de phase. Barre d’échelle = 50 μm. (C) Exemple d’une bonne dissection imagée par microscopie confocale avec HRP (vert) et phalloïdine (bleu). (D) Une mauvaise dissection manquant de fibres musculaires dorsales du TILM manquantes (flèche). Barre d’échelle = 50 μm Veuillez cliquer ici pour voir une version plus grande de cette figure.
| Anticorps/Coloration | Dilution* |
| Anti-ATP5A | 1:500 |
| Anti-bruchpilot (nc82) | 1:20 |
| Protéine de chaîne anti-cystéine (ab49) | 1:50 |
| Anti-disques de grande taille (4F3) | 1:200 |
| Anti-hrp | 1:550 |
| Anti-polyubiquitine (FK2) | 1:1000 |
| Anti-repo (8D12) | 1:5 |
| Anticorps secondaire anti-souris de chèvre | 1:800 |
| Phalloïdine | 1:2000 |
| *Diluer dans 5% NGS |
Tableau 2. Anticorps et dilutions. Les fournisseurs commerciaux des anticorps utilisés dans ces études sont énumérés dans la Liste des matériaux.
Discussion
La jambe adulte de la drosophile est un modèle idéal pour étudier la neurodégénérescence étant donné la simplicité relative avec des MN bien caractérisées cartographiées à partir de lignées de neuroblastes et de modèles d’arborisation stéréotypés. Plusieurs rapports ont déjà utilisé des NM de jambe pour l’étude des maladies neurodégénératives21,22. Ces études ont utilisé des raies exprimant la GFP combinées à une analyse en mosaïque avec un marqueur cellulaire répressible (MARCM) pour imager à travers la cuticule et ont documenté une série de changements morphologiques. L’imagerie des NMJ adultes par immunocytochimie avec cuticule réséquée permet une caractérisation plus poussée avec la capacité de suivre les changements moléculaires complexes à l’aide d’une boîte à outils d’anticorps disponibles.
La partie immunocytochimie de ce protocole est relativement standard et peut être mise en œuvre indépendamment du génotype (voir 23 pour une excellente description des méthodes générales de coloration des anticorps à utiliser avec la drosophile). En outre, des paramètres tels que l’intensité de fluorescence, la longueur des branches axonales, le nombre et la taille des boutons peuvent être déterminés à l’aide de diverses macros ImageJ disponibles une fois que les images sont capturées et que des méthodes détaillées d’analyse quantitative ont été publiées (par exemple, voir 24,25,26). Ainsi, la technique de dissection est la principale innovation décrite ici. Avant la dissection, les mouches sont immergées dans un alcool pour dépouiller les hydrocarbures cuticulaires. L’éthanol et le méthanol sont couramment utilisés à cette fin; cependant, nous n’avons utilisé que du méthanol. Plusieurs facteurs sont essentiels au succès de la dissection: Tout d’abord, l’utilisation de pinces modifiées avec un biseau permet un contact très superficiel avec la cuticule. Deuxièmement, en utilisant un microscope à dissection capable d’un grossissement total de 60 à 100x afin que la surface de la cuticule soit clairement visible. Pour les microscopes avec un grossissement maximal inférieur, des objectifs 2x sont disponibles pour la plupart des marques courantes et devraient être suffisants lorsqu’ils sont combinés avec des lentilles existantes. Troisièmement, l’étape de fixation initiale rend la cuticule cassante et plus facile à retirer sans endommager le muscle en dessous. Une fixation excessive à cette étape rend toute la jambe trop raide pour une dissection efficace. Par conséquent, la fixation initiale doit être limitée à 30 minutes. Le fixateur de formaldéhyde ne pénétrera pas suffisamment pour réticuler efficacement le tissu sous-jacent pendant cette courte période et donc une deuxième étape de fixation est nécessaire. Avant la deuxième fixation, les tissus doivent être maintenus sur la glace pour éviter la dégradation et les changements de morphologie. Quatrièmement, nous avons constaté qu’il est également important de disséquer les échantillons alors que le froid est important, probablement pour des raisons similaires en ce sens que la cuticule est fragile et qu’un petit morceau peut être plus facilement enlevé.
Avec de la pratique, nous constatons qu’environ 50% des dissections seront utilisables sans lésion tissulaire discernable. Bien que ce pourcentage puisse sembler faible par rapport à certains autres tissus, la procédure de dissection est rapide et de nombreuses jambes peuvent être traitées en 30 à 60 minutes. Par conséquent, même si les taux de réussite sont faibles au départ, il est possible d’obtenir 4 à 5 bons échantillons pour chaque groupe expérimental. Cependant, une limitation peut être le nombre de mouches disponibles à un moment donné si les génotypes et/ou l’âge entraînent une létalité importante.
Une autre limitation est que nous n’avons pas été en mesure de disséquer d’autres zones de la jambe au-delà de la région proximale du fémur en raison de la taille. Ainsi, nous pouvons étudier les tonnelles MN identifiées innervant le TILM de manière fiable et il est possible de disséquer la cuticule au-dessus du muscle dépresseur du tibia avec de petits changements dans la façon dont la jambe est orientée lors de la dissection. Cependant, l’accès à d’autres régions de la jambe s’est avéré plus difficile sans perturber l’architecture axonale pendant la dissection.
Ici, nous présentons des méthodes de dissection pour détecter les changements au NMJ adulte pour les MN définis innervant le tilm en utilisant l’immunocytochimie. La jambe est utile en tant que système simple, innervé par seulement ~ 50 MN et contenant 14 muscles avec une anatomie bien décrite. La préparation disséquée des jambes peut être utilisée à travers les génotypes et une série d’anticorps est disponible pour la visualisation NMJ sans qu’il soit nécessaire de constituer des stocks génotypiquement complexes de constructions de gènes rapporteurs dans des arrière-plans mutants. Cette approche permettra une caractérisation plus détaillée des changements au NMJ pour les maladies MN et d’autres conditions liées à l’âge.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Nous remercions Eric Roberts pour ses conseils en matière d’imagerie. Nous tenons également à remercier les services de technologie de l’information du Rhode Island College et en particulier Michael Caine et Jake Douglas pour la vidéographie. Les anticorps monoclonaux anti-dlg et anti-brp ont été développés par UC-Berkeley et Universitaetsklinikim Wuerzburg respectivement, et ont été obtenus à partir de la Developmental Studies Hybridoma Bank, créée par le NICHD du NIH et maintenue à l’Université de l’Iowa, Département de biologie, Iowa City, IA 52242, États-Unis. La recherche rapportée ici a été entièrement soutenue par le Rhode Island Institutional Development Award (IDeA) Network of Biomedical Research Excellence de l’Institut national des sciences médicales générales des National Institutes of Health sous le numéro de subvention [P20GM103430].
matériels
| Name | Company | Catalog Number | Comments |
| 10x Phosphate Buffered Saline | Fisher Scientific | BP3991 | |
| 24 well plates | Corning | 3473 | Hydrophobic, ultra-low attachment surface |
| 2x objective accessory | Olympus | 110AL2X | Screw-on attachment |
| Anti-ATP5A primary antibody | Abcam | ab14748 | Mouse monoclonal |
| Anti-bruchpilot primary antibody | Developmental Studies Hybridoma Bank | nc82 | Mouse monoclonal |
| Anti-discs large primary antibody | Developmental Studies Hybridoma Bank | 4F3 | Mouse monoclonal |
| Anti-hrp primary antibody | Jackson Immuno Research | 123-605-021 | Alexa Fluor 647 conjugated polyclonal |
| Anti-polyubiquitin (FK2) primary antibody | Millipore Sigma | 04-263 | Mouse monoclonal |
| Confocal Microscope | Olympus | FV1000 | Objectives (NA): 10x (0.4), 20x (0.85), 40x (1.20), 60x (1.42), 100x (1.40) |
| Coverslips | Corning | 285022 | 160-190 mm thickness |
| Dissecting forceps | Fine Science Tools | 11252-00 | Dumont #5SF |
| Dissecting Microscope | Olympus | SZ61 | |
| Formaldehyde | Fisher Scientific | BP531-500 | 37% stock stabilized with methanol |
| Goat anti-mouse secondary antibody | Jackson Immuno Research | 115-545-146 | Alexa Fluor 488 conjugated |
| Goat Serum | Novus Biologicals | NB036768 | 0.2 mm filtered |
| Laboratory sealing tape | Fisher Scientific | 03-448-254 | Parafilm M |
| Methanol | Fisher Scientific | A413 | |
| Microscope Slides | Fisher Scientific | 12-550-123 | 76mm x 25mm |
| Mounting media | Molecular Probes | S36972 | Slowfade Diamond mounting media |
| Nonionic surfactant | Acros Organics | 215680010 | Triton-X 100 |
| Nutator | Fisher Scientific | S06622 | |
| Phalloidin | Invitrogen | A34055 | Alexa Fluor 555- conjugated |
| Sharpening stone | Fine Science Tools | 29008-01 | |
| Silicone elastomer | Electron Microscopy Sciences | 2423610 | Sylgard 184 |
Références
- McDermott, C. J., Shaw, P. J. Diagnosis and management of motor neurone disease. BMJ. 336 (7645), 658-662 (2008).
- Global Collaborators, G. B. D. M. N. D. Global, regional, and national burden of motor neuron diseases 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurology. 17 (12), 1083-1097 (2018).
- Foster, L. A., Salajegheh, M. K. Motor Neuron Disease: Pathophysiology, Diagnosis, and Management. American Journal of Medicine. 132 (1), 32-37 (2019).
- Bede, P., Pradat, P. F. Editorial: Biomarkers and Clinical Indicators in Motor Neuron Disease. Frontiers in Neurology. 10, 1318 (2019).
- Clark, J. A., Southam, K. A., Blizzard, C. A., King, A. E., Dickson, T. C. Axonal degeneration, distal collateral branching and neuromuscular junction architecture alterations occur prior to symptom onset in the SOD1(G93A) mouse model of amyotrophic lateral sclerosis. Journal of Chemical Neuroanatomy. 76, 35-47 (2016).
- Martineau, E., Di Polo, A., Van de Velde, C., Robitaille, R. Dynamic neuromuscular remodeling precedes motor-unit loss in a mouse model of ALS. Elife. 7, (2018).
- Shahidullah, M., et al. Defects in synapse structure and function precede motor neuron degeneration in Drosophila models of FUS-related ALS. Journal of Neuroscience. 33 (50), 19590-19598 (2013).
- Tremblay, E., Martineau, E., Robitaille, R. Opposite Synaptic Alterations at the Neuromuscular Junction in an ALS Mouse Model: When Motor Units Matter. Journal of Neuroscience. 37 (37), 8901-8918 (2017).
- Harris, K. P., Littleton, J. T. Transmission, Development, and Plasticity of Synapses. Genetics. 201 (2), 345-375 (2015).
- Beramendi, A., Peron, S., Casanova, G., Reggiani, C., Cantera, R. Neuromuscular junction in abdominal muscles of Drosophila melanogaster during adulthood and aging. Journal of Comparative Neurology. 501 (4), 498-508 (2007).
- Banerjee, S., et al. Miniature neurotransmission is required to maintain Drosophila synaptic structures during ageing. Nature Communications. 12 (1), 4399 (2021).
- Liao, S., Broughton, S., Nassel, D. R. Behavioral Senescence and Aging-Related Changes in Motor Neurons and Brain Neuromodulator Levels Are Ameliorated by Lifespan-Extending Reproductive Dormancy in Drosophila. Frontiers in Cellular Neuroscience. 11, 111 (2017).
- Mahoney, R. E., Rawson, J. M., Eaton, B. A. An age-dependent change in the set point of synaptic homeostasis. Journal of Neuroscience. 34 (6), 2111-2119 (2014).
- Fernandes, J. J., Keshishian, H. Development of the adult neuromuscular system. International Review of Neurobiology. 43, 221-239 (1999).
- Truman, J. W. Metamorphosis of the central nervous system of Drosophila. Journal of Neurobiology. 21 (7), 1072-1084 (1990).
- Baek, M., Mann, R. S. Lineage and birth date specify motor neuron targeting and dendritic architecture in adult Drosophila. Journal of Neuroscience. 29 (21), 6904-6916 (2009).
- Enriquez, J., et al. Specification of individual adult motor neuron morphologies by combinatorial transcription factor codes. Neuron. 86 (4), 955-970 (2015).
- Soler, C., Daczewska, M., Da Ponte, J. P., Dastugue, B., Jagla, K. Coordinated development of muscles and tendons of the Drosophila leg. Development. 131 (24), 6041-6051 (2004).
- Guan, W., Venkatasubramanian, L., Baek, M., Mann, R. S., Enriquez, J. Visualize Drosophila Leg Motor Neuron Axons Through the Adult Cuticle. Journal of Visualized Experiments. (140), e58365 (2018).
- Agudelo, A., et al. Age-dependent degeneration of an identified adult leg motor neuron in a Drosophila SOD1 model of ALS. Biology Open. 9 (10), (2020).
- Fernius, J., Starkenberg, A., Thor, S. Bar-coding neurodegeneration: identifying subcellular effects of human neurodegenerative disease proteins using Drosophila leg neurons. Disease Models & Mechanisms. 10 (8), 1027-1038 (2017).
- Sreedharan, J., Neukomm, L. J., Brown, R. H., Freeman, M. R. Age-Dependent TDP-43-Mediated Motor Neuron Degeneration Requires GSK3, hat-trick, and xmas-2. Current Biology. 25 (16), 2130-2136 (2015).
- Patel, N. H. Imaging neuronal subsets and other cell types in whole-mount Drosophila embryos and larvae using antibody probes. Methods in Cell Biology. 44, 445-487 (1994).
- Guirado, R., Carceller, H., Castillo-Gomez, E., Castren, E., Nacher, J. Automated analysis of images for molecular quantification in immunohistochemistry. Heliyon. 4 (6), 00669 (2018).
- Castells-Nobau, A., et al. Two Algorithms for High-throughput and Multi-parametric Quantification of Drosophila Neuromuscular Junction Morphology. Journal of Visualized Experiments. (123), e55395 (2017).
- Brown, J. R., Phongthachit, C., Sulkowski, M. J. Immunofluorescence and image analysis pipeline for Drosophila motor neurons. Biology Methods and Protocols. 4 (1), (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon