Method Article
てんかんのマウスモデルにおける熱誘発発作の行動スクリーニング
要約
この方法の目的は、マウスモデルにおける温熱療法または熱誘発発作をスクリーニングすることである。このプロトコルは、体温の上昇が発作につながるかどうかを判断するために、体温の継続的な監視を備えたカスタムメイドのチャンバの使用を記述しています。
要約
トランスジェニックマウスモデルは、てんかんを含むヒト神経学的障害の様々な側面を研究する上で強力なツールであることが証明されている。 SCN1A関連遺伝子てんかんは、不完全な浸透度および臨床的変動性を有する広範囲の発作性障害を含む。SCN1A変異は、単純で自己限定的な発熱関連熱性けいれん(FS)、熱性けいれんプラスを伴う中等度の遺伝子てんかん(GEFS+)からより重篤なDravet症候群(DS)まで、多種多様な発作表現型をもたらし得る。FSは遺伝子てんかんを患っていない6〜7歳未満の小児に一般的に見られるが、GEFS+患者のFSは成人期まで引き続き発生する。伝統的に、実験FSは、動物を乾燥空気または加熱ランプの流れに曝露することによってマウスにおいて誘導され、そして体温の変化速度はしばしば十分に制御されていない。ここでは、デジタル温度コントローラとヒーターを備えた扇風機を備えたプレキシガラスフロントを備えたカスタムメイドの加熱チャンバを説明し、加熱された強制空気を温度制御された方法でテストアリーナに送ることができます。直腸プローブを介して監視されるチャンバー内に配置されたマウスの体温は、チャンバー内の温度を上昇させることによって再現可能な方法で40〜42°Cに上昇させることができる。加熱期間中の動物の継続的な視覚的モニタリングは、野生型の同腹仔における行動発作を誘発しない体温でFS変異を有するマウスにおける熱誘発性発作の誘発を実証する。動物はチャンバーから簡単に取り出して冷却パッドの上に置き、体温を急速に正常に戻すことができます。この方法は、てんかんマウスモデルにおける熱誘発発作の発生のための単純で迅速で再現性のあるスクリーニングプロトコルを提供する。
概要
てんかんは、米国で4番目に一般的な神経学的障害のファミリー1であり、再発性発作を引き起こすCNSにおける興奮性および抑制性ドライブの不均衡によって特徴付けられる。熱性発作(FS)または発熱関連発作は、一般集団において、最も頻繁には、3ヶ月から6〜7歳までの小児において起こり得る。しかし、遺伝子変異を有する一部の個体では、ほとんどの場合、ナトリウムチャネル遺伝子において、FSは成人期まで7歳を超えて持続し得る。この状態は、熱性けいれんプラスまたはFS+と呼ばれる。ゲノムシーケンシングの急速な進歩により、ヒトナトリウムイオンチャネル遺伝子SCN1Aに1,300以上の変異が同定され、てんかん変異のホットスポットとなっています。SCN1A変異は、熱性けいれん(FS)、熱性けいれんプラスを伴う遺伝子てんかん(GEFS+)、およびDravet症候群(DS)2,3,4,5,6を含む広範囲の発作性障害に関連している。SCN1Aミスセンス変異の約20%がGEFS+5,7,8につながる。小児期の複雑または長期のFSの小児病歴は、その後、側頭葉てんかん(TLE)9,10,11などのより衰弱性の形態のてんかんに発展し得る。Dravet症候群は、SCN1Aの切り詰め変異または機能喪失変異のために生じ、難治性てんかんの重篤な形態であり、難治性発作に発症する熱性発作の小児期に発症し、しばしば認知障害、発達障害および運動障害と関連している2,5,12。.GEFS+および/またはDSを有する多くの個体は熱性けいれんを示すので、これらの発作性障害とよりよく闘うための新しい治療法を開発することが不可欠になる。
SCN1A関連てんかんの動物モデルは、さまざまな種類の発作(熱性発作と一般化)を特徴付け、発作発生のニューロンメカニズムを解剖する上で非常に貴重であることが証明されています13,14,15,16,17,18。げっ歯類の脳における脳波/EMG記録を介した自然発作の研究は十分に確立されており、非常に有用なツールであるが、マウスモデルにおける熱性発作を模倣しようとした研究はごくわずかである14、16、19、20、21、22、23。.以前の研究では、加熱された乾燥空気のジェット、または熱システムを備えたメタクリレートシリンダー、または密閉された試験arenas9,16,21,22,23,24の温度コントローラを備えたヒートランプを使用して、温熱療法を介して発作を誘発した。より制御された環境で体温を上昇させるために、ここで説明するプロトコルは、チャンバ内のマウスの体温の再現可能な上昇速度を可能にする温度制御加熱システムを備えたカスタムメイドのチャンバを使用する。熱室は木材(長さ40cm×幅34cm×高さ31cm)で構成され、K熱電対を備えたデジタル温度コントローラが取り付けられました。チャンバの背面パネルにヒーターを備えた小型の軸流ファンは、加熱された空気をデジタル温度コントローラによって調整されたチャンバに導きます。この強制空気加熱システムにより、チャンバ温度が上昇する速度を制御することができます。(図1A、B)。木製の熱室の内側にあるK熱電対は、デジタル温度コントローラにフィードバックを送信し、アッセイ中にボックス内の温度を一定に保ちます。デジタル温度コントローラに温度を設定すると、電動ファンは加熱された強制空気を通気口に送り、チャンバを均一に加熱することができます(図1A)。ヒートチャンバのフロントパネルは透明なプレキシガラスシートで、試験のビデオ録画を容易にします。
成体(P30−P40)マウス、GEFS+および同数の野生型同腹仔を対照群として働く原因となるSCN1Aにおけるミスセンス変異についてヘテロ接合性を、各実験について選択した。これらの研究で用いた動物(雄と雌の両方)は、体重が15g以上の野生型マウスは、同じ年齢の重い動物よりも熱誘発性発作に対してより敏感であった。パイロット研究では、変異型マウスと野生型マウスの両方が、チャンバーの後ろのより涼しい角を探し出し、長期間そこにとどまっていることが観察されました。これを回避するため、ヒートチャンバー試験アリーナ内の有効床面積は、チャンバーの右側に木製ブロックB(寸法20cm x 8cm x 7.2cm)を配置して、長さ16.5cm×幅21.5cm×高さ27.5cmに縮小した(図1A)。熱室は厚さ1.9cmの合板(長さ40cm×幅34cm×高さ31cm)で、白い積層体で覆われ、K熱電対を備えたデジタル温度コントローラが取り付けられました。チャンバ壁のラミネート表面は不浸透性であり、70%エタノールで拭き取ることによって試験の間に容易に消毒することができる。ヒートチャンバの温度を最初に50°Cに設定し、実験開始前に少なくとも1時間予熱し、チャンバ内の均一な加熱を確保した。各マウスには、実験全体を通して体温を連続的にモニタリングするための直腸体温計を取り付けた。一度に1匹のマウスをチャンバーに入れ、1分〜10分の間、温度を50°Cに保った。その後、11~20分間55°Cまで昇温し、最後に21~30分間60°Cまで昇温した。これにより、マウス体温の上昇速度が再現可能であった(図2A)。各試験はビデオ録画され、行動分析はオフラインで実施された。
加熱プロトコルは、加熱チャンバの初期温度およびチャンバが加熱される速度を変更するように容易に変更することができ、これにより、アッセイ中にマウスの体温が上昇する速度が変化する。したがって、この方法は、熱誘発発作を含む行動スクリーンを設定する際に、従来の方法よりも柔軟性が高い。熱誘発性発作プロトコルは、変異マウスを熱誘発性発作に対してより耐性にするか、または発作が観察される閾値温度を上昇させる抗てんかん薬をスクリーニングするためにも使用することができる。同様に、熱誘発性発作に対するケト食などの制限的食生活レジームの有益な効果は、通常のチャウ給餌マウスとケト給餌マウスで調べることができる。
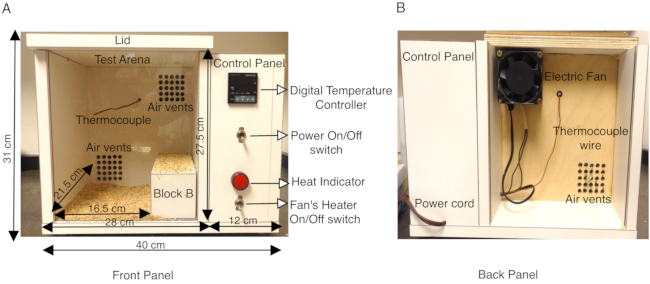
図1:カスタムメイドのマウスヒートチャンバの説明(A)木製マウスヒートチャンバのフロントパネルには、デジタル温度コントローラ、K熱電対、ファンヒーターのON/OFFスイッチ、および熱インジケータをオンにする電源ON/OFFスイッチを含むサイドコントロールパネルが表示されます。ボックスと内側のテストアリーナの外形寸法はcmで示されています。試験アリーナ表面を効果的に縮小するために使用される木製ブロックBも示されている。試験アリーナの底部は、マウスが加熱された木の表面に直接接触するのを防ぐために、穂軸の寝具で覆われています。(B)ヒートチャンバの背面パネルには、上部の通気口に取り付けられたファンと、チャンバに電気を供給するための電源コードが表示されます。この図は、Das et al., 2021, eNeuro14の図3から修正されている。この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
すべての動物処置は、カリフォルニア大学アーバイン校の施設動物ケアおよび使用委員会(IACUC)のガイドラインに従って実施された。
熱誘起発作アッセイの準備
- ヒートチャンバー の電源 オンボタンをオンにし、続いて ヒートオン ボタンを押します。
- デジタル温度コントローラのキーパッドを使用して、ヒートチャンバの温度を50°Cに設定します。
- チャンバーを 50 °C で予熱するまで最低 1 時間待ってから、最初のマウスをチャンバーに導入します。予熱は、チャンバ内の均一な加熱を保証します。
- マウスの熱室の床に穂軸の寝具を敷きます。
- 各熱誘起発作アッセイ試行を記録するために、熱室の前にビデオ記録カメラを取り付ける。
- 直径140mmのペトリ皿に厚いティッシュペーパーの層を敷き詰め、氷の上に置き、冷却パッドとして機能します。
注:アッセイの最後に、個々のマウスを予冷した冷却パッドに移し、体温の上昇を抑えます。
熱誘導発作アッセイのためのマウスの準備
- 10匹の成体マウス(P30−P40)、突然変異を引き起こすてんかんを運ぶ5匹、および熱誘発発作スクリーニングアッセイのための野生型同腹仔の5匹を選択する。
注:変異を引き起こすてんかんを全く有さない野生型マウスは、44°C未満の温度で熱誘発性発作を示さず、対照群として機能する。 - スクリーニングアッセイに使用する各マウスを秤量し、その体重を記録する。アッセイには、体重15g以上のマウスのみを使用すべきである。
- マウスの熱室で一度に 1 台のマウスをスクリーニングします。
- ベルジャーの底に数滴のイソフルランを使用して、マウスを10〜15秒間簡単に麻酔します。
- 動物をベル瓶から取り出し、ペーパータオルの上に置きます。
- マウスが有害なつま先のピンチに反応しないことを確認して、マウスが完全に麻酔されていることを確認します。
- 直腸温度プローブの金属先端を潤滑剤(ワセリンなど)でコーティングし、2cm以下の深さでマウスに静かに挿入します。
- 直腸プローブをマウスの尾部にテープで固定し、アッセイ中にプローブが出ないようにします。
メモ:または、動物をマウス拘束コーンに入れ、直腸温度プローブを挿入します。尾にテーピングして固定します。 - 直腸プローブが、マウスの内部体温を表示するマルチメーターに接続されていることを確認します。
- 動物を穂軸の寝具が並ぶ新鮮なケージ、すなわち回復ケージに入れます。
- タイマーを起動し、5分間待ちます。マウスが麻酔から完全に回復し、マウスが活動的でグルーミングされるまで、マウスを観察します。
- 同時に、マウスの深部体温を35〜36°Cで安定するまで監視します。
- 5分の終わりに、マウスの体温に注意してください。これは、時間「0」分における初期体温である。
注:マウスの深部体温が35°C未満の場合は、動物が麻酔誘発性低体温から回復するまでさらに時間待ちます。 - すぐに、個々のマウスを予熱したマウスチャンバーに移します。これは、実験試行の開始を示します。一度に 1 つのマウスのみがスクリーニングされます。
3. 熱誘起発作アッセイ
- 予熱したマウス熱室の床にマウスをそっと置いた後、プレキシガラスのドアを閉じ、実験をビデオ録画するためのカメラを起動します。
- ストップウォッチを起動します。実験期間中、直腸体温計からマウスの体温を1分間隔で記録する。
- マウスの体温が0.25〜0.5°C /minの速度で上昇するように、一定の間隔でマウスの熱室の温度を上げます。
注:体温の急激な上昇は熱中症や死に至る可能性があるため、避けるべきです。 - このプロトコルに従って、 図2Aに示すように、マウスヒートチャンバの温度を10分ごとに5°C上昇させます。
- 5分で、熱室の温度を55°Cに設定し、デジタル温度表示に示すように10分 までに熱室の温度を55°Cに安定化させた。
- 同様に、19.5分で温度を60°Cまで上昇させ、20分 までに熱室の温度を60°Cに安定させる。各発作スクリーニング試験は30分間持続する。
- マウスに発作がある場合(発声、頭のうなずき、前肢のクローヌス、後肢の伸展、横転、または全身性強壮/間代性痙攣を経験する)がある場合は、次の情報を記録します。
- 直腸体温計から発作時のマウスの体温(発作閾値温度)を記録する。
- マウスによって表示された頭部うなずき、前肢の結節、後肢の伸展、側面への転倒、および/または全身性強直間代性発作(GTCS)などの発作行動特性を記録する。
- マウスをチャンバーから素早く、または静かに持ち上げ、ステップ 1.6 で準備した冷却パッドの上に置きます。
注:マウスがラシーンスケール5発作を経験し、制御不能なジャンプを示している場合、動物を熱室から拾い上げて外部の冷却パッドに移すことは困難です。しかし、典型的な熱誘発発作は30秒から60秒の間続きます.したがって、マウスは熱室から取り出し、熱誘発発作エピソードの開始から60秒以内に冷却パッドに置くべきです。 - マウスの体温が36〜37°Cに下がるのを待ってから、回収ケージに移します。一度に1匹のマウスだけが回復ケージに入れられます。
注:熱誘発性スクリーニングにまだ使用されていないマウスと、熱誘発性発作実験試験をすでに経験しているマウスを混在させないでください。 - マウスの尾と直腸プローブワイヤーの間のテープを一対のはさみで優しく慎重に切断し、直腸プローブをマウスから取り外します。
- 直腸プローブの金属先端を70%アルコールと軟部組織ワイプで拭き取り、次の試験に備えます。
- マウスを自宅のケージに戻す前に、通常の活動(歩行、グルーミングなど)を再開するまで、回復ケージ内のマウスを観察し続けます。これは、このマウスの実験試行の終了を示します。
- アッセイ後の動物状態を記録し、生存または死んでいるか試験セッションから回収した。制御不能なジャンプおよび全身性強直/間代性発作を伴う高強度発作は、マウスの死をもたらすことがある。
- 30分間の観察期間内にマウスの熱誘発発作が起こらない場合、またはマウスの体温が44°Cに達した場合は、マウスを熱室から取り出し、マウスの体温が36〜37°Cに戻るまで冷却パッドの上に置きます。
- マウスヒートチャンバの温度を50°Cにリセットし、デジタル温度コントローラの表示温度が50°Cを示すまで平衡化させます。
- 個々のマウスの試行の間に穂軸寝具を交換してください。
- セクション2の説明に従ってスクリーニング試験のために次のマウスを準備し、セクション3のステップを繰り返します。
4. 動物を安楽死させる
- ほとんどの動物は熱誘発発作後に回復するが、我々の経験では、いくつかのマウスは、熱誘発発作の24〜48時間以内に自宅のケージでSUDEP(EPilepsyにおける突然の説明不能死)を受ける。30分間の試験に続いて、すべてのマウスについて個別に熱誘発発作のスクリーニングを終了した後、施設のIACUCガイドラインに従ってすべてのマウスを安楽死させる。
5. 熱誘起発作データの解析
- 動物のコホートのスクリーニングを完了した後、以下の式を用いて発作を示す所与の遺伝子型におけるマウスの割合を計算する:
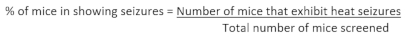
- 熱誘発性発作を示す遺伝子型におけるすべてのマウス(ステップ3.7に記された)の発作閾値温度を平均することによって、所与の遺伝子型内のマウスの平均発作閾値温度を推定する。
- 依然として同一性および遺伝子型に盲目である間、熱誘発発作アッセイスクリーニング中の各マウスのビデオ記録をコンピュータ画面上で再生し、発作発作の重症度をスコアリングする。
- 以前の研究13,14によって記述されているように修正されたラシーンスケール13を用いて、熱誘発発作行動を示す個々のマウスにスコアを与える。詳しくは、表 1 を参照してください。
- マウスが、熱誘発性発作を経験している間に、頭部のみがうなずくだけを示す場合、2のスコアを与える。マウスが頭がうなずいて発作エピソードを開始するが、前肢のクローヌス、転倒、および/またはジャンプを示す場合は、5のスコアを与えます。
- 上記のように修正されたRacine scale13 を使用して、各マウスの最大スコアを記録します。
- 所与の遺伝子型における全てのマウスによって示された最大ラシーンスコアの散布図をプロットする。
- 熱誘発性発作などの行動発作の重症度を決定する方法として、異なるマウス群間で最大ラシンスコアを統計的に比較する。
注:ラシンスコアは、異なる変異マウス群または遺伝子型間の発作特性を比較するのに役立ちます。野生型マウスは熱誘発性発作を受けず、ラシーンスコア比較のために考慮する必要がないことが予想される。 - 実験計画に基づき、適切な統計解析を行い、野生型マウスと変異型マウスの間で発作を示すマウスの割合、およびそれらの平均発作閾値温度が互いに有意に異なるかどうかを判定する。
| ラシーンスコア | 発作特性 | ||
| 0 | 発作なし | ||
| 1 | 口と顔の動き | ||
| 2 | うなずく | ||
| 3 | 前肢クローナス、通常は1肢 | ||
| 4 | 飼育を伴う前肢クローナス | ||
| 5 | 全身性強直間代性発作、飼育、跳躍、転倒 | ||
表 1: ラシーンのスコア
結果
熱性けいれん変異を有する動物モデルは、野生型の同腹仔で発作を誘発しない高温で熱誘発性発作を受けることが予想される。SCN1A変異は、熱性および非熱性全身性発作の両方を示すK1270T GEFS+患者を含む熱性けいれんと関連している7。我々は、CRISPRが生成したSCN1A K1270T GEFS+変異マウスをスクリーニングし、発作耐性129X1/SvJ(129X1)および発作感受性C57BL/NJ(B6N)バックグラウンドの2つの遺伝的背景における熱発作の発生について、最近研究14 で記載した。GEFS+変異を全く有さず、したがって熱誘発性発作を示すことが予想されないマウス熱チャンバー内の年齢一致した野生型同腹仔は、対照群として役立った。経時的な体温変化の速度を、アッセイ中に毎分記録したマウスの平均体温をプロットすることによって評価した。それぞれの129X1およびB6N遺伝的背景において試験したヘテロ接合型変異マウスと野生型同腹仔との間の体温の変化率に差はなかった(図2B、C)。このことは、K1270T GEFS+ヘテロ接合型変異マウスにおいて体温調節が変化していないことを示唆している。
129X1(n=15)またはB6N(n=9)遺伝的背景からのすべてのヘテロ接合型変異マウスは、熱誘発性発作を示した(図2D)。129X1富化バックグラウンド(n=13)の野生型マウスのいずれも、熱誘発性発作を示さなかった(図2D)。対照的に、発作感受性B6Nバックグラウンドで試験したマウスの3分の1(9匹のマウスのうちn=3匹)は、熱誘発性発作を示した。統計的比較は、熱誘発性発作を示すヘテロ接合型変異マウスの割合が、129X1およびB6N遺伝的背景の両方において、それぞれの野生型対応マウスよりも有意に高かったことを示している(図2D、フィッシャーの正確確率検定、129X1p<0.0001;B6NJ p = 0.009)。129X1およびB6N遺伝的背景におけるヘテロ接合型変異マウス間の平均発作閾値温度は類似していた。129X1変異マウスの平均発作閾値温度は42.6±0.20°Cであり、これはB6Nマウスに見られる平均発作閾値温度42.7±0.06°Cと有意に異ならなかった(図2E;両側不対スチューデントのt検定、p = 0.782)。熱誘発性発作を示した3匹のB6N野生型マウスの平均発作閾値温度は43.7±0.08°Cであり、B6Nヘテロ接合型変異マウスによって示された平均発作閾値42.7±0.06°Cよりも有意に高いことに注意することが重要である(図2E、両側不対スチューデントt検定、p<0.0001)。
チャンバーのプレキシガラス前面は、アッセイ中に連続ビデオ録画を行うことを可能にし、後で前述のように修正されたラシーンスケールで各マウスの発作重症度をスコアリングするために使用することができる14,20。典型的なアッセイでは、ヘテロ接合型変異マウスは、発声および/または頭部うなずきを伴う熱誘発性発作(ラシーンスコア2)を示し、体温が約42°Cに達すると、前肢クローヌスに急速に移行し、横に倒れ、ジャンプし、後肢伸展し、および/または全身性強直/間代性発作(ラシーンスコア3〜5)を示す。 最大ラシーンスコアは、変異マウスの中で最も重篤な熱誘発発作行動を表す。129X1富化バックグラウンド(n=15)におけるヘテロ接合型変異マウスの最大ラシンスコアは、B6N(n=9)遺伝的バックグラウンドにおけるヘテロ接合型変異マウスと変わらない(図2F;マン・ホイットニー検定, p > 0.9999).このことは、K1270T GEFS+変異マウスにおける熱誘発発作行動特性が、株の背景とは無関係であることを示唆している。
まとめると、このデータは、すべての変異マウスが、同様の頻度、発作閾値温度、および行動発作の重症度で、系統に依存しない方法で熱誘発発作を示すことを実証している。野生型の同腹仔の大半は、44°C以下でそのような発作を示さない。 発作感受性B6Nバックグラウンドの野生型対照マウスの約3分の1は、熱誘発性発作(おそらく遺伝的バックグラウンド効果による)を示したが、発作閾値温度は、同じバックグラウンドの変異マウスと比較して有意に高かった。これらの結果は、B6N遺伝的背景にある変異マウスが 、SCN1A GEFS+変異が保有しているため、より低い温度閾値で熱誘発性発作を起こしやすいことを示唆している。したがって、このプロトコルを使用して、てんかん変異マウスにおける熱誘発性発作を評価し、熱誘発性発作を受けないか、または有意に高い温度で熱発作を示す野生型同腹仔マウスと区別することができる。
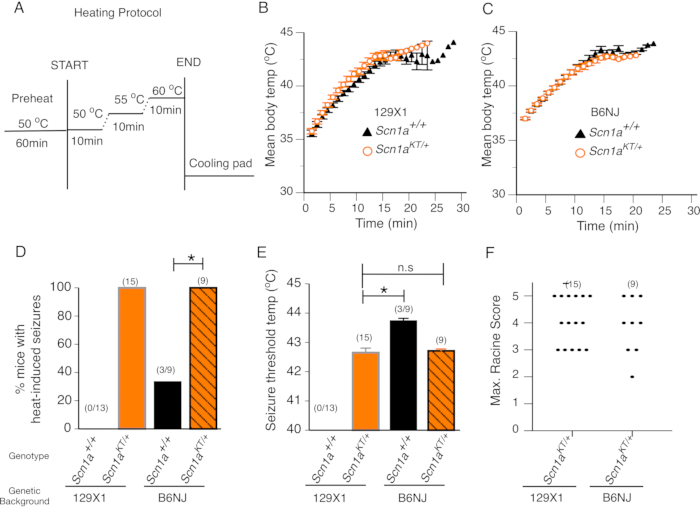
図2:変異マウスは熱誘発性発作を示す。 (A)マウスにおける熱誘発性発作の行動スクリーニングのための加熱プロトコル。(B-C)野生型(Scn1a+/+ - 黒三角)およびヘテロ接合型変異体(Scn1aKT/+ - オレンジ円)マウスの経時的なマウスの平均体温は、それぞれ2つの遺伝的背景129X1およびB6Nである。(d)両方の遺伝的背景において熱誘発発作を示すマウスの割合。野生型(Scn1a+/+)およびヘテロ接合型(Scn1aKT/+)マウスは、それぞれ黒およびオレンジ色のバーで表わされる。129X1およびB6Nバックグラウンドにおけるヘテロ接合型変異体は、それぞれオレンジ色の固体バーおよび黒い縞模様のオレンジ色のバーで示されている。(e)両系統の野生型(Scn1a+/+)およびヘテロ接合型変異体(Scn1aKT/+)マウスにおける熱誘導性発作に対する発作温度閾値。(f)両方の遺伝的背景においてヘテロ接合型(Scn1aKT/+)マウスが示す熱誘発発作の最大ラシーンスコアの散乱分布。各ドットは、1 台のマウスでの最大ラシーン スコアを表します。各遺伝子型における動物の数は、括弧内に示されている。パネルB〜Fに示すデータは、S.E±.M平均である。この図は、Das et al., 2021, eNeuro14の図3から修正されている。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
我々は、ヒト患者における熱性発作の行動と同等の行動であるマウスにおける熱誘発性発作の発生をスクリーニングするための簡単で効果的なプロトコールを記述する。アッセイは、いくつかのパラメータ−発作を示すマウスの割合、発作閾値、ラシーンスケールでの発作の重症度を含む、体温の上昇に対する対照マウス群および試験マウス群の感受性を比較するために評価する。
このプロトコルの重要なステップは、マウスの体温を継続的に監視しながらチャンバ内の熱を増加させることを含む。野生型動物は体温>44°Cで熱誘発性発作を起こす可能性があるため、これらのアッセイでマウスが経験する最高体温は44°Cであることが不可欠です。 全身麻酔または鎮痛薬による前処理は、動物の深部体温を低下させたり、体温調節を妨げたりして、発作閾値温度データ収集を混乱させる可能性があります。したがって、このスクリーニングプロトコール下のマウスは、30分間の試験ウィンドウ中にこれらの薬剤を提供することができなかった。すべての手続きは、機関のIACUC委員会によって承認されなければなりません。アッセイ中のマウスの深部体温の継続的なモニタリングを確実にするために、直腸温度プローブをマウスの尾部にしっかりとテープで固定する。アッセイ中に、マウス体温がマウスチャンバーの温度を上昇させた後でさえも長期間にわたって変化しないままであることが判明した場合、直腸温度プローブがマウスから出てこないか、または尾部に緩く取り付けられていることを確認する。
マウスモデルの遺伝的背景は、SCN1A変異および薬理学的に誘導された発作に対する感受性に影響を及ぼし得る18、25、26、27。上記の結果で論じたように、マウスの遺伝的背景は、熱誘発性発作に対する感受性に影響を及ぼす可能性がある。Scn1aK1270T GEFS+変異マウスを、129X1およびB6NJの2つの遺伝的背景で試験し、発作感受性B6NJバックグラウンドにおける野生型マウスのわずかな割合(33%)も、熱誘発発作を受けることが観察された。しかし、ヘテロ接合型変異体Scn1aKT/+マウスと比較して、B6NJ野生型マウスは有意に高い温度閾値で熱誘導性発作を経験した。これは、CRISPRノックインによって導入された遺伝子変異(Scn1a K1270T)が、変異マウスを温熱療法誘発発作に対してより感受性にすることを確認する。
このプロトコルを採用することにはいくつかの利点があり、以下に要約します。第1に、乾燥空気の流れや加熱されたランプの使用とは異なり、密閉された空間内に設置された温度制御された強制空気は、実験者が所望の速度で試験アリーナを加熱することをより詳細に制御することを可能にする。加熱プロトコルのステップは、開始温度、各ステップの持続時間などを増減するように簡単に変更して、ラットなどの重く、またはより大きなげっ歯類である高齢マウスをスクリーニングすることができる。第2に、添付の直腸プローブを介したマウス体温の継続的なモニタリングは、アッセイ全体を通して、個々のマウスにおける体温変化の速度に関する貴重な情報を与える。これにより、実験者は、このプロトコルを他の試験分野に適応させる際に、マウスの温度変化率が0.25-0.5°C/分を超えないことを注意深く観察することができる(これは動物にとってストレスになるかもしれない)。重要なことに、異なるマウス群における経時的な体温の変化率は、体温調節能力に光を当てることができ、突然変異を引き起こす熱性けいれんがマウスの体温調節も変化させるかどうかを理解するのに役立つ可能性がある。第3に、継続的な体温モニタリングは、マウスが経験した発作の最初の発作と同時に記録されるため、このプロトコルを使用した発作閾値温度測定が正確であることを保証します。動物の体温が継続的に監視されていない場合、または動物を試験アリーナから連れ出した後に発作閾値温度が測定されない場合、発作閾値は、発作後のマウスを処理するのにかかる時間によって変化し得る。最後に、この方法は、ヒト患者の熱性発作を模倣するためにマウスに発熱を誘発する(病原体を注入することによって)侵襲的方法を使用する必要性を回避する。
このプロトコルの限界の1つは、幼い(年齢のP30未満)マウスを熱誘発性発作についてスクリーニングすることが困難であることです。このプロトコルは、成体マウス(P30-P40以上)の熱または温熱療法誘発発作に対する感受性をスクリーニングするために開発されました。我々の経験では、若い野生型マウス、特に体重が15g未満のマウスは、未発達の体温調節機構、生理学的熱ストレス、またはその両方の組み合わせに起因する可能性のある熱誘発性発作を受ける可能性がより高い。したがって、このプロトコルを使用して幼いマウスに熱誘発発作スクリーニングを行うことは理想的ではない。
マウスを熱誘発性発作にさらしながら脳波モニタリングを組み合わせた将来の研究は、以前の研究と同様に、熱誘発性発作の脳波発作パターンに光を当てることができる19。マウス脳内の特定の領域におけるニューロン活性は、脳組織を採取した後、光遺伝学的アプローチと免疫組織化学に基づく研究を組み合わせることによって追跡することができる。また、ケト食などの制限食が熱性けいれんを減少させる効果は、ケト給餌マウスおよび通常のチャウ給餌マウスを熱誘発性発作プロトコールに供することによって評価することができる。同様に、てんかん薬物スクリーニングパラダイムを開発して、ビヒクル給餌マウスまたは対照マウスと比較した場合、薬物供給または治療マウスにおける熱誘発発作を改善または抑制する抗てんかん薬候補を試験および同定することができる。
開示事項
著者らは利益相反がないと宣言しています。
謝辞
コナー・J・スミスがカスタマイズされたマウス熱室の建設に協力してくれたことに感謝します。我々は、アッセイ開発の初期段階で加熱プロトコルを標準化するためのO'Dowdラボメンバー、リーシャ・ゼンおよびアンドリュー・サルガドの助けを認める。また、ダニー・ベナビデスとクマール・ペリンバムに、原稿の実験手順の一部をビデオ録画してくれたことにも感謝します。この研究は、D.O.D.に授与されたNIH助成金(NS083009)によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Axial fan | Farnam | AF20-200-120-xx10-3.1 | Farnam custom products -Axial Fan Heater with Fan |
| Digital temperature controller | Inkbird | ITC-100RH | Inkbird digital PID temperature controller ITC-100RH with K thermocouple |
| Mouse rectal temperature probe | ThermoWorks, Braintree Scientific, Inc | RET-3 | Mouse rectal temperature probe with thermometer |
参考文献
- Hirtz, D., et al. How common are the 'common' neurologic disorders. Neurology. 68, 326-337 (2007).
- Catterall, W. A. Sodium Channel Mutations and Epilepsy. Jasper's Basic Mechanisms of the Epilepsies. , Center for Biotechnology Information. US. Internet (2012).
- Mantegazza, M., Broccoli, V. SCN 1A /Na V 1.1 channelopathies: Mechanisms in expression systems, animal models, and human iPSC models. Epilepsia. 60, (2019).
- Stafstrom, C. E. Persistent Sodium Current and Its Role in Epilepsy. Epilepsy Currents. 7, 15-22 (2007).
- Schutte, S. S., Schutte, R. J., Barragan, E. V., O'Dowd, D. K. Model systems for studying cellular mechanisms of SCN1A-related epilepsy. Journal of Neurophysiology. 115, 1755-1766 (2016).
- Wei, F., et al. Ion Channel Genes and Epilepsy: Functional Alteration, Pathogenic Potential, and Mechanism of Epilepsy. Neuroscience Bulletin. 33, 455-477 (2017).
- Abou-Khalil, B., et al. Partial and generalized epilepsy with febrile seizures plus and a novel SCN1A mutation. Neurology. 57, 2265-2272 (2001).
- Zhang, Y. -H., et al. Genetic epilepsy with febrile seizures plus: Refining the spectrum. Neurology. 89, 1210-1219 (2017).
- Patterson, K. P., et al. Enduring memory impairments provoked by developmental febrile seizures are mediated by functional and structural effects of neuronal restrictive silencing factor. Journal of Neuroscience. 37, 3799-3812 (2017).
- Rossi, M. A. SCN1A and febrile seizures in mesial temporal epilepsy: An early signal to guide prognosis and treatment. Epilepsy Currents. 14, 189-190 (2014).
- Zhang, Y., et al. Altered gut microbiome composition in children with refractory epilepsy after ketogenic diet. Epilepsy Research. 145, 163-168 (2018).
- Meng, H., et al. The SCN1A mutation database: Updating information and analysis of the relationships among genotype, functional alteration, and phenotype. Human Mutation. 36, 573-580 (2015).
- Cheah, C. S., et al. Specific deletion of NaV1.1 sodium channels in inhibitory interneurons causes seizures and premature death in a mouse model of Dravet syndrome. Proceedings of the National Academy of Science U.S.A. 109, 14646-14651 (2012).
- Das, A., et al. Interneuron dysfunction in a new mouse model of SCN1A GEFS. eNeuro. , (2021).
- Kalume, F., et al. Sudden unexpected death in a mouse model of Dravet syndrome. Journal of Clinical Investigations. 123, 1798-1808 (2013).
- Martin, M. S., et al. Altered function of the SCN1A voltage-gated sodium channel leads to gamma-aminobutyric acid-ergic (GABAergic) interneuron abnormalities. Journal of Biological Chemistry. 285, 9823-9834 (2010).
- Rubinstein, M., et al. Dissecting the phenotypes of Dravet syndrome by gene deletion. Brain. 138, 2219-2233 (2015).
- Yu, F. H., et al. Reduced sodium current in GABAergic interneurons in a mouse model of severe myoclonic epilepsy in infancy. Nature Neuroscience. 9, 1142-1149 (2006).
- Dutton, S. B. B., et al. Early-life febrile seizures worsen adult phenotypes in Scn1a mutants. Experimental Neurology. 293, 159-171 (2017).
- Cheah, C. S., et al. Specific deletion of NaV1.1 sodium channels in inhibitory interneurons causes seizures and premature death in a mouse model of Dravet syndrome. Proceedings of the National Academy of Science U.S.A. 109, 14646-14651 (2012).
- Oakley, J. C., Cho, A. R., Cheah, C. S., Scheuer, T., Catterall, W. A. Synergistic GABA-enhancing therapy against seizures in a mouse model of Dravet Syndrome. Journal of Pharmacology and Experimental Therapeutics. 345, 215-224 (2013).
- Ricobaraza, A., et al. Epilepsy and neuropsychiatric comorbidities in mice carrying a recurrent Dravet syndrome SCN1A missense mutation. Scientific Reports. 9, (2019).
- Warner, T. A., Liu, Z., Macdonald, R. L., Kang, J. -Q. Heat induced temperature dysregulation and seizures in Dravet Syndrome/GEFS+ Gabrg2+/Q390X mice. Epilepsy Research. 134, 1-8 (2017).
- Eun, B. -L., Abraham, J., Mlsna, L., Kim, M. J., Koh, S. Lipopolysaccharide potentiates hyperthermia-induced seizures. Brain and Behavior. 5, 00348(2015).
- Miller, A. R., Hawkins, N. A., McCollom, C. E., Kearney, J. A. Mapping genetic modifiers of survival in a mouse model of Dravet syndrome. Genes Brain and Behavior. 13, 163-172 (2013).
- Mistry, A. M., et al. Strain- and age-dependent hippocampal neuron sodium currents correlate with epilepsy severity in Dravet syndrome mice. Neurobiology of Disease. 65, 1-11 (2014).
- Ogiwara, I., et al. Nav1.1 localizes to axons of parvalbumin-positive inhibitory interneurons: a circuit basis for epileptic seizures in mice carrying an Scn1a gene mutation. Journal of Neuroscience. 27, 5903-5914 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved