Method Article
Ein Verhaltensbildschirm für hitzeinduzierte Anfälle in Mausmodellen der Epilepsie
In diesem Artikel
Zusammenfassung
Ziel der Methode ist es, in Mausmodellen auf Hyperthermie oder hitzeinduzierte Anfälle zu screenen. Das Protokoll beschreibt die Verwendung einer speziell angefertigten Kammer mit kontinuierlicher Überwachung der Körpertemperatur, um festzustellen, ob eine erhöhte Körpertemperatur zu Anfällen führt.
Zusammenfassung
Transgene Mausmodelle haben sich als leistungsfähige Werkzeuge bei der Untersuchung verschiedener Aspekte menschlicher neurologischer Erkrankungen, einschließlich Epilepsie, erwiesen. Die SCN1A-assoziierten genetischen Epilepsien umfassen ein breites Spektrum von Anfallsleiden mit unvollständiger Penetranz und klinischer Variabilität. SCN1A-Mutationen können zu einer Vielzahl von Anfallsphänotypen führen, die von einfachen, selbstlimitierten fieberassoziierten Fieberanfällen (FS), moderater genetischer Epilepsie mit Fieberkrämpfen plus (GEFS +) bis hin zum schwereren Dravet-Syndrom (DS) reichen. Obwohl FS häufig bei Kindern unter 6-7 Jahren beobachtet wird, die keine genetische Epilepsie haben, tritt FS bei GEFS + -Patienten weiterhin bis ins Erwachsenenalter auf. Traditionell wurden experimentelle FS bei Mäusen induziert, indem das Tier einem Strom trockener Luft oder Heizlampen ausgesetzt wurde, und die Änderungsrate der Körpertemperatur ist oft nicht gut kontrolliert. Hier beschreiben wir eine speziell angefertigte Heizkammer mit Plexiglasfront, die mit einem digitalen Temperaturregler und einem mit einer Heizung ausgestatteten elektrischen Ventilator ausgestattet ist, der erwärmte Zwangsluft temperaturgesteuert in die Testarena leiten kann. Die Körpertemperatur einer Maus, die in der Kammer platziert und durch eine rektale Sonde überwacht wird, kann reproduzierbar auf 40-42 ° C erhöht werden, indem die Temperatur in der Kammer erhöht wird. Die kontinuierliche visuelle Überwachung der Tiere während der Erhitzungszeit zeigt die Induktion von hitzeinduzierten Anfällen bei Mäusen, die eine FS-Mutation bei einer Körpertemperatur tragen, die bei Wildtyp-Wurfpartnern keine Verhaltensanfälle hervorruft. Tiere können leicht aus der Kammer entfernt und auf ein Kühlkissen gelegt werden, um die Körpertemperatur schnell wieder zu normalisieren. Diese Methode bietet ein einfaches, schnelles und reproduzierbares Screening-Protokoll für das Auftreten von hitzeinduzierten Anfällen in Epilepsie-Mausmodellen.
Einleitung
Epilepsie, die vierthäufigste Familie neurologischer Erkrankungen in den Vereinigten Staaten1, ist durch ein Ungleichgewicht des erregenden und hemmenden Antriebs im ZNS gekennzeichnet, das zu wiederkehrenden Anfällen führt. Fieberanfälle (FS) oder fieberbedingte Anfälle können in der Allgemeinbevölkerung auftreten, am häufigsten bei Kindern bereits im Alter von 3 Monaten bis 6-7 Jahren. Bei einigen Personen mit genetischen Mutationen, am häufigsten in einem Natriumkanalgen, kann FS jedoch über das Alter von 7 Jahren bis ins Erwachsenenalter hinaus bestehen bleiben. Dieser Zustand wird als Fieberkrämpfe plus oder FS + bezeichnet. Schnelle Fortschritte in der Genomsequenzierung haben über 1.300 Mutationen im menschlichen Natriumionenkanalgen SCN1A identifiziert, was es zu einem Hotspot für Epilepsiemutationen macht. SCN1A-Mutationen wurden mit einem breiten Spektrum von Anfallsleiden in Verbindung gebracht, darunter Fieberkrämpfe (FS), genetische Epilepsie mit Fieberkrämpfen plus (GEFS +) und Dravet-Syndrom (DS) 2,3,4,5,6. Etwa 20% der SCN1A-Missense-Mutationen führen zu GEFS+5,7,8. Die pädiatrische Anamnese komplexer oder längerer FS in der Kindheit kann sich anschließend zu schwächenderen Formen der Epilepsie wie Temporallappenepilepsie (TLE) 9,10,11 entwickeln. Das Dravet-Syndrom entsteht durch Kürzungsmutationen oder Funktionsverlust bei SCN1A und ist eine schwere Form der hartnäckigen Epilepsie, bei der im Kindesalter fieberhafte Anfälle auftreten, die sich zu refraktären Anfällen entwickeln und oft mit kognitiven, entwicklungsbedingten und motorischen Beeinträchtigungen verbunden sind2,5,12 . Da viele Personen mit GEFS+ und/oder DS fieberhafte Anfälle aufweisen, ist es unerlässlich, neuartige Therapien zu entwickeln, um diese Anfallsleiden besser zu bekämpfen.
Tiermodelle der SCN1A-assoziierten Epilepsie haben sich als von unschätzbarem Wert bei der Charakterisierung verschiedener Arten von Anfällen (fieberhaft vs. generalisiert) und der Sezierung des neuronalen Mechanismus der Anfallsgeneration13,14,15,16,17,18 erwiesen. Während die Untersuchung spontaner Anfälle über EEG / EMG-Aufzeichnungen in Nagetiergehirnen gut etabliert und ein sehr nützliches Werkzeug ist, haben nur wenige Studien versucht, Fieberkrämpfe in Mausmodellen nachzuahmen14,16,19,20,21,22,23 . Frühere Studien haben einen Strahl erhitzter trockener Luft oder einen Methacrylatzylinder, der mit einem thermischen System ausgestattet ist, oder Wärmelampen mit einem Temperaturregler in geschlossenen Testarenen verwendet9,16,21,22,23,24, um Anfälle durch Hyperthermie zu induzieren. Um die Körpertemperatur in einer kontrollierteren Umgebung zu erhöhen, verwendet das hier beschriebene Protokoll eine speziell angefertigte Kammer mit einem temperaturgesteuerten Heizsystem, das reproduzierbare Steigerungsraten der Körpertemperatur einer Maus in der Kammer ermöglicht. Die Wärmekammer wurde aus Holz (Länge 40 cm x Breite 34 cm x Höhe 31 cm) gebaut und mit einem digitalen Temperaturregler mit K-Thermoelement ausgestattet. Ein kleiner Axialventilator, der mit einer Heizung an der Rückseite der Kammer ausgestattet ist, leitet erwärmte Luft in die Kammer, die von einem digitalen Temperaturregler geregelt wird. Dieses Zwangsluftheizungssystem ermöglicht es, die Geschwindigkeit zu steuern, mit der die Kammertemperatur ansteigt. (Abbildung 1A,B). Das K-Thermoelement, das sich in der hölzernen Wärmekammer befindet, sendet eine Rückmeldung an den digitalen Temperaturregler, um während des Assays konstante Temperaturen in der Box aufrechtzuerhalten. Durch Einstellen der Temperatur am digitalen Temperaturregler kann der elektrische Ventilator erwärmte Zwangsluft durch Lüftungsschlitze leiten, um die Kammer gleichmäßig zu erwärmen (Abbildung 1A). Die Frontplatte der Wärmekammer besteht aus einer durchsichtigen Plexiglasplatte, die eine einfache Videoaufzeichnung der Versuche ermöglicht.
Erwachsene (P30-P40) Mäuse, heterozygot für eine Missense-Mutation in SCN1A, die GEFS + verursacht, und eine gleiche Anzahl von Wildtyp-Streukameraden, die als Kontrollgruppe dienen, wurden für jedes Experiment ausgewählt. Tiere, sowohl männliche als auch weibliche, die in diesen Studien verwendet wurden, wogen mindestens 15 g, da Wildtypmäuse mit einem geringeren Gewicht empfindlicher auf hitzebedingte Anfälle reagierten als schwerere Tiere im gleichen Alter. In der Pilotstudie wurde beobachtet, dass sowohl mutierte als auch Wildtyp-Mäuse die kühleren Ecken der Kammer auf der Rückseite suchten und dort für längere Zeit blieben. Um dies zu umgehen, wurde die effektive Bodengröße in der Wärmekammer-Testarena auf Länge 16,5 cm x Breite 21,5 cm x Höhe 27,5 cm reduziert, indem ein Holzblock B (Abmessungen 20 cm x 8 cm x 7,2 cm) auf der rechten Seite der Kammer platziert wurde (Abbildung 1A). Die Wärmekammer wurde aus 1,9 cm starkem Sperrholz (Länge 40 cm x Breite 34 cm x Höhe 31 cm) gefertigt, mit weißem Laminat verkleidet und mit einem digitalen Temperaturregler mit K-Thermoelement ausgestattet. Die Laminatoberfläche der Kammerwände ist undurchlässig und kann zwischen den Versuchen durch Abwischen mit 70% Ethanol leicht desinfiziert werden. Die Temperatur der Wärmekammer wurde zunächst auf 50 °C eingestellt und vor Beginn des Experiments für mindestens 1 h vorgewärmt, um eine gleichmäßige Erwärmung innerhalb der Kammer zu gewährleisten. Jede Maus wurde mit einem Rektalthermometer zur kontinuierlichen Überwachung der Körpertemperatur während des gesamten Experiments ausgestattet. Eine einzelne Maus wurde jeweils in die Kammer gestellt und die Temperatur wurde zwischen der 1. und 10. Minute bei 50 ° C gehalten. Die Temperatur wurde dann für die 11.-20. Minute auf 55 ° C erhöht und schließlich für die 21. bis 30. Minute auf 60 ° C erhöht. Dies führte zu einer reproduzierbaren Steigerungsrate der Mauskörpertemperatur (Abbildung 2A). Jede Studie wurde auf Video aufgezeichnet und die Verhaltensanalyse wurde offline durchgeführt.
Das Heizprotokoll kann leicht modifiziert werden, um die Anfangstemperatur der Wärmekammer und die Rate, mit der die Kammer erwärmt wird, zu ändern, was wiederum ändert, wie schnell die Körpertemperatur der Maus während des Assays erhöht wird. Somit bietet diese Methode mehr Flexibilität gegenüber herkömmlichen Methoden bei der Einrichtung der Verhaltensbildschirme mit hitzeinduzierten Anfällen. Das hitzeinduzierte Anfallsprotokoll kann auch verwendet werden, um nach Antiepileptika zu suchen, die mutierte Mäuse widerstandsfähiger gegen hitzeinduzierte Anfälle machen oder die Schwellentemperatur erhöhen, bei der Anfälle beobachtet werden. In ähnlicher Weise können vorteilhafte Auswirkungen von restriktiven Diätregimen wie der Keto-Diät auf hitzeinduzierte Anfälle bei normalen Chow-gefütterten vs. Keto-gefütterten Mäusen untersucht werden.
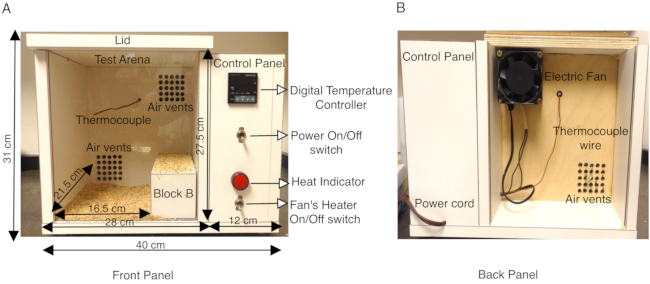
Abbildung 1: Beschreibung der speziell angefertigten Mauswärmekammer. (A) Die Vorderseite der hölzernen Mauswärmekammer zeigt das seitliche Bedienfeld mit dem Ein-/Ausschalter, der den digitalen Temperaturregler, das K-Thermoelement, den EIN/AUS-Schalter des Heizlüfters und die Wärmeanzeige einschaltet. Die Außenmaße der Box und der inneren Testarena sind in cm dargestellt. Ein Holzblock B, mit dem die Oberfläche der Testarena effektiv reduziert wird, ist ebenfalls zu sehen. Der Boden der Testarena ist mit Lehmbettwäsche bedeckt, um zu verhindern, dass Mäuse direkt mit beheizten Holzoberflächen in Berührung kommen. (B) Die Rückseite der Wärmekammer zeigt den Ventilator, der an der oberen Lüftungsöffnung montiert ist, und das Netzkabel zur Stromversorgung der Kammer. Diese Abbildung ist gegenüber Abbildung 3 in Das et al., 2021, eNeuro14 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protokoll
Alle Tierverfahren wurden in Übereinstimmung mit den Richtlinien des Institutional Animal Care and Use Committee (IACUC) an der University of California, Irvine, durchgeführt.
1. Vorbereitung für den hitzeinduzierten Anfallstest
- Schalten Sie die Einschalttaste in der Wärmekammer ein, gefolgt von der Taste "Einheizen ".
- Stellen Sie die Temperatur der Wärmekammer über die Tastatur am digitalen Temperaturregler auf 50 °C ein.
- Warten Sie mindestens 1 Stunde, um die Kammer bei 50 °C vorzuwärmen, bevor Sie die erste Maus in die Kammer einführen. Die Vorwärmung sorgt für eine gleichmäßige Erwärmung in der Kammer.
- Legen Sie den Boden der Mauswärmekammer mit Kolbenbettwäsche aus.
- Montieren Sie eine Videoaufzeichnungskamera vor der Wärmekammer, um jeden hitzeinduzierten Anfallsassay-Versuch aufzuzeichnen.
- Eine Petrischale mit einem Durchmesser von 140 mm mit dicken Schichten Seidenpapier auslegen und auf Eis legen, um als Kühlkissen zu dienen.
HINWEIS: Am Ende des Assays wird die einzelne Maus auf das vorgekühlte Kühlkissen übertragen, um die erhöhte Körpertemperatur zu senken.
2. Vorbereitung der Maus auf den hitzeinduzierten Anfallstest
- Wählen Sie 10 erwachsene Mäuse (P30-P40), 5, die die Epilepsie verursachende Mutation tragen, und 5 der Wildtyp-Wurfpartner für den hitzeinduzierten Anfalls-Screening-Assay.
HINWEIS: Wildtyp-Mäuse, die keine epilepsieverursachende Mutation beherbergen, zeigen keine hitzeinduzierten Anfälle bei Temperaturen unter 44 ° C und dienen als Kontrollgruppe. - Wiegen Sie jede Maus, die für den Screening-Assay verwendet werden soll, und zeichnen Sie ihr Körpergewicht auf. Für den Assay sollten nur Mäuse mit einem Gewicht von 15 g oder mehr verwendet werden.
- Screenen Sie jeweils eine Maus in der Wärmekammer der Maus.
- Betäuben Sie die Maus kurz für 10-15 s mit ein paar Tropfen Isofluran am Boden eines Glockenglases.
- Nehmen Sie das Tier aus dem Glockenglas und legen Sie es auf ein Papiertuch.
- Stellen Sie sicher, dass die Maus vollständig betäubt ist, indem Sie überprüfen, ob die Maus nicht auf eine schädliche Zehenklemme reagiert.
- Beschichten Sie die Metallspitze des rektalen Temperaturfühlers mit einem Schmiermittel (z. B. Vaseline) und führen Sie es vorsichtig in einer Tiefe von weniger als oder gleich 2 cm in die Maus ein.
- Befestigen Sie die rektale Sonde mit Klebeband am Schwanz der Maus, damit die Sonde während des Assays nicht herauskommt.
HINWEIS: Alternativ können Sie das Tier in einen Maus-Rückhaltekegel legen und den rektalen Temperaturfühler einsetzen. Sichern Sie es, indem Sie es an den Schwanz kleben. - Stellen Sie sicher, dass die rektale Sonde an ein Multimeter angeschlossen ist, das die innere Körpertemperatur der Maus anzeigt.
- Legen Sie das Tier in einen frischen, mit Lehmbettwäsche ausgekleideten Käfig, d. H. Den Auffangkäfig.
- Starten Sie einen Timer und warten Sie 5 min. Beobachten Sie die Maus, bis sie sich vollständig von der Narkose erholt hat und die Maus aktiv ist und pflegt.
- Überwachen Sie gleichzeitig die Körperkerntemperatur der Maus, bis sie sich bei 35-36 ° C stabilisiert.
- Notieren Sie sich am Ende von 5 Minuten die Körpertemperatur der Maus. Dies ist die anfängliche Körpertemperatur zum Zeitpunkt "0" min.
HINWEIS: Wenn die Körperkerntemperatur der Maus unter 35 ° C liegt, warten Sie auf zusätzliche Zeit, bis sich das Tier von der anästhesieinduzierten Unterkühlung erholt hat. - Schnell die einzelne Maus in die vorgewärmte Mauskammer geben. Dies markiert den START des Versuchs. Es wird jeweils nur eine Maus gescreent.
3. Hitzeinduzierter Anfallstest
- Nachdem Sie die Maus vorsichtig auf den Boden der vorgeheizten Mauswärmekammer gelegt haben, schließen Sie die Plexiglastür und starten Sie die Kamera für die Videoaufzeichnung des Experiments.
- Starten Sie die Stoppuhr. Zeichnen Sie die Körpertemperatur der Maus vom Rektalthermometer in Abständen von 1 Minute für die Dauer des Experiments auf.
- Erhöhen Sie in regelmäßigen Abständen die Temperatur der Mauswärmekammer so, dass die Körpertemperatur der Maus mit einer Rate von 0,25-0,5 °C / min ansteigt.
HINWEIS: Ein schneller Anstieg der Körpertemperatur kann zu Hitzschlag oder Tod führen und sollte vermieden werden. - Erhöhen Sie nach diesem Protokoll die Temperatur der Mauswärmekammer alle 10 min um 5 °C, wie in Abbildung 2A dargestellt.
- Stellen Sie bei 9,5 min die Temperatur der Wärmekammer auf 55 °C ein, um die Temperatur der Wärmekammer bis zur 10. Minute auf 55 °C zu stabilisieren, wie auf der digitalen Temperaturanzeige angezeigt.
- Erhöhen Sie in ähnlicher Weise die Temperatur auf 60 ° C bei 19,5 Minuten, um die Temperatur der Wärmekammer bis zur 20. Minute auf 60 ° C zu stabilisieren. Jeder Anfalls-Screening-Versuch dauert 30 Minuten.
- Wenn die Maus einen Anfall hat (vokalisiert, zeigt Kopfnicken, Vordergliedmaßen-Klonus, Hinterbeinstreckung, fällt auf die Seite oder erlebt generalisierte tonische/klonische Krämpfe), notieren Sie die folgenden Informationen.
- Erfassen Sie die Körpertemperatur der Maus während des Anfalls (Anfallsschwellentemperatur) vom Rektaltemperaturthermometer.
- Notieren Sie die Anfallsverhaltensmerkmale wie Kopfnicken, Klonus der Vordergliedmaßen, Verlängerung der Hintergliedmaßen, Fallen auf die Seite und / oder generalisierte tonische/klonische Anfälle (GTCS), die von der Maus angezeigt werden.
- Nehmen Sie die Maus schnell, aber vorsichtig aus der Kammer und legen Sie sie auf das in Schritt 1.6 vorbereitete Kühlkissen.
HINWEIS: Wenn bei einer Maus Anfälle im Racine-Maßstab 5 auftreten und unkontrolliertes Springen auftritt, kann es schwierig sein, das Tier aus der Wärmekammer aufzunehmen und auf das Kühlkissen draußen zu übertragen. Ein typischer hitzeinduzierter Anfall dauert jedoch zwischen 30 s und 60 s.Daher sollte die Maus innerhalb von 60 s nach Beginn der hitzeinduzierten Anfallsepisode aus der Wärmekammer genommen und auf das Kühlkissen gelegt werden. - Warten Sie, bis die Körpertemperatur der Maus auf 36-37 ° C gesunken ist, bevor Sie sie in einen Auffangkäfig übertragen. Es wird jeweils nur eine Maus in einen Erholungskäfig gelegt.
HINWEIS: Mischen Sie keine Mäuse, die noch nicht für das hitzeinduzierte Screening verwendet wurden, mit der Maus, die bereits den hitzeinduzierten Anfallsversuch erlebt hat. - Schneiden Sie vorsichtig und vorsichtig das Band zwischen dem Mausschwanz und dem rektalen Sondendraht mit einer Schere, um die rektale Sonde von der Maus zu entfernen.
- Wischen Sie die Metallspitze der rektalen Sonde mit 70% Alkohol und Weichteiltüchern ab, um sie für die nächste Studie bereit zu halten.
- Beobachten Sie die Maus weiterhin im Erholungskäfig, bis sie ihre normale Aktivität (Gehen, Pflege usw.) wieder aufnimmt, bevor Sie die Maus in ihren Heimatkäfig zurückbringen. Dies markiert das ENDE des Versuchs für diese Maus.
- Zeichnen Sie den Tierstatus nach dem Assay-alive auf und erholen Sie sich von der Testsitzung oder tot. Hochintensive Anfälle mit unkontrolliertem Springen und generalisierten tonischen/klonischen Anfällen können manchmal zum Tod der Maus führen.
- Wenn eine Maus innerhalb des 30-minütigen Beobachtungszeitraums keine hitzebedingten Anfälle erleidet oder die Körpertemperatur der Maus 44 ° C erreicht, entfernen Sie die Maus aus der Wärmekammer und legen Sie sie auf das Kühlkissen, bis die Körpertemperatur der Maus auf 36-37 ° C zurückkehrt.
- Stellen Sie die Temperatur der Mauswärmekammer auf 50 °C zurück und lassen Sie sie ausgleichen, bis die Anzeigetemperatur am digitalen Temperaturregler 50 °C anzeigt.
- Wechseln Sie die Kolbeneinstreu zwischen den einzelnen Mausversuchen.
- Bereiten Sie die nächste Maus wie in Abschnitt 2 beschrieben für den Screening-Versuch vor und wiederholen Sie die Schritte aus Abschnitt 3.
4. Einschläfern der Tiere
- Obwohl sich die meisten Tiere nach hitzeinduzierten Anfällen erholen, werden nach unserer Erfahrung einige der Mäuse innerhalb von 24-48 Stunden nach hitzeinduzierten Anfällen SUDEP (Sudden Unexplained Death in EPilepsy) in ihrem Hauskäfig unterzogen. Nach Abschluss des Screenings an allen Mäusen einzeln auf hitzeinduzierte Anfälle nach dem 30-minütigen Versuch sollten alle Mäuse gemäß den IACUC-Richtlinien der Institution eingeschläfert werden.
5. Analyse der hitzeinduzierten Anfallsdaten
- Nach Abschluss des Screenings einer Kohorte von Tieren berechnen Sie den Prozentsatz der Mäuse in einem bestimmten Genotyp, die Anfälle zeigen, mit der folgenden Formel:
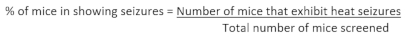
- Schätzen Sie die mittlere Anfallsschwellentemperatur von Mäusen innerhalb eines bestimmten Genotyps, indem Sie die Anfallsschwellentemperatur aller Mäuse (in Schritt 3.7 erwähnt) in diesem Genotyp, die hitzeinduzierte Anfälle aufweisen, mitteln.
- Während Sie immer noch blind für die Identität und den Genotyp sind, spielen Sie die Videoaufzeichnungen jeder Maus während des hitzeinduzierten Anfallsassay-Screenings auf einem Computerbildschirm ab, um die Schwere der Anfallsanfälle zu ermitteln.
- Geben Sie einer einzelnen Maus, die ein hitzeinduziertes Anfallsverhalten aufweist, Punktzahlen unter Verwendung der modifizierten Racine-Skala13, wie in früheren Studien beschrieben13,14. Weitere Informationen finden Sie in Tabelle 1.
- Wenn eine Maus, während sie hitzebedingte Anfälle erlebt, nur Kopfnicken zeigt, geben Sie ihr eine Punktzahl von 2. Wenn eine Maus eine Anfallsepisode mit Kopfnicken beginnt, aber auch einen Klonus der Vordergliedmaßen aufweist, umfällt und / oder springt, geben Sie ihr eine Punktzahl von 5.
- Notieren Sie die maximale Punktzahl für jede Maus mit der modifizierten Racine-Skala13, wie oben beschrieben.
- Zeichnen Sie einen Streugraphen der maximalen Racine-Scores, die von allen Mäusen in einem bestimmten Genotyp gezeigt werden.
- Vergleichen Sie statistisch die maximalen Racine-Werte zwischen verschiedenen Mausgruppen als Methode zur Bestimmung der Schwere von Verhaltensanfällen wie hitzeinduzierten Anfällen.
HINWEIS: Racin-Scores sind hilfreich, um Anfallsmerkmale zwischen verschiedenen mutierten Mäusegruppen oder Genotypen zu vergleichen. Es wird erwartet, dass die Wildtyp-Mäuse keine hitzeinduzierten Anfälle erleiden würden und nicht für Racine-Score-Vergleiche in Betracht gezogen werden müssten. - Führen Sie auf der Grundlage des experimentellen Designs eine geeignete statistische Analyse durch, um festzustellen, ob der Prozentsatz der Mäuse, die Anfälle zwischen Wildtyp- und mutierten Mäusen aufweisen, und ihre mittleren Anfallsschwellenwerte signifikant voneinander abweichen.
| Racine Punktzahl | Anfallsmerkmale | ||
| 0 | Keine Anfälle | ||
| 1 | Mund- und Gesichtsbewegungen | ||
| 2 | Kopfnicken | ||
| 3 | Clonus der Vordergliedmaße, meist ein Glied | ||
| 4 | Klonus der Vordergliedmaßen mit Aufzucht | ||
| 5 | Generalisierter tonisch-klonischer Anfall, Aufzucht, Springen, Umfallen | ||
Tabelle 1: Racine-Ergebnisse
Ergebnisse
Es wird erwartet, dass Tiermodelle mit fieberhaften Anfallsmutationen hitzebedingte Anfälle bei erhöhten Körpertemperaturen erleiden, die keine Anfälle bei den Wildtyp-Wurfpartnern induzieren. SCN1A-Mutationen wurden mit Fieberkrämpfen in Verbindung gebracht, einschließlich K1270T GEFS + -Patienten, die sowohl fieberhafte als auch afebrile generalisierte Anfälle aufweisen7. Wir untersuchten CRISPR-generierte SCN1A K1270T GEFS+-mutierte Mäuse, die kürzlich in einer Studie14 für das Auftreten von Hitzeanfällen in zwei genetischen Hintergründen beschrieben wurden - anfallsresistente 129X1/SvJ (129X1) und anfallsanfällige C57BL/NJ (B6N)-Hintergründe. Altersangepasste Wildtyp-Wurfgefährten in der Wärmekammer der Maus, die keine GEFS + -Mutationen beherbergen und daher nicht erwartet werden, dass sie hitzeinduzierte Anfälle aufweisen, dienten als Kontrollgruppe. Die Rate der Körpertemperaturänderung im Laufe der Zeit wurde bewertet, indem die mittlere Körpertemperatur von Mäusen aufgezeichnet wurde, die während des Assays jede Minute aufgezeichnet wurde. Es gab keinen Unterschied in der Änderungsrate der Körpertemperatur zwischen heterozygoten mutierten Mäusen und Wildtyp-Wurfpartnern, die in den jeweiligen genetischen Hintergründen 129X1 und B6N getestet wurden (Abbildung 2B,C). Dies deutet darauf hin, dass die Thermoregulation bei heterozygoten mutierten Mäusen von K1270T GEFS + nicht verändert ist.
Alle heterozygoten mutierten Mäuse von 129X1 (n = 15) oder B6N (n = 9) genetischen Hintergründen zeigten hitzeinduzierte Anfälle (Abbildung 2D). Keine der Wildtyp-Mäuse im 129X1-angereicherten Hintergrund (n = 13) zeigte hitzeinduzierte Anfälle (Abbildung 2D). Im Gegensatz dazu zeigte ein Drittel der getesteten Mäuse (n = 3 der 9 Mäuse) im anfallsempfindlichen B6N-Hintergrund hitzeinduzierte Anfälle. Ein statistischer Vergleich zeigt, dass der Prozentsatz der heterozygoten mutierten Mäuse, die hitzeinduzierte Anfälle aufwiesen, sowohl im genetischen Hintergrund 129X1 als auch im B6N-Bereich signifikant höher war als bei ihren jeweiligen Wildtyp-Gegenstückmäusen (Abbildung 2D, genauer Fisher-Test, 129X1 p < 0,0001; B6NJ p = 0,009). Die durchschnittliche Anfallsschwelle zwischen den heterozygoten mutierten Mäusen im genetischen Hintergrund von 129X1 und B6N war ähnlich. 129X1-mutierte Mäuse haben eine mittlere Anfallsschwelle von 42,6 ± 0,20 °C, die sich nicht signifikant von der mittleren Anfallsschwelle von 42,7 ± 0,06 °C bei B6N-Mäusen unterschied (Abbildung 2E; zweischwänziger ungepaarter Student's t-Test, p = 0,782). Es ist wichtig zu beachten, dass die mittlere Anfallsschwelle von drei B6N-Wildtyp-Mäusen, die hitzeinduzierte Anfälle aufwiesen, 43,7 ± 0,08 °C betrug und signifikant höher war als die mittlere Anfallsschwelle von 42,7 ± 0,06 °C, die von heterozygoten mutierten B6N-Mäusen gezeigt wurde (Abbildung 2E, zweischwänziger ungepaarter Student's t-Test, p < 0,0001).
Die Plexiglasfront der Kammer ermöglicht es, während des Assays kontinuierliche Videoaufnahmen zu machen, die später verwendet werden können, um die Anfallsschwere bei jeder Maus auf einer modifizierten Racine-Skala zu bewerten, wie zuvor beschrieben14,20. Während eines typischen Assays zeigten heterozygote mutierte Mäuse hitzeinduzierte Anfälle mit Vokalisierung und / oder Kopfnicken (Racine-Score 2) und gingen schnell in den Klonus der Vordergliedmaßen über, fielen auf die Seite, sprangen, die Verlängerung der Hintergliedmaßen und / oder generalisierte tonische / klonische Anfälle (Racine erzielte 3-5), wenn die Körpertemperatur etwa 42 ° C erreichte. Der maximale Racine-Score stellt das schwerste hitzeinduzierte Anfallsverhalten unter den mutierten Mäusen dar. Der maximale Racine-Score von heterozygoten mutierten Mäusen im angereicherten Hintergrund von 129X1 (n = 15) unterscheidet sich nicht von heterozygoten mutierten Mäusen im genetischen Hintergrund B6N (n = 9) (Abbildung 2F; Mann-Whitney-Test, S. > 0,9999). Dies deutet darauf hin, dass hitzeinduzierte Anfallsverhaltensmerkmale bei K1270T GEFS+-mutierten Mäusen unabhängig vom Stammhintergrund sind.
Zusammengenommen zeigen die Daten, dass alle mutierten Mäuse hitzeinduzierte Anfälle mit ähnlicher Häufigkeit, Anfallsschwellentemperatur und verhaltensbedingter Anfallsschwere in einer dehnungsunabhängigen Weise aufweisen. Die Mehrheit der Wildtyp-Wurfgefährten zeigt solche Anfälle bei oder unter 44 ° C nicht. Etwa ein Drittel der Wildtyp-Kontrollmäuse in einem anfallsempfindlichen B6N-Hintergrund zeigten hitzeinduzierte Anfälle (möglicherweise aufgrund genetischer Hintergrundeffekte), aber die Anfallsschwellentemperatur war im Vergleich zu mutierten Mäusen im selben Hintergrund signifikant höher. Diese Ergebnisse deuten darauf hin, dass mutierte Mäuse im genetischen B6N-Hintergrund aufgrund der SCN1A GEFS + -Mutation, die sie beherbergen, anfällig für hitzeinduzierte Anfälle bei niedrigeren Temperaturschwellen sind. So kann man mit diesem Protokoll hitzeinduzierte Anfälle bei epilepsiemutierten Mäusen bewerten und von Wildtyp-Wurfpaarungsmäusen unterscheiden, die entweder keine hitzeinduzierten Anfälle erleiden oder Hitzeanfälle bei deutlich höheren Temperaturen aufweisen.
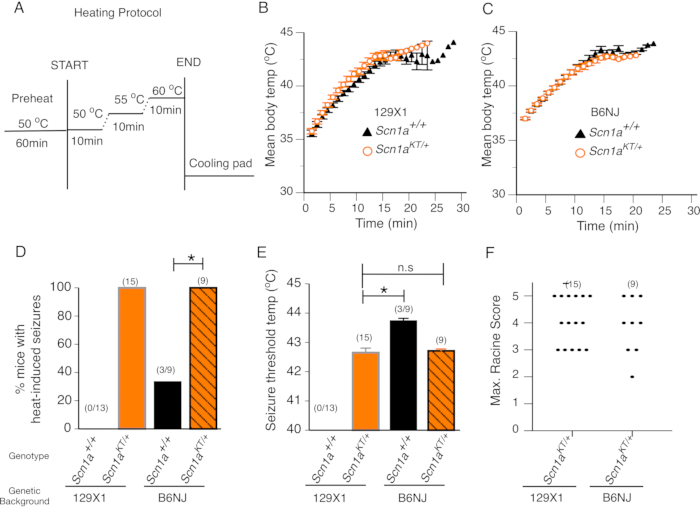
Abbildung 2: Mutierte Mäuse zeigen hitzeinduzierte Anfälle. (A) Das Erwärmungsprotokoll für das Verhaltensscreening von hitzeinduzierten Anfällen bei Mäusen. (B-C) Mittlere Körpertemperatur von Mäusen im Laufe der Zeit bei Wildtyp- (Scn1a+/+ - schwarze Dreiecke) und heterozygoten mutierten (Scn1aKT/+ - orangefarbene Kreise) Mäusen in zwei genetischen Hintergründen 129X1 bzw. B6N. (D) Prozentsatz der Mäuse, die hitzeinduzierte Anfälle in beiden genetischen Hintergründen zeigen. Wildtyp- (Scn1a+/+) und heterozygote (Scn1aKT/+) Mäuse werden durch schwarze bzw. orangefarbene Balken dargestellt. Heterozygote Mutanten in 129X1- und B6N-Hintergründen sind in orangefarbenen festen Balken bzw. orangefarbenen Balken mit schwarzen Streifen dargestellt. (E) Anfallstemperaturschwelle zu hitzeinduzierten Anfällen bei Wildtyp- (Scn1a+/+) und heterozygoten mutierten (Scn1aKT/+) Mäusen beider Stämme. (F) Streuverteilung der maximalen Racin-Scores von hitzeinduzierten Anfällen, die von heterozygoten (Scn1aKT/+) Mäusen in beiden genetischen Hintergründen gezeigt werden. Jeder Punkt repräsentiert die maximale Racine-Punktzahl in einer einzelnen Maus. Die Anzahl der Tiere in jedem Genotyp ist in Klammern angegeben. Die in den Feldern B-F dargestellten Daten sind gemeint ± S.E.M. Diese Abbildung ist gegenüber Abbildung 3 in Das et al., 2021, eNeuro14 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Wir beschreiben ein einfaches und effektives Protokoll zum Screening auf das Auftreten von hitzeinduzierten Anfällen bei Mäusen, dem Verhaltensäquivalent von Fieberkrämpfen bei menschlichen Patienten. Der Assay bewertet mehrere Parameter - einschließlich des Prozentsatzes der Mäuse, die Anfälle zeigen, der Anfallsschwelle, der Schwere der Anfälle auf einer Racine-Skala, um die Empfindlichkeit von Kontroll- und Testmäusegruppen gegenüber dem Anstieg der Körpertemperatur zu vergleichen.
Ein kritischer Schritt in diesem Protokoll besteht darin, die Wärme in der Kammer zu erhöhen und gleichzeitig die Körpertemperatur der Maus kontinuierlich zu überwachen. Es ist unerlässlich, dass die maximale Körpertemperatur, die die Mäuse in diesen Assays erfahren, 44 ° C beträgt, da Wildtiere bei Körpertemperaturen > 44 ° C hitzebedingte Anfälle erleiden können. Eine Vorbehandlung mit Vollnarkose oder Analgetika kann die Körperkerntemperatur von Tieren senken oder die Thermoregulation beeinträchtigen, was wiederum die Datenerfassung der Anfallsschwelle beeinträchtigen würde. Daher konnten Mäuse unter diesem Screening-Protokoll während des 30-minütigen Testfensters nicht mit diesen Wirkstoffen versorgt werden. Alle Verfahren müssen vom IACUC-Ausschuss der Institution genehmigt werden. Um eine kontinuierliche Überwachung der Körperkerntemperatur der Maus während des Assays zu gewährleisten, kleben Sie den rektalen Temperaturfühler sicher an den Schwanz der Mäuse. Wenn während des Assays festgestellt wird, dass die Körpertemperatur der Maus auch nach Erhöhung der Temperatur der Mauskammer für längere Zeit unverändert bleibt, stellen Sie sicher, dass der rektale Temperaturfühler nicht aus der Maus herausgekommen ist oder lose am Schwanz befestigt ist.
Der genetische Hintergrund von Mausmodellen kann die Empfindlichkeit gegenüber der SCN1A-Mutation und pharmakologisch induzierten Anfällen beeinflussen18,25,26,27. Wie in den obigen Ergebnissen diskutiert, kann der genetische Hintergrund der Mäuse ihre Anfälligkeit für hitzeinduzierte Anfälle beeinflussen. Scn1a K1270T GEFS + mutierte Mäuse wurden in zwei genetischen Hintergründen getestet - 129X1 und B6NJ, und ein kleiner Prozentsatz von Wildtyp-Mäusen (33%) im anfallsempfindlichen B6NJ-Hintergrund, wurden ebenfalls beobachtet, um hitzeinduzierten Anfällen zu unterziehen. Im Vergleich zu den heterozygoten mutierten Scn1aKT/+-Mäusen erlebten die B6NJ-Wildtyp-Mäuse jedoch hitzeinduzierte Anfälle bei einer signifikant höheren Temperaturschwelle. Dies bestätigt, dass die genetische Mutation (Scn1a K1270T), die durch CRISPR-Knock-in eingeführt wurde, die mutierten Mäuse anfälliger für Hyperthermie-induzierte Anfälle macht.
Die Annahme dieses Protokolls hat mehrere Vorteile, die im Folgenden zusammengefasst werden. Erstens, im Gegensatz zur Verwendung von Trockenluftströmen oder beheizten Lampen, bietet eine temperaturgesteuerte Zwangsluft, die in einem geschlossenen Raum eingerichtet ist, dem Experimentator mehr Kontrolle über das Aufheizen der Testarena mit der gewünschten Geschwindigkeit. Die Schritte im Heizprotokoll können leicht geändert werden, um die Starttemperatur, die Dauer jedes Schritts usw. zu erhöhen / zu verringern, um ältere Mäuse zu screenen, die schwerer oder größere Nagetiere wie Ratten sind. Zweitens liefert die kontinuierliche Überwachung der Körpertemperatur der Maus über die angeschlossene rektale Sonde wertvolle Informationen über die Rate der Körpertemperaturänderung in der einzelnen Maus während des gesamten Assays. Dies ermöglicht es dem Experimentator, genau zu beobachten, dass die Temperaturänderungsrate in der Maus 0,25-0,5 ° C / min nicht überschreitet (was für die Tiere stressig sein könnte), wenn er dieses Protokoll an andere Testarenen anpasst. Wichtig ist, dass die Rate der Änderung der Körpertemperatur im Laufe der Zeit in verschiedenen Mäusegruppen Aufschluss über ihre Fähigkeit zur Thermoregulation geben kann und hilfreich sein könnte, um zu verstehen, ob Fieberkrämpfe, die Mutationen verursachen, auch die Thermoregulation bei Mäusen verändern. Drittens stellt die kontinuierliche Überwachung der Körpertemperatur sicher, dass die mit diesem Protokoll durchgeführten Temperaturmessungen der Anfallsschwelle genau sind, da sie gleichzeitig mit dem ersten Anfall der Maus aufgezeichnet werden. Wenn die Körpertemperatur des Tieres nicht kontinuierlich überwacht wird oder die Anfallsschwellentemperatur gemessen wird, nachdem das Tier aus der Testarena genommen wurde, können die Anfallsschwellenwerte aufgrund der Zeit, die benötigt wird, um die Mäuse nach Anfällen zu behandeln, variieren. Schließlich umgeht diese Methode die Notwendigkeit, invasive Methoden zu verwenden, um Fieber (durch Injektion von Krankheitserregern) bei Mäusen zu induzieren, um Fieberkrämpfe bei menschlichen Patienten nachzuahmen.
Eine der Einschränkungen dieses Protokolls besteht darin, dass es schwierig ist, jugendliche (weniger als P30 im Alter) Mäuse auf hitzeinduzierte Anfälle zu untersuchen. Das Protokoll wurde entwickelt, um die Empfindlichkeit erwachsener Mäuse (P30-P40 und höher) gegenüber hitze- oder hyperthermieinduzierten Anfällen zu untersuchen. Nach unserer Erfahrung sind die jüngeren Wildtyp-Mäuse, insbesondere diejenigen, die unter 15 g wiegen, eher hitzeinduzierten Anfällen ausgesetzt, die auf unterentwickelte Thermoregulationsmechanismen, physiologischen thermischen Stress oder eine Kombination aus beidem zurückzuführen sein könnten. Daher ist es nicht ideal, den hitzeinduzierten Anfallsbildschirm an jugendlichen Mäusen mit diesem Protokoll durchzuführen.
Zukünftige Studien, die die EEG-Überwachung kombinieren, während die Maus hitzeinduzierten Anfällen ausgesetzt wird, können Aufschluss über EEG-Anfallsmuster von hitzeinduzierten Anfällen geben, ähnlich wie in einer früheren Studie19. Die neuronale Aktivität in bestimmten Bereichen des Mausgehirns kann durch die Kombination von optogenetischen Ansätzen und immunhistochemischen Studien nach der Gewinnung des Hirngewebes verfolgt werden. Auch die Auswirkungen von restriktiven Diäten wie der Keto-Diät auf die Verringerung von Fieberkrämpfen können bewertet werden, indem keto-gefütterte Mäuse und normale Chow-gefütterte Mäuse einem hitzeinduzierten Anfallsprotokoll unterzogen werden. In ähnlicher Weise können Epilepsie-Screening-Paradigmen entwickelt werden, um antiepileptische Wirkstoffkandidaten zu testen und zu identifizieren, die hitzeinduzierte Anfälle bei medikamentengefütterten oder behandelten Mäusen im Vergleich zu mit Fahrzeugen gefütterten oder Kontrollmäusen verbessern oder unterdrücken.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Wir danken Connor J. Smith für seine Hilfe beim Bau der maßgeschneiderten Mauswärmekammer. Wir danken den O'Dowd-Labormitgliedern, Lisha Zeng und Andrew Salgado, für die Standardisierung des Erwärmungsprotokolls in den frühen Phasen der Assay-Entwicklung. Wir danken auch Danny Benavides und Kumar Perinbam für die Videoaufzeichnung von Teilen des experimentellen Verfahrens für das Manuskript. Diese Arbeit wurde durch den NIH-Zuschuss (NS083009) unterstützt, der an D.O.D. vergeben wurde.
Materialien
| Name | Company | Catalog Number | Comments |
| Axial fan | Farnam | AF20-200-120-xx10-3.1 | Farnam custom products -Axial Fan Heater with Fan |
| Digital temperature controller | Inkbird | ITC-100RH | Inkbird digital PID temperature controller ITC-100RH with K thermocouple |
| Mouse rectal temperature probe | ThermoWorks, Braintree Scientific, Inc | RET-3 | Mouse rectal temperature probe with thermometer |
Referenzen
- Hirtz, D., et al. How common are the 'common' neurologic disorders. Neurology. 68, 326-337 (2007).
- Catterall, W. A. Sodium Channel Mutations and Epilepsy. Jasper's Basic Mechanisms of the Epilepsies. , Center for Biotechnology Information. US. Internet (2012).
- Mantegazza, M., Broccoli, V. SCN 1A /Na V 1.1 channelopathies: Mechanisms in expression systems, animal models, and human iPSC models. Epilepsia. 60, (2019).
- Stafstrom, C. E. Persistent Sodium Current and Its Role in Epilepsy. Epilepsy Currents. 7, 15-22 (2007).
- Schutte, S. S., Schutte, R. J., Barragan, E. V., O'Dowd, D. K. Model systems for studying cellular mechanisms of SCN1A-related epilepsy. Journal of Neurophysiology. 115, 1755-1766 (2016).
- Wei, F., et al. Ion Channel Genes and Epilepsy: Functional Alteration, Pathogenic Potential, and Mechanism of Epilepsy. Neuroscience Bulletin. 33, 455-477 (2017).
- Abou-Khalil, B., et al. Partial and generalized epilepsy with febrile seizures plus and a novel SCN1A mutation. Neurology. 57, 2265-2272 (2001).
- Zhang, Y. -H., et al. Genetic epilepsy with febrile seizures plus: Refining the spectrum. Neurology. 89, 1210-1219 (2017).
- Patterson, K. P., et al. Enduring memory impairments provoked by developmental febrile seizures are mediated by functional and structural effects of neuronal restrictive silencing factor. Journal of Neuroscience. 37, 3799-3812 (2017).
- Rossi, M. A. SCN1A and febrile seizures in mesial temporal epilepsy: An early signal to guide prognosis and treatment. Epilepsy Currents. 14, 189-190 (2014).
- Zhang, Y., et al. Altered gut microbiome composition in children with refractory epilepsy after ketogenic diet. Epilepsy Research. 145, 163-168 (2018).
- Meng, H., et al. The SCN1A mutation database: Updating information and analysis of the relationships among genotype, functional alteration, and phenotype. Human Mutation. 36, 573-580 (2015).
- Cheah, C. S., et al. Specific deletion of NaV1.1 sodium channels in inhibitory interneurons causes seizures and premature death in a mouse model of Dravet syndrome. Proceedings of the National Academy of Science U.S.A. 109, 14646-14651 (2012).
- Das, A., et al. Interneuron dysfunction in a new mouse model of SCN1A GEFS. eNeuro. , (2021).
- Kalume, F., et al. Sudden unexpected death in a mouse model of Dravet syndrome. Journal of Clinical Investigations. 123, 1798-1808 (2013).
- Martin, M. S., et al. Altered function of the SCN1A voltage-gated sodium channel leads to gamma-aminobutyric acid-ergic (GABAergic) interneuron abnormalities. Journal of Biological Chemistry. 285, 9823-9834 (2010).
- Rubinstein, M., et al. Dissecting the phenotypes of Dravet syndrome by gene deletion. Brain. 138, 2219-2233 (2015).
- Yu, F. H., et al. Reduced sodium current in GABAergic interneurons in a mouse model of severe myoclonic epilepsy in infancy. Nature Neuroscience. 9, 1142-1149 (2006).
- Dutton, S. B. B., et al. Early-life febrile seizures worsen adult phenotypes in Scn1a mutants. Experimental Neurology. 293, 159-171 (2017).
- Cheah, C. S., et al. Specific deletion of NaV1.1 sodium channels in inhibitory interneurons causes seizures and premature death in a mouse model of Dravet syndrome. Proceedings of the National Academy of Science U.S.A. 109, 14646-14651 (2012).
- Oakley, J. C., Cho, A. R., Cheah, C. S., Scheuer, T., Catterall, W. A. Synergistic GABA-enhancing therapy against seizures in a mouse model of Dravet Syndrome. Journal of Pharmacology and Experimental Therapeutics. 345, 215-224 (2013).
- Ricobaraza, A., et al. Epilepsy and neuropsychiatric comorbidities in mice carrying a recurrent Dravet syndrome SCN1A missense mutation. Scientific Reports. 9, (2019).
- Warner, T. A., Liu, Z., Macdonald, R. L., Kang, J. -Q. Heat induced temperature dysregulation and seizures in Dravet Syndrome/GEFS+ Gabrg2+/Q390X mice. Epilepsy Research. 134, 1-8 (2017).
- Eun, B. -L., Abraham, J., Mlsna, L., Kim, M. J., Koh, S. Lipopolysaccharide potentiates hyperthermia-induced seizures. Brain and Behavior. 5, 00348(2015).
- Miller, A. R., Hawkins, N. A., McCollom, C. E., Kearney, J. A. Mapping genetic modifiers of survival in a mouse model of Dravet syndrome. Genes Brain and Behavior. 13, 163-172 (2013).
- Mistry, A. M., et al. Strain- and age-dependent hippocampal neuron sodium currents correlate with epilepsy severity in Dravet syndrome mice. Neurobiology of Disease. 65, 1-11 (2014).
- Ogiwara, I., et al. Nav1.1 localizes to axons of parvalbumin-positive inhibitory interneurons: a circuit basis for epileptic seizures in mice carrying an Scn1a gene mutation. Journal of Neuroscience. 27, 5903-5914 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten