Method Article
Un dépistage comportemental des crises induites par la chaleur dans des modèles murins d’épilepsie
Dans cet article
Résumé
Le but de la méthode est de dépister l’hyperthermie ou les crises induites par la chaleur dans des modèles murins. Le protocole décrit l’utilisation d’une chambre construite sur mesure avec une surveillance continue de la température corporelle pour déterminer si une température corporelle élevée entraîne des convulsions.
Résumé
Les modèles murins transgéniques se sont révélés être des outils puissants dans l’étude de divers aspects des troubles neurologiques humains, y compris l’épilepsie. Les épilepsies génétiques associées au SCN1A comprennent un large éventail de troubles épileptiques avec une pénétrance incomplète et une variabilité clinique. Les mutations SCN1A peuvent entraîner une grande variété de phénotypes épileptiques allant de simples convulsions fébriles associées à la fièvre (FS) auto-limitées, à l’épilepsie génétique de niveau modéré avec convulsions fébriles plus (GEFS +) au syndrome de Dravet (DS) plus sévère. Bien que les FS soient couramment observés chez les enfants de moins de 6 à 7 ans qui ne souffrent pas d’épilepsie génétique, les FS chez les patients GEFS+ continuent de se produire à l’âge adulte. Traditionnellement, les FS expérimentales ont été induites chez la souris en exposant l’animal à un flux d’air sec ou à des lampes chauffantes, et le taux de changement de la température corporelle n’est souvent pas bien contrôlé. Ici, nous décrivons une chambre de chauffage sur mesure, avec une façade en plexiglas, équipée d’un régulateur de température numérique et d’un ventilateur électrique équipé d’un chauffage, qui peut envoyer de l’air forcé chauffé dans l’arène de test de manière contrôlée par la température. La température corporelle d’une souris placée dans la chambre, surveillée par une sonde rectale, peut être augmentée à 40-42 °C de manière reproductible en augmentant la température à l’intérieur de la chambre. La surveillance visuelle continue des animaux pendant la période de chauffage démontre l’induction de crises induites par la chaleur chez les souris porteuses d’une mutation FS à une température corporelle qui ne provoque pas de crises comportementales chez les compagnons de portée de type sauvage. Les animaux peuvent être facilement retirés de la chambre et placés sur un coussin de refroidissement pour ramener rapidement la température corporelle à la normale. Cette méthode fournit un protocole de dépistage simple, rapide et reproductible pour l’apparition de crises induites par la chaleur dans des modèles murins d’épilepsie.
Introduction
L’épilepsie, la quatrième famille la plus courante de troubles neurologiques aux États-Unis1, se caractérise par un déséquilibre de la pulsion excitatrice et inhibitrice dans le SNC qui conduit à des crises récurrentes. Des convulsions fébriles (FS) ou des convulsions associées à la fièvre peuvent survenir dans la population générale, le plus souvent chez les enfants dès l’âge de 3 mois à 6-7 ans. Cependant, chez certaines personnes présentant des mutations génétiques, le plus souvent dans un gène du canal sodique, la FS peut persister au-delà de l’âge de 7 ans à l’âge adulte. Cette condition est appelée convulsions fébriles plus ou FS +. Les progrès rapides dans le séquençage du génome ont permis d’identifier plus de 1 300 mutations dans le gène du canal ionique sodium humain SCN1A, ce qui en fait un point chaud pour les mutations de l’épilepsie. Les mutations SCN1A ont été liées à un large éventail de troubles épileptiques, y compris les convulsions fébriles (FS), l’épilepsie génétique avec convulsions fébriles plus (GEFS +) et le syndrome de Dravet (DS)2,3,4,5,6. Environ 20% des mutations faux-sens SCN1A conduisent à GEFS + 5,7,8. Les antécédents pédiatriques de SS complexes ou prolongés dans l’enfance peuvent par la suite se transformer en formes plus débilitantes d’épilepsie telles que l’épilepsie du lobe temporal (TLE)9,10,11. Le syndrome de Dravet survient en raison de mutations de troncature ou de perte de mutations fonctionnelles dans SCN1A et est une forme grave d’épilepsie intraitable, avec l’apparition chez l’enfant de convulsions fébriles qui se transforment en crises réfractaires, et est souvent associé à des déficiences cognitives, développementales et motrices2,5,12 . Étant donné que de nombreuses personnes atteintes de GEFS+ et/ou de DS présentent des convulsions fébriles, il devient impératif de développer de nouvelles thérapies pour mieux lutter contre ces troubles épileptiques.
Les modèles animaux d’épilepsie associée au SCN1A se sont révélés inestimables pour caractériser différents types de crises (fébriles vs généralisées) et disséquer le mécanisme neuronal de génération de crises13,14,15,16,17,18. Bien que l’étude des crises spontanées via des enregistrements EEG / EMG dans le cerveau des rongeurs soit bien établie et constitue un outil très utile, seules quelques études ont tenté d’imiter les crises fébriles dans des modèles murins14,16,19,20,21,22,23 . Des études antérieures ont utilisé un jet d’air sec chauffé, ou un cylindre de méthacrylate équipé d’un système thermique, ou des lampes chauffantes avec un régulateur de température dans des arènes d’essai fermées9,16,21,22,23,24 pour induire des crises par hyperthermie. Afin d’augmenter la température corporelle dans un environnement plus contrôlé, le protocole décrit ici utilise une chambre construite sur mesure avec un système de chauffage à température contrôlée qui a permis des taux reproductibles d’augmentation de la température corporelle d’une souris à l’intérieur de la chambre. La chambre de chauffage a été construite en bois (longueur 40 cm x largeur 34 cm x hauteur 31 cm) et a été équipée d’un régulateur de température numérique avec un thermocouple K. Un petit ventilateur axial équipé d’un réchauffeur sur le panneau arrière de la chambre dirige l’air chauffé dans la chambre régulée par un régulateur de température numérique. Ce système de chauffage à air pulsé permet de contrôler la vitesse à laquelle la température de la chambre augmente. (Figure 1A,B). Le thermocouple K situé à l’intérieur de la chambre de chauffage en bois envoie un retour d’information au régulateur de température numérique, afin de maintenir des températures constantes à l’intérieur de la boîte pendant le test. Le réglage de la température sur le régulateur de température numérique permet au ventilateur électrique d’envoyer de l’air forcé chauffé à travers les bouches d’aération pour chauffer uniformément la chambre (Figure 1A). Le panneau avant de la chambre de chaleur est une feuille de plexiglas transparent pour permettre un enregistrement vidéo facile des essais.
Des souris adultes (P30-P40), hétérozygotes pour une mutation faux-sens dans SCN1A qui provoque GEFS+ et un nombre égal de compagnons de portée de type sauvage servant de groupe témoin, ont été sélectionnées pour chaque expérience. Les animaux, mâles et femelles, utilisés dans ces études pesaient au moins 15 g, car les souris de type sauvage pesant moins étaient plus sensibles aux crises induites par la chaleur que les animaux plus lourds du même âge. Dans l’étude pilote, on a observé des souris mutantes et de type sauvage à la recherche des coins les plus froids de la chambre à l’arrière et y sont restées pendant de longues périodes. Pour contourner ce problème, la taille effective du plancher à l’intérieur de l’arène d’essai de la chambre thermique a été réduite à 16,5 cm x largeur 21,5 cm x hauteur 27,5 cm en plaçant un bloc de bois B (dimensions 20 cm x 8 cm x 7,2 cm) sur le côté droit de la chambre (Figure 1A). La chambre thermique a été construite en contreplaqué de 1,9 cm d’épaisseur (longueur 40 cm x largeur 34 cm x hauteur 31 cm) recouvert de stratifié blanc et équipé d’un régulateur de température numérique avec un thermocouple K. La surface stratifiée des parois de la chambre est imperméable et peut être facilement désinfectée entre les essais en essuyant avec 70% d’éthanol. La température de la chambre thermique a d’abord été réglée à 50 °C et préchauffée pendant au moins 1 h avant le début de l’expérience, afin d’assurer un chauffage uniforme à l’intérieur de la chambre. Chaque souris a été équipée d’un thermomètre rectal pour une surveillance continue de la température corporelle tout au long de l’expérience. Une seule souris a été placée dans la chambre à la fois et la température a été maintenue à 50 ° C entre la 1ère et la 10ème minute. La température a ensuite été portée à 55 °C pendant la 11e à la 20e minute, puis à 60 °C pendant la 21e à la 30e minute. Il en a résulté un taux reproductible d’augmentation de la température corporelle de la souris (Figure 2A). Chaque essai a été filmé et l’analyse comportementale a été menée hors ligne.
Le protocole de chauffage peut être facilement modifié pour changer la température initiale de la chambre thermique et la vitesse à laquelle la chambre est chauffée, ce qui modifie à son tour la vitesse à laquelle la température corporelle de la souris est élevée pendant le test. Ainsi, cette méthode offre plus de flexibilité par rapport aux méthodes traditionnelles dans la mise en place des écrans comportementaux impliquant des crises induites par la chaleur. Le protocole de crise induite par la chaleur peut également être utilisé pour dépister les médicaments antiépileptiques qui rendent les souris mutantes plus résistantes aux crises induites par la chaleur ou augmentent la température seuil à laquelle les crises sont observées. De même, les effets bénéfiques des régimes restrictifs tels que le régime céto sur les crises induites par la chaleur peuvent être examinés chez les souris normales nourries au chow par rapport aux souris nourries au céto.
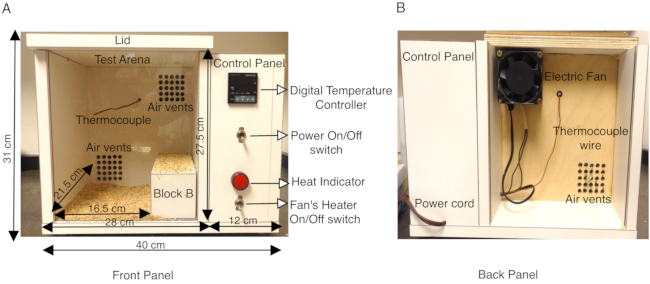
Figure 1 : Description de la chambre chauffante de la souris construite sur mesure. (A) Le panneau avant de la chambre chauffante en bois de la souris montre le panneau de commande latéral contenant l’interrupteur Power ON/OFF qui allume le régulateur de température numérique, le thermocouple K, l’interrupteur ON/OFF du radiateur soufflant et l’indicateur de chaleur. Les dimensions extérieures de la boîte et de l’arène de test intérieure sont indiquées en cm. Un bloc de bois B utilisé pour réduire efficacement la surface de l’arène d’essai est également montré. Le fond de l’arène de test est recouvert de litière en torchis pour empêcher les souris d’entrer directement en contact avec des surfaces en bois chauffées. (B) Le panneau arrière de la chambre de chaleur montre le ventilateur monté sur l’aération supérieure et le cordon d’alimentation pour fournir de l’électricité à la chambre. Cette figure est modifiée à partir de la figure 3 dans Das et al., 2021, eNeuro14. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocole
Toutes les procédures animales ont été effectuées conformément aux directives de l’Institutional Animal Care and Use Committee (IACUC) de l’Université de Californie à Irvine.
1. Préparation au test de crise induite par la chaleur
- Allumez le bouton De mise sous tension de la chambre de chauffage, suivi du bouton Allumer la chaleur .
- Réglez la température de la chambre thermique à 50 °C à l’aide du clavier du régulateur de température numérique.
- Attendez au moins 1 h pour préchauffer la chambre à 50 °C avant d’introduire la première souris dans la chambre. Le préchauffage assure un chauffage uniforme à l’intérieur de la chambre.
- Tapisser le sol de la chambre chauffante de la souris avec une litière en torchis.
- Montez une caméra d’enregistrement vidéo devant la chambre de chaleur pour enregistrer chaque essai de dosage de crise induite par la chaleur.
- Tapisser une boîte de Petri de 140 mm de diamètre avec d’épaisses couches de papier de soie et la placer sur de la glace pour servir de tampon de refroidissement.
REMARQUE: À la fin du test, la souris individuelle sera transférée sur le coussin de refroidissement précélindé pour aider à faire baisser leur température corporelle élevée.
2. Préparation de la souris au test de crise induite par la chaleur
- Sélectionnez 10 souris adultes (P30-P40), 5 porteuses de la mutation causant l’épilepsie et 5 des compagnons de portée de type sauvage pour le test de dépistage des crises induites par la chaleur.
REMARQUE: Les souris de type sauvage, ne nourrissant aucune mutation causant l’épilepsie, ne présentent pas de crises induites par la chaleur à des températures inférieures à 44 ° C et servent de groupe témoin. - Peser chaque souris à utiliser pour le test de dépistage et enregistrer son poids corporel. Seules les souris pesant 15 g ou plus doivent être utilisées pour le test.
- Filtrez une souris à la fois dans la chambre de chauffage de la souris.
- Anesthésiez brièvement la souris pendant 10 à 15 s en utilisant quelques gouttes d’isoflurane au fond d’un pot à cloche.
- Sortez l’animal du pot à cloche et placez-le sur une serviette en papier.
- Assurez-vous que la souris est complètement anesthésiée en vérifiant que la souris ne répond pas à un pincement d’orteil nocif.
- Enduisez l’extrémité métallique de la sonde de température rectale d’un lubrifiant (comme de la vaseline) et insérez-la doucement dans la souris à une profondeur inférieure ou égale à 2 cm.
- Fixez la sonde rectale à la queue de la souris avec du ruban adhésif, afin que la sonde ne sorte pas pendant le test.
REMARQUE: Alternativement, placez l’animal dans un cône de retenue de souris et insérez la sonde de température rectale. Fixez-le en scotchant à la queue. - Assurez-vous que la sonde rectale est connectée à un multimètre qui affiche la température corporelle interne de la souris.
- Placez l’animal dans une cage fraîche bordée de litière en torchis, c’est-à-dire la cage de récupération.
- Démarrez une minuterie et attendez 5 min. Observez la souris jusqu’à ce qu’elle se soit complètement remise de l’anesthésie et que la souris soit active et en toilettage.
- Simultanément, surveillez la température corporelle centrale de la souris jusqu’à ce qu’elle se stabilise à 35-36 ° C.
- Au bout de 5 min, notez la température corporelle de la souris. Il s’agit de la température corporelle initiale au temps « 0 » min.
REMARQUE: Si la température corporelle centrale de la souris est inférieure à 35 ° C, attendez plus de temps pour que l’animal se remette de l’hypothermie induite par l’anesthésie. - Transférez rapidement la souris individuelle dans la chambre de souris préchauffée. Cela marque le DÉBUT de l’essai expérimental. Une seule souris est filtrée à la fois.
3. Dosage des crises induites par la chaleur
- Après avoir délicatement placé la souris sur le sol de la chambre chauffante préchauffée, fermez la porte en plexiglas et démarrez la caméra pour l’enregistrement vidéo de l’expérience.
- Démarrez le chronomètre. Enregistrez la température corporelle de la souris à partir du thermomètre rectal à des intervalles de 1 minute pendant toute la durée de l’expérience.
- À intervalles réguliers, augmentez la température de la chambre de chaleur de la souris de sorte que la température corporelle de la souris augmente à un taux de 0,25-0,5 ° C / min.
REMARQUE: L’augmentation rapide de la température corporelle peut entraîner un coup de chaleur ou la mort et doit être évitée. - En suivant ce protocole, augmentez la température de la chambre de chaleur de la souris de 5 °C toutes les 10 minutes, comme illustré à la figure 2A.
- À 9,5 min, réglez la température de la chambre thermique à 55 °C, pour stabiliser la température de la chambre thermique à 55 °C à la 10e minute comme indiqué sur l’affichage numérique de la température.
- De même, augmentez la température à 60 °C à 19,5 min pour stabiliser la température de la chambre thermique à 60 °C à la 20e minute. Chaque essai de dépistage des crises dure 30 min.
- Si la souris a une crise (vocalise, montre un hochement de tête, clonage des membres antérieurs, extension des membres postérieurs, tombe sur le côté ou éprouve des convulsions toniques / cloniques généralisées), notez les informations suivantes.
- Enregistrez la température corporelle de la souris pendant la crise (température seuil de saisie) à partir du thermomètre à température rectale.
- Enregistrez les caractéristiques du comportement épileptique telles que le hochement de tête, le clonage des membres antérieurs, l’extension des membres postérieurs, les chutes sur le côté et / ou les crises toniques / cloniques généralisées (GTCS) affichées par la souris.
- Prenez rapidement mais doucement la souris dans la chambre et placez-la sur le coussin de refroidissement préparé à l’étape 1.6.
REMARQUE: Si une souris subit des crises de Racine à l’échelle 5 et présente des sauts incontrôlés, il peut être difficile de ramasser l’animal dans la chambre de chaleur et de le transférer sur le coussin de refroidissement à l’extérieur. Cependant, une crise typique induite par la chaleur dure entre 30 s et 60 s.Ainsi, la souris doit être sortie de la chambre de chaleur et placée sur le coussin de refroidissement dans les 60 s suivant le début de l’épisode de crise induite par la chaleur. - Attendez que la température corporelle de la souris descende à 36-37 °C, avant de la transférer dans une cage de récupération. Une seule souris est placée dans une cage de récupération à la fois.
REMARQUE: Ne mélangez pas des souris qui n’ont pas encore été utilisées pour le dépistage induit par la chaleur avec la souris qui a déjà expérimenté l’essai expérimental de crise induite par la chaleur. - Coupez doucement et soigneusement le ruban adhésif entre la queue de la souris et le fil de la sonde rectale avec une paire de ciseaux pour retirer la sonde rectale de la souris.
- Essuyez l’extrémité métallique de la sonde rectale avec 70% d’alcool et des lingettes pour les tissus mous pour la garder prête pour le prochain essai.
- Continuez à observer la souris dans la cage de récupération jusqu’à ce qu’elle reprenne une activité normale (marche, toilettage, etc.), avant de la ramener dans sa cage d’origine. Cela marque la fin de l’essai expérimental pour cette souris.
- Enregistrer le statut de l’animal après le test vivant et récupéré de la séance d’essai ou mort. Les crises de haute intensité impliquant des sauts incontrôlés et des crises toniques / cloniques généralisées peuvent parfois entraîner la mort de la souris.
- Si une souris ne subit pas de crises induites par la chaleur au cours de la période d’observation de 30 minutes ou si la température corporelle de la souris atteint 44 °C, retirez la souris de la chambre chauffante et placez-la sur le coussin de refroidissement jusqu’à ce que la température corporelle de la souris revienne à 36-37 °C.
- Réinitialisez la température de la chambre chauffante de la souris à 50 °C et laissez-la s’équilibrer jusqu’à ce que la température d’affichage sur le régulateur de température numérique affiche 50 °C.
- Changer la litière en épi entre les essais individuels sur les souris.
- Préparez la souris suivante pour l’essai de dépistage comme décrit à la rubrique 2 et répétez les étapes de la rubrique 3.
4. Euthanasier les animaux
- Bien que la plupart des animaux récupèrent des crises post-induites par la chaleur, selon notre expérience, quelques-unes des souris subissent sudep (mort subite inexpliquée dans EPilepsy) dans leur cage domestique dans les 24 à 48 heures suivant les crises induites par la chaleur. Après avoir terminé le dépistage individuel sur toutes les souris pour les crises induites par la chaleur après l’essai de 30 minutes, euthanasier toutes les souris conformément aux directives de l’IACUC de l’institution.
5. Analyse des données de saisie induites par la chaleur
- Après avoir terminé le dépistage d’une cohorte d’animaux, calculez le pourcentage de souris dans un génotype donné présentant des convulsions en utilisant la formule suivante:
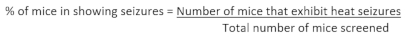
- Estimer la température moyenne du seuil de saisie des souris dans un génotype donné en faisant la moyenne de la température seuil de saisie de toutes les souris (notées à l’étape 3.7) de ce génotype qui présentent des crises induites par la chaleur.
- Tout en étant toujours aveugle à l’identité et au génotype, rejouez les enregistrements vidéo de chacune des souris pendant le dépistage des crises induites par la chaleur sur un écran d’ordinateur pour noter la gravité des crises.
- Donnez des scores à une souris individuelle présentant un comportement de crise induit par la chaleur en utilisant l’échelle de Racine modifiée13 telle que décrite par des études antérieures13,14. Voir le tableau 1 pour plus de détails.
- Si une souris, alors qu’elle subit des crises induites par la chaleur, ne montre que des hochements de tête, donnez-lui un score de 2. Si une souris commence un épisode de crise avec un hochement de tête mais présente également un clonus du membre antérieur, une chute et / ou un saut, donnez-lui un score de 5.
- Enregistrez le score maximal pour chaque souris à l’aide de l’échelle racine modifiée13 comme décrit ci-dessus.
- Tracez un graphique de dispersion des scores de Racine maximaux présentés par toutes les souris dans un génotype donné.
- Comparez statistiquement les scores de Racine maximums entre différents groupes de souris comme méthode pour déterminer la gravité des crises comportementales telles que les crises induites par la chaleur.
REMARQUE: Les scores de Racine sont utiles pour comparer les caractéristiques des crises entre différents groupes de souris mutantes ou génotypes. On s’attend à ce que les souris de type sauvage ne subissent pas de crises induites par la chaleur et n’aient pas à être prises en compte pour les comparaisons de score Racine. - Sur la base d’une conception expérimentale, effectuer une analyse statistique appropriée pour déterminer si le pourcentage de souris présentant des crises entre des souris de type sauvage et des souris mutantes, et leurs valeurs de température seuil moyenne de saisie sont significativement différentes les unes des autres.
| Racine Score | Caractéristiques épileptiques | ||
| 0 | Pas de crises | ||
| 1 | Mouvements de la bouche et du visage | ||
| 2 | Hochement de tête | ||
| 3 | Clonus du membre antérieur, généralement un membre | ||
| 4 | Clonus de membres antérieurs avec élevage | ||
| 5 | Crise tonique-clonique généralisée, élevage, saut, chute | ||
Tableau 1 : Scores de Racine.
Résultats
On s’attend à ce que les modèles animaux présentant des mutations de convulsions fébriles subissent des crises induites par la chaleur à des températures corporelles élevées qui n’induisent pas de crises chez les compagnons de portée de type sauvage. Les mutations SCN1A ont été associées à des convulsions fébriles, y compris des patients K1270T GEFS+, qui présentent à la fois des convulsions fébriles et des crises généralisées d’afébrile7. Nous avons examiné les souris mutantes SCN1A K1270T GEFS+ générées par CRISPR récemment décrites dans une étude14 pour la présence de crises de chaleur dans deux contextes génétiques - 129X1/SvJ résistant aux crises (129X1) et C57BL/NJ (B6N) sensibles aux crises. Les compagnons de litière de type sauvage appariés selon l’âge dans la chambre de chaleur de la souris qui ne présentent aucune mutation GEFS + et ne devraient donc pas présenter de crises induites par la chaleur, ont servi de groupe témoin. Le taux de variation de la température corporelle au fil du temps a été évalué en traçant la température corporelle moyenne des souris enregistrée chaque minute pendant le test. Il n’y avait aucune différence dans le taux de changement de température corporelle entre les souris mutantes hétérozygotes et les compagnons de portée de type sauvage testés dans les contextes génétiques respectifs 129X1 et B6N (Figure 2B, C). Cela suggère que la thermorégulation n’est pas altérée chez les souris mutantes hétérozygotes K1270T GEFS+.
Toutes les souris mutantes hétérozygotes issues de milieux génétiques 129X1 (n = 15) ou B6N (n = 9) présentaient des crises induites par la chaleur (Figure 2D). Aucune des souris de type sauvage dans le fond enrichi 129X1 (n = 13) n’a présenté de crises induites par la chaleur (Figure 2D). En revanche, un tiers des souris testées (n = 3 sur les 9 souris) dans le fond B6N sensible aux crises ont présenté des crises induites par la chaleur. La comparaison statistique montre que le pourcentage de souris mutantes hétérozygotes présentant des crises induites par la chaleur était significativement plus élevé que leurs homologues de type sauvage respectifs dans les milieux génétiques 129X1 et B6N (Figure 2D, test exact de Fisher, 129X1 p < 0,0001; B6NJ p = 0,009). La température moyenne du seuil de saisie entre les souris mutantes hétérozygotes dans les antécédents génétiques 129X1 et B6N était similaire. Les souris mutantes 129X1 ont une température seuil de saisie moyenne de 42,6 ± 0,20 °C, ce qui n’était pas significativement différent de la température seuil moyenne de saisie de 42,7 ± 0,06 °C observée chez les souris B6N (Figure 2E; test t de Student non apparié à deux queues, p = 0,782). Il est important de noter que la température seuil moyenne de saisie de trois souris de type sauvage B6N présentant des crises induites par la chaleur était de 43,7 ± 0,08 °C et significativement plus élevée que le seuil de crise moyen de 42,7 ± 0,06 °C affiché par les souris mutantes hétérozygotes B6N (Figure 2E, test t de Student non apparié à deux queues, p < 0,0001).
L’avant en plexiglas de la chambre permet de faire des enregistrements vidéo continus pendant le test qui peuvent être utilisés plus tard pour noter la gravité des crises chez chaque souris sur une échelle de Racine modifiée comme décrit précédemment14,20. Au cours d’un essai typique, les souris mutantes hétérozygotes présenteraient des crises induites par la chaleur avec vocalisation et / ou hochement de tête (score de Racine 2), et passeraient rapidement au clonus du membre antérieur, tombant sur le côté, sautant, extension des membres postérieurs et / ou crises toniques / cloniques généralisées (scores de Racine 3-5) lorsque la température corporelle atteignait environ 42 ° C. Le score maximal de Racine représente le comportement de crise induit par la chaleur le plus sévère chez les souris mutantes. Le score maximal de Racine des souris mutantes hétérozygotes dans un fond enrichi 129X1 (n = 15) n’est pas différent de celui des souris mutantes hétérozygotes dans le fond génétique B6N (n = 9) (Figure 2F; Test de Mann-Whitney, p > 0,9999). Cela suggère que les caractéristiques de comportement des crises induites par la chaleur chez les souris mutantes K1270T GEFS+ sont indépendantes du fond de la souche.
Prises ensemble, les données démontrent que toutes les souris mutantes présentent des crises induites par la chaleur avec une fréquence, une température seuil de saisie et une gravité de crise comportementale similaires d’une manière indépendante de la souche. La majorité des compagnons de portée de type sauvage ne présentent pas de telles crises à une température égale ou inférieure à 44 °C. Environ un tiers des souris témoins de type sauvage dans un fond B6N sensible aux crises présentaient des crises induites par la chaleur (peut-être en raison d’effets de fond génétiques), mais la température seuil de saisie était significativement plus élevée que celle des souris mutantes dans le même contexte. Ces résultats suggèrent que les souris mutantes dans le fond génétique B6N sont sensibles aux crises induites par la chaleur à des seuils de température plus bas en raison de la mutation SCN1A GEFS + qu’elles hébergent. Ainsi, en utilisant ce protocole, on peut évaluer les crises induites par la chaleur chez les souris mutantes de l’épilepsie et les distinguer des souris compagnons de litière de type sauvage, qui ne subissent pas de crises induites par la chaleur ou présentent des crises de chaleur à des températures significativement plus élevées.
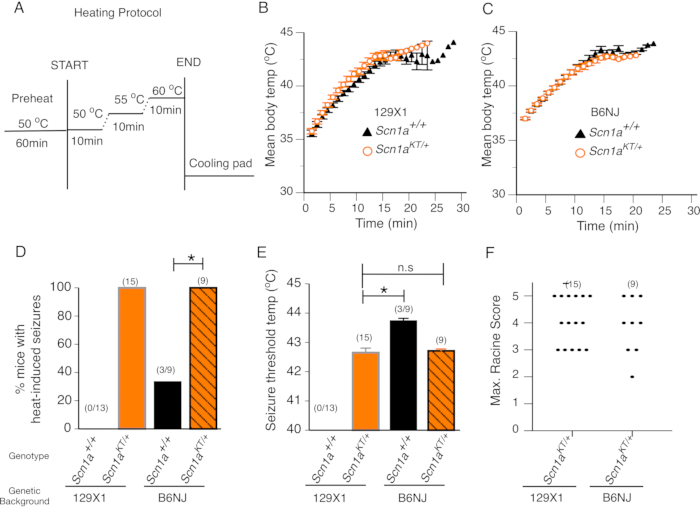
Figure 2: Les souris mutantes présentent des crises induites par la chaleur. (A) Le protocole de chauffage pour le dépistage comportemental des crises induites par la chaleur chez la souris. (B-C) Température corporelle moyenne des souris au fil du temps chez les souris de type sauvage (Scn1a+/+ - triangles noirs) et mutantes hétérozygotes (Scn1aKT/+ - cercles orange) dans deux milieux génétiques 129X1 et B6N, respectivement. (D) Pourcentage de souris présentant des crises induites par la chaleur dans les deux contextes génétiques. Les souris de type sauvage (Scn1a+/+) et hétérozygotes (Scn1aKT/+) sont représentées par des barres noires et oranges, respectivement. Les mutants hétérozygotes dans les arrière-plans 129X1 et B6N sont représentés dans des barres pleines orange et des barres orange avec des bandes noires, respectivement. (E) Seuil de température de saisie pour les crises induites par la chaleur chez les souris de type sauvage (Scn1a+/+) et mutantes hétérozygotes (Scn1aKT/+) dans les deux souches. (F) Distribution de dispersion des scores racine maximaux de crises induites par la chaleur présentées par des souris hétérozygotes (Scn1aKT/+) dans les deux milieux génétiques. Chaque point représente le score Racine maximal dans une seule souris. Le nombre d’animaux dans chaque génotype est indiqué entre parenthèses. Les données présentées dans les panneaux B à F sont moyennes ± S.E.M. Cette figure est modifiée à partir de la figure 3 dans Das et al., 2021, eNeuro14. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Nous décrivons un protocole simple et efficace pour dépister l’apparition de crises induites par la chaleur chez la souris, l’équivalent comportemental des crises fébriles chez les patients humains. Le test évalue plusieurs paramètres - y compris le pourcentage de souris présentant des convulsions, le seuil de crise, la gravité des crises sur une échelle de Racine, afin de comparer la sensibilité des groupes de souris témoins et de test à l’augmentation de la température corporelle.
Une étape critique de ce protocole consiste à augmenter la chaleur dans la chambre tout en surveillant en permanence la température corporelle de la souris. Il est impératif que la température corporelle maximale que les souris connaîtront dans ces essais soit de 44 ° C, car les animaux de type sauvage peuvent subir des crises induites par la chaleur à des températures corporelles >44 ° C. Le prétraitement sous anesthésie générale ou analgésiques pourrait réduire la température corporelle centrale des animaux ou interférer avec la thermorégulation, ce qui à son tour confondrait la collecte de données sur la température du seuil de saisie. Ainsi, les souris sous ce protocole de dépistage n’ont pas pu recevoir ces agents pendant la fenêtre d’essai de 30 minutes. Toutes les procédures doivent être approuvées par le comité de l’IACUC de l’institution. Pour assurer une surveillance continue de la température corporelle centrale de la souris pendant le test, collez solidement la sonde de température rectale à la queue des souris. Si, pendant le test, la température corporelle de la souris reste inchangée pendant de longues périodes, même après avoir augmenté la température de la chambre de la souris, assurez-vous que la sonde de température rectale n’est pas sortie de la souris ou n’est pas attachée lâchement à la queue.
Le contexte génétique des modèles murins peut affecter la sensibilité à la mutation SCN1A et aux crises pharmacologiquement induites18,25,26,27. Comme discuté dans les résultats ci-dessus, le fond génétique des souris peut influencer leur susceptibilité aux crises induites par la chaleur. Scn1a Des souris mutantes K1270T GEFS+ ont été testées dans deux contextes génétiques - 129X1 et B6NJ, et un faible pourcentage de souris de type sauvage (33%) dans le fond B6NJ sensible aux crises, ont également été observées pour subir des crises induites par la chaleur. Cependant, par rapport aux souris mutantes hétérozygotes Scn1aKT/+, les souris de type sauvage B6NJ ont connu des crises induites par la chaleur à un seuil de température significativement plus élevé. Cela confirme que la mutation génétique (Scn1a K1270T) introduite par CRISPR knock-in rend les souris mutantes plus sensibles aux crises induites par l’hyperthermie.
L’adoption de ce protocole présente plusieurs avantages, qui sont résumés ci-dessous. Tout d’abord, contrairement à l’utilisation d’un courant d’air sec ou de lampes chauffées, un air forcé à température contrôlée installé dans un espace clos offre à l’expérimentateur plus de contrôle sur le chauffage de l’arène d’essai à la vitesse souhaitée. Les étapes du protocole de chauffage peuvent être facilement modifiées pour augmenter / diminuer la température de départ, la durée de chaque étape, etc. pour dépister les souris plus âgées qui sont des rongeurs plus lourds ou plus gros tels que les rats. Deuxièmement, la surveillance continue de la température corporelle de la souris via la sonde rectale attachée fournit des informations précieuses sur le taux de changement de température corporelle chez chaque souris, tout au long du test. Cela permet à l’expérimentateur d’observer de près que le taux de changement de température chez la souris ne dépasse pas 0,25-0,5 ° C / min (ce qui pourrait être stressant pour les animaux), lors de l’adaptation de ce protocole à d’autres arènes de test. Il est important de noter que le taux de changement de la température corporelle au fil du temps dans différents groupes de souris peut faire la lumière sur leur capacité à thermoréguler et pourrait être utile pour comprendre si les convulsions fébriles causant des mutations modifient également la thermorégulation chez la souris. Troisièmement, la surveillance continue de la température corporelle garantit que les mesures de température du seuil de saisie à l’aide de ce protocole sont exactes, car elles sont enregistrées en même temps que le premier épisode de crise subi par la souris. Si la température corporelle de l’animal n’est pas surveillée en permanence ou si la température du seuil de saisie est mesurée après avoir sorti l’animal de l’arène d’essai, les valeurs seuils de saisie peuvent varier en raison du temps nécessaire pour manipuler les souris après les crises. Enfin, cette méthode contourne la nécessité d’utiliser des méthodes invasives pour induire de la fièvre (en injectant des agents pathogènes) chez la souris afin d’imiter les convulsions fébriles chez les patients humains.
L’une des limites de ce protocole est qu’il est difficile de dépister les souris juvéniles (moins de P30 en âge) pour les crises induites par la chaleur. Le protocole a été développé pour dépister la sensibilité des souris adultes (P30-P40 et plus) aux crises induites par la chaleur ou l’hyperthermie. D’après notre expérience, les jeunes souris de type sauvage, en particulier celles pesant moins de 15 g, sont plus susceptibles de subir des crises induites par la chaleur, ce qui pourrait être dû à des mécanismes de thermorégulation sous-développés, à un stress thermique physiologique ou à une combinaison des deux. Par conséquent, il n’est pas idéal d’effectuer le dépistage des crises induites par la chaleur sur des souris juvéniles en utilisant ce protocole.
Des études futures qui combinent la surveillance EEG tout en soumettant la souris à des crises induites par la chaleur peuvent faire la lumière sur les modèles de crises EEG des crises induites par la chaleur, similaires à une étude précédente19. L’activité neuronale dans des zones spécifiques du cerveau de la souris peut être tracée en combinant des approches optogénétiques et des études basées sur l’immunohistochimie après la récolte du tissu cérébral. En outre, les effets des régimes restrictifs tels que le régime céto sur la réduction des convulsions fébriles peuvent être évalués en soumettant les souris nourries au céto et les souris normales nourries au chow au protocole de crise induite par la chaleur. De même, des paradigmes de dépistage des médicaments contre l’épilepsie peuvent être développés pour tester et identifier les médicaments antiépileptiques candidats qui améliorent ou suppriment les crises induites par la chaleur chez les souris nourries ou traitées par rapport aux souris nourries au véhicule ou témoins.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Nous tenons à remercier Connor J. Smith pour son aide dans la construction de la chambre chauffante personnalisée de la souris. Nous reconnaissons l’aide des membres du laboratoire O’Dowd, Lisha Zeng et Andrew Salgado, pour normaliser le protocole de chauffage au cours des premières étapes du développement du test. Nous remercions également Danny Benavides et Kumar Perinbam pour l’enregistrement vidéo de certaines parties de la procédure expérimentale du manuscrit. Ce travail a été soutenu par la subvention nih (NS083009) accordée à D.O.D.
matériels
| Name | Company | Catalog Number | Comments |
| Axial fan | Farnam | AF20-200-120-xx10-3.1 | Farnam custom products -Axial Fan Heater with Fan |
| Digital temperature controller | Inkbird | ITC-100RH | Inkbird digital PID temperature controller ITC-100RH with K thermocouple |
| Mouse rectal temperature probe | ThermoWorks, Braintree Scientific, Inc | RET-3 | Mouse rectal temperature probe with thermometer |
Références
- Hirtz, D., et al. How common are the 'common' neurologic disorders. Neurology. 68, 326-337 (2007).
- Catterall, W. A. Sodium Channel Mutations and Epilepsy. Jasper's Basic Mechanisms of the Epilepsies. , (2012).
- Mantegazza, M., Broccoli, V. SCN 1A /Na V 1.1 channelopathies: Mechanisms in expression systems, animal models, and human iPSC models. Epilepsia. 60, (2019).
- Stafstrom, C. E. Persistent Sodium Current and Its Role in Epilepsy. Epilepsy Currents. 7, 15-22 (2007).
- Schutte, S. S., Schutte, R. J., Barragan, E. V., O'Dowd, D. K. Model systems for studying cellular mechanisms of SCN1A-related epilepsy. Journal of Neurophysiology. 115, 1755-1766 (2016).
- Wei, F., et al. Ion Channel Genes and Epilepsy: Functional Alteration, Pathogenic Potential, and Mechanism of Epilepsy. Neuroscience Bulletin. 33, 455-477 (2017).
- Abou-Khalil, B., et al. Partial and generalized epilepsy with febrile seizures plus and a novel SCN1A mutation. Neurology. 57, 2265-2272 (2001).
- Zhang, Y. -. H., et al. Genetic epilepsy with febrile seizures plus: Refining the spectrum. Neurology. 89, 1210-1219 (2017).
- Patterson, K. P., et al. Enduring memory impairments provoked by developmental febrile seizures are mediated by functional and structural effects of neuronal restrictive silencing factor. Journal of Neuroscience. 37, 3799-3812 (2017).
- Rossi, M. A. SCN1A and febrile seizures in mesial temporal epilepsy: An early signal to guide prognosis and treatment. Epilepsy Currents. 14, 189-190 (2014).
- Zhang, Y., et al. Altered gut microbiome composition in children with refractory epilepsy after ketogenic diet. Epilepsy Research. 145, 163-168 (2018).
- Meng, H., et al. The SCN1A mutation database: Updating information and analysis of the relationships among genotype, functional alteration, and phenotype. Human Mutation. 36, 573-580 (2015).
- Cheah, C. S., et al. Specific deletion of NaV1.1 sodium channels in inhibitory interneurons causes seizures and premature death in a mouse model of Dravet syndrome. Proceedings of the National Academy of Science U.S.A. 109, 14646-14651 (2012).
- Das, A., et al. Interneuron dysfunction in a new mouse model of SCN1A GEFS. eNeuro. , (2021).
- Kalume, F., et al. Sudden unexpected death in a mouse model of Dravet syndrome. Journal of Clinical Investigations. 123, 1798-1808 (2013).
- Martin, M. S., et al. Altered function of the SCN1A voltage-gated sodium channel leads to gamma-aminobutyric acid-ergic (GABAergic) interneuron abnormalities. Journal of Biological Chemistry. 285, 9823-9834 (2010).
- Rubinstein, M., et al. Dissecting the phenotypes of Dravet syndrome by gene deletion. Brain. 138, 2219-2233 (2015).
- Yu, F. H., et al. Reduced sodium current in GABAergic interneurons in a mouse model of severe myoclonic epilepsy in infancy. Nature Neuroscience. 9, 1142-1149 (2006).
- Dutton, S. B. B., et al. Early-life febrile seizures worsen adult phenotypes in Scn1a mutants. Experimental Neurology. 293, 159-171 (2017).
- Cheah, C. S., et al. Specific deletion of NaV1.1 sodium channels in inhibitory interneurons causes seizures and premature death in a mouse model of Dravet syndrome. Proceedings of the National Academy of Science U.S.A. 109, 14646-14651 (2012).
- Oakley, J. C., Cho, A. R., Cheah, C. S., Scheuer, T., Catterall, W. A. Synergistic GABA-enhancing therapy against seizures in a mouse model of Dravet Syndrome. Journal of Pharmacology and Experimental Therapeutics. 345, 215-224 (2013).
- Ricobaraza, A., et al. Epilepsy and neuropsychiatric comorbidities in mice carrying a recurrent Dravet syndrome SCN1A missense mutation. Scientific Reports. 9, (2019).
- Warner, T. A., Liu, Z., Macdonald, R. L., Kang, J. -. Q. Heat induced temperature dysregulation and seizures in Dravet Syndrome/GEFS+ Gabrg2+/Q390X mice. Epilepsy Research. 134, 1-8 (2017).
- Eun, B. -. L., Abraham, J., Mlsna, L., Kim, M. J., Koh, S. Lipopolysaccharide potentiates hyperthermia-induced seizures. Brain and Behavior. 5, 00348 (2015).
- Miller, A. R., Hawkins, N. A., McCollom, C. E., Kearney, J. A. Mapping genetic modifiers of survival in a mouse model of Dravet syndrome. Genes Brain and Behavior. 13, 163-172 (2013).
- Mistry, A. M., et al. Strain- and age-dependent hippocampal neuron sodium currents correlate with epilepsy severity in Dravet syndrome mice. Neurobiology of Disease. 65, 1-11 (2014).
- Ogiwara, I., et al. Nav1.1 localizes to axons of parvalbumin-positive inhibitory interneurons: a circuit basis for epileptic seizures in mice carrying an Scn1a gene mutation. Journal of Neuroscience. 27, 5903-5914 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon