Method Article
Uno schermo comportamentale per le convulsioni indotte dal calore in modelli murini di epilessia
In questo articolo
Riepilogo
L'obiettivo del metodo è quello di schermare l'ipertermia o le convulsioni indotte dal calore nei modelli murini. Il protocollo descrive l'uso di una camera costruita su misura con monitoraggio continuo della temperatura corporea per determinare se la temperatura corporea elevata porta a convulsioni.
Abstract
I modelli murini transgenici hanno dimostrato di essere strumenti potenti nello studio di vari aspetti dei disturbi neurologici umani, tra cui l'epilessia. Le epilessie genetiche associate a SCN1A comprendono un ampio spettro di disturbi convulsivi con penetranza incompleta e variabilità clinica. Le mutazioni di SCN1A possono provocare una grande varietà di fenotipi convulsivi che vanno da semplici crisi febbrili associate alla febbre (FS), epilessia genetica di livello moderato con convulsioni febbrili plus (GEFS+) alla sindrome di Dravet (DS) più grave. Sebbene le FS siano comunemente osservate nei bambini di età inferiore ai 6-7 anni che non hanno l'epilessia genetica, le FS nei pazienti GEFS+ continuano a verificarsi nell'età adulta. Tradizionalmente, le FS sperimentali sono state indotte nei topi esponendo l'animale a un flusso di aria secca o lampade di riscaldamento, e il tasso di variazione della temperatura corporea spesso non è ben controllato. Qui, descriviamo una camera di riscaldamento su misura, con un frontale in plexiglass, dotata di un regolatore di temperatura digitale e di un ventilatore elettrico dotato di riscaldatore, che può inviare aria forzata riscaldata nell'arena di prova in modo a temperatura controllata. La temperatura corporea di un topo posto nella camera, monitorata attraverso una sonda rettale, può essere aumentata a 40-42 °C in modo riproducibile aumentando la temperatura all'interno della camera. Il monitoraggio visivo continuo degli animali durante il periodo di riscaldamento dimostra l'induzione di convulsioni indotte dal calore nei topi portatori di una mutazione FS a una temperatura corporea che non provoca convulsioni comportamentali nei compagni di cucciolata selvatici. Gli animali possono essere facilmente rimossi dalla camera e posizionati su un pad di raffreddamento per riportare rapidamente la temperatura corporea alla normalità. Questo metodo prevede un protocollo di screening semplice, rapido e riproducibile per l'insorgenza di convulsioni indotte dal calore in modelli murini di epilessia.
Introduzione
L'epilessia, la quarta famiglia più comune di disturbi neurologici negli Stati Uniti1, è caratterizzata da uno squilibrio di spinta eccitatoria e inibitoria nel SNC che porta a convulsioni ricorrenti. Convulsioni febbrili (FS) o convulsioni associate alla febbre possono verificarsi nella popolazione generale, il più delle volte nei bambini già dai 3 mesi fino ai 6-7 anni di età. Tuttavia, in alcuni individui con mutazioni genetiche, il più delle volte in un gene del canale del sodio, la FS può persistere oltre l'età di 7 anni nell'età adulta. Questa condizione è indicata come convulsioni febbrili plus o FS +. I rapidi progressi nel sequenziamento del genoma hanno identificato oltre 1.300 mutazioni nel gene del canale ionico del sodio umano SCN1A, rendendolo un hotspot per le mutazioni dell'epilessia. Le mutazioni di SCN1A sono state collegate a un ampio spettro di disturbi convulsivi, tra cui convulsioni febbrili (FS), epilessia genetica con convulsioni febbrili plus (GEFS+) e sindrome di Dravet (DS)2,3,4,5,6. Circa il 20% delle mutazioni missenso di SCN1A porta a GEFS+5,7,8. La storia pediatrica di FS complessa o prolungata nell'infanzia può successivamente svilupparsi in forme più debilitanti di epilessia come l'epilessia del lobo temporale (TLE)9,10,11. La sindrome di Dravet insorge a causa di mutazioni di troncamento o mutazioni di perdita di funzione in SCN1A ed è una forma grave di epilessia intrattabile, con insorgenza infantile di convulsioni febbrili che si sviluppano in convulsioni refrattarie ed è spesso associata a disturbi cognitivi, dello sviluppo e motori2,5,12 . Poiché molti individui con GEFS + e / o DS mostrano convulsioni febbrili, diventa imperativo sviluppare nuove terapie per combattere meglio questi disturbi convulsivi.
I modelli animali di epilessia associata a SCN1A si sono dimostrati preziosi nel caratterizzare diversi tipi di convulsioni (febbrili vs generalizzate) e sezionare il meccanismo neuronale della generazione di convulsioni13,14,15,16,17,18. Mentre lo studio delle convulsioni spontanee tramite registrazioni EEG / EMG nel cervello dei roditori è ben consolidato ed è uno strumento molto utile, solo pochi studi hanno tentato di imitare le convulsioni febbrili in modelli murini14,16,19,20,21,22,23 . Studi precedenti hanno utilizzato un getto di aria secca riscaldata, o un cilindro di metacrilato dotato di un sistema termico, o lampade di calore con un regolatore di temperatura in arene di prova chiuse9,16,21,22,23,24 per indurre convulsioni tramite ipertermia. Al fine di aumentare la temperatura corporea in un ambiente più controllato, il protocollo qui descritto utilizza una camera costruita su misura con un sistema di riscaldamento a temperatura controllata che consentiva tassi riproducibili di aumento della temperatura corporea di un mouse all'interno della camera. La camera di calore è stata costruita in legno (lunghezza 40 cm x larghezza 34 cm x altezza 31 cm) ed è stata dotata di un termoregolatore digitale con termocoppia K. Un piccolo ventilatore assiale dotato di un riscaldatore sul pannello posteriore della camera dirige l'aria riscaldata nella camera regolata da un regolatore di temperatura digitale. Questo sistema di riscaldamento ad aria forzata consente di controllare la velocità con cui aumenta la temperatura della camera. (Figura 1A,B). La termocoppia K situata all'interno della camera termica in legno invia feedback al regolatore di temperatura digitale, per mantenere costanti le temperature all'interno della scatola durante il test. L'impostazione della temperatura sul regolatore di temperatura digitale consente alla ventola elettrica di inviare aria forzata riscaldata attraverso le prese d'aria per riscaldare uniformemente la camera (Figura 1A). Il pannello frontale della camera di calore è un foglio di plexiglass trasparente per consentire una facile registrazione video delle prove.
Per ogni esperimento sono stati selezionati topi adulti (P30-P40), eterozigoti per una mutazione missenso in SCN1A che fa sì che GEFS+ e un numero uguale di compagni di cucciolata selvatici fungano da gruppo di controllo. Gli animali, sia maschi che femmine, utilizzati in questi studi pesavano almeno 15 g poiché i topi selvatici che pesavano meno erano più sensibili alle convulsioni indotte dal calore rispetto agli animali più pesanti della stessa età. Nello studio pilota, sia i topi mutanti che quelli selvatici sono stati osservati per cercare gli angoli più freddi della camera sul retro e sono rimasti lì per periodi di tempo prolungati. Per aggirare questo problema, le dimensioni effettive del pavimento all'interno dell'arena di prova della camera di calore sono state ridotte a lunghezza 16,5 cm x larghezza 21,5 cm x altezza 27,5 cm posizionando un blocco di legno B (dimensioni 20 cm x 8 cm x 7,2 cm) sul lato destro della camera (Figura 1A). La camera di calore è stata costruita in compensato di 1,9 cm di spessore (lunghezza 40 cm x larghezza 34 cm x altezza 31 cm) rivestito in laminato bianco e dotato di un termoregolatore digitale con termocoppia K. La superficie laminata delle pareti della camera è impermeabile e può essere facilmente igienizzata tra una prova e l'altra pulendo con il 70% di etanolo. La temperatura della camera termica è stata inizialmente impostata a 50 °C e preriscaldata per almeno 1 ora prima dell'inizio dell'esperimento, per garantire un riscaldamento uniforme all'interno della camera. Ogni topo è stato dotato di un termometro rettale per il monitoraggio continuo della temperatura corporea durante l'esperimento. Un singolo mouse è stato posto nella camera alla volta e la temperatura è stata mantenuta a 50 ° C tra il 1 ° e il 10 ° minuto. La temperatura è stata quindi aumentata a 55 ° C per l'11 ° -20 ° minuto e infine aumentata a 60 ° C per il 21 ° -30 ° minuto. Ciò ha comportato un tasso riproducibile di aumento della temperatura corporea del topo (Figura 2A). Ogni prova è stata videoregistrata e l'analisi comportamentale è stata condotta offline.
Il protocollo di riscaldamento può essere facilmente modificato per modificare la temperatura iniziale della camera di calore e la velocità di riscaldamento della camera, che a sua volta cambia la velocità con cui la temperatura corporea del mouse viene elevata durante il test. Pertanto, questo metodo offre una maggiore flessibilità rispetto ai metodi tradizionali nella creazione di schermi comportamentali che coinvolgono convulsioni indotte dal calore. Il protocollo di crisi indotta dal calore può anche essere utilizzato per lo screening di farmaci antiepilettici che rendono i topi mutanti più resistenti alle convulsioni indotte dal calore o aumentano la temperatura di soglia a cui si osservano le convulsioni. Allo stesso modo, gli effetti benefici di regimi dietetici restrittivi come la dieta cheto sulle convulsioni indotte dal calore possono essere esaminati nei normali topi nutriti con chow e cheto.
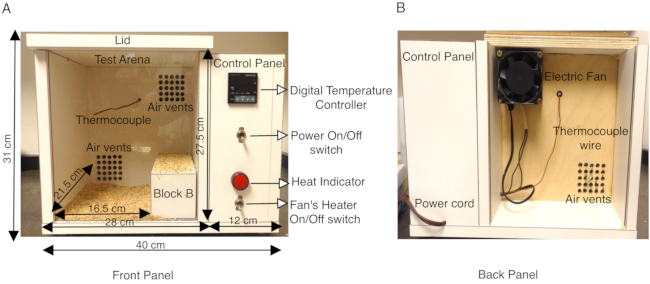
Figura 1: Descrizione della camera di calore del mouse costruita su misura. (A) Il pannello frontale della camera di calore del mouse in legno mostra il pannello di controllo laterale contenente l'interruttore Power ON/OFF che accende il regolatore di temperatura digitale, la termocoppia K, l'interruttore ON/OFF del termoventilatore e l'indicatore di calore. Le dimensioni esterne della scatola e dell'arena di prova interna sono mostrate in cm. Viene anche mostrato un blocco di legno B utilizzato per ridurre efficacemente la superficie dell'arena di prova. Il fondo dell'arena di prova è coperto da lettino di pannocchia per impedire ai topi di entrare direttamente in contatto con superfici di legno riscaldate. (B) Il pannello posteriore della camera di calore mostra la ventola montata sulla presa d'aria superiore e il cavo di alimentazione per fornire elettricità alla camera. Questa cifra è modificata dalla Figura 3 in Das et al., 2021, eNeuro14. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocollo
Tutte le procedure sugli animali sono state eseguite in conformità con le linee guida dell'Institutional Animal Care and Use Committee (IACUC) presso l'Università della California, Irvine.
1. Preparazione per il test delle convulsioni indotte dal calore
- Accendere il pulsante di accensione sulla camera di calore, seguito dal pulsante Di accensione .
- Impostare la temperatura della camera di calore a 50 °C utilizzando la tastiera del regolatore di temperatura digitale.
- Attendere almeno 1 ora per preriscaldare la camera a 50 °C prima di introdurre il primo mouse nella camera. Il preriscaldamento garantisce un riscaldamento uniforme all'interno della camera.
- Rivestire il pavimento della camera di calore del mouse con lettiera di pannocchia.
- Montare una telecamera di registrazione video davanti alla camera di calore per registrare ogni prova di analisi delle convulsioni indotta dal calore.
- Rivestire una capsula di Petri di 140 mm di diametro con spessi strati di carta velina e posizionarla sul ghiaccio per fungere da cuscinetto di raffreddamento.
NOTA: Alla fine del test, il singolo mouse verrà trasferito sul pad di raffreddamento prechilled per aiutare a ridurre la temperatura corporea elevata.
2. Preparare il topo per il test delle convulsioni indotte dal calore
- Selezionare 10 topi adulti (P30-P40), 5 che portano la mutazione che causa l'epilessia e 5 dei compagni di cucciolata wild-type per il test di screening delle convulsioni indotto dal calore.
NOTA: I topi selvatici, che non ospitano alcuna mutazione che causa epilessia, non presentano convulsioni indotte dal calore a temperature inferiori a 44 °C e fungono da gruppo di controllo. - Pesare ogni topo da utilizzare per il test di screening e registrare il suo peso corporeo. Per il test devono essere utilizzati solo topi di peso pari o superiore a 15 g.
- Schermare un mouse alla volta nella camera di calore del mouse.
- Anestetizzare brevemente il mouse per 10-15 s usando alcune gocce di isoflurano sul fondo di un barattolo a campana.
- Prendi l'animale dal barattolo della campana e mettilo su un tovagliolo di carta.
- Assicurarsi che il mouse sia completamente anestetizzato controllando che il mouse non risponda a un pizzico nocivo del dito del piede.
- Rivestire la punta metallica della sonda di temperatura rettale con un lubrificante (come la vaselina) e inserirla delicatamente nel mouse a una profondità inferiore o uguale a 2 cm.
- Fissare la sonda rettale alla coda del mouse con del nastro adesivo, in modo che la sonda non esca durante il test.
NOTA: in alternativa, posizionare l'animale in un cono di ritenuta del mouse e inserire la sonda di temperatura rettale. Fissalo fissandolo alla coda. - Assicurarsi che la sonda rettale sia collegata a un multimetro che visualizzi la temperatura corporea interna del mouse.
- Metti l'animale in una gabbia fresca rivestita di lettiera di pannocchia, cioè la gabbia di recupero.
- Avvia un timer e attendi 5 minuti. Osservare il mouse fino a quando non si è completamente ripreso dall'anestesia e il mouse è attivo e toelettatura.
- Allo stesso tempo, monitorare la temperatura corporea interna del mouse fino a quando non si stabilizza a 35-36 °C.
- Alla fine di 5 minuti, annotare la temperatura corporea del mouse. Questa è la temperatura corporea iniziale al tempo "0" min.
NOTA: se la temperatura corporea interna del topo è inferiore a 35 °C, attendere un ulteriore periodo di tempo affinché l'animale si riprenda dall'ipotermia indotta dall'anestesia. - Trasferire rapidamente il singolo mouse nella camera del mouse preriscaldata. Questo segna l'INIZIO della prova dell'esperimento. Viene visualizzato un solo mouse alla volta.
3. Test delle convulsioni indotte dal calore
- Dopo aver posizionato delicatamente il mouse sul pavimento della camera termica del mouse preriscaldata, chiudere la porta in plexiglass e avviare la telecamera per la registrazione video dell'esperimento.
- Avvia il cronometro. Registrare la temperatura corporea del topo dal termometro rettale a intervalli di 1 minuto per la durata dell'esperimento.
- A intervalli regolari, aumentare la temperatura della camera termica del mouse in modo tale che la temperatura corporea del mouse aumenti ad una velocità di 0,25-0,5 °C /min.
NOTA: Rapidi aumenti della temperatura corporea possono portare a colpi di calore o morte e dovrebbero essere evitati. - Seguendo questo protocollo, aumentare la temperatura della camera termica del mouse di 5 °C ogni 10 minuti, come mostrato nella Figura 2A.
- A 9,5 min, impostare la temperatura della camera di calore a 55 °C, per stabilizzare la temperatura della camera termica a 55 °C entro il 10 ° minuto come mostrato sul display digitale della temperatura.
- Allo stesso modo, aumentare la temperatura a 60 °C a 19,5 minuti per stabilizzare la temperatura della camera di calore a 60 °C entro il 20 ° minuto. Ogni prova di screening delle convulsioni dura 30 minuti.
- Se il topo ha un attacco (vocalizza, mostra l'annuire della testa, il clono dell'arto anteriore, l'estensione degli arti posteriori, cade su un fianco o sperimenta convulsioni tonico / cloniche generalizzate), registrare le seguenti informazioni.
- Registrare la temperatura corporea del topo durante il sequestro (temperatura della soglia convulsiva) dal termometro a temperatura rettale.
- Registrare le caratteristiche del comportamento convulsivo come l'annuimento della testa, il clono dell'arto anteriore, l'estensione dell'arto posteriore, la caduta laterale e / o le crisi tonico / cloniche generalizzate (GTCS) visualizzate dal topo.
- Prelevare rapidamente ma delicatamente il mouse dalla camera e posizionarlo sul pad di raffreddamento preparato al punto 1.6.
NOTA: Se un topo sta vivendo convulsioni in scala Racine 5 e mostra salti incontrollati, può essere difficile raccogliere l'animale dalla camera di calore e trasferirlo al pad di raffreddamento all'esterno. Tuttavia, un tipico attacco indotto dal calore dura tra 30 s e 60 s.Pertanto, il topo deve essere portato fuori dalla camera termica e messo sul pad di raffreddamento entro 60 s dall'inizio dell'episodio di convulsioni indotte dal calore. - Attendere che la temperatura corporea del topo scenda a 36-37 °C, prima di trasferirla in una gabbia di recupero. Solo un topo viene posto in una gabbia di recupero alla volta.
NOTA: non mescolare topi che devono ancora essere utilizzati per lo screening indotto dal calore con il topo che ha già sperimentato lo studio dell'esperimento di convulsioni indotte dal calore. - Delicatamente e con attenzione, tagliare il nastro tra la coda del topo e il filo della sonda rettale con un paio di forbici per rimuovere la sonda rettale dal mouse.
- Pulire la punta metallica della sonda rettale con alcool al 70% e salviette per i tessuti molli per tenerla pronta per la prossima prova.
- Continuare a osservare il topo nella gabbia di recupero fino a quando non riprende la normale attività (camminare, toelettare, ecc.), Prima di riportare il topo nella sua gabbia di casa. Questo segna la FINE della prova dell'esperimento per questo topo.
- Registrare lo stato dell'animale dopo il test vivo e recuperato dalla sessione di test o morto. Le convulsioni ad alta intensità che coinvolgono salti incontrollati e convulsioni tonico / cloniche generalizzate possono talvolta causare la morte del topo.
- Se un topo non avverte convulsioni indotte dal calore entro il periodo di osservazione di 30 minuti o la temperatura corporea del mouse raggiunge i 44 °C, rimuovere il mouse dalla camera di calore e posizionarlo sul pad di raffreddamento fino a quando la temperatura corporea del mouse ritorna a 36-37 °C.
- Ripristinare la temperatura della camera termica del mouse a 50 °C e consentirne l'equilibrio fino a quando la temperatura del display sul regolatore di temperatura digitale non mostrerà 50 °C.
- Cambia la lettiera della pannocchia tra le singole prove sui topi.
- Preparare il mouse successivo per lo studio di screening come descritto nel paragrafo 2 e ripetere i passaggi del paragrafo 3.
4. Eutanasia degli animali
- Sebbene la maggior parte degli animali recuperi convulsioni post-indotte dal calore, nella nostra esperienza, alcuni dei topi subiscono SUDEP (Sudden Unexplained Death in EPilepsy) nella loro gabbia domestica entro 24-48 ore dalle convulsioni indotte dal calore. Dopo aver concluso lo screening su tutti i topi individualmente per le convulsioni indotte dal calore dopo lo studio di 30 minuti, eutanasizzare tutti i topi secondo le linee guida IACUC dell'istituzione.
5. Analisi dei dati sulle convulsioni indotte dal calore
- Dopo aver completato lo screening di una coorte di animali, calcolare la percentuale di topi in un dato genotipo che mostra convulsioni utilizzando la seguente formula:
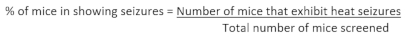
- Stimare la temperatura media della soglia convulsiva dei topi all'interno di un dato genotipo facendo la media della temperatura della soglia convulsiva di tutti i topi (notata nel passaggio 3.7) in quel genotipo che presenta convulsioni indotte dal calore.
- Pur essendo ancora cieco all'identità e al genotipo, riprodurre le registrazioni video di ciascuno dei topi durante lo screening del test delle convulsioni indotto dal calore sullo schermo di un computer per valutare la gravità degli attacchi convulsivi.
- Dare punteggi ai singoli topi che mostrano un comportamento convulsivo indotto dal calore utilizzando la scala di Racine modificata13 come descritto da studi precedenti13,14. Vedere la Tabella 1 per i dettagli.
- Se un topo, mentre sperimenta convulsioni indotte dal calore, mostra solo un cenno della testa, dagli un punteggio di 2. Se un topo inizia un episodio convulsivo con la testa che annuisce, ma mostra anche il clono dell'arto anteriore, cadendo e / o saltando, dargli un punteggio di 5.
- Registrare il punteggio massimo per ciascun mouse utilizzando la scala Racine modificata13 come descritto sopra.
- Traccia un grafico a dispersione dei punteggi massimi di Racine esibiti da tutti i topi in un dato genotipo.
- Confronta statisticamente i punteggi massimi di Racine tra diversi gruppi di topi come metodo per determinare la gravità delle convulsioni comportamentali come le convulsioni indotte dal calore.
NOTA: I punteggi di Racine sono utili per confrontare le caratteristiche delle convulsioni tra diversi gruppi di topi mutanti o genotipi. Si prevede che i topi wild-type non subiscano convulsioni indotte dal calore e non debbano essere considerati per i confronti del punteggio di Racine. - Sulla base di un disegno sperimentale, eseguire un'analisi statistica appropriata per determinare se la percentuale di topi che presentano convulsioni tra topi wild-type e mutanti e i loro valori medi di temperatura di soglia convulsiva sono significativamente diversi l'uno dall'altro.
| Racine Punteggio | Caratteristiche delle convulsioni | ||
| 0 | Nessuna convulsione | ||
| 1 | Movimenti della bocca e del viso | ||
| 2 | Testa che annuisce | ||
| 3 | Clono anteriore, di solito un arto | ||
| 4 | Clono dell'arto anteriore con allevamento | ||
| 5 | Convulsioni tonico-cloniche generalizzate, allevamento, salto, caduta | ||
Tabella 1: Punteggi Racine.
Risultati
Si prevede che i modelli animali con mutazioni febbrili delle convulsioni subiscano convulsioni indotte dal calore a temperature corporee elevate che non inducono convulsioni nei compagni di cucciolata selvatici. Le mutazioni di SCN1A sono state collegate a convulsioni febbrili, inclusi pazienti K1270T GEFS+, che mostrano convulsioni generalizzate sia febbrili che afebrilari7. Abbiamo esaminato i topi mutanti SCN1A K1270T GEFS+ generati da CRISPR recentemente descritti in uno studio14 per l'insorgenza di convulsioni da calore in due background genetici: 129X1 /SvJ resistente alle convulsioni (129X1) e sfondi C57BL / NJ (B6N) sensibili alle convulsioni. Compagni di cucciolata selvatici di tipo età abbinati nella camera di calore del topo che non ospitano alcuna mutazione GEFS + e, quindi, non ci si aspetta che mostrino convulsioni indotte dal calore, serviti come gruppo di controllo. La velocità del cambiamento della temperatura corporea nel tempo è stata valutata tracciando la temperatura corporea media dei topi registrata ogni minuto durante il test. Non c'è stata alcuna differenza nel tasso di variazione della temperatura corporea tra topi mutanti eterozigoti e compagni di cucciolata selvatici testati nei rispettivi background genetici 129X1 e B6N (Figura 2B, C). Ciò suggerisce che la termoregolazione non è alterata nei topi mutanti eterozigoti K1270T GEFS+.
Tutti i topi mutanti eterozigoti di origine genetica 129X1 (n = 15) o B6N (n = 9) hanno mostrato convulsioni indotte dal calore (Figura 2D). Nessuno dei topi wild-type nello sfondo arricchito 129X1 (n = 13) ha mostrato convulsioni indotte dal calore (Figura 2D). Al contrario, un terzo dei topi testati (n = 3 su 9 topi) nello sfondo B6N sensibile alle convulsioni ha mostrato convulsioni indotte dal calore. Il confronto statistico mostra che la percentuale di topi mutanti eterozigoti che presentavano convulsioni indotte dal calore era significativamente più alta rispetto ai rispettivi topi di controparte wild-type in entrambi i background genetici 129X1 e B6N (Figura 2D, test esatto di Fisher, 129X1 p < 0,0001; B6NJ p = 0,009). La temperatura media della soglia convulsiva tra i topi mutanti eterozigoti in background genetici 129X1 e B6N era simile. I topi mutanti 129X1 hanno una temperatura media di soglia convulsiva di 42,6 ± 0,20 °C, che non era significativamente diversa dalla temperatura media della soglia convulsiva di 42,7 ± 0,06 °C osservata nei topi B6N (Figura 2E; t-test dello studente a due code spaiato, p = 0,782). È importante notare che la temperatura media della soglia convulsiva di tre topi wild-type B6N che hanno mostrato convulsioni indotte dal calore era di 43,7 ± 0,08 °C e significativamente superiore alla soglia convulsiva media di 42,7 ± 0,06 °C mostrata da topi mutanti eterozigoti B6N (Figura 2E, t-test di Student senza spaiato a due code, p < 0,0001).
La parte anteriore in plexiglass della camera consente di eseguire registrazioni video continue durante il test che possono essere utilizzate in seguito per valutare la gravità delle convulsioni in ciascun topo su una scala Racine modificata come descritto in precedenza14,20. Durante un test tipico, i topi mutanti eterozigoti mostrerebbero convulsioni indotte dal calore con vocalizzazione e / o cenno del capo (punteggio Racine 2) e rapidamente transizione al clono dell'arto anteriore, cadendo di lato, saltando, estensione degli arti posteriori e / o convulsioni tonico / cloniche generalizzate (punteggi Racine 3-5) quando la temperatura corporea raggiungeva circa 42 ° C. Il punteggio massimo di Racine rappresenta il comportamento convulsivo indotto dal calore più grave tra i topi mutanti. Il punteggio massimo di Racine di topi mutanti eterozigoti in background arricchito 129X1 (n = 15) non è diverso dai topi mutanti eterozigoti nel background genetico B6N (n = 9) (Figura 2F; Test di Mann-Whitney, p > 0,9999). Ciò suggerisce che le caratteristiche del comportamento convulsivo indotto dal calore nei topi mutanti K1270T GEFS + sono indipendenti dallo sfondo del ceppo.
Presi insieme, i dati dimostrano che tutti i topi mutanti mostrano convulsioni indotte dal calore con frequenza, temperatura di soglia convulsiva e gravità delle convulsioni comportamentali simili in modo indipendente dal ceppo. La maggior parte dei cucciolate selvatiche non presenta tali convulsioni a 44 °C o al di sotto di essa. Circa un terzo dei topi di controllo wild-type in uno sfondo B6N sensibile alle convulsioni ha mostrato convulsioni indotte dal calore (probabilmente a causa di effetti di fondo genetici), ma la temperatura della soglia convulsiva era significativamente più alta rispetto ai topi mutanti nello stesso background. Questi risultati suggeriscono che i topi mutanti nel background genetico B6N sono suscettibili alle convulsioni indotte dal calore a soglie di temperatura più basse a causa della mutazione SCN1A GEFS + che ospitano. Pertanto, utilizzando questo protocollo, è possibile valutare le convulsioni indotte dal calore nei topi mutanti con epilessia e distinguere dai topi selvatici, che non subiscono convulsioni indotte dal calore o mostrano convulsioni di calore a temperature significativamente più elevate.
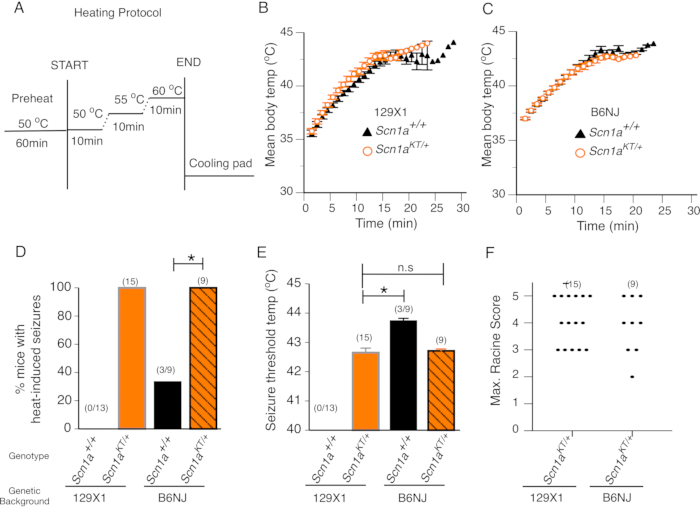
Figura 2: I topi mutanti mostrano convulsioni indotte dal calore. (A) Il protocollo di riscaldamento per lo screening comportamentale delle convulsioni indotte dal calore nei topi. (B-C) Temperatura corporea media dei topi nel tempo in topi wild-type (Scn1a+/+ - triangoli neri) ed eterozigoti mutanti (Scn1aKT/+ - cerchi arancioni) in due background genetici 129X1 e B6N, rispettivamente. (D) Percentuale di topi che mostrano convulsioni indotte dal calore in entrambi i contesti genetici. I topi wild-type (Scn1a+/+) ed eterozigoti (Scn1aKT/+) sono rappresentati rispettivamente da barre nere e arancioni. I mutanti eterozigoti in sfondi 129X1 e B6N sono mostrati rispettivamente in barre solide arancioni e barre arancioni con strisce nere. (E) Soglia della temperatura convulsiva alle convulsioni indotte dal calore in topi wild-type (Scn1a+/+) e mutanti eterozigoti (Scn1aKT/+) in entrambi i ceppi. (F) Distribuzione a dispersione dei punteggi massimi di Racine delle convulsioni indotte dal calore esibite da topi eterozigoti (Scn1aKT/+) in entrambi i background genetici. Ogni punto rappresenta il punteggio massimo racine in un singolo mouse. Il numero di animali in ogni genotipo è mostrato tra parentesi. I dati mostrati nei pannelli B-F sono medi ± S.E.M. Questa cifra è modificata dalla Figura 3 in Das et al., 2021, eNeuro14. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Descriviamo un protocollo semplice ed efficace per lo screening del verificarsi di convulsioni indotte dal calore nei topi, l'equivalente comportamentale delle convulsioni febbrili nei pazienti umani. Il test valuta diversi parametri - tra cui la percentuale di topi che mostrano convulsioni, soglia convulsiva, gravità delle convulsioni su scala Racine, al fine di confrontare la sensibilità dei gruppi di topi di controllo e test agli aumenti della temperatura corporea.
Un passaggio critico in questo protocollo prevede l'aumento del calore nella camera mentre si monitora continuamente la temperatura corporea del mouse. È imperativo che la temperatura corporea massima che i topi sperimenteranno in questi test sia di 44 ° C perché gli animali selvatici possono subire convulsioni indotte dal calore a temperature corporee >44 ° C. Il pretrattamento con anestesia generale o analgesici potrebbe ridurre la temperatura corporea interna degli animali o interferire con la termoregolazione, che a sua volta confonderebbe la raccolta dei dati sulla temperatura della soglia convulsiva. Pertanto, i topi sotto questo protocollo di screening non hanno potuto essere forniti con questi agenti durante la finestra di prova di 30 minuti. Tutte le procedure devono essere approvate dal comitato IACUC dell'istituzione. Per garantire un monitoraggio continuo della temperatura corporea interna del topo durante il test, fissare saldamente la sonda di temperatura rettale alla coda dei topi. Se durante il test, la temperatura corporea del topo rimane invariata per periodi di tempo prolungati anche dopo aver aumentato la temperatura della camera del topo, assicurarsi che la sonda di temperatura rettale non sia uscita dal mouse o sia attaccata liberamente alla coda.
Il background genetico dei modelli murini può influenzare la sensibilità alla mutazione SCN1A e le convulsioni farmacologicamente indotte18,25,26,27. Come discusso nei risultati sopra, il background genetico dei topi può influenzare la loro suscettibilità alle convulsioni indotte dal calore. Scn1a · I topi mutanti K1270T GEFS+ sono stati testati in due background genetici - 129X1 e B6NJ, e una piccola percentuale di topi wild-type (33%) nello sfondo B6NJ sensibile alle convulsioni, sono stati anche osservati per subire convulsioni indotte dal calore. Tuttavia, rispetto ai topi mutanti eterozigoti Scn1aKT/+, i topi wild-type B6NJ hanno avuto convulsioni indotte dal calore a una soglia di temperatura significativamente più alta. Ciò conferma che la mutazione genetica (Scn1a K1270T) introdotta dal knock-in CRISPR rende i topi mutanti più suscettibili alle convulsioni indotte da ipertermia.
Ci sono diversi vantaggi nell'adottare questo protocollo, che sono riassunti di seguito. In primo luogo, a differenza dell'uso di flusso di aria secca o lampade riscaldate, un'aria forzata a temperatura controllata installata all'interno di uno spazio chiuso fornisce allo sperimentatore un maggiore controllo sul riscaldamento dell'arena di prova alla velocità desiderata. I passaggi nel protocollo di riscaldamento possono essere facilmente modificati per aumentare / diminuire la temperatura iniziale, la durata di ogni passaggio, ecc. Per schermare i topi più vecchi che sono roditori più pesanti o più grandi come i ratti. In secondo luogo, il monitoraggio continuo della temperatura corporea del topo tramite la sonda rettale collegata, fornisce preziose informazioni sulla velocità di variazione della temperatura corporea nel singolo topo, durante tutto il test. Ciò consente allo sperimentatore di osservare da vicino che il tasso di variazione della temperatura nel topo non supera 0,25-0,5 ° C / min (che potrebbe essere stressante per gli animali), quando si adatta questo protocollo ad altre arene di prova. È importante sottolineare che il tasso di variazione della temperatura corporea nel tempo in diversi gruppi di topi può far luce sulla loro capacità di termoregolarsi e potrebbe essere utile per capire se le convulsioni febbrili che causano mutazioni alterano anche la termoregolazione nei topi. In terzo luogo, il monitoraggio continuo della temperatura corporea garantisce che le misurazioni della temperatura della soglia convulsiva utilizzando questo protocollo siano accurate, poiché vengono registrate in concomitanza con il primo attacco di convulsioni sperimentato dal topo. Se la temperatura corporea dell'animale non viene monitorata continuamente o la temperatura della soglia convulsiva viene misurata dopo aver portato l'animale fuori dall'arena di prova, i valori della soglia di convulsione possono variare a causa del tempo impiegato per gestire i topi dopo le convulsioni. Infine, questo metodo aggira la necessità di utilizzare metodi invasivi per indurre la febbre (iniettando agenti patogeni) nei topi per imitare le convulsioni febbrili nei pazienti umani.
Uno dei limiti di questo protocollo è che è difficile lo screening dei topi giovani (meno di P30 di età) per le convulsioni indotte dal calore. Il protocollo è stato sviluppato per lo screening della sensibilità dei topi adulti (P30-P40 e superiori) alle convulsioni indotte da calore o ipertermia. Nella nostra esperienza, i topi selvatici più giovani, in particolare quelli di peso inferiore a 15 g, hanno maggiori probabilità di subire convulsioni indotte dal calore, che potrebbero essere dovute a meccanismi di termoregolazione sottosviluppati, stress termico fisiologico o una combinazione di entrambi. Quindi, non è l'ideale eseguire lo screening convulsivo indotto dal calore su topi giovani usando questo protocollo.
Studi futuri che combinano il monitoraggio EEG mentre sottopongono il topo a convulsioni indotte dal calore possono far luce sui modelli di crisi EEG delle convulsioni indotte dal calore, simile a uno studio precedente19. L'attività neuronale in aree specifiche del cervello del topo può essere rintracciata combinando approcci optogenetici e studi basati sull'immunoistochimica dopo la raccolta del tessuto cerebrale. Inoltre, gli effetti di diete restrittive come la dieta cheto sulla riduzione delle convulsioni febbrili possono essere valutati sottoponendo topi cheto-nutriti e topi normali nutriti con chow a un protocollo di convulsioni indotte dal calore. Allo stesso modo, i paradigmi di screening dei farmaci per l'epilessia possono essere sviluppati per testare e identificare i candidati farmaci antiepilettici che migliorano o sopprimono le convulsioni indotte dal calore nei topi nutriti con farmaci o trattati rispetto ai topi alimentati con veicoli o di controllo.
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Vorremmo ringraziare Connor J. Smith per il suo aiuto nella costruzione della camera termica del mouse personalizzata. Riconosciamo l'aiuto dei membri del laboratorio O'Dowd, Lisha Zeng e Andrew Salgado per la standardizzazione del protocollo di riscaldamento durante le prime fasi dello sviluppo del test. Ringraziamo anche Danny Benavides e Kumar Perinbam per aver registrato parti della procedura sperimentale per il manoscritto. Questo lavoro è stato supportato dalla sovvenzione NIH (NS083009) assegnata a D.O.D.
Materiali
| Name | Company | Catalog Number | Comments |
| Axial fan | Farnam | AF20-200-120-xx10-3.1 | Farnam custom products -Axial Fan Heater with Fan |
| Digital temperature controller | Inkbird | ITC-100RH | Inkbird digital PID temperature controller ITC-100RH with K thermocouple |
| Mouse rectal temperature probe | ThermoWorks, Braintree Scientific, Inc | RET-3 | Mouse rectal temperature probe with thermometer |
Riferimenti
- Hirtz, D., et al. How common are the 'common' neurologic disorders. Neurology. 68, 326-337 (2007).
- Catterall, W. A. Sodium Channel Mutations and Epilepsy. Jasper's Basic Mechanisms of the Epilepsies. , Center for Biotechnology Information. US. Internet (2012).
- Mantegazza, M., Broccoli, V. SCN 1A /Na V 1.1 channelopathies: Mechanisms in expression systems, animal models, and human iPSC models. Epilepsia. 60, (2019).
- Stafstrom, C. E. Persistent Sodium Current and Its Role in Epilepsy. Epilepsy Currents. 7, 15-22 (2007).
- Schutte, S. S., Schutte, R. J., Barragan, E. V., O'Dowd, D. K. Model systems for studying cellular mechanisms of SCN1A-related epilepsy. Journal of Neurophysiology. 115, 1755-1766 (2016).
- Wei, F., et al. Ion Channel Genes and Epilepsy: Functional Alteration, Pathogenic Potential, and Mechanism of Epilepsy. Neuroscience Bulletin. 33, 455-477 (2017).
- Abou-Khalil, B., et al. Partial and generalized epilepsy with febrile seizures plus and a novel SCN1A mutation. Neurology. 57, 2265-2272 (2001).
- Zhang, Y. -H., et al. Genetic epilepsy with febrile seizures plus: Refining the spectrum. Neurology. 89, 1210-1219 (2017).
- Patterson, K. P., et al. Enduring memory impairments provoked by developmental febrile seizures are mediated by functional and structural effects of neuronal restrictive silencing factor. Journal of Neuroscience. 37, 3799-3812 (2017).
- Rossi, M. A. SCN1A and febrile seizures in mesial temporal epilepsy: An early signal to guide prognosis and treatment. Epilepsy Currents. 14, 189-190 (2014).
- Zhang, Y., et al. Altered gut microbiome composition in children with refractory epilepsy after ketogenic diet. Epilepsy Research. 145, 163-168 (2018).
- Meng, H., et al. The SCN1A mutation database: Updating information and analysis of the relationships among genotype, functional alteration, and phenotype. Human Mutation. 36, 573-580 (2015).
- Cheah, C. S., et al. Specific deletion of NaV1.1 sodium channels in inhibitory interneurons causes seizures and premature death in a mouse model of Dravet syndrome. Proceedings of the National Academy of Science U.S.A. 109, 14646-14651 (2012).
- Das, A., et al. Interneuron dysfunction in a new mouse model of SCN1A GEFS. eNeuro. , (2021).
- Kalume, F., et al. Sudden unexpected death in a mouse model of Dravet syndrome. Journal of Clinical Investigations. 123, 1798-1808 (2013).
- Martin, M. S., et al. Altered function of the SCN1A voltage-gated sodium channel leads to gamma-aminobutyric acid-ergic (GABAergic) interneuron abnormalities. Journal of Biological Chemistry. 285, 9823-9834 (2010).
- Rubinstein, M., et al. Dissecting the phenotypes of Dravet syndrome by gene deletion. Brain. 138, 2219-2233 (2015).
- Yu, F. H., et al. Reduced sodium current in GABAergic interneurons in a mouse model of severe myoclonic epilepsy in infancy. Nature Neuroscience. 9, 1142-1149 (2006).
- Dutton, S. B. B., et al. Early-life febrile seizures worsen adult phenotypes in Scn1a mutants. Experimental Neurology. 293, 159-171 (2017).
- Cheah, C. S., et al. Specific deletion of NaV1.1 sodium channels in inhibitory interneurons causes seizures and premature death in a mouse model of Dravet syndrome. Proceedings of the National Academy of Science U.S.A. 109, 14646-14651 (2012).
- Oakley, J. C., Cho, A. R., Cheah, C. S., Scheuer, T., Catterall, W. A. Synergistic GABA-enhancing therapy against seizures in a mouse model of Dravet Syndrome. Journal of Pharmacology and Experimental Therapeutics. 345, 215-224 (2013).
- Ricobaraza, A., et al. Epilepsy and neuropsychiatric comorbidities in mice carrying a recurrent Dravet syndrome SCN1A missense mutation. Scientific Reports. 9, (2019).
- Warner, T. A., Liu, Z., Macdonald, R. L., Kang, J. -Q. Heat induced temperature dysregulation and seizures in Dravet Syndrome/GEFS+ Gabrg2+/Q390X mice. Epilepsy Research. 134, 1-8 (2017).
- Eun, B. -L., Abraham, J., Mlsna, L., Kim, M. J., Koh, S. Lipopolysaccharide potentiates hyperthermia-induced seizures. Brain and Behavior. 5, 00348(2015).
- Miller, A. R., Hawkins, N. A., McCollom, C. E., Kearney, J. A. Mapping genetic modifiers of survival in a mouse model of Dravet syndrome. Genes Brain and Behavior. 13, 163-172 (2013).
- Mistry, A. M., et al. Strain- and age-dependent hippocampal neuron sodium currents correlate with epilepsy severity in Dravet syndrome mice. Neurobiology of Disease. 65, 1-11 (2014).
- Ogiwara, I., et al. Nav1.1 localizes to axons of parvalbumin-positive inhibitory interneurons: a circuit basis for epileptic seizures in mice carrying an Scn1a gene mutation. Journal of Neuroscience. 27, 5903-5914 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon