このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
孤独なミツバチの幼虫に対する農薬の効果の評価
要約
本議定書は、農薬に汚染された規定を孤独なミツバチの幼虫、 オスミア・ショベルタに供給する方法を説明している。この手順は、孤独なミツバチの幼虫に対する農薬の生態毒性を調べる。
要約
花粉媒介者の農薬の現在の生態学的リスク評価は、主に実験室の状態のみを考慮してきた。孤独なミツバチの幼虫にとって、農薬で汚染された食物の摂取は、人口統計学的観点から、幼虫の死亡率を増加させ、来年の成虫の孤独なミツバチの収集率および個体数を減少させる可能性がある。しかし、孤独なミツバチの幼虫に対する農薬の影響に関する研究は限られています。したがって、農薬が孤独なミツバチの幼虫にどのように影響するかを理解することは、農薬の生態学的リスク評価の不可欠な部分と考えるべきである。本研究は、孤独なミツバチの幼虫である オスミア・ショベルタ を致死的または致死以下の量の農薬に曝露し、幼虫の体重増加、発生期間、収穫能力、および摂取した食物の食物消費効率の変換を追跡する方法を提示する。この方法の有効性を実証するために、 O. excavata の幼虫に、急性致死量および亜致死量のクロルピリホスを含む規定を与えた。次に、処理した幼虫の上記の指標を調査した。この技術は、花粉媒介者に対する農薬のリスクを予測し、軽減するのに役立ちます。
概要
花粉媒介者は、現代のグローバル農業の生態系サービスにおいて重要な役割を果たしています。ミツバチ(アピスメリフェラ;膜翅目:Apidae)は伝統的に作物の不可欠な経済的花粉媒介者と考えられてきましたが、最近の研究は、オスミア(膜翅目:Megachilidae)が特定の作物の受粉を改善し、果実のサイズと種子の数を増やし、世界のさまざまな地域の商業果樹園における非対称果実の割合を減らす上でも非常に重要であることを示唆しています1。Osmia excavataは、中国北部と北西部、日本2,3,4のように、主にアジアでリンゴの受粉に理想的な種と考えられてきました。それは、類似または時にはより高い効率で特定の作物に受粉サービスを提供することができます。この点で、それらはミツバチ4、5、6と相乗効果で置き換えられるか、または働くことが示されている。
O. excavataの生物学的特徴は、社会的なミツバチと比較してユニークです。その一兆性、孤独な、そして営巣活動は主に春と初夏に起こります。O. excavataの巣は、通常、既存の穴、典型的には枯れ木、中空の植物、わらの管、および自然条件の竹の茎に見られる3。大人のO.ショベルは、その繭から現れて交尾し、花粉を集め、卵を産むための巣を作り、1週間後に孵化し始めます。受精卵は雌に発達し、未受精卵は雄に発達する3。雌は蜂管の底に分布しており、対応する規定はより重要です。対照的に、男性はマイナー規定7でチューブ出口の近くにいたので、男性が最初に出て、女性が後で出てきます。雌は花粉と少量の蜜を、細胞8内の各幼虫の唯一の食物源である湿った塊に混ぜる。
いくつかの研究では、受粉昆虫の個体数が9,10個減少したことが報告されています。農薬の広範な使用は、花粉媒介者の豊富さと多様性を低下させる主な要因の1つとして特定されており、受粉サービスを危険にさらす可能性もあります11,12。農薬の副作用を軽減・軽減するためには、花粉媒介者に対して農薬リスク評価を実施する必要があります。一部の国では、使用される農薬からミツバチへの安全性を確保するために規制の枠組みが確立されています13,14。最近の研究では、オスミアはミツバチよりも農薬の影響を受けやすいことが示されています1,15。
興味深いことに、ほとんどのリスク評価は成体のミツバチに焦点を当てていた11,12。O.ショベル、特に幼虫に関する研究はほとんど行われていない。さらに、農薬によって直接引き起こされるオスミアの死亡率は、最も一般的には16と考えられている。それでもなお、幼虫の体重増加、発生期間、摂食パターン、排卵能力、その後の成虫行動、および繁殖力などの慢性毒性は、急性致死毒性と同じ害を有する可能性があり、孤独なミツバチ17に対する有効な実験方法の欠如のためにしばしば無視される。
これまで、孤独なミツバチの幼虫に対する農薬の効果を評価するために2つの方法が使用されてきた:(1)適量の農薬が、孤独なミツバチの卵を除去することなく、規定の局所的な場所に施用された1,18,19,20;(2)規定を特定量の農薬21を含む人工花粉・蜜混合物で置き換える。ただし、上記の 2 つの方法にはいくつかの制限があります。前者は急性毒性しか測定できませんが、幼虫が短期間に全用量を摂取したため、慢性毒性は測定できません。後者は、人間の操作のために高い死亡率につながるでしょう1。ここでは、実環境における規定において残留農薬を摂食する幼虫の挙動をシミュレーションすることにより、高度に制御された研究条件下でのO.ショベルバに対する農薬の生態毒性を研究する浸漬法について説明した。本研究の方法は、上記2つの方法の欠点を解決し、有害物質が急性および慢性毒性に及ぼす影響を測定するのに適している。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. 供給チューブの準備
- 電気巻鉄を使用して、2 mL 遠沈管の蓋に穴 (直径約 0.3 mm) を打ち抜きます ( 材料表を参照)。このような遠心管を使用して、 O. excavata 幼虫およびその供給塊を維持する。
2. 農薬の調製
- 技術グレードの農薬( 材料表を参照)をアセトンに溶解し、1 x 104 μg a.i. mL-1のストック溶液を取得します。次いで、溶液の5つ以上の濃度への勾配希釈を行う。
注:この研究では、0.1、0.2、0.4、0.8、1.6、3.2、6.4μgのa.i. mL-1 のクロルピリホスが使用されました。
3. 規定の作成
- O.ショベルの規定( 材料表を参照)と新しく孵化したO .ショベル の幼虫を含むプラスチック製のミツバチ管を大量飼育プログラムから入手する。
注:開花の20日前から開花期全体まで農薬は使用しませんでした。化学分析の結果、無作為に選択された50の規定で一般的に使用される農薬含有量は、両方とも最小試験レベルを下回っていたことが示された。 - 柔らかいブラシを使用して静かに規定と幼虫を分離します。巣9内の規定サイズと細胞位置に基づいて雌幼虫を選択する。次に、均一なサイズの規定と選択された雌の幼虫をペトリ皿(直径60mm)に置き、使用のためにそれらを脇に置いておく。
注:一般的に使用される農薬の内容を分析するために、クロルピリホス、イミダクロプリド、フェンジフェヌロン、フォキシム、アベルメクチンの50の規定がランダムに選択されました。ソフトブラシのパラメータは、(a)ブラシの直径:0.3 mm、(b)ブラシの長さ:2 cm、(c)ペンの長さ:18 cmです。
4. 農薬による処理の提供
- ケージを使用して、選択した均等なサイズの規定(ステップ3.2から;クロルピリホス0.1、0.2、0.4、0.8、1.6、3.2、6.4μgのa.i. mL-1)に希釈農薬(ステップ3.2から)を10秒間浸します。対照チェック(CK)を0.2%溶媒(本試験ではアセトン)に浸す。
注:濃度処理ごとに3回の反復があり、各反復は60個の規定で構成されていました。各規定の投与量の差は、均等なサイズの規定を選択することによって減少させることができる。 - 農薬で規定を処理する前後の農薬溶液の量を測定します。次いで、60質量規定を含む各処理における殺虫剤の浸漬体積を計算する(補足表1)。滅菌作業台上の風乾後、穴の開いた別々の遠心管(ステップ1.1から)に規定を置きます。
注:実験の前に、規定を入れたケージを農薬溶液に入れ、浸漬前後の農薬溶液の体積を測定して誤差をなくしてください。 - 柔らかいブラシを使用して、雌の幼虫を自然に乾燥した規定の表面に個々に移す。
注:1つのチューブに1匹の幼虫。
5. 成長条件
- O. ショベル の幼虫を暗所の生育室内に戻し、相対湿度65%~75%、2°C16で25±した。
6. 結果の検討
- 急性致死毒性試験
- 幼虫を処理済みおよび対照(CK)規定に48時間置いた後、幼虫の死亡率を測定する。
注:死亡基準:幼虫が軽度の接触に反応しなかった場合、ブラックライトランプ22の下で柔らかいブラシを使用した。ブラックライトランプは、幼虫の暗い成長条件をシミュレートし、成長指標をチェックする際に幼虫への光の影響を避けるために使用された。人為的ミスを排除するために、対照群における48時間後の規定からの幼虫の除去の有無にかかわらず死亡率も測定された。 - 昆虫飼育試験の48時間前後に60個の規定を計量し、各幼虫が消費する供給量を決定する。
- 各幼虫が消費する各濃度での農薬の用量を、食べられた供給物の割合および各供給物の農薬含有量に従って計算する。
注:線量計算の式は23です。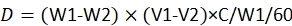
ここで、Dは各幼虫による農薬の消費用量である。W1は農薬の注入前の60規定の重量である。W2 は、48 時間後の 60 規定の残りの重量です。V1は、60規定の浸漬前の農薬の量です。V2は、60規定の浸漬後の農薬の量である。Cは農薬の濃度である。
- 幼虫を処理済みおよび対照(CK)規定に48時間置いた後、幼虫の死亡率を測定する。
- 致死性以下の毒性試験
- 飼育試験前および14日間の治療後に幼虫を計量し、幼虫の体重増加を決定する。
- ブラックライトランプの下で繭を繭付けしている間、 O.ショベル を毎日観察して、幼虫の発育期間を測定します。
- 処理済みおよびCK規定の摂食の14日後に規定の残りの部分を計量し、摂取された食物の消費および変換効率(ECI)24を計算する。
- 対照ミツバチが成虫に出現したときに小さなはさみを使って繭を狙撃して、侵入の数を調べます。
Access restricted. Please log in or start a trial to view this content.
結果
規定における一般的に使用される農薬、クロルピリホス、イミダクロプリド、フェンジフェヌロン、フォキシム、アベルメクチンの含有量は、対照群における定量限界(0.01〜0.02mg kg-1)未満であった。これらの結果は、各治療に対する残留農薬の影響を除外した。対照群における48時間後の幼虫を規定から除去した有無にかかわらず死亡率を評価した。結果は有意差を示さず(表1
Access restricted. Please log in or start a trial to view this content.
ディスカッション
成虫の花粉媒介者の場合、農薬の生態毒性を測定するための2つの主要な方法があります。1つは、殺虫昆虫の胸郭に農薬を施用する接触方法である。もう1つは胃毒性法で、成虫の花粉媒介者に農薬25,26を含む蜂蜜水が供給されます。近年、O.ショベルの受粉効果や開花率が比較的低いことが分かっている27。幼虫の成長およ?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は宣言する利益相反を持っていません。
謝辞
この研究は、中国の国家主要研究開発プログラム(2017YFD0200400)、主要科学技術イノベーションプロジェクト(2017CXGC0214)、山東省ミツバチ産業イノベーションチーム、山東省農業科学アカデミー農業科学技術イノベーションプロジェクト(CXGC2019G01)、山東省農業科学アカデミー農業科学技術イノベーションプロジェクト(CXGC2021B13)の支援を受けた。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Abamectin | Jinan Lvba Pesticide Co. Ltd | ||
| Black-light lamps | Kanghua Medical Device Co., Ltd | ||
| Centrifugal tube box with 100 Wells | Shanghai Rebus Network Technology Co., Ltd | ||
| Centrifuge tube | Shanghai Rebus Network Technology Co., Ltd | 2 mL; Serve as bee tube | |
| Electric soldering iron | Kunshan Kaipai Hardware Electromechanical Co., Ltd | ||
| Electronic scale | Sartorius Scientific Instruments (Beijing) Co., Ltd | 3137510295 | |
| Graduated cylinder | Anhui Weiss Experimental Equipment Co. Ltd | ||
| Petri dishes (60 mm diameter) | Qingdao jindian biochemical equipment co., LTD | ||
| Pollen provision | Yantai Bifeng Agricultural Science and Technology Co. Ltd | ||
| Soft brush | Wengang Wenhai painting material factory | ||
| Solitary bees | Yantai Bifeng Agricultural Science and Technology Co. Ltd |
参考文献
- Sgolastra, F., Tosi, S., Medrzycki, P., Porrini, C., Burgio, G. Toxicity of spirotetramat on solitary bee larvae, Osmia cornuta (hymenoptera: megachilidae), in laboratory conditions. Journal of Apicultural Science. 59 (2), 73-83 (2015).
- Wei, S. G., Wang, R., Smirle, M. J., Xu, H. L. Release of Osmia excavata and Osmia jacoti (Hymenoptera: Megachilidae) for apple pollination. TheCanadian Entomologist. 134 (3), 369-380 (2002).
- Men, X. Y., et al. Biological characteristics and pollination service of Mason bee. Chinese Journal of Applied Entomology. 55 (6), 973-983 (2018).
- Bosch, J., Kemp, W. P., Trostle, G. E. Bee population returns and cherry yields in an orchard pollinated with Osmia lignaria (Hymenoptera: Megachilidae). Journal of Economic Entomology. 99 (2), 408-413 (2006).
- Winfree, R., Williams, N. M., Dushoff, J., Kremen, C. Native bees provide insurance against ongoing honey bee losses. Ecology Letters. 10 (11), 1105-1113 (2007).
- Garibaldi, L. A., Steffan-Dewenter, I., Winfree, R. Wild pollinators enhance fruit set of crops regardless of honey bee abundance. Science. 339 (6127), 1608-1611 (2013).
- Bosch, J., Sgolastra, F., Kemp, W. P. Life cycle ecophysiology of Osmia. mason bees used as crop pollinators. Bee Pollination in Agricultural Ecosystems. James, R. R., Pitts-Singer, T. L. , Oxford University Press. Oxford, UK. 83-104 (2008).
- Liu, L., et al. Population investigation and restriction factors analyses of Osmia excavata Alfken in Jiaodong. Apiculture of China. 69 (9), 68-71 (2018).
- Biesmeijer, J. C., Roberts, S. P. M., Reemer, M. Parallel declines in pollinators and insect-pollinated plants in Britain and the Netherlands. Science. 313 (5785), 351-354 (2006).
- Potts, S. G., Biesmeijer, J. C., Kremen, C. Global pollinator declines: trends, impacts and drivers. Trends in Ecology & Evolution. 25 (6), 345-353 (2010).
- Chen, L., Yan, Q., Zhang, J., Yuan, S., Liu, X. Joint toxicity of acetamiprid and co-applied pesticide adjuvants on honeybees under semi-field and laboratory conditions. Environmental Toxicology and Chemistry. 38 (9), 1940-1946 (2019).
- Sgolastra, F., Medrzycki, P., Bortolotti, L., Renzi, M. T., Bosch, J. Synergistic mortality between a neonicotinoid insecticide and an ergosterol-biosynthesis-inhibiting fungicide in three bee species. Pest Management Science. 73 (6), 1236-1243 (2017).
- Bireley, R., et al. Preface: Workshop on pesticide exposure assessment paradigm for non-Apis bees. Environmental Entomology. 48 (1), 1-3 (2019).
- European Food Safety Authority. EFSA Guidance Document on the risk assessment of plant protection products on bees (Apis mellifera, Bombus spp. and solitary bees). EFSA Journal. 11 (7), 3295(2013).
- Rundlof, M., et al. Seed coating with a neonicotinoid insecticide negatively affects wild bees. Nature. 521 (7550), 77-80 (2015).
- Yuan, R., et al. Toxicity and hazard assessment of six neonicotinoid insecticides on Osmia excavata (hymenoptera:megachilidae). Acta Entomologica Sinica. 61 (8), 950-956 (2018).
- Lin, Z., Meng, F., Zheng, H., Zhou, T., Hu, F. Effects of neonicotinoid insecticides on honeybee health. Acta Entomologica Sinica. 57 (5), 607-615 (2014).
- Gradish, A. E., Scott-Dupree, C. D., Cutler, G. C. Susceptibility of Megachile rotundata to insecticides used in wild blueberry production in Atlantic Canada. Journal of Pest Science. 85, 133-140 (2012).
- Hodgson, E. W., Pitts-Singer, T. L., Barbour, J. D. Effects of the insect growth regulator, novaluron on immature alfalfa leafcutting bees, Megachile rotundata. Journal of Insect Science. 11, 43(2011).
- Konrad, R., Ferry, N., Gatehouse, A. M. R., Babendreier, D. Potential effects of oilseed rape expressing oryzacystatin-1 (OC-1) and of purified insecticidal proteins on larvae of the solitary bee Osmia bicornis. PLoS ONE. 3 (7), 2664(2008).
- Abbott, V. A., Nadeau, J. L., Higo, H. A., Winston, M. L. Lethal and sublethal effects of imidacloprid on Osmia lignaria and clothianidin on Megachile rotundata (Hymenoptera: megachilidae). Journal of Economic Entomology. 101, 784-796 (2008).
- Yan, Z., Wang, Z. Sublethal effect of abamectin on 3rd instar larvae of Prodenia litura. Chinese Journal of Tropical Crops. 32 (10), 1945-1950 (2011).
- Song, Y., et al. Comparative ecotoxicity of insecticides with different modes of action to Osmia excavata (Hymenoptera: Megachilidae). Ecotoxicology and Environmental Safety. 212 (5), 112015(2021).
- Chen, F. J., Wu, G., Ge, F., Parajulee, M. N., Shrestha, R. B. Effects of elevated CO2 and transgenic Bt cotton on plant chemistry, performance, and feeding of an insect herbivore, the cotton bollworm. Entomologia Experimentalis Et Applicata. 115 (2), 341-350 (2005).
- Cang, T., et al. Toxicity and safety evaluation of pesticides commonly used in strawberry production to bees. Zhejiang Agricultural Sciences. (4), 785-787 (2009).
- Cang, T., et al. Acute toxicity and safety assessment of chiral fipronil against Apis mellifera and Trichogramma ostriniae. Ecotoxicology. 7 (3), 326-330 (2012).
- Liu, X., Pan, W. Measures to ensure pollination effect and cocoon recovery rate of Osmia excavata in apple orchard. Northwest Horticulture. (3), 20-21 (2017).
- Meikle, W. G., Adamczyk, J. J., Weiss, M., Ross, J., Beren, E. Sublethal concentrations of clothianidin affect honey bee colony growth and hive CO2 concentration. Scientific Reports. 11 (1), 4364(2021).
- Meikle, W. G., Adamczyk, J. J., Weiss, M., Ross, J., Beren, E. Sublethal concentrations of clothianidin affect honey bee colony behavior and interact with landscapes to affect colony growth. BioRxiv. , (2020).
- Wang, Y. F., et al. Combination effects of three neonicotinoid pesticides on physiology and survival of honey bees (Apis mellifera L). Journal of Environmental Entomology. 41 (3), 612-618 (2019).
- Kopit, A. M., Pitts-Singer, T. L. Routes of pesticide exposure in solitary, cavity-nesting bees. Environmental Entomology. 47 (3), 499-510 (2018).
- Cheng, Y., et al. Chronic oral toxicity of chlorpyrifos and imidacloprid to adult honey bees (Apis mellifera L). Asian Journal of Ecotoxicology. 11 (2), 715-719 (2016).
- Li, M., Ma, C., Xiao, L., Li, Z., Su, S. Effects of chlorpyrifos on behavior response of Apis mellifera and Apis cerana. Apicultural Science Association of China. , (2016).
- Cresswell, J. E. A meta-analysis of experiments testing the effects of a neonicotinoid insecticide (imidacloprid) on honey bees. Ecotoxicology. 20 (1), 149-157 (2011).
- Nauen, R., Ebbinghaus-Kintscher, U., Schmuck, R. Toxicity and nicotinic acetylcholine receptor interaction of imidacloprid and its metabolites in Apis mellifera (Hymenoptera; Apidae). Pest Management Science. 57 (7), 577-586 (2001).
- Colin, M. E., et al. A method to quantify and analyze the foraging activity of honey bees: relevance to the sublethal effects induced by systemic insecticides. Archives of Environmental Contamination and Toxicology. 47 (3), 387-395 (2004).
- Decourtye, A., et al. Comparative sublethal toxicity of nine pesticides on olfactory learning performances of the honeybee Apis mellifera. Archives of Environmental Contamination & Toxicology. 48 (2), 242-250 (2005).
- Williamson, S. M., Wright, G. A. Exposure to multiple cholinergic pesticides impairs olfactory learning and memory in honeybees. Journal of Experimental Biology. 216 (10), 1799-1807 (2013).
- Henry, M., et al. A common pesticide decreases foraging success and survival in honey bees. Science. 336 (6079), 348-350 (2012).
- Matsumoto, T. Reduction in homing flights in the honey bee Apis mellifera after a sublethal dose of neonicotinoid insecticides. Bulletin of Insectology. 66 (1), 1-9 (2013).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved