È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Valutare l'effetto dei pesticidi sulle larve delle api solitarie
In questo articolo
Riepilogo
Il presente protocollo spiega un metodo per alimentare le larve delle api solitarie, Osmia excavata, con disposizioni contaminate da pesticidi. La procedura esamina l'ecotossicità del pesticida alle larve delle api solitarie.
Abstract
Le attuali valutazioni del rischio ecologico dei pesticidi sugli impollinatori hanno considerato principalmente solo le condizioni di laboratorio. Per le larve delle api solitarie, l'ingestione di provviste contaminate da pesticidi può aumentare il tasso di mortalità delle larve, diminuire il tasso di raccolta e la popolazione di api solitarie adulte nel prossimo anno da una prospettiva demografica. Ma ci sono studi limitati sugli effetti dei pesticidi sulle larve delle api solitarie. Pertanto, capire come i pesticidi influenzano le larve delle api solitarie dovrebbe essere considerato parte integrante della valutazione del rischio ecologico dei pesticidi. Questo studio presenta un metodo per esporre le larve dell'ape solitaria, Osmia excavata , a dosi letali o subletali di pesticidi, monitorando l'aumento di peso larvale, la durata dello sviluppo, la capacità di eclosione e la conversione dell'efficienza del consumo alimentare del cibo ingerito. Per dimostrare l'efficacia di questo metodo, le larve di O. excavata sono state alimentate con provviste contenenti dosi acute letali e subletali di clorpirifos. Quindi, sono stati studiati gli indici di cui sopra delle larve trattate. Questa tecnica aiuta a prevedere e mitigare il rischio di pesticidi per gli impollinatori.
Introduzione
Gli impollinatori svolgono un ruolo fondamentale nei servizi ecosistemici della moderna agricoltura globale. Mentre le api mellifere (Apis mellifera; Gli imenotteri: Apidae) sono stati tradizionalmente considerati come gli impollinatori economici essenziali delle colture, recenti ricerche suggeriscono che Osmia (Hymenoptera: Megachilidae) è anche molto importante nel migliorare l'impollinazione per alcune colture, aumentando le dimensioni dei frutti e il numero di semi e riducendo la proporzione di frutta asimmetrica nei frutteti commerciali in diverse parti del mondo1. Osmia excavata è stata considerata una specie ideale per l'impollinazione delle mele, principalmente in Asia, come nel nord e nord-ovest della Cina e in Giappone 2,3,4. Può fornire servizi di impollinazione per alcune colture con efficienza simile o talvolta con maggiore efficienza. A questo proposito, è stato dimostrato che sostituiscono o lavorano in sinergia con le apimellifere 4,5,6.
Le caratteristiche biologiche di O. excavata sono uniche rispetto alle api sociali. La sua attività univoltina, solitaria e di nidificazione si verifica principalmente in primavera e all'inizio dell'estate. I nidi di O. excavata si trovano di solito in fori preesistenti, tipicamente in legno morto, piante cave, tubi di paglia e gambo di bambù nella condizione naturale3. L'adulto O. excavata emerge dal suo bozzolo per accoppiarsi, raccogliere polline e costruire un nido per deporre le uova, che iniziano a schiudersi una settimana dopo. Le uova fecondate si sviluppano in femmine, mentre le uova non fecondate si sviluppano in maschi3. Le femmine sono distribuite nella parte inferiore del tubo delle api e le disposizioni corrispondenti sono più significative. Al contrario, i maschi erano in prossimità dell'uscita del tubo con disposizioni minori7, quindi i maschi escono per primi e le femmine escono più tardi. La femmina mescola il polline con una piccola quantità di nettare in un blob umido, l'unica fonte di cibo per ogni larva nella cellula8.
Diversi studi hanno riportato una diminuzione della popolazione di insetti impollinatori 9,10. L'uso estensivo di pesticidi è stato identificato come uno dei principali fattori per ridurre l'abbondanza e la diversità degli impollinatori e può anche mettere in pericolo i servizi di impollinazione11,12. Per ridurre e mitigare gli effetti negativi dei pesticidi, è necessario condurre una valutazione del rischio dei pesticidi per gli impollinatori. Alcuni paesi hanno stabilito quadri normativi per garantire la sicurezza delle api dai pesticidi utilizzati13,14. Studi recenti hanno dimostrato che Osmia era più suscettibile ai pesticidi rispetto alle api da miele 1,15.
È interessante notare che la maggior parte delle valutazioni del rischio si sono concentrate sulle api adulte 11,12; poche ricerche sono state condotte su O. excavata, in particolare sulle larve. Inoltre, la mortalità di Osmia direttamente causata dai pesticidi è più comunemente considerata16. Tuttavia, le tossicità croniche come l'aumento di peso larvale, la durata dello sviluppo, i modelli di alimentazione, la capacità di eclosione, il successivo comportamento adulto e la fecondità possono avere lo stesso danno delle tossicità letali acute e sono spesso ignorate a causa della mancanza di un metodo sperimentale efficace per le api solitarie17.
Fino ad ora, due metodi sono utilizzati per valutare gli effetti dei pesticidi sulle larve delle api solitarie: (1) una quantità appropriata di pesticidi è stata applicata nel punto localizzato di disposizioni senza rimuovere l'uovo delle api solitarie 1,18,19,20; (2) sostituzione delle disposizioni con miscele artificiali di polline e nettare contenenti una quantità specifica di antiparassitario21. Tuttavia, ci sono alcune limitazioni ai due metodi di cui sopra. Il primo può misurare solo la tossicità acuta, ma non la tossicità cronica perché le larve hanno ingerito l'intera dose in un breve periodo di tempo; quest'ultimo porterebbe ad un alto tasso di mortalità a causa della manipolazione umana1. Qui, il metodo di immersione è stato descritto per studiare l'ecotossicità dei pesticidi a O. excavata in condizioni di ricerca altamente controllate, simulando il comportamento dell'alimentazione larvale con pesticidi residui nelle disposizioni nell'ambiente reale. Il metodo di questo studio risolve gli svantaggi dei due metodi di cui sopra ed è adatto per misurare gli effetti di una sostanza pericolosa sulla tossicità acuta e cronica.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Preparazione del tubo di alimentazione
- Praticare un foro (~ 0,3 mm di diametro) nel coperchio di un tubo di centrifuga da 2 ml utilizzando un ferro da avvolgimento elettrico (vedere Tabella dei materiali). Utilizzare un tale tubo centrifuga per mantenere una larva di O. excavata e la sua massa di fornitura.
2. Preparazione del pesticida
- Sciogliere il pesticida di grado tecnico (vedi Tabella dei materiali) in acetone per acquisire soluzioni stock di 1 x 104 μg a.i. mL-1. Quindi, eseguire diluizioni graduali della soluzione a più di cinque concentrazioni.
NOTA: in questo studio sono stati utilizzati clorpirifos a 0,1, 0,2, 0,4, 0,8, 1,6, 3,2, 6,4 μg a.i. mL-1 .
3. Preparazione delle disposizioni
- Acquisire tubi di plastica per api contenenti provviste (vedi Tabella dei materiali) e larve di O. excavata appena tratteggiate da un programma di allevamento di massa.
NOTA: Nessun pesticida è stato utilizzato da 20 giorni prima della fioritura all'intero periodo di fioritura; i risultati delle analisi chimiche hanno mostrato che i contenuti di pesticidi comunemente usati in cinquanta disposizioni selezionate a caso erano entrambi al di sotto dei livelli minimi di prova. - Separare le provviste e le larve delicatamente usando una spazzola morbida. Seleziona le larve femmine in base alle dimensioni della fornitura e alla posizione della cellula all'interno del nido9. Quindi, posizionare provviste di dimensioni uniformi e larve femminili selezionate in piastre di Petri (diametro 60 mm) e metterle da parte per l'uso.
NOTA: Cinquanta disposizioni sono state selezionate a caso per analizzare il contenuto di pesticidi comunemente usati: clorpirifos, imidacloprid, fendifenuron, phoxim, avermectina. I parametri della spazzola morbida sono (a) diametro del pennello: 0,3 mm, (b) lunghezza del pennello: 2 cm, (c) lunghezza della penna: 18 cm.
4. Fornire un trattamento con pesticidi
- Immergere le disposizioni selezionate di dimensioni uniformi (dal punto 3.2) in pesticidi diluiti (dal punto 2.1; clorpirifos a 0,1, 0,2, 0,4, 0,8, 1,6, 3,2, 6,4 μg a.i. mL-1) per 10 s utilizzando una gabbia. Immergere il controllo di controllo (CK) in solvente allo 0,2% (acetone in questo studio).
NOTA: esistono tre repliche per trattamento di concentrazione e ogni replica consisteva in 60 disposizioni. La differenza di dosaggio di ciascuna disposizione può essere ridotta selezionando disposizioni di dimensioni uniformi. - Misurare il volume della soluzione di pesticida prima e dopo aver trattato le disposizioni con il pesticida. Quindi, calcolare il volume immerso di insetticida in ciascun trattamento, comprese le 60 disposizioni di massa (Tabella supplementare 1). Posizionare le disposizioni in tubi centrifughi separati con fori (dal punto 1.1) dopo l'essiccazione all'aria su un piano di lavoro sterile.
NOTA: prima dell'esperimento, inserire le gabbie contenenti le disposizioni nella soluzione di pesticidi e quindi misurare il volume della soluzione di pesticidi prima e dopo l'ammollo per eliminare l'errore. - Trasferire le larve femminili individualmente sulla superficie delle provviste essiccate naturalmente usando una spazzola morbida.
NOTA: Una larva in un tubo.
5. Condizioni di crescita
- Allevare le larve di O. excavata in una camera di crescita al buio, 65%-75% di umidità relativa e 25 ± 2 °C16.
6. Esame dei risultati
- Il test di tossicità letale acuta
- Misurare la mortalità delle larve dopo averle posizionate sul trattamento e le disposizioni di controllo (CK) per 48 ore.
NOTA: I criteri di morte: quando le larve non hanno risposto al tocco lieve usando una spazzola morbida sotto lampade a luce nera22. Le lampade a luce nera sono state utilizzate per simulare le condizioni di crescita scure delle larve ed evitare l'influenza della luce sulle larve durante il controllo degli indicatori di crescita. Per eliminare l'errore umano, sono state misurate anche le morti con e senza rimozione delle larve dalle disposizioni dopo 48 ore nei gruppi di controllo. - Pesare 60 provviste prima e dopo 48 ore di prove di allevamento di insetti per determinare la quantità di provviste consumata da ciascuna larva.
- Calcola la dose di pesticida ad ogni concentrazione consumata da ciascuna larva in base alla percentuale di fornitura consumata e al contenuto di pesticidi in ciascuna fornitura.
NOTA: L'equazione per il calcolo della dose è23: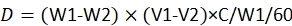
dove, D è la dose consumata di pesticida da ciascuna larva; W1 è il peso di 60 disposizioni prima dell'infusione di pesticida; W2 è il peso residuo di 60 provviste dopo 48 h; V1 è il volume di pesticida prima dell'immersione per 60 disposizioni; V2 è il volume di pesticida dopo l'immersione per 60 disposizioni; C è la concentrazione del pesticida.
- Misurare la mortalità delle larve dopo averle posizionate sul trattamento e le disposizioni di controllo (CK) per 48 ore.
- Il test di tossicità subletale
- Pesare le larve prima delle prove di allevamento e dopo 14 giorni di trattamenti per determinare l'aumento di peso larvale.
- Osserva O. excavata ogni giorno durante il bozzolo sotto lampade a luce nera per misurare la durata dello sviluppo larvale.
- Pesare le porzioni rimanenti di accantonamenti dopo 14 giorni dall'alimentazione con disposizioni trattate e CK per calcolare il consumo e l'efficienza della conversione degli alimenti ingeriti (ICE)24.
- Esamina il numero di eclosioni tagliando i bozzoli usando una piccola forbice quando le api di controllo emergono negli adulti.
Access restricted. Please log in or start a trial to view this content.
Risultati
I tenori di antiparassitari di uso comune, clorpirifos, imidacloprid, fendifenuron, phoxim, avermectina nelle disposizioni erano inferiori al limite di quantificazione (0,01-0,02 mg kg-1) nel gruppo di controllo; questi risultati hanno escluso l'influenza dei residui di pesticidi su ciascun trattamento. È stata valutata la mortalità con e senza rimozione delle larve dalle provviste dopo 48 ore nei gruppi di controllo; i risultati non hanno mostrato differenze significative (Tabella 1), indic...
Access restricted. Please log in or start a trial to view this content.
Discussione
Per gli impollinatori adulti, ci sono due metodi principali per misurare l'ecotossicità dei pesticidi. Uno è il metodo di contatto, in cui il pesticida viene applicato al protorace degli insetti adulti; l'altro è il metodo di tossicità gastrica, in cui gli impollinatori adulti vengono nutriti con acqua di miele contenente pesticida25,26. Negli ultimi anni, è stato riscontrato che l'effetto di impollinazione e il tasso di eclosione di O. excavata son...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Questo studio è stato supportato dal National Key R&D Program of China (2017YFD0200400), major scientific and technological innovation Project (2017CXGC0214), Bee Industry Innovation Team della provincia di Shandong, Agricultural Science and Technology Innovation Project della Shandong Academy of Agricultural Sciences (CXGC2019G01) e Agricultural Science and Technology Innovation Project della Shandong Academy of Agricultural Sciences (CXGC2021B13).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Abamectin | Jinan Lvba Pesticide Co. Ltd | ||
| Black-light lamps | Kanghua Medical Device Co., Ltd | ||
| Centrifugal tube box with 100 Wells | Shanghai Rebus Network Technology Co., Ltd | ||
| Centrifuge tube | Shanghai Rebus Network Technology Co., Ltd | 2 mL; Serve as bee tube | |
| Electric soldering iron | Kunshan Kaipai Hardware Electromechanical Co., Ltd | ||
| Electronic scale | Sartorius Scientific Instruments (Beijing) Co., Ltd | 3137510295 | |
| Graduated cylinder | Anhui Weiss Experimental Equipment Co. Ltd | ||
| Petri dishes (60 mm diameter) | Qingdao jindian biochemical equipment co., LTD | ||
| Pollen provision | Yantai Bifeng Agricultural Science and Technology Co. Ltd | ||
| Soft brush | Wengang Wenhai painting material factory | ||
| Solitary bees | Yantai Bifeng Agricultural Science and Technology Co. Ltd |
Riferimenti
- Sgolastra, F., Tosi, S., Medrzycki, P., Porrini, C., Burgio, G. Toxicity of spirotetramat on solitary bee larvae, Osmia cornuta (hymenoptera: megachilidae), in laboratory conditions. Journal of Apicultural Science. 59 (2), 73-83 (2015).
- Wei, S. G., Wang, R., Smirle, M. J., Xu, H. L. Release of Osmia excavata and Osmia jacoti (Hymenoptera: Megachilidae) for apple pollination. TheCanadian Entomologist. 134 (3), 369-380 (2002).
- Men, X. Y., et al. Biological characteristics and pollination service of Mason bee. Chinese Journal of Applied Entomology. 55 (6), 973-983 (2018).
- Bosch, J., Kemp, W. P., Trostle, G. E. Bee population returns and cherry yields in an orchard pollinated with Osmia lignaria (Hymenoptera: Megachilidae). Journal of Economic Entomology. 99 (2), 408-413 (2006).
- Winfree, R., Williams, N. M., Dushoff, J., Kremen, C. Native bees provide insurance against ongoing honey bee losses. Ecology Letters. 10 (11), 1105-1113 (2007).
- Garibaldi, L. A., Steffan-Dewenter, I., Winfree, R. Wild pollinators enhance fruit set of crops regardless of honey bee abundance. Science. 339 (6127), 1608-1611 (2013).
- Bosch, J., Sgolastra, F., Kemp, W. P. Life cycle ecophysiology of Osmia. mason bees used as crop pollinators. Bee Pollination in Agricultural Ecosystems. James, R. R., Pitts-Singer, T. L. , Oxford University Press. Oxford, UK. 83-104 (2008).
- Liu, L., et al. Population investigation and restriction factors analyses of Osmia excavata Alfken in Jiaodong. Apiculture of China. 69 (9), 68-71 (2018).
- Biesmeijer, J. C., Roberts, S. P. M., Reemer, M. Parallel declines in pollinators and insect-pollinated plants in Britain and the Netherlands. Science. 313 (5785), 351-354 (2006).
- Potts, S. G., Biesmeijer, J. C., Kremen, C. Global pollinator declines: trends, impacts and drivers. Trends in Ecology & Evolution. 25 (6), 345-353 (2010).
- Chen, L., Yan, Q., Zhang, J., Yuan, S., Liu, X. Joint toxicity of acetamiprid and co-applied pesticide adjuvants on honeybees under semi-field and laboratory conditions. Environmental Toxicology and Chemistry. 38 (9), 1940-1946 (2019).
- Sgolastra, F., Medrzycki, P., Bortolotti, L., Renzi, M. T., Bosch, J. Synergistic mortality between a neonicotinoid insecticide and an ergosterol-biosynthesis-inhibiting fungicide in three bee species. Pest Management Science. 73 (6), 1236-1243 (2017).
- Bireley, R., et al. Preface: Workshop on pesticide exposure assessment paradigm for non-Apis bees. Environmental Entomology. 48 (1), 1-3 (2019).
- European Food Safety Authority. EFSA Guidance Document on the risk assessment of plant protection products on bees (Apis mellifera, Bombus spp. and solitary bees). EFSA Journal. 11 (7), 3295(2013).
- Rundlof, M., et al. Seed coating with a neonicotinoid insecticide negatively affects wild bees. Nature. 521 (7550), 77-80 (2015).
- Yuan, R., et al. Toxicity and hazard assessment of six neonicotinoid insecticides on Osmia excavata (hymenoptera:megachilidae). Acta Entomologica Sinica. 61 (8), 950-956 (2018).
- Lin, Z., Meng, F., Zheng, H., Zhou, T., Hu, F. Effects of neonicotinoid insecticides on honeybee health. Acta Entomologica Sinica. 57 (5), 607-615 (2014).
- Gradish, A. E., Scott-Dupree, C. D., Cutler, G. C. Susceptibility of Megachile rotundata to insecticides used in wild blueberry production in Atlantic Canada. Journal of Pest Science. 85, 133-140 (2012).
- Hodgson, E. W., Pitts-Singer, T. L., Barbour, J. D. Effects of the insect growth regulator, novaluron on immature alfalfa leafcutting bees, Megachile rotundata. Journal of Insect Science. 11, 43(2011).
- Konrad, R., Ferry, N., Gatehouse, A. M. R., Babendreier, D. Potential effects of oilseed rape expressing oryzacystatin-1 (OC-1) and of purified insecticidal proteins on larvae of the solitary bee Osmia bicornis. PLoS ONE. 3 (7), 2664(2008).
- Abbott, V. A., Nadeau, J. L., Higo, H. A., Winston, M. L. Lethal and sublethal effects of imidacloprid on Osmia lignaria and clothianidin on Megachile rotundata (Hymenoptera: megachilidae). Journal of Economic Entomology. 101, 784-796 (2008).
- Yan, Z., Wang, Z. Sublethal effect of abamectin on 3rd instar larvae of Prodenia litura. Chinese Journal of Tropical Crops. 32 (10), 1945-1950 (2011).
- Song, Y., et al. Comparative ecotoxicity of insecticides with different modes of action to Osmia excavata (Hymenoptera: Megachilidae). Ecotoxicology and Environmental Safety. 212 (5), 112015(2021).
- Chen, F. J., Wu, G., Ge, F., Parajulee, M. N., Shrestha, R. B. Effects of elevated CO2 and transgenic Bt cotton on plant chemistry, performance, and feeding of an insect herbivore, the cotton bollworm. Entomologia Experimentalis Et Applicata. 115 (2), 341-350 (2005).
- Cang, T., et al. Toxicity and safety evaluation of pesticides commonly used in strawberry production to bees. Zhejiang Agricultural Sciences. (4), 785-787 (2009).
- Cang, T., et al. Acute toxicity and safety assessment of chiral fipronil against Apis mellifera and Trichogramma ostriniae. Ecotoxicology. 7 (3), 326-330 (2012).
- Liu, X., Pan, W. Measures to ensure pollination effect and cocoon recovery rate of Osmia excavata in apple orchard. Northwest Horticulture. (3), 20-21 (2017).
- Meikle, W. G., Adamczyk, J. J., Weiss, M., Ross, J., Beren, E. Sublethal concentrations of clothianidin affect honey bee colony growth and hive CO2 concentration. Scientific Reports. 11 (1), 4364(2021).
- Meikle, W. G., Adamczyk, J. J., Weiss, M., Ross, J., Beren, E. Sublethal concentrations of clothianidin affect honey bee colony behavior and interact with landscapes to affect colony growth. BioRxiv. , (2020).
- Wang, Y. F., et al. Combination effects of three neonicotinoid pesticides on physiology and survival of honey bees (Apis mellifera L). Journal of Environmental Entomology. 41 (3), 612-618 (2019).
- Kopit, A. M., Pitts-Singer, T. L. Routes of pesticide exposure in solitary, cavity-nesting bees. Environmental Entomology. 47 (3), 499-510 (2018).
- Cheng, Y., et al. Chronic oral toxicity of chlorpyrifos and imidacloprid to adult honey bees (Apis mellifera L). Asian Journal of Ecotoxicology. 11 (2), 715-719 (2016).
- Li, M., Ma, C., Xiao, L., Li, Z., Su, S. Effects of chlorpyrifos on behavior response of Apis mellifera and Apis cerana. Apicultural Science Association of China. , (2016).
- Cresswell, J. E. A meta-analysis of experiments testing the effects of a neonicotinoid insecticide (imidacloprid) on honey bees. Ecotoxicology. 20 (1), 149-157 (2011).
- Nauen, R., Ebbinghaus-Kintscher, U., Schmuck, R. Toxicity and nicotinic acetylcholine receptor interaction of imidacloprid and its metabolites in Apis mellifera (Hymenoptera; Apidae). Pest Management Science. 57 (7), 577-586 (2001).
- Colin, M. E., et al. A method to quantify and analyze the foraging activity of honey bees: relevance to the sublethal effects induced by systemic insecticides. Archives of Environmental Contamination and Toxicology. 47 (3), 387-395 (2004).
- Decourtye, A., et al. Comparative sublethal toxicity of nine pesticides on olfactory learning performances of the honeybee Apis mellifera. Archives of Environmental Contamination & Toxicology. 48 (2), 242-250 (2005).
- Williamson, S. M., Wright, G. A. Exposure to multiple cholinergic pesticides impairs olfactory learning and memory in honeybees. Journal of Experimental Biology. 216 (10), 1799-1807 (2013).
- Henry, M., et al. A common pesticide decreases foraging success and survival in honey bees. Science. 336 (6079), 348-350 (2012).
- Matsumoto, T. Reduction in homing flights in the honey bee Apis mellifera after a sublethal dose of neonicotinoid insecticides. Bulletin of Insectology. 66 (1), 1-9 (2013).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon