JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
살충제가 독방 꿀벌의 유충에 미치는 영향 평가
요약
본 프로토콜은 고독한 꿀벌 인 Osmia excavata의 유충에게 살충제로 오염 된 조항을 먹이는 방법을 설명합니다. 이 절차는 독방 꿀벌의 유충에 대한 살충제의 생태 독성을 검사합니다.
초록
수분제에 대한 살충제에 대한 현재의 생태 학적 위험 평가는 주로 실험실 조건 만 고려했습니다. 독방 꿀벌의 유충의 경우, 살충제로 오염 된 조항을 섭취하면 유충의 사망률이 증가하고 인구 통계 학적 관점에서 내년에 성인 독방 꿀벌의 수거율과 인구가 감소 할 수 있습니다. 그러나 살충제가 독방 꿀벌의 유충에 미치는 영향에 대한 연구는 제한적입니다. 따라서 살충제가 독방 꿀벌의 유충에 어떻게 영향을 미치는지 이해하는 것은 살충제 생태 위험 평가의 필수적인 부분으로 간주되어야합니다. 이 연구는 독방 꿀벌, Osmia excavata 의 유충을 살충제의 치명적인 또는 치사하 복용량에 노출시키고, 유충 체중 증가, 발달 기간, 폐색 능력 및 섭취 된 음식의 식품 소비 효율 전환을 추적하는 방법을 제시합니다. 이 방법의 효과를 입증하기 위해, O. excavata 의 유충은 급성 치사 및 아치사 용량의 클로르 피리 포스를 포함하는 조항을 먹였습니다. 그 후, 처리된 유충의 상기 지수를 조사하였다. 이 기술은 수분제에 대한 살충제의 위험을 예측하고 완화하는 데 도움이됩니다.
서문
Pollinators는 현대 세계 농업의 생태계 서비스에서 중요한 역할을합니다. 꿀벌 (아피스 멜리페라; Hymenoptera : Apidae)는 전통적으로 작물의 필수 경제적 수분제로 간주되어 왔으며, 최근 연구에 따르면 Osmia (Hymenoptera : Megachilidae)는 특정 작물의 수분을 개선하고 과일 크기와 종자 수를 늘리며 세계 여러 지역의 상업용 과수원에서 비대칭 과일의 비율을 줄이는 데에도 매우 중요합니다1. Osmia excavata는 중국 북부 및 북서부 및 일본 2,3,4와 같은 아시아에서 주로 사과 수분에 이상적인 종으로 간주되어 왔습니다. 그것은 유사하거나 때로는 더 큰 효율로 특정 작물에 대한 수분 서비스를 제공 할 수 있습니다. 이 점에서, 그들은 꿀벌 4,5,6과 시너지 효과를 대체하거나 작용하는 것으로 나타났습니다.
O. excavata의 생물학적 특성은 사회적 꿀벌과 비교하여 독특합니다. 그것의 단일한, 독방 및 중첩 활동은 주로 봄과 초여름에 발생합니다. O. excavata의 둥지는 일반적으로 자연 조건의 죽은 나무, 중공 식물, 짚 튜브 및 대나무 줄기에서 일반적으로 기존의 구멍에서 발견됩니다3. 성인 O. excavata는 누에 고치에서 나와 짝짓기를하고, 꽃가루를 모으고, 일주일 후에 부화하기 시작하는 알을 낳기 위해 둥지를 짓습니다. 수정 된 난자는 암컷으로 발전하는 반면, 수정되지 않은 난자는 수컷으로 발전합니다3. 암컷은 꿀벌 튜브의 바닥에 분포하며 해당 조항이 더 중요합니다. 대조적으로, 수컷은 사소한 조항7로 튜브 출구의 근접에 있었기 때문에 수컷이 먼저 나오고 암컷은 나중에 나옵니다. 암컷은 소량의 과즙과 꽃가루를 섞어 촉촉한 얼룩으로 섞는데, 이는 세포8의 각 유충의 유일한 식량원입니다.
여러 연구에 따르면 수분을 공급하는 곤충 9,10 개체수가 감소했다고보고했습니다. 살충제의 광범위한 사용은 수분자의 풍부함과 다양성을 감소시키는 주요 요인 중 하나로 확인되었으며 또한 수분 서비스(11,12)를 위태롭게 할 수 있습니다. 살충제의 부작용을 줄이고 완화하려면 수분제에 대한 살충제 위험 평가를 수행해야합니다. 일부 국가에서는13,14 사용 된 살충제로부터 꿀벌에 대한 안전을 보장하기 위해 규제 프레임 워크를 수립했습니다. 최근 연구에 따르면 오스미아는 꿀벌1,15보다 살충제에 더 취약했습니다.
흥미롭게도, 대부분의 위험 평가는 성인 꿀벌11,12에 초점을 맞추고있었습니다. O. excavata, 특히 애벌레에 대한 연구는 거의 수행되지 않았습니다. 또한, 살충제에 의해 직접 야기 된 Osmia의 사망률은 가장 일반적으로16으로 간주됩니다. 여전히, 애벌레 체중 증가, 발달 기간, 수유 패턴, 망막 능력, 후속 성인 행동 및 번식력과 같은 만성 독성은 급성 치명적인 독성과 동일한 해를 미칠 수 있으며 독방 꿀벌에 대한 효과적인 실험 방법이 부족하기 때문에 종종 무시됩니다17.
지금까지 두 가지 방법이 고독한 꿀벌의 유충에 대한 살충제의 영향을 평가하기 위해 사용됩니다 : (1) 독방 꿀벌의 알을 제거하지 않고 적절한 양의 살충제가 국부적 인 장소에 적용되었습니다 1,18,19,20; (2) 특정 양의 살충제21을 함유하는 인공 꽃가루-과즙 혼합물로 조항을 대체한다. 그러나 위의 두 가지 방법에는 몇 가지 제한 사항이 있습니다. 전자는 급성 독성 만 측정 할 수 있지만 유충이 단기간에 전체 용량을 섭취했기 때문에 만성 독성은 측정 할 수 없습니다. 후자는 인간의 조작으로 인해 높은 사망률로 이어질 것입니다1. 여기에서, 침지 방법은 실제 환경에서 잔류 농약에 대한 유충 먹이의 거동을 시뮬레이션함으로써 고도로 통제된 연구 조건 하에서 O. excavata에 대한 살충제의 생태독성을 연구하기 위해 기술되었다. 이 연구의 방법은 위의 두 가지 방법의 단점을 해결하고 급성 및 만성 독성에 대한 유해 물질의 영향을 측정하는 데 적합합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 공급관의 제조
- 전기 권선 철을 사용하여 2 mL 원심분리 튜브의 뚜껑에 구멍(~0.3 mm 직경)을 펀치 합니다(재료 표 참조). 이러한 원심 분리 튜브를 사용하여 O. excavata 유충과 그 공급 질량을 유지하십시오.
2. 농약의 제조
- 기술 등급 살충제 ( 재료 표 참조)를 아세톤에 용해시켜 1 x 104 μg a.i. mL-1의 원액을 얻습니다. 그런 다음, 용액의 구배 희석을 다섯 개 이상의 농도로 수행한다.
참고: 0.1, 0.2, 0.4, 0.8, 1.6, 3.2, 6.4 μg a.i. mL-1 에서의 클로르피리포스를 본 연구에 사용하였다.
3. 조항의 준비
- 식량을 포함하는 플라스틱 꿀벌 튜브 ( 재료 표 참조)와 대량 사육 프로그램에서 O. excavata 의 새로 부화 된 유충을 구입하십시오.
참고 : 개화 20 일 전부터 전체 개화 기간까지 살충제를 사용하지 않았습니다. 화학 분석 결과는 무작위로 선택된 오십 개 조항에서 일반적으로 사용되는 살충제 함량이 모두 최소 시험 수준보다 낮았다는 것을 보여주었습니다. - 부드러운 브러시를 사용하여 부드럽게 조항과 애벌레를 분리하십시오. 둥지 내의 공급 크기와 세포 위치에 따라 암컷 유충을 선택하십시오9. 그런 다음 균일 한 크기의 식량과 선별 된 암컷 유충을 페트리 접시 (직경 60mm)에 넣고 따로 보관하여 사용하십시오.
참고 : 일반적으로 사용되는 살충제의 내용물을 분석하기 위해 오십 개의 조항이 무작위로 선택되었습니다 : chlorpyrifos, imidacloprid, fendifenuron, phoxim, avermectin. 부드러운 브러시 매개 변수는 (a) 브러시의 직경 : 0.3mm, (b) 브러시 길이 : 2cm, (c) 펜 길이 : 18cm입니다.
4. 살충제로 처리 제공
- 선택된 고르게 크기 규정(단계 3.2로부터)을 희석된 살충제(단계 2.1로부터; 0.1, 0.2, 0.4, 0.8, 1.6, 3.2, 6.4 μg a.i. mL-1에서 클로르피리포스)에 담그고 케이지를 사용하여 10초 동안 담그십시오. 대조군 확인(CK)을 0.2% 용매(본 연구에서 아세톤)에 담그십시오.
참고: 농도 처리당 세 번의 반복실험이 있으며 각 반복실험은 60개 조항으로 구성되었습니다. 각 조항의 복용량 차이는 균등하게 크기가 지정된 조항을 선택하여 줄일 수 있습니다. - 살충제로 조항을 처리하기 전후에 살충제 용액의 양을 측정하십시오. 그런 다음, 60 질량 조항을 포함하여 각 처리에서 살충제의 침지 부피를 계산하십시오 (보충 표 1). 규정물을 구멍이 있는 별도의 원심 튜브(단계 1.1부터)에 놓고 멸균 작업대 위에 공기 건조를 한 후.
참고 : 실험 전에 조항이 들어있는 케이지를 살충제 용액에 넣은 다음 담그기 전후에 살충제 용액의 양을 측정하여 오류를 제거하십시오. - 암컷 유충을 부드러운 브러시를 사용하여 자연적으로 말린 공급물의 표면으로 개별적으로 옮깁니다.
참고 : 한 튜브에 하나의 애벌레.
5. 성장 조건
- O. excavata 의 유충을 어둠 속에서, 65%-75% 상대 습도, 및 25± 2°C에서16%의 성장 챔버 내에 진방시킨다.
6. 결과 심사
- 급성 치사 독성 시험
- 48 시간 동안 치료 및 대조 (CK) 조항에 그들을 배치 한 후 유충의 사망률을 측정하십시오.
참고 : 사망 기준 : 유충이 검은 빛 램프22 아래에서 부드러운 브러시를 사용하여 가벼운 터치에 반응하지 않았을 때. 검은 빛 램프는 유충의 어두운 성장 조건을 시뮬레이션하고 성장 지표를 확인할 때 유충에 대한 빛의 영향을 피하기 위해 사용되었습니다. 인간의 실수를 제거하기 위해, 통제 그룹에서 48 시간 후에 조항에서 유충을 제거하거나 제거하지 않은 사망자도 측정되었습니다. - 각 유충이 소비하는 공급량을 결정하기 위해 곤충 사육 시험의 48 시간 전후에 60 조항을 계량하십시오.
- 각 유충이 섭취 한 각 농도에서 살충제의 복용량을 먹는 조항의 비율과 각 조항의 살충제 함량에 따라 계산하십시오.
참고 : 복용량 계산을위한 방정식은23입니다 :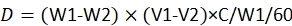
여기서, D는 각 유충에 의한 살충제의 소비 된 복용량이고; W1은 살충제 주입 전에 60 조항의 무게입니다. W2는 48 h 후에 60 조항의 나머지 무게이다; V1은 60 조항에 대한 침지 전 살충제의 양입니다. V2는 60 조항에 대한 침지 후 살충제의 양입니다. C는 살충제의 농도이다.
- 48 시간 동안 치료 및 대조 (CK) 조항에 그들을 배치 한 후 유충의 사망률을 측정하십시오.
- 아치사독성시험
- 유충 체중 증가를 결정하기 위해 사육 시험 전과 치료 14 일 후에 유충의 무게를 측정하십시오.
- 애벌레 발달 기간을 측정하기 위해 검은 빛 램프 아래에서 누에 고치를 치는 동안 매일 O. excavata 를 관찰하십시오.
- 처리 및 CK 조항에 대한 먹이 14 일 후에 조항의 나머지 부분을 계량하여 섭취 된 식품 (ECI)의 소비 및 전환 효율을 계산하십시오 (ECI)24.
- 통제 꿀벌이 성인으로 나타날 때 작은 가위를 사용하여 누에 고치를 저격하여 에클로션의 수를 검사하십시오.
Access restricted. Please log in or start a trial to view this content.
결과
일반적으로 사용되는 살충제, 클로르피리포스, 이미다클로프리드, 펜디페누론, 팍심, 아버멕틴의 함량은 대조군에서 정량화 한계(0.01-0.02 mg kg-1) 미만이었다; 이러한 결과는 각 처리에 대한 살충제 잔류 물의 영향을 배제했습니다. 대조군에서 48 시간 후에 규정에서 유충을 제거하거나 제거하지 않은 사망률을 평가하였다; 결과는 유의한 차이를 보이지 않았으며(표 1), 경미한 ?...
Access restricted. Please log in or start a trial to view this content.
토론
성인 수분제의 경우 살충제의 생태 독성을 측정하는 두 가지 주요 방법이 있습니다. 하나는 살충제가 성인 곤충의 앞부분에 적용되는 접촉 방법입니다. 다른 하나는 성인 수분자가 살충제25,26을 함유 한 꿀 물을 공급하는 위 독성 방법입니다. 최근 몇 년 동안, O. excavata의 수분 효과 및 폐색률이 상대적으로 낮은 것으로 밝혀졌다27
Access restricted. Please log in or start a trial to view this content.
공개
저자는 선언 할 이해 상충이 없습니다.
감사의 말
이 연구는 중국의 국가 핵심 R & D 프로그램 (2017YFD0200400), 주요 과학 기술 혁신 프로젝트 (2017CXGC0214), 산동성의 꿀벌 산업 혁신 팀, 산동 농업 과학 아카데미의 농업 과학 기술 혁신 프로젝트 (CXGC2019G01), 산동 농업 과학 아카데미의 농업 과학 기술 혁신 프로젝트 (CXGC2021B13)의 지원을 받았다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Abamectin | Jinan Lvba Pesticide Co. Ltd | ||
| Black-light lamps | Kanghua Medical Device Co., Ltd | ||
| Centrifugal tube box with 100 Wells | Shanghai Rebus Network Technology Co., Ltd | ||
| Centrifuge tube | Shanghai Rebus Network Technology Co., Ltd | 2 mL; Serve as bee tube | |
| Electric soldering iron | Kunshan Kaipai Hardware Electromechanical Co., Ltd | ||
| Electronic scale | Sartorius Scientific Instruments (Beijing) Co., Ltd | 3137510295 | |
| Graduated cylinder | Anhui Weiss Experimental Equipment Co. Ltd | ||
| Petri dishes (60 mm diameter) | Qingdao jindian biochemical equipment co., LTD | ||
| Pollen provision | Yantai Bifeng Agricultural Science and Technology Co. Ltd | ||
| Soft brush | Wengang Wenhai painting material factory | ||
| Solitary bees | Yantai Bifeng Agricultural Science and Technology Co. Ltd |
참고문헌
- Sgolastra, F., Tosi, S., Medrzycki, P., Porrini, C., Burgio, G. Toxicity of spirotetramat on solitary bee larvae, Osmia cornuta (hymenoptera: megachilidae), in laboratory conditions. Journal of Apicultural Science. 59 (2), 73-83 (2015).
- Wei, S. G., Wang, R., Smirle, M. J., Xu, H. L. Release of Osmia excavata and Osmia jacoti (Hymenoptera: Megachilidae) for apple pollination. TheCanadian Entomologist. 134 (3), 369-380 (2002).
- Men, X. Y., et al. Biological characteristics and pollination service of Mason bee. Chinese Journal of Applied Entomology. 55 (6), 973-983 (2018).
- Bosch, J., Kemp, W. P., Trostle, G. E. Bee population returns and cherry yields in an orchard pollinated with Osmia lignaria (Hymenoptera: Megachilidae). Journal of Economic Entomology. 99 (2), 408-413 (2006).
- Winfree, R., Williams, N. M., Dushoff, J., Kremen, C. Native bees provide insurance against ongoing honey bee losses. Ecology Letters. 10 (11), 1105-1113 (2007).
- Garibaldi, L. A., Steffan-Dewenter, I., Winfree, R. Wild pollinators enhance fruit set of crops regardless of honey bee abundance. Science. 339 (6127), 1608-1611 (2013).
- Bosch, J., Sgolastra, F., Kemp, W. P. Life cycle ecophysiology of Osmia. mason bees used as crop pollinators. Bee Pollination in Agricultural Ecosystems. James, R. R., Pitts-Singer, T. L. , Oxford University Press. Oxford, UK. 83-104 (2008).
- Liu, L., et al. Population investigation and restriction factors analyses of Osmia excavata Alfken in Jiaodong. Apiculture of China. 69 (9), 68-71 (2018).
- Biesmeijer, J. C., Roberts, S. P. M., Reemer, M. Parallel declines in pollinators and insect-pollinated plants in Britain and the Netherlands. Science. 313 (5785), 351-354 (2006).
- Potts, S. G., Biesmeijer, J. C., Kremen, C. Global pollinator declines: trends, impacts and drivers. Trends in Ecology & Evolution. 25 (6), 345-353 (2010).
- Chen, L., Yan, Q., Zhang, J., Yuan, S., Liu, X. Joint toxicity of acetamiprid and co-applied pesticide adjuvants on honeybees under semi-field and laboratory conditions. Environmental Toxicology and Chemistry. 38 (9), 1940-1946 (2019).
- Sgolastra, F., Medrzycki, P., Bortolotti, L., Renzi, M. T., Bosch, J. Synergistic mortality between a neonicotinoid insecticide and an ergosterol-biosynthesis-inhibiting fungicide in three bee species. Pest Management Science. 73 (6), 1236-1243 (2017).
- Bireley, R., et al. Preface: Workshop on pesticide exposure assessment paradigm for non-Apis bees. Environmental Entomology. 48 (1), 1-3 (2019).
- European Food Safety Authority. EFSA Guidance Document on the risk assessment of plant protection products on bees (Apis mellifera, Bombus spp. and solitary bees). EFSA Journal. 11 (7), 3295(2013).
- Rundlof, M., et al. Seed coating with a neonicotinoid insecticide negatively affects wild bees. Nature. 521 (7550), 77-80 (2015).
- Yuan, R., et al. Toxicity and hazard assessment of six neonicotinoid insecticides on Osmia excavata (hymenoptera:megachilidae). Acta Entomologica Sinica. 61 (8), 950-956 (2018).
- Lin, Z., Meng, F., Zheng, H., Zhou, T., Hu, F. Effects of neonicotinoid insecticides on honeybee health. Acta Entomologica Sinica. 57 (5), 607-615 (2014).
- Gradish, A. E., Scott-Dupree, C. D., Cutler, G. C. Susceptibility of Megachile rotundata to insecticides used in wild blueberry production in Atlantic Canada. Journal of Pest Science. 85, 133-140 (2012).
- Hodgson, E. W., Pitts-Singer, T. L., Barbour, J. D. Effects of the insect growth regulator, novaluron on immature alfalfa leafcutting bees, Megachile rotundata. Journal of Insect Science. 11, 43(2011).
- Konrad, R., Ferry, N., Gatehouse, A. M. R., Babendreier, D. Potential effects of oilseed rape expressing oryzacystatin-1 (OC-1) and of purified insecticidal proteins on larvae of the solitary bee Osmia bicornis. PLoS ONE. 3 (7), 2664(2008).
- Abbott, V. A., Nadeau, J. L., Higo, H. A., Winston, M. L. Lethal and sublethal effects of imidacloprid on Osmia lignaria and clothianidin on Megachile rotundata (Hymenoptera: megachilidae). Journal of Economic Entomology. 101, 784-796 (2008).
- Yan, Z., Wang, Z. Sublethal effect of abamectin on 3rd instar larvae of Prodenia litura. Chinese Journal of Tropical Crops. 32 (10), 1945-1950 (2011).
- Song, Y., et al. Comparative ecotoxicity of insecticides with different modes of action to Osmia excavata (Hymenoptera: Megachilidae). Ecotoxicology and Environmental Safety. 212 (5), 112015(2021).
- Chen, F. J., Wu, G., Ge, F., Parajulee, M. N., Shrestha, R. B. Effects of elevated CO2 and transgenic Bt cotton on plant chemistry, performance, and feeding of an insect herbivore, the cotton bollworm. Entomologia Experimentalis Et Applicata. 115 (2), 341-350 (2005).
- Cang, T., et al. Toxicity and safety evaluation of pesticides commonly used in strawberry production to bees. Zhejiang Agricultural Sciences. (4), 785-787 (2009).
- Cang, T., et al. Acute toxicity and safety assessment of chiral fipronil against Apis mellifera and Trichogramma ostriniae. Ecotoxicology. 7 (3), 326-330 (2012).
- Liu, X., Pan, W. Measures to ensure pollination effect and cocoon recovery rate of Osmia excavata in apple orchard. Northwest Horticulture. (3), 20-21 (2017).
- Meikle, W. G., Adamczyk, J. J., Weiss, M., Ross, J., Beren, E. Sublethal concentrations of clothianidin affect honey bee colony growth and hive CO2 concentration. Scientific Reports. 11 (1), 4364(2021).
- Meikle, W. G., Adamczyk, J. J., Weiss, M., Ross, J., Beren, E. Sublethal concentrations of clothianidin affect honey bee colony behavior and interact with landscapes to affect colony growth. BioRxiv. , (2020).
- Wang, Y. F., et al. Combination effects of three neonicotinoid pesticides on physiology and survival of honey bees (Apis mellifera L). Journal of Environmental Entomology. 41 (3), 612-618 (2019).
- Kopit, A. M., Pitts-Singer, T. L. Routes of pesticide exposure in solitary, cavity-nesting bees. Environmental Entomology. 47 (3), 499-510 (2018).
- Cheng, Y., et al. Chronic oral toxicity of chlorpyrifos and imidacloprid to adult honey bees (Apis mellifera L). Asian Journal of Ecotoxicology. 11 (2), 715-719 (2016).
- Li, M., Ma, C., Xiao, L., Li, Z., Su, S. Effects of chlorpyrifos on behavior response of Apis mellifera and Apis cerana. Apicultural Science Association of China. , (2016).
- Cresswell, J. E. A meta-analysis of experiments testing the effects of a neonicotinoid insecticide (imidacloprid) on honey bees. Ecotoxicology. 20 (1), 149-157 (2011).
- Nauen, R., Ebbinghaus-Kintscher, U., Schmuck, R. Toxicity and nicotinic acetylcholine receptor interaction of imidacloprid and its metabolites in Apis mellifera (Hymenoptera; Apidae). Pest Management Science. 57 (7), 577-586 (2001).
- Colin, M. E., et al. A method to quantify and analyze the foraging activity of honey bees: relevance to the sublethal effects induced by systemic insecticides. Archives of Environmental Contamination and Toxicology. 47 (3), 387-395 (2004).
- Decourtye, A., et al. Comparative sublethal toxicity of nine pesticides on olfactory learning performances of the honeybee Apis mellifera. Archives of Environmental Contamination & Toxicology. 48 (2), 242-250 (2005).
- Williamson, S. M., Wright, G. A. Exposure to multiple cholinergic pesticides impairs olfactory learning and memory in honeybees. Journal of Experimental Biology. 216 (10), 1799-1807 (2013).
- Henry, M., et al. A common pesticide decreases foraging success and survival in honey bees. Science. 336 (6079), 348-350 (2012).
- Matsumoto, T. Reduction in homing flights in the honey bee Apis mellifera after a sublethal dose of neonicotinoid insecticides. Bulletin of Insectology. 66 (1), 1-9 (2013).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유