Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Évaluation de l’effet des pesticides sur les larves des abeilles solitaires
Dans cet article
Résumé
Le présent protocole explique une méthode pour nourrir les larves des abeilles solitaires, Osmia excavata, contaminées par des pesticides. La procédure examine l’écotoxicité du pesticide pour les larves des abeilles solitaires.
Résumé
Les évaluations actuelles des risques écologiques des pesticides sur les pollinisateurs n’ont principalement tenu compte que des conditions de laboratoire. Pour les larves d’abeilles solitaires, l’ingestion de provisions contaminées par des pesticides peut augmenter le taux de mortalité des larves, diminuer le taux de collecte et la population d’abeilles solitaires adultes au cours de la prochaine année d’un point de vue démographique. Mais il existe peu d’études sur les effets des pesticides sur les larves d’abeilles solitaires. Par conséquent, comprendre comment les pesticides influencent les larves d’abeilles solitaires devrait être considéré comme faisant partie intégrante de l’évaluation des risques écologiques des pesticides. Cette étude présente une méthode pour exposer les larves d’abeille solitaire, Osmia excavata , à des doses létales ou sublétales de pesticide, en suivant le gain de poids larvaire, la durée de développement, la capacité d’éclosion et la conversion de l’efficacité de la consommation alimentaire des aliments ingérés. Pour démontrer l’efficacité de cette méthode, les larves d’O. excavata ont été nourries avec des provisions contenant des doses aiguës létales et sublétales de chlorpyrifos. Ensuite, les indices ci-dessus des larves traitées ont été étudiés. Cette technique aide à prédire et à atténuer le risque des pesticides pour les pollinisateurs.
Introduction
Les pollinisateurs jouent un rôle essentiel dans les services écosystémiques de l’agriculture mondiale moderne. Alors que les abeilles mellifères (Apis mellifera; Hyménoptères: Apidae) ont traditionnellement été considérés comme les pollinisateurs économiques essentiels des cultures, des recherches récentes suggèrent que Osmia (Hyménoptères: Megachilidae) est également très important pour améliorer la pollinisation de certaines cultures, augmenter la taille des fruits et le nombre de graines, et réduire la proportion de fruits asymétriques dans les vergers commerciaux dans différentes parties du monde1. Osmia excavata a été considéré comme une espèce idéale pour la pollinisation des pommes, principalement en Asie, comme dans le nord et le nord-ouest de la Chine et au Japon 2,3,4. Il peut fournir des services de pollinisation pour certaines cultures avec une efficacité similaire ou parfois plus efficace. À cet égard, il a été démontré qu’elles remplacent ou travaillent en synergie avec les abeilles mellifères 4,5,6.
Les caractéristiques biologiques d’O. excavata sont uniques par rapport aux abeilles sociales. Son activité univoltine, solitaire et de nidification se produit principalement au printemps et au début de l’été. Les nids d’O. excavata se trouvent généralement dans des trous préexistants, généralement dans le bois mort, les plantes creuses, les tubes de paille et la tige de bambou à l’état naturel3. O . excavata adulte émerge de son cocon pour s’accoupler, ramasser du pollen et construire un nid pour pondre des œufs, qui commencent à éclore une semaine plus tard. Les œufs fécondés se développent en femelles, tandis que les œufs non fécondés se développent en mâles3. Les femelles sont réparties dans le fond du tube d’abeille et les provisions correspondantes sont plus importantes. En revanche, les mâles étaient à proximité de la sortie du tube avec des provisions mineures7, de sorte que les mâles sortent en premier, et les femelles sortent plus tard. La femelle mélange le pollen avec une petite quantité de nectar dans une tache humide, la seule source de nourriture pour chaque larve de la cellule8.
Plusieurs études ont rapporté une diminution de la population d’insectes pollinisateurs 9,10. L’utilisation intensive de pesticides a été identifiée comme l’un des principaux facteurs de réduction de l’abondance et de la diversité des pollinisateurs et peut également mettre en danger les services de pollinisation11,12. Pour réduire et atténuer les effets néfastes des pesticides, il est nécessaire de procéder à une évaluation des risques liés aux pesticides pour les pollinisateurs. Certains pays ont établi des cadres réglementaires pour assurer la sécurité des abeilles contre les pesticides utilisés13,14. Des études récentes ont montré qu’Osmia était plus sensible aux pesticides que les abeilles mellifères 1,15.
Fait intéressant, la plupart des évaluations des risques étaient axées sur les abeilles mellifères adultes11,12; peu de recherches ont été menées sur O. excavata, en particulier les larves. De plus, la mortalité d’Osmia directement causée par les pesticides est le plus souvent considérée comme16. Pourtant, les toxicités chroniques telles que le gain de poids larvaire, la durée du développement, les habitudes alimentaires, la capacité d’éclosion, le comportement ultérieur des adultes et la fécondité peuvent avoir les mêmes dommages que les toxicités létales aiguës et sont souvent ignorées en raison de l’absence d’une méthode expérimentale efficace pour les abeilles solitaires17.
Jusqu’à présent, deux méthodes sont utilisées pour évaluer les effets des pesticides sur les larves d’abeilles solitaires: (1) une quantité appropriée de pesticide a été appliquée à l’endroit localisé des provisions sans enlever l’œuf des abeilles solitaires 1,18,19,20; 2° remplacer les dispositions par des mélanges artificiels pollen-nectar contenant une quantité déterminée de pesticide21. Cependant, il existe certaines limites aux deux méthodes ci-dessus. Le premier ne peut mesurer que la toxicité aiguë, mais pas la toxicité chronique parce que les larves ont ingéré la totalité de la dose dans un court laps de temps; ce dernier conduirait à un taux de mortalité élevé en raison de manipulationshumaines 1. Ici, la méthode d’immersion a été décrite pour étudier l’écotoxicité des pesticides à O. excavata dans des conditions de recherche hautement contrôlées en simulant le comportement des larves se nourrissant de pesticides résiduels dans les provisions dans l’environnement réel. La méthode de cette étude résout les inconvénients des deux méthodes ci-dessus et convient à la mesure des effets d’une substance dangereuse sur la toxicité aiguë et chronique.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Préparation de la sonde d’alimentation
- Percez un trou (~0,3 mm de diamètre) dans le couvercle d’un tube de centrifugeuse de 2 mL à l’aide d’un fer à enroulement électrique (voir tableau des matériaux). Utilisez un tel tube de centrifugeuse pour maintenir une larve d’O. excavata et sa masse d’approvisionnement.
2. Préparation du pesticide
- Dissoudre le pesticide de qualité technique (voir tableau des matériaux) dans de l’acétone pour acquérir des solutions mères de 1 x 104 μg d’i.a. mL-1. Ensuite, effectuez des dilutions de gradient de la solution à plus de cinq concentrations.
NOTE : Des chlorpyrifos à 0,1, 0,2, 0,4, 0,8, 1,6, 3,2, 6,4 μg a.i. mL-1 ont été utilisés dans cette étude.
3. Préparation des dispositions
- Acquérir des tubes d’abeilles en plastique contenant des provisions (voir tableau des matériaux) et des larves nouvellement écloses d’O . excavata dans le cadre d’un programme d’élevage en masse.
REMARQUE: Aucun pesticide n’a été utilisé de 20 jours avant la floraison jusqu’à toute la période de floraison; les résultats des analyses chimiques ont montré que les teneurs en pesticides couramment utilisées dans cinquante dispositions sélectionnées au hasard étaient toutes deux inférieures aux niveaux d’essai minimaux. - Séparez doucement les provisions et les larves à l’aide d’une brosse douce. Sélectionnez les larves femelles en fonction de la taille de l’approvisionnement et de la position de la cellule dans le nid9. Ensuite, placez des provisions de taille uniforme et des larves femelles sélectionnées dans des boîtes de Pétri (60 mm de diamètre) et mettez-les de côté pour utilisation.
NOTE: Cinquante dispositions ont été choisies au hasard pour analyser le contenu des pesticides couramment utilisés: chlorpyrifos, imidaclopride, fendifenuron, phoxim, avermectine. Les paramètres de la brosse souple sont (a) le diamètre de la brosse: 0,3 mm, (b) la longueur de la brosse: 2 cm, (c) la longueur du stylo: 18 cm.
4. Fournir un traitement avec un pesticide
- Faire tremper les provisions sélectionnées de taille uniforme (à partir de l’étape 3.2) dans un pesticide dilué (à partir de l’étape 2.1; chlorpyrifos à 0,1, 0,2, 0,4, 0,8, 1,6, 3,2, 6,4 μg a.i. mL-1) pendant 10 s à l’aide d’une cage. Tremper le contrôle (CK) dans un solvant à 0,2 % (acétone dans cette étude).
REMARQUE : Il y a trois répétitions par traitement par concentration, et chaque répétition comprenait 60 provisions. La différence de dosage de chaque disposition peut être réduite en sélectionnant des dispositions de taille uniforme. - Mesurer le volume de la solution de pesticide avant et après le traitement des provisions avec le pesticide. Ensuite, calculez le volume immergé d’insecticide dans chaque traitement, y compris 60 provisions de masse (tableau supplémentaire 1). Placer les provisions dans des tubes centrifuges séparés avec des trous (à partir de l’étape 1.1) après séchage à l’air sur une table de travail stérile.
REMARQUE: Avant l’expérience, mettez les cages contenant les provisions dans la solution de pesticide, puis mesurez le volume de solution de pesticide avant et après le trempage pour éliminer l’erreur. - Transférer les larves femelles individuellement à la surface des provisions séchées naturellement à l’aide d’une brosse douce.
REMARQUE: Une larve dans un tube.
5. Conditions de croissance
- Élevez les larves d’O. excavata dans une chambre de croissance dans l’obscurité, avec 65% à 75% d’humidité relative et 25 ± 2 °C16.
6. Examen des résultats
- L’essai de toxicité létale aiguë
- Mesurer la mortalité des larves après les avoir placées sur les provisions traitées et de contrôle (CK) pendant 48 h.
NOTE: Les critères de décès: lorsque les larves n’ont pas répondu au toucher doux à l’aide d’une brosse douce sous des lampes à lumière noire22. Des lampes à lumière noire ont été utilisées pour simuler les conditions de croissance sombres des larves et éviter l’influence de la lumière sur les larves lors de la vérification des indicateurs de croissance. Pour éliminer l’erreur humaine, les mortalités avec et sans retrait des larves des provisions après 48 h dans les groupes témoins ont également été mesurées. - Peser 60 provisions avant et après 48 h d’essais d’élevage d’insectes pour déterminer la quantité de provisions consommée par chaque larve.
- Calculer la dose de pesticide à chaque concentration consommée par chaque larve en fonction du pourcentage de provisions consommées et de la teneur en pesticides de chaque fourniture.
REMARQUE: L’équation pour le calcul de la dose estde 23: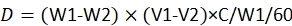
où, D est la dose consommée de pesticide par chaque larve; W1 est le poids de 60 provisions avant l’infusion de pesticide; W2 est le poids restant de 60 provisions après 48 h; V1 est le volume de pesticide avant immersion pour 60 provisions; V2 est le volume de pesticide après immersion pour 60 provisions; C est la concentration du pesticide.
- Mesurer la mortalité des larves après les avoir placées sur les provisions traitées et de contrôle (CK) pendant 48 h.
- L’essai de toxicité sublétale
- Peser les larves avant les essais d’élevage et après 14 jours de traitements pour déterminer le gain de poids larvaire.
- Observez O. excavata quotidiennement pendant le cocooning sous des lampes à lumière noire pour mesurer la durée de développement larvaire.
- Peser les portions restantes des provisions après 14 jours d’alimentation sur les provisions traitées et les provisions CK pour calculer la consommation et l’efficacité de la conversion des aliments ingérés (ICE)24.
- Examinez le nombre d’éclosions en tirant sur les cocons à l’aide d’un petit ciseau lorsque les abeilles témoins émergent chez les adultes.
Access restricted. Please log in or start a trial to view this content.
Résultats
Les teneurs en pesticides couramment utilisés, chlorpyrifos, imidaclopride, fendifenuron, phoxim, avermectine dans les provisions étaient inférieures à la limite de quantification (0,01-0,02 mg kg-1) dans le groupe témoin; ces résultats excluent l’influence des résidus de pesticides sur chaque traitement. La mortalité avec et sans retrait des larves des provisions après 48 h dans les groupes témoins a été évaluée; les résultats n’ont montré aucune différence significative (tableau ...
Access restricted. Please log in or start a trial to view this content.
Discussion
Pour les pollinisateurs adultes, il existe deux méthodes principales pour mesurer l’écotoxicité des pesticides. L’un est la méthode de contact, dans laquelle le pesticide est appliqué sur le prothorax des insectes adultes; l’autre est la méthode de toxicité gastrique, dans laquelle les pollinisateurs adultes sont nourris avec de l’eau de miel contenant du pesticide25,26. Au cours des dernières années, il a été constaté que l’effet de pollini...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Cette étude a été soutenue par le Programme national clé de R&D de la Chine (2017YFD0200400), le Projet majeur d’innovation scientifique et technologique (2017CXGC0214), l’Équipe d’innovation de l’industrie apicole de la province du Shandong, le Projet d’innovation en sciences et technologies agricoles de l’Académie des sciences agricoles du Shandong (CXGC2019G01) et le Projet d’innovation en sciences et technologies agricoles de l’Académie des sciences agricoles du Shandong (CXGC2021B13).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Abamectin | Jinan Lvba Pesticide Co. Ltd | ||
| Black-light lamps | Kanghua Medical Device Co., Ltd | ||
| Centrifugal tube box with 100 Wells | Shanghai Rebus Network Technology Co., Ltd | ||
| Centrifuge tube | Shanghai Rebus Network Technology Co., Ltd | 2 mL; Serve as bee tube | |
| Electric soldering iron | Kunshan Kaipai Hardware Electromechanical Co., Ltd | ||
| Electronic scale | Sartorius Scientific Instruments (Beijing) Co., Ltd | 3137510295 | |
| Graduated cylinder | Anhui Weiss Experimental Equipment Co. Ltd | ||
| Petri dishes (60 mm diameter) | Qingdao jindian biochemical equipment co., LTD | ||
| Pollen provision | Yantai Bifeng Agricultural Science and Technology Co. Ltd | ||
| Soft brush | Wengang Wenhai painting material factory | ||
| Solitary bees | Yantai Bifeng Agricultural Science and Technology Co. Ltd |
Références
- Sgolastra, F., Tosi, S., Medrzycki, P., Porrini, C., Burgio, G. Toxicity of spirotetramat on solitary bee larvae, Osmia cornuta (hymenoptera: megachilidae), in laboratory conditions. Journal of Apicultural Science. 59 (2), 73-83 (2015).
- Wei, S. G., Wang, R., Smirle, M. J., Xu, H. L. Release of Osmia excavata and Osmia jacoti (Hymenoptera: Megachilidae) for apple pollination. TheCanadian Entomologist. 134 (3), 369-380 (2002).
- Men, X. Y., et al. Biological characteristics and pollination service of Mason bee. Chinese Journal of Applied Entomology. 55 (6), 973-983 (2018).
- Bosch, J., Kemp, W. P., Trostle, G. E. Bee population returns and cherry yields in an orchard pollinated with Osmia lignaria (Hymenoptera: Megachilidae). Journal of Economic Entomology. 99 (2), 408-413 (2006).
- Winfree, R., Williams, N. M., Dushoff, J., Kremen, C. Native bees provide insurance against ongoing honey bee losses. Ecology Letters. 10 (11), 1105-1113 (2007).
- Garibaldi, L. A., Steffan-Dewenter, I., Winfree, R. Wild pollinators enhance fruit set of crops regardless of honey bee abundance. Science. 339 (6127), 1608-1611 (2013).
- Bosch, J., Sgolastra, F., Kemp, W. P. Life cycle ecophysiology of Osmia. mason bees used as crop pollinators. Bee Pollination in Agricultural Ecosystems. James, R. R., Pitts-Singer, T. L. , Oxford University Press. Oxford, UK. 83-104 (2008).
- Liu, L., et al. Population investigation and restriction factors analyses of Osmia excavata Alfken in Jiaodong. Apiculture of China. 69 (9), 68-71 (2018).
- Biesmeijer, J. C., Roberts, S. P. M., Reemer, M. Parallel declines in pollinators and insect-pollinated plants in Britain and the Netherlands. Science. 313 (5785), 351-354 (2006).
- Potts, S. G., Biesmeijer, J. C., Kremen, C. Global pollinator declines: trends, impacts and drivers. Trends in Ecology & Evolution. 25 (6), 345-353 (2010).
- Chen, L., Yan, Q., Zhang, J., Yuan, S., Liu, X. Joint toxicity of acetamiprid and co-applied pesticide adjuvants on honeybees under semi-field and laboratory conditions. Environmental Toxicology and Chemistry. 38 (9), 1940-1946 (2019).
- Sgolastra, F., Medrzycki, P., Bortolotti, L., Renzi, M. T., Bosch, J. Synergistic mortality between a neonicotinoid insecticide and an ergosterol-biosynthesis-inhibiting fungicide in three bee species. Pest Management Science. 73 (6), 1236-1243 (2017).
- Bireley, R., et al. Preface: Workshop on pesticide exposure assessment paradigm for non-Apis bees. Environmental Entomology. 48 (1), 1-3 (2019).
- European Food Safety Authority. EFSA Guidance Document on the risk assessment of plant protection products on bees (Apis mellifera, Bombus spp. and solitary bees). EFSA Journal. 11 (7), 3295(2013).
- Rundlof, M., et al. Seed coating with a neonicotinoid insecticide negatively affects wild bees. Nature. 521 (7550), 77-80 (2015).
- Yuan, R., et al. Toxicity and hazard assessment of six neonicotinoid insecticides on Osmia excavata (hymenoptera:megachilidae). Acta Entomologica Sinica. 61 (8), 950-956 (2018).
- Lin, Z., Meng, F., Zheng, H., Zhou, T., Hu, F. Effects of neonicotinoid insecticides on honeybee health. Acta Entomologica Sinica. 57 (5), 607-615 (2014).
- Gradish, A. E., Scott-Dupree, C. D., Cutler, G. C. Susceptibility of Megachile rotundata to insecticides used in wild blueberry production in Atlantic Canada. Journal of Pest Science. 85, 133-140 (2012).
- Hodgson, E. W., Pitts-Singer, T. L., Barbour, J. D. Effects of the insect growth regulator, novaluron on immature alfalfa leafcutting bees, Megachile rotundata. Journal of Insect Science. 11, 43(2011).
- Konrad, R., Ferry, N., Gatehouse, A. M. R., Babendreier, D. Potential effects of oilseed rape expressing oryzacystatin-1 (OC-1) and of purified insecticidal proteins on larvae of the solitary bee Osmia bicornis. PLoS ONE. 3 (7), 2664(2008).
- Abbott, V. A., Nadeau, J. L., Higo, H. A., Winston, M. L. Lethal and sublethal effects of imidacloprid on Osmia lignaria and clothianidin on Megachile rotundata (Hymenoptera: megachilidae). Journal of Economic Entomology. 101, 784-796 (2008).
- Yan, Z., Wang, Z. Sublethal effect of abamectin on 3rd instar larvae of Prodenia litura. Chinese Journal of Tropical Crops. 32 (10), 1945-1950 (2011).
- Song, Y., et al. Comparative ecotoxicity of insecticides with different modes of action to Osmia excavata (Hymenoptera: Megachilidae). Ecotoxicology and Environmental Safety. 212 (5), 112015(2021).
- Chen, F. J., Wu, G., Ge, F., Parajulee, M. N., Shrestha, R. B. Effects of elevated CO2 and transgenic Bt cotton on plant chemistry, performance, and feeding of an insect herbivore, the cotton bollworm. Entomologia Experimentalis Et Applicata. 115 (2), 341-350 (2005).
- Cang, T., et al. Toxicity and safety evaluation of pesticides commonly used in strawberry production to bees. Zhejiang Agricultural Sciences. (4), 785-787 (2009).
- Cang, T., et al. Acute toxicity and safety assessment of chiral fipronil against Apis mellifera and Trichogramma ostriniae. Ecotoxicology. 7 (3), 326-330 (2012).
- Liu, X., Pan, W. Measures to ensure pollination effect and cocoon recovery rate of Osmia excavata in apple orchard. Northwest Horticulture. (3), 20-21 (2017).
- Meikle, W. G., Adamczyk, J. J., Weiss, M., Ross, J., Beren, E. Sublethal concentrations of clothianidin affect honey bee colony growth and hive CO2 concentration. Scientific Reports. 11 (1), 4364(2021).
- Meikle, W. G., Adamczyk, J. J., Weiss, M., Ross, J., Beren, E. Sublethal concentrations of clothianidin affect honey bee colony behavior and interact with landscapes to affect colony growth. BioRxiv. , (2020).
- Wang, Y. F., et al. Combination effects of three neonicotinoid pesticides on physiology and survival of honey bees (Apis mellifera L). Journal of Environmental Entomology. 41 (3), 612-618 (2019).
- Kopit, A. M., Pitts-Singer, T. L. Routes of pesticide exposure in solitary, cavity-nesting bees. Environmental Entomology. 47 (3), 499-510 (2018).
- Cheng, Y., et al. Chronic oral toxicity of chlorpyrifos and imidacloprid to adult honey bees (Apis mellifera L). Asian Journal of Ecotoxicology. 11 (2), 715-719 (2016).
- Li, M., Ma, C., Xiao, L., Li, Z., Su, S. Effects of chlorpyrifos on behavior response of Apis mellifera and Apis cerana. Apicultural Science Association of China. , (2016).
- Cresswell, J. E. A meta-analysis of experiments testing the effects of a neonicotinoid insecticide (imidacloprid) on honey bees. Ecotoxicology. 20 (1), 149-157 (2011).
- Nauen, R., Ebbinghaus-Kintscher, U., Schmuck, R. Toxicity and nicotinic acetylcholine receptor interaction of imidacloprid and its metabolites in Apis mellifera (Hymenoptera; Apidae). Pest Management Science. 57 (7), 577-586 (2001).
- Colin, M. E., et al. A method to quantify and analyze the foraging activity of honey bees: relevance to the sublethal effects induced by systemic insecticides. Archives of Environmental Contamination and Toxicology. 47 (3), 387-395 (2004).
- Decourtye, A., et al. Comparative sublethal toxicity of nine pesticides on olfactory learning performances of the honeybee Apis mellifera. Archives of Environmental Contamination & Toxicology. 48 (2), 242-250 (2005).
- Williamson, S. M., Wright, G. A. Exposure to multiple cholinergic pesticides impairs olfactory learning and memory in honeybees. Journal of Experimental Biology. 216 (10), 1799-1807 (2013).
- Henry, M., et al. A common pesticide decreases foraging success and survival in honey bees. Science. 336 (6079), 348-350 (2012).
- Matsumoto, T. Reduction in homing flights in the honey bee Apis mellifera after a sublethal dose of neonicotinoid insecticides. Bulletin of Insectology. 66 (1), 1-9 (2013).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon