Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Bewertung der Wirkung von Pestiziden auf die Larven der Solitärbienen
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll erläutert eine Methode zur Verfütterung von mit Pestiziden kontaminierten Vorräten an die Larven der Solitärbienen, Osmia excavata. Das Verfahren untersucht die Ökotoxizität des Pestizids für die Larven der Solitärbienen.
Zusammenfassung
Aktuelle ökologische Risikobewertungen von Pestiziden an Bestäubern haben in erster Linie nur Laborbedingungen berücksichtigt. Für die Larven von Solitärbienen kann die Aufnahme von mit Pestiziden kontaminierten Vorräten die Sterblichkeitsrate der Larven erhöhen, die Sammelrate und die Population erwachsener Solitärbienen im nächsten Jahr aus demografischer Sicht verringern. Aber es gibt begrenzte Studien über die Auswirkungen von Pestiziden auf die Larven von Solitärbienen. Daher sollte das Verständnis, wie Pestizide die Larven von Einzelbienen beeinflussen, als integraler Bestandteil der ökologischen Risikobewertung von Pestiziden betrachtet werden. Diese Studie präsentiert eine Methode, um die Larven der Solitärbiene, Osmia excavata , tödlichen oder subletalen Dosen von Pestiziden auszusetzen, wobei die Gewichtszunahme der Larven, die Entwicklungsdauer, die Eklosionsfähigkeit und die Umwandlung der Lebensmittelverbrauchseffizienz der aufgenommenen Nahrung verfolgt werden. Um die Wirksamkeit dieser Methode zu demonstrieren, wurden die Larven von O. excavata mit Proviant gefüttert, die akute tödliche und subletale Dosen von Chlorpyrifos enthielt. Dann wurden die obigen Indizes der behandelten Larven untersucht. Diese Technik hilft, das Risiko von Pestiziden für Bestäuber vorherzusagen und zu mindern.
Einleitung
Bestäuber spielen eine entscheidende Rolle in den Ökosystemleistungen der modernen globalen Landwirtschaft. Während Honigbienen (Apis mellifera; Hymenoptera: Apidae) wurden traditionell als die wesentlichen wirtschaftlichen Bestäuber von Nutzpflanzen angesehen, neuere Forschungen deuten darauf hin, dass Osmia (Hymenoptera: Megachilidae) auch sehr wichtig ist, um die Bestäubung für bestimmte Kulturen zu verbessern, die Fruchtgröße und die Anzahl der Samen zu erhöhen und den Anteil asymmetrischer Früchte in kommerziellen Obstgärten in verschiedenen Teilen der Welt zu verringern1. Osmia excavata gilt als ideale Art für die Apfelbestäubung, hauptsächlich in Asien, wie in Nord- und Nordwestchina und Japan 2,3,4. Es kann Bestäubungsdienste für bestimmte Kulturen mit ähnlicher oder manchmal mit größerer Effizienz erbringen. In dieser Hinsicht haben sie gezeigt, dass sie die Honigbienen ersetzen oder in Synergie mit ihnen arbeiten 4,5,6.
Die biologischen Eigenschaften von O. excavata sind einzigartig im Vergleich zu sozialen Bienen. Seine univoltine, solitäre und nistende Aktivität tritt hauptsächlich im Frühjahr und Frühsommer auf. Die Nester von O. excavata befinden sich normalerweise in bereits bestehenden Löchern, typischerweise in Totholz, Hohlpflanzen, Strohröhren und Bambusstängeln im natürlichen Zustand3. Der erwachsene O. excavata taucht aus seinem Kokon auf, um sich zu paaren, Pollen zu sammeln und ein Nest zu bauen, um Eier zu legen, die eine Woche später zu schlüpfen beginnen. Die befruchteten Eier entwickeln sich zu Weibchen, während sich die unbefruchteten Eier zu Männchenentwickeln 3. Weibchen sind im Boden des Bienenrohrs verteilt, und die entsprechenden Vorräte sind bedeutender. Im Gegensatz dazu befanden sich die Männchen in der Nähe des Röhrenausgangs mit geringfügigen Proviant7, so dass die Männchen zuerst herauskommen und die Weibchen später herauskommen. Das Weibchen mischt Pollen mit einer kleinen Menge Nektar zu einem feuchten Klecks, der einzigen Nahrungsquelle für jede Larve in derZelle 8.
Mehrere Studien haben über einen Rückgang der Population von bestäubenden Insektenberichtet 9,10. Der extensive Einsatz von Pestiziden wurde als einer der Hauptfaktoren für die Verringerung der Häufigkeit und Vielfalt von Bestäubern identifiziert und kann auch die Bestäubungsdienste gefährden11,12. Um die nachteiligen Auswirkungen von Pestiziden zu reduzieren und zu mildern, ist es notwendig, eine Pestizid-Risikobewertung für Bestäuber durchzuführen. Einige Länder haben regulatorische Rahmenbedingungen geschaffen, um die Sicherheit der Bienen vor den verwendeten Pestiziden zu gewährleisten13,14. Jüngste Studien haben gezeigt, dass Osmia anfälliger für Pestizide war als Honigbienen 1,15.
Interessanterweise konzentrierten sich die meisten Risikobewertungen auf erwachsene Honigbienen11,12; An O. excavata, insbesondere den Larven, wurde wenig geforscht. Darüber hinaus wird die Mortalität von Osmia, die direkt durch Pestizide verursacht wird, am häufigsten als16 angesehen. Dennoch können die chronischen Toxizitäten wie Larvengewichtszunahme, Entwicklungsdauer, Fütterungsmuster, Eklosionsfähigkeit, nachfolgendes Verhalten von Erwachsenen und Fruchtbarkeit den gleichen Schaden anrichten wie die akuten tödlichen Toxizitäten und werden oft ignoriert, da es keine wirksame experimentelle Methode für die Einzelbienengibt 17.
Bisher werden zwei Methoden verwendet, um die Auswirkungen von Pestiziden auf die Larven von Solitärbienen zu bewerten: (1) eine angemessene Menge an Pestiziden wurde an der lokalisierten Stelle der Proviant ausgebracht, ohne das Ei von Solitärbienen zu entfernen 1,18,19,20; (2) Ersetzung der Bestimmungen durch künstliche Pollen-Nektar-Gemische, die eine bestimmte Menge an Schädlingsbekämpfungsmittelnenthalten 21. Es gibt jedoch einige Einschränkungen für die beiden oben genannten Methoden. Ersteres kann nur die akute Toxizität messen, nicht aber die chronische Toxizität, da die Larven die gesamte Dosis in kurzer Zeit aufgenommen haben; Letzteres würde aufgrund menschlicher Manipulation zu einer hohen Sterblichkeitsrateführen 1. Hier wurde die Immersionsmethode beschrieben, um die Ökotoxizität von Pestiziden für O. excavata unter streng kontrollierten Forschungsbedingungen zu untersuchen, indem das Verhalten von Larven, die sich von Restpestiziden ernähren, in den Vorräten in der realen Umgebung simuliert wurde. Die Methode dieser Studie löst die Nachteile der beiden oben genannten Methoden und eignet sich zur Messung der Auswirkungen eines gefährlichen Stoffes auf die akute und chronische Toxizität.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Vorbereitung der Ernährungssonde
- Stanzen Sie ein Loch (~0,3 mm Durchmesser) mit einem elektrischen Wickeleisen in den Deckel eines 2-ml-Zentrifugenrohrs (siehe Materialtabelle). Verwenden Sie ein solches Zentrifugenröhrchen, um eine O. excavata-Larve und ihre Versorgungsmasse zu erhalten.
2. Herstellung von Pestiziden
- Lösen Sie das technische Pestizid (siehe Materialtabelle) in Aceton auf, um Stammlösungen von 1 x 104 μg a.i. mL-1 zu erhalten. Führen Sie dann Gradientenverdünnungen der Lösung auf mehr als fünf Konzentrationen durch.
HINWEIS: In dieser Studie wurden Chlorpyrifos bei 0,1, 0,2, 0,4, 0,8, 1,6, 3,2, 6,4 μg a.i. mL-1 verwendet.
3. Vorbereitung der Bestimmungen
- Erwerben Sie Plastikbienenröhren mit Vorräten (siehe Materialtabelle) und neu geschlüpfte Larven von O. excavata aus einem Massenaufzuchtprogramm.
HINWEIS: Von 20 Tagen vor der Blüte bis zur gesamten Blütezeit wurden keine Pestizide verwendet; Die Ergebnisse der chemischen Analyse zeigten, dass die üblicherweise verwendeten Pestizidgehalte in zufällig ausgewählten fünfzig Bestimmungen beide unter den Mindesttestwerten lagen. - Trennen Sie Proviant und Larven sanft mit einer weichen Bürste. Wählen Sie weibliche Larven basierend auf der Bereitstellungsgröße und der Zellposition innerhalb des Nestes9. Legen Sie dann einheitlich große Vorräte und ausgewählte weibliche Larven in Petrischalen (60 mm Durchmesser) und legen Sie sie zur Verwendung beiseite.
HINWEIS: Fünfzig Bestimmungen wurden nach dem Zufallsprinzip ausgewählt, um den Gehalt an häufig verwendeten Pestiziden zu analysieren: Chlorpyrifos, Imidacloprid, Fendifenuron, Phoxim, Avermectin. Die weichen Bürstenparameter sind (a) Durchmesser der Bürste: 0,3 mm, (b) Länge der Bürste: 2 cm, (c) Länge des Stiftes: 18 cm.
4. Behandlung mit Pestiziden
- Die ausgewählten gleichmäßig dimensionierten Vorräte (aus Schritt 3.2) werden in verdünnten Pestiziden (aus Schritt 2.1; Chlorpyrifos bei 0,1, 0,2, 0,4, 0,8, 1,6, 3,2, 6,4 μg a.i. mL-1) für 10 s mit einem Käfig eingeweicht. Den Kontrollcheck (CK) in 0,2% Lösungsmittel (Aceton in dieser Studie) einweichen.
HINWEIS: Es gibt drei Replikate pro Konzentrationsbehandlung, und jede Replikation bestand aus 60 Bestimmungen. Der Dosisunterschied jeder Bestimmung kann durch die Auswahl gleichmäßig großer Bestimmungen reduziert werden. - Messen Sie das Volumen der Pestizidlösung vor und nach der Behandlung der Vorräte mit dem Pestizid. Berechnen Sie dann das eingetauchte Volumen des Insektizids in jeder Behandlung, einschließlich 60 Massenbestimmungen (Ergänzende Tabelle 1). Legen Sie die Vorräte nach der Lufttrocknung in separate Zentrifugalröhrchen mit Löchern (ab Schritt 1.1) auf einen sterilen Arbeitstisch.
HINWEIS: Legen Sie vor dem Experiment die Käfige mit den Vorräten in die Pestizidlösung und messen Sie dann das Volumen der Pestizidlösung vor und nach dem Einweichen, um den Fehler zu beseitigen. - Weibliche Larven einzeln mit einer weichen Bürste auf die Oberfläche von natürlich getrockneten Proviant übertragen.
HINWEIS: Eine Larve in einer Röhre.
5. Wachstumsbedingungen
- Züchten Sie die Larven von O. excavata in einer Wachstumskammer im Dunkeln, 65%-75% relative Luftfeuchtigkeit und 25 ± 2 °C16.
6. Prüfung der Ergebnisse
- Der akute tödliche Toxizitätstest
- Messen Sie die Mortalität der Larven, nachdem sie 48 h lang auf die behandelten und die Kontrollbestimmungen (CK) aufgebracht wurden.
HINWEIS: Die Todeskriterien: wenn die Larven nicht auf milde Berührung mit einer weichen Bürste unter Schwarzlichtlampen reagierten22. Schwarzlichtlampen wurden verwendet, um die dunklen Wachstumsbedingungen von Larven zu simulieren und den Einfluss von Licht auf die Larven bei der Überprüfung von Wachstumsindikatoren zu vermeiden. Um menschliches Versagen zu eliminieren, wurden auch die Mortalitäten mit und ohne Entfernung von Larven aus den Vorräten nach 48 h in Kontrollgruppen gemessen. - Wiegen Sie 60 Proviant vor und nach 48 h Insektenaufzuchtversuchen, um die Menge an Vorrat zu bestimmen, die von jeder Larve verbraucht wird.
- Berechnen Sie die Pestiziddosis bei jeder Konzentration, die von jeder Larve verbraucht wird, entsprechend dem Prozentsatz der aufgenommenen Vorräte und dem Pestizidgehalt in jeder Proviant.
HINWEIS: Die Gleichung für die Dosisberechnung lautet23: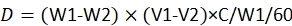
wobei D die verbrauchte Dosis von Pestiziden durch jede Larve ist; W1 ist das Gewicht von 60 Proviant vor der Infusion von Pestiziden; W2 ist das Restgewicht von 60 Proviant nach 48 h; V1 ist das Volumen des Pestizids vor dem Eintauchen für 60 Bestimmungen; V2 ist das Volumen des Pestizids nach dem Eintauchen für 60 Proviant; C ist die Konzentration des Pestizids.
- Messen Sie die Mortalität der Larven, nachdem sie 48 h lang auf die behandelten und die Kontrollbestimmungen (CK) aufgebracht wurden.
- Der Test der subletalen Toxizität
- Wiegen Sie die Larven vor der Aufzucht und nach 14 Tagen der Behandlung, um die Larvengewichtszunahme zu bestimmen.
- Beobachten Sie O. excavata täglich während des Cocoonings unter Schwarzlichtlampen, um die Dauer der Larvenentwicklung zu messen.
- Wiegen Sie die verbleibenden Teile der Vorräte nach 14 Tagen Fütterung auf behandelten und CK-Bestimmungen, um den Verbrauch und die Effizienz der Umwandlung von aufgenommenen Lebensmitteln (EBI) zu berechnen24.
- Untersuchen Sie die Anzahl der Eklosionen, indem Sie die Kokons mit einer kleinen Schere abschneiden, wenn die Kontrollbienen zu Erwachsenen werden.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Die Gehalte an häufig verwendeten Pestiziden, Chlorpyrifos, Imidacloprid, Fendifenuron, Phoxim, Avermectin in den Bestimmungen lagen in der Kontrollgruppe unter der Bestimmungsgrenze (0,01-0,02 mg kg-1); Diese Ergebnisse schlossen den Einfluss von Pestizidrückständen auf jede Behandlung aus. Die Mortalität mit und ohne Entfernung von Larven aus der Versorgung nach 48 h in Kontrollgruppen wurde bewertet; Die Ergebnisse zeigten keine signifikanten Unterschiede (Tabelle 1), was auf ein gering...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Für erwachsene Bestäuber gibt es zwei Hauptmethoden zur Messung der Ökotoxizität von Pestiziden. Eine ist die Kontaktmethode, bei der das Pestizid auf den Prothorax der erwachsenen Insekten aufgetragen wird; Die andere ist die Magentoxizitätsmethode, bei der die erwachsenen Bestäuber mit dem Pestizid25,26 enthaltendem Honigwasser gefüttert werden. In den letzten Jahren wurde festgestellt, dass der Bestäubungseffekt und die Eklosionsrate von O. excavat...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben keine Interessenkonflikte zu erklären.
Danksagungen
Diese Studie wurde vom National Key R&D Program of China (2017YFD0200400), dem Major Scientific and Technological Innovation Project (2017CXGC0214), dem Bee Industry Innovation Team der Provinz Shandong, dem Agricultural Science and Technology Innovation Project der Shandong Academy of Agricultural Sciences (CXGC2019G01) und dem Agricultural Science and Technology Innovation Project der Shandong Academy of Agricultural Sciences (CXGC2021B13) unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Abamectin | Jinan Lvba Pesticide Co. Ltd | ||
| Black-light lamps | Kanghua Medical Device Co., Ltd | ||
| Centrifugal tube box with 100 Wells | Shanghai Rebus Network Technology Co., Ltd | ||
| Centrifuge tube | Shanghai Rebus Network Technology Co., Ltd | 2 mL; Serve as bee tube | |
| Electric soldering iron | Kunshan Kaipai Hardware Electromechanical Co., Ltd | ||
| Electronic scale | Sartorius Scientific Instruments (Beijing) Co., Ltd | 3137510295 | |
| Graduated cylinder | Anhui Weiss Experimental Equipment Co. Ltd | ||
| Petri dishes (60 mm diameter) | Qingdao jindian biochemical equipment co., LTD | ||
| Pollen provision | Yantai Bifeng Agricultural Science and Technology Co. Ltd | ||
| Soft brush | Wengang Wenhai painting material factory | ||
| Solitary bees | Yantai Bifeng Agricultural Science and Technology Co. Ltd |
Referenzen
- Sgolastra, F., Tosi, S., Medrzycki, P., Porrini, C., Burgio, G. Toxicity of spirotetramat on solitary bee larvae, Osmia cornuta (hymenoptera: megachilidae), in laboratory conditions. Journal of Apicultural Science. 59 (2), 73-83 (2015).
- Wei, S. G., Wang, R., Smirle, M. J., Xu, H. L. Release of Osmia excavata and Osmia jacoti (Hymenoptera: Megachilidae) for apple pollination. TheCanadian Entomologist. 134 (3), 369-380 (2002).
- Men, X. Y., et al. Biological characteristics and pollination service of Mason bee. Chinese Journal of Applied Entomology. 55 (6), 973-983 (2018).
- Bosch, J., Kemp, W. P., Trostle, G. E. Bee population returns and cherry yields in an orchard pollinated with Osmia lignaria (Hymenoptera: Megachilidae). Journal of Economic Entomology. 99 (2), 408-413 (2006).
- Winfree, R., Williams, N. M., Dushoff, J., Kremen, C. Native bees provide insurance against ongoing honey bee losses. Ecology Letters. 10 (11), 1105-1113 (2007).
- Garibaldi, L. A., Steffan-Dewenter, I., Winfree, R. Wild pollinators enhance fruit set of crops regardless of honey bee abundance. Science. 339 (6127), 1608-1611 (2013).
- Bosch, J., Sgolastra, F., Kemp, W. P. Life cycle ecophysiology of Osmia. mason bees used as crop pollinators. Bee Pollination in Agricultural Ecosystems. James, R. R., Pitts-Singer, T. L. , Oxford University Press. Oxford, UK. 83-104 (2008).
- Liu, L., et al. Population investigation and restriction factors analyses of Osmia excavata Alfken in Jiaodong. Apiculture of China. 69 (9), 68-71 (2018).
- Biesmeijer, J. C., Roberts, S. P. M., Reemer, M. Parallel declines in pollinators and insect-pollinated plants in Britain and the Netherlands. Science. 313 (5785), 351-354 (2006).
- Potts, S. G., Biesmeijer, J. C., Kremen, C. Global pollinator declines: trends, impacts and drivers. Trends in Ecology & Evolution. 25 (6), 345-353 (2010).
- Chen, L., Yan, Q., Zhang, J., Yuan, S., Liu, X. Joint toxicity of acetamiprid and co-applied pesticide adjuvants on honeybees under semi-field and laboratory conditions. Environmental Toxicology and Chemistry. 38 (9), 1940-1946 (2019).
- Sgolastra, F., Medrzycki, P., Bortolotti, L., Renzi, M. T., Bosch, J. Synergistic mortality between a neonicotinoid insecticide and an ergosterol-biosynthesis-inhibiting fungicide in three bee species. Pest Management Science. 73 (6), 1236-1243 (2017).
- Bireley, R., et al. Preface: Workshop on pesticide exposure assessment paradigm for non-Apis bees. Environmental Entomology. 48 (1), 1-3 (2019).
- European Food Safety Authority. EFSA Guidance Document on the risk assessment of plant protection products on bees (Apis mellifera, Bombus spp. and solitary bees). EFSA Journal. 11 (7), 3295(2013).
- Rundlof, M., et al. Seed coating with a neonicotinoid insecticide negatively affects wild bees. Nature. 521 (7550), 77-80 (2015).
- Yuan, R., et al. Toxicity and hazard assessment of six neonicotinoid insecticides on Osmia excavata (hymenoptera:megachilidae). Acta Entomologica Sinica. 61 (8), 950-956 (2018).
- Lin, Z., Meng, F., Zheng, H., Zhou, T., Hu, F. Effects of neonicotinoid insecticides on honeybee health. Acta Entomologica Sinica. 57 (5), 607-615 (2014).
- Gradish, A. E., Scott-Dupree, C. D., Cutler, G. C. Susceptibility of Megachile rotundata to insecticides used in wild blueberry production in Atlantic Canada. Journal of Pest Science. 85, 133-140 (2012).
- Hodgson, E. W., Pitts-Singer, T. L., Barbour, J. D. Effects of the insect growth regulator, novaluron on immature alfalfa leafcutting bees, Megachile rotundata. Journal of Insect Science. 11, 43(2011).
- Konrad, R., Ferry, N., Gatehouse, A. M. R., Babendreier, D. Potential effects of oilseed rape expressing oryzacystatin-1 (OC-1) and of purified insecticidal proteins on larvae of the solitary bee Osmia bicornis. PLoS ONE. 3 (7), 2664(2008).
- Abbott, V. A., Nadeau, J. L., Higo, H. A., Winston, M. L. Lethal and sublethal effects of imidacloprid on Osmia lignaria and clothianidin on Megachile rotundata (Hymenoptera: megachilidae). Journal of Economic Entomology. 101, 784-796 (2008).
- Yan, Z., Wang, Z. Sublethal effect of abamectin on 3rd instar larvae of Prodenia litura. Chinese Journal of Tropical Crops. 32 (10), 1945-1950 (2011).
- Song, Y., et al. Comparative ecotoxicity of insecticides with different modes of action to Osmia excavata (Hymenoptera: Megachilidae). Ecotoxicology and Environmental Safety. 212 (5), 112015(2021).
- Chen, F. J., Wu, G., Ge, F., Parajulee, M. N., Shrestha, R. B. Effects of elevated CO2 and transgenic Bt cotton on plant chemistry, performance, and feeding of an insect herbivore, the cotton bollworm. Entomologia Experimentalis Et Applicata. 115 (2), 341-350 (2005).
- Cang, T., et al. Toxicity and safety evaluation of pesticides commonly used in strawberry production to bees. Zhejiang Agricultural Sciences. (4), 785-787 (2009).
- Cang, T., et al. Acute toxicity and safety assessment of chiral fipronil against Apis mellifera and Trichogramma ostriniae. Ecotoxicology. 7 (3), 326-330 (2012).
- Liu, X., Pan, W. Measures to ensure pollination effect and cocoon recovery rate of Osmia excavata in apple orchard. Northwest Horticulture. (3), 20-21 (2017).
- Meikle, W. G., Adamczyk, J. J., Weiss, M., Ross, J., Beren, E. Sublethal concentrations of clothianidin affect honey bee colony growth and hive CO2 concentration. Scientific Reports. 11 (1), 4364(2021).
- Meikle, W. G., Adamczyk, J. J., Weiss, M., Ross, J., Beren, E. Sublethal concentrations of clothianidin affect honey bee colony behavior and interact with landscapes to affect colony growth. BioRxiv. , (2020).
- Wang, Y. F., et al. Combination effects of three neonicotinoid pesticides on physiology and survival of honey bees (Apis mellifera L). Journal of Environmental Entomology. 41 (3), 612-618 (2019).
- Kopit, A. M., Pitts-Singer, T. L. Routes of pesticide exposure in solitary, cavity-nesting bees. Environmental Entomology. 47 (3), 499-510 (2018).
- Cheng, Y., et al. Chronic oral toxicity of chlorpyrifos and imidacloprid to adult honey bees (Apis mellifera L). Asian Journal of Ecotoxicology. 11 (2), 715-719 (2016).
- Li, M., Ma, C., Xiao, L., Li, Z., Su, S. Effects of chlorpyrifos on behavior response of Apis mellifera and Apis cerana. Apicultural Science Association of China. , (2016).
- Cresswell, J. E. A meta-analysis of experiments testing the effects of a neonicotinoid insecticide (imidacloprid) on honey bees. Ecotoxicology. 20 (1), 149-157 (2011).
- Nauen, R., Ebbinghaus-Kintscher, U., Schmuck, R. Toxicity and nicotinic acetylcholine receptor interaction of imidacloprid and its metabolites in Apis mellifera (Hymenoptera; Apidae). Pest Management Science. 57 (7), 577-586 (2001).
- Colin, M. E., et al. A method to quantify and analyze the foraging activity of honey bees: relevance to the sublethal effects induced by systemic insecticides. Archives of Environmental Contamination and Toxicology. 47 (3), 387-395 (2004).
- Decourtye, A., et al. Comparative sublethal toxicity of nine pesticides on olfactory learning performances of the honeybee Apis mellifera. Archives of Environmental Contamination & Toxicology. 48 (2), 242-250 (2005).
- Williamson, S. M., Wright, G. A. Exposure to multiple cholinergic pesticides impairs olfactory learning and memory in honeybees. Journal of Experimental Biology. 216 (10), 1799-1807 (2013).
- Henry, M., et al. A common pesticide decreases foraging success and survival in honey bees. Science. 336 (6079), 348-350 (2012).
- Matsumoto, T. Reduction in homing flights in the honey bee Apis mellifera after a sublethal dose of neonicotinoid insecticides. Bulletin of Insectology. 66 (1), 1-9 (2013).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten