Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Pestisitlerin yalnız arıların larvaları üzerindeki etkisinin değerlendirilmesi
Bu Makalede
Özet
Mevcut protokol, pestisitle kirlenmiş hükümleri yalnız arıların larvalarına, Osmia excavata'ya beslemek için bir yöntem açıklamaktadır. Prosedür, pestisitin yalnız arıların larvalarına ekotoksisitesini inceler.
Özet
Pestisitlerin tozlayıcılar üzerindeki mevcut ekolojik risk değerlendirmeleri öncelikle sadece laboratuvar koşullarını dikkate almıştır. Yalnız arıların larvaları için, pestisitlerle kontamine olmuş hükümlerin yutulması, larvaların ölüm oranını artırabilir, gelecek yıl demografik açıdan yetişkin yalnız arıların toplanma oranını ve popülasyonunu azaltabilir. Ancak pestisitlerin yalnız arıların larvaları üzerindeki etkileri hakkında sınırlı çalışmalar vardır. Bu nedenle, pestisitlerin yalnız arıların larvalarını nasıl etkilediğini anlamak, pestisit ekolojik risk değerlendirmesinin ayrılmaz bir parçası olarak düşünülmelidir. Bu çalışma, yalnız arı Osmia ekskavata larvalarını ölümcül veya ölümcül pestisit dozlarına maruz bırakmak, larva kilo alımını, gelişim süresini, eklozyon yeteneğini ve yutulan gıdaların gıda tüketim verimliliği dönüşümünü izlemek için bir yöntem sunmaktadır. Bu yöntemin etkinliğini göstermek için, O. excavata larvaları, akut ölümcül ve sublethal klorpirifos dozlarını içeren hükümlerle beslendi. Daha sonra, tedavi edilen larvaların yukarıdaki indeksleri araştırıldı. Bu teknik, pestisitlerin tozlayıcılara karşı riskini tahmin etmeye ve azaltmaya yardımcı olur.
Giriş
Tozlayıcılar, modern küresel tarımın ekosistem hizmetlerinde kritik bir rol oynamaktadır. Bal arıları (Apis mellifera; Hymenoptera: Apidae) geleneksel olarak mahsullerin temel ekonomik tozlayıcıları olarak kabul edilmiştir, son araştırmalar Osmia'nın (Hymenoptera: Megachilidae) bazı ürünler için tozlaşmayı iyileştirmede, meyve büyüklüğünü ve tohum sayısını arttırmada ve dünyanın farklı bölgelerindeki ticari meyve bahçelerinde asimetrik meyve oranını azaltmada çok önemli olduğunu göstermektedir1. Osmia ekskavata, özellikle Asya'da, kuzey ve kuzeybatı Çin ve Japonya gibi elma tozlaşması için ideal bir tür olarak kabul edilmiştir 2,3,4. Bazı ürünler için benzer veya bazen daha fazla verimlilikle tozlaşma hizmetleri sağlayabilir. Bu bakımdan, bal arılarının 4,5,6 yerine geçtiği veya sinerji içinde çalıştığı gösterilmiştir.
O. ekskavata'nın biyolojik özellikleri, sosyal arılarla karşılaştırıldığında benzersizdir. Univoltin, yalnız ve yuvalama aktivitesi esas olarak ilkbahar ve yaz başlarında gerçekleşir. O. ekskavata'nın yuvaları genellikle önceden var olan deliklerde, tipik olarak ölü odunlarda, içi boş bitkilerde, saman tüplerinde ve bambu sapında doğal durumdabulunur 3. Yetişkin O. ekskavata, kozasından çiftleşmek, polen toplamak ve bir hafta sonra yumurtadan çıkmaya başlayan yumurta bırakmak için bir yuva inşa etmek için ortaya çıkar. Döllenmiş yumurtalar dişilere dönüşürken, döllenmemiş yumurtalar erkeklere dönüşür3. Dişiler arı tüpünün dibine dağıtılır ve ilgili hükümler daha önemlidir. Buna karşılık, erkekler küçük hükümler7 ile tüp çıkışının yakınındaydı, bu yüzden erkekler önce çıkıyor ve dişiler daha sonra çıkıyor. Dişi, polenleri az miktarda nektar ile nemli bir bloğa karıştırır, hücre8'deki her larva için tek besin kaynağıdır.
Birçok çalışma, tozlaşan böceklerin popülasyonunda bir azalma olduğunu bildirmiştir 9,10. Pestisitlerin yaygın kullanımı, tozlayıcı bolluğunu ve çeşitliliğini azaltmanın ana faktörlerinden biri olarak tanımlanmıştır ve ayrıca tozlaşma hizmetlerini de tehlikeye atabilir11,12. Pestisitlerin olumsuz etkilerini azaltmak ve hafifletmek için, tozlayıcılar için bir pestisit risk değerlendirmesi yapmak gerekir. Bazı ülkeler, kullanılan pestisitlerden arıların güvenliğini sağlamak için düzenleyici çerçeveler oluşturmuştur13,14. Son zamanlarda yapılan çalışmalar, Osmia'nın pestisitlere karşı bal arılarından daha duyarlı olduğunu göstermiştir 1,15.
İlginçtir ki, çoğu risk değerlendirmesi yetişkin bal arılarına odaklanmıştır11,12; O. excavata üzerinde, özellikle larvalar üzerinde çok az araştırma yapılmıştır. Ayrıca, doğrudan pestisitlerin neden olduğu Osmia mortalitesi en yaygın olarak16 olarak kabul edilir. Yine de, larva kilo alımı, gelişim süresi, beslenme düzenleri, eklozyon yeteneği, sonraki yetişkin davranışı ve doğurganlık gibi kronik toksisiteler, akut ölümcül toksisitelerle aynı zarara sahip olabilir ve yalnız arılar için etkili bir deneysel yöntemin bulunmaması nedeniyle genellikle göz ardı edilir17.
Şimdiye kadar, pestisitlerin yalnız arıların larvaları üzerindeki etkilerini değerlendirmek için iki yöntem kullanılmıştır: (1) yalnız arıların yumurtasını çıkarmadan lokalize hükümler noktasında uygun miktarda pestisit uygulanmıştır 1,18,19,20; (2) Hükümlerin belirli miktarda pestisit içeren yapay polen-nektar karışımları ile değiştirilmesi21. Bununla birlikte, yukarıdaki iki yöntemde bazı sınırlamalar vardır. İlki sadece akut toksisiteyi ölçebilir, ancak kronik toksisiteyi ölçemez, çünkü larvalar tüm dozu kısa sürede yutarlar; ikincisi, insan manipülasyonu nedeniyle yüksek bir ölüm oranına yol açacaktır1. Burada, pestisitlerin O. ekskavata'ya ekotoksisitesini yüksek kontrollü araştırma koşulları altında incelemek için daldırma yöntemi, gerçek ortamdaki hükümlerde artık pestisit üzerinde larva beslenmesinin davranışını simüle ederek tanımlanmıştır. Bu çalışmanın yöntemi, yukarıdaki iki yöntemin dezavantajlarını çözmekte ve tehlikeli bir maddenin akut ve kronik toksisite üzerindeki etkilerini ölçmek için uygundur.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Besleme tüpünün hazırlanması
- Elektrikli sargı demiri kullanarak 2 mL'lik bir santrifüj tüpünün kapağına bir delik (~0,3 mm çapında) delin (bkz. Bir O. excavata larvasını ve tedarik kütlesini korumak için böyle bir santrifüj tüpü kullanın.
2. Pestisit hazırlanması
- 1 x 104 μg a.i. mL-1'lik stok çözeltileri elde etmek için teknik sınıf pestisiti (bakınız Malzeme Tablosu) asetonda çözün. Daha sonra, çözeltinin gradyan seyreltmelerini beşten fazla konsantrasyona gerçekleştirin.
NOT: Bu çalışmada 0.1, 0.2, 0.4, 0.8, 1.6, 3.2, 6.4 μg a.i. mL-1'de klorpirifos kullanılmıştır.
3. Hükümlerin hazırlanması
- Bir kütle yetiştirme programından erzak içeren plastik arı tüpleri ( Malzeme Tablosuna bakınız) ve yeni yumurtadan çıkmış O. ekskavat larvaları edinin.
NOT: Çiçeklenmeden önceki 20 günden tüm çiçeklenme dönemine kadar hiçbir pestisit kullanılmamıştır; kimyasal analiz sonuçları, rastgele seçilen elli maddede yaygın olarak kullanılan pestisit içeriğinin her ikisinin de minimum test seviyelerinin altında olduğunu göstermiştir. - Yumuşak bir fırça kullanarak hükümleri ve larvaları nazikçe ayırın. Yuva9 içindeki provizyon büyüklüğüne ve hücre konumuna göre dişi larvaları seçin. Daha sonra, Petri kaplarına (60 mm çapında) eşit büyüklükte hükümler ve seçilmiş dişi larvalar yerleştirin ve bunları kullanmak üzere bir kenara koyun.
NOT: Yaygın olarak kullanılan pestisitlerin içeriğini analiz etmek için elli hüküm rastgele seçilmiştir: klorpirifos, imidakloprid, fendifenuron, phoxim, avermectin. Yumuşak fırça parametreleri şunlardır: (a) fırçanın çapı: 0,3 mm, (b) fırçanın uzunluğu: 2 cm, (c) kalemin uzunluğu: 18 cm.
4. Pestisit ile tedavi sağlanması
- Seçilen eşit büyüklükteki hükümleri (adım 3.2'den itibaren) seyreltilmiş pestisitte (adım 2.1'den itibaren; 0.1, 0.2, 0.4, 0.8, 1.6, 3.2, 6.4 μg a.i. mL-1'de klorpirifos) bir kafes kullanarak 10 s bekletin. Kontrol kontrolünü (CK) %0.2 çözücüye (bu çalışmada aseton) batırın.
NOT: Konsantrasyon işlemi başına üç çoğaltma vardır ve her çoğaltma 60 hükümden oluşur. Her bir provizyonun dozaj farkı, eşit büyüklükte provizyonlar seçilerek azaltılabilir. - Pestisit çözeltisinin hacmini, hükümleri pestisit ile işlemeden önce ve sonra ölçün. Daha sonra, 60 kütle hükmü de dahil olmak üzere her tedavide daldırılmış insektisit hacmini hesaplayın (Ek Tablo 1). Hükümleri, steril bir çalışma masasında hava ile kuruduktan sonra delikli (adım 1.1'den itibaren) ayrı santrifüj tüplere yerleştirin.
NOT: Deneyden önce, hükümleri içeren kafesleri pestisit çözeltisine koyun ve daha sonra hatayı ortadan kaldırmak için ıslatmadan önce ve sonra pestisit çözeltisinin hacmini ölçün. - Dişi larvaları yumuşak bir fırça kullanarak doğal olarak kurutulmuş hükümlerin yüzeyine ayrı ayrı aktarın.
NOT: Bir tüpte bir larva.
5. Büyüme koşulları
- O. ekskavata larvalarını karanlıkta bir büyüme odasında,% 65 -% 75 bağıl nemde ve 25 ± 2 ° C16'da destekleyin.
6. Sonuçların incelenmesi
- Akut ölümcül toksisite testi
- Larvaların mortalitesini, tedavi edilen ve kontrol (CK) hükümlerine 48 saat boyunca yerleştirdikten sonra ölçün.
NOT: Ölüm kriterleri: larvalar siyah ışık lambaları altında yumuşak bir fırça kullanarak hafif dokunuşa cevap vermediğinde22. Larvaların karanlık büyüme koşullarını simüle etmek ve büyüme göstergelerini kontrol ederken ışığın larvalar üzerindeki etkisinden kaçınmak için siyah ışık lambaları kullanılmıştır. İnsan hatasını ortadan kaldırmak için, kontrol gruplarında 48 saatten sonra larvaların hükümlerden çıkarılması olan ve alınmayan ölüm oranları da ölçülmüştür. - Her larva tarafından tüketilen erzak miktarını belirlemek için 48 saatlik böcek yetiştirme denemelerinden önce ve sonra 60 erzak tartın.
- Her larva tarafından tüketilen her konsantrasyondaki pestisit dozunu, yenen tedarik yüzdesine ve her provizyondaki pestisit içeriğine göre hesaplayın.
NOT: Doz hesaplama denklemi23'tür: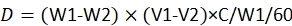
burada, D, her larva tarafından tüketilen pestisit dozudur; W1, pestisit infüzyonundan önce 60 hükmün ağırlığıdır; W2, 48 saatten sonra 60 hükmün kalan ağırlığıdır; V1, 60 hüküm için daldırmadan önce pestisit hacmidir; V2, 60 hüküm için daldırıldıktan sonra pestisit hacmidir; C, pestisitin konsantrasyonudur.
- Larvaların mortalitesini, tedavi edilen ve kontrol (CK) hükümlerine 48 saat boyunca yerleştirdikten sonra ölçün.
- Sublethal toksisite testi
- Larva kilo alımını belirlemek için yetiştirme denemelerinden önce ve 14 günlük tedavilerden sonra larvaları tartın.
- Larva gelişim süresini ölçmek için siyah ışıklı lambalar altında koza sırasında günlük olarak O. ekskavata'yı gözlemleyin.
- Alınan gıdaların (ECI) 24 günlük tüketimini, dönüşüm verimliliğini hesaplamak için işlenmiş ve CK hükümleriyle beslendikten 14 gün sonra hükümlerin kalan kısımlarını tartın.
- Kontrol arıları yetişkinlere girdiğinde kozaları küçük bir makas kullanarak keskin nişancı kullanarak eglosyon sayısını inceleyin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Yaygın olarak kullanılan pestisitlerin, klorpirifosların, imidakloprid, fendifenuron, phoxim, avermektinin içeriği, kontrol grubundaki niceleme sınırından (0.01-0.02 mg kg-1) daha azdı; Bu sonuçlar, pestisit kalıntılarının her bir tedavi üzerindeki etkisini dışlamıştır. Kontrol gruplarında 48 saatten sonra larvaların erzaklardan çıkarılması ve çıkarılması ile ve çıkarılmadan mortalite değerlendirildi; Sonuçlar, küçük bir insan hatasını gösteren anlamlı bir fark göster...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Yetişkin tozlayıcılar için, pestisitlerin ekotoksisitesini ölçmek için iki ana yöntem vardır. Birincisi, pestisitin yetişkin böceklerin prothoraksına uygulandığı temas yöntemidir; diğeri ise yetişkin tozlayıcıların pestisit içeren ballı su ile beslendiği gastrik toksisite yöntemidir25,26. Son yıllarda O. ekskavata'nın tozlaşma etkisinin ve eklozyon oranının nispeten düşük olduğu tespit edilmiştir27
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların beyan edecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Çin Ulusal Anahtar Ar-Ge Programı (2017YFD0200400), Büyük Bilimsel ve Teknolojik İnovasyon Projesi (2017CXGC0214), Shandong Eyaleti Arı Endüstrisi İnovasyon Ekibi, Shandong Tarım Bilimleri Akademisi Tarım Bilimi ve Teknolojisi İnovasyon Projesi (CXGC2019G01) ve Shandong Tarım Bilimleri Akademisi Tarım Bilimi ve Teknolojisi İnovasyon Projesi (CXGC2021B13) tarafından desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Abamectin | Jinan Lvba Pesticide Co. Ltd | ||
| Black-light lamps | Kanghua Medical Device Co., Ltd | ||
| Centrifugal tube box with 100 Wells | Shanghai Rebus Network Technology Co., Ltd | ||
| Centrifuge tube | Shanghai Rebus Network Technology Co., Ltd | 2 mL; Serve as bee tube | |
| Electric soldering iron | Kunshan Kaipai Hardware Electromechanical Co., Ltd | ||
| Electronic scale | Sartorius Scientific Instruments (Beijing) Co., Ltd | 3137510295 | |
| Graduated cylinder | Anhui Weiss Experimental Equipment Co. Ltd | ||
| Petri dishes (60 mm diameter) | Qingdao jindian biochemical equipment co., LTD | ||
| Pollen provision | Yantai Bifeng Agricultural Science and Technology Co. Ltd | ||
| Soft brush | Wengang Wenhai painting material factory | ||
| Solitary bees | Yantai Bifeng Agricultural Science and Technology Co. Ltd |
Referanslar
- Sgolastra, F., Tosi, S., Medrzycki, P., Porrini, C., Burgio, G. Toxicity of spirotetramat on solitary bee larvae, Osmia cornuta (hymenoptera: megachilidae), in laboratory conditions. Journal of Apicultural Science. 59 (2), 73-83 (2015).
- Wei, S. G., Wang, R., Smirle, M. J., Xu, H. L. Release of Osmia excavata and Osmia jacoti (Hymenoptera: Megachilidae) for apple pollination. TheCanadian Entomologist. 134 (3), 369-380 (2002).
- Men, X. Y., et al. Biological characteristics and pollination service of Mason bee. Chinese Journal of Applied Entomology. 55 (6), 973-983 (2018).
- Bosch, J., Kemp, W. P., Trostle, G. E. Bee population returns and cherry yields in an orchard pollinated with Osmia lignaria (Hymenoptera: Megachilidae). Journal of Economic Entomology. 99 (2), 408-413 (2006).
- Winfree, R., Williams, N. M., Dushoff, J., Kremen, C. Native bees provide insurance against ongoing honey bee losses. Ecology Letters. 10 (11), 1105-1113 (2007).
- Garibaldi, L. A., Steffan-Dewenter, I., Winfree, R. Wild pollinators enhance fruit set of crops regardless of honey bee abundance. Science. 339 (6127), 1608-1611 (2013).
- Bosch, J., Sgolastra, F., Kemp, W. P. Life cycle ecophysiology of Osmia. mason bees used as crop pollinators. Bee Pollination in Agricultural Ecosystems. James, R. R., Pitts-Singer, T. L. , Oxford University Press. Oxford, UK. 83-104 (2008).
- Liu, L., et al. Population investigation and restriction factors analyses of Osmia excavata Alfken in Jiaodong. Apiculture of China. 69 (9), 68-71 (2018).
- Biesmeijer, J. C., Roberts, S. P. M., Reemer, M. Parallel declines in pollinators and insect-pollinated plants in Britain and the Netherlands. Science. 313 (5785), 351-354 (2006).
- Potts, S. G., Biesmeijer, J. C., Kremen, C. Global pollinator declines: trends, impacts and drivers. Trends in Ecology & Evolution. 25 (6), 345-353 (2010).
- Chen, L., Yan, Q., Zhang, J., Yuan, S., Liu, X. Joint toxicity of acetamiprid and co-applied pesticide adjuvants on honeybees under semi-field and laboratory conditions. Environmental Toxicology and Chemistry. 38 (9), 1940-1946 (2019).
- Sgolastra, F., Medrzycki, P., Bortolotti, L., Renzi, M. T., Bosch, J. Synergistic mortality between a neonicotinoid insecticide and an ergosterol-biosynthesis-inhibiting fungicide in three bee species. Pest Management Science. 73 (6), 1236-1243 (2017).
- Bireley, R., et al. Preface: Workshop on pesticide exposure assessment paradigm for non-Apis bees. Environmental Entomology. 48 (1), 1-3 (2019).
- European Food Safety Authority. EFSA Guidance Document on the risk assessment of plant protection products on bees (Apis mellifera, Bombus spp. and solitary bees). EFSA Journal. 11 (7), 3295(2013).
- Rundlof, M., et al. Seed coating with a neonicotinoid insecticide negatively affects wild bees. Nature. 521 (7550), 77-80 (2015).
- Yuan, R., et al. Toxicity and hazard assessment of six neonicotinoid insecticides on Osmia excavata (hymenoptera:megachilidae). Acta Entomologica Sinica. 61 (8), 950-956 (2018).
- Lin, Z., Meng, F., Zheng, H., Zhou, T., Hu, F. Effects of neonicotinoid insecticides on honeybee health. Acta Entomologica Sinica. 57 (5), 607-615 (2014).
- Gradish, A. E., Scott-Dupree, C. D., Cutler, G. C. Susceptibility of Megachile rotundata to insecticides used in wild blueberry production in Atlantic Canada. Journal of Pest Science. 85, 133-140 (2012).
- Hodgson, E. W., Pitts-Singer, T. L., Barbour, J. D. Effects of the insect growth regulator, novaluron on immature alfalfa leafcutting bees, Megachile rotundata. Journal of Insect Science. 11, 43(2011).
- Konrad, R., Ferry, N., Gatehouse, A. M. R., Babendreier, D. Potential effects of oilseed rape expressing oryzacystatin-1 (OC-1) and of purified insecticidal proteins on larvae of the solitary bee Osmia bicornis. PLoS ONE. 3 (7), 2664(2008).
- Abbott, V. A., Nadeau, J. L., Higo, H. A., Winston, M. L. Lethal and sublethal effects of imidacloprid on Osmia lignaria and clothianidin on Megachile rotundata (Hymenoptera: megachilidae). Journal of Economic Entomology. 101, 784-796 (2008).
- Yan, Z., Wang, Z. Sublethal effect of abamectin on 3rd instar larvae of Prodenia litura. Chinese Journal of Tropical Crops. 32 (10), 1945-1950 (2011).
- Song, Y., et al. Comparative ecotoxicity of insecticides with different modes of action to Osmia excavata (Hymenoptera: Megachilidae). Ecotoxicology and Environmental Safety. 212 (5), 112015(2021).
- Chen, F. J., Wu, G., Ge, F., Parajulee, M. N., Shrestha, R. B. Effects of elevated CO2 and transgenic Bt cotton on plant chemistry, performance, and feeding of an insect herbivore, the cotton bollworm. Entomologia Experimentalis Et Applicata. 115 (2), 341-350 (2005).
- Cang, T., et al. Toxicity and safety evaluation of pesticides commonly used in strawberry production to bees. Zhejiang Agricultural Sciences. (4), 785-787 (2009).
- Cang, T., et al. Acute toxicity and safety assessment of chiral fipronil against Apis mellifera and Trichogramma ostriniae. Ecotoxicology. 7 (3), 326-330 (2012).
- Liu, X., Pan, W. Measures to ensure pollination effect and cocoon recovery rate of Osmia excavata in apple orchard. Northwest Horticulture. (3), 20-21 (2017).
- Meikle, W. G., Adamczyk, J. J., Weiss, M., Ross, J., Beren, E. Sublethal concentrations of clothianidin affect honey bee colony growth and hive CO2 concentration. Scientific Reports. 11 (1), 4364(2021).
- Meikle, W. G., Adamczyk, J. J., Weiss, M., Ross, J., Beren, E. Sublethal concentrations of clothianidin affect honey bee colony behavior and interact with landscapes to affect colony growth. BioRxiv. , (2020).
- Wang, Y. F., et al. Combination effects of three neonicotinoid pesticides on physiology and survival of honey bees (Apis mellifera L). Journal of Environmental Entomology. 41 (3), 612-618 (2019).
- Kopit, A. M., Pitts-Singer, T. L. Routes of pesticide exposure in solitary, cavity-nesting bees. Environmental Entomology. 47 (3), 499-510 (2018).
- Cheng, Y., et al. Chronic oral toxicity of chlorpyrifos and imidacloprid to adult honey bees (Apis mellifera L). Asian Journal of Ecotoxicology. 11 (2), 715-719 (2016).
- Li, M., Ma, C., Xiao, L., Li, Z., Su, S. Effects of chlorpyrifos on behavior response of Apis mellifera and Apis cerana. Apicultural Science Association of China. , (2016).
- Cresswell, J. E. A meta-analysis of experiments testing the effects of a neonicotinoid insecticide (imidacloprid) on honey bees. Ecotoxicology. 20 (1), 149-157 (2011).
- Nauen, R., Ebbinghaus-Kintscher, U., Schmuck, R. Toxicity and nicotinic acetylcholine receptor interaction of imidacloprid and its metabolites in Apis mellifera (Hymenoptera; Apidae). Pest Management Science. 57 (7), 577-586 (2001).
- Colin, M. E., et al. A method to quantify and analyze the foraging activity of honey bees: relevance to the sublethal effects induced by systemic insecticides. Archives of Environmental Contamination and Toxicology. 47 (3), 387-395 (2004).
- Decourtye, A., et al. Comparative sublethal toxicity of nine pesticides on olfactory learning performances of the honeybee Apis mellifera. Archives of Environmental Contamination & Toxicology. 48 (2), 242-250 (2005).
- Williamson, S. M., Wright, G. A. Exposure to multiple cholinergic pesticides impairs olfactory learning and memory in honeybees. Journal of Experimental Biology. 216 (10), 1799-1807 (2013).
- Henry, M., et al. A common pesticide decreases foraging success and survival in honey bees. Science. 336 (6079), 348-350 (2012).
- Matsumoto, T. Reduction in homing flights in the honey bee Apis mellifera after a sublethal dose of neonicotinoid insecticides. Bulletin of Insectology. 66 (1), 1-9 (2013).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır