Method Article
腫瘍マクロ解剖による腫瘍含量の増加
要約
このプロトコールは、ホルマリン固定パラフィン包埋組織試料の腫瘍含量パーセントを増加させる方法を提示する。
要約
ホルマリン固定パラフィン包埋(FFPE)組織における汚染非腫瘍組織の存在は、ゲノム研究を大きく損なう可能性がある。本明細書では、下流の核酸抽出を行う前に不要な組織を除去および排除することによって、組織標本の腫瘍含量の割合を増強するように設計された方法であるマクロ解剖について説明する。FFPE組織ブロックを切片化し、4〜5μmのスライドマウント組織切片を作製した。ヘマトキシリンおよびエオジン(H&E)染色のために代表的なセクションが提出され、その後、ボード認定の病理学者によってレビューされました。レビュー中、病理学者はH&Eの腫瘍組織の領域を特定し、マークを付けた。完了したら、標識の付いたH&Eを使用して、同じ組織ブロックからの連続した染色されていない切片の切除をガイドしました。マクロ解剖の効果を実証するために、一致した大解剖および非解剖されたびまん性大細胞型B細胞リンパ腫(DLBCL)から抽出されたRNAを、DLBCLサブタイプおよびBCL2転座状態を決定することができるデジタル遺伝子発現アッセイ上で実行した。結果は、マクロ解剖が、調査されたサンプルの60%においてサブタイプまたはBCL2転座ステータスコールを変化させたことを示した。結論として、マクロ解剖は、核酸抽出の前に腫瘍濃縮を行うための簡単で効果的な方法であり、その生成物は下流のゲノム研究において自信を持って使用することができる。
概要
通常の臨床診断プロセスの一部として収集され、臨床組織リポジトリに保持されるホルマリン固定パラフィン包埋(FFPE)組織は、がん研究を含むヒト研究のための膨大なリソース1を表す。ヒトの疾患に対する我々の理解が深まるにつれて、以前は形態学的および免疫表現型特性に基づく単一の実体であると考えられていた疾患が、実際には分子サブタイピングアッセイを必要とする別個の分子サブタイプで構成されていることがますます明らかになりつつある。その結果、これらのサブタイプを識別できる高感度ゲノムアッセイがますます重要になってきている2。FFPE組織は、固定関連の問題のためにゲノム技術との互換性が低いことで有名ですが、技術とプロトコルが進化するにつれて、これらの技術はこの臨床的に遍在する組織フォーマットとますます互換性が高まっています3,4,5。しかしながら、FFPE組織は、しばしば腫瘍と非腫瘍組織材料の混和物であり、非腫瘍材料の存在はしばしば望ましくないものであり、高い割合で存在する場合、ゲノム解析の結果を著しく損ない、影響を与える可能性がある6。実際、60%の最小腫瘍含量がこのような分析に頻繁に使用され、研究基準7を満たしているにもかかわらず、この閾値に満たない組織を除外することができる。これは、患者の組織が貴重で大量に収集することが困難なまれな疾患環境で特に問題になる可能性があります。
マクロ切除は、正常組織3の量を減らすことによって低腫瘍含量の影響を最小限に抑える方法である。核酸抽出の前にこのような交絡非腫瘍物質を除去することは、腫瘍百分率含量、ひいては抽出核酸の腫瘍純度を有意に増強することができる。組織切除は、専門家の病理学的レビューに決定的に依存しており、ここで、腫瘍領域は、ボード認定病理学者によって新たに生成されたヘマトキシリンおよびエオジン(H&E)染色組織切片上に同定され、丸で囲まれる8。丸で囲まれたH&Eは、不要な組織と標的組織の除去と収集をそれぞれガイドするために使用されます。このプロトコルは、メイヨークリニックのAIDS and Cancer Specimen Resource (ACSR) Technical Core Laboratoryで実施された病理学的レビューから組織採取までのマクロ解剖のステップを説明しています。
プロトコル
すべてのサンプルを収集し、承認されたメイヨークリニックIRBプロトコル(PR16-000507およびPR2207-02)に準拠して使用しました。
1. サンプル調製
- ティッシュフローティングウォーターバスをオンにします。温度を39°Cに設定し、水が温度に達するようにします。木製のコレクションスティックを水風呂に浸します。
- 切片化するFFPE組織ブロックを特定して取得します。
- プレラベル顕微鏡スライドは、溶媒洗浄に耐えることができる組織学グレードの永久マーカーを使用した。
- ミクロトームを使用してFFPEブロックを切断します。各ブロックについて、少なくとも2つのフルフェースセクションをセクションあたり4~5μmの厚さで切断します(図1A)。
- 切り出したてのリボンの組織切片をスライドマウント用の予め加温した組織浮遊槽に移す(図1B、C)。
メモ:温水は、セクションのしわを「アイロン」にするのに役立ちます(図1C)。 - 各セクションを順番に処理する場合は、鉗子を使用してリボンから1つのセクションを取り外します(図1D)。
- あらかじめラベル付けされた顕微鏡スライド上の単一のセクションを収集します。
- 顕微鏡スライドを断面の下の角度で沈め、組織切片の縁がスライドに接触するようにスライドを位置決めする(図1E)。
- 組織切片に接触したら、スライドをゆっくりとフローティングバスから引き出し、組織切片が水から出てくるときにスライドに対して平らにまっすぐになるようにします(図1F)。
- スライドごとに1つの組織切片をマウントし、すべての切片が収集されるまで繰り返す。
- スライドに取り付けられた組織切片を室温(RT)で十分に乾燥させます。
2. 病理学的レビュー
- 各ブロック9の1つの代表的な組織切片に対してH&E染色を行う。
- 染色したばかりのH&Eを、理事会認定の病理学者による病理学的レビューのために提出してください。
注:レビュー中、病理学者は各組織における腫瘍含有量の割合を決定して記録し、各H&Eスライド上の腫瘍領域を丸で囲みます(図 2 および 図3、行1を参照)。 表 1は、 図3、行1に示すサンプルA〜Eに対するH&Eの病理学的レビュー中に決定された細胞性による腫瘍含量の割合を概説する。腫瘍含量が<60%の切片はマクロ解剖を必要とする7。核酸抽出に必要な切片の数は、丸で囲まれた腫瘍領域の大きさに依存する。プロトコルのセクション1で不十分なセクションが切断され、さらに切断が可能な場合は、追加のセクションを切断する必要があります。
3. 脱パラフィン化
- ヒュームフードに、2つのガラス染色皿に希釈されていない組織学グレードのd-リモネンまたはd-リモネンベースの溶媒を、1つのガラス染色皿に希釈されていない200プルーフ分子グレードのエタノールをプレフィルします。
警告: d-リモネンが皮膚や目に触れないようにし、蒸気や霧を吸い込まないようにし、発火源から遠ざけてください。エタノールを熱、火花、裸火から遠ざけ、こぼれたり皮膚や目に触れたり、換気をよくしたり、蒸気を吸ったりしないでください。
メモ:ラックに入れられたスライドを沈めるように皿を十分に満たしてください(図4A)。図示の20スライド染色皿を充填するには250mLが必要である。40スライドごとにd-リモネンとエタノール洗浄を交換してください。D-リモネン(C10H16)は、組織学的方法論においてより一般的になりつつあり、抽出後に良質の核酸を生じるキシレンに代わる、同様に効果的で毒性の低い脱ろう剤である10、11、12、13、14。このプロトコールは、より生物に優しい代替物15を用いて実施され得るが、抽出された核酸品質に対するそれらの効果は、もしあれば、決定されたままである。 - 染色されていないFFPE組織をガラス製のCoplinスライドラックにスライドして取り付けたラック(図4A、差し込み図)。
- ラックに入れられたスライドをd-リモネン洗浄1に2分間沈める。最初の20秒間は静かにかき混ぜる。
メモ: 洗濯物間の持ち越しを最小限に抑えるため、スライドのラックを洗濯物から取り外すときは、ラックを少しだけ水切りしてから、ラックの底面をティッシュペーパーで軽く叩いて余分な洗濯物を取り外します。 - ラックに入れられたスライドを希釈されていないD-リモネン洗浄2に2分間沈める。最初の20秒間は静かにかき混ぜる。ラックを取り外し、水切りし、もう一度軽くたたきます。
- ラックに入れられたスライドをエタノール洗浄に2分間沈める。最初の20秒間は静かにかき混ぜる。ラックを取り外し、吸収性ティッシュの上に置き、排水します。スライドを少なくとも10分間、ただし2時間以内で風乾させます。
3. マクロ解剖
- ベンチで、コプリンガラス瓶にDNase/RNaseフリーウォーターの3%グリセロール50mLをプレフィルします。
メモ:グリセロール洗浄は、40スライドごとに交換してください。 - 1.5 mL マイクロチューブに、マイクロチューブあたり 160 μL の組織消化バッファーをプレラベル付けおよびプレフィルします。
注:マクロ解剖後に行う核酸抽出には、DNA/RNA FFPE抽出キットを使用しました(材料表)。したがって、このプロトコルで使用される組織消化バッファーは、10 μLのプロテイナーゼKおよび150 μLのPKDバッファーで構成されていました。 - H&Eの病理学的マーキングを脱パラフィン処理された組織スライドの背面にトレースします。
注:非脱パラフィン化組織(図3、行2および図4B)と比較して、脱パラフィン化組織は白色であり、非常に視認性が高い(図3、行3、および図4C)。脱パラフィン化組織の特徴のこの高められた視認性と識別可能性は、マクロ解剖を可能にする。H&Eをベンチに伏せて置き、デパラフィン処理スライドの前面を、適合した病理学者がH&Eをレビューした(図4D)の背面に当てる。脱パラフィン処理組織をH&E組織に合わせます(図4E)。病理学者のマーキングをトレースすることは、マクロ解剖プロセスにおける重要なステップであり、これらのマーキングを可能な限り正確に再現するように注意する必要があります。これは、サンプルB、D、およびE(図3、図4E、および図4Eの差し込み図i)などの小さな組織およびまたは切断された組織にとって特に困難であり得る。トレースを助けるために、墨色の細かいまたは超微細なニブマーカー(図4E、差し込み図ii)を使用して、病理学者が描いたマーキングをトレースする必要があります。エタノールワイプは、エラーを除去し、必要に応じて再トレースを可能にするのに役立ちます。 - マークされた脱パラフィン処理スライド組織を裏返しにし、きれいなカミソリの刃の角でマーカーの線をなぞって腫瘍領域の縁を事前に切断します。
- 各スライドを順次取り扱い、脱パラフィン化スライドを3%グリセロール溶液に浸漬する。スライドをゆっくりと取り外す前に、ティッシュが完全に水没していることを確認してください(図4F)。
注:グリセロールディップの目的は、組織を湿らせて組織収集を支援するだけでなく、組織と収集された組織を配置する必要があるプラスチックマイクロチューブとの間の反発を引き起こす可能性のある静電荷の蓄積を減らすことです。 - 余分なグリセロール溶液を除去するためにティッシュでスライドの背面を優しく拭き取り、スライドをベンチの上に置き、側面を下向きに拭いた。ティッシュを1〜2分間短時間風乾させます。
注:過剰なグリセロールを抽出プロセスに持ち越すと、核酸抽出の収率と品質に悪影響を及ぼす可能性があります。組織はわずかに湿っている必要がありますが、収集時に目に見えて濡れていないはずです。 - 関心のある腫瘍領域がスライド上のどこにあるかに応じて、カミソリの刃の平らな縁を使用して、(a)腫瘍組織を直接収集するか、カミソリを使用して目的の組織をスライドからこすり落とすか、または(b)目的の腫瘍組織を収集する前にまず非腫瘍組織を除去して廃棄します(図3)。
メモ:採取された組織は、ブレードの底部に集まるか、巻き上がる傾向があります(図4G)。 - 木の棒を使用して、採取した組織をブレードから取り出し(図4H および差し込み図)、適切なラベル付けおよびプレフィルドマイクロチューブ(図4I)に移します。
注:消化バッファーは、木製ピックから液体に組織を「引き抜く」のに役立ちます。 - 核酸抽出に進みます。
注:核酸抽出は、製造元の指示書に従ってDNA/RNA FFPE抽出キットを使用して完了し、得られた核酸をUV-vis分光光度計を使用して定量しました。得られたRNAを、デジタル遺伝子発現プロファイリングベースのDLBCL90アッセイ16上で実行した。
結果
合計5つのびまん性大細胞型B細胞リンパ腫(DLBCL)FFPE組織ブロックを切片化し、得られた切片を核酸抽出の前にマクロ解剖するか、または切除しなかった。抽出したRNAをDLBCL90アッセイ16上で実行した。大切開サンプルを2回実行し、1回は5 μLのRNAストック濃度を使用し、1回は総RNAインプットの300 ng以下を使用し、1回は5 μLのRNAストックを使用して、それぞれの解剖されていない対応物のRNAインプットと一致するように希釈しました。DLBCL90の結果の概要を 表2に示します。
DLBCLは、異なる治療応答性を有する3つの異なる起源細胞(COO)サブタイプ、すなわちGCB、ABC、および未分類またはUNC17,18として知られる中間群からなる。MYC、BCL2、およびBCL6を単独または組み合わせて関与する転座(ダブルまたはトリプルヒット)もまた、DLBCL、特にGCBサブタイプ19において頻繁に観察される。DLBCL90アッセイは、その前身であるLymph2Cx臨床アッセイの拡張であり、DLBCL COOサブタイプ決定が可能ですが、主に蛍光in-situハイブリダイゼーション(FISH)の代替としてデジタル遺伝子発現を使用してBCL2を含むダブルヒット(DH)転座を有するサンプルを同定するために開発されました16,20。表2の結果は、マクロ解剖が、調査したサンプルの60%(3/5)のCOOまたはDHITsigステータスコールのいずれかを変化させたことを示しています。
サンプルAのマクロ解剖はCOOコールには影響しなかったが、DHITsigコールをNEGからUNCLASSに変更し、この変化はマクロ解剖されたサンプルRNA入力に関係なく、同様の確率スコア(0.224、0.254)で観察された。対照的に、サンプルCのマクロ解剖はDHITsigコールには影響を及ぼさなかったが、COOコールをGCBからUNCに変更した。ここでも、この変化は、大解剖されたサンプルRNA入力に関係なく観察された。しかし、0.117では、COOコール確率は、RNAインプットが減少したマクロ解剖サンプルのコール閾値0.1に近かった。サンプル A と同様に、サンプル E のマクロ解剖は COO 呼び出しには影響しませんでしたが、DHITsig 呼び出しを変更しました。しかし、サンプルEの場合、コールはUNCLASSからNEGに変更され、合理的に類似した確率コール(0.849、0.833)でマクロ解剖されたサンプルRNA入力に関係なくそうしました。特に、DHITsig NEGへのこのコール変化は、サンプルEがABC-DLBCLに見出され、BCL2を含む二重ヒット転座がGCB-DLBCLで排他的に観察されることが報告されていることを考えると、生物学的に理にかなっている19。

図1:ミクロトームを用いたスライドマウント 組織切片の生成(A)FFPE組織ブロックをミクロトームチャックで所定の位置に保持し、切断して、順次FFPE組織切片のリボンを作製した。(B)予め浸した木の棒を用いて、ミクロトームからリボンを回収し、温水浴に移す。(C)水の暖かさは、組織リボンのしわをアイロンをかけるのに役立ちます。(D)個々のFFPE組織切片は、2つの切片の接合部に閉じた鉗子を配置し、鉗子を静かに開いて、切片を互いに切断することによって、組織リボンから除去される。(E)切片は、スライドガラスを斜めに沈め、切片の端がスライドガラスに触れるまで組織切片に向かって側面を静かに移動させることによって、水から収集される。(F)スライドとセクションが接触したら、ゆっくりとスライドを水から取り外し、組織セクションがスライドに対して平らになるようにします。 この図の拡大版を表示するには、ここをクリックしてください。

図2:ヘマトキシリンおよびエオジン(H&E)染色切片の病理学および組織学的レビュー(A,B)H&E組織切片は、ボード認定病理学者による顕微鏡レビューを受ける。(C,D)病理学者が組織全体を見て、それが100%腫瘍組織ではないことを発見したら、病理学者はマーカーを使用して組織の腫瘍領域を囲む。(E,F)マークされたH&Eを元のFFPE組織ブロックに対して保持することは、すべての組織が腫瘍材料ではないことを示す。この図の拡大版を表示するには、ここをクリックしてください。
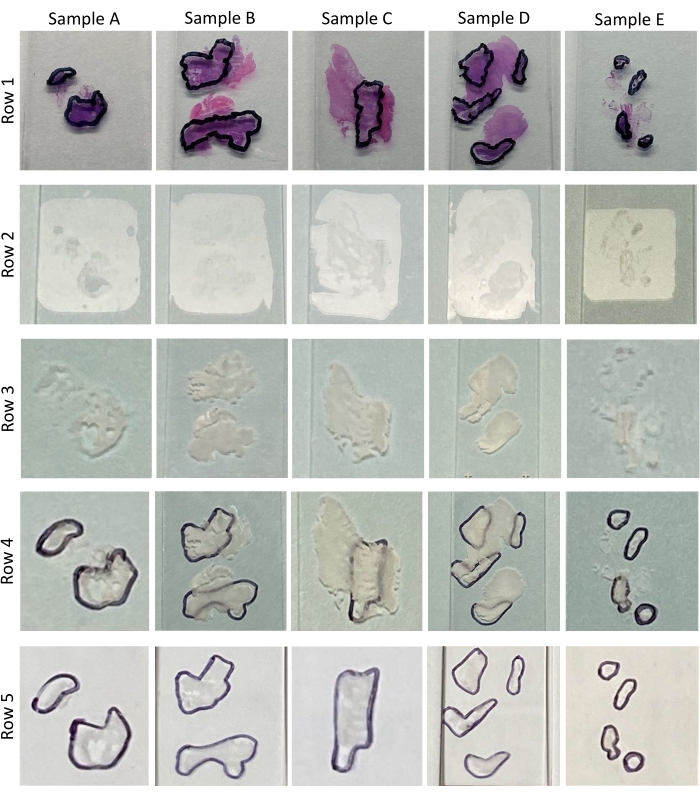
図3:組織サンプル この画像は、病理学的にレビューされ、腫瘍マークが付いたH&E(行1)、未処理のスライドマウントFFPE組織切片(行2)、脱パラフィン化スライドマウントFFPE組織切片(行3)、スライドの背面に病理マーキングがトレースされた脱パラフィン化スライドマウントFFPE組織切片(行4)、このプロトコルを実証するために使用された5サンプル(A-E)の脱パラフィン化およびマクロ解剖されたスライドマウントFFPE組織切片(行5)を実証する。 この図の拡大版を表示するには、ここをクリックしてください。

図4:FFPE組織切片の脱パラフィン化およびマクロ解剖:(A)ヒュームフード内で、スライドラックに取り付けられたFFPE組織は、2回のd-リモネン洗浄と1回のエタノール洗浄で洗浄される。(B,C)洗浄後、すべてのパラフィンが除去され、組織のみがスライド上に残り、これは現在、洗浄前のものと比較して白く、非常に視認性が高い。(D)脱パラフィン化スライドに取り付けられた組織切片は、その一致するマーク付きH&Eの背面にうつ伏せに置かれる(E)H&Eの腫瘍領域マーキングは、微細または超微細なニブ付き永久マーカーを使用して脱パラフィン化スライドの背面にトレースされる(F)マークされた脱パラフィン化スライドマウント組織切片は、次いで、グリセロール洗浄に浸漬され、収集のために組織切片を湿らせる。スライドをグリセロールからゆっくりと除去し、スライドの背面をティッシュで拭き取って余分なグリセロールを除去してから、スライド組織をベンチ上に上向きに敷く。(G)清潔なカミソリの刃の平らな側面を使用して、組織を大解剖し、病理学者のマーキングの外側の不要な組織を廃棄してから、刃の端に沿って集まる目的の組織を収集する。(H)刃の端から採取した組織を除去するために木の棒を使用する。(i)次いで、組織は、予め標識されたマイクロチューブに予め充填された組織消化緩衝液に移され、核酸抽出の準備ができている。この図の拡大版を表示するには、ここをクリックしてください。
| サンプル ID | 全組織(a) | 組織の丸みを帯びた領域(b) | 組織全体の腫瘍全体の含有量(c) | マクロ解剖による腫瘍含量のフォールド増加(d) | マクロ解剖されていない(e) | マクロ解剖 (f) | ||||
| % 生存腫瘍 | % その他 | % 生存腫瘍 | % その他 | 抽出された5μmスライドの数 | RNA conc (ng/μL) | 抽出された5μmスライドの数 | RNAコンク (ng/μL) | |||
| サンプルA | 60 | 40 | 75 | 25 | 45 | 1.7 | 2 | 19.0 | 4 | 58.3 |
| サンプルB | 60 | 40 | 65 | 35 | 39 | 1.7 | 1 | 34.0 | 2 | 60.0 |
| サンプル C | 40 | 60 | 65 | 35 | 26 | 2.5 | 1 | 13.7 | 2 | 46.2 |
| サンプル D | 35 | 65 | 90 | 10 | 32 | 2.9 | 1 | 57.3 | 2 | 60.0 |
| サンプル E | 20 | 80 | 30 | 70 | 6 | 5.0 | 3 | 25.2 | 3 | 44.6 |
表1:病理レビューデータ。 表は、(a)領域別組織切片全体における生存腫瘍の割合、(b)細胞性によるレビュー中に病理学者が丸で囲んだ/マークした領域における生存腫瘍の割合、(c)組織全体の推定腫瘍細胞性(a x b)、(d)マクロ解剖で達成された腫瘍細胞性の推定倍数の増加、 (eおよびf)多数の5μmの染色されていないFFPEスライドマウント組織切片を抽出し、得られたRNA濃度を一致させた非マクロ解剖およびマクロ解剖サンプルについて抽出した。%その他は、所与の試料中に存在する、腫瘍組織ではない他のすべての組織を指し、結合組織、間質線維芽細胞、血管、ならびに他の固有の間質要素を含むことができる。 この表をダウンロードするには、ここをクリックしてください。
| サンプル ID | RNA インプット (ng) | DLBCL90 COO コール | DLBCL90 呼び出し確率 | DHITsig call | DHITsig pos probability | DHITsig neg 確率 | |
| マクロ解剖されていない | サンプルA | 95.0 | ティッカー | 0.000 | ネグ | 0.135 | 0.865 |
| サンプルB | 170.0 | ティッカー | 0.000 | ネグ | 0.032 | 0.968 | |
| サンプル C | 68.5 | ティッカー | 0.028 | ネグ | 0.033 | 0.967 | |
| サンプル D | 286.5 | 甲乙丙 | 0.998 | ネグ | 0.002 | 0.998 | |
| サンプル E | 126.0 | 甲乙丙 | 0.989 | アンクラス | 0.212 | 0.788 | |
| マクロ解剖 | サンプルA_M | 291.7 | ティッカー | 0.000 | アンクラス | 0.224 | 0.776 |
| サンプルB_M | 300.0 | ティッカー | 0.000 | ネグ | 0.016 | 0.984 | |
| サンプルC_M | 231.2 | アンクラス | 0.210 | ネグ | 0.015 | 0.985 | |
| サンプルD_M | 300.0 | 甲乙丙 | 0.999 | ネグ | 0.002 | 0.998 | |
| サンプルE_M | 223.2 | 甲乙丙 | 0.987 | ネグ | 0.151 | 0.849 | |
| マクロ解剖 & RNA 希釈 | サンプルA_M | 95.0 | ティッカー | 0.000 | アンクラス | 0.254 | 0.746 |
| サンプルB_M | 170.0 | ティッカー | 0.000 | ネグ | 0.023 | 0.977 | |
| サンプルC_M | 68.5 | アンクラス | 0.117 | ネグ | 0.027 | 0.973 | |
| サンプルD_M | 286.5 | 甲乙丙 | 0.999 | ネグ | 0.002 | 0.998 | |
| サンプルE_M | 126.0 | 甲乙丙 | 0.995 | ネグ | 0.167 | 0.833 | |
表2:DLBCL90デジタル遺伝子発現アッセイの結果。 5つのサンプル(A〜E)は、核酸抽出が行われる前にマクロ解剖されていないか、またはマクロ解剖された。得られたRNAをDLBCL90アッセイで実行し、最大RNAインプット量は5 μLであり、非マクロ解剖サンプルは5 μLのストックRNAを使用して実行した。マクロ解剖された各サンプルは、(a)60ng/μLのアリコートが可能でない限り、5μLのストックRNAを使用し、(b)5μLのストックRNAを使用して、マクロ解剖されていない対応物の濃度/入力に合わせて希釈した。接尾辞 _M は、そのサンプルがマクロ解剖されたことを示します。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
FFPE組織は、しばしば腫瘍組織と非腫瘍組織の不均一な混合である。高感度ゲノム検査は、臨床および研究環境の両方でますます普及しつつありますが、汚染された非腫瘍組織の存在によって混乱する可能性があります。実際、ゲノム研究には60%の最小腫瘍含量がしばしば推奨されます。腫瘍の割合は、腫瘍材料によって占める組織の面積によって、または組織内の腫瘍細胞の割合によって決定することができる。面積別の腫瘍は腫瘍純度の一般的に使用される測定基準ですが、必ずしも組織の正確な記述を描写するわけではありません。2つの組織、両方とも1000個の細胞を持ち、そのうち500個が腫瘍細胞であると考える。組織Aにおいて、500個の非腫瘍細胞は、腫瘍細胞のそれと同程度の体積を有する間質細胞である。この組織において、腫瘍の割合は、細胞性および面積の両方によって50%と考えることができる。組織Bにおいて、500個の非腫瘍細胞は、腫瘍細胞の4倍の体積を有する脂肪細胞である。この組織では、腫瘍の割合は依然として細胞性によって50%であるが、面積によって20%である。第3の組織である組織Cは、500個の腫瘍細胞と、腫瘍細胞の4倍および0.5倍の体積を有する400個の脂肪細胞および800個の間質細胞から構成される。100個の脂肪細胞が800個の間質細胞の体積に等しいと仮定すると、組織Cの腫瘍の割合は細胞性(500/1700)で29%であるが、それでも面積で20%である。組織Dはまた、腫瘍、脂肪、および間質細胞から構成され、体積比は1倍、4倍、および0.1倍である。ただし、セル数はそれぞれ 400、10、および 720 です。したがって、組織Dの腫瘍の割合は、細胞性によって35%(400/1130)であるが、面積によって78%である。これらの例は過度に単純化されており、現実世界の組織組成を反映していないが、組織組成の重要性と、面積および細胞性による腫瘍含量の違いを明確に伝えている。重要なことに、下流の核酸抽出のための腫瘍含量の濃縮に関しては、腫瘍細胞よりも多くの非腫瘍細胞からゲノム材料を抽出する交絡可能性が高まるため、腫瘍細胞性はより重要な属性である。これは、細胞性百分率の観点から組織の腫瘍含量を評価する必要性を強調するだけでなく、非腫瘍組織の潜在的な悪影響を最小限に抑えるために不要な組織を切除する必要性も強調する。組織濃縮にはいくつかの方法があり、主な方法はマクロ解剖およびマイクロダイセクションである。
マクロ解剖は、このプロトコルに記載されている方法であり、比較的迅速で単純であり、高価または特殊な装置を必要としない。マクロ切除は腫瘍含量を大幅に改善することができるが、非腫瘍物質を完全に排除するわけではないことを理解することは重要である。マクロ解剖の目的は、望ましくない組織から生じる「ノイズ」を低減するために、望ましくない組織を排除することによって関心組織を十分に富化することであり、これは次に、関心組織からの関心のあるシグナルを増強することができる。したがって、マクロ解剖媒介腫瘍富化は、関心のあるマーカー、特に存在量が少ないか発現不良の腫瘍特異的分子マーカーをよりよく検出するために、シグナル対ノイズ比を増強する方法である。しかし、マクロ解剖は、カミソリの刃などの粗いツールによって提供される精度の欠如のために制限があり、病理学者のマーカーの線の太さに起因する精度の問題、および病理学者のH&E境界をたどる際の潜在的なエラーの影響を受けやすい。上記でほのめかしたように、腫瘍自体の内部に埋め込まれた内在的かつ腫瘍誘導性の間質要素(すなわち、結合組織、間質線維芽細胞、血管、良性反応性リンパ球、マクロファージ)の存在のために、100%の腫瘍純度を達成することは不可能である。実際、多くの侵襲性またはびまん性浸潤性悪性腫瘍は、堅牢なデスモプラスティック間質応答を誘導し、間質線維芽細胞および他の非腫瘍性細胞型と密接に混合された腫瘍細胞のクラスターをもたらす。ここで、膵臓癌組織21のようなこの間質反応パターンに関連する腫瘍は、手動マクロ解剖よりもむしろデジタル誘導マイクロダイセクションからより多くの利益を得得る。
手動マイクロダイセクションは、針またはメスを用いた組織特異的細胞または集団の同定、解剖、および単離を助けるために顕微鏡下で行われ、マクロディスセクション22よりも精度が増すという利点を有する。しかし、手動マイクロダイセクションは、腫瘍含有量が少ない複雑な組織や、手動解剖と両立しない複雑な特徴を持つ複雑な組織に必要な繊細さを欠いた面倒なプロセスです。このような組織は、レーザーキャプチャマイクロダイセクションのような高精度の自動化された方法を使用して解剖することができる。実際、デジタル誘導マイクロダイセクションは、膵臓癌組織23において手動マクロダイセクションと比較してより高い割合の腫瘍内容物をもたらすことが示されている。しかし、これらの高精度の自動化方法の欠点は、専門的で高価な機器や高度に訓練された個人の必要性など、ワークフローへの組み込みを妨げています。遺伝子発現プロファイリングに対するマクロダイセクションとレーザーキャプチャマイクロダイセクション(LCM)の効果を比較したde Bruinらの研究では、LCMサンプルは総RNA収量が低く(平均30ng)、cDNAライブラリ調製入力しきい値24を満たすために2ラウンドのmRNA増幅が必要であることが判明しました。その結果得られたLCM遺伝子発現プロファイルは、マクロ解剖プロファイルが非腫瘍間質寄与の影響を受けるよりも、mRNA増幅のラウンドによって影響を受けることを発見し、マクロ解剖は信頼性の高い遺伝子発現データを生成するために適切に使用できると結論付けた24。
NanoStringデジタル遺伝子発現プロファイリングの重要な利点は、特に高度に分解されたFFPE由来RNAを扱う場合、RNA増幅やcDNAライブラリの調製などの酵素依存プロセスを必要としないことです。しかしながら、アッセイは通常、総RNA25,26の50〜300ngの間のインプットに対して最適化されており、de Bruinら24の知見に基づいて、組織インプットを増加させることなくマイクロディスsected組織と互換性がない可能性がある。組織サンプルが外科的切除ではなく小さな生検としてますます収集される時代には好ましくない需要です。DLBCL90アッセイに使用されたRNAインプットは、大解剖組織と非解剖組織の両方で68.5~300ngの範囲であった。結果は、マクロ解剖の結果、検査されたサンプルの60%でコール変化をもたらし、マクロ解剖されたサンプルのRNAインプットに関係なくこれらの変化が観察されたことを示している。しかし、低 RNA 入力の COO 確率は COO GCB/UNC 確率コールしきい値を侵食し、しきい値は GCB で 0 ~ <0.1、UNC で 0.1 ~ 0.9、ABC コール20 で >0.9 ~ 1.0 です。DLBCL COOの主なサブタイプはGCBとABCで、DLBCLの全ケースの41%と44%を占め、UNCは2つの中間グループを表し、ABCは最も積極的な20,27です。したがって、サンプルCのマクロ解剖時のCOOコールの変化は、GCBからABCへのCOOサブタイプの直接的な変化を引き起こさなかったが、GCBからUNCへの変化は、より攻撃的な疾患への移行を示唆している可能性がある。さらに、最近の研究は、UNCサブタイプが単なる中間サブタイプではなく、サブタイプ特異的な治療的に利用可能な属性を潜在的に有している可能性があることを示している28。同様に、サンプルAおよびEのマクロ解剖は、DHITsig呼び出しにおいてDH陰性からDH陽性へ、またはその逆への直接的な変化を引き起こさなかった。しかしながら、マクロ解剖時のGCBサンプル(サンプルA)のNEGからUNCLASSへの移動およびABCサンプル(サンプルE)のUNCLASSからNEGへの移動は、BCL2を含むダブルヒット転座がもっぱらGCB現象であると報告されているため、生物学的に適切である19。転座は伝統的に臨床現場でFISHによって遍在的に検出されていますが、それらの検出のためのより関与が少なく時間のかかる代替方法を特定する機運が高まっています。DLBCL90アッセイは、この必要性に対処する重要なツールであり、そこでは、このアッセイが臨床診断で使用されるFISHプローブへの不可解な転座を検出することができるという発見によって、その使用の理論的根拠が強化される29。
上記のマクロ解剖プロトコルは、研究者が一般的に使用される研究包含基準の閾値を下回る組織サンプルの腫瘍含有量を増加させることを可能にする簡単な方法を概説している。研究ワークフローにマクロ解剖を含めることで、研究者は腫瘍含有量を増加させることによって、腫瘍密度の低い組織を研究除外から救済することができます。その結果、結果として生じるRNAおよびDNA溶出物がゲノム調査中の腫瘍を表しているという信頼性が高まります。組織郭清のための他のより正確な方法が存在するが、より広大で非浸潤性、シート状、または固体様式で成長する腫瘍の場合、マクロ解剖で十分である可能性が高い。ここで提示された結果は、ゲノムアッセイおよびマクロ解剖における腫瘍純度が、これを達成するための信頼できるツールとして重要であることを強調している。
開示事項
著者らには開示するものは何もありません。
謝辞
この研究は、NIHが資金提供するAIDS and Cancer Specimen Resource (ACSR, UM1 CA181255-2) の生物標本科学プログラムの下で支援されています。ビデオは撮影され、メイヨークリニックメディアサービスによってポストプロダクション編集が行われました。
資料
| Name | Company | Catalog Number | Comments |
| 200-proof ethanol | Decon | 2701 | |
| AllPrep DNA/RNA FFPE Kit | Qiagen | 80234 | DNA/RNA FFPE extraction kit |
| Coplin pots | Various | x | |
| DLBCL90 probes | NanoString | various | Digital gene expression profiling based DLBCL90 assay |
| d-Limonene | VWR | 89376-092 | |
| Forceps | Various | x | |
| Glass micrscope slides | FisherBrand | 12-550-15 | |
| Glycerol | VWR | 0854-1L | |
| Master kits | NanoString | various | |
| Microtome | Leica | RM2265 | |
| Microtubes | Ambion | AM12400 | |
| NanoDrop One | Thermo Scientific | ND-ONE-W | Spectrophotometer for DNA, RNA and protein qualitation |
| nCounter | NanoString | x | Digital gene expression profiling platform used to run the DLBCL90 assay |
| Permanent marker | Electrib Microscope Sciences | 72109-12 | |
| Razor blade dispenser | Electrib Microscope Sciences | 71985-10 | |
| Razor blades | Electrib Microscope Sciences | 71985-23 | |
| Tissue digestion buffer | Qiagen | 80234 | |
| Ultrapure water | VWR | SH30538.02 | |
| Waterbath | Triangle Biomedical Sciences | TFB-120 | |
| Wooden stick | FisherBrand | 22363158 |
参考文献
- Mathieson, W., Thomas, G. A. Why formalin-fixed, paraffin-embedded biospecimens must be used in genomic medicine: An evidence-based review and conclusion. Journal of Histochemistry and Cytochemistry. 68 (8), 543-552 (2020).
- Robetorye, R. S., Maguire, A., Rosenthal, A. C., Rimsza, L. M. Profiling of lymphoma from formalin-fixed paraffin-embedded tissue. Seminars in Hematology. 56 (1), 46-51 (2019).
- Moorcraft, S. Y., Gonzalez, D., Walker, B. A. Understanding next generation sequencing in oncology: A guide for oncologists. Critical Reviews in Oncology/Hematology. 96 (3), 463-474 (2015).
- Haile, S., et al. Automated high throughput nucleic acid purification from formalin-fixed paraffin-embedded tissue samples for next generation sequence analysis. PLoS One. 12 (6), 0178706 (2017).
- Oh, E., et al. Comparison of accuracy of whole-exome sequencing with formalin-fixed paraffin-embedded and fresh frozen tissue samples. PLoS One. 10 (12), 0144162 (2015).
- Holley, T., et al. Deep clonal profiling of formalin fixed paraffin embedded clinical samples. PLoS One. 7 (11), 50586 (2012).
- . TCGA Tissue sample requirements: High quality requirements yield high quality data Available from: https://www.cancer.gov/about-nci/organization/ccg/structural-genomics/tcga/studied-cancers (2021)
- Javey, M., et al. Innovative tumor tissue dissection tool for molecular oncology diagnostics. The Journal of Molecular Diagnostics: JMD. 23 (4), 399-406 (2021).
- Feldman, A. T., Wolfe, D. Tissue processing and hematoxylin and eosin staining. Methods in Molecular Biology. 1180, 31-43 (2014).
- Duan, Q., Zhang, H., Zheng, J., Zhang, L. Turning cold into hot: Firing up the tumor microenvironment. Trends in Cancer. 6 (7), 605-618 (2020).
- Kim, Y. W., et al. Safety evaluation and risk assessment of d-Limonene. Journal of Toxicology and Environmental Health Part B: Critical Reviews. 16 (1), 17-38 (2013).
- Foti, C., et al. Occupational contact dermatitis to a limonene-based solvent in a histopathology technician. Contact Dermatitis. 56 (2), 109-112 (2007).
- Meuse, C. W., Barker, P. E. Quantitative infrared spectroscopy of formalin-fixed, paraffin-embedded tissue specimens: paraffin wax removal with organic solvents. Applied Immunohistochemistry and Molecular Morphology. 17 (6), 547-552 (2009).
- Schmeller, J., et al. Setting out the frame conditions for feasible use of FFPE derived RNA. Pathology - Research and Practice. 215 (2), 381-386 (2019).
- Prema, V., et al. Biofriendly substitutes for xylene in deparaffinization. Journal of Pharmacy and Bioallied Sciences. 12, 623-630 (2020).
- Ennishi, D., et al. Double-hit gene expression signature defines a distinct subgroup of germinal center B-cell-like diffuse large B-cell lymphoma. Journal of Clinical Oncology. 37 (3), 190-201 (2019).
- Alizadeh, A. A., et al. Distinct types of diffuse large B-cell lymphoma identified by gene expression profiling. Nature. 403 (6769), 503-511 (2000).
- Rosenwald, A., et al. The use of molecular profiling to predict survival after chemotherapy for diffuse large-B-cell lymphoma. The New England Journal of Medicine. 346 (25), 1937-1947 (2002).
- Scott, D. W., et al. High-grade B-cell lymphoma with MYC and BCL2 and/or BCL6 rearrangements with diffuse large B-cell lymphoma morphology. Blood. 131 (18), 2060-2064 (2018).
- Scott, D. W., et al. Determining cell-of-origin subtypes of diffuse large B-cell lymphoma using gene expression in formalin-fixed paraffin-embedded tissue. Blood. 123 (8), 1214-1217 (2014).
- Heinrich, M. A., Mostafa, A., Morton, J. P., Hawinkels, L., Prakash, J. Translating complexity and heterogeneity of pancreatic tumor: 3D in vitro to in vivo models. Advanced Drug Delivery Reviews. 174, 265-293 (2021).
- Erickson, H. S., Gillespie, J. W., Emmert-Buck, M. R. Tissue microdissection. Methods in Molecular Biology. 424, 433-448 (2008).
- Geiersbach, K., et al. Digitally guided microdissection aids somatic mutation detection in difficult to dissect tumors. Cancer Genetics. 209 (1-2), 42-49 (2016).
- de Bruin, E. C., et al. Macrodissection versus microdissection of rectal carcinoma: minor influence of stroma cells to tumor cell gene expression profiles. BMC Genomics. 6, 142 (2005).
- Ramsower, C. A., et al. Clinical laboratory validation of the MCL35 assay for molecular risk stratification of mantle cell lymphoma. Journal of Hematopathology. 13 (4), 231-238 (2020).
- Maguire, A., et al. Enhanced DNA repair and genomic stability identify a novel HIV-related diffuse large B-cell lymphoma signature. International Journal of Cancer. 145 (11), 3078-3088 (2019).
- Rosenwald, A., Staudt, L. M. Gene expression profiling of diffuse large B-cell lymphoma. Leukemia & Lymphoma. 44, 41-47 (2003).
- Wright, G. W., et al. A probabilistic classification tool for genetic subtypes of diffuse large B cell lymphoma with therapeutic implications. Cancer Cell. 37 (4), 551-568 (2020).
- Hilton, L. K., et al. The double-hit signature identifies double-hit diffuse large B-cell lymphoma with genetic events cryptic to FISH. Blood. 134 (18), 1528-1532 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved