Method Article
Повышение содержания опухоли с помощью макродиссекции опухоли
В этой статье
Резюме
Этот протокол представляет собой метод увеличения процентного опухолевого содержания формалин-фиксированных образцов тканей, встроенных в парафин.
Аннотация
Наличие загрязняющих неопухолевых тканей в формалин-фиксированных парафиновых тканях (FFPE) может значительно подорвать геномные исследования. Здесь мы описываем макродиссекцию, способ, предназначенный для увеличения процентного содержания опухоли в образце ткани путем удаления и устранения нежелательной ткани до выполнения последующей экстракции нуклеиновых кислот. Тканевые блоки FFPE были разделены для получения 4-5 мкм скользящих тканевых срезов. Репрезентативный раздел был представлен для окрашивания гематоксилина и эозина (H & E) и впоследствии рассмотрен сертифицированным патологоанатомом. В ходе обзора патологоанатом идентифицировал и отметил области опухолевой ткани в H&E. После завершения демаркированный H&E использовался для направления резекции последовательных неокрашенных участков из того же блока ткани. Чтобы продемонстрировать эффекты макродиссекции, РНК, извлеченную из сопоставленных макрорассекционных и нерасфеченных диффузных больших В-клеточных лимфом (DLBCL), была запущена на цифровом анализе экспрессии генов, способном определять подтип DLBCL и транслокационный статус BCL2. Результаты показали, что макродиссекция изменила подтип или вызовы статуса транслокации BCL2 в 60% исследованных образцов. В заключение, макродиссекция является простым и эффективным методом для выполнения обогащения опухоли до экстракции нуклеиновых кислот, продукт которой затем может быть уверенно использован в последующих геномных исследованиях.
Введение
Формалин-фиксированные парафиновые (FFPE) ткани, собранные как часть нормального клинического диагностического процесса и сохраненные в клинических тканевых хранилищах, представляют собой обширный ресурс для исследований на людях, включая исследования рака1. По мере углубления нашего понимания болезней человека становится все более очевидным, что болезни, ранее считавшиеся единичными сущностями, основанными на морфологических и иммунофенотипических характеристиках, на самом деле состоят из различных молекулярных подтипов, которые требуют молекулярных субтипических анализов. Следовательно, высокочувствительные геномные анализы, способные различать эти подтипы, становятся все более важными2. Хотя ткани FFPE известны тем, что плохо совместимы с геномными методами из-за проблем, связанных с фиксацией, по мере развития технологий и протоколов эти методы становятся все более совместимыми с этим клинически вездесущим форматом тканей 3,4,5. Однако ткани FFPE часто представляют собой примеси опухолевых и неопухолевых тканевых материалов, где присутствие неопухолевого материала часто нежелательно и может, если оно присутствует в высокой пропорции, значительно подорвать и повлиять на результаты геномного анализа6. Действительно, минимальное содержание опухоли в 60% часто используется для таких анализов, где ткани, которые не достигают этого порога, могут быть исключены, несмотря на то, что в противном случае соответствуют критериям исследования7. Это может быть особенно проблематично в условиях редких заболеваний, где ткани пациента драгоценны и их трудно собрать в больших количествах.
Макродиссекция – это метод, который минимизирует последствия низкого содержания опухоли за счет уменьшения количества нормальной ткани3. Удаление такого смешивающего неопухолевого материала до экстракции нуклеиновых кислот может значительно увеличить процентное содержание опухоли и, следовательно, чистоту опухоли экстрагированных нуклеиновых кислот. Резекция ткани критически полагается на экспертный патологический обзор, в котором область опухоли идентифицируется и обводится на свежегенерированном участке ткани, окрашенном гематоксилином и эозином (H & E), сертифицированным патологоанатомом8. Обведенный H & E затем используется для руководства удалением и сбором нежелательных и целевых тканей соответственно. Этот протокол описывает этапы макродиссекции от патологического обзора до сбора тканей, как это выполняется в лаборатории технического ядра ресурса образцов СПИДа и рака (ACSR) в клинике Майо.
протокол
Все образцы были собраны и использованы в соответствии с утвержденными протоколами IRB клиники Майо (PR16-000507 и PR2207-02).
1. Пробоподготовка
- Включите тканевую плавающую водяную баню. Установите температуру на 39 °C и дайте воде достичь температуры. Замачивайте деревянные коллекционные палочки на водяной бане.
- Определите и извлеките тканевые блоки FFPE, подлежащие разделению.
- Предварительно маркировочный микроскоп скользит с использованием перманентного маркера гистологического класса, который может выдерживать промывку растворителем.
- Используйте микротом для секционирования блоков FFPE. Вырежьте не менее 2 полнолицевых секций толщиной 4-5 мкм на секцию для каждого блока (рисунок 1А).
- Перенесите свежеразрезанную ленту срезов ткани в предварительно нагретую тканевую плавающую ванну для монтажа на горку (рисунок 1B, C).
ПРИМЕЧАНИЕ: Теплая вода помогает «сгладить» морщины на участках (рисунок 1С). - Обрабатывая каждую секцию последовательно, используйте щипцы, чтобы оторвать один участок от ленты (рисунок 1D).
- Соберите одну секцию на предварительно маркированном слайде микроскопа.
- Погрузите предметное стекло микроскопа под углом под сечением, расположив затвор таким образом, чтобы край участка ткани касался слайда (рисунок 1E).
- После контакта с участком ткани медленно вытащите горку из плавающей ванны, чтобы позволить секции ткани выпрямиться вровень с горкой, когда она выходит из воды (рисунок 1F).
- Установите 1 секцию ткани на слайд и повторяйте до тех пор, пока все секции не будут собраны.
- Дайте срезам ткани, установленным на слайдах, тщательно высохнуть при комнатной температуре (RT).
2. Патологический обзор
- Выполните окрашивание H&E на одном репрезентативном участке ткани для каждого блока9.
- Отправьте свежеиспачканный H&Es для патологического обзора сертифицированным патологоанатомом.
ПРИМЕЧАНИЕ: Во время обзора патологоанатом определяет и записывает процентное содержание опухоли в каждой ткани и обводит область опухоли на каждом слайде H &E (см. Рисунок 2 и Рисунок 3, Строка 1). В таблице 1 приведен процентный процент содержания опухоли по клеточности, определяемый в ходе патологического обзора H&Es для образцов A-E, показанных на рисунке 3, строка 1. Участки с содержанием опухоли <60% требуют макродиссекции7. Количество участков, необходимых для экстракции нуклеиновых кислот, зависит от размера обведенной опухолевой области. Если в разделе 1 протокола было вырезано недостаточное количество секций и возможны дальнейшие сокращения, то, возможно, потребуется вырезать дополнительные участки.
3. Депарафинизация
- В вытяжной вытяжке предварительно заполните две стеклянные витражи неразбавленной гистологической маркой d-лимонен или растворителем на основе d-лимонена и 1 стеклянную витражную посуду неразбавленным 200-стойким молекулярным этанолом.
ВНИМАНИЕ: Избегайте контакта d-лимонена с кожей и глазами, избегайте вдыхания пара или тумана и держитесь подальше от источников возгорания. Держите этанол вдали от тепла, искр и открытого огня, избегайте разливов и контакта с кожей или глазами, хорошо проветривайте и избегайте вдыхания паров.
ПРИМЕЧАНИЕ: Наполните посуду достаточно, чтобы погрузить горки (рисунок 4A); Для заполнения 20-слайдовой окрашенной посуды требуется 250 мл. Замените промывки d-лимонена и этанола после каждых 40 слайдов. D-лимонен (C10H16) является альтернативным, столь же эффективным и менее токсичным депарафинирующим агентом ксилола, который становится все более распространенным в гистологических методологиях и дает нуклеиновые кислоты хорошего качества после экстракции 10,11,12,13,14. Хотя этот протокол может быть выполнен с использованием более биодружественных альтернатив15, их влияние, если таковое имеется, на качество экстрагированных нуклеиновых кислот еще предстоит определить. - Поместите незапятнанные слайды FFPE, установленные на ткани, в стеклянные слайд-стойки Coplin (рисунок 4A, вставка).
- Погружайте стеллажные горки в промывку d-Limonene 1 на 2 мин; осторожно перемешивайте в течение первых 20 секунд.
ПРИМЕЧАНИЕ: Чтобы свести к минимуму перенос между стирками, при извлечении стойки с горками из стирки дайте стойке ненадолго стечь, прежде чем осторожно смазать дно стойки на папиросной бумаге, чтобы удалить лишнюю стирку. - Погружайте стеллажные горки в неразбавленную промывку D-Лимонена 2 на 2 мин; осторожно перемешивайте в течение первых 20 секунд. Снимите, слейте воду и снова смажьте стойку.
- Погружайте стеллажные горки в промывку этанола на 2 мин; осторожно перемешивайте в течение первых 20 секунд. Снимите стойку и поместите ее на абсорбирующую ткань для слива. Дайте горкам высохнуть на воздухе не менее 10 мин, но не более 2 ч.
3. Макродиссекция
- На скамейке предварительно наполните стеклянную банку Coplin 50 мл 3% глицерина в воде, свободной от ДНКазы/РНКазы.
ПРИМЕЧАНИЕ: Замените глицериновую стирку после каждых 40 слайдов. - Предварительно маркировать и предварительно заполнять микротрубки 1,5 мл 160 мкл буфера тканевого пищеварения на микротрубку.
ПРИМЕЧАНИЕ: Экстракция нуклеиновых кислот, выполняемая после макродиссекции, использовала набор для экстракции ДНК/РНК FFPE (Таблица материалов). Таким образом, тканевый буфер пищеварения, используемый в этом протоколе, содержал 10 мкл протеиназы K и 150 мкл буфера PKD. - Проследите патологические отметины на H&E на задней части депарафинизированных тканевых слайдов.
ПРИМЕЧАНИЕ: По сравнению с недепарафинизированными тканями (рисунок 3, строка 2 и рисунок 4B), депараффинизированные ткани имеют белый цвет и хорошо видны (рисунок 3, строка 3 и рисунок 4C). Именно эта повышенная видимость и различимость депарафинизированных тканей позволяют макродиссекции. Поместите H&E лицевой стороной вниз на скамейку и поместите переднюю часть депарафинизированного слайда против спины соответствующего патологоанатома, рассмотренного H&E (рисунок 4D). Выровняйте депарафинизированную ткань с тканью H&E (рисунок 4E). Отслеживание маркировки патологоанатома является критическим шагом в процессе макродиссекции, и следует позаботиться о том, чтобы воспроизвести эти отметки как можно точнее. Это может быть особенно сложно для небольших и/или разрозненных тканей, таких как образцы B, D и E (рисунок 3, рисунок 4E и вставка i на рисунке 4E ). Чтобы облегчить трассировку, следует использовать чернильный тонкий или ультратонкий маркер (рисунок 4E, вставка II), чтобы проследить нарисованные патологоанатомом маркировки. Салфетки с этанолом могут быть полезны для устранения ошибок и при необходимости позволяют отследить их. - Поверните теперь отмеченную депарафинизированную ткань слайда лицевой стороной вверх и проведите линию маркера углом чистого лезвия бритвы, чтобы предварительно срезать края области опухоли.
- Обрабатывая каждый слайд последовательно, окуните депарафинизированные слайды в 3% раствор глицерина. Убедитесь, что ткань полностью погружена, прежде чем медленно удалять слайд (рисунок 4F).
ПРИМЕЧАНИЕ: Цель глицеринового погружения состоит в том, чтобы ослабить ткань, чтобы помочь сбору тканей, а также уменьшить накопление статического заряда, который может вызвать отталкивание между тканью и пластиковой микротрубкой, в которую должна быть помещена собранная ткань. - Аккуратно протрите заднюю часть горки салфеткой, чтобы удалить лишний раствор глицерина, и уложите горку на скамейку, протерев стороной вниз. Дайте тканям ненадолго проветриться в течение 1-2 мин.
ПРИМЕЧАНИЕ: Перенос избытка глицерина в процесс экстракции может негативно повлиять на выход и качество экстракции нуклеиновых кислот. Ткани должны быть слегка влажными, но не видимо влажными при сборе. - В зависимости от того, где область опухоли, представляющая интерес, расположена на слайде, используйте плоский край лезвия бритвы, чтобы либо (а) непосредственно собрать опухолевую ткань, используя бритву, чтобы соскоблить / собрать интересующую ткань со слайда, или (б) сначала удалить и выбросить неопухолевую ткань, прежде чем собирать интересующую опухолевую ткань (рисунок 3).
ПРИМЕЧАНИЕ: Собранная ткань имеет тенденцию собираться или сворачиваться в нижней части лезвия (рисунок 4G) - Используйте деревянную палочку, чтобы удалить собранную ткань из лезвия (рисунок 4H и вставка) и перенести ее в соответствующую предварительно маркированную и предварительно заполненную микропробирку (рисунок 4I).
ПРИМЕЧАНИЕ: Буфер пищеварения служит для «вытягивания» ткани из деревянной кирки в жидкость. - Приступайте к экстракции нуклеиновых кислот.
ПРИМЕЧАНИЕ: Экстракция нуклеиновых кислот была завершена с использованием набора для экстракции ДНК / РНК FFPE в соответствии с инструкциями производителя, и полученные нуклеиновые кислоты были количественно определены с использованием спектрофотометра UV-vis. Полученная РНК была запущена на цифровом анализе DLBCL90 на основе профилирования генов16.
Результаты
В общей сложности было разделено 5 тканевых блоков диффузной большой В-клеточной лимфомы (DLBCL) FFPE, и полученные участки были либо макродиссечены, либо нет до экстракции нуклеиновых кислот. Извлеченная РНК была запущена на анализе DLBCL9016. Макродиссекции образцов были запущены дважды, один раз с использованием 5 мкл концентрации запаса РНК, но не более 300 нг от общего входа РНК и один раз с использованием 5 мкл запаса РНК, разбавленного для соответствия входам РНК их соответствующих нерасфеченных аналогов. Результаты DLBCL90 приведены в таблице 2.
DLBCL состоит из 3 различных подтипов клеток происхождения (COO) с различной терапевтической реакцией, а именно GCB, ABC и промежуточной группы, известной как неклассифицированная или UNC17,18. Транслокации с участием MYC, BCL2 и или BCL6 отдельно или в комбинации (двойное или тройное попадание) также часто наблюдаются в DLBCL, особенно в подтипе GCB19. Анализ DLBCL90 является расширением своего предшественника, клинического анализа Lymph2Cx, и, таким образом, способен определять подтип DLBCL COO, но был в основном разработан для идентификации образцов, содержащих транслокации двойного попадания (DH) с участием BCL2 с использованием цифровой экспрессии генов в качестве альтернативы флуоресцентной гибридизации in-situ (FISH)16,20. Результаты в таблице 2 показывают, что макродиссекция изменила либо coo, либо статус DHITsig требует 60% (3/5) исследуемых образцов.
Макродиссекция образца A не повлияла на вызов COO, но изменила вызов DHITsig с NEG на UNCLASS, и это изменение наблюдалось независимо от макрорассектированного входа РНК образца и с аналогичными показателями вероятности (0,224, 0,254). Напротив, макродиссекция образца C не повлияла на вызов DHITsig, но изменила вызов COO с GCB на UNC. Опять же, это изменение наблюдалось независимо от макрорассектированного входа образца РНК. Однако при 0,117 вероятность вызова главного операционного директора была ближе к порогу вызова 0,1 для макрорассектированной выборки с уменьшенным входом РНК. Подобно образцу A, макродиссекция образца E не повлияла на вызов COO, но изменила вызов DHITsig. Однако для образца E вызов изменился с UNCLASS на NEG и сделал это независимо от макрораспределенного образца РНК с достаточно похожими вероятностными вызовами (0,849, 0,833). Примечательно, что это изменение вызова на DHITsig NEG имеет биологический смысл, учитывая, что образец E был обнаружен в ABC-DLBCL, а транслокации двойного попадания с участием BCL2, как сообщается, наблюдаются исключительно в GCB-DLBCL19.

Рисунок 1: Создание скользящих участков ткани с использованием микротома. (A) Тканевый блок FFPE удерживается на месте микротомным патроном и разрезается для получения ленты последовательных участков ткани FFPE. (B) С помощью предварительно пропитанных деревянных палочек лента собирается из микротома и переносится на ванну с теплой водой. (C) Тепло воды помогает сгладить складки в тканевой ленте. (D) Отдельные участки ткани FFPE удаляются из тканевой ленты путем размещения закрытых щипцов на стыке двух секций и осторожного открытия щипцов, что отделяет участки друг от друга. (E) Секции собираются из воды путем погружения стеклянной горки под углом и осторожного перемещения стороны к сечению ткани до тех пор, пока край секции не коснется стеклянного предметного стекла. (F) Как только слайд и секция соприкасаются, медленно извлеките горку из воды, позволяя участку ткани упасть вровень с горкой. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Патология и гистологический обзор окрашенных участков гематоксилина и эозина (H & E). (A, B) Участок ткани H & E подвергается микроскопическому обзору сертифицированным патологоанатомом. (С,Г) Как только патологоанатом осмотрел всю ткань и обнаружил, что это не 100% опухолевая ткань, патологоанатом будет использовать маркер для окружения опухолевой области ткани. (Э,Ф) Удержание маркированного H & E против исходного тканевого блока FFPE показывает, что не вся ткань является опухолевым материалом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
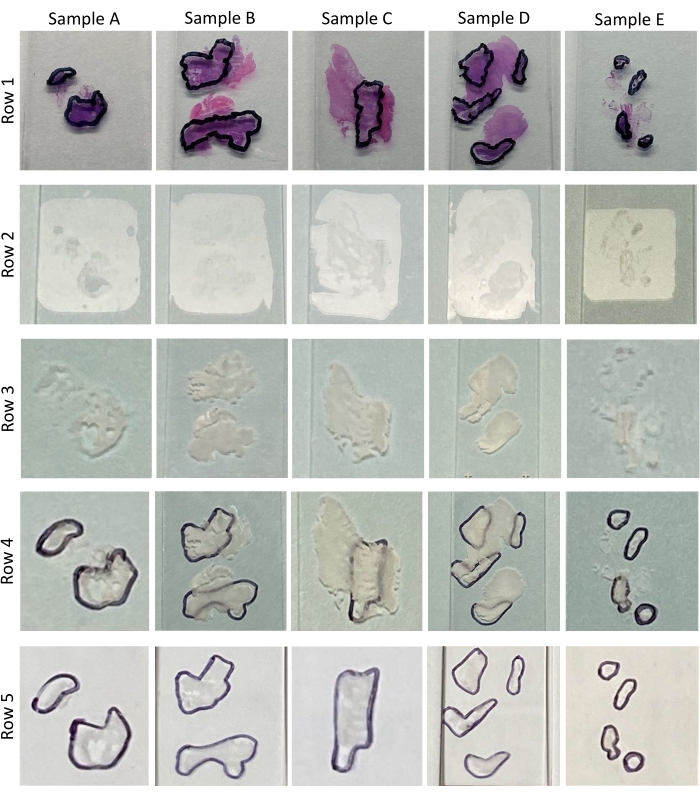
Рисунок 3: Образцы тканей. Это изображение демонстрирует патологически рассмотренные и помеченные опухолью H&Es (Ряд 1), необработанные скользящие участки тканей FFPE (Ряд 2), депарафинизированные скользящие участки тканей FFPE (Ряд 3), депарафинизированные скользящие участки ткани FFPE с патологическими маркировками, прослеживаемыми на задней части слайда (Ряд 4), депарафинизированные и макрорассекционные скользящие участки тканей FFPE (Ряд 5) для 5 образцов (A-E), используемых для демонстрации этого протокола. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Депарафинизация и макродиссекция участков тканей FFPE: (A) В вытяжном шкафу ткани FFPE, установленные в скользящей стойке, промываются в двух промывках d-лимонена и одной промывке этанола. (В,С) После стирки весь парафин был удален, и на слайде осталась только ткань, которая теперь белая и хорошо видна по сравнению с ее предварительно промытым аналогом. (D) Депарафинизированный скользящий участок ткани помещается лицевой стороной вниз на задней части его соответствия с маркировкой H & E. (E) Маркировка опухолевой области на H & E затем прослеживается на задней части депарафинизированного слайда с использованием тонкого или ультратонкого перманентного маркера (F) Отмеченный депарафинизированный участок ткани, установленный на слайде, затем погружается в глицериновую промывку, чтобы ослабить участок ткани для сбора. Слайд медленно удаляется из глицерина, а задняя часть слайда протирается салфеткой, чтобы удалить избыток глицерина, прежде чем положить ткань слайда лицевой стороной вверх на скамейку. (G) Используя плоскую сторону чистого лезвия бритвы, ткань макрорассекается, а нежелательная ткань вне маркировки патологоанатома отбрасывается перед сбором интересующей ткани, которая собирается вдоль края лезвия. (H) Деревянная палочка используется для удаления собранной ткани с края лезвия. (I) Затем ткань переносится в предварительно маркированный буфер переваривания ткани микротрубки и готова к экстракции нуклеиновых кислот. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Идентификатор образца | Цельная ткань (а) | Обведенная область ткани (b) | Общее содержание опухоли в целой ткани (c) | Складное увеличение опухолевого содержания путем макродиссекции (d) | Не макрораспределен (e) | Макрораспределение (f) | ||||
| % Жизнеспособная опухоль | % Другие | % Жизнеспособная опухоль | % Другие | Количество извлеченных слайдов размером 5 мкм | Конк РНК (нг/мкл) | Количество извлеченных слайдов размером 5 мкм | РНК конк (нг/мкл) | |||
| Образец A | 60 | 40 | 75 | 25 | 45 | 1.7 | 2 | 19.0 | 4 | 58.3 |
| Образец B | 60 | 40 | 65 | 35 | 39 | 1.7 | 1 | 34.0 | 2 | 60.0 |
| Пример C | 40 | 60 | 65 | 35 | 26 | 2.5 | 1 | 13.7 | 2 | 46.2 |
| Образец D | 35 | 65 | 90 | 10 | 32 | 2.9 | 1 | 57.3 | 2 | 60.0 |
| Образец E | 20 | 80 | 30 | 70 | 6 | 5.0 | 3 | 25.2 | 3 | 44.6 |
Таблица 1: Данные обзора патологии. В таблице показано (a) процент жизнеспособной опухоли во всем участке ткани по областям, (b) процент жизнеспособной опухоли в области, обведенной / отмеченной патологоанатомом во время обзора по клеточности, (c) предполагаемая общая клеточность опухоли всей ткани (a x b), (d) предполагаемое увеличение клеточности опухоли, достигнутое с помощью макродиссекции, (e и f) количество извлеченных 5 мкм неокрашенных участков тканей, установленных на слайдах FFPE, и результирующие концентрации РНК для соответствующих немакроссекторных и макродиссектированных образцов. % Другое относится ко всем другим тканям, присутствующим в данном образце, которые не являются опухолевой тканью и могут включать соединительную ткань, стромальные фибробласты, кровеносные сосуды, а также другие присущие стромальные элементы. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
| Идентификатор образца | Вход РНК (нг) | Вызов главного операционного директора DLBCL90 | Вероятность вызова DLBCL90 | Звонок DHITsig | DHITsig pos вероятность | Вероятность DHITsig neg | |
| Не макроразделено | Образец A | 95.0 | ГКБ | 0.000 | Отрицательный | 0.135 | 0.865 |
| Образец B | 170.0 | ГКБ | 0.000 | Отрицательный | 0.032 | 0.968 | |
| Пример C | 68.5 | ГКБ | 0.028 | Отрицательный | 0.033 | 0.967 | |
| Образец D | 286.5 | Азбука | 0.998 | Отрицательный | 0.002 | 0.998 | |
| Образец E | 126.0 | Азбука | 0.989 | ЮНКЛАСС | 0.212 | 0.788 | |
| Макрораспределение | Пример A_M | 291.7 | ГКБ | 0.000 | ЮНКЛАСС | 0.224 | 0.776 |
| Пример B_M | 300.0 | ГКБ | 0.000 | Отрицательный | 0.016 | 0.984 | |
| Пример C_M | 231.2 | ЮНКЛАСС | 0.210 | Отрицательный | 0.015 | 0.985 | |
| Пример D_M | 300.0 | Азбука | 0.999 | Отрицательный | 0.002 | 0.998 | |
| Пример E_M | 223.2 | Азбука | 0.987 | Отрицательный | 0.151 | 0.849 | |
| Макрорассещенный и разбавленный РНК | Пример A_M | 95.0 | ГКБ | 0.000 | ЮНКЛАСС | 0.254 | 0.746 |
| Пример B_M | 170.0 | ГКБ | 0.000 | Отрицательный | 0.023 | 0.977 | |
| Пример C_M | 68.5 | ЮНКЛАСС | 0.117 | Отрицательный | 0.027 | 0.973 | |
| Пример D_M | 286.5 | Азбука | 0.999 | Отрицательный | 0.002 | 0.998 | |
| Пример E_M | 126.0 | Азбука | 0.995 | Отрицательный | 0.167 | 0.833 | |
Таблица 2: Результаты цифрового анализа экспрессии генов DLBCL90. Пять образцов (A-E) были либо не макрорассекнуты, либо макрорассекнуты до того, как была выполнена экстракция нуклеиновых кислот. Полученная РНК была запущена на анализе DLBCL90, для которого максимальный входной объем РНК составляет 5 мкл. Немакроссекции образцы были запущены с использованием 5 мкл запасной РНК. Каждый макрорасщепленный образец запускали дважды с использованием (а) 5 мкл исходной РНК, если только не были возможны аликвоты 60 нг/мкл и (б) 5 мкл исходной РНК, разбавленной для соответствия концентрациям/входу их нема макрорассекционных аналогов. Суффикс _M означает, что этот образец был макрораспределен. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Ткани FFPE часто представляют собой гетерогенные примеси опухолевых и неопухолевых тканей. Высокочувствительные геномные тесты становятся все более распространенными как в клинических, так и в исследовательских условиях, но могут быть сбиты с толку наличием загрязняющей неопухолевой ткани. Действительно, минимальное содержание опухоли в 60% часто рекомендуется для геномных исследований. Процентное содержание опухоли может быть определено площадью ткани, занятой опухолевым материалом, или долей опухолевых клеток внутри ткани. Хотя опухоль по площади является широко используемой метрикой чистоты опухоли, она не всегда изображает точное описание ткани. Рассмотрим две ткани, обе с 1000 клетками, из которых 500 являются опухолевыми клетками. В ткани А 500 неопухолевых клеток представляют собой стромальные клетки с объемами, аналогичными объемам опухолевой клетки. В этой ткани процент опухоли можно считать 50% как по клеточности, так и по площади. В ткани B 500 неопухолевых клеток представляют собой жировые клетки с объемами, которые в 4 раза больше, чем опухолевые клетки. В этой ткани процент опухоли по-прежнему составляет 50% по клеточности, но 20% по площади. Третья ткань, ткань С, состоит из 500 опухолевых клеток плюс 400 жировых клеток и 800 стромальных клеток с объемами, которые в 4 и 0,5 раза больше, чем опухолевые клетки, соответственно. Учитывая, что 100 жировых клеток равны объему 800 стромальных клеток, процент опухоли ткани С составляет 29% по клеточности (500/1700), но все же 20% по площади. Ткань D также состоит из опухолевых, жировых и стромальных клеток с объемными соотношениями 1x, 4x и 0,1x. Однако количество клеток составляет 400, 10 и 720 соответственно. Таким образом, процент опухоли ткани D составляет 35% по клеточности (400/1130), но 78% по площади. Эти примеры чрезмерно упрощены и не отражают реальных тканевых композиций, но ясно передают важность состава ткани и разницу между содержанием опухоли по площади и по клеточности. Важно отметить, что когда дело доходит до обогащения содержания опухоли для последующей экстракции нуклеиновых кислот, клеточность опухоли является более важным атрибутом из-за повышенного смешивающего потенциала извлечения геномного материала из большего количества неопухолевых клеток, чем опухолевых клеток. Это не только подчеркивает необходимость оценки опухолевого содержания тканей с точки зрения процентной клеточности, но и необходимость иссечения нежелательной ткани, чтобы свести к минимуму любые потенциальные негативные последствия неопухолевой ткани. Существует несколько методов обогащения тканей, основными из которых являются макродиссекция и микродиссекция.
Макродиссекция, метод, описанный в этом протоколе, является относительно быстрым, простым и не требует дорогостоящего или специализированного оборудования. Хотя макродиссекция может значительно улучшить содержание опухоли, важно понимать, что она не полностью устраняет неопухолевой материал. Целью макродиссекции является достаточное обогащение интересующей ткани путем исключения нежелательной ткани, чтобы уменьшить «шум», исходящий от нежелательной ткани, что, в свою очередь, может усилить сигнал интереса от интересующей ткани. Таким образом, макродиссекционное опосредованное обогащение опухоли является способом повышения отношения сигнал/шум с целью лучшего обнаружения маркеров, представляющих интерес, особенно опухолеспецифических молекулярных маркеров с низким содержанием или плохой экспрессией. Тем не менее, макродиссекция имеет ограничения из-за отсутствия точности, предлагаемой грубыми инструментами, такими как лезвия бритвы, и подвержена проблемам точности, связанным с толщиной линии маркера патологоанатома, а также потенциальным ошибкам при отслеживании демаркаций H &E патологоанатомов. Как упоминалось выше, невозможно достичь 100% чистоты опухоли из-за наличия присущих и вызывающих опухоль стромальных элементов (то есть соединительной ткани, стромальных фибробластов, кровеносных сосудов, доброкачественных реактивных лимфоцитов, макрофагов), встроенных в саму опухоль. Действительно, многие инвазивные или диффузно инфильтративные злокачественные новообразования вызывают устойчивый десмопластический стромальный ответ, в результате чего образуются кластеры опухолевых клеток, которые тесно смешиваются со стромальными фибробластами и другими неопухолевыми типами клеток; где опухоли, связанные с этой картиной стромальной реакции, такие как ткани рака поджелудочной железы21, могут в большей степени выигрывать от микродиссекции с цифровым управлением, а не от ручной макродиссекции.
Ручная микродиссекция выполняется под микроскопом для облегчения идентификации, рассечения и выделения тканей специфических клеток или популяций с использованием иглы или скальпеля и имеет преимущество повышенной точности по сравнению с макродиссекцией22. Тем не менее, ручная микродиссекция является трудоемким процессом, которому не хватает утонченности, необходимой для сложных тканей с низким содержанием опухоли или сложными особенностями, несовместимыми с ручной рассечением. Такие ткани могут быть рассечены с использованием высокоточных автоматизированных методов, таких как микродиссекция лазерного захвата. Действительно, было показано, что микродиссекция с цифровым управлением дает более высокий процент содержимого опухоли по сравнению с ручной макродиссекцией в тканях рака поджелудочной железы23. Однако недостатки этих высокоточных автоматизированных методов, такие как потребность в специализированном, дорогостоящем оборудовании и высококвалифицированных специалистах, препятствуют его включению в рабочие процессы. Исследование, проведенное de Bruin et al., сравнивающее влияние макродиссекции и микродиссекции лазерного захвата (LCM) на профилирование экспрессии генов, показало, что образцы LCM имели низкий общий выход РНК (30 нг в среднем) и требовали двух раундов амплификации мРНК для достижения порога входа24 подготовки библиотеки кДНК. Авторы обнаружили, что результирующие профили экспрессии генов LCM были затронуты раундами амплификации мРНК больше, чем макрорассекционные профили были затронуты неопухолевыми стромальными вкладами, и пришли к выводу, что макродиссекция может быть адекватно использована для получения надежных данных экспрессии генов24.
Существенным преимуществом профилирования экспрессии цифровых генов NanoString, особенно при работе с сильно деградированной РНК, полученной из FFPE, является то, что оно не требует ферментативно-зависимых процессов, таких как амплификация РНК или подготовка библиотек кДНК. Тем не менее, анализы обычно оптимизированы для входов между 50-300 нг общей РНК25,26, которые, основываясь на выводах de Bruin et al.24, могут быть несовместимы с микродиссеченными тканями без увеличения тканевого входа; неблагоприятный спрос в эпоху, когда образцы тканей все чаще собираются в виде небольших биопсий, а не хирургических резекций. Входные данные РНК, используемые для анализа DLBCL90, варьировались от 68,5 до 300 нг как для макродиссеченных, так и для нерасфеченных тканей. Результаты показывают, что макродиссекция привела к изменениям вызовов в 60% исследованных образцов и что эти изменения наблюдались независимо от входа РНК макрорассектированных образцов. Тем не менее, вероятность COO для низкого входа РНК действительно посягала на порог вероятности вызова COO GCB / UNC, где пороговые значения составляют от 0 до <0,1 для GCB, 0,1-0,9 для UNC и >0,9 до 1,0 для вызовов ABC20. Основными подтипами DLBCL COO являются GCB и ABC, которые составляют 41% и 44% всех случаев DLBCL, причем UNC представляет собой промежуточную группу из двух, а ABC - наиболее агрессивные 20,27. Таким образом, в то время как изменение вызова COO при макродиссекции образца C не вызвало откровенного изменения подтипа COO с GCB на ABC, изменение от GCB к UNC может указывать на сдвиг в сторону более агрессивного заболевания. Более того, недавние исследования показывают, что подтип UNC является не просто промежуточным подтипом и что он может потенциально обладать подтип-специфическими терапевтически эксплуатируемыми атрибутами28. Аналогичным образом, макродиссекция образцов A и E не вызывала откровенных изменений в вызовах DHITsig от DH отрицательного к DH положительному, или наоборот. Однако перемещения образца GCB (образец A) из NEG в UNCLASS и образца ABC (образец E) из UNCLASS в NEG при макродиссекции являются биологически приемлемыми, поскольку транслокации двойного попадания с участием BCL2, как сообщается, являются исключительно феноменом GCB19. Хотя транслокации традиционно и повсеместно обнаруживаются FISH в клинических условиях, растет импульс к выявлению альтернативного менее сложного и трудоемкого метода их обнаружения. Анализ DLBCL90 является важным инструментом, который удовлетворяет эту потребность, где обоснование его использования подкрепляется выводом о том, что этот анализ способен обнаруживать транслокации, загадочные для зондов FISH, используемых в клинической диагностике29.
Протокол макродиссекции, описанный выше, описывает простой метод, который позволяет исследователям увеличить содержание опухоли в образцах тканей, которые обычно опускаются ниже обычно используемых пороговых значений критериев включения в исследование. Включение макродиссекции в рабочий процесс исследования позволяет исследователям спасать плохо плотные опухолями ткани от исключения исследования путем увеличения их опухолевого содержания. В свою очередь, это позволяет повысить уверенность в том, что полученные элюаты РНК и ДНК представляют собой опухоль, исследуемую геномом. Хотя существуют и другие более точные методы рассечения тканей, для опухолей, которые растут более экспансивным, неинфильтративным, листовидным или твердым образом, макродиссекции, вероятно, достаточно. Представленные здесь результаты подчеркивают важность чистоты опухоли в геномных анализах и макродиссекции как надежного инструмента для достижения этого.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа поддерживается финансируемым NIH Ресурсом образцов СПИДа и рака (ACSR, UM1 CA181255-2) в рамках своей научной программы по биообразцам. Видео было снято, а пост-продакшн монтаж был выполнен Mayo Clinic Media Services.
Материалы
| Name | Company | Catalog Number | Comments |
| 200-proof ethanol | Decon | 2701 | |
| AllPrep DNA/RNA FFPE Kit | Qiagen | 80234 | DNA/RNA FFPE extraction kit |
| Coplin pots | Various | x | |
| DLBCL90 probes | NanoString | various | Digital gene expression profiling based DLBCL90 assay |
| d-Limonene | VWR | 89376-092 | |
| Forceps | Various | x | |
| Glass micrscope slides | FisherBrand | 12-550-15 | |
| Glycerol | VWR | 0854-1L | |
| Master kits | NanoString | various | |
| Microtome | Leica | RM2265 | |
| Microtubes | Ambion | AM12400 | |
| NanoDrop One | Thermo Scientific | ND-ONE-W | Spectrophotometer for DNA, RNA and protein qualitation |
| nCounter | NanoString | x | Digital gene expression profiling platform used to run the DLBCL90 assay |
| Permanent marker | Electrib Microscope Sciences | 72109-12 | |
| Razor blade dispenser | Electrib Microscope Sciences | 71985-10 | |
| Razor blades | Electrib Microscope Sciences | 71985-23 | |
| Tissue digestion buffer | Qiagen | 80234 | |
| Ultrapure water | VWR | SH30538.02 | |
| Waterbath | Triangle Biomedical Sciences | TFB-120 | |
| Wooden stick | FisherBrand | 22363158 |
Ссылки
- Mathieson, W., Thomas, G. A. Why formalin-fixed, paraffin-embedded biospecimens must be used in genomic medicine: An evidence-based review and conclusion. Journal of Histochemistry and Cytochemistry. 68 (8), 543-552 (2020).
- Robetorye, R. S., Maguire, A., Rosenthal, A. C., Rimsza, L. M. Profiling of lymphoma from formalin-fixed paraffin-embedded tissue. Seminars in Hematology. 56 (1), 46-51 (2019).
- Moorcraft, S. Y., Gonzalez, D., Walker, B. A. Understanding next generation sequencing in oncology: A guide for oncologists. Critical Reviews in Oncology/Hematology. 96 (3), 463-474 (2015).
- Haile, S., et al. Automated high throughput nucleic acid purification from formalin-fixed paraffin-embedded tissue samples for next generation sequence analysis. PLoS One. 12 (6), 0178706 (2017).
- Oh, E., et al. Comparison of accuracy of whole-exome sequencing with formalin-fixed paraffin-embedded and fresh frozen tissue samples. PLoS One. 10 (12), 0144162 (2015).
- Holley, T., et al. Deep clonal profiling of formalin fixed paraffin embedded clinical samples. PLoS One. 7 (11), 50586 (2012).
- . TCGA Tissue sample requirements: High quality requirements yield high quality data Available from: https://www.cancer.gov/about-nci/organization/ccg/structural-genomics/tcga/studied-cancers (2021)
- Javey, M., et al. Innovative tumor tissue dissection tool for molecular oncology diagnostics. The Journal of Molecular Diagnostics: JMD. 23 (4), 399-406 (2021).
- Feldman, A. T., Wolfe, D. Tissue processing and hematoxylin and eosin staining. Methods in Molecular Biology. 1180, 31-43 (2014).
- Duan, Q., Zhang, H., Zheng, J., Zhang, L. Turning cold into hot: Firing up the tumor microenvironment. Trends in Cancer. 6 (7), 605-618 (2020).
- Kim, Y. W., et al. Safety evaluation and risk assessment of d-Limonene. Journal of Toxicology and Environmental Health Part B: Critical Reviews. 16 (1), 17-38 (2013).
- Foti, C., et al. Occupational contact dermatitis to a limonene-based solvent in a histopathology technician. Contact Dermatitis. 56 (2), 109-112 (2007).
- Meuse, C. W., Barker, P. E. Quantitative infrared spectroscopy of formalin-fixed, paraffin-embedded tissue specimens: paraffin wax removal with organic solvents. Applied Immunohistochemistry and Molecular Morphology. 17 (6), 547-552 (2009).
- Schmeller, J., et al. Setting out the frame conditions for feasible use of FFPE derived RNA. Pathology - Research and Practice. 215 (2), 381-386 (2019).
- Prema, V., et al. Biofriendly substitutes for xylene in deparaffinization. Journal of Pharmacy and Bioallied Sciences. 12, 623-630 (2020).
- Ennishi, D., et al. Double-hit gene expression signature defines a distinct subgroup of germinal center B-cell-like diffuse large B-cell lymphoma. Journal of Clinical Oncology. 37 (3), 190-201 (2019).
- Alizadeh, A. A., et al. Distinct types of diffuse large B-cell lymphoma identified by gene expression profiling. Nature. 403 (6769), 503-511 (2000).
- Rosenwald, A., et al. The use of molecular profiling to predict survival after chemotherapy for diffuse large-B-cell lymphoma. The New England Journal of Medicine. 346 (25), 1937-1947 (2002).
- Scott, D. W., et al. High-grade B-cell lymphoma with MYC and BCL2 and/or BCL6 rearrangements with diffuse large B-cell lymphoma morphology. Blood. 131 (18), 2060-2064 (2018).
- Scott, D. W., et al. Determining cell-of-origin subtypes of diffuse large B-cell lymphoma using gene expression in formalin-fixed paraffin-embedded tissue. Blood. 123 (8), 1214-1217 (2014).
- Heinrich, M. A., Mostafa, A., Morton, J. P., Hawinkels, L., Prakash, J. Translating complexity and heterogeneity of pancreatic tumor: 3D in vitro to in vivo models. Advanced Drug Delivery Reviews. 174, 265-293 (2021).
- Erickson, H. S., Gillespie, J. W., Emmert-Buck, M. R. Tissue microdissection. Methods in Molecular Biology. 424, 433-448 (2008).
- Geiersbach, K., et al. Digitally guided microdissection aids somatic mutation detection in difficult to dissect tumors. Cancer Genetics. 209 (1-2), 42-49 (2016).
- de Bruin, E. C., et al. Macrodissection versus microdissection of rectal carcinoma: minor influence of stroma cells to tumor cell gene expression profiles. BMC Genomics. 6, 142 (2005).
- Ramsower, C. A., et al. Clinical laboratory validation of the MCL35 assay for molecular risk stratification of mantle cell lymphoma. Journal of Hematopathology. 13 (4), 231-238 (2020).
- Maguire, A., et al. Enhanced DNA repair and genomic stability identify a novel HIV-related diffuse large B-cell lymphoma signature. International Journal of Cancer. 145 (11), 3078-3088 (2019).
- Rosenwald, A., Staudt, L. M. Gene expression profiling of diffuse large B-cell lymphoma. Leukemia & Lymphoma. 44, 41-47 (2003).
- Wright, G. W., et al. A probabilistic classification tool for genetic subtypes of diffuse large B cell lymphoma with therapeutic implications. Cancer Cell. 37 (4), 551-568 (2020).
- Hilton, L. K., et al. The double-hit signature identifies double-hit diffuse large B-cell lymphoma with genetic events cryptic to FISH. Blood. 134 (18), 1528-1532 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены