このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
次世代シーケンシングのためのマウス網膜内皮細胞の単離
要約
このプロトコルは、細胞収量、純度、および生存率に最適化されたマウス生後網膜内皮細胞の単離方法について説明しています。これらの細胞は、次世代シーケンシングアプローチに適しています。
要約
次世代シーケンシングの最近の改善により、分子生物学および細胞生物学に関する研究者の知識が進歩し、いくつかの研究により血管生物学の新しいパラダイムが明らかになりました。これらの方法を血管発生のモデルに適用するには、胚および出生後の組織からの細胞分離技術の最適化が必要です。細胞収量、生存率、純度はすべて、次世代シーケンシングアプローチから正確で再現性のある結果を得るために最大である必要があります。新生児マウス網膜血管新生モデルは、血管発生のメカニズムを研究するために研究者によって使用されます。研究者は、このモデルを使用して、血管形成および成熟中の血管新生および動脈静脈運命の仕様のメカニズムを調査しました。次世代シーケンシング技術を適用して網膜血管発生モデルを研究するには、細胞収量、生存率、および純度を最大化する網膜内皮細胞の単離方法の最適化が必要です。このプロトコルは、蛍光活性化セルソーティング(FACS)を使用したマウス網膜組織の単離、消化、および精製の方法について説明しています。結果は、FACS精製CD31+/CD45-内皮細胞集団が内皮細胞の遺伝子発現に対して高度に濃縮されており、FACS後60分間生存率に変化を示さないことを示しています。バルクRNAシーケンシングやシングルセルRNAシーケンシングなど、この方法を使用して単離された内皮細胞に対する次世代シーケンシングアプローチの代表的な結果が含まれており、網膜内皮細胞単離のためのこの方法が次世代シーケンシングアプリケーションと互換性があることを示しています。網膜内皮細胞単離のこの方法は、血管発生の新しいメカニズムを明らかにするための高度なシーケンシング技術を可能にします。
概要
次世代シーケンシングアプローチによる核酸シーケンシングのハイスループット能力は、分子生物学および細胞生物学に関する研究者の知識を大幅に進歩させました。これらの高度な技術には、全トランスクリプトームRNAシーケンシング、一塩基多型(SNP)を特定するための標的領域のDNAシーケンシング、クロマチン免疫沈降(ChIP)シーケンシングにおける結合転写因子のDNAシーケンシング、またはトランスポザーゼアクセスクロマチンシーケンシング(ATAC)シーケンシングのアッセイにおけるオープンクロマチン領域、およびシングルセルRNAシーケンシングが含まれます1.血管生物学では、これらの進歩により、研究者は発生と疾患の複雑なメカニズムを解明し、さまざまな表現型の連続体に沿って遺伝子発現パターンを区別することができました2,3。将来の実験では、次世代シーケンシングと血管発生の評価モデルを組み合わせることで複雑なメカニズムをさらに定義できますが、サンプル調製の方法は高度なシーケンシング技術と互換性がある必要があります。
次世代シーケンシングアプローチの品質、精度、再現性は、サンプル調製の方法によって異なります。細胞のサブセットを単離したり、組織から単一細胞懸濁液を生成したりする場合、細胞集団の細胞数、生存率、および純度を最大化するには、最適な消化および精製方法が不可欠です4,5。これには消化方法のバランスが必要です:組織から細胞を放出し、下流のアプローチに十分な細胞を得るためには強力な消化が必要ですが、消化が強すぎると細胞の生存率に悪影響を及ぼします6,7。さらに、細胞集団の純度は、堅牢な結果とデータの正確な分析に必要であり、FACSを通じて達成できます。これは、血管発生の確立されたモデルに次世代シーケンシングを適用するために、細胞分離方法を最適化することの重要性を浮き彫りにしています。
血管の発達を調べるための十分に特徴付けられたモデルは、マウス網膜血管発達モデルです。マウス網膜血管系は出生後に2次元の表在神経叢で発達し、出生後(P)3に視神経からの最初の血管新生が見られ、P6に茎細胞と先端細胞を伴う血管新生前部と初期血管成熟が見られ、P9後に血管叢の成熟が見られます8,9。初期血管神経叢のリモデリングの間、内皮細胞は、循環ネットワークを生成するために、異なる血管における動脈、毛細血管、および静脈表現型に向かって仕様化を受ける10、11。したがって、この方法は、研究者が血管新生血管叢形成および内皮動脈静脈の仕様および成熟を、発生中の様々な時点で視覚化することを可能にする9。さらに、このモデルは、血管新生および血管神経叢の発達に対するトランスジェニック操作の影響を調べるための方法を提供し、血管の発達、動脈静脈奇形、および酸素誘発性血管新生の研究に適用されています12,13,14,15,16。.次世代シーケンシングアプローチとマウス網膜血管発生モデルを組み合わせるには、網膜組織から内皮細胞を単離するための最適化されたプロトコルが必要です。
このプロトコルは、細胞収量、純度、および生存率を最大化するために、P6でマウスの網膜組織を消化するための最適化された方法を説明しています。網膜組織をP6マウスから単離し、20分間消化し、CD31およびCD45について免疫染色し、FACSを通して精製して、約2.5時間で内皮細胞の単一細胞懸濁液を単離した(図1A)。これらの内皮細胞は、単離後60分間高い生存率を維持することが判明し17、次世代シーケンシング法のためのライブラリ調製を可能にしました。さらに、この分離プロトコルを使用した2つの別々の次世代シーケンシングメソッド(全トランスクリプトームRNAシーケンシングとシングルセルRNAシーケンシング)からのFACSゲーティングおよび品質管理結果に関する代表的な結果が得られます。この方法により、次世代シーケンシングアプローチを網膜血管新生モデルと組み合わせて使用することで、血管発生の新しいメカニズムを解明することができます。
Access restricted. Please log in or start a trial to view this content.
プロトコル
イェール大学とバージニア大学の施設動物管理および使用委員会は、このプロトコルに記載されているすべての動物実験を承認しました。
1.網膜分離のためのマウスの目を取得します
- 氷冷PBSを1回調製し、48ウェルプレートの各ウェルに500 μLを加えます。
- 承認された施設のガイドラインに従って、生後6日目(P6)に新生児マウスを安楽死させます。この実験では、約4〜8匹の新生児マウスの同腹仔を、呼吸停止後少なくとも3分間、イソフルラン吸入を介して P6で安楽死させ、続いて斬首します。
- 各マウスから目を取り除きます。解剖ハサミを使用してまぶたに対して垂直に切断することにより、目の上の皮膚と膜を切り取ります。次に、鉗子を使用して目の上下をそっと押し下げ、目がソケットから外れるようにします。
- 鉗子で目の下を慎重につまみ、目をくっつけたままの視神経を切断します。次に、収穫が終了するまで、準備した1x氷冷PBSの48ウェルプレートに各眼を置きます。
注:マウスごとに1つのウェルを使用し、同じウェルに1つのマウスの両目を使用します。
- 鉗子で目の下を慎重につまみ、目をくっつけたままの視神経を切断します。次に、収穫が終了するまで、準備した1x氷冷PBSの48ウェルプレートに各眼を置きます。
2.マウス網膜組織を分離する
- 底部に解剖パッドを敷いたペトリ皿に、氷冷PBS1倍500μLを入れて目を沈め、倍率4.0倍に設定した解剖顕微鏡の下に置きます。
- 目を傷つけないように、先端の広いトランスファーピペットを使用して解剖パッドに目を吊り下げます。
注意: 目が完全にPBSで覆われていることを確認してください。
- 目を傷つけないように、先端の広いトランスファーピペットを使用して解剖パッドに目を吊り下げます。
- 2つの細かい解剖鉗子を使用して、安定化のために鉗子の1つで視神経を保持し、2番目の鉗子で角膜と強膜が接続する前房に穴を開けます(図1B)。角膜の周りの約75%の円で穴を引き裂きます。
- 鉗子の1つで視神経を保持したまま、2番目の鉗子を使用して、網膜組織から強膜をそっと引き裂きます。
- 上記のように、2番目の鉗子を使用して、網膜組織の硝子体をそっと引き裂きます。
- 再び、2番目の鉗子を使用して、硝子体を取り除いたときに外れなかった水晶体と硝子体神経叢血管をそっと取り除きます。これを行うには、網膜にほとんど触れるまで開いた鉗子で網膜に手を伸ばし、鉗子を閉じて水晶体と顎骨神経叢の血管をつかみ、網膜から鉗子を引き出します。これは、すべての血管が取り外されるまで繰り返すことができます。
注:硝子神経叢は、透明なウェブのような構造に似ています。
- 2 mLの微量遠心チューブに500 μLの1x氷冷PBSを満たし、網膜をチューブに入れます。先に進む前に、すべての網膜を目から隔離し、氷のように冷たいPBSに入れます。
注:マウスごとに1つのチューブを使用し、同じマウスからの2つの網膜がチューブを共有します。網膜組織が破れている場合は、それを複数の断片に移します。マウスの同腹仔の網膜組織解離の合計時間は、安楽死から最終的な網膜組織分離で終わる15〜60分かかるべきである。
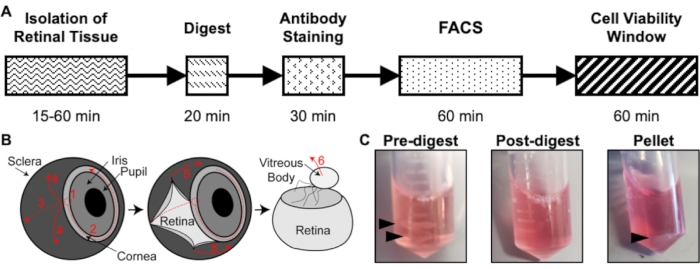
図1:分離プロトコルの概要 。 (A)各ステップの推定時間を含む分離タイムラインの概略図:網膜組織の分離、消化物、抗体染色、FACS、および細胞生存率ウィンドウ。(B)眼から網膜組織を単離するためのステップバイステップガイド、番号付きの解剖ステップ:1)角膜を突き刺す、2)角膜を涙液、3)涙液強膜、4)網膜から強膜を除去する、5)網膜から強膜および接続組織をさらに除去する、6)網膜から硝子体および硝子体血管を除去する。(C)さまざまな消化ステップ中の網膜組織の代表的な画像:消化前、消化後、ペレット(黒い矢印は網膜組織または細胞ペレットを強調しています)。Chavkinらの許可を得て転載、S. Karger AG、バーゼル17に掲載。 この図の拡大版を表示するには、ここをクリックしてください。
3.網膜組織を単一の細胞懸濁液に消化します
- 単離された2つの網膜ごとに500 μLの消化液を調製します。FBSおよびコラゲナーゼII型をDMEMに添加し、最終濃度10%FBSおよび1 mg/mLコラゲナーゼII型にします。溶液を混合し、水浴を用いて37°Cに温める。
- 慎重にピペッティングして、2 mLマイクロ遠心チューブから余分なPBSを取り除きます。網膜組織を完全に覆うのに十分なPBS、各チューブに約100μLを残します。
- 500 μLの消化液を網膜組織を含む各チューブに加えます(図1C)。
- P1000ピペッターとピペットチップを使用して、消化液中の網膜組織を5回ピペットで上下させます。
- 消化混合物を37°Cの水浴中で20分間インキュベートします。
- P1000ピペッターとピペットチップを使用して、消化混合物を5分ごとに上下にピペットします。インキュベーション後、網膜組織は単一の細胞懸濁液に溶解したため、消化混合物は濁っているはずです(図1C)。
4.セルをカウントします
- 卓上遠心分離機を4°Cに設定し、消化混合物チューブを中に置きます。消化混合物を375 x g で5分間遠心分離してペレット化します。
- ピペッティングで上清消化液を慎重に取り除きます。セルペレットを乱さないでください(図1C)。ピペットで穏やかに上下に混合することにより、ペレットを500 μLの氷冷1x PBSに再懸濁します。
- 顕微鏡下で血球計算盤で細胞を数えます。
注:細胞数は、網膜2個あたり約1 x 106 細胞です。 - 穏やかな混合によって細胞が適切に再懸濁されていることを確認し、次に、前述のように、20 μLの細胞懸濁液をコントロール染色用の3つのチューブ(チューブ1:IgGコントロール、チューブ2:CD31コントロール、およびチューブ3:CD45コントロール)に分注します17、18。
- 卓上遠心分離機を4°Cに設定し、細胞を含むチューブを中に置きます。375 x g で5分間遠心分離することにより、細胞をペレット化します。
5.抗体で細胞を免疫染色します
- 染色した2つの網膜と4本のコントロールチューブあたり100 μLの染色バッファーを調製します。FBS、HEPES、およびD-グルコースをHBSSバッファーに添加し、最終濃度10%FBS、10 mM HEPES、および1 mg/mL D-グルコースにします。
- CD31およびCD45に対する蛍光標識抗体を取得します。抗体を1:100希釈で染色バッファーに加えます(チューブ1:IgG抗体のみ、チューブ2:CD31抗体のみ、チューブ3:CD45抗体のみ)。染色バッファー100 μLあたり1 μLの抗体を添加し、最終抗体濃度を2 μg/mLにします。
- ピペッティングにより洗浄したセルペレットからPBSを注意深く取り出します。
- ペレットを0.5 x 106 細胞あたり100 μLの抗体染色液に再懸濁します。
- 単一細胞懸濁液を抗体染色溶液とともに、暗所の氷上で30分間インキュベートします。10分ごとにチューブをタップして、細胞を穏やかに混合します。
6. 蛍光活性化セルソーティングの準備
- 卓上遠心分離機を4°Cにセットし、細胞を含むチューブを中に置きます。375 x g で5分間遠心分離することにより、細胞をペレット化します。
- 上清を除去し、これらの細胞を500 μLの1x PBSに再懸濁して洗浄します。
- 卓上遠心分離機を4°Cにセットし、細胞を含むチューブを中に置きます。375 x g で5分間遠心分離することにより細胞をペレット化
- 1.5 mL の FACS バッファーを調製します (1x PBS 中の 1% FBS)。
- 上清を除去し、ピペッターで穏やかに混合することにより、細胞ペレットを300 μLのFACSバッファーに再懸濁します。
- FACSバッファーを含むサンプルチューブにヨウ化プロピジウム(PI)を最終濃度0.5 μg/mLまで加えます。PIは生存マーカーとして使用されます。
- 細胞懸濁液をセルストレーナースナップキャップを通して5 mL試験管に移し、結合します。セルストレーナースナップキャップには35 μmのフィルターが含まれている必要があり、セル懸濁液はフィルターに直接ピペットで移すことができます。
- FACSチューブを暗闇の中で氷の上に保ち、セルソーターに移します。
7. FACS機器をセットアップします
- 100 μmのノズルをFACS装置に取り付けます。
注:このサイズのノズルは、収集量を最小限に抑え、孤立したセル密度を最大化します。 - FACS装置に取り付ける収集チューブとして、250 μLの1x PBSを1.5 mLの微量遠心チューブに調製します。
8. FACS による 生内皮細胞の単離
- FACS機器とコンピュータの電源を入れます。FACSソフトウェアアイコンをクリックして、コンピュータ上のFACSソフトウェアを開き、FACS機器を実行および操作します。定期的な品質管理テストを実行します。
- コントロール染色されたサンプルをFACS装置にロードして、軸を調整します。IgG抗体のみの細胞から始めてFSCとSSCを生成および調整し、次にCD31抗体のみでCD31を生成および調整し、次にCD45抗体のみでCD45を生成および調整します。コントロールサンプルからデータを記録します。
- 染色したサンプル細胞をFACS装置にロードし、サンプルを実行します。
- 前方散乱および側方散乱(それぞれFSC-AおよびSSC-A)パラメータに基づいてセルをゲートします(図2A)。
注:FSC-AおよびSSC-Aパラメータは、サイズ、密度、粒度、表面特性、および屈折率に基づいてセルを選択するために使用されます。 - FSC-AおよびFSC-Hで細胞をゲートして細胞ダブレットを同定し、単一細胞のみを収集します(図2A)。
注:FSC-AおよびFSC-Hパラメータは、前方散乱中に細胞ダブレットがより大きな面積対高さ比を含む液滴になるという原理に基づいて、単一細胞を選択するために使用されます。 - PIおよびSSC-Aによって細胞をゲートし、生細胞を同定する(図2A)。
注:生細胞はPI陰性になります。 - コントロールでCD31+/CD45-ゲートを作り、CD31とCD45でセルをゲートします(図2A、B)。
- 250 μLのFACSバッファーを入れた収集チューブを挿入します。
- CD31陽性/CD45陰性の細胞を設置した収集チューブに分類し始めます。
- さらなる分析のために、収集チューブを氷の上に置いてください。サンプルは、このステップ1で次世代シーケンシングアプリケーション用に処理できます。
9.生存率アッセイを実行します
- 10 μLの細胞を10 μLの0.4%トリパンブルー溶液と混合して、細胞の生存率を評価します。
- 染色した混合物を血球計算盤のスライドにピペッティングして、生細胞をカウントします。正確な生存率カウントのために顕微鏡の下にスライドを置きます。青い細胞を生存不能として数え、透明な細胞を生存可能として数えます。
- 生細胞数を総細胞数で割って、生存率を計算します。
10.遺伝子発現アッセイを実行します
- サンプルあたり10,000〜20,000個の細胞を取得し、RNA単離を実行してマウス網膜内皮細胞の遺伝子発現を解析します。RNA単離は、エタノールベースのRNA沈殿を使用した市販のキットを使用して実行され、その後、遠心分離およびメンブレンカラムを使用して、細胞ライセートから精製RNAを洗浄および溶出します。サンプルは、このステップ1で一部の次世代シーケンシングアプリケーション用に処理できます。
- 逆転写酵素および支持試薬19を用いてRNAをcDNAに変換する。
- DNA結合色素と定量PCR(qPCR)機20を用いて定量する。プライマーを含む384ウェルqPCRプレートにcDNAサンプルをロードして、目的の遺伝子を増幅します。反応量は、遺伝子増幅の定量に使用されるDNA結合色素を含めて、合計10 μLである必要があります。
- CD31、VE-カドヘリン、CD45、およびβ-アクチンのフォワードプライマーおよびリバースプライマーを使用して、遺伝子発現を測定します。
- 次世代シーケンシングアプリケーションにサンプルを使用する1.
Access restricted. Please log in or start a trial to view this content.
結果
網膜組織の消化とCD31およびCD45の免疫染色により、細胞、単一細胞、および生存率をゲーティングした後、CD31+/CD45-内皮細胞の識別可能な集団が得られます(図2A)。CD45免疫染色は、血小板および一部の白血球を含むCD31+/CD45+細胞を除去するために必要です21。抗体特異性を示し、ゲーティング戦略を導くために、実験ごとにコントロールを実行する必要が...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
このプロトコルは、高い細胞数、純度、および生存率のために最適化された、出生後のマウス網膜組織から内皮細胞を単離する方法を説明しています。細胞純度は、CD31+/CD45-免疫染色による消化された単一細胞懸濁液からの内皮細胞集団のFACS単離によって得られます。単離の質は、トリパンブルー染色による生存率およびCD31、CD45、およびVE-カドヘリンのqPCRによる遺伝子発現のアッセイで定?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者には関連する開示はありません。
謝辞
Yale Flow Cytometry施設、バージニア大学フローサイトメトリーコア施設、Yale Center for Genomic Analysis、およびUniversity of Virginia Genome Analysis and Technology Coreの方々に、提示された実験に貢献するための努力、専門知識、アドバイスをいただき、ありがとうございます。この研究は、N.W.C.(T32 HL007224, T32 HL007284), S.C. (T32 HL007284), K.W. (R01 HL142650), およびK.K.H. (R01 HL146056, R01 DK118728, UH3 EB025765)へのNIH助成金によって資金提供された。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 2 mL Eppendorf safe-lock tubes | USA Scientific | 4036-3352 | |
| 5 ml Falcon Test Tubes with Cell Strainer Snap Cap | Corning | 352235 | |
| 60 mm Non TC-treated Culture Dish | Corning | 430589 | |
| APC Rat Anti-Mouse CD31 | BD Biosciences | 551262 | |
| APC Rat IgG2a κ Isotype Control | BD Biosciences | 553932 | |
| BD FACSChorus Software | BD Biosciences | FACSCHORUS | |
| BD FACSMelody Cell Sorter | BD Biosciences | FACSMELODY | |
| Collagenase Type II | Sigma-Aldrich | 234115 | |
| Costar 48-well Clear TC-treated Multiple Well Plates, Individually Wrapped, Sterile | Corning | 3548 | |
| D-Glucose | Gibco | A2494001 | |
| Disposable Graduated Transfer Pipettes | Fisher Scientific | 12-711-9AM | |
| Dissecting Pan Wax | Carolina | 629100 | |
| Dissection scissors | Fine Science Tools | 14085-08 | |
| Dissection Stereo Microscope M165 FC | Leica | M165FC | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965-052 | |
| Dulbecco’s Phosphate Buffered Saline (PBS) | Gibco | 14190144 | |
| Eppendorf Flex-Tubes Microcentrifuge Tubes 1.5 mL | Sigma-Aldrich | 22364120 | |
| Fetal Bovine Serum (FBS) | Gemini Bio | 100-106 | |
| Fine dissection forceps | Fine Science Tools | 11250-00 | |
| Hank's Buffered Salt Solution (HBSS) | Gibco | 14175095 | |
| HEPES (1M) | Gibco | 15630130 | |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708890 | |
| Isoflurane, USP | Covetrus | 11695067772 | |
| Isotemp General Purpose Deluxe Water Bath | Fisher Scientific | FSGPD20 | |
| Primer: ActB_Forward: 5’- agagggaaatcgtgcgtgac -3’ | Integrated DNA Technologies | N/A | |
| Primer: ActB_Reverse: 5’- caatagtgatgacctggccgt -3’ | Integrated DNA Technologies | N/A | |
| Primer: CD31_Forward: 5’- gagcccaatcacgtttcagttt -3’ | Integrated DNA Technologies | N/A | |
| Primer: CD31_Reverse: 5’- tccttcctgcttcttgctagct -3’ | Integrated DNA Technologies | N/A | |
| Primer: CD45_Forward: 5’- gggttgttctgtgccttgtt -3’ | Integrated DNA Technologies | N/A | |
| Primer: CD45_Reverse: 5’- ctggacggacacagttagca -3’ | Integrated DNA Technologies | N/A | |
| Primer: VE-Cadherin_Forward: 5’- tcctctgcatcctcactatcaca -3’ | Integrated DNA Technologies | N/A | |
| Primer: VE-Cadherin_Reverse: 5’- gtaagtgaccaactgctcgtgaat -3’ | Integrated DNA Technologies | N/A | |
| Propidium iodide | Sigma-Aldrich | P4864 | |
| RNeasy Plus Mini Kit | Qiagen | 74134 | |
| Sorvall Legend Micro 21R Centrifuge, Refrigerated | ThermoFisher | 75002477 | |
| SYBR-Green iTaq Universal SYBR Green Supermix | Bio-Rad | 172-5120 | |
| Trypan Blue Solution | ThermoFisher | 15250061 | |
| V450 Rat Anti-Mouse CD45 | BD Biosciences | 560501 | |
| V450 Rat IgG2b, κ Isotype Control | BD Biosciences | 560457 |
参考文献
- Slatko, B. E., Gardner, A. F., Ausubel, F. M. Overview of next-generation sequencing technologies. Current Protocols in Molecular Biology. 122 (1), 59(2018).
- Chavkin, N. W., Hirschi, K. K. Single cell analysis in vascular biology. Frontiers in Cardiovascular Medicine. 7, 42(2020).
- Ma, F., Hernandez, G. E., Romay, M., Iruela-Arispe, M. L. Single-cell RNA sequencing to study vascular diversity and function. Current Opinion in Hematology. 28 (3), 221-229 (2021).
- Potter, A. S., Potter, S. S., S, Dissociation of tissues for single-cell analysis. Methods in Molecular Biology. 1926, 55-62 (2019).
- Braga, F. A. V., Miragaia, R. J. Tissue handling and dissociation for single-cell RNA-seq. Single Cell Methods: Methods in Molecular Biology. 1979, 9-21 (2019).
- Brink, S. C., et al. Single-cell sequencing reveals dissociatin-induced gene expression in tissue subpopulations. Nature Methods. 14 (10), 935-936 (2017).
- Skulska, K., Wegrzyn, A. S., Chelmonska-Soyta, A., Chodaczek, G. Impact of tissue enzymatic digestion on analysis of immune cells in mouse reproductive mucosa with a focus on gammadelta T cells. Journal of Immunological Methods. 474, 112665(2019).
- Connolly, S., Hores, T., Smith, L., D'Amore, P. Characterization of vascular development in the mouse retina. Microvascular Research. 36 (3), 275-290 (1988).
- Crist, A., Young, C., Meadows, S. Characterization of arteriovenous identity in the developing neonate mouse retina. Gene Expression Patterns: GEP. 23-24, 22-31 (2017).
- dela Paz, N. G., D'Amore, P. A. Arterial versus venous endothelial cells. Cell and Tissue Research. 335 (1), 5-16 (2009).
- Fang, J. S., Hirschi, K. K. Molecular regulation of arteriovenous endothelial cell specification. F1000Res. 8, (2019).
- Smith, L. E., et al. Oxygen-induced retinopathy in the mouse. Investigative Ophthalmology and Visual Science. 35 (1), 101-111 (1994).
- Pitulescu, M. E., Schmidt, I., Benedito, R., Adams, R. H. Inducible gene targeting in the neonatal vasculature and analysis of retinal angiogenesis in mice. Nature Protocols. 5 (9), 1518-1534 (2010).
- Ruiz, S., et al. A mouse model of hereditary hemorrhagic telangiectasia generated by transmammary-delivered immunoblocking of BMP9 and BMP10. Scientific Reports. 6, 37366(2016).
- Fang, J. S., et al. Shear-induced Notch-Cx37-p27 axis arrests endothelial cell cycle to enable arterial specification. Nature Communication. 8 (1), 2149(2017).
- Ola, R., et al. SMAD4 prevents flow induced arterial-venous malformations by inhibiting Casein Kinase 2. Circulation. 138 (21), 2379-2394 (2018).
- Chavkin, N. W., Walsh, K., Hirschi, K. K. Isolation of highly purified and viable retinal endothelial cells. Journal of Vascular Research. 58 (1), 49-57 (2020).
- Hulspas, R., O'Gorman, M. R. G., Wood, B. L., Gratama, J. W., Sutherland, D. R. Considerations for the control of background fluorescence in clinical flow cytometry. Cytometry PartB: Clinical Cytometry. 76 (6), 355-364 (2009).
- Bachman, J. Reverse-transcription PCR (RT-PCR). Methods in Enzymology. 530, 67-74 (2013).
- Green, M. R., Sambrook, J. Quantification of RNA by real-time Reverse Transcription-Polymerase Chain Reaction (RT-PCR). Cold Spring Harbour Protocols. 2018 (10), (2018).
- Liu, L., Shi, G. P. CD31: beyond a marker for endothelial cells. Cardiovascular Research. 94 (1), 3-5 (2012).
- Zarkada, G., et al. Specialized endothelial tip cells guide neuroretina vascularization and blood-retina-barrier formation. Developmental Cell. 56 (15), 2237-2251 (2021).
- Su, X., Sorenson, C. M., Sheibani, N. Isolation and characterization of murine retinal endothelial cells. Molecular Vision. 9, 171-178 (2003).
- Benedito, R., et al. The notch ligands Dll4 and Jagged1 have opposing effects on angiogenesis. Cell. 137 (6), 1124-1135 (2009).
- Daneman, R., et al. Wnt/beta-catenin signaling is required for CNS, but not non-CNS, angiogenesis. Proceedings of the National Academy of Sciences of the United States of America. 106 (2), 641-646 (2009).
- Okabe, K., et al. Neurons limit angiogenesis by titrating VEGF in retina. Cell. 159 (3), 584-596 (2014).
- Crist, A. M., Lee, A. R., Patel, N. R., Westhoff, D. E., Meadows, S. M. Vascular deficiency of Smad4 causes arteriovenous malformations: a mouse model of Hereditary Hemorrhagic Telangiectasia. Angiogenesis. 21 (2), 363-380 (2018).
- Kim, Y. H., Choe, S. W., Chae, M. Y., Hong, S., Oh, S. P. SMAD4 deficiency leads to development of arteriovenous malformations in neonatal and adult mice. Journal of the American Heart Association. 7 (21), 009514(2018).
- Ma, W., et al. Absence of TGFbeta signaling in retinal microglia induces retinal degeneration and exacerbates choroidal neovascularization. eLife. 8, 42049(2019).
- Luo, W., et al. Arterialization requires the timely suppression of cell growth. Nature. 589 (7842), 437-441 (2021).
- Lawson, N. D., Vogel, A. M., Weinstein, B. M. sonic hedgehog and vascular endothelial growth factor act upstream of the Notch pathway during arterial endothelial differentiation. Developmental Cell. 3 (1), 127-136 (2002).
- Larrivee, B., et al. ALK1 signaling inhibits angiogenesis by cooperating with the Notch pathway. Developmental Cell. 22 (3), 489-500 (2012).
- Wythe, J. D., et al. ETS factors regulate Vegf-dependent arterial specification. Developmental Cell. 26 (1), 45-58 (2013).
- Davis, D. M., Purvis, J. E. Computational analysis of signaling patterns in single cells. Seminars in Cell and Developmental Biology. 0, 35-43 (2015).
- Gaudet, S., Miller-Jensen, K. Redefining signaling pathways with an expanding single-cell toolbox. Trends in Biotechnology. 34 (6), 458-469 (2016).
- Aibar, S., et al. SCENIC: single-cell regulatory network inference and clustering. Nature Methods. 14 (11), 1083-1086 (2017).
- Trapnell, C., et al. The dynamics and regulators of cell fate decisions are revealed by pseudotemporal ordering of single cells. Nature Biotechnology. 32 (4), 381-386 (2014).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved