このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
豚腎臓およびマウス肝臓からのFAHD1タンパク質の抽出および精製
要約
このプロトコールは、ブタ腎臓およびマウス肝臓からフマリアセトアセテート加水分解酵素ドメイン含有タンパク質1(FAHD1)を抽出する方法を記載する。列挙された方法は、目的の他のタンパク質に適合させ、他の組織に対して改変してもよい。
要約
フマリアセト酢酸加水分解酵素ドメイン含有タンパク質1(FAHD1)は、真核生物においてFAHスーパーファミリーの最初の同定されたメンバーであり、ミトコンドリアにおいてオキサロ酢酸デカルボキシラーゼとして作用する。この記事では、豚の腎臓およびマウス肝臓からFAHD1を抽出および精製するための一連の方法を提示する。対象となる方法は、高速タンパク質液体クロマトグラフィー(FPLC)によるイオン交換クロマトグラフィー、FPLCによる分取および分析ゲルろ過、およびプロテオミクスアプローチです。全タンパク質抽出後、硫酸アンモニウム沈殿およびイオン交換クロマトグラフィーを探索し、イオン交換およびサイズ排除クロマトグラフィーを用いた逐次戦略 を介して FAHD1を抽出した。この代表的なアプローチは、目的の他のタンパク質(有意なレベルで発現)に適合させ、他の組織について改変してもよい。組織から精製されたタンパク質は、高品質の抗体、および/または強力で特異的な薬理学的阻害剤の開発をサポートし得る。
概要
真核生物FAHドメイン含有タンパク質1(FAHD1)は、二官能性オキサロ酢酸(OAA)デカルボキシラーゼ(ODx)1およびアシルピルビン酸加水分解酵素(ApH)2として作用する。それはミトコンドリア2に局在し、酵素1、2、3、4、5、6の広範なFAHスーパーファミリーに属する。そのApH活性はわずかな関連性しかないが、FAHD1のODx活性はTCAサイクルフラックス1、7、8、9の調節に関与している。OAAは、トリカルボン酸サイクルにおける中央クエン酸合成酵素反応に必要とされるだけでなく、電子伝達系の一部として、およびカタプレロティック代謝産物としてコハク酸デヒドロゲナーゼの競合阻害剤としても作用する。ヒト臍帯静脈内皮細胞(HUVEC)におけるFAHD1遺伝子発現のダウンレギュレーションは、解糖系への付随的な切り替えに関連する細胞増殖速度10の有意な低下、およびミトコンドリア膜電位の有意な阻害をもたらした。作業モデルは、ミトコンドリア機能障害関連老化(MiDAS)11様表現型8を指し、ミトコンドリアOAAレベルはFAHD1活性1,8,9によって厳密に調節される。
組換えタンパク質は、組織からではなく細菌12から発現および精製を介して得る方が容易である。しかし、細菌で発現されるタンパク質は、翻訳後修飾の欠如の可能性によって偏っているか、単に問題となる可能性がある(すなわち、プラスミド喪失、細菌ストレス応答、歪んだ/未形成のジスルフィド結合、分泌不良、タンパク質凝集、タンパク質分解的切断など)。特定の用途では、タンパク質は、そのような修飾を含むため、および/または起こり得る人工物を排除するために、細胞溶解物または組織から取得する必要がある。組織から精製されたタンパク質は、FAHD113などの選択された酵素に対する高品質の抗体、および/または強力で特異的な薬理学的阻害剤の開発を支持する。
この原稿は、ブタ腎臓およびマウス肝臓からのFAHD1の抽出および精製のための一連の方法を提示する。記載されている方法は、高速タンパク質液体クロマトグラフィー(FPLC)を必要としますが、それ以外の場合は一般的な実験装置を使用します。代替的な方法は、他の場所で見出すことができる14、15、16、17。全タンパク質抽出後、提案されたプロトコルには試験段階が含まれ、硫酸アンモニウム沈殿およびイオン交換クロマトグラフィーのサブプロトコルが議論される(図1)。これらのサブプロトコールを定義した後、目的のタンパク質は、イオン交換およびFPLCによるサイズ排除クロマトグラフィーを用いた逐次戦略を介して抽出される。これらのガイドラインに基づいて、最終プロトコールは、関心のある他のタンパク質に対して個別に適合され得る。
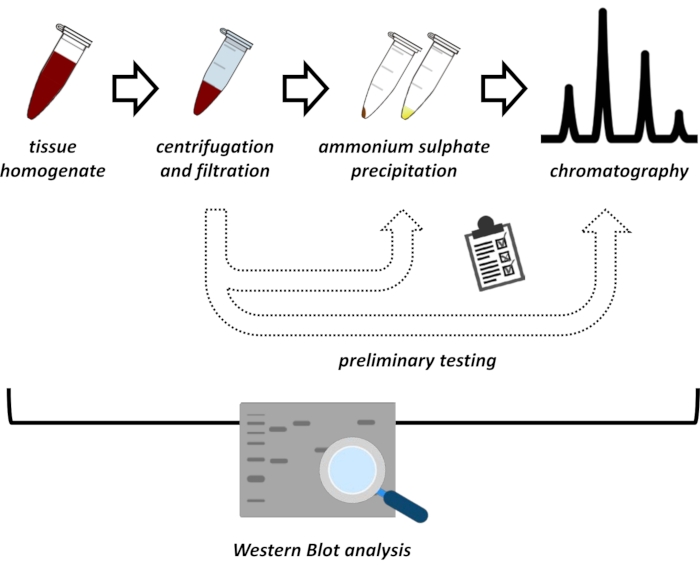
図 1: このプロトコルの全体的な戦略 上から下へ:タンパク質は組織から抽出されます。組織ホモジネートを調製し、遠心分離し、濾過した。上清およびペレット由来サンプルのペアごとに、硫酸アンモニウム沈殿およびイオン交換クロマトグラフィー(FPLC)の試験を実施して、最適な条件をプローブする必要があります。これらのサブプロトコールを確立した後、タンパク質は、硫酸アンモニウム沈殿、イオン交換クロマトグラフィー、および反復サイズ排除クロマトグラフィー(FPLC)の逐次手順 を介して 、様々なpHおよび塩濃度で抽出され得る。すべてのステップはウェスタンブロットによって制御される必要があります。 この図の拡大版を表示するには、ここをクリックしてください。
Access restricted. Please log in or start a trial to view this content.
プロトコル
すべての実験は、機関のガイドラインに準拠して実施した。豚の腎臓は地元のスーパーマーケットから新鮮に入手しました。肝臓組織は、オーストリアのインスブルック大学(Rennweg 10, 6020 Innsbruck, Austria)の生物医学老化研究所で、大学-Dozの監督下で維持されているC57BL6野生型マウスから採取した。ピダー・ヤンセン=デュル博士は、2013年に発行されたプロジェクトリーダーとしての倫理的許可(BMWF-66.008/0007-II/3b/2013)によってカバーされました。このプロジェクトのためのマウスの維持と使用は、オーストリア教育科学研究省(BMBWF)が発行した2020年5月5日からの倫理的許可第2020-0.242.978号の対象となります。
1. 準備
注:プロトコルを開始する前に、一般的な化学物質および材料に加えて、タンパク質溶解バッファー、粗組織サンプル、および特定の抗体など、いくつかのものを調製する必要があります。
- 組織の正味重量100 gあたり250 mLのタンパク質溶解バッファーを調製する:50 mM NaF、1 mM PMSF、2 μg/mLアプロチニン、および1 mM活性化オルトバナジンを含む250 mLの1x PBSを調製する( 表1参照)。0.22 μmのシリンジフィルターユニットを使用して溶液をろ過します。
注:オルトバナジン酸塩の活性化は、タンパク質チロシンホスファターゼ18のより強力な阻害剤に変換するために使用する前に必要である。活性化されたオルトバナジン酸塩は、市販の供給業者から入手してもよいが、以下のようにして調製することもできる。- ddH2O中の(ナトリウム)オルトバナジン酸塩の200mMストック溶液を調製する。10mLの溶液を調製するために、368mgのNa3VO4を9mLの水に加え、攪拌して溶解する。溶解したら、ddH2Oで体積を10mLに構成する。
注:オルトバナジン酸ナトリウム溶液の開始pHは、材料の供給源によって異なる可能性があり、pHは、以下のように反復的なアプローチで10に調整する必要がある。 - 溶液の初期pHに応じて、NaOHまたはHClでpHを10に調整する。pH>10では、溶液は黄色を呈する。溶液が無色になるまで沸騰させ、室温まで冷却し、pHを確認してください。pHが>10の場合は、少量のHClを加えてpHを10に調整します。この時点で、ソリューションは再び黄色に変わることがあります。
- 溶液が無色のままでpHが10(約5〜7倍)に安定するまで、沸騰と冷却を繰り返します。この時点で、HClを添加すると、溶液中に黄色がかすかに現れる。活性化されたオルトバナジン酸塩を-20°Cで1mLアリコート中に保存する。
- ddH2O中の(ナトリウム)オルトバナジン酸塩の200mMストック溶液を調製する。10mLの溶液を調製するために、368mgのNa3VO4を9mLの水に加え、攪拌して溶解する。溶解したら、ddH2Oで体積を10mLに構成する。
- 組織1グラムあたり2mLの溶解緩衝液でチューブを調製し、氷の上に置く。
注:このプロトコルは、1頭のブタ腎臓(約100〜150g)に対して合計30mLの溶解緩衝液で満たされた8つの50mLチューブを使用し、2本のチューブにそれぞれ20匹のマウス肝臓(それぞれ1〜2g)用の40mLの溶解緩衝液で充填した。 - 組織を準備する:ポリスチレンフォームボックス内の氷の上に置かれた事前に洗浄されたガラス板上で組織を解剖する。その後の溶解のためにそれぞれのチューブに容易に移されるようにそれぞれ約100mgの組織片を切断する。組織片を調製したチューブに移す(ステップ1.2)。
- 飽和硫酸アンモニウム溶液を調製する:500mLのddH2Oを70°Cに加熱し、攪拌しながら、硫酸アンモニウム粉末( 原料表参照)を硫酸アンモニウムが溶解しなくなるまで徐々に加える。この(過)飽和溶液を室温まで冷却し、4°Cで一晩保存する。
2. 総タンパク質抽出
注 冷たいタンパク質溶解バッファーでサンプルを調製した後 (ステップ 1.3 を参照)、超音波プローブによる超音波処理 を介して 、または次のように電気ホモジナイザーを使用して、組織を可能な限り最適に均質化します。
- 組織の均質化
- 豚腎臓の場合、好ましくは、試料を氷上に保持しながら超音波プローブによって懸濁液を超音波処理する(15秒パルスの10サイクル、パルス間の30秒間隔で氷上の試料を冷却し、50%デューティサイクルで中程度の振幅で)。
- マウスの臓器の場合、サンプルを氷上に保ちながら、電気ホモジナイザーを使用して懸濁液を均質化します(低力から始めて、ゆっくりと中力まで加速します)。電気ホモジナイザーをPBSで定期的に洗浄して、デバイスを詰まらせる有機材料を除去します。
- サンプルから20μLを取り出し、均質化された組織の細胞が適切に破壊されているかどうかを顕微鏡下で確認する。それ以外の場合は、均質化を繰り返します。
- チューブを卓上遠心分離機で10,000 x g で4°Cで30分間遠心分離する。
注:オプションで、上清を20,000 x g で2回目に4°Cで30分間遠心分離し、移送された可能性のある初期ペレットの小さな画分を除去します。これにより、ステップ2.3の後続のフィルタリングが簡素化されます。 - 上清を新鮮なチューブに集め、氷の上に置きます。0.45 μm および 0.22 μm のシリンジフィルターユニットを使用して上清を順次ろ過します。上清を10mLバッチにアリコートし、短期保存の場合は-20°Cで、長期保存の場合は-80°Cで凍結します。
注: 0.45 μm で事前ろ過すると、粒子の大部分が除去され、0.22 μm で 2 回目のろ過ステップでより細かい粒子が除去されます。0.22 μmのフィルターを直接使用すると、フィルターが目詰まりする危険性があります。 - 上清40 μLに10 μLの5x SDSサンプルバッファー(表1参照)を加え、95°Cで 10分間煮沸することにより、SDS-PAGE/ウェスタンブロット分析用の50 μLサンプルを調製します。
- 必要に応じて、ステップ2.2で得られたペレット約100 μLを900 μLのddH2Oに再懸濁し、上記のようにSDS-PAGE/ウェスタンブロット分析用のサンプルを調製する。
注:陽性対照に加えて、ウェスタンブロット分析にペレット由来サンプルを含めることは、タンパク質の発現が低いか、または抗体が問題であることを示す。
- 必要に応じて、ステップ2.2で得られたペレット約100 μLを900 μLのddH2Oに再懸濁し、上記のようにSDS-PAGE/ウェスタンブロット分析用のサンプルを調製する。
3. SDS-PAGEとウェスタンブロット解析
注: タンパク質の溶解性をチェックするには、ウェスタンブロット分析が必要です。以下では、ウェット/タンクブロッティングシステムを使用したエレクトロブロッティングのプロトコルについて説明します( 材料表を参照)。SDS-PAGEの代替プロトコルは、他の場所で見つけることができる19。
- 製造者の指示に従って不連続な12.5%ポリアクリルアミドSDS-PAGEゲルを調製する(すなわち、解決ゲルの上にスタッキングゲル; 表1を参照のこと)。手順 2 で以前に準備したサンプルを実行します (手順 4、5、および 6 に似ています。以下を参照)。
- タンパク質マーカーはしごを最初のウェルにロードします( 材料表を参照)。陽性対照として5ngのhFAHD1組換えタンパク質(細菌12から得られた; 表1を参照されたい)を第2のウェルに負荷する。
- 続いて、分析対象のサンプル20 μLをロードし、残りのすべてのウェルを20 μLの調製されたSDS−PAGE 1xサンプルバッファー(すなわち、ddH2Oで希釈した5xサンプルバッファー)で満たす。SDS 実行バッファーを使用して、SDS-PAGE ゲルを 125 V で実行します ( 表 1 を参照)。
- SDS-PAGEが完了した後、ウェスタンブロット分析を行い、FAHD1に対して産生された利用可能な抗体を用いて膜をプローブする( 表1参照)。
注:サンプルは粗組織ホモジネートから採取されるため、通常、この時点でのSDS-PAGEおよびウェスタンブロット分析の品質が損なわれます。ただし、抽出するタンパク質が上清に可溶であるかどうかを確認することが重要です。以下のプロトコールを、ブタ腎臓、および肝臓、心臓、脳、および腎臓を含む異なるマウス器官について試験した。- 10x ウェスタンブロット転送バッファーを準備します ( 表 1 を参照)。1xウェスタンブロット転写バッファー( 表1参照)を準備し、4°Cに冷却します。
- PVDF膜をメタノール中で2分間活性化する。膜をddH2Oで2分間洗浄する。1xウェスタンブロット転写バッファー中でメンブレンを15分間平衡化します。
- SDS実行バッファーを除去しながら、SDSゲルを1x PBSで10分間洗浄し、その後、1xウェスタンブロット転写バッファーで10分間インキュベートして平衡化します。エレクトロブロッティングカセットを組み立てる(すなわち、活性化PVDF膜とゲルを組み合わせる)ことは、製造元の指示に従って行う。
- ブロットをエレクトロブロッティングで、氷で満たされた発泡スチロールの箱または冷蔵室(4°C) で 1時間、ブロットを実行します。PVDF膜を、その露出側がチューブの内側を向いている50mLチューブに移す。膜を20mLのウェスタンブロットブロットブロッキングバッファー(表 1参照)中で、チューブローラー( 材料表を参照)上で転がしながら4°Cで一晩インキュベートする。
- 翌日、ロールしながら同じチューブ内の20mLのウェスタンブロット洗浄バッファー(0.1%(v/v)Tween 20を含むPBS)で膜を5分間洗浄する。ウェスタンブロットブロットブロッキングバッファーで1:500に希釈した一次抗体2 (標的FAHD1; 表1参照)と同じチューブ内でメンブレンを、圧延しながら室温で1時間インキュベートする。
- 同じチューブ内の膜を、圧延中に20mLのウェスタンブロット洗浄バッファーでそれぞれ10分間3回洗浄する。5mLのウェスタンブロットブロットブロッキングバッファーで1:3000に希釈したHRP結合二次抗体( 材料表を参照)でメンブレンを室温で30分間インキュベートする。
- 同じチューブ内の膜を、20mLのウェスタンブロット洗浄バッファーでそれぞれ10分間3回、1x PBSでそれぞれ5分間2回洗浄する。片方の端をピンセットで慎重に持ち、セルロース片またはワットマン紙を膜の反対側(下側)の端に触れて、膜を乾かします。膜(露出した側を上に)を清潔なガラス板の上に置きます。
- ピペットを使用して調製したECLウェスタンブロット基質1mLで膜全体を慎重に覆い、気泡を生じないように注意してください。ECL溶液を3分間インキュベートさせ、直ちにX線フィルムまたはイメージングシステムを使用して膜を発達させる。
注:タンパク質がいずれのサンプルでも検出されず、陽性対照でのみ検出された場合、これはタンパク質が不溶性であるか、抗体によって検出されるのに十分な量で存在しないことを示している可能性があります。陽性対照のナノグラムのみがロードされた場合、最初のシナリオがより可能性が高い。タンパク質がまったく検出されなかった場合は、抗体の品質を確認し、モノクローナル抗体ではなくポリクローナル抗体に切り替えることもできます。まれに、すなわち、いくつかの疎水性タンパク質について、タンパク質は遠心分離後に検出され得るが、濾過後には検出可能ではない。このような場合、疎水性タンパク質に特別なフィルターユニットを使用することをお勧めします。
- 任意選択で、ウェスタンブロット後にPVDF膜を染色して、SDS−PAGEゲルからPVDF膜へのタンパク質の正常な転写を制御する。
注:トラブルシューティング、メソッド開発、および文書化にはクーマシー染色が推奨されますが、このプロトコルを適用した後、膜はさらなるウェスタンブロット分析で失われることに注意してください。Ponceau S染色は弱い染色を与えるが、膜を再プローブする場合に使用することができる。- 染色物(クーマシーまたはポンソーS)と脱染色溶液を入れた小さなトレイを準備します。
- ピンセットを用いて、膜を染色溶液に入れ、膜がよく染色されるまで穏やかに振とう(5〜10分)。
- 膜を脱染溶液に移し、溶液が飽和するまで振とうする(5〜10分)。膜上にタンパク質バンドが観察できるようになるまで脱染色ステップを繰り返す。バンドがまったく観察されない場合は、より長いインキュベーション時間で染色を繰り返します。ピンセットを使用してガラス板の上に置いて膜を乾燥させます。
4.試験:硫酸アンモニウム沈殿
注:硫酸アンモニウム沈殿は、タンパク質の溶解度を変えることによってタンパク質を精製する方法である。予備実験では、硫酸アンモニウム濃度は、FAHD1を溶液中に残しながら、最大量のタンパク質夾雑物を沈殿させる値まで順次増加する。タンパク質の溶解度は、ウェスタンブロット分析 によって 再びプローブされる。
- ステップ2.3から続行する:サンプルのアリコートを解凍するか、タンパク質抽出の直後に(すなわち、サンプルを凍結せずに)続行する。0.22 μmのフィルターユニットを使用してサンプルをろ過し、解凍後に析出物の可能性を排除します。氷上で6本の1.5 mLチューブを用意し、各チューブに250 μLのサンプルを移す。
- 上記で調製したチューブに5%、10%、15%、20%、25%、および30%の硫酸アンモニウムの希釈系列を調製し、タンパク質溶解緩衝液で最終容量を1000μLにする。サンプルをチューブ回転子上で4°Cで一晩インキュベートする( 材料表を参照)。
- 卓上遠心分離機を用いて、10,000 x g で4°Cで30分間遠心分離し、すべての上清を別々のチューブに慎重に移した。得られたペレットを風乾し、それぞれを1000μLのddH2Oに再懸濁する。
- 前のステップからの再懸濁ペレットおよび上清の各ペアについて、40 μLを10 μLの5x SDSサンプルバッファーと混合し、液体の大部分が気化するまで開いた蓋で95°Cで沸騰させる。次いで、ペレットをddH2O中の50%DMSOの混合物に再懸濁する。
- SDS-PAGE(ステップ3)を実行しますが、ゲルを80Vで3時間実行します。硫酸アンモニウムの各濃度について、再懸濁ペレットおよび上清に由来するサンプルをペアでロードする(ステップ4.3)。ウェスタンブロット分析を実行します(ステップ3)。
- 精製されるタンパク質(すなわち、FAHD1)が上清に由来するサンプル中に残る硫酸アンモニウムの最高濃度をチェックする。その結果に基づいて、将来の実験で使用する目的のタンパク質に対する硫酸アンモニウム沈殿プロトコールを定義する。
注:硫酸アンモニウムは、SDS-PAGEおよびウェスタンブロットを歪めることがよく知られている。硫酸アンモニウムの濃度が増加するにつれて、ウェスタンブロット分析の品質が損なわれます。ただし、前のステップ3と同様に、この分析は、所定の濃度の硫酸アンモニウムにおける目的のタンパク質の溶解度をチェックするために使用されます。このプロトコールは、他のタンパク質を沈殿させることを目的としているが、精製されるタンパク質は可溶性のままでなければならない。
5. テスト: FPLCによるイオン交換クロマトグラフィー
注:荷電した官能基を持つ分子はFPLC用のシリカ粒子カラムに結合し、表面電荷に応じてタンパク質を分化させることができます。この工程を、陽イオン交換カラムおよび陰イオン交換カラムを用いて2回行う( 材料表を参照)。プロトコルステップは、カチオンクロマトグラフィーまたはアニオン交換クロマトグラフィーのいずれでも同じですが、使用するバッファーは異なります( 表1を参照)。「低塩」15mM NaClおよび「高塩」1M NaCl条件の両方を有する。使用するカラムには、1 mL/分の流量を推奨します。
- FPLCシステムをアニオン交換カラムまたはカチオン交換カラムでセットアップします。20% EtOH (H2 O 中) の 5 カラム容量 (CV) でカラムを洗浄し、続いて 5 CV の ddH2O でカラムを洗浄します。あるいは、クロマトグラムにピークが観察されなくなるまで、1 CV の低塩緩衝液、高塩緩衝液、および再度低塩緩衝液の順にカラムを洗浄しますが、少なくとも 1 回は洗浄します。
- 小規模での硫酸アンモニウム沈殿のための最適なプロトコールを決定した後(ステップ4)、沈殿プロトコールを10mLの元の組織ホモジネートに適用する(ステップ2)。任意選択で、低塩緩衝液に対して試料を透析する。
- サンプルをカラムに塗布し(例えば、注入またはサンプルポンプを使用して)、フロースルーを収集します。カラムを 1 CV の低塩バッファーで洗浄します。
- 100% 低塩バッファー/0% 高塩バッファーから 0% 低塩バッファー/100% 高塩バッファーまでの線形グラジエント溶出を 3 CV 以内に設定します。1 mL 画分を連続的に収集します。グラジエントが終了したら、1 CVの範囲にわたってクロマトグラムにタンパク質関連ピーク(280/255 nmでのUV吸収)が検出されなくなるまで、高塩緩衝液で実行し続けます。
- 0.5 M NaOH (ddH 2 O 中) に溶解した 1 mLの 25% SDS を塗布してカラムを洗浄します。連続して、3 CV の ddH 2 O および 3 CV の20% EtOH (ddH2O 単位) でカラムを洗浄します。
- すべてのピーク画分およびフロースルーのSDS-PAGEサンプルを収集し、ウェスタンブロット を介して 目的のタンパク質の存在をプローブします(ステップ3)。回収した画分を液体窒素中で急速凍結し、-80°Cで保存する。
- ウェスタンブロット分析が完了したら、目的のタンパク質を含む画分を解凍してプールし、残りを破棄します。代替カラム(すなわち、カチオン交換カラムまたはアニオン交換カラム)でステップ5.1〜5.5を繰り返します。
- 両方のカラムがプローブされたら、将来の実験で使用する目的のタンパク質のFPLCプロトコルを定義します。超遠心フィルターユニット(10 kDa、 材料表を参照)を使用してタンパク質溶液の体積を2 mLまで減らします。
注: この一連の実験では、2 つの期待される結果があります。目的のタンパク質がカラムの1つに付着していて、タンパク質溶液が溶出後にすでに非常に純粋であるか、またはタンパク質がどちらの場合もフロースルーに残っていたかのどちらかです。後者のシナリオでは、タンパク質はフロースルーにありますが、このステップの洗浄効果は依然として有意である可能性があります。このような場合、ブタ腎臓およびマウス肝臓におけるFAHD1については、このイオン交換の工程は依然として行われる。カチオン交換カラムもアニオン交換カラムも適切な洗浄効果を提供できない場合は、FPLCに塗布する前に、溶解液および緩衝液のpHを変更し、実行中のバッファーに対してサンプルを透析することができます。
6. 硫酸アンモニウム沈殿およびFPLCのための定義されたサブプロトコルを使用したタンパク質抽出
注:FPLC用シリカゲルカラム( 材料表を参照)内の多孔質粒子は、流体力学的半径に従ってタンパク質を分化させることを可能にする。記載されたステップは、サイズ排除クロマトグラフィー(SEC)を使用して、FPLCシステムを用いて実施されるべきである。使用する SEC カラム ( 材料表を参照) の場合、0.3 mL/分の流量を推奨します。
- 必要な材料をすべて準備し(ステップ1を参照)、組織から総タンパク質を抽出します(ステップ2を参照)。試験に使用しなかったすべての組織ホモジネートを用いて硫酸アンモニウム沈殿を行う(ステップ4を参照)。容量が大きい場合は、超遠心フィルターユニット(10 kDa、 材料表を参照)を使用して溶解液を50 mL以下の小さな容量まで濃縮します。
- イオン交換クロマトグラフィーを用いて第1精製工程を行う(工程5参照)。
- 前の手順で説明したように、ウェスタンブロット用のサンプルを準備します。ウェスタンブロット分析を行い、イオン交換クロマトグラフィーからのすべてのFAHD1含有画分をプールする。
- 超遠心フィルターユニット(10 kDa)を使用して、タンパク質溶液の体積を2 mLまで減らします。0.45 μm および 0.22 μm のシリンジフィルターユニットで溶液を順次ろ過し、微小沈殿を除去します。
- 1 mM DTT を含む 1 CV の SEC ランニングバッファー ( 表 1 を参照) で SEC カラムを平衡化します。サンプルをカラムにロードし、すべてのタンパク質が溶出するまでクロマトグラフィーを実行します (1-2 CV)。
- クロマトグラムの有意なピーク(280/255 nmでのUV吸収)に対応するフロースルーの1 mLの画分を収集し、前の手順で説明したように、SDS-PAGEおよびウェスタンブロット分析用に収集した各画分の50 μLサンプルを調製します。液体窒素を用いて全ての画分をスナップフリーズし、-80°Cで保存する。
- SEC カラムを 1 CV の ddH 2 O および 1 CV の20% EtOH (ddH2O 単位) で連続して洗浄します。ウェスタンブロット分析を実行し、フラクションを含むすべてのFAHD1をプールします。超遠心フィルターユニットを使用して、タンパク質溶液の体積を2mLまで減らします(10kDa、 材料表を参照)。
- 市販のBCAアッセイキットを用いてタンパク質濃度を評価します( 材料表を参照)。
注:移動相のpHおよび塩含有量は、球状タンパク質20の溶出プロファイルに影響を与える可能性がある。酸性または塩基性条件は、ピークの定義が少なくなり、タンパク質間相互作用が増加し、カラム20上のタンパク質の部分的な保持をもたらし得る。この効果は、さらなるタンパク質精製のために利用され得る。異なる流速、pH、および塩濃度を有するステップ6の反復は、タンパク質20の純度を高め得る。
7. 銀染色
注:SDS-PAGEゲルの銀染色分析は、クーマシー染色では見られない可能性のあるタンパク質汚染をチェックするために必要です。以下のプロトコルは、文献21に見出すことができる多くのバージョンのうちの1つである。すべてのインキュベーションステップは、清潔なガラストレイで振って行います。銀とホルムアルデヒドを含む液体はすべて特別な廃液容器に集め、適切に廃棄してください。
- SDS−PAGEゲルを銀染色固定溶液( 表1参照)中で低温室で一晩インキュベートする。ゲルを銀染色インキュベーション溶液( 表1参照)中で室温で3時間インキュベートする。任意選択で、かすかなバンドの検出を改善するためにグルタルアルデヒド( 表1参照)を添加する。ゲルをddH2Oでそれぞれ10分間4回洗浄する。
- ゲルを銀染色銀溶液( 表1参照)中で1時間インキュベートする。
注:これからは、すべての液体とゲル自体に有毒な銀とホルムアルデヒドが含まれていることに注意してください。 - ゲルを銀染色現像液( 表1参照)中で、バンドがはっきりと見えるまで激しく振とうしながらインキュベートする。反応を停止させるために、現像液を捨て、直ちにゲルを銀染色停止液(表1参照)中で最低 10分間インキュベートする。
メモ: 手順 7.2 および 7.3 で染色されたバンドは、常により発達します。染色が弱い場合、記載されているよりも多くのホルムアルデヒドを溶液に添加することが必要な場合があります。
Access restricted. Please log in or start a trial to view this content.
結果
FAHD1タンパク質は、提示されたプロトコールを用いてブタ腎臓およびマウス肝臓から抽出した。マウス組織の場合、最終精製工程の後に数μgを得るために複数の臓器が必要である。このため、この記事では、豚の腎臓からのFAHD1の抽出に焦点を当てており、これははるかに例示的な実験です。マウス肝臓からのFAHD1の抽出は、このプロトコルの困難および可能性のある落とし穴を提示するため?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
プロトコルの重要なステップ
タンパク質の取り扱いに関する一般的なガイドラインに従うことは、氷上や適度なpHおよび塩条件下での作業など、不可欠です。プロテアーゼ阻害剤の使用は、この方法にとって有益であるが、プロテアソーム阻害剤の使用は強く推奨される。サンプルを凍結および融解すると、常にタンパク質沈殿(少なくとも部分的に)が生じる可能性があるため...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは競合する金銭的利益を持っていない。
謝辞
著者らは、Ayse ÖztürkとEva Albertiniによる技術支援に非常に感謝しています。肝臓組織の生成に用いたマウスは、大学-Dozの監督下で維持した。Pidder Jansen-Dürr博士(インスブルック大学生物医学老化研究所、Rennweg 10, 6020 Innsbruck, Austria).
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter units | MERCK | SLGP033RS | Millex-HP, 0.22 µm, PES 33 mm, not steril |
| 0.45 µm filter units | MERCK | SLHP033NS | Millex-HP, 0.45 µm, PES 33 mm, not steril |
| 15 mL Falcon tubes | VWR | 734-0451 | centrifugal tubes |
| 50 mL Falcon tubes | VWR | 734-0448 | centrifugal tubes |
| 96-Well UV Microplate | Thermo-Fischer | 8404 | UV/VIS transparent flat-bottom 96 well plates |
| Acrylamide/Bis Solution (40%, 29:1 ratio) | BIO-RAD | #1610147 | 40% acrylamide/bis-acrylamide, 29:1 (3.3% crosslinker) solution for casting polyacrylamide gels |
| ÄKTA FPLC system | GE Healthcare Life Sciences / Cytiva | - | using the FPLC system by GE Healthcare; different custom versions exist; this work used the "ÄKTA pure" system |
| Amicon Ultra-15, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC901024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 15 mL |
| Amicon Ultra-4, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC801024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 4 mL |
| Ammonium sulfate powder | MERCK | A4418 | ammonium sulphate for molecular biology, ≥99.0% |
| Ammoniumpersulfat reagent grade, 98% | MERCK | 215589 | Catalyst for acrylamide gel polymerization. |
| Coomassie Brilliant blue R 250 | MERCK | 1125530025 | Coomassie Brilliant blue R 250 (C.I. 42660) for electrophoresis Trademark of Imperial Chemical Industries PLC. CAS 6104-59-2, pH 6.2 (10 g/l, H2O, 25 °C) |
| Dialysis tubing cellulose membrane | MERCK | D9277 | Cellulose membranes for the exchange of buffers via dialysis. |
| Eppendof tubes 1.5 mL | VWR | 525-1042 | microcentrifugal tubes; autoclaved |
| HiLoad 26/600 Superdex 75 pg | GE Healthcare Life Sciences / Cytiva | 28989334 | HiLoad Superdex 75 pg prepacked columns are for high-resolution size exclusion chromatography of recombinant proteins |
| Immun-Blot PVDF Membrane | BIO-RAD | #1620177 | PVDF membranes are protein blotting membranes optimized for fluorescent and multiplex fluorescent applications. |
| Mini Trans-Blot Electrophoretic Transfer Cell | BIO-RAD | #1703930 | Use the Mini Trans-Blot Cell for rapid blotting of Mini-PROTEAN precast and handcast gels. |
| Mini-PROTEAN Tetra Vertical Electrophoresis Cell for Mini Precast Gels | BIO-RAD | #1658004 | 4-gel vertical electrophoresis system, includes electrode assembly, companion running module, tank, lid with power cables, mini cell buffer dam. |
| Mono Q 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516701 | Mono Q columns are strong anion exchange chromatography columns for protein analysis or small scale, high resolution polishing of proteins. |
| Mono S 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516901 | Mono S columns are strong cation exchange chromatography columns for protein analysis or small scale high resolution polishing of proteins. |
| PageRuler Prestained Protein Ladder, 10 to 180 kDa | Thermo-Fischer | 26616 | A mixture of 10 blue-, orange-, and green-stained proteins (10 to 180 kDa) for use as size standards in protein electrophoresis (SDS-PAGE) and western blotting. |
| Pierce BCA Protein Assay Kit | Thermo-Fischer | 23225 | A two-component, high-precision, detergent-compatible protein assay for determination of protein concentration. |
| Sonifier 250; Ultrasonic Cell Disruptor w/ Converter | Branson | - | New models at https://www.emerson.com/documents/automation/brochure-sonifier-sfx250-sfx550-cell-disruptors-homogenizers-branson-en-us-168180.pdf |
| Swine Anti-Rabbit Immunoglobulins/HRP (affinity isolated) | Agilent Dako | P0399 | The antibody used for horseradish peroxidase conjugation reacts with rabbit immunoglobulins of all classes. |
| TEMED, 1,2-Bis(dimethylamino)ethane, TMEDA | MERCK | T9281 | TEMED (N,N,N′,N′-Tetramethylethylenediamine) is molecule which allows rapid polymerization of polyacrylamide gels. |
| Tube Roller | - | - | A general tube rotator roller; e.g. a new model at https://labstac.com/de/Mixer/Roller/c/71 |
| Tube Rotator | - | - | A general tube rotator wheel; e.g. a new model at https://labstac.com/de/Tube-Roller/p/MT123 |
| ULTRA-TURRAX; T 25 digital | IKA | 0003725000 | New models at https://www.ika.com/de/Produkte-Lab-Eq/Dispergierer-Dipergiergeraet-Homogenisierer-Homogenisator-csp-177/T-25-digital-ULTRA-TURRAX-cpdt-3725000/ |
参考文献
- Pircher, H., et al. Identification of FAH domain-containing protein 1 (FAHD1) as oxaloacetate decarboxylase. Journal of Biological Chemistry. 290 (11), 6755-6762 (2015).
- Pircher, H., et al. Identification of human Fumarylacetoacetate Hydrolase Domain-containing Protein 1 (FAHD1) as a novel mitochondrial acylpyruvase. Journal of Biological Chemistry. 286 (42), 36500-36508 (2011).
- Kang, T. -W., et al. Senescence surveillance of pre-malignant hepatocytes limits liver cancer development. Nature. 479 (7374), 547-551 (2011).
- Hong, H., Seo, H., Park, W., Kim, K. K. -J. Sequence, structure and function-based classification of the broadly conserved FAH superfamily reveals two distinct fumarylpyruvate hydrolase subfamilies. Environmental Microbiology. 22 (1), 270-285 (2020).
- Timm, D. E., Mueller, H. A., Bhanumoorthy, P., Harp, J. M., Bunick, G. J. Crystal structure and mechanism of a carbon-carbon bond hydrolase. Structure. 7 (9), London, England. 1023-1033 (1999).
- Bateman, R. L., et al. Mechanistic inferences from the crystal structure of Fumarylacetoacetate Hydrolase with a bound phosphorus-based inhibitor. Journal of Biological Chemistry. 276 (18), 15284-15291 (2001).
- Weiss, A. K. H., et al. Structural basis for the bi-functionality of human oxaloacetate decarboxylase FAHD1. Biochemical Journal. 475 (22), 3561-3576 (2018).
- Etemad, S., et al. Oxaloacetate decarboxylase FAHD1 - a new regulator of mitochondrial function and senescence. Mechanisms of Ageing and Development. 177, 22-29 (2019).
- Weiss, A. K. H., et al. Regulation of cellular senescence by eukaryotic members of the FAH superfamily - A role in calcium homeostasis. Mechanisms of Ageing and Development. 190, 111284(2020).
- Petit, M., Koziel, R., Etemad, S., Pircher, H., Jansen-Dürr, P. Depletion of oxaloacetate decarboxylase FAHD1 inhibits mitochondrial electron transport and induces cellular senescence in human endothelial cells. Experimental Gerontology. 92, 7-12 (2017).
- Wiley, C. D., et al. Mitochondrial dysfunction induces senescence with a distinct secretory phenotype. Cell Metabolism. 23 (2), 303-314 (2016).
- Weiss, A. K. H., et al. Expression, purification, crystallization, and enzyme assays of Fumarylacetoacetate Hydrolase Domain-containing proteins. Journal of Visualized Experiments: JoVE. (148), e59729(2019).
- Weiss, A. K. H., et al. Inhibitors of Fumarylacetoacetate Hydrolase Domain Containing Protein 1 (FAHD1). Molcules. 26 (16), 5009(2021).
- Mizutani, H., Kunishima, N. Purification, crystallization and preliminary X-ray analysis of the fumarylacetoacetase family member TTHA0809 from Thermus thermophilus HB8. Acta Crystallographica Section F Structural Biology and Crystallization Communications. 63 (9), 792-794 (2007).
- Lee, C. H. A simple outline of methods for protein isolation and purification. Endocrinology and Metabolism. 32 (1), Seoul, Korea. 18-22 (2017).
- Amer, H. E. A. Purification of proteins: Between meaning and different methods). Proteomics Technologies and Applications. , (2019).
- Niu, L., Yuan, H., Gong, F., Wu, X., Wang, W. Protein extraction methods shape much of the extracted proteomes. Frontiers in Plant Science. 9, 802(2018).
- Gordon, J. A. Use of vanadate as protein-phosphotyrosine phosphatase inhibitor. Methods in Enzymology. 201, 477-482 (1991).
- Gallagher, S. R. SDS-polyacrylamide gel electrophoresis (SDS-PAGE). Current Protocols in Essential Laboratory Techniques. , (2012).
- Ahmed, U., Saunders, G. Effect of pH on Protein Size Exclusion Chromatography. , Available from: https://www.agilent.com/cs/library/applications/5990-8138EN.pdf (2011).
- Sørensen, B. K., et al. Silver staining of proteins on electroblotting membranes and intensification of silver staining of proteins separated by polyacrylamide gel electrophoresis. Analytical Biochemistry. 304 (1), 33-41 (2002).
- Fagerberg, L., et al. Analysis of the human tissue-specific expression by genome-wide integration of transcriptomics and antibody-based proteomics. Molecular & Cellular Proteomics. 13 (2), 397-406 (2014).
- Cytiva Life Fundamentals of size exclusion chromatography. , Available from: https://www.cytivalifesciences.com/en/us/solutions/protein-research/knowledge-center/protein-purification-methods/size-exclusion-chromatography (2022).
- Rosano, G. L., Ceccarelli, E. A. Recombinant protein expression in Escherichia coli: advances and challenges. Frontiers in Microbiology. 5, 172(2014).
- Rosano, G. L., Morales, E. S., Ceccarelli, E. A. New tools for recombinant protein production in Escherichia coli: A 5-year update. Protein Science: A Publication of the Protein Society. 28 (8), 1412-1422 (2019).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved