JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
돼지 신장과 마우스 간에서 FAHD1 단백질의 추출 및 정제
요약
이 프로토콜은 돼지 신장 및 마우스 간으로부터 푸마리아세토아세테이트 가수분해효소 도메인 함유 단백질 1(FAHD1)을 추출하는 방법을 기술한다. 열거된 방법들은 관심있는 다른 단백질에 적응될 수 있고 다른 조직에 대해 변형될 수 있다.
초록
푸마리아세토아세테이트 가수분해효소 도메인-함유 단백질 1 (FAHD1)은 진핵생물에서 FAH 수퍼패밀리의 최초로 확인된 구성원이며, 미토콘드리아에서 옥살로아세테이트 데카르복실라제로서 작용한다. 이 기사에서는 돼지 신장 및 마우스 간에서 FAHD1을 추출하고 정제하는 일련의 방법을 제시합니다. 다루는 방법은 빠른 단백질 액체 크로마토그래피 (FPLC)를 사용한 이온 교환 크로마토그래피, FPLC를 사용한 제조 및 분석 겔 여과 및 프로테오믹 접근법입니다. 총 단백질 추출 후, 황산암모늄 침전 및 이온 교환 크로마토그래피를 탐구하고, FAHD1은 이온 교환 및 크기 배제 크로마토그래피를 사용하는 순차적 전략을 통해 추출되었다. 이러한 대표적인 접근법은 관심있는 다른 단백질(상당한 수준에서 발현됨)에 적응되고 다른 조직에 대해 변형될 수 있다. 조직으로부터 정제된 단백질은 고품질 항체 및/또는 강력하고 특이적인 약리학적 억제제의 개발을 지원할 수 있다.
서문
진핵 FAH 도메인-함유 단백질 1 (FAHD1)은 이관능성 옥살로아세테이트 (OAA) 탈카르복실라제 (ODx)1 및 아실피루베이트 가수분해효소 (ApH)2로서 작용한다. 그것은 미토콘드리아 2에 국한되어 있으며 효소 1,2,3,4,5,6의 광범위한 FAH 수퍼 패밀리에 속합니다. 그의 ApH 활성은 단지 미미한 관련성이 있는 반면, FAHD1의 ODx 활성은 TCA 사이클 플럭스 1,7,8,9의 조절에 관여한다. OAA는 트리카르복실산 사이클에서 중심 시트레이트 합성효소 반응에 필요할 뿐만 아니라 전자 수송 시스템의 일부로서 그리고 카타플레틱 대사산물로서 숙시네이트 데하이드로게나제의 경쟁적 억제제로서 작용한다. 인간 탯줄 정맥 내피 세포 (HUVEC)에서 FAHD1 유전자 발현의 하향 조절은 세포 증식 속도의 현저한 감소(10), 및 미토콘드리아 막 전위의 현저한 억제를 초래했으며, 이는 당분해로의 수반되는 전환과 관련되었다. 작업 모델은 미토콘드리아 기능 장애 관련 노화 (MiDAS)11 유사 표현형 8을 말하며, 여기서 미토콘드리아 OAA 수준은 FAHD1 활성 1,8,9에 의해 엄격하게 조절됩니다.
재조합 단백질은 조직보다는 박테리아(12)로부터의 발현 및 정제를 통해 수득하는 것이 더 쉽다. 그러나, 박테리아에서 발현된 단백질은 번역 후 변형의 가능한 부족에 의해 편향될 수 있거나, 또는 단순히 문제가 될 수 있다(즉, 플라스미드 손실, 박테리아 스트레스 반응, 왜곡/형성되지 않은 이황화 결합, 없음 또는 불량한 분비, 단백질 응집, 단백질 분해 절단 등). 특정 적용을 위해, 단백질은 그러한 변형을 포함하고/하거나 가능한 아티팩트를 배제하기 위해 세포 용해물 또는 조직으로부터 수득될 필요가 있다. 조직으로부터 정제된 단백질은 FAHD113과 같은 선택된 효소에 대한 고품질 항체 및/또는 강력하고 특이적인 약리학적 억제제의 개발을 지원한다.
이 원고는 돼지 신장과 마우스 간에서 FAHD1을 추출하고 정제하기위한 일련의 방법을 제시합니다. 기술된 방법에는 빠른 단백질 액체 크로마토그래피(FPLC)가 필요하지만 그렇지 않으면 일반적인 실험실 장비를 사용합니다. 대안적인 방법들은 다른 곳에서 발견될 수 있다(14,15,16,17). 총 단백질 추출 후, 제안된 프로토콜은 황산암모늄 침전 및 이온 교환 크로마토그래피를 위한 서브프로토콜이 논의되는 테스트 단계를 포함한다(도 1). 이들 서브-프로토콜을 정의한 후에, 관심있는 단백질은 FPLC를 사용한 이온 교환 및 크기-배제 크로마토그래피를 사용하는 순차적 전략을 통해 추출된다. 이들 가이드라인에 기초하여, 최종 프로토콜은 관심있는 다른 단백질에 대해 개별적으로 적응될 수 있다.
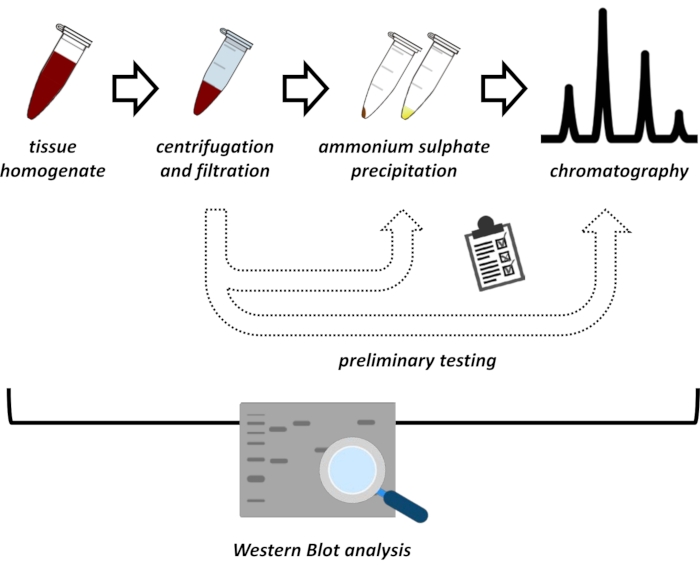
그림 1: 이 프로토콜의 전반적인 전략. 위에서 아래로: 단백질은 조직에서 추출됩니다. 조직 균질액을 제조하고, 원심분리하고, 여과한다. 각 쌍의 상청액 및 펠렛 유래 샘플에 대해 황산암모늄 침전 및 이온 교환 크로마토그래피 (FPLC)에 대한 테스트를 수행하여 최적의 조건을 조사해야합니다. 이들 서브프로토콜을 확립한 후, 단백질은 다양한 pH 및 염 농도에서 황산암모늄 침전, 이온 교환 크로마토그래피 및 반복적 크기 배제 크로마토그래피(FPLC)의 순차적 절차를 통해 추출될 수 있다. 모든 단계는 웨스턴 블롯으로 제어해야합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Access restricted. Please log in or start a trial to view this content.
프로토콜
모든 실험은 제도적 지침에 따라 수행되었다. 돼지 신장은 현지 슈퍼마켓에서 신선하게 얻어졌다. 간 조직은 Univ.-Doz의 감독하에 오스트리아 인스브루크 대학교 렌스벡 10, 6020 인스브루크의 생물의학 노화 연구소에서 유지된 C57BL6 야생형 마우스로부터 수확되었다. Pidder Jansen-Dürr 박사는 2013 년에 발행 된 프로젝트 리더로서 윤리적 허가를 받았습니다 (BMWF-66.008/0007-II/3b / 2013). 이 프로젝트에 대한 생쥐의 유지 보수 및 사용은 오스트리아 교육과학연구부(BMBWF)가 발행한 2020년 5월 5일부터 윤리 허가 제2020-0.242.978호에 따라 적용됩니다.
1. 준비
참고 : 프로토콜이 시작되기 전에 일반적인 화학 물질 및 물질 외에도 단백질 용해 완충액, 조조직 샘플 및 특정 항체와 같은 몇 가지 사항을 준비해야합니다.
- 조직 순중량 100g 당 단백질 용해 완충액 250mL를 준비한다: 50 mM NaF, 1 mM PMSF, 2 μg/mL 아프로티닌 및 1 mM 활성화된 오르토바나데이트를 갖는 1x PBS 250 mL. 용액을 0.22 μm 시린지 필터 유닛을 사용하여 필터링한다.
참고 : 단백질 티로신 포스파타제18의보다 강력한 억제제로 전환하기 위해 사용하기 전에 orthovanadate의 활성화가 필요합니다. 활성화된 오르토바나데이트는 상업적 공급자로부터 얻을 수 있지만, 또한 다음과 같이 제조된다.- ddH2O 중의 (나트륨) 오르토바나데이트의200mM 원액을 준비한다. 10 mL의 용액을 제조하기 위해, 368 mg의Na3VO4를 물 9 mL에 첨가하고, 교반하여 용해시킨다. 일단 용해되면, 부피를ddH2O로 10 mL까지 구성한다.
참고 : 나트륨 오르토바나데이트 용액의 시작 pH는 물질의 공급원에 따라 다를 수 있으며 다음과 같이 반복적 인 접근 방식으로 pH를 10으로 조정해야합니다. - 용액의 초기 pH에 따라 NaOH 또는 HCl로 pH를 10으로 조정하십시오. pH > 10에서, 용액은 황색을 가질 것이다. 용액이 무색으로 바뀔 때까지 끓여서 실온으로 식히고 pH를 확인하십시오. pH가 >10이면 소량의 HCl을 첨가하여 pH를 10으로 조정한다. 이 시점에서 용액이 다시 노란색으로 바뀔 수 있습니다.
- 용액이 무색으로 유지되고 pH가 10 (약 5-7 배)에서 안정화 될 때까지 끓여서 냉각을 반복하십시오. 이 시점에서 HCl을 첨가하면 용액에서 노란색이 희미하게 나타납니다. 활성화된 오르토바나데이트를 -20°C에서 1 mL 분취량으로 저장한다.
- ddH2O 중의 (나트륨) 오르토바나데이트의200mM 원액을 준비한다. 10 mL의 용액을 제조하기 위해, 368 mg의Na3VO4를 물 9 mL에 첨가하고, 교반하여 용해시킨다. 일단 용해되면, 부피를ddH2O로 10 mL까지 구성한다.
- 조직 그램 당 2mL의 용해 완충액으로 튜브를 준비하고 얼음 위에 놓습니다.
참고 :이 프로토콜은 8 개의 50 mL 튜브를 사용했으며, 각각 돼지 신장 1 개 (약 100-150 g)에 대해 총 30 mL의 용해 완충액으로 채워졌고 2 개의 튜브는 각각 20 마리의 마우스 간 (각각 1-2 g)에 대해 40 mL의 용해 완충액으로 채워졌습니다. - 조직 준비: 폴리스티렌 폼 박스의 얼음 위에 놓인 미리 청소된 유리판에서 조직을 해부하십시오. 각각 약 100 mg의 조직 조각을 절단하여 후속 용해를 위해 각각의 튜브로 쉽게 옮깁니다. 조직 조각을 준비된 튜브 내로 옮긴다(단계 1.2).
- 포화 황산암모늄 용액을 준비한다: 500 mL의ddH2O를 70°C로 가열하고, 교반하면서, 황산암모늄이 더 이상 용해되지 않을 때까지 황산암모늄 분말( 물자의 표 참조)을 서서히 첨가한다. 이 (과도한) 포화 용액을 실온으로 식히고 하룻밤 사이에 4 °C에서 보관하십시오.
2. 총 단백질 추출
참고 차가운 단백질 용해 완충액에서 샘플을 준비한 후(단계 1.3 참조), 다음과 같이 초음파 프로브에 의한 초음파 처리 또는 전기 균질기를 사용하여 가능한 한 최선을 다해 조직을 균질화한다.
- 조직의 균질화
- 돼지 신장의 경우, 샘플을 얼음 위에 유지하면서 초음파 프로브에 의해 현탁액을 초음파 처리하는 것이 바람직합니다 (15 s 펄스의 10 사이클, 펄스 사이에 30 s 간격으로 얼음 위에서 샘플을 냉각시키는 간격, 50 % 듀티 사이클의 중간 진폭에서).
- 마우스 장기의 경우, 샘플을 얼음 위에 유지하면서 전기 균질 기 (낮은 힘으로 시작하여 천천히 중간 힘으로 가속)를 사용하여 현탁액을 균질화하십시오. PBS로 전기 호모게나이저를 정기적으로 세척하여 장치를 막히는 임의의 유기 물질을 제거한다.
- 샘플에서 20 μL를 꺼내어 균질화 된 조직의 세포가 적절하게 파괴되었는지 현미경으로 확인하십시오. 그렇지 않으면 균질화를 반복하십시오.
- 튜브를 탁상 원심분리기에서 4°C에서 30분 동안 10,000 x g 로 원심분리한다.
주: 임의로, 상층액을 4°C에서 30분 동안 20,000 x g 에서 두 번째로 원심분리하여 이송되었을 수 있는 초기 펠릿의 작은 분획을 제거한다. 이것은 단계 2.3에서 후속 여과를 단순화 할 것이다. - 상층액을 신선한 튜브에 모아 얼음 위에 놓습니다. 0.45 μm 및 0.22 μm 시린지 필터 유닛을 사용하여 상청액을 순차적으로 필터링한다. 상청액을 10 mL 배치로 분취하고, 이를 단기 보관을 위해 -20°C에서 또는 장기간 보관을 위해 -80°C에서 동결시킨다.
참고: 0.45 μm로 사전 필터링하면 0.22 μm로 두 번째 필터링 단계가 더 미세한 입자를 제거하기 전에 대부분의 입자가 제거됩니다. 0.22μm 필터를 직접 사용하면 필터가 막힐 위험이 있습니다. - 상청액 40 μL에 10 μL의 5x SDS 샘플 버퍼 (표 1 참조)를 첨가하고, 이어서 95°C에서 10분 동안 비등시킴으로써 SDS-PAGE/웨스턴 블롯 분석을 위한 50 μL 샘플을 제조하였다.
- 임의로, 단계 2.2에서 수득된 약 100 μL의 펠렛을 900 μL의ddH2O에 재현탁시키고, 상기 기재된 바와 같이 SDS-PAGE/웨스턴 블롯 분석을 위한 샘플을 제조하였다.
참고: 웨스턴 블롯 분석에 펠릿 유래 샘플을 포함시키는 것은 양성 대조군 이외에 단백질의 발현이 낮은지, 또는 항체가 문제가 있는지를 나타낼 것이다.
- 임의로, 단계 2.2에서 수득된 약 100 μL의 펠렛을 900 μL의ddH2O에 재현탁시키고, 상기 기재된 바와 같이 SDS-PAGE/웨스턴 블롯 분석을 위한 샘플을 제조하였다.
3. SDS-PAGE 및 웨스턴 블롯 분석
참고: 단백질 용해도를 확인하기 위해서는 웨스턴 블롯 분석이 필요합니다. 다음은 습식/탱크 블롯팅 시스템을 사용하여 전기 블롯팅을 위한 프로토콜을 설명합니다( 재료 표 참조). SDS-PAGE에 대한 대체 프로토콜은 다른 곳(19)에서 발견될 수 있다.
- 제조자의 지시에 따라 불연속 12.5% 폴리아크릴아미드 SDS-PAGE 겔을 제조한다(즉, 분해능 겔의 상부에 스태킹 겔; 표 1 참조). 2단계에서 이전에 준비한 샘플을 실행합니다(단계 4, 5 및 6과 유사함, 아래 참조).
- 단백질 마커 사다리를 첫 번째 웰에 로드 합니다(물질 표 참조). 5 ng의 hFAHD1 재조합 단백질 (박테리아12로부터 수득; 표 1 참조)을 양성 대조군으로서 두 번째 웰에 로딩한다.
- 이어서, 분석될 샘플 20 μL를 로딩하고, 나머지 모든 웰을 20 μL의 제조된 SDS-PAGE 1x 샘플 버퍼 (즉,ddH2O로 희석된 5x 샘플 버퍼)로 채운다. SDS 실행 버퍼를 사용하여 125V에서 SDS-PAGE 겔을 실행합니다( 표 1 참조).
- SDS-PAGE가 완료된 후, 웨스턴 블롯 분석을 수행하고 FAHD1에 대해 상승가능한 항체를 사용하여 멤브레인을 프로브한다( 표 1 참조).
참고: 샘플이 조조직 균질물로부터 취해지기 때문에, 일반적으로 이 시점에서 SDS-PAGE 및 웨스턴 블롯 분석의 품질이 저하된다; 그러나 추출할 단백질이 상청액에 용해되는지 여부를 확인하는 것이 중요합니다. 다음 프로토콜은 돼지 신장 및 간, 심장, 뇌 및 신장을 포함한 다양한 마우스 장기에 대해 시험하였다.- 10x 웨스턴 블롯 전달 버퍼를 준비한다( 표 1 참조). 1x 웨스턴 블롯 전달 버퍼( 표 1 참조)를 준비하고 이를 4°C로 냉각시킨다.
- 메탄올에서 2분 동안 PVDF 막을 활성화시킨다. 멤브레인을 2분 동안ddH2O로 세척한다. 멤브레인을 1x 웨스턴 블롯 전달 완충액에서 15분 동안 평형화시킨다.
- SDS-겔을 10분 동안 1x PBS로 세척하고 진탕하면서 SDS 실행 완충액을 제거한 다음, 평형화를 위해 10분 동안 1x 웨스턴 블롯 전달 완충액에서 겔을 인큐베이션한다. 전기블롯팅 카세트(즉, 활성화된 PVDF 멤브레인과 겔을 결합)를 제조자의 지시에 따라 조립한다.
- 얼음으로 채워진 폴리스티렌 폼 박스 또는 냉장실(4°C)에서 1시간 동안 300mA에서 전기블롯팅을 통해 블롯을 실행한다. PVDF 멤브레인을 튜브의 안쪽을 향하는 노출면이 있는 50mL 튜브로 옮깁니다. 멤브레인을 20 mL의 웨스턴 블롯 블로킹 버퍼 (표 1 참조)에서 튜브 롤러 상에서 롤링하면서 4°C에서 하룻밤 동안 인큐베이션한다 (표 1 참조).
- 다음날, 롤링하는 동안 동일한 튜브에서 20 mL의 웨스턴 블롯 세척 완충액 (0.1% (v/v) 트윈 20을 갖는 PBS)으로 멤브레인을 5분 동안 세척한다. 멤브레인을 롤링하는 동안 실온에서 1 h 동안 웨스턴 블롯 차단 완충액에서 1:500으로 희석된 일차 항체2 (표적화 FAHD1; 표 1 참조)와 동일한 튜브에서 인큐베이션한다.
- 동일한 튜브에서 멤브레인을 10분 동안 각각 20 mL의 웨스턴 블롯 세척 완충액으로 세 번 롤링하면서 세척한다. 멤브레인을 5 mL의 웨스턴 블롯 블로킹 완충액에 1:3000으로 희석된 HRP 컨쥬게이션된 이차 항체 ( 표 표 참조)와 함께 실온에서 30분 동안 인큐베이션한다.
- 멤브레인을 동일한 튜브에서 10분 동안 각각 20 mL의 웨스턴 블롯 세척 완충액으로 세 번 세척하고, 각각 1x PBS로 5분 동안 2회 세척한다. 한쪽 가장자리에 핀셋으로 조심스럽게 잡고 셀룰로오스 조각이나 Whatman 종이 조각을 멤브레인의 반대쪽 (아래쪽) 가장자리로 만져서 멤브레인을 건조시킵니다. 멤브레인 (노출 된면을 위로 향하게)을 청소 된 유리 판에 놓습니다.
- 피펫을 사용하여 준비된 ECL 웨스턴 블롯 기판 1 mL로 전체 멤브레인을 조심스럽게 덮고 기포가 생성되지 않도록주의하십시오. ECL 용액을 3분 동안 인큐베이션하고, 즉시 X선 필름을 사용하거나 이미징 시스템을 사용하여 멤브레인을 개발한다.
참고: 단백질이 시료 중 어느 곳에서도 검출되지 않고 양성 대조군에서만 검출된 경우, 이는 단백질이 불용성이거나 항체에 의해 검출되기에 적절한 양으로 존재하지 않음을 나타낼 수 있습니다. 양성 대조군의 나노그램 만로드되면 첫 번째 시나리오가 더 가능성이 높습니다. 단백질이 전혀 검출되지 않았다면, 항체의 품질을 확인하고, 모노클로날 항체가 아닌 폴리클로날 항체로 전환할 수 있다. 드문 경우, 즉 일부 소수성 단백질의 경우, 단백질은 원심분리 후에 검출 가능할 수 있지만 여과 후에는 검출 할 수 없습니다. 이러한 경우 소수성 단백질에 특수 필터 장치를 사용하는 것이 좋습니다.
- 임의로, 웨스턴 블롯 후에 PVDF 막을 염색하여 SDS-PAGE 겔로부터 PVDF 막으로의 단백질의 성공적인 전달을 조절한다.
참고: Coomassie 염색은 문제 해결, 방법 개발 및 문서화에 권장되지만, 이 프로토콜을 적용한 후에는 추가 웨스턴 블롯 분석을 위해 멤브레인이 손실된다는 점에 유의하십시오. Ponceau S 염색은 더 약한 염색을 제공하지만 멤브레인을 다시 프로브해야하는 경우 사용할 수 있습니다.- 염색 (Coomassie 또는 Ponceau S) 및 탈염색 용액이 포함 된 작은 트레이를 준비하십시오.
- 핀셋을 사용하여 멤브레인을 염색 용액에 넣고 멤브레인이 잘 염색 될 때까지 부드럽게 흔들어줍니다 (5-10 분).
- 멤브레인을 탈지 용액으로 옮기고 용액이 포화 될 때까지 흔들어 라. (5-10 분). 멤브레인 상에서 단백질 밴드가 관찰될 수 있을 때까지 탈지 단계를 반복하는 단계; 밴드가 전혀 관찰되지 않으면 더 긴 배양 시간으로 염색을 반복하십시오. 핀셋을 사용하여 유리 접시에 올려 멤브레인을 말립니다.
4. 시험: 황산암모늄 침전
참고: 황산암모늄 침전은 단백질의 용해도를 변경하여 단백질을 정제하는 방법입니다. 예비 실험에서, 황산암모늄 농도는 FAHD1을 용액에 남겨두면서 최대량의 단백질 오염물질을 침전시키는 값으로 순차적으로 증가한다. 단백질의 용해도는 웨스턴 블롯 분석을 통해 다시 프로브됩니다.
- 단계 2.3에서 진행: 샘플의 분취량을 해동하거나 단백질 추출 직후(즉, 샘플을 동결시키지 않고) 진행한다. 샘플을 0.22 μm 필터 유닛을 사용하여 여과하여 해동 후 가능한 침전물을 배제한다. 얼음 위에 여섯 개의 1.5 mL 튜브를 준비하고 250 μL의 샘플을 각 튜브로 옮깁니다.
- 상기에서 제조된 튜브에 5%, 10%, 15%, 20%, 25%, 및 30% 황산암모늄의 희석 시리즈를 준비하고, 단백질 용해 완충액으로 최종 부피를 1000 μL로 구성한다. 샘플을 튜브 회전기 상에서 하룻밤 동안 4°C에서 인큐베이션한다( 물질의 표 참조).
- 탁상용 원심분리기를 사용하여, 4°C에서 30분 동안 10,000 x g 에서 원심분리하고, 모든 상층액을 분리된 튜브로 조심스럽게 옮겼다. 생성된 펠렛을 공기-건조시키고, 이들 각각을 1000 μL의ddH2O에 재현탁시켰다.
- 이전 단계로부터의 재현탁된 펠릿 및 상청액의 각 쌍에 대해, 40 μL를 10 μL의 5x SDS 샘플 버퍼와 혼합하고, 대부분의 액체가 기화될 때까지 열린 뚜껑으로 95°C에서 끓인다. 이어서, 펠렛을ddH2O중의 50% DMSO의 혼합물에 재현탁시킨다.
- SDS-PAGE (단계 3)를 수행하되 겔을 80V에서 3 시간 동안 실행한다. 황산암모늄의 각 농도에 대해, 재현탁된 펠릿 및 상청액으로부터 유래된 샘플을 쌍으로 로딩한다(단계 4.3). 웨스턴 블롯 분석을 수행합니다(단계 3).
- 정제될 단백질(즉, FAHD1)이 상청액으로부터 유래된 샘플에 남아있는 황산암모늄의 최고 농도를 확인한다. 결과에 기초하여, 관심있는 단백질에 대한 황산암모늄 침전 프로토콜을 정의하고, 향후 실험에 사용될 것이다.
참고: 황산암모늄은 SDS-PAGE 및 웨스턴 블롯을 왜곡시키는 것으로 잘 알려져 있습니다. 황산암모늄의 농도가 증가함에 따라 웨스턴 블롯 분석의 품질이 저하됩니다. 그러나, 단계 3 이전과 마찬가지로, 이 분석은 황산암모늄의 주어진 농도에서 관심있는 단백질의 용해도를 확인하기 위해 사용된다. 이 프로토콜은 다른 단백질을 침전시키는 것을 목표로하지만, 정제 할 단백질은 가용성을 유지해야합니다.
5. 시험: FPLC를 가진 이온 교환 크로마토그래피
참고: 하전된 작용기를 가진 분자는 FPLC용 실리카 입자 컬럼에 결합되어, 표면 전하에 따라 단백질의 분화를 가능하게 한다. 양이온 교환 컬럼과 음이온 교환 컬럼을 사용하여 이 단계를 두 번 수행하십시오( 재료 표 참조). 프로토콜 단계는 양이온 또는 음이온 교환 크로마토그래피에 대해 동일하지만, 사용되는 완충제는 상이하다( 표 1 참조); 둘 다 "저염" 15 mM NaCl 및 "고염" 1 M NaCl 조건을 가진다. 사용된 컬럼의 경우, 1mL/min의 유속을 권장합니다.
- 음이온 또는 양이온 교환 컬럼으로 FPLC 시스템을 설정하십시오. 컬럼을 20% EtOH(inH2O)의 5 컬럼 부피(CVs)로 세척하고, 이어서 ddH2O.의 5CVs로 번갈아 가면서, 크로마토그램에서 더 이상 피크가 관찰되지 않을 때까지1CV의 저염 완충액, 고염 완충액 및 다시 저염 완충액으로 컬럼을 세척하되, 적어도 1회 세척한다.
- 작은 규모로 황산암모늄 침전에 대한 최적의 프로토콜을 결정한 후(단계 4), 침전 프로토콜을 10 mL의 원래 조직 균질액에 적용한다(단계 2). 임의로, 저염 완충액에 대해 샘플을 투석한다.
- 샘플을 컬럼 상에 적용하고(예를 들어, 주입에 의해 또는 샘플 펌프를 사용하여) 유동-관통을 수집한다. 컬럼을 저염 완충액의 1 CV로 세척한다.
- 3 CV 이내에 100% 저염 완충액/0% 고염 완충액에서 0% 저염 완충액/100% 고염 완충액으로 선형 구배 용출을 설정합니다. 1 mL 분획을 지속적으로 수집합니다. 구배가 끝난 후, 1 CV 범위에 걸쳐 크로마토그램에서 더 이상 단백질 관련 피크 (280/255 nm에서의 UV 흡수)가 검출되지 않을 때까지 고 염 완충액으로 계속 실행하십시오.
- 컬럼을 세척하기 위해 0.5 M NaOH (ddH2O 중)에 용해된25% SDS 1 mL를 적용한다. 연속적으로, 컬럼을 ddH2O의 3개의 CVs 및20% EtOH의 3개의 CVs(ddH2O에서)로 세척한다.
- 모든 피크-분획 및 유동-관통의 SDS-PAGE 샘플을 수집하고, 이를 웨스턴 블롯을 통해 관심있는 단백질의 존재에 대해 프로브한다(단계 3). 수집된 분획을 액체 질소에서 스냅-냉동하고 이를 -80°C에서 저장한다.
- 웨스턴 블롯 분석이 완료된 후, 관심있는 단백질을 함유하는 분획을 해동 및 풀링하고 다른 것들은 버린다. 대체 컬럼(즉, 양이온 또는 음이온 교환 컬럼)으로 5.1-5.5단계를 반복한다.
- 두 컬럼이 모두 프로브된 후, 미래의 실험에 사용될 관심있는 단백질에 대한 FPLC 프로토콜을 정의한다. 초원심분리 필터 유닛(10 kDa, Table of Materials)을 사용하여 단백질 용액의 부피를 2 mL로 줄이십시오.
참고: 이 일련의 실험에는 두 가지 예상 결과가 있습니다. 관심있는 단백질이 컬럼 중 하나에 부착되어 있고 단백질 용액이 용출 후 이미 매우 순수하거나 두 경우 모두 단백질이 흐름에 남아 있습니다. 후자의 시나리오에서는 단백질이 흐름에 있지만 이 단계의 세척 효과는 여전히 중요할 수 있습니다. 그러한 경우에, 돼지 신장 및 마우스 간에서의 FAHD1에 관해서는, 이온 교환의이 단계가 여전히 수행 될 것이다. 양이온성 또는 음이온성 교환 컬럼이 적절한 세척 효과를 제공할 수 없는 경우, 용해물 및 완충액의 pH를 변형시키고, FPLC에 적용하기 전에 실행 완충제에 대해 샘플을 투석하려고 시도할 수 있다.
6. 황산암모늄 침전 및 FPLC에 대해 정의된 하위 프로토콜을 사용한 단백질 추출
참고: FPLC용 실리카겔 컬럼의 다공성 입자( 물질의 표 참조)는 유체역학적 반경에 따라 단백질의 분화를 가능하게 한다. 기술된 단계들은 크기 배제 크로마토그래피(SEC)를 사용하여 FPLC 시스템으로 수행되어야 한다. 사용 된 SEC 컬럼 ( 재료 표 참조)의 경우 0.3 mL / min의 유속을 권장합니다.
- 필요한 모든 물질을 준비하고(단계 1 참조), 조직으로부터 전체 단백질을 추출한다(단계 2 참조). 시험에 사용되지 않은 모든 조직 균질물로 황산암모늄 침전을 수행한다(단계 4 참조). 더 큰 부피의 경우, 초원심분리 필터 유닛 (10 kDa; 재료 표 참조)을 사용하여 용해물을 50 mL 이하의 더 작은 부피로 농축하십시오.
- 이온성 교환 크로마토그래피를 사용하여 첫 번째 정제 단계를 수행한다(단계 5 참조).
- 이전 단계에서 설명한 대로 웨스턴 블롯을 위한 샘플을 준비합니다. 웨스턴 블롯 분석을 수행하고 이온 교환 크로마토그래피의 분획을 포함하는 모든 FAHD1을 풀링합니다.
- 울트라 원심분리 필터 유닛(10 kDa)을 사용하여 단백질 용액의 부피를 2 mL로 줄이십시오. 용액을 0.45 μm 및 0.22 μm 시린지 필터 유닛으로 순차적으로 필터링하여 임의의 미세침전을 제거한다.
- SEC 컬럼을 1 mM DTT를 함유하는 SEC 실행 완충액 ( 표 1 참조)의 1 CV로 평형화시킨다. 샘플을 컬럼 상에 로딩하고 모든 단백질이 용출될 때까지 크로마토그래피를 실행한다(1-2 CV).
- 크로마토그램 (280/255 nm에서의 UV 흡수)에서 유의한 피크에 상응하는 유동 관통 1 mL의 분획을 수집하고, 이전 단계에서 기술된 바와 같이 SDS-PAGE 및 웨스턴 블롯 분석을 위해 수집된 각 분획의 50 μL 샘플을 준비한다. 모든 분획을 액체 질소를 사용하여 스냅-동결시키고, 이를 -80°C에서 저장한다.
- SEC 컬럼을 ddH2O의 1 CV 및20% EtOH의 1 CV (ddH2O에서)로 연속적으로 세척한다. 웨스턴 블롯 분석을 수행하고, 분획을 함유하는 모든 FAHD1을 풀링한다. 울트라 원심분리 필터 유닛(10 kDa, Table of Materials를 참조)을 사용하여 단백질 용액의 부피를 2 mL로 줄이십시오.
- 상업적 BCA 분석 키트를 사용하여 단백질 농도를 평가 한다(표 참조).
주: 이동상의 pH 및 염 함량은 구상 단백질(20)의 용출 프로파일에 영향을 미칠 수 있다. 산성 또는 염기성 조건은 피크가 덜 정의되고 증가된 단백질-매트릭스 상호작용을 초래하여 컬럼(20) 상의 단백질의 부분적 체류를 유도할 수 있다. 이러한 효과는 추가의 단백질 정제를 위해 이용될 수 있다. 상이한 유속, pH 및 염 농도를 갖는 단계 6의 반복은 단백질20의 순도를 향상시킬 수 있다.
7. 실버 염색
참고: SDS-PAGE 젤의 실버 염색 분석은 Coomassie 염색으로는 볼 수 없는 단백질 오염을 확인하기 위해 필요합니다. 다음의 프로토콜은 문헌21에서 찾을 수 있는 많은 버전들 중 하나이다. 깨끗한 유리 트레이에서 흔들어서 모든 인큐베이션 단계를 수행하십시오. 모든 은과 포름알데히드 함유 액체를 특수 폐기물 용기에 수거하여 적절하게 폐기하십시오.
- SDS-PAGE 겔을 냉장실에서 하룻밤 동안 은 염색 고정 용액( 표 1 참조)으로 인큐베이션한다. 겔을 실온에서 3시간 동안 은 염색 인큐베이션 용액( 표 1 참조)에 인큐베이션한다. 선택적으로, 글루타르알데히드( 표 1 참조)를 첨가하여 희미한 밴드의 검출을 개선한다. 겔을 각각 10분 동안ddH2O로 네 번 세척한다.
- 겔을 1시간 동안 은 염색은 용액( 표 1 참조)에서 인큐베이션한다.
참고 : 지금부터 모든 액체와 젤 자체에는 독성이있는은과 포름 알데히드가 포함되어 있음을 명심하십시오. - 겔을 은 염색 현상액( 표 1 참조)에 인큐베이션하고, 밴드가 선명하게 보일 때까지 격렬하게 흔들어 준다. 반응을 중지시키기 위해, 현상액은 버리고, 즉시 겔을 최소 10분 동안 은 염색 정지 용액( 표 1 참조)에서 인큐베이션한다.
참고 : 7.2 단계와 7.3 단계에서 염색 된 밴드는 지속적으로 더 발전 될 것입니다. 용액에 명시된 것보다 더 많은 포름 알데히드를 첨가하는 것은 염색이 약한 경우 필요할 수 있습니다.
Access restricted. Please log in or start a trial to view this content.
결과
FAHD1 단백질은 제시된 프로토콜을 사용하여 돼지 신장 및 마우스 간으로부터 추출되었다. 마우스 조직의 경우, 최종 정제 단계 후에 수 μg을 얻기 위해서는 여러 장기가 필요합니다. 이러한 이유로이 기사는 돼지 신장에서 FAHD1을 추출하는 데 중점을 둡니다.이 실험은 훨씬 더 모범적 인 실험입니다. 마우스 간에서 FAHD1의 추출은이 프로토콜의 어려움과 가능한 함정을 제시하기 위해 수행됩니다. 일...
Access restricted. Please log in or start a trial to view this content.
토론
프로토콜의 중요한 단계
단백질의 취급에 대한 일반적인 지침을 따르는 것은 얼음 작업과 적당한 pH 및 소금 조건에서 작업하는 것과 같이 필수적입니다. 프로테아제 억제제의 사용은 방법에 유익한 반면, 프로테아좀 억제제의 사용은 매우 권장됩니다. 샘플을 동결 및 해동하면 항상 (적어도 부분적으로) 단백질 침전이 발생할 수 있으므로 초기 단백질 용해물의 해동 분취량 (단계 2...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 경쟁하는 재정적 이익이 없습니다.
감사의 말
저자는 Ayse Öztürk와 Eva Albertini의 기술 지원에 매우 감사드립니다. 간 조직의 생성에 사용된 마우스는 Univ.-Doz의 감독 하에 유지되었다. Pidder Jansen-Dürr 박사 (Innsbruck University, Rennweg 10, 6020 Innsbruck, Austria의 생물 의학 노화 연구 연구소).
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter units | MERCK | SLGP033RS | Millex-HP, 0.22 µm, PES 33 mm, not steril |
| 0.45 µm filter units | MERCK | SLHP033NS | Millex-HP, 0.45 µm, PES 33 mm, not steril |
| 15 mL Falcon tubes | VWR | 734-0451 | centrifugal tubes |
| 50 mL Falcon tubes | VWR | 734-0448 | centrifugal tubes |
| 96-Well UV Microplate | Thermo-Fischer | 8404 | UV/VIS transparent flat-bottom 96 well plates |
| Acrylamide/Bis Solution (40%, 29:1 ratio) | BIO-RAD | #1610147 | 40% acrylamide/bis-acrylamide, 29:1 (3.3% crosslinker) solution for casting polyacrylamide gels |
| ÄKTA FPLC system | GE Healthcare Life Sciences / Cytiva | - | using the FPLC system by GE Healthcare; different custom versions exist; this work used the "ÄKTA pure" system |
| Amicon Ultra-15, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC901024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 15 mL |
| Amicon Ultra-4, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC801024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 4 mL |
| Ammonium sulfate powder | MERCK | A4418 | ammonium sulphate for molecular biology, ≥99.0% |
| Ammoniumpersulfat reagent grade, 98% | MERCK | 215589 | Catalyst for acrylamide gel polymerization. |
| Coomassie Brilliant blue R 250 | MERCK | 1125530025 | Coomassie Brilliant blue R 250 (C.I. 42660) for electrophoresis Trademark of Imperial Chemical Industries PLC. CAS 6104-59-2, pH 6.2 (10 g/l, H2O, 25 °C) |
| Dialysis tubing cellulose membrane | MERCK | D9277 | Cellulose membranes for the exchange of buffers via dialysis. |
| Eppendof tubes 1.5 mL | VWR | 525-1042 | microcentrifugal tubes; autoclaved |
| HiLoad 26/600 Superdex 75 pg | GE Healthcare Life Sciences / Cytiva | 28989334 | HiLoad Superdex 75 pg prepacked columns are for high-resolution size exclusion chromatography of recombinant proteins |
| Immun-Blot PVDF Membrane | BIO-RAD | #1620177 | PVDF membranes are protein blotting membranes optimized for fluorescent and multiplex fluorescent applications. |
| Mini Trans-Blot Electrophoretic Transfer Cell | BIO-RAD | #1703930 | Use the Mini Trans-Blot Cell for rapid blotting of Mini-PROTEAN precast and handcast gels. |
| Mini-PROTEAN Tetra Vertical Electrophoresis Cell for Mini Precast Gels | BIO-RAD | #1658004 | 4-gel vertical electrophoresis system, includes electrode assembly, companion running module, tank, lid with power cables, mini cell buffer dam. |
| Mono Q 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516701 | Mono Q columns are strong anion exchange chromatography columns for protein analysis or small scale, high resolution polishing of proteins. |
| Mono S 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516901 | Mono S columns are strong cation exchange chromatography columns for protein analysis or small scale high resolution polishing of proteins. |
| PageRuler Prestained Protein Ladder, 10 to 180 kDa | Thermo-Fischer | 26616 | A mixture of 10 blue-, orange-, and green-stained proteins (10 to 180 kDa) for use as size standards in protein electrophoresis (SDS-PAGE) and western blotting. |
| Pierce BCA Protein Assay Kit | Thermo-Fischer | 23225 | A two-component, high-precision, detergent-compatible protein assay for determination of protein concentration. |
| Sonifier 250; Ultrasonic Cell Disruptor w/ Converter | Branson | - | New models at https://www.emerson.com/documents/automation/brochure-sonifier-sfx250-sfx550-cell-disruptors-homogenizers-branson-en-us-168180.pdf |
| Swine Anti-Rabbit Immunoglobulins/HRP (affinity isolated) | Agilent Dako | P0399 | The antibody used for horseradish peroxidase conjugation reacts with rabbit immunoglobulins of all classes. |
| TEMED, 1,2-Bis(dimethylamino)ethane, TMEDA | MERCK | T9281 | TEMED (N,N,N′,N′-Tetramethylethylenediamine) is molecule which allows rapid polymerization of polyacrylamide gels. |
| Tube Roller | - | - | A general tube rotator roller; e.g. a new model at https://labstac.com/de/Mixer/Roller/c/71 |
| Tube Rotator | - | - | A general tube rotator wheel; e.g. a new model at https://labstac.com/de/Tube-Roller/p/MT123 |
| ULTRA-TURRAX; T 25 digital | IKA | 0003725000 | New models at https://www.ika.com/de/Produkte-Lab-Eq/Dispergierer-Dipergiergeraet-Homogenisierer-Homogenisator-csp-177/T-25-digital-ULTRA-TURRAX-cpdt-3725000/ |
참고문헌
- Pircher, H., et al. Identification of FAH domain-containing protein 1 (FAHD1) as oxaloacetate decarboxylase. Journal of Biological Chemistry. 290 (11), 6755-6762 (2015).
- Pircher, H., et al. Identification of human Fumarylacetoacetate Hydrolase Domain-containing Protein 1 (FAHD1) as a novel mitochondrial acylpyruvase. Journal of Biological Chemistry. 286 (42), 36500-36508 (2011).
- Kang, T. -W., et al. Senescence surveillance of pre-malignant hepatocytes limits liver cancer development. Nature. 479 (7374), 547-551 (2011).
- Hong, H., Seo, H., Park, W., Kim, K. K. -J. Sequence, structure and function-based classification of the broadly conserved FAH superfamily reveals two distinct fumarylpyruvate hydrolase subfamilies. Environmental Microbiology. 22 (1), 270-285 (2020).
- Timm, D. E., Mueller, H. A., Bhanumoorthy, P., Harp, J. M., Bunick, G. J. Crystal structure and mechanism of a carbon-carbon bond hydrolase. Structure. 7 (9), London, England. 1023-1033 (1999).
- Bateman, R. L., et al. Mechanistic inferences from the crystal structure of Fumarylacetoacetate Hydrolase with a bound phosphorus-based inhibitor. Journal of Biological Chemistry. 276 (18), 15284-15291 (2001).
- Weiss, A. K. H., et al. Structural basis for the bi-functionality of human oxaloacetate decarboxylase FAHD1. Biochemical Journal. 475 (22), 3561-3576 (2018).
- Etemad, S., et al. Oxaloacetate decarboxylase FAHD1 - a new regulator of mitochondrial function and senescence. Mechanisms of Ageing and Development. 177, 22-29 (2019).
- Weiss, A. K. H., et al. Regulation of cellular senescence by eukaryotic members of the FAH superfamily - A role in calcium homeostasis. Mechanisms of Ageing and Development. 190, 111284(2020).
- Petit, M., Koziel, R., Etemad, S., Pircher, H., Jansen-Dürr, P. Depletion of oxaloacetate decarboxylase FAHD1 inhibits mitochondrial electron transport and induces cellular senescence in human endothelial cells. Experimental Gerontology. 92, 7-12 (2017).
- Wiley, C. D., et al. Mitochondrial dysfunction induces senescence with a distinct secretory phenotype. Cell Metabolism. 23 (2), 303-314 (2016).
- Weiss, A. K. H., et al. Expression, purification, crystallization, and enzyme assays of Fumarylacetoacetate Hydrolase Domain-containing proteins. Journal of Visualized Experiments: JoVE. (148), e59729(2019).
- Weiss, A. K. H., et al. Inhibitors of Fumarylacetoacetate Hydrolase Domain Containing Protein 1 (FAHD1). Molcules. 26 (16), 5009(2021).
- Mizutani, H., Kunishima, N. Purification, crystallization and preliminary X-ray analysis of the fumarylacetoacetase family member TTHA0809 from Thermus thermophilus HB8. Acta Crystallographica Section F Structural Biology and Crystallization Communications. 63 (9), 792-794 (2007).
- Lee, C. H. A simple outline of methods for protein isolation and purification. Endocrinology and Metabolism. 32 (1), Seoul, Korea. 18-22 (2017).
- Amer, H. E. A. Purification of proteins: Between meaning and different methods). Proteomics Technologies and Applications. , (2019).
- Niu, L., Yuan, H., Gong, F., Wu, X., Wang, W. Protein extraction methods shape much of the extracted proteomes. Frontiers in Plant Science. 9, 802(2018).
- Gordon, J. A. Use of vanadate as protein-phosphotyrosine phosphatase inhibitor. Methods in Enzymology. 201, 477-482 (1991).
- Gallagher, S. R. SDS-polyacrylamide gel electrophoresis (SDS-PAGE). Current Protocols in Essential Laboratory Techniques. , (2012).
- Ahmed, U., Saunders, G. Effect of pH on Protein Size Exclusion Chromatography. , Available from: https://www.agilent.com/cs/library/applications/5990-8138EN.pdf (2011).
- Sørensen, B. K., et al. Silver staining of proteins on electroblotting membranes and intensification of silver staining of proteins separated by polyacrylamide gel electrophoresis. Analytical Biochemistry. 304 (1), 33-41 (2002).
- Fagerberg, L., et al. Analysis of the human tissue-specific expression by genome-wide integration of transcriptomics and antibody-based proteomics. Molecular & Cellular Proteomics. 13 (2), 397-406 (2014).
- Cytiva Life Fundamentals of size exclusion chromatography. , Available from: https://www.cytivalifesciences.com/en/us/solutions/protein-research/knowledge-center/protein-purification-methods/size-exclusion-chromatography (2022).
- Rosano, G. L., Ceccarelli, E. A. Recombinant protein expression in Escherichia coli: advances and challenges. Frontiers in Microbiology. 5, 172(2014).
- Rosano, G. L., Morales, E. S., Ceccarelli, E. A. New tools for recombinant protein production in Escherichia coli: A 5-year update. Protein Science: A Publication of the Protein Society. 28 (8), 1412-1422 (2019).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유